Качественные реакции на неорганические вещества и ионы
Таблица. Качественные реакции на анионы
| Анион | Реактив | Наблюдаемая реакция |
| SO42- | соли Ва2+ | Выпадение белого осадка BaSO4 |
| NO3— | добавить конц. H2SO4 и Сu, нагреть | Образование голубого раствора (ионы Сu2+), выделение газа бурого (NO2) |
| РО43- | ионы Ag+ | Выпадение светло-желтого осадка в нейтральной среде:
ЗАg+ + РO43- = Аg3РO4 |
| СrO42- | ионы Ва2+ | Выпадение желтого осадка:
Ва2+ + СrO42- = BaCrO4 |
| S2- | ионы Рb2+ | Выпадение черного осадка:
Pb2+ + S2- = PbS |
| СО32- | ионы Са2+ | выпадение белого осадка СаСО3 |
| CO2 | известковая вода Са(ОН)2 | Выпадение белого осадка и его растворение при пропускании СO2:
Са(ОН)2 + СO2 = СаСО3+Н2O СаСО3 + СO2 + Н2O = Са(НСO3)2 |
| SO32- | ионы Н+ | Появление запаха SO2:
2Н+ + SO32- = Н2O + SO2 Сернистый газ обесцвечивает бромную воду. |
| F— | ионы Са2+ | Выпадение белого осадка:
Са2+ + 2F— = CaF2 |
| Cl— | ионы Аg+ | Выпадение белого творожистого осадка:
Аg+ + Cl— = AgCl |
| Br— | ионы Аg+ | Выпадение светло-желтого осадка:
Ag+ + Br— = AgBr осадок темнеет на свету |
| I— | ионы Аg+ | Выпадение желтого осадка:
Аg+ + I— = АgI осадок темнеет на свету |
| ОН— | индикаторы: лакмус
фенолфталеин |
синее окрашивание
малиновое окрашивание |
Таблица. Качественные реакции на катионы
| Катион | Реактив | Наблюдаемая реакция |
| Li+ | Пламя | Карминово-красное окрашивание |
| Na+ | Пламя | Желтое окрашивание |
| K+ | Пламя | Фиолетовое окрашивание |
| Ca2+ | Пламя | Кирпично-красное окрашивание |
| Sr2+ | Пламя | Карминово-красное окрашивание |
| Ba2+ | 1) Пламя
2) Ион SO42- |
1) Желто-зеленое окрашивание
2) Выпадение белого осадка BaSO4 |
| Cu2+ | 1) Вода
2) Ионы ОН— |
1) Растворы солей Сu2+ имеют голубую окраску
2) Голубой осадок Cu(OH)2 |
| Pb2+ | Ион S2- | Выпадение черного осадка: PbS |
| Ag+ | Ион Cl— | Выпадение белого осадка:
Аg+ + Cl— = AgCl |
| Fe2+ | Красная кровяная соль, K3[Fe(CN)6] | Выпадение синего осадка KFe[Fe(CN)6] |
| Fe3+ | 1) Желтая кровяная соль, K4[Fe(CN)6] 2) Роданид-ион SCN— |
1) Выпадение синего осадка: KFe[Fe(CN)6]
2) Появление ярко-красного окрашивания |
| Al3+ | Щелочь (амфотерные свойства гидроксида) | Выпадение белого осадка гидроксида алюминия при добавлении первых порций щелочи и его растворение при дальнейшем добавлении. |
| NH4+ | Щелочь при нагревании | Запах аммиака NH3 и окрашивание влажного лакмуса в синий цвет |
| H+ | Индикаторы: лакмус, метилоранж | Красное окрашивание (кислая среда) |
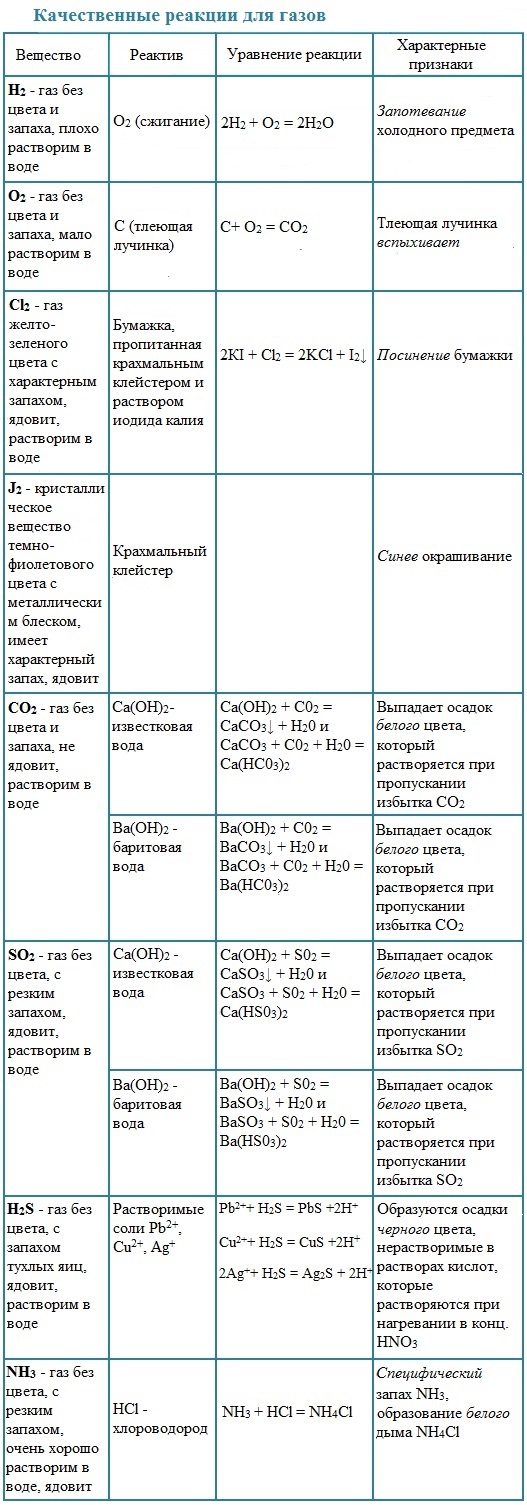
Таблица. Качественные реакции на газы
| Газ | Качественная реакция |
| Водород, H2 | Хлопок при поднесении горящей лучинки к источнику водорода |
| Азот, N2 | Горящая лучинка тухнет в атмосфере азота. При пропускании через раствор Ca(OH)2 осадок не выпадает |
| Кислород, O2 | Тлеющая лучинка ярко загорается в атмосфере кислорода |
| Озон, O3 | Взаимодействие озона с раствором иодидов с выпадением кристаллического иода I2 в осадок:
2KI + O3 + H2O = 2KOH + I2↓ + O2↑ |
| Хлор, Сl2 | При взаимодействии хлора с растворами иодидов в осадок выпадает желтый осадок йода I2:
2KI + Cl2 = 2KCl + I2↓ |
| Аммиак, NH3 | Резкий запах; влажный лакмус синеет. Реакция аммиака с хлороводородом («дым» без огня):
NH3 + HCl = NH4Cl |
| Углекислый газ, CO2 | Тлеющая лучинка гаснет в атмосфере углекислого газа. Пропускание углекислого газа через известковую воду Ca(OH)2: Ca(OH)2 + CO2 = CaCO3↓ + H2O Дальнейшее пропускание приведет к растворению осадка: CaCO3 + CO2 + H2O = Ca(HCO3)2 |
| Оксид азота (II), NO | Оксид азота (II) очень чувствителен к кислороду воздуха, потому на воздухе буреет, окисляясь до оксида азота (IV) NO2:
2NO+ O2 = 2NO2 |
| Сернистый газ, SO2 | Обесцвечивание бромной воды и раствора перманганата калия |
| Сероводород, H2S | Чёрный осадок сульфида при пропускании через раствор соли меди или свинца |
Таблицы качественных реакций
21-Дек-2013 | комментариев 9 | Лолита Окольнова
Вопросы части С объединяют знание всех тем химии. В случае Задания С2 ЕГЭ по химии — знание всех классов неорганических веществ и их качественных реакции.
Дается конкретный химический эксперимент, ход которого нужно описать химическими реакциями.
Для таких реакции обычно предлагаются какие-то внешние проявления — выделения газа, выпадение осадка или изменение окраски раствора.
Таблица качественных реакций для газов
| Описание | Формула |
Реакции |
| Бурый газ |
NO2 |
1) N2 + 2O2 = 2NO2 2) взаимодействие металлов с азотной кислотой (концентрированной) 3) разложение нитратов |
| Запах тухлых яиц |
H2S |
Взаимодействие активных металлов с концентрированной серной кислотой: |
|
Газ с резким запахом. Растворимый в воде |
SO2 |
1) взаимодействие серасодежащих веществ с кислородом
2) взаимодействие некоторых металлов с концентрированной серной кислотой |
| Газ с резким характерным запахом, растворимый в воде |
NH3 |
1) N2 + 3H2 = 2NH3 2) обменные реакции солей аммония |
| Газ, не поддерживающий горение, малорастворимый в воде, не ядовитый |
N2 |
1) горение азотсодержащих веществ; NH4NO2 = N2 + 2H2O |
|
Газы, поддерживающие горение: (для NO2 – бурый цвет) |
O2 O3 NO2 |
3C + 2O3 = 3CO2 С + 2NO2 = CO2 + 2NO |
Таблица качественных реакций для щелочных металлов:
Т.к. все соединения щелочных металлов хорошо растворимы в воде, то их определяют по цвету пламени:
(указан так же цвет пламени некоторых щелочно-земельных металлов)
|
желто-зеленое |
фиолетовое |
кирпично-красное |
ярко-красное |
желтое |
карминово-красное |
|
Ba2+ |
K+ |
Са2+ |
Li+ |
Na+ |
Sr2+ |
Таблица качественных реакций
— цвета осадков
|
Осадки белого цвета |
Качественная реакция |
|
Белый творожистый нерастворимый в воде; нерастворимый в HNO3 |
Ag+ + Cl— → AgCl↓ качественная реакция на соли серебра; качественная реакция на хлорид-ионы; |
|
Белый осадок нерастворимый в кислотах |
Ba2+ + SO4 -2 → BaSO4↓ качественная реакция на соли бария; качественная реакция на сульфат-ионы; |
|
Белый осадок образуется при пропускании газа без цвета с резким запахом через известковую воду; растворяется при пропускании избытка газа; растворяется в кислотах |
Сa(OH)2 + SO2 = CaSO3↓ + H2O
|
|
Белый осадок образуется при добавлении щелочи; растворяется в избытке щелочи |
Al3+ + 3OH— = Al(OH)3↓ Zn2+ + 2OH— = Zn(OH)2↓
|
|
Белый осадок образуется при пропускании газа без цвета и запаха через известковую воду; растворяется при пропускании избытка газа; растворяется в кислотах |
Сa(OH)2 + CO2 = CaCO3↓ + H2O
CaCO3 + 2H+ → CO2↑ + H2O + Ca2+ |
|
Осадок светло-желтого цвета (осадок кремового цвета) образуется при приливании AgNO3; нерастворим в HNO3; |
Ag+ + Br— → AgBr↓ качественная реакция на бромид-ионы; (качественная реакция на соли серебра); |
|
Осадок желтого цвета образуется при приливании AgNO3; нерастворим в HNO3; |
Ag+ + I— → AgJ↓ качественная реакция на иодид-ионы; (качественная реакция на соли серебра); |
|
Осадок желтого цвета образуется при приливании AgNO3; растворим в кислотах; |
3Ag+ + PO43- → Ag3PO4↓ |
|
Осадки коричневых цветов |
Качественная реакция |
|
Осадок бурого цвета образуется при взаимодействии с растворами щелочей; |
Fe3+ +3OH— → Fe(OH)3↓ качественная реакция на соли железа |
|
Осадки синих и зеленых цветов |
Качественная реакция |
|
Осадки зеленого цвета |
Fe2+ +2OH— → Fe(OH)2↓ |
|
Осадок голубого цвета (осадок синего цвета) образуется при взаимодействии с растворами щелочей |
Cu2+ +2OH— → Cu(OH)2↓ качественная реакция на соли меди (II) |
|
Осадок синего цвета образуется при взаимодействии с раствором красной кровяной и желтой кровяной соли |
3Fe2+ + 2[Fe(CN)6]3- → Fe3[Fe(CN)6]2↓ качественная реакция на соли железа (II) — с красной кровяной солью; 4Fe3+ + 3[Fe(CN)6]-4 → Fe4[Fe(CN)6]3↓ качественная реакция на соли железа (III) — с желтой кровяной солью; |
|
Осадки черного цвета |
Качественная реакция |
|
Осадок черного цвета Образуется при взаимодействии с сульфидами или с H2S |
Fe2+ + S2- → FeS↓ Ni2+ + S2- → NiS↓ Cu2+ + S2- → CuS↓ Pb2+ + S2- → PbS↓ Hg2+ + S2- → HgS↓ Ag+ + S2- → Ag2S↓ качественная реакция на сульфид-ионы |
Обсуждение: «Таблицы качественных реакций»
(Правила комментирования)
Главная » КАЧЕСТВЕННЫЕ РЕАКЦИИ » Качественные реакции для газов
Качественные реакции для газов
Качественные реакции на неорганические газообразные вещества.

« Установление качественного состава предельных углеводородов
Качественные реакции щелочных и щелочноземельных металлов по окраске пламени »
Написать комментарий
Имя (обязательно)
Почта (скрыта) (обязательно)
Сайт
Качественные реакции на катионы.
|
Катион |
Реагент или воздействие |
Внешний эффект |
Краткое ионное уравнение реакции на катион |
|
Н+ |
Индикаторы |
Изменение цвета: универсальный индикатор и лакмус покраснеют, метиловый оранжевый—порозовеет. |
Не записываем. |
|
Na+ |
Пламя |
Окраска пламени становится равномерно желтой. |
Не записываем. |
|
K+ |
Пламя |
Окраска пламени становится равномерно фиолетовой. |
Не записываем. |
|
Ca2+ |
|
Окрашивает бесцветное пламя горелки в красный цвет |
|
|
Ag+ |
Раствор с анионом Cl- |
Выпадает белый творожистый осадок, не растворимый в азотной кислоте, чернеющий на свету. |
Ag++Cl— = AgCl↓ |
|
NH4+ |
Раствор щелочи при нагревании |
Запах аммиака. Влажная индикаторная бумага дает изменение как на ион ОН— |
NH4++OH— = NH3↑+H2O |
|
Cu2+ |
Раствор щелочи |
В голубом или синем растворе соли выпадает осадок синего цвета. |
Cu2++2OH— = Cu(OH)2↓ |
|
Ba2+ |
1) пламя; 2) раствор с анионом SO42- |
1) Окраска пламени становится равномерно желто-зеленой; 2) выпадает белый осадок, который в кислотах не растворяется. |
1)Не записываем; 2)Ba2++SO42- = BaSO4↓ |
|
Fe2+ |
Красная кровяная соль K3(Fe(CN)6) |
Выпадение темно-синего осадка. |
K++Fe2++(Fe(CN)6)3-= =KFe(Fe(CN)6)↓ |
|
Ca2+ |
Пламя |
Окраска пламени становится равномерно кирпично-красной. |
Не записываем. |
|
Fe3+ |
1) Желтая кровяная соль K4(Fe(CN)6); 2) роданид-ион SCN—;3) раствор щелочи |
1) Выпадение синего осадка; 2) кроваво-красное окрашивание раствора; 3) выпадение бурого осадка. |
1)K++Fe3++(Fe(CN)64-= =KFe(Fe(CN)6)↓ 2)не записываем 3)Fe3++3OH— = Fe(OH)3↓ |
Качественные реакции на анионы.
|
Анион |
Реагент |
Внешний эффект |
Краткое ионное уравнение реакции на катион |
|
ОН— |
Индикаторы |
Изменение цвета: универсальный индикатор и лакмус посинеют, метиловый оранжевый—пожелтеет. |
Не записываем. |
|
Cl— |
Раствор с катионом Ag+ |
Выпадает белый творожистый осадок, не растворимый в азотной кислоте, чернеющий на свету. |
Cl—+Ag+ = AgCl↓ |
|
Br— |
Раствор с катионом Ag+ |
Выпадение светло-желтого осадка, который растворяется в азотной кислоте и темнеет на свету. |
Br—+Ag+ = AgBr↓ |
|
J— |
Раствор с катионом Ag+ |
Выпадение желтого осадка, который растворяется в азотной кислоте и темнеет на свету. |
J—+Ag+ = AgJ↓ |
|
S2- |
Раствор с катионом Pb2+ |
Выпадение черного осадка. |
S2-+Pb2+ = PbS↓ |
|
SO42- |
Раствор с катионом Ba2+ |
Выпадает белый осадок, который в кислотах не растворяется. |
SO42-+Ba2+ = BaSO4↓ |
|
SO32- |
Раствор с катионом H+ |
Выделяется газ, имеющий запах жженой спички. |
SO32-+2H+ = H2O+SO2↑ |
|
CO32- |
Раствор с катионом Ca2+ |
Выпадает белый осадок, который в кислотах растворяется с выделением газа без цвета и запаха. |
CO32-+Ca2+ = CaCO3↓ |
|
PO43- |
Раствор с катионом Ag+ |
Выпадение желтого осадка, который растворяется в азотной кислоте. |
PO43-+3Ag+ = Ag3PO4↓ |
Распознавание газов
|
Газ |
Реагент |
Аналитический эффект |
|
СО2 |
Са(ОН)2 |
Помутнение известковой воды |
|
O2 |
|
Вспыхивание тлеющей лучинки |
|
Н2 |
|
Лающий хлопок при поджигании |
|
NH3 |
OH—, to |
Посинение красной лакмусовой бумажки, малиновое окрашивание фенолфталеиновой бумажки. Появление тумана при поднесении стеклянной палочки, смоченной концентрированной HCl |
Качественные реакции в органической химии
|
Вещество или класс веществ |
Реагент |
Аналитический эффект |
|
Алканы |
|
Горят бесцветным пламенем |
|
Непредельные соединения (алкены, алкины, алкадиены) |
Br2 (водн.) |
Обесцвечивание бромной воды |
|
KMnO4 |
Обесцвечивание подкисленного раствора перманганата калия |
|
|
Алкины (терминальные) |
Ag2O (аммиачный р-р) |
Выпадение творожистого осадка серого цвета |
|
Спирты первичные |
СuO, to |
Покраснение прокаленной медной проволоки |
|
Спирты многоатомные |
Сu(OH)2 |
Образование раствора ярко-синего цвета |
|
Фенол |
Fe3+ |
Образование раствора сиренево-фиолетового цвета |
|
Br2 (водн.) |
Выпадение белого осадка |
|
|
Альдегиды |
Ag2O (аммиачный р-р), to |
Образование налета металлического серебра на стенках сосуда – «серебряное зеркало» |
|
Cu(OH)2, to |
Выпадение кирпично-красного осадка Cu2O |
|
|
Карбоновые кислоты (низшие) |
СО32- |
Бурное выделение газа |
|
Анилин |
Br2 (водн.) |
Выпадение белого осадка |
|
Алифатические амины |
|
Посинение красной лакмусовой бумаги |
|
Углеводы (восстанавливающие) |
Cu(OH)2, to |
Образование раствора ярко-синего цвета, при нагревании окраска исчезает и выпадает осадок кирпично-красного цвета |
|
Белки |
Cu(OH)2, ОН— |
Фиолетовая окраска раствора (биуретовая реакция) |
|
HNO3 |
Появление желтой окраски (ксантопротеиновая реакция) |
- Взрослым: Skillbox, Хекслет, Eduson, XYZ, GB, Яндекс, Otus, SkillFactory.
- 8-11 класс: Умскул, Лектариум, Годограф, Знанио.
- До 7 класса: Алгоритмика, Кодланд, Реботика.
- Английский: Инглекс, Puzzle, Novakid.
Получение газообразных веществ. Качественные реакции на газообразные вещества (кислород, водород, углекислый газ, аммиак)
В зависимости от плотности газа относительно плотности воздуха используют разные приспособления для получения газов. Так, самые простейшие газы собирают в пробирки.
Если газ тяжелее воздуха, то колба с реактивами и пробирка для сбора газа располагаются вертикально, при этом горлышки сосудов направлены вверх, и в них опускаются концы соединяющей сосуды трубки.
Если газ легче воздуха, то колба с реактивами располагается горизонтально, а пробирка для сбора газа размещается вертикально, при этом её горлышко направлено вниз.
Аппарат Киппа – одно из самых универсальных приспособлений для получения большого объёма газа. Он состоит из трёх стеклянных частей: верхнего сосуда, средней колбы-реактора и нижнего сосуда. В реакторе размещена воронка, и к нему же через боковое отверстие, закрытое пробкой, крепится газоотводная трубка с зафиксированным на ней краном.
Принцип работы этого аппарата заключается в его периодическом действии:
- В реактор помещают твёрдый реагент, частицы которого должны соответствовать такому размеру, чтобы они не могли попасть в нижний сосуд. После этого боковое отверстие реактора закрывают пробкой с трубкой.
- Далее открывают кран, через воронку наливают жидкий реагент.
- Для вытеснения воздуха пропускают газ через трубку в течение часа. Затем кран перекрывают.
- В это время жидкий реагент начинает вытесняться газом через воронку в нижний сосуд.
Если требуется взаимодействие с газом, то открывают кран. По окончании работы с газом кран необходимо перекрыть.
Получение водорода
Водород H2 – это самый лёгкий газ, не имеющий цвета и запаха. Существует несколько способов получения водорода в лабораторных условиях:
- путём электролиза воды;
- в результате взаимодействия цинка с не концентрированной соляной или серной кислотой;
- в результате взаимодействия алюминия на щелочной раствор.
Электролиз воды представляет собой процесс, в ходе которого дистиллированная вода под действием электрического тока распадается на кислород и водород, при этом водород образуется на отрицательном электроде, т. е. катоде.
2H2O + Q → 2H2 + O2, где Q – энергия.
Реакция цинка и кислоты
Реакция, в которой взаимодействуют цинк и кислота, проводится в аппарате Киппа. В реактор помещается цинк в виде немного расплавленных палочек. В верхний сосуд через воронку добавляют соляную кислоту. Кислота в ходе работы аппарата прогоняется через трубку в нижний сосуд. Заполняя нижний сосуд, кислота вступает в реакцию с палочками цинка, при этом образуются хлорид цинка и испаряющийся водород:
Zn + 2HCl = ZnCl2 + H2↑.
Газообразный водород выходит из аппарата через трубку. Если трубку перекрыть краном, то водород начнёт давить на кислотный раствор. Затем следует вытеснение кислоты из нижнего сосуда в обратном направлении к верхнему сосуду. При этом взаимодействие кислоты с цинком прекращается, соответственно, прекращается и испарение водорода.
Если требуется небольшое количество водорода, то в лабораториях используют аппарат Кирюшкина. Он представляет собой закреплённую на штативе цилиндрическую колбу, через горлышко которой проходит воронка, достающая до дна. На горлышке колбы размещают резиновую прокладку.
Цинк помещают на резиновую прокладку, а кислоту заливают через воронку. Принцип дальнейшей реакции аналогичен процессу, проходящему в аппарате Киппа. Водород при взаимодействии цинка и кислоты выделяется через трубку, вставленную в боковое отверстие цилиндрической колбы.
Если в реакции использовать серную кислоту, то важно следить за её концентрацией. Поскольку слишком концентрированная серная кислота добавляет к получаемому водороду примеси в виде оксида серы и сероводорода.
Кроме этого, от чистоты используемого цинка также зависит чистота водорода. Например, если использовать загрязнённый цинк, то вместо чистого водорода можно получить ядовитые газообразные соединения: арсин, или мышьяковистый водород, а также фосфин. В этом случае газы приобретают характерный запах.
Если всё же не удалось избежать загрязнения водорода, то для его очистки используют подкисленный раствор перманганата калия или дихромата калия, через который и пропускают загрязнённый водород. После этого водород необходимо обезводить, для этого его пропускают сначала через раствор едкого калия, затем через раствор серной кислоты.
Реакция алюминия и щелочного раствора
Получение водорода путём взаимодействия алюминия с щелочным раствором используется для наполнения аэростатов. Это обусловлено меньшими затратами в объёмах реагентов. Например, для получения 1 м3 водорода необходимо около трёх кг цинка, тогда как в реакции с алюминием используется всего около 900 гр. этого вещества.
Так, в реакции с алюминием участвует водный раствор гидроксида натрия. В результате взаимодействия образуется соль чёрного цвета, тетрагидроксоалюминат натрия, и выделяется водород:
2Al + 2 NaOH + 6H2O = 2Na[Al(OH)2] + 3H2↑.
Получение кислорода
Кислород O2 – это бесцветный газ, не имеющий запаха. Он тяжелее воздуха и плохо растворяется в воде. Получение кислорода в лаборатории основывается на разложении сложных соединений, насыщенных кислородом. К таким веществам относят пероксид водорода, бертолетова соль или перманганат калия.
Получение кислорода из пероксида водорода
Этот метод получения кислорода проводится в специальном приборе, который состоит из колбы Вюрца, т. е. круглодонной колбы с отводом, воронки, трубки, через которую будет поступать газ, а также из сосуда, в который будет поступать кислород через трубку.
Перед началом реакции в колбу Вюрца закладывают порошкообразный диоксид марганца MnO2, который будет выступать в качестве катализатора разложения. Затем через воронку по каплям добавляют к катализатору раствор пероксида водорода H2O2.
В ходе реакции начинается выделение кислорода, который постепенно накапливается в другой колбе. Поскольку кислород тяжелее воздуха, то его сбор происходит за счёт вытеснения воздуха.
2H2O2 2H2O + O2↑.
Получение кислорода из бертолетовой соли или перманганата калия
Кислород можно получить из бертолетовой соли либо из перманганата калия путём их разложения. Эта реакция происходит в специальном приборе, который состоит из закреплённой на штативе горизонтально под углом пробирки, горлышко которой закрывают специальной резиновой прокладкой.
Через эту прокладку из горлышка выходит конец трубки, а второй конец помещается в кристаллизатор с водой. Рядом с кристаллизатором находится перевёрнутая вниз цилиндрическая пробирка, также наполненная водой.
Перманганат калия или бертолетова соль смешивается с катализатором диоксидом магния и помещается на дно закреплённой штативом пробирки. При равномерном постепенном нагреве спиртовкой дна пробирки начинается распад смешанного с катализатором вещества. Происходит выделение кислорода, который движется по трубке в перевёрнутую цилиндрическую пробирку, вытесняя собой воду.
2KClO3 2KCl + 3O2↑;
2KMnO4 K2MnO4 + MnO2 + O2↑.
Метод электролиза воды
Как и в случае с водородом, кислород можно получить путём воздействия на дистиллированную воду постоянным электрическим током. При этом происходит выделение не только кислорода, но и водорода.
Устройство для электролиза воды может иметь любую конструкцию, например, быть представлено в виде U-образной трубки или химического стакана.
К дистиллированной воде добавляют некоторое количество щёлочи или серной кислоты для лучшей электропроводности, поскольку вода сама по себе является плохим проводником. Выделение кислорода происходит на положительном электроде, т. е. аноде.
Получение углекислого газа
Углекислый газ, или четырёхвалентный оксид углерода CO2, представляет собой хорошо растворимый в воде бесцветный газ, не имеющий запаха. Его плотность больше плотности воздуха. Углекислый газ не способен поддерживать реакцию горения.
Получение CO2 в условиях лаборатории сводится к методу вытеснения воздуха за счёт большей плотности путём реакции между кислотами и карбонатами.
Эту реакцию обычно проводят в аппарате Киппа, а если необходимо получить небольшое количество углекислого газа, то получение происходит в приборе Кирюшкина.
В реактор аппарата вводят кусочки мрамора, через воронку в верхний сосуд заливают не концентрированную соляную кислоту. За счёт воздействия кислоты на карбонат кальция происходит выделение углекислого газа:
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑.
Получение аммиака
Аммиак NH3 – хорошо растворимый в воде бесцветный газ, обладающий резким запахом. Плотность аммиака меньше плотности воздуха.
Получение аммиака основывается на способности солей аммония разлагаться под воздействием на них щёлочи, при этом происходит выделение газообразного аммиака.
Реакция разложения солей аммония проводится в приборе, который состоит из горизонтально расположенной на штативе пробирки, наклонённой немного вниз во избежание образования капелек воды в ходе реакции. Эта пробирка соединяется газоотводной трубкой с расположенной горлышком вниз пробиркой. Горлышко пробирки-приёмника закрывается ватой.
Реакционную пробирку наполняют смесью хлорида аммония и натровой извести. Дно пробирки постепенно нагревают. В результате реакции происходит выделение аммиака, который скапливается в расположенной вертикально пробирке:
Ca(OH)2 + 2NH4Cl CaCl2 + 2H2O + 2NH3↑.
Качественные реакции на газообразные вещества
Для определения наличия кислорода проводят качественную реакцию путём помещения тлеющей лучины в сосуд. Поскольку кислород поддерживает реакцию горения, то лучина должна вспыхнуть при наличии в сосуде чистого кислорода.
Как и в случае с кислородом, качественной реакцией на водород считается реакция горения. Пробирку, заполненную водородом, прогревают над пламенем спиртовки или горелки. В пробирке чистый водород быстро загорается, при этом реакция горения протекает бурно, с характерными звуками и голубоватым пламенем. При проведении качественной реакции следует проявлять осторожность и заранее проверять водород на чистоту, поскольку в смеси с воздухом водород становится взрывоопасным.
Качественная реакция на углекислый газ происходит за счёт взаимодействия CO2 с насыщенным раствором гидроокиси кальция, т. е. известковой водой. Когда углекислый газ проходит через это раствор, то происходит образование мелкокристаллического осадка карбоната кальция, при этом раствор становится мутным. В этот раствор помещается лакмусовая бумажка, которая при наличии углекислого газа должна посинеть.
CO2 + Ca(OH)2 = CaCO3↓ + H2O.
Наличие аммиака определяется путём поднесения друг к другу двух стеклянных палочек. Одна палочка обтирается раствором аммиака, а другая – раствором соляной кислоты. При поднесении их друг к другу появляется белый дым:
NH3 + HCl = NH4Cl.
Кроме этого, индикатором наличия аммиака служит посиневшая лакмусовая бумага, опущенная в водный раствор аммиака. Это обусловлено тем, что водный аммиачный раствор представляет собой основание:
NH3 + H2O NH4– + OH–.
Качественные реакции органических соединений (Таблица)
Справочная таблица содержит качественные реакции органических соединений, такие как алканы, алкены, бензол, фенол, спирты, амины, альдегиды, карбоновые кислоты и другие вещества.
Таблица качественные реакции органических соединений
|
Органическое соединение |
Реактив (реагент) |
Качественные реакции органических соединений |
Запах |
|
Алканы |
Действие пламя |
Обычно определяют путем исключения. Низшие алканы горят голубоватым пламенем |
Есть запах |
|
Алкены С=С |
1) Бромная вода 2) Раствор КМnO4 3) Горение |
1) Обесцвечивание раствора 2) Обесцвечивание раствора, выпадение бурого осадка МnО2↓ 3) Горят слегка желтоватым пламенем (частицы углерода) |
Есть запах |
|
Алкины CH=CH или R-C=CH |
Ag2O (NH2 · H2O) |
Бледно-желтый осадок Ag3O3↓ |
— |
|
CuCl (NH3 · H2O) |
Красный осадок Cu2O2↓ |
— |
|
|
Толуол |
KMnO4 (раствор) (кислотный раствор) |
Обесцвечивание раствора (при нагревании) |
— |
|
Бензол |
Горение |
Качественную реакцию бензола обычно определяют путем исключения. Горит коптящим пламенем |
Есть запах |
|
Фенол |
1) Бромная вода 2) Раствор Na2СО3 3) FeCl3 |
1) Обесцвечивание, выпадение бело-желтого осадка трибромфенола 2) Выделение углекислого газа 3) Фиолетовое окрашивание |
Есть запах |
|
Спирты |
1) Na 2) Горение 3) Мерная горячая прокаленная Сu-проволока |
1) Выделение водорода 2) Горят светлым голубоватым пламенем 3) Восстановление красной окраски у прокаленной горячей медной проволоки |
Есть запах |
|
Многоатомные спирты |
Сu(ОН)2 + NaOH |
Синее окрашивание — образование глицератов и другое |
Нет |
|
Амины |
1) Лакмус 2) HHal |
1) В водном растворе — синее окрашивание 2) Образуют соли с галогеноводородами — после выпаривания твердый осадок |
Есть запах |
|
Анилин |
1) Бромная вода 2) HHal |
1) Обесцвечивание бромной воды, выпадение осадка триброманилина 2) После упаривания твердый осадок — соль гидрогалогенида анилина |
Есть запах |
|
Альдегиды -CHO |
1) Аg2О 2) Сu(ОН)2 |
1) Реакция серебряного зеркала 2) Выпадение красного осадка Сu2O↓ |
Есть запах |
|
Карбоновые кислоты -COOH |
1) Лакмус 2) Na2CO2 (раствор) |
1) Красное окрашивание 2) Выделение газа CO2↑ |
Есть запах |
|
Муравьиная кислота |
Ag2O (NH2 · H2O) |
Реакция серебряного зеркала (при нагревании) |
Есть запах |
|
Олеиновая кислота |
Br2 (раствор) |
Обесцвечивание |
Есть запах |
|
Уксусная кислота |
Na2CO2 (раствор) |
Выделение газа CO2↑ , характерный запах уксуса |
Есть запах |
|
Крахмал |
Раствор I2 в KI или спиртовой раствор иода |
При качественной реакции на органическое соединение крахмал происходит синее окрашивание |
Нет |
|
Белки |
Конц. HNO3 |
Желтое окрашивание, при добавлении щелочного раствора — оранжевое |
Нет |
|
Глюкоза -CHO |
Cu(OH)2, tº (свежеприготовленный из 2х капель CuSO4 и 1 мл NaOH) 1) Без tº 2) С tº |
1) Образование хелата 2) Выпадение красного осадка Cu2O |
Нет |
|
Сахароза |
Cu(OH)2 взвесь |
Растворение осадка |
Нет |
|
Cl-производные |
Cu + пламя |
Зеленое окрашивание пламени парами CuCl2 |
Нет |
|
Мыло (стеарат натрия) |
1) Лакмус 2) HCl |
1) Щелочная среда в результате гидролиза окрашивается в синий цвет 2) Белый осадок ввиде хлопьев стеариновой кислоты |
Нет |
_______________
Источник информации:Насонова А.Е. Химия в таблицах. 8-11 класс. Справочное пособие, 2000
Чтобы поделиться, нажимайте
В ЕГЭ и ЦТ по химии каждый год присутствуют задания на определения веществ в пронумерованных пробирках, задания с зашифрованными буквами веществами (А, Б, В и т.д.), задания на различение веществ и т.п. Для выполнения этих заданий вам необходимо знать качественные реакции на определение (распознавание) веществ. Предлагаю вам выборку качественных реакций с видео-опытами. Список реакций НЕ является полным, но этого достаточно для ЕГЭ и ЦТ по химии. Учтите, что качественные реакции, которые прведены первыми для каждого вещества (иона) являются наиболее используемыми на практике, а также в заданиях ЕГЭ и ЦТ.
Оглавление (кликайте, чтобы не листать):
Основные качественные реакции на катионы
Основные качественные реакции на анионы
Окраска (цвет) всех осадков и их особенности
Качественные реакции для индивидуальных веществ
Общие правила различения веществ друг от друга
Примеры задания из ЕГЭ и ЦТ на эту тему с видео-объяснениями
Для качественного анализа пригодны не все реакции, а лишь те, которые сопровождаются каким-либо внешним эффектом:
- Образование характерных осадков
- Растворение вещества
- Появление (изменение) окраски
- Выделение газов
- Изменение запаха
- Окрашивание пламени
ОСНОВНЫЕ КАЧЕСТВЕННЫЕ РЕАКЦИИ НА КАТИОНЫ
| Катион | Реактив | Наблюдаемые признаки и ионное уравнение | Примеры уравнений реакций/примечания |
| Li+ | F— | Помутнение раствора из-за образования малорастворимого вещества белого цвета
Li+ + F— = LiF↓ |
LiNO3 + AgF = LiF↓ + AgNO3
CH3COOLi + NH4F = LiF↓ +CH3COONH4 |
| PO43- | Помутнение раствора из-за образования малорастворимого вещества белого цвета
3Li+ + PO43-= Li3PO4↓ |
3LiOH + Na3PO4 = Li3PO4↓ + 3NaOH
3LiI + K3PO4 = Li3PO4↓ + 3KI |
|
| Пламя | Карминово-красное окрашивание (ближе к малиновому) | ||
| Видео-опыты по обнаружению ионов лития Li+ Развернуть/свернуть Изменение цвета пламени солями лития |
|||
| Na+, K+, Rb+, Cs+ | Не возможно обнаружить в растворе (нельзя обнаружить только для заданий ЕГЭ и ЦТ, но в реальности существуют качественные реакции). | ||
| Na+ | Пламя | Жёлтое окрашивание | |
| K+ | Пламя | Фиолетовое окрашивание | |
| Rb+ | Пламя | Красно-голубое окрашивание | |
| Cs+ | Пламя | Голубоватое окрашивание | |
| Видео-опыты по обнаружению ионов лития Na+, K+, Rb+, Cs+ Развернуть/свернуть Изменение цвета пламени солями натрия Изменение цвета пламени солями калия Изменение цвета пламени солями рубидия Изменение цвета пламени солями цезия |
|||
| Са2+ | СO32- | Появление белого осадка
Ca2+ + CO32- = CaCO3↓ |
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
Ca(NO3)2 + K2CO3 = CaCO3↓ + 2KNO3 |
| F— | Появление белого осадка
Ca2+ + 2F— = CaF2↓ |
CaBr2 + 2NaF = CaF2↓ + 2NaBr
CaI2 + 2NH4F = CaF2↓ + 2NH4I |
|
| SO32- | Появление белого осадка
Ca2+ + SO32- = CaSO3↓ |
Ca(NO3)2 + Na2SO3 = CaSO3↓ + 2NaNO3
(CH3COO)2Ca + Li2SO3 = CaSO3↓ + 2CH3COOLi |
|
| SiO32- | Появление белого осадка
Ca2+ + SiO32- = CaSiO3↓ |
Ca(HS)2 + K2SiO3 = CaSiO3↓ + 2KHS
CaCl2 + Na2SiO3 = CaSiO3↓ + 2NaCl |
|
| PO43- | Появление белого осадка
3Ca2+ + 2PO43- = Ca3(PO4)2↓ |
3Ca(HCO3)2 + 2K3PO4 = Ca3(PO4)2↓ + 6KHCO3
3Ca(NO2)2 + 2Na3PO4 = Ca3(PO4)2↓ + 6NaNO2 |
|
| HPO42- | Появление белого осадка
Ca2+ + HPO42-= CaHPO4↓ |
CaCl2 + Na2HPO4 = CaHPO4↓ + 2NaCl
Ca(NO3)2 + K2HPO4 = CaHPO4↓ + 2KNO3 |
|
| SO42- | Помутнение раствора из-за образования малорастворимого вещества белого цвета
Ca2+ + SO42- = CaSO4↓ |
Ca(NO3)2 + Na2SO4 = CaSO4↓ + 2NaNO3
CaCl2 + MgSO4 = CaSO4↓ + MgCl2 |
|
| Пламя | Кирпично-красное окрашивание | ||
| Видео-опыты по обнаружению ионов кальция Ca2+ Развернуть/свернуть Реакция между карбонатом натрия и хлоридом кальция Реакция между фторидом натрия и бромидом кальция Реакция между сульфатом магния и хлоридом кальция Изменение цвета пламени солями кальция |
|||
| Ba2+, Sr2+ | SO42- | Появление белого мелкодисперсного осадка (нерастворимого в килотах), напоминающего молоко
Ba2+ + SO42- = BaSO4↓ Sr2+ + SO42- = SrSO4↓ |
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Sr(NO3)2 + H2SO4 = SrSO4↓ + 2HNO3 |
| СO32- | Появление белого осадка
Ba2+ + CO32- = BaCO3↓ Sr2+ + CO32- = SrCO3↓ |
BaCl2 + Na2CO3 = BaCO3↓ + 2NaCl
Sr(NO3)2 + K2CO3 = SrCO3↓ + 2KNO3 |
|
| F— | Помутнение раствора из-за образования малорастворимого вещества белого цвета для бария и появление белого осадка для стронция
Ba2+ + 2F— = BaF2↓ Sr2+ + 2F— = SrF2↓ |
BaBr2 + 2NaF = BaF2↓ + 2NaBr
SrI2 + 2NH4F = SrF2↓ + 2NH4I |
|
| SO32- | Появление белого осадка
Ba2+ + SO32- = BaSO3↓ Sr2+ + SO32- = SrSO3↓ |
Ba(NO3)2 + Na2SO3 = BaSO3↓ + 2NaNO3
(CH3COO)2Sr + Li2SO3 = SrSO3↓ + 2CH3COOLi |
|
| SiO32- | Появление белого осадка
Ba2+ + SiO32- = BaSiO3↓ Sr2+ + SiO32- = SrSiO3↓ |
Ba(HSO3)2 + K2SiO3 = BaSiO3↓ + 2KHSO3
SrCl2 + Na2SiO3 = SrSiO3↓ + 2NaCl |
|
| PO43- | Появление белого осадка
3Ba2+ + 2PO43- = Ba3(PO4)2↓ 3Sr2+ + 2PO43- = Sr3(PO4)2↓ |
3Ba(HCO3)2 + 2K3PO4 = Ba3(PO4)2↓ + 6KHCO3
3Sr(NO2)2 + 2Na3PO4 = Sr3(PO4)2↓ + 6NaNO2 |
|
| HPO42- | Появление белого осадка
Ba2+ + HPO42-= BaHPO4↓ Sr2+ + HPO42-= SrHPO4↓ |
BaCl2 + Na2HPO4 = BaHPO4↓ + 2NaCl
Sr(NO3)2 + K2HPO4 = SrHPO4↓ + 2KNO3 |
|
| CrO42- | Появление жёлтого осадка
Ba2+ + CrO42-= BaCrO4↓ Sr2+ + CrO42-= SrCrO4↓ |
Ba(NO3)2 + K2CrO4 = BaCrO4↓ + 2KNO3
SrCl2 + Na2CrO4 = SrCrO4↓ + 2NaCl |
|
| Пламя | Желто-зеленое окрашивание для ионов бария
Карминово-красное окрашивание для ионов стронция |
||
| Видео-опыты по обнаружению ионов бария Ba2+ и стронция Sr2+ Развернуть/свернуть Качественная реакция на сульфит- и сульфат-ион Реакция между нитратом стронция и сульфатом калия Реакция между хлоридом бария и карбонатом натрия Реакция между нитратом стронция и карбонатом натрия Реакция между нитратом стронция и фторидом натрия Реакция между нитратом бария и хроматом калия Реакция между хлоридом бария и хроматом калия Изменение окраски пламени солями стронция Изменение окраски пламени солями бария |
|||
| Mg2+ | OH— | Появление белого осадка (нерастворимого в избытке щёлочи)
Mg2+ + 2OH— = Mg(OH)2↓ |
MgCl2 +2NaOH = Mg(OH)2↓ + 2NaCl
Mg(NO3)2 +2KOH = Mg(OH)2↓ + 2KNO3 |
| СO32- | Появление белого осадка
Mg2+ + CO32- = MgCO3↓ А также может образоваться основная соль – гидроксокарбонат (MgOH)2CO3↓ из-за гидролиза |
MgCl2 + Na2CO3 = MgCO3↓ + 2NaCl
2MgCl2+2Na2CO3+H2O=(MgOH)2CO3↓ + 4NaCl + CO2↑ |
|
| F— | Появление белого осадка
Mg2+ + 2F— = MgF2↓ |
MgBr2 + 2NaF = MgF2↓ + 2NaBr
MgI2 + 2NH4F = MgF2↓ + 2NH4I |
|
| SO32- | Помутнение раствора из-за образования малорастворимого вещества белого цвета
Mg2+ + SO32- = MgSO3↓ |
(CH3COO)2Mg + Li2SO3 = MgSO3↓ + 2CH3COOLi
Mg(NO3)2 + Na2SO3 = MgSO3↓ + 2NaNO3 |
|
| SiO32- | Появление белого осадка
Mg2+ + SiO32- = MgSiO3↓ |
MgSO4 + K2SiO3 = MgSiO3↓ + K2SO4
MgCl2 + Na2SiO3 = MgSiO3↓ + 2NaCl |
|
| PO43- | Появление белого осадка
3Mg2+ + 2PO43- = Mg3(PO4)2↓ |
3Mg(HCO3)2 + 2K3PO4 = Mg3(PO4)2↓ + 6KHCO3
3MgSO4 + 2Na3PO4 = Mg3(PO4)2↓ + 3Na2SO4 |
|
| HPO42- | Помутнение раствора из-за образования малорастворимого вещества белого цвета
Mg2+ + HPO42-= MgHPO4↓ |
MgCl2 + Na2HPO4 = MgHPO4↓ + 2NaCl
Mg(NO3)2 + K2HPO4 = MgHPO4↓ + 2KNO3 |
|
| Видео-опыты по обнаружению ионов магния Mg2+ Развернуть/свернуть Реакция между хлоридом магния и гидроксидом калия Реакция между хлоридом магния и карбонатом натрия |
|||
| NH4+ | OH— при нагревании | Выделение газа с резким запахом, посинение влажной лакмусовой бумажки
NH4+ + OH— = NH3↑ + H2O |
NH4Cl + NaOH = NaCl + NH3↑ + H2O
(NH4)2SO4 + 2KOH = K2SO4 + 2NH3↑ + 2H2O |
| Видео-опыты по обнаружению ионов аммония NH4+ Развернуть/свернуть Реакция между хлоридом аммония и гидроксидом натрия |
|||
| Zn2+ | OH— | Выпадение белого осадка гидроксида цинка при приливании первых порций щелочи и его растворение при дальнейшем приливании щелочи за счёт амфотерных свойств.
1) Zn2+ + 2OH— = Zn(OH)2↓ 2) Zn(OH)2 + 2OH— = [Zn(OH)4]2- |
1) Zn(NO3)2 + 2NaOH = Zn(OH)2↓ + 2NaNO3
2) Zn(OH)2 + 2NaOH = Na2[Zn(OH)4] Помните, что гидроксиды катионов Al3+, Cr3+ не переводятся в комплексное соединение гидратом аммиака. Zn2+ при добавлении конц. раствора аммиака сначала образуется Zn(OH)2, а при избытке аммиак способствует растворению осадка: Zn(OH)2 + 4NH3 = [Zn(NH3)4](OH)2 |
| S2- | Появление белого осадка (легко растворимого в минеральных кислотах)
Zn2+ + S2- = ZnS↓ |
Zn(NO3)2 + Na2S = ZnS↓ + 2NaNO3
ZnSO4 + K2S = ZnS↓ + K2SO4 ZnS не выпадает в осадок при насыщении растворов солей цинка сероводородом |
|
| СO32- | Появление белого осадка
Zn2+ + CO32- = ZnCO3↓ А также может образоваться основная соль – гидроксокарбонат (ZnOH)2CO3↓ из-за гидролиза |
ZnCl2 + Na2CO3 = ZnCO3↓ + 2NaCl
2ZnCl2+2K2CO3+H2O=(ZnOH)2CO3↓ + 4KCl + CO2↑ |
|
| PO43- | Появление белого осадка
3Zn2+ + 2PO43- = Zn3(PO4)2↓ |
3ZnSO4 + 2Na3PO4 = Zn3(PO4)2↓ + 3Na2SO4
3Zn(NO3)2 + 2Na3PO4 = Zn3(PO4)2↓ + 6NaNO3 |
|
| CrO42- | Появление жёлтого осадка
Zn2+ + CrO42-= ZnCrO4↓ |
Zn(NO3)2 + K2CrO4 = ZnCrO4↓ + 2KNO3
ZnCl2 + Na2CrO4 = ZnCrO4↓ + 2NaCl |
|
| Видео-опыты по обнаружению ионов цинка Zn2+ Развернуть/свернуть Реакция между нитратом цинка и гидроксидом натрия Реакция между хлоридом цинка и карбонатом натрия |
|||
| Al3+ | OH— | Выпадение белого осадка гидроксида алюминия при приливании первых порций щелочи и его растворение при дальнейшем приливании щелочи за счёт амфотерных свойств.
1) Al3+ + 3OH— = Al(OH)3↓ 2) Al(OH)3 + OH— = [Al(OH)4]— или Al(OH)3 + 3OH— = [Al(OH)6]3- |
1) AlCl3 + 3KOH = Al(OH)3↓ + 3KCl
2) Al(OH)3 + KOH = K[Al(OH)4] или Al(OH)3 + 3KOH = K3[Al(OH)6] Помните, что гидроксид катиона Al3+ не переводится в комплексное соединение гидратом аммиака. |
| PO43— | Появление белого осадка
Al3+ + PO43- = AlPO4↓ |
Al2(SO4)3 + 2K3PO4 = 2AlPO4↓ + 3K2SO4
AlCl3 + Na3PO4 = AlPO4↓ + 3NaCl |
|
| СO32- | Появление белого осадка и выделение бесцветного газа из-за полного гидролиза карбоната алюминия
2Al3+ + 3СO32-+ 3Н2О = 2Al(OH)3↓ + 6КCl + 3CO2↑ |
2AlCl3 + 3К2СO3+ 3Н2О = 2Al(OH)3↓ + 6КCl + 3CO2↑ | |
| Видео-опыты по обнаружению ионов алюминия Al3+ Развернуть/свернуть Амфотерность гидроксида алюминия |
|||
| Cr3+ | OH— | Выпадение серо-зелёного осадка гидроксида хрома (III) при приливании первых порций щелочи и его растворение при дальнейшем приливании щелочи за счёт амфотерных свойств.
1) Cr3+ + 3OH— = Cr(OH)3↓ 2) Cr(OH)3 + OH— = [Cr(OH)4]— или Cr(OH)3 + 3OH— = [Cr(OH)6]3- |
1) CrBr3 + 3NaOH = Cr(OH)3↓ + 3NaBr
2) Cr(OH)3 + NaOH = Na[Cr(OH)4] или Cr(OH)3 + 3NaOH = Na3[Cr(OH)6] Помните, что гидроксид хрома (III) не переводятся в комплексное соединение гидратом аммиака. Раствор, содержащий [Cr(OH)6]3-, при добавлении хлорной или бромной воды в щелочной среде становится желтым из-за образования хромат-аниона CrO42-: 2[Cr(OH)6]3- + 3Br2 + 4OH— = 2CrO42- + 6Br— + 8H2O |
| PO43— | Появление чёрного (чёрно-зелёного) осадка
Cr3+ + PO43- = CrPO4↓ |
Cr2(SO4)3 + 2K3PO4 = 2CrPO4↓ + 3K2SO4
CrCl3 + Rb3PO4 = CrPO4↓ + 3RbCl |
|
| СO32- | Появление серо-зелёного осадка и выделение бесцветного газа из-за полного гидролиза карбоната хрома (III)
2Cr3+ + 3СO32-+ 3Н2О = 2Cr(OH)3↓ + 6КCl + 3CO2↑ |
Сr2(SO4)3 + 3К2CO3 + 3Н2О = 2Cr(OH)3↓ + 3К2SO4 + 3CO2↑ | |
| Видео-опыты по обнаружению ионов хрома Cr3+ Развернуть/свернуть Амфотерность гидроксида хрома |
|||
| Fe2+ | OH— | Появление грязно-зелёного осадка (хотя должен быть белый), буреющего со временем
Fe2+ + 2OH— = Fe(OH)2↓ |
FeCl2 +2NaOH = Fe(OH)2↓ + 2NaCl
Fe(NO3)2 +2KOH = Fe(OH)2↓ + 2KNO3 |
| Fe(CN)63− (Красная кровяная соль K3[Fe(CN)6]) | Синий осадок (турнбулева синь):
K+ + Fe2+ + [Fe(CN)6]3- = KFe[Fe(CN)6]↓ |
FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6]↓+ 2KCl | |
| СO32- | Появление белого осадка
Fe2+ + CO32- = FeCO3↓ |
(NH4)2Fe(SO4)2 + Na2CO3 = FeCO3↓ + Na2SO4 + (NH4)2SO4 | |
| S2- | Появление чёрного осадка (легко растворимого в минеральных кислотах)
Fe2+ + S2- = FeS↓ |
FeSO4 + (NH4)2S = FeS↓ + (NH4)2SO4
Сульфид железа (II) можно получить только при достаточно большой концентрации ионов S2- врастворе. FeS не выпадает в осадок при насыщении растворов солей железа(II) сероводородом |
|
| Видео-опыты по обнаружению ионов железа Fe2+ Развернуть/свернуть Реакция между хлоридом железа (II) и гидроксидом натрия Качественная реакция на ион железа Fe2+ |
|||
| Fe3+ | OH— | Появление бурого осадка
Fe3+ + 3OH— = Fe(OH)3↓ |
FeCl3+2CsOH = Fe(OH)3↓ + 2CsCl
Fe(NO3)3 +2NaOH = Fe(OH)3↓ + 2NaNO3 |
| Fe(CN)64− (желтая кровяная соль) K4[Fe(CN)6] | Синий осадок (берлинская лазурь):
K+ + Fe3+ + [Fe(CN)6]4- = KFe[Fe(CN)6]↓ |
FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6]↓+ 3KCl | |
| SCN— (роданид-ион) | Появление красно-кровавого окрашивания
Fe3+ + 3SCN— = Fe(SCN)3 |
FeCl3 + 3NH4SCN = Fe(SCN)3 + 3NH4Cl | |
| PO43- | Появление жёлтого осадка
Fe3+ + PO43- = FePO4↓ |
Fe2(SO4)3 + 2K3PO4 = 2FePO4↓ + 3K2SO4
FeCl3 + Na3PO4 = FePO4↓ + 3NaCl |
|
| Видео-опыты по обнаружению ионов железа Fe3+ Развернуть/свернуть Получение гидроксида железа (III) и исследование его свойств Качественная реакция на ион железа Fe3+ |
|||
| Mn2+ | OH— | Появление белого осадка, розовеющего (буреющего) на воздухе
Mn2+ + 2OH— = Mn(OH)2↓ |
MnBr2 +2NaOH = Mn(OH)2↓ + 2NaBr
Mn(NO3)2 +2KOH = Mn(OH)2↓ + 2KNO3 |
| S2- | Появление телесно-розового осадка
Mn2+ + S2- = MnS↓ |
MnSO4 + (NH4)2S = MnS↓ + (NH4)2SO4
MnCl2 + Na2S = MnS↓ + 2NaCl |
|
| СO32- | Появление белого осадка
Mn2+ + CO32- = MnCO3↓ |
MnCl2 + Na2CO3 = MnCO3↓ + 2NaCl
Mn(NO3)2 + K2CO3 = MnCO3↓ + 2KNO3 |
|
| HPO42- | Появление белого осадка
3Mn2+ + 4HPO42- = Mn3(PO4)2↓ + 2H2PO4— |
3MnCl2 + 4Na2HPO4 = Mn3(PO4)2↓ + 6NaCl + 2NaH2PO4 | |
| Видео-опыты по обнаружению ионов марганца Mn2+ Развернуть/свернуть Реакция между нитратом марганца (II) и гидроксидом натрия Реакция между нитратом марганца (II) и карбонатом натрия |
|||
| Pb2+ | S2- | Появление чёрного осадка
Pb2+ + S2- = PbS↓ |
(CH3COO)2Pb + K2S = PbS↓ + 2CH3COOK
Pb(NO3)2 + Na2S = PbS↓ + 2NaNO3 |
| I— | Появление жёлто-золотистого осадка
Pb2+ + 2I— = PbI2↓ |
(CH3COO)2Pb + 2NaI = PbI2↓ + 2CH3COONa
Pb(NO3)2 + CaI2 = PbI2↓ + Ca(NO3)2 |
|
| SO42- | Появление белого осадка
Pb2+ + SO42- = PbSO4↓ |
(CH3COO)2Pb + K2SO4 = PbSO4↓ + 2CH3COOK
Pb(NO3)2 + H2SO4 = PbSO4↓ + 2HNO3 |
|
| Cl— | Появление белого осадка, растворимого в горячей воде
Pb2+ + 2Cl— = PbCl2↓ |
(CH3COO)2Pb + 2NaCl = PbCl2↓ + 2CH3COONa
Pb(NO3)2 + BaCl2 = PbCl2↓ + Ba(NO3)2 |
|
| OH— | Выпадение белого осадка гидроксида свинца (II) при приливании первых порций щелочи и его растворение при дальнейшем приливании щелочи за счёт амфотерных свойств.
1) Pb2+ + 2OH— = Pb(OH)2↓ 2) Pb(OH)2 + 2OH— = [Pb(OH)4]2- |
1) Pb(NO3)2 + 2NaOH = Pb(OH)2↓ + 2NaNO3
2) Pb(OH)2 + 2NaOH = Na2[Pb(OH)4] |
|
| HPO42- | Появление белого осадка
3Pb2+ + 4HPO42- = Pb3(PO4)2↓ + 2H2PO4— |
3Pb(NO3)2 + 4Na2HPO4 = Pb3(PO4)2↓ + 6NaNO3 + 2NaH2PO4 | |
| CrO42- | Появление жёлтого осадка
Pb2+ + CrO42-= PbCrO4↓ |
Pb(NO3)2 + K2CrO4 = PbCrO4↓ + 2KNO3 | |
| Видео-опыты по обнаружению ионов свинца Pb2+ Развернуть/свернуть Реакция между хлоридом свинца (II) и иодидом натрия Реакция между нитратом свинца (II) и сульфатом натрия Реакция между нитратом свинца (II) и хлоридом калия Сравнение осадков галогенидов свинца (II) Реакция между нитратом свинца (II) и хроматом калия |
|||
| Ag+ | Cl— | Появление белого творожистого осадка
Ag+ + Cl— = AgCl↓ |
AgF + NaCl = AgCl↓ + NaF
3AgNO3 + AlCl3 = 3AgCl↓ + Al(NO3)3 |
| Br— | Появление белого-жёлтого осадка
Ag+ + Br— = AgBr↓ |
AgF + KBr = AgBr↓ + KF
CH3COOAg + RbBr = AgBr↓ + CH3COORb |
|
| I— | Появление жёлтого осадка
Ag+ + I— = AgI↓ |
AgF + NaI = AgI↓ + NaF
2AgNO3 + ZnI2 = 2AgI↓ + Zn(NO3)2 |
|
| CrO42- | Появление кирпично-красного осадка
2Ag+ + CrO42-= Ag2CrO4↓ |
2AgNO3 + K2CrO4 = Ag2CrO4↓ + 2KNO3
2CH3COOAg + Na2CrO4 = Ag2CrO4↓+ 2CH3COONa |
|
| S2- | Появление чёрного-коричневого осадка
2Ag+ + S2- = Ag2S↓ |
2CH3COOAg + K2S = Ag2S↓ + 2CH3COOK
2AgNO3 + Na2S = Ag2S↓ + 2NaNO3 |
|
| OH— | Появление чёрного осадка
2Ag+ + 2OH— = Ag2O↓ + H2O |
2AgNO3 + 2KOH = Ag2O↓ + H2O + 2KNO3
2AgNO3 + Ba(OH)2 = Ag2O↓ + H2O + Ba(NO3)2 |
|
| PO43- | Появление жёлтого осадка
3Ag+ + PO43-= Ag3PO4↓ |
Na3PO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3
Rb3PO4 + 3AgNO3 = Ag3PO4↓ + 3RbNO3 |
|
| HPO42- | Появление жёлтого осадка
3Ag+ + 2HPO42- = Ag3PO4↓ + H2PO4— |
3AgNO3 + 2K2HPO4 = Ag3PO4↓ + 3KNO3 + KH2PO4 | |
| SO42- | Помутнение раствора из-за образования малорастворимого вещества белого цвета
2Ag+ + SO42- = Ag2SO4↓ |
2AgNO3 + K2SO4 = Ag2SO4↓ + 2KNO3
2CH3COOAg + Na2SO4 = Ag2SO4↓ + 2CH3COONa |
|
| Видео-опыты по обнаружению ионов серебра Ag+ Развернуть/свернуть Реакция между нитратом серебра (I) и хлоридом натрия Сравнение окраски осадков галогенидов серебра (I) Реакция между нитратом серебра (I) и сульфидом натрия Реакция между нитратом серебра (I) и хромата калия Реакция между нитратом серебра (I) и гидроксидом калия Реакция между нитратом серебра (I) и фосфорной кислотой |
|||
| Cu2+ | OH— | Появление голубого осадка Cu2+ + 2OH— = Cu(OH)2↓ | CuCl2 +2NaOH = Cu(OH)2↓ + 2NaCl
Cu(NO3)2 +2KOH = Cu(OH)2↓ + 2KNO3 |
| S2- | Появление чёрного осадка (нерастворимого в серной и соляной кислотах)
Cu2+ + S2- = CuS↓ |
(CH3COO)2Cu + K2S = CuS↓ + 2CH3COOK
Cu(NO3)2 + Na2S = CuS↓ + 2NaNO3 |
|
| I— | Образование осадка белого цвета, который выделяющимся при этом свободным йодом окрашивается в бурый цвет
2Cu2+ + 4I— = 2CuI + I2 |
2CuSO4 + 4KI = 2CuI↓ + I2 + 2K2SO4 | |
| Пламя | Ярко-синее окрашивание | ||
| Видео-опыты по обнаружению ионов меди Cu2+ Развернуть/свернуть Реакция между хлоридом меди (II) и гидроксидом натрия Реакция между сульфатом меди (II) и иодидом калия Реакция между сульфатом меди (II) и сульфидом натрия Изменение окраски пламени солями меди (II) |
|||
| H+ | Индикаторы: метилоранж и лакмус | Оранжевый метилоранж меняет свой цвет на красный.
Фиолетовый лакмус меняет свой цвет на красный. |
|
| CO32- | Выделение бесцветного газа без запаха
2H+ + CO32- = H2O + CO2↑ |
2HCl + Na2CO3 = 2NaCl + H2O + CO2↑
H2SO4 + K2CO3 = K2SO4 + H2O + CO2↑ |
|
| HCO3— | Выделение бесцветного газа без запаха
H+ + HCO3— = H2O + CO2↑ |
HNO3 + NaHCO3 = NaNO3+ H2O + CO2↑
2HBr + Ba(HCO3)2 = BaBr2 + 2H2O + 2CO2↑ |
|
| SO32- | Выделение бесцветного газа с резким запахом
2H+ + SO32- = H2O + SO2↑ |
2HBr + Rb2SO3 = 2RbBr + H2O + SO2↑
H2SO4 + Na2SO3 = Na2SO4 + H2O + SO2↑ |
|
| HSO3— | Выделение бесцветного газа с резким запахом
H+ + HSO3— = H2O + SO2↑ |
HCl + NaHSO3 = NaCl + H2O + SO2↑
2HBr + Ca(HCO3)2 = CaBr2 + 2H2O + 2SO2↑ |
|
| S2- | Выделение бесцветного газа с запахом тухлых яиц
2H+ + S2- = H2S↑ |
2HBr + K2S = 2KBr + H2S↑
H2SO4 + Na2S = Na2SO4 + H2S↑ |
|
| HS— | Выделение бесцветного газа с запахом тухлых яиц
H+ + HS— = H2S↑ |
HNO3 + NaHS = NaNO3 + H2S↑
2HBr + Sr(HS)2 = SrBr2 + 2H2S↑ |
|
| SiO32- | Образование белого студенистого осадка
2H+ + SiO32- = H2SiO3↓ |
2HBr + Na2SiO3 = 2NaBr + H2SiO3↓
H2SO4 + K2SiO3 = K2SO4 + H2SiO3↓ |
|
| Видео-опыты по обнаружению ионов водорода H+ Развернуть/свернуть Действие кислот на индикаторы Реакция между карбонатом натрия и серной кислотой Реакция между гидрокарбонатом натрия и соляной кислотой Реакция между сульфитом натрия и соляной кислотой Реакция между сульфидом калия и соляной кислотой Получение кремниевой кислоты |
ОСНОВНЫЕ КАЧЕСТВЕННЫЕ РЕАКЦИИ НА АНИОНЫ
| Анион | Реактив | Наблюдаемые признаки и ионное уравнение | Примеры уравнений реакций/примечания |
| SO42- | Ba2+ | Появление белого мелкодисперсного осадка (нерастворимого в килотах), напоминающего молоко
Ba2+ + SO42- = BaSO4↓ |
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
BaBr2 + K2SO4 = BaSO4↓ + 2KBr |
| Sr2+ | Появление белого осадка (нерастворимого в килотах)
Sr2+ + SO42- = SrSO4↓ |
SrCl2 + Na2SO4 = SrSO4↓ + 2NaCl
Sr(NO3)2 + H2SO4 = SrSO4↓ + 2HNO3 |
|
| Ca2+ | Помутнение раствора из-за образования малорастворимого вещества белого цвета
Ca2+ + SO42- = CaSO4↓ |
Ca(NO3)2 + Na2SO4 = CaSO4↓ + 2NaNO3
CaCl2 + MgSO4 = CaSO4↓ + MgCl2 |
|
| Pb2+ | Появление белого осадка
Pb2+ + SO42- = PbSO4↓ |
(CH3COO)2Pb + K2SO4 = PbSO4↓ + 2CH3COOK
Pb(NO3)2 + H2SO4 = PbSO4↓ + 2HNO3 |
|
| Ag+ | Помутнение раствора из-за образования малорастворимого вещества белого цвета
2Ag+ + SO42- = Ag2SO4↓ |
2AgNO3 + K2SO4 = Ag2SO4↓ + 2KNO3
2CH3COOAg + Na2SO4 = Ag2SO4↓ + 2CH3COONa |
|
| Видео-опыты по обнаружению сульфат ионов SO42- Развернуть/свернуть Реакция между сульфатом магния и хлоридом кальция Качественная реакция на сульфит- и сульфат-ион Реакция между нитратом стронция и сульфатом калия Реакция между нитратом свинца (II) и сульфатом натрия |
|||
| PO43- | Ag+ | Появление жёлтого осадка
3Ag+ + PO43-= Ag3PO4↓ |
Na3PO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3
Rb3PO4 + 3AgNO3 = Ag3PO4↓ + 3RbNO3 |
| Li+ | Помутнение раствора из-за образования малорастворимого вещества белого цвета
3Li+ + PO43-= Li3PO4↓ |
3LiOH + Na3PO4 = Li3PO4↓ + 3NaOH
3LiI + K3PO4 = Li3PO4↓ + 3KI |
|
| Ca2+ | Появление белого осадка
3Ca2+ + 2PO43- = Ca3(PO4)2↓ |
3Ca(HCO3)2 + 2K3PO4 = Ca3(PO4)2↓ + 6KHCO3
3Ca(NO2)2 + 2Na3PO4 = Ca3(PO4)2↓ + 6NaNO2 |
|
| Ba2+ | Появление белого осадка
3Ba2+ + 2PO43- = Ba3(PO4)2↓ |
3Ba(HCO3)2 + 2K3PO4 = Ba3(PO4)2↓ + 6KHCO3
3Ba(NO2)2 + 2Na3PO4 = Ba3(PO4)2↓ + 6NaNO2 |
|
| Sr2+ | Появление белого осадка
3Sr2+ + 2PO43- = Sr3(PO4)2↓ |
3Sr(HSO3)2 + 2K3PO4 = Sr3(PO4)2↓ + 6KHSO3
3Sr(NO3)2 + 2Cs3PO4 = Sr3(PO4)2↓ + 6CsNO3 |
|
| Mg2+ | Появление белого осадка
3Mg2+ + 2PO43- = Mg3(PO4)2↓ |
3Mg(HCO3)2 + 2K3PO4 = Mg3(PO4)2↓ + 6KHCO3
3MgSO4 + 2Na3PO4 = Mg3(PO4)2↓ + 3Na2SO4 |
|
| Zn2+ | Появление белого осадка
3Zn2+ + 2PO43- = Zn3(PO4)2↓ |
3ZnSO4 + 2Na3PO4 = Zn3(PO4)2↓ + 3Na2SO4
3Zn(NO3)2 + 2Na3PO4 = Zn3(PO4)2↓ + 6NaNO3 |
|
| Al3+ | Появление белого осадка
Al3+ + PO43- = AlPO4↓ |
Al2(SO4)3 + 2K3PO4 = 2AlPO4↓ + 3K2SO4
AlCl3 + Na3PO4 = AlPO4↓ + 3NaCl |
|
| Cr3+ | Появление чёрного (чёрно-зелёного) осадка
Cr3+ + PO43- = CrPO4↓ |
Cr2(SO4)3 + 2K3PO4 = 2CrPO4↓ + 3K2SO4
CrCl3 + Rb3PO4 = CrPO4↓ + 3RbCl |
|
| Fe3+ | Появление жёлтого осадка
Fe3+ + PO43- = FePO4↓ |
Fe2(SO4)3 + 2K3PO4 = 2FePO4↓ + 3K2SO4
FeCl3 + Na3PO4 = FePO4↓ + 3NaCl |
|
| Видео-опыты по обнаружению фосфат ионов PO43- Развернуть/свернуть Реакция между нитратом серебра (I) и фосфорной кислотой |
|||
| HPO42- | Ca2+ | Появление белого осадка
Ca2+ + HPO42-= CaHPO4↓ |
CaCl2 + Na2HPO4 = CaHPO4↓ + 2NaCl
Ca(NO3)2 + K2HPO4 = CaHPO4↓ + 2KNO3 |
| Ba2+ | Появление белого осадка
Ba2+ + HPO42-= BaHPO4↓ |
BaCl2 + Na2HPO4 = BaHPO4↓ + 2NaCl
Ba(NO3)2 + K2HPO4 = BaHPO4↓ + 2KNO3 |
|
| Sr2+ | Появление белого осадка
Sr2+ + HPO42-= SrHPO4↓ |
SrCl2 + Rb2HPO4 = SrHPO4↓ + 2RbCl
Sr(NO3)2 + Cs2HPO4 = SrHPO4↓ + 2CsNO3 |
|
| Mg2+ | Помутнение раствора из-за образования малорастворимого вещества белого цвета
Mg2+ + HPO42-= MgHPO4↓ |
MgCl2 + Na2HPO4 = MgHPO4↓ + 2NaCl
Mg(NO3)2 + K2HPO4 = MgHPO4↓ + 2KNO3 |
|
| Mn2+ | Появление белого осадка
3Mn2+ + 4HPO42- = Mn3(PO4)2↓ + 2H2PO4— |
3MnCl2 + 4Na2HPO4 = Mn3(PO4)2↓ + 6NaCl + 2NaH2PO4 | |
| Pb2+ | Появление белого осадка
3Pb2+ + 4HPO42- = Pb3(PO4)2↓ + 2H2PO4— |
3Pb(NO3)2 + 4Na2HPO4 = Pb3(PO4)2↓ + 6NaNO3 + 2NaH2PO4 | |
| Ag+ | Появление жёлтого осадка
3Ag+ + 2HPO42- = Ag3PO4↓ + H2PO4— |
3AgNO3 + 2K2HPO4 = Ag3PO4↓ + 3KNO3 + KH2PO4 | |
| Видео-опыты по обнаружению гидрофосфат ионов HPO42- Развернуть/свернуть |
|||
| CrO42- | Ba2+ | Появление жёлтого осадка
Ba2+ + CrO42-= BaCrO4↓ |
Ba(NO3)2 + Rb2CrO4 = BaCrO4↓ + 2RbNO3
BaCl2 + Cs2CrO4 = BaCrO4↓ + 2CsCl |
| Sr2+ | Появление жёлтого осадка
Sr2+ + CrO42-= SrCrO4↓ |
Sr(NO3)2 + K2CrO4 = SrCrO4↓ + 2KNO3
SrCl2 + Na2CrO4 = SrCrO4↓ + 2NaCl |
|
| Zn2+ | Появление жёлтого осадка
Zn2+ + CrO42-= ZnCrO4↓ |
Zn(NO3)2 + K2CrO4 = ZnCrO4↓ + 2KNO3
ZnCl2 + Na2CrO4 = ZnCrO4↓ + 2NaCl |
|
| Pb2+ | Появление жёлтого осадка
Pb2+ + CrO42-= PbCrO4↓ |
Pb(NO3)2 + K2CrO4 = PbCrO4↓ + 2KNO3 | |
| Ag+ | Появление кирпично-красного осадка
2Ag+ + CrO42-= Ag2CrO4↓ |
2AgNO3 + K2CrO4 = Ag2CrO4↓ + 2KNO3
2CH3COOAg + Na2CrO4 = Ag2CrO4↓+ 2CH3COONa |
|
| Видео-опыты по обнаружению хромат ионов CrO42- Развернуть/свернуть Реакция между нитратом бария и хроматом калия Реакция между хлоридом бария и хроматом калия Реакция между нитратом свинца (II) и хроматом калия Реакция между нитратом серебра (I) и хромата калия |
|||
| S2- | Pb2+ | Появление чёрного осадка
Pb2+ + S2- = PbS↓ |
(CH3COO)2Pb + K2S = PbS↓ + 2CH3COOK
Pb(NO3)2 + Na2S = PbS↓ + 2NaNO3 |
| Ag+ | Появление чёрного-коричневого осадка
2Ag+ + S2- = Ag2S↓ |
2CH3COOAg + K2S = Ag2S↓ + 2CH3COOK
2AgNO3 + Na2S = Ag2S↓ + 2NaNO3 |
|
| Cu2+ | Появление чёрного осадка (нерастворимого в серной и соляной кислотах)
Cu2+ + S2- = CuS↓ |
(CH3COO)2Cu + K2S = CuS↓ + 2CH3COOK
Cu(NO3)2 + Na2S = CuS↓ + 2NaNO3 |
|
| Zn2+ | Появление белого осадка (легко растворимого в минеральных кислотах)
Zn2+ + S2- = ZnS↓ |
Zn(NO3)2 + Na2S = ZnS↓ + 2NaNO3
ZnSO4 + K2S = ZnS↓ + K2SO4 ZnS не выпадает в осадок при насыщении растворов солей цинка сероводородом |
|
| Fe2+ | Появление чёрного осадка (легко растворимого в минеральных кислотах)
Fe2+ + S2- = FeS↓ |
FeSO4 + (NH4)2S = FeS↓ + (NH4)2SO4
Сульфид железа (II) можно получить только при достаточно большой концентрации ионов S2- врастворе. FeS не выпадает в осадок при насыщении растворов солей железа(II) сероводородом |
|
| Mn2+ | Появление телесно-розового осадка
Mn2+ + S2- = MnS↓ |
MnSO4 + (NH4)2S = MnS↓ + (NH4)2SO4
MnCl2 + Na2S = MnS↓ + 2NaCl |
|
| H+ | Выделение бесцветного газа с запахом тухлых яиц
2H+ + S2- = H2S↑ |
2HBr + K2S = 2KBr + H2S↑
H2SO4 + Na2S = Na2SO4 + H2S↑ |
|
| HS— | H+ | Выделение бесцветного газа с запахом тухлых яиц
H+ + HS— = H2S↑ |
HNO3 + NaHS = NaNO3 + H2S↑
2HBr + Sr(HS)2 = SrBr2 + 2H2S↑ |
| Видео-опыты по обнаружению сульфид ионов S2- Развернуть/свернуть Реакция между нитратом серебра (I) и сульфидом натрия Реакция между сульфатом меди (II) и сульфидом натрия Реакция между сульфидом калия и соляной кислотой |
|||
| CO32- | Ca2+ | Появление белого осадка
Ca2+ + CO32- = CaCO3↓ |
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
Ca(NO3)2 + K2CO3 = CaCO3↓ + 2KNO3 |
| H+ | Выделение бесцветного газа без запаха
2H+ + CO32- = H2O + CO2↑ |
2HCl + Na2CO3 = 2NaCl + H2O + CO2↑
H2SO4 + K2CO3 = K2SO4 + H2O + CO2↑ |
|
| Ba2+ | Появление белого осадка
Ba2+ + CO32- = BaCO3↓ |
BaCl2 + Na2CO3 = BaCO3↓ + 2NaCl
Ba(NO3)2 + K2CO3 = BaCO3↓ + 2KNO3 |
|
| Sr2+ | Появление белого осадка
Sr2+ + CO32- = SrCO3↓ |
SrCl2 + Cs2CO3 = SrCO3↓ + 2CsCl
Sr(NO3)2 + K2CO3 = SrCO3↓ + 2KNO3 |
|
| Mg2+ | Появление белого осадка
Mg2+ + CO32- = MgCO3↓ А также может образоваться основная соль – гидроксокарбонат (MgOH)2CO3↓ из-за гидролиза |
MgCl2 + Na2CO3 = MgCO3↓ + 2NaCl
2MgCl2+2Na2CO3+H2O=(MgOH)2CO3↓ + 4NaCl + CO2↑ |
|
| Zn2+ | Появление белого осадка
Zn2+ + CO32- = ZnCO3↓ А также может образоваться основная соль – гидроксокарбонат (ZnOH)2CO3↓ из-за гидролиза |
ZnCl2 + Na2CO3 = ZnCO3↓ + 2NaCl
2ZnCl2+2K2CO3+H2O=(ZnOH)2CO3↓ + 4KCl + CO2↑ |
|
| Al3+ | Появление белого осадка и выделение бесцветного газа из-за полного гидролиза карбоната алюминия
2Al3+ + 3СO32-+ 3Н2О = 2Al(OH)3↓ + 6КCl + 3CO2↑ |
2AlCl3 + 3К2СO3+ 3Н2О = 2Al(OH)3↓ + 6КCl + 3CO2↑ | |
| Cr3+ | Появление серо-зелёного осадка и выделение бесцветного газа из-за полного гидролиза карбоната хрома (III)
2Cr3+ + 3СO32-+ 3Н2О = 2Cr(OH)3↓ + 6КCl + 3CO2↑ |
Сr2(SO4)3 + 3К2CO3 + 3Н2О = 2Cr(OH)3↓ + 3К2SO4 + 3CO2↑ | |
| Fe2+ | Появление белого осадка
Fe2+ + CO32- = FeCO3↓ |
(NH4)2Fe(SO4)2 + Na2CO3 = FeCO3↓ + Na2SO4 + (NH4)2SO4 | |
| Mn2+ | Появление белого осадка
Mn2+ + CO32- = MnCO3↓ |
MnCl2 + Na2CO3 = MnCO3↓ + 2NaCl
Mn(NO3)2 + K2CO3 = MnCO3↓ + 2KNO3 |
|
| HCO3— | H+ | Выделение бесцветного газа без запаха
H+ + HCO3— = H2O + CO2↑ |
HNO3 + NaHCO3 = NaNO3+ H2O + CO2↑
2HBr + Ba(HCO3)2 = BaBr2 + 2H2O + 2CO2↑ |
| Видео-опыты по обнаружению карбонат ионов CO32- и гидрокарбонат ионов HCO3— Развернуть/свернуть Реакция между карбонатом натрия и хлоридом кальция Реакция между хлоридом бария и карбонатом натрия Реакция между нитратом стронция и карбонатом натрия Реакция между хлоридом магния и карбонатом натрия Реакция между хлоридом цинка и карбонатом натрия Реакция между нитратом марганца (II) и карбонатом натрия Реакция между карбонатом натрия и серной кислотой Реакция между гидрокарбонатом натрия и соляной кислотой |
|||
| SO32- | H+ | Выделение бесцветного газа с резким запахом
2H+ + SO32- = H2O + SO2↑ |
2HBr + Rb2SO3 = 2RbBr + H2O + SO2↑
H2SO4 + Na2SO3 = Na2SO4 + H2O + SO2↑ |
| Ca2+ | Появление белого осадка
Ca2+ + SO32- = CaSO3↓ |
Ca(NO3)2 + Na2SO3 = CaSO3↓ + 2NaNO3
(CH3COO)2Ca + Li2SO3 = CaSO3↓ + 2CH3COOLi |
|
| Ba2+ | Появление белого осадка
Ba2+ + SO32- = BaSO3↓ |
Ba(NO3)2 + Na2SO3 = BaSO3↓ + 2NaNO3
(CH3COO)2Ba+ Li2SO3 = BaSO3↓ + 2CH3COOLi |
|
| Sr2+ | Появление белого осадка
Sr2+ + SO32- = SrSO3↓ |
Sr(NO3)2 + K2SO3 = SrSO3↓ + 2KNO3
(CH3COO)2Sr + Rb2SO3 = SrSO3↓ + 2CH3COORb |
|
| Mg2+ | Помутнение раствора из-за образования малорастворимого вещества белого цвета
Mg2+ + SO32- = MgSO3↓ |
(CH3COO)2Mg + Li2SO3 = MgSO3↓ + 2CH3COOLi
Mg(NO3)2 + Na2SO3 = MgSO3↓ + 2NaNO3 |
|
| HSO3— | H+ | Выделение бесцветного газа с резким запахом
H+ + HSO3— = H2O + SO2↑ |
HCl + NaHSO3 = NaCl + H2O + SO2↑
2HBr + Ca(HCO3)2 = CaBr2 + 2H2O + 2SO2↑ |
| Видео-опыты по обнаружению сульфит ионов SO32- Развернуть/свернуть Качественная реакция на сульфит- и сульфат-ион Реакция между сульфитом натрия и соляной кислотой |
|||
| SiO32- | H+ | Образование белого студенистого осадка
2H+ + SiO32- = H2SiO3↓ |
2HBr + Na2SiO3 = 2NaBr + H2SiO3↓
H2SO4 + K2SiO3 = K2SO4 + H2SiO3↓ |
| Li+ | Помутнение раствора из-за образования малорастворимого вещества белого цвета
2Li+ + SiO32- = Li2SiO3↓ |
2LiBr + Na2SiO3 = Li2SiO3↓ + 2NaBr
2LiCl + K2SiO3 = Li2SiO3↓ + 2KCl |
|
| Ca2+ | Появление белого осадка
Ca2+ + SiO32- = CaSiO3↓ |
Ca(HS)2 + K2SiO3 = CaSiO3↓ + 2KHS
CaCl2 + Na2SiO3 = CaSiO3↓ + 2NaCl |
|
| Ba2+ | Появление белого осадка
Ba2+ + SiO32- = BaSiO3↓ |
Ba(HSO3)2 + K2SiO3 = BaSiO3↓ + 2KHSO3
BaCl2 + Na2SiO3 = BaSiO3↓ + 2NaCl |
|
| Sr2+ | Появление белого осадка
Sr2+ + SiO32- = SrSiO3↓ |
Sr(HCO3)2 + K2SiO3 = SrSiO3↓ + 2KHCO3
SrCl2 + Na2SiO3 = SrSiO3↓ + 2NaCl |
|
| Mg2+ | Появление белого осадка
Mg2+ + SiO32- = MgSiO3↓ |
MgSO4 + K2SiO3 = MgSiO3↓ + K2SO4
MgCl2 + Na2SiO3 = MgSiO3↓ + 2NaCl |
|
| Видео-опыты по обнаружению силикат ионов SiO32- Развернуть/свернуть Получение кремниевой кислоты |
|||
| F— | Ca2+ | Появление белого осадка
Ca2+ + 2F— = CaF2↓ |
CaBr2 + 2NaF = CaF2↓ + 2NaBr
CaI2 + 2NH4F = CaF2↓ + 2NH4I |
| Li+ | Помутнение раствора из-за образования малорастворимого вещества белого цвета
Li+ + F— = LiF↓ |
LiNO3 + AgF = LiF↓ + AgNO3
CH3COOLi + NH4F = LiF↓ +CH3COONH4 |
|
| Ba2+ | Помутнение раствора из-за образования малорастворимого вещества белого цвета для бария и появление белого осадка для стронция
Ba2+ + 2F— = BaF2↓ |
BaBr2 + 2NaF = BaF2↓ + 2NaBr
BaI2 + 2NH4F = BaF2↓ + 2NH4I |
|
| Sr2+ | Помутнение раствора из-за образования малорастворимого вещества белого цвета для бария и появление белого осадка для стронция
Sr2+ + 2F— = SrF2↓ |
SrCl2 + 2NaF = SrF2↓ + 2NaCl
SrI2 + 2NH4F = SrF2↓ + 2NH4I |
|
| Mg2+ | Появление белого осадка
Mg2+ + 2F— = MgF2↓ |
MgBr2 + 2NaF = MgF2↓ + 2NaBr
MgI2 + 2NH4F = MgF2↓ + 2NH4I |
|
| Видео-опыты по обнаружению фторид ионов F— Развернуть/свернуть Реакция между фторидом натрия и бромидом кальция Реакция между нитратом стронция и фторидом натрия |
|||
| Cl— | Ag+ | Появление белого творожистого осадка
Ag+ + Cl— = AgCl↓ |
AgF + NaCl = AgCl↓ + NaF
3AgNO3 + AlCl3 = 3AgCl↓ + Al(NO3)3 |
| Pb2+ | Появление белого осадка, растворимого в горячей воде
Pb2+ + 2Cl— = PbCl2↓ |
(CH3COO)2Pb + 2NaCl = PbCl2↓ + 2CH3COONa
Pb(NO3)2 + BaCl2 = PbCl2↓ + Ba(NO3)2 |
|
| Видео-опыты по обнаружению хлорид ионов Cl— Развернуть/свернуть Реакция между нитратом свинца (II) и хлоридом калия Реакция между нитратом серебра (I) и хлоридом натрия |
|||
| Br— | Ag+ | Появление белого-жёлтого осадка
Ag+ + Br— = AgBr↓ |
AgF + KBr = AgBr↓ + KF
CH3COOAg + RbBr = AgBr↓ + CH3COORb |
| Pb2+ | Появление белого малорастворимого вещеста
Pb2+ + 2Br— = PbBr2↓ |
(CH3COO)2Pb + 2NaBr= PbBr2↓ + 2CH3COONa
Pb(NO3)2 + CaBr2 = PbBr2↓ + Ca(NO3)2 |
|
| Видео-опыты по обнаружению бромид ионов Br— Развернуть/свернуть Сравнение осадков галогенидов серебра (I) Сравнение осадков галогенидов свинца (II) |
|||
| I— | Ag+ | Появление жёлтого осадка
Ag+ + I— = AgI↓ |
AgF + NaI = AgI↓ + NaF
2AgNO3 + ZnI2 = 2AgI↓ + Zn(NO3)2 |
| Pb2+ | Появление жёлто-золотистого осадка
Pb2+ + 2I— = PbI2↓ |
(CH3COO)2Pb + 2NaI = PbI2↓ + 2CH3COONa
Pb(NO3)2 + CaI2 = PbI2↓ + Ca(NO3)2 |
|
| Cu2+ | Образование осадка белого цвета, который выделяющимся при этом свободным йодом окрашивается в бурый цвет
2Cu2+ + 4I— = 2CuI + I2 |
2CuSO4 + 4KI = 2CuI↓ + I2 + 2K2SO4 | |
| Видео-опыты по обнаружению иодид ионов I— Развернуть/свернуть Реакция между хлоридом свинца (II) и иодидом натрия Реакция между сульфатом меди (II) и иодидом калия |
|||
| OH— | Индикаторы: фенолфталеин, метилоранж и лакмус | Бесцветный фенолфталеин меняет свой цвет на малиновый.
Оранжевый метилоранж меняет свой цвет на жёлтый. Фиолетовый лакмус меняет свой цвет на синий. |
|
| NH4+ (при нагревании) | Выделение газа с резким запахом, посинение влажной лакмусовой бумажки
NH4+ + OH— = NH3↑ + H2O |
NH4Cl + NaOH = NaCl + NH3↑ + H2O
(NH4)2SO4 + 2KOH = K2SO4 + 2NH3↑ + 2H2O |
|
| Zn2+ | Выпадение белого осадка гидроксида цинка при приливании первых порций щелочи и его растворение при дальнейшем приливании щелочи за счёт амфотерных свойств.
1) Zn2+ + 2OH— = Zn(OH)2↓ 2) Zn(OH)2 + 2OH— = [Zn(OH)4]2- |
1) Zn(NO3)2 + 2NaOH = Zn(OH)2↓ + 2NaNO3
2) Zn(OH)2 + 2NaOH = Na2[Zn(OH)4] Помните, что гидроксиды катионов Al3+, Cr3+ не переводятся в комплексное соединение гидратом аммиака. Zn2+ при добавлении конц. раствора аммиака сначала образуется Zn(OH)2, а при избытке аммиак способствует растворению осадка: Zn(OH)2 + 4NH3 = [Zn(NH3)4](OH)2 |
|
| Al3+ | Выпадение белого осадка гидроксида алюминия при приливании первых порций щелочи и его растворение при дальнейшем приливании щелочи за счёт амфотерных свойств.
1) Al3+ + 3OH— = Al(OH)3↓ 2) Al(OH)3 + OH— = [Al(OH)4]— или Al(OH)3 + 3OH— = [Al(OH)6]3- |
1) AlCl3 + 3KOH = Al(OH)3↓ + 3KCl
2) Al(OH)3 + KOH = K[Al(OH)4] или Al(OH)3 + 3KOH = K3[Al(OH)6] Помните, что гидроксид катиона Al3+ не переводится в комплексное соединение гидратом аммиака. |
|
| Cr3+ | Выпадение серо-зелёного осадка гидроксида хрома (III) при приливании первых порций щелочи и его растворение при дальнейшем приливании щелочи за счёт амфотерных свойств.
1) Cr3+ + 3OH— = Cr(OH)3↓ 2) Cr(OH)3 + OH— = [Cr(OH)4]— или Cr(OH)3 + 3OH— = [Cr(OH)6]3- |
1) CrBr3 + 3NaOH = Cr(OH)3↓ + 3NaBr
2) Cr(OH)3 + NaOH = Na[Cr(OH)4] или Cr(OH)3 + 3NaOH = Na3[Cr(OH)6] Помните, что гидроксид хрома (III) не переводятся в комплексное соединение гидратом аммиака. Раствор, содержащий [Cr(OH)6]3-, при добавлении хлорной или бромной воды в щелочной среде становится желтым из-за образования хромат-аниона CrO42-: 2[Cr(OH)6]3- + 3Br2 + 4OH— = 2CrO42- + 6Br— + 8H2O |
|
| Mg2+ | Появление белого осадка (нерастворимого в избытке щёлочи)
Mg2+ + 2OH— = Mg(OH)2↓ |
MgCl2 +2NaOH = Mg(OH)2↓ + 2NaCl
Mg(NO3)2 +2KOH = Mg(OH)2↓ + 2KNO3 |
|
| Fe2+ | Появление грязно-зелёного осадка (хотя должен быть белый), буреющего со временем
Fe2+ + 2OH— = Fe(OH)2↓ |
FeCl2 +2NaOH = Fe(OH)2↓ + 2NaCl
Fe(NO3)2 +2KOH = Fe(OH)2↓ + 2KNO3 |
|
| Fe3+ | Появление бурого осадка
Fe3+ + 3OH— = Fe(OH)3↓ |
FeCl3+2CsOH = Fe(OH)3↓ + 2CsCl
Fe(NO3)3 +2NaOH = Fe(OH)3↓ + 2NaNO3 |
|
| Mn2+ | Появление белого осадка, розовеющего (буреющего) на воздухе
Mn2+ + 2OH— = Mn(OH)2↓ |
MnBr2 +2NaOH = Mn(OH)2↓ + 2NaBr
Mn(NO3)2 +2KOH = Mn(OH)2↓ + 2KNO3 |
|
| Pb2+ | Выпадение белого осадка гидроксида свинца (II) при приливании первых порций щелочи и его растворение при дальнейшем приливании щелочи за счёт амфотерных свойств.
1) Pb2+ + 2OH— = Pb(OH)2↓ 2) Pb(OH)2 + 2OH— = [Pb(OH)4]2- |
1) Pb(NO3)2 + 2NaOH = Pb(OH)2↓ + 2NaNO3
2) Pb(OH)2 + 2NaOH = Na2[Pb(OH)4] |
|
| Ag+ | Появление чёрного осадка
2Ag+ + 2OH— = Ag2O↓ + H2O |
2AgNO3 + 2KOH = Ag2O↓ + H2O + 2KNO3
2AgNO3 + Ba(OH)2 = Ag2O↓ + H2O + Ba(NO3)2 |
|
| Cu2+ | Появление голубого осадка Cu2+ + 2OH— = Cu(OH)2↓ | CuCl2 +2NaOH = Cu(OH)2↓ + 2NaCl
Cu(NO3)2 +2KOH = Cu(OH)2↓ + 2KNO3 |
|
| Видео-опыты по обнаружению гидроксид ионов OH— Развернуть/свернуть Действие щелочей на индикаторы Реакция между хлоридом магния и гидроксидом калия Реакция между хлоридом аммония и гидроксидом натрия Реакция между нитратом цинка и гидроксидом натрия Амфотерность гидроксида алюминия Амфотерность гидроксида хрома (III) Реакция между хлоридом железа (II) и гидроксидом натрия Получение гидроксида железа (III) и исследование его свойств Реакция между нитратом марганца (II) и гидроксидом натрия Реакция между нитратом серебра (I) и гидроксидом калия Реакция между хлоридом меди (II) и гидроксидом натрия |
ОКРАСКА (ЦВЕТ) ВСЕХ ОСАДКОВ И ИХ ОСОБЕННОСТИ
| Цвет | Формула | Ионное уравнение получения | Особенности |
| Белый | LiF | Li+ + F— = LiF↓ | Белый аморфный осадок. Растворимость фторида лития в воде уменьшается в присутствии аммиака |
| Белый | Li3PO4 | 3Li+ + PO43-= Li3PO4↓
3Li+ + HPО42– = Li3PO4↓ + H+ |
Фосфат лития растворим в растворах кислот и солей аммония |
| Белый | CaCO3 | Ca2+ + CO32- = CaCO3↓ | Карбонат кальция растворим в кислотах.
Также можно получить при пропускании углекислого газа через известковую воду: Сa(OH)2 + CO2 = CaCO3↓ + H2O. Образовавшийся осадок растворяется в избытке CO2: CaCO3↓ + H2O + CO2 = Ca(HCO3)2 |
| Белый | CaF2 | Ca2+ + 2F— = CaF2↓ | Белый студенистый осадок. Малорастворимый в кислотах и разлагающийся при нагревании с концентрированной серной кислотой |
| Белый | CaSO3 | Ca2+ + SO32- = CaSO3↓ | Сульфит кальция растворим в кислотах.
Также можно получить при пропускании сернистого газа через известковую воду: Сa(OH)2 + SO2 = CaSO3↓ + H2O. Образовавшийся осадок растворяется в избытке SO2: CaSO3↓ + H2O + SO2 = Ca(HSO3)2 |
| Белый | CaSiO3 | Ca2+ + SiO32- = CaSiO3↓ | Известно большое количество силикатов кальция:
CaSiO3 — метасиликат или просто силикат кальция Ca3Si2O7 — пиросиликат кальция Ca2SiO4 — ортосиликат кальция |
| Белый | Ca3(PO4)2 | 3Ca2+ + 2PO43- = Ca3(PO4)2↓ | При действии кислот ортофосфат кальция переходит в более растворимый дигидрофосфат |
| Белый | CaHPO4 | Ca2+ + HPO42-= CaHPO4↓ | При действии кислот гидрофосфат кальция переходит в более растворимый дигидрофосфат |
| Белый | CaSO4 | Ca2+ + SO42- = CaSO4↓ | Осадок сульфата кальция нерастворим в кислотах и щелочах, но растворяется в насыщенном водном растворе сульфата аммония |
| Белый | BaSO4 | Ba2+ + SO42- = BaSO4↓ | Осадок нерастворим в щелочах и кислотах, за исключением концентрированной серной кислоты, в которой он заметно растворяется с образованием гидросульфата бария Ba(HSO4)2 |
| Белый | SrSO4 | Sr2+ + SO42- = SrSO4↓ | Осадок нерастворим в щелочах и кислотах, за исключением концентрированной серной кислоты, в которой он заметно растворяется с образованием гидросульфата стронция Sr(HSO4)2 |
| Белый | BaCO3 | Ba2+ + CO32- = BaCO3↓ | Карбонат бария растворим в кислотах. При действии избытка раствора углекислого газа переводится в растворимый гидрокарбонат |
| Белый | SrCO3 | Sr2+ + CO32- = SrCO3↓ | Карбонат стронция растворим в кислотах. При действии избытка раствора углекислого газа переводится в растворимый гидрокарбонат |
| Белый | BaF2 | Ba2+ + 2F— = BaF2↓ | Разлагается при нагревании с концентрированной серной кислотой |
| Белый | SrF2 | Sr2+ + 2F— = SrF2↓ | Разлагается при нагревании с концентрированной серной кислотой |
| Белый | BaSO3 | Ba2+ + SO32- = BaSO3↓ | Растворяется в кислотах |
| Белый | SrSO3 | Sr2+ + SO32- = SrSO3↓ | Растворяется в кислотах |
| Белый | BaSiO3 | Ba2+ + SiO32- = BaSiO3↓ | Растворяется в сильных кислотах |
| Белый | SrSiO3 | Sr2+ + SiO32- = SrSiO3↓ | Растворяется в сильных кислотах |
| Белый | Ba3(PO4)2 | 3Ba2+ + 2PO43- = Ba3(PO4)2↓ | С избытком фосфорной кислоты образует растворимый в воде дигидрофосфат.
Заметно растворим в присутствии NH4Cl, уксусной кислоте и хорошо растворим в сильных кислотах |
| Белый | Sr3(PO4)2 | 3Sr2+ + 2PO43- = Sr3(PO4)2↓ | С избытком фосфорной кислоты образует растворимый в воде дигидрофосфат.
Заметно растворим в присутствии NH4Cl, уксусной кислоте и хорошо растворим в сильных кислотах |
| Белый | BaHPO4 | Ba2+ + HPO42-= BaHPO4↓ | Растворяется в кислотах (не серной) |
| Белый | SrHPO4 | Sr2+ + HPO42-= SrHPO4↓ | Растворяется в кислотах (не серной) |
| Белый | Mg(OH)2 | Mg2+ + 2OH— = Mg(OH)2↓ | Не растворяется в щелочах, но в аммонийных солях легко растворяется |
| Белый | MgCO3 | Mg2+ + CO32- = MgCO3↓ | Растворим в кислотах. При действии избытка раствора углекислого газа переводится в растворимый гидрокарбонат |
| Белый | MgF2 | Mg2+ + 2F— = MgF2↓ | Хорошо растворяется в растворах фторидов и сульфатов щелочных металлов |
| Белый | MgSO3 | Mg2+ + SO32- = MgSO3↓ | Растворим в кислотах. При действии избытка раствора сернистого газа переводится в растворимый гидрокарбонат |
| Белый | MgSiO3 | Mg2+ + SiO32- = MgSiO3↓ | Растворяется в сильных кислотах |
| Белый | Mg3(PO4)2 | 3Mg2+ + 2PO43- = Mg3(PO4)2↓ | С избытком фосфорной кислоты образует растворимый в воде дигидрофосфат |
| Белый | MgHPO4 | Mg2+ + HPO42-= MgHPO4↓ | С избытком фосфорной кислоты образует растворимый в воде дигидрофосфат |
| Белый | Zn(OH)2 | Zn2+ + 2OH— = Zn(OH)2↓ | Растворяется в избытке растворов щелочей |
| Белый | ZnS | Zn2+ + S2- = ZnS↓ | Легко растворяется в минеральных кислотах |
| Белый | ZnCO3 | Zn2+ + CO32- = ZnCO3↓ | Растворим в кислотах. При действии избытка раствора углекислого газа переводится в растворимый гидрокарбонат |
| Белый | Zn3(PO4)2 | 3Zn2+ + 2PO43- = Zn3(PO4)2↓ | Растворяется в щелочах, аммиаке и кислотах |
| Белый | Al(OH)3 | Al3+ + 3OH— = Al(OH)3↓ | Растворяется в избытке растворов щелочей |
| Белый | AlPO4 | Al3+ + PO43- = AlPO4↓ | Растворяется в щелочах и кислотах |
| Белый | FeCO3 | Fe2+ + CO32- = FeCO3↓ | Во влажном воздухе легко окисляется до FeOHCO3, вследствие чего окраска его уже в момент образования приобретает бурый цвет.
Растворяется в избытке раствора углекислого газа. |
| Белый | Mn(OH)2 | Mn2+ + 2OH— = Mn(OH)2↓ | Розовеет (буреет) на воздухе. Не растворим в щелочах, но растворим в аммонийных солях и сильных кислотах |
| Белый | MnCO3 | Mn2+ + CO32- = MnCO3↓ | Растворяется в кислотах |
| Белый | Mn3(PO4)2 | 3Mn2+ + 4HPO42- = Mn3(PO4)2↓ + 2H2PO4—
3Mn2+ + 2PO43- = Mn3(PO4)2↓ |
Белый аморфный осадок |
| Белый | PbSO4 | Pb2+ + SO42— = PbSO4↓ | Растворяется при нагревании в щелочах, концентрированной серной кислоте и растворе ацетата аммония |
| Белый | PbCl2 | Pb2+ + 2Cl— = PbCl2↓ | Является малорастворимым веществом, растворяется в горячей воде, щелочах и концентрированной соляной кислоте |
| Белый | Pb(OH)2 | Pb2+ + 2OH— = Pb(OH)2↓ | Растворяется в кислотах и щелочах |
| Белый | Pb3(PO4)2 | 3Pb2+ + 4HPO42- = Pb3(PO4)2↓ + 2H2PO4—
3Pb2+ + 2PO43- = Pb3(PO4)2↓ |
Белый аморфный осадок |
| Белый | AgCl | Ag+ + Cl— = AgCl↓ | Осадок белый творожистый. Растворим в концентрированном растворе аммиака и концентрированной соляной кислоте |
| Белый | H2SiO3 | 2H+ + SiO32- = H2SiO3↓ | Осадок белый студенистый |
| Оранжевый | Ag2CrO4 | 2Ag+ + CrO42-= Ag2CrO4↓ | Осадок оранжевый (кирпично-красный). Растворим в кислотах и концентрированном растворе аммиака |
| Жёлтый | BaCrO4 | Ba2+ + CrO42-= BaCrO4↓ | В растворах сильных неорганических кислот растворяется с образованием дихромата. Плохо растворим в уксусной кислоте, что используется для отделения бария от ионов стронция |
| Жёлтый | SrCrO4 | Sr2+ + CrO42-= SrCrO4↓ | В растворах сильных неорганических кислот и уксусной кислоте растворяется с образованием дихромата |
| Жёлтый | ZnCrO4 | Zn2+ + CrO42-= ZnCrO4↓ | Растворим в кислотах и щелочах |
| Жёлтый | PbCrO4 | Pb2+ + CrO42-= PbCrO4↓ | Растворим в кислотах и щелочах |
| Жёлтый | AgBr | Ag+ + Br— = AgBr↓ | Осадок бело-жёлтый (светло-жёлтый). Частично растворим в концентрированном растворе аммиака |
| Жёлтый | Ag3PO4 | 3Ag+ + PO43- = Ag3PO4↓
3Ag+ + 2HPO42- = Ag3PO4↓ + H2PO4— |
Растворим в растворе аммиака |
| Жёлтый | CdS | Cd2+ + S2- = CdS↓ | Осадок имеет ярко-желтую окраску – «канареечный цвет». В разбавленных кислотах при кипячении легко растворим |
| Серо-зелёный | Cr(OH)3 | Cr3+ + 3OH— = Cr(OH)3↓ | Растворим в кислотах и щелочах |
| Чёрно-зелёный | CrPO4 | Cr3+ + PO43- = CrPO4↓ | Чёрно-зелёный (черный) осадок |
| Грязно-зелёный | Fe(OH)2 | Fe2+ + 2OH— = Fe(OH)2↓ | Должен быть белого цвета, но из-за окисления получается грязно-зелёный цвет. Растворим в кислотах |
| Чёрный | FeS | Fe2+ + S2- = FeS↓ | Не выпадает в осадок при насыщении растворов солей железа(II) сероводородом. Растворяется в кислотах |
| Чёрный | PbS | Pb2+ + S2- = PbS↓ | Растворим в азотной кислоте |
| Чёрный | Ag2S | 2Ag+ + S2- = Ag2S↓ | Осадок чёрный (чёрно-коричневый). Растворим в азотной кислоте |
| Чёрный | Ag2O | 2Ag+ + 2OH— = Ag2O↓ + H2O | Осадок чёрный (чёрно-коричневый). Растворяется в концентрированном растворе аммиака |
| Чёрный | CuS | Cu2+ + S2- = CuS↓ | Выпадает в осадок из солянокислых и сернокислых растворов ее солей, но в разбавленной HNО3 при нагревании легко растворяется |
| Чёрный | NiS | Ni2+ + S2- → NiS↓ | Растворим в азотной кислоте |
| Чёрный | HgS | Hg2+ + S2- → HgS↓ | В разбавленных кислотах нерастворим, растворяется только в концентрированной HNО3 и царской водке при нагревании |
| Бурый | Fe(OH)3 | Fe3+ + 3OH— = Fe(OH)3↓ | Растворим в кислотах, но не растворим в концентрированном растворе аммиака |
| Телесно-розовый | MnS | Mn2+ + S2- = MnS↓ | Не выпадает в осадок при насыщении растворов солей марганца(II) сероводородом. Растворим в кислотах |
| Голубой | Cu(OH)2 | Cu2+ + 2OH— = Cu(OH)2↓ | Растворим в кислотах и растворе аммиака |
КАЧЕСТВЕННЫЕ РЕАКЦИИ ДЛЯ ИНДИВИДУАЛЬНЫХ ВЕЩЕСТВ
| Вещество | Реактив | Реакция | Характерные признаки |
| Н2 | О2 (сжигание) | 2Н2 + О2 = 2Н2О | Запотевание холодного предмета |
| О2 | С (тлеющая лучинка) | С + О2 = СО2 | Вспышка |
| О3 | KI (p-p) | 2KI + O3 + H2O = 2KOH + I2↓ + O2↑ | Образование кристаллического иода тёмно-фиолетового цвета |
| Сl2 | Бумажка, пропитанная крахмальным клейстером и раствором иодида калия | 2KI + Cl2 = 2KCl + I2↓ | Посинение бумажки |
| I2 | Крахмальный клейстер | Синее окрашивание | |
| СО2 | Известковая вода | Са(ОН)2 + СО2 = СаСО3↓+ Н2О
CaCO3↓ + H2O + CO2 = Ca(HCO3)2 |
Помутнение раствора с последующим растворение осадка при пропускании избытка углекислого газа |
| С (тлеющая лучинка) | Гаснет в атмосфере углекислого газа | ||
| NH3 | Хлороводород | NH3 + HCl = NH4Cl | Белый дым. Специфический запах NH3, образование белого дыма (NH4Cl) |
| SO2 | Окрашенные растворы окислителей (KMnO4 и Br2) | SO2 + Br2 + 2H2O = H2SO4 + 2HBr
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + 2MnSO4 + K2SO4 |
Обесцвечивание растворов |
ОБЩИЕ ПРАВИЛА РАЗЛИЧЕНИЯ ВЕЩЕСТВ ДРУГ ОТ ДРУГА
- По разной среде раствора:
1) Изменение окраски индикаторов:
Фенолфталеин (бесцветный) применяется для определения щелочной реакции среды (присутствуют ионы OH—). Изменяет цвет на малиновый.
Лакмус (фиолетовый) в кислой среде (присутствуют ионы H+) становится красным, в щелочной — синим.
Метилоранж (оранжевый) в кислой среде (присутствуют ионы H+) становится красным, в щелочной — жёлтым.
2) Среда раствора аммиака NH3 является щелочной, так как протекает обратимое взаимодействие с водой: NH3 + H2O ↔ NH4+ + OH–.
3) H2SiO3 является очень слабой нерастворимой в воде кислотой, поэтому она не изменяет окраску индикаторов.
4) Некоторые соли подвергаются гидролизу и поэтому их растворы меняют окраску индикаторов:
СuSO4 гидролизуется по катиону, поэтому раствор этой соли имеет кислую реакцию среды.
Na2CO3 гидролизуется по аниону, поэтому раствор этой соли имеет щелочную реакцию среды.
- Как отличить металлы различной активности:
Например, щелочные и щелочноземельные металлы можно отличить от других металлов реакцией с водой. Первые реагируют быстро и очень бурно в обычных условиях:
2Na + 2H2O → 2NaOH + H2 (при обычных условиях)
Fe + H2O → без нагревания реакция НЕ идет (но идёт при нагревании: 3Fe + 4H2O → Fe3O4 + H2↑).
- Как отличить оксиды активных металлов (щелочных и щелочноземельных) от оксидов других металлов:
Оксиды активных металлов реагируют с водой в обычных условиях:
K2O + H2O → 2KOH
ZnO + H2O → реакция НЕ идет (ни при каких условиях)
- Как отличить кислоты-окислители от кислот-неокислителей:
В отличие от обычных кислот, кислоты-окислители реагируют с металлами, стоящими в ряду напряжений правее водорода:
HBr + Ag → реакция не идет
4HNO3 (конц.) + Cu → Cu(NO3)2 + 2NO2↑ + 2H2O (выделение бурого газа)
- Как отличить солислабой и сильной кислот:
В этом случае часто берут соль угольной, сернистой, сероводородной или кремниевой кислот. В реакциях этих солей с сильными кислотами выделяется газ или выпадает осадок:
K2CO3 + 2HCl → 2KCl + CO2↑ + H2O
K2S + 2HCl → 2KCl + H2S↑
K2SiO3 + 2HCl → 2KCl + H2SiO3↓
K2SO4 + HCl → реакция не идет (осадок, газ, малодиссоциирующее вещество не образуются)
BaSO3 + 2HCl → BaCl2 + SO2↑ + H2O
BaSO4 + HCl → реакция не идет (осадок, газ, малодиссоциирующее вещество не образуются)
- Как отличить соли слабого и сильного основания:
Соли слабых основания при взаимодействии со щелочами дают осадки, а соли сильных оснований – нет:
Cu(NO3)2 + 2NaOH → Cu(OH)2↓ + 2NaNO3
NH4NO3 + KOH → NH3↑ + H2O + KNO3 (при нагревании)
KNO3 + NaOH → реакция не идет (осадок, газ, малодиссоциирующее вещество не образуются)
- Как отличитьсоли двух металлов, один из которых образует амфотерные соединения (например, Zn, Be, Al и др.):
Реагентом, которым можно отличить эти типы солей, являются щелочи:
Al(NO3)3 + 4KOH(р) → 3KNO3 + K[Al(OH)4] — осадок Al(OH)3 сначала образуется, а затем растворяется в избытке щелочи.
Cu(NO3)2 + 2KOH → Cu(OH)2↓ + 2KNO3 — осадок не растворяется.
- Как отличить гидроксиды двух металлов, один из которых образует амфотерные соединения (например, Zn, Be, Al и др.):
Этим реагентом являются щелочи:
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4] (растворение осадка)
Mg(OH)2 + KOH → реакция не идет.
- Как отличить соли двух металлов, оба из которых образует малорастворимые или нерастворимые гидроксиды:
С помощью щелочей. В результате этого образуются нерастворимые основания, которые могут отличаться по цвету. Но помните, что для этого надо знать цвета всех осадков, и часто нерастворимые основания могут иметь одинаковый цвет.
FeCl3 + 3KOH = Fe(OH)3↓ (бурый осадок) + 3KCl
CuBr2 + 2NaOH = Cu(OH)2↓(голубой осадок) + 2NaBr
- Как отличить соль и кислоту:
1) с металлом (выделение газа водорода в реакциях с кислотами-неокислителями)
KCl + Fe → реакция не идет
CuCl2 + Zn = ZnCl2 + Cu↓
2HCl + Fe → FeCl2 + H2↑
2) с кислыми карбонатами или сульфитами (выделение газа)
HCl + NaHCO3 → NaCl + CO2↑ + H2O
KCl + NaHCO3 → реакция не идет (осадок, газ, малодиссоциирующее вещество не образуются).
- Как отличить кислую соль от средней:
Кислые соли слабых кислот, например гидрокарбонаты, реагируют с сильными кислотами с выделением газа:
KHCO3 + HCl → KCl + CO2↑ + H2O
KNO3+ HCl → реакция не идет (осадок, газ, малодиссоциирующее вещество не образуются).
- Как отличить кислоту от воды:
1) Индикаторами: об этом смотри в пункте 1.
2) Если кислота сильная, то можно добавить соль слабой кислоты (например, K2CO3, KHCO3), чтобы выделился газ:
2HNO3 + K2CO3 → 2KNO3 + CO2↑ + H2O
H2O + K2CO3 → растворение соли без химической реакции, видимых признаков нет.
- Как отличить растворимую соль от щелочи:
Провести реакцию ионного обмена с образованием осадка или газа, например:
2NaOH + CuCl2 → Cu(OH)2↓ + 2NaCl
NaCl + CuCl2 → реакция не идет, так как ни газ, ни осадок, ни малодиссоциирующее соединение не образуется.
- Как распознать присутствие отдельных солей:
Для этого необходимо знать все качественные реакции, цвета осадков, запахи газов, специфические свойства и т.п. Чтобы найти все варианты – смотри таблицу растворимости и таблицы качественных реакций выше).
- Общая схема качественного различения веществ:
Возможны два варианта:
Одно вещество реагирует с добавленным реагентом, а второе нет. При этом обязательно, должно быть ясно видно, что реакция одного из исходных веществ с добавленным реагентом действительно прошла, то есть наблюдается какой-либо ее внешний признак — выпадал осадок, выделился газ, произошло изменение цвета и т.п.
Например, нельзя отличить воду от раствора гидроксида натрия с помощью соляной кислоты, не смотря на то, что щелочи с кислотами прекрасно реагируют:
NaOH + HCl = NaCl + H2O
Связано это с отсутствием каких-либо внешних признаков реакции. Прозрачный бесцветный раствор соляной кислоты при смешении с бесцветным раствором гидроксида образует такой же прозрачный раствор. Но зато, можно воду от водного раствора щелочи можно различить, например, с помощью раствора хлорида магния – в данной реакции выпадает белый осадок:
2NaOH + MgCl2 = Mg(OH)2 ↓+ 2NaCl
2) также вещества можно отличить друг от друга, если они оба реагируют с добавляемым реагентом, но делают это по-разному.
Например, различить раствор карбоната натрия от раствора нитрата серебра можно с помощью раствора соляной кислоты.
С карбонатом натрия соляная кислота реагирует с выделением бесцветного газа без запаха — углекислого газа (СО2):
2HCl + Na2CO3 = 2NaCl + H2O + CO2↑
А с нитратом серебра с образованием белого творожистого осадка AgCl
HCl + AgNO3 = HNO3 + AgCl↓
Примеры заданий из ЦТ и ЕГЭ, в которых необходимо было использовать знания о качественных реакциях:
Из ЦТ по химии:
В четырех пронумерованных пробирках находятся водные растворы неорганических соединений.
| Вещество | Номер пробирки |
| А) соляная кислота
Б) гидроксид калия В) иодид кальция Г) карбонат натрия |
1
2 3 4 |
О них известно следующее:
— при добавлении в пробирку 1 содержимого пробирки 2 приводит к образованию белого осадка;
— при смешивании содержимого пробирок 1 и 4 образуется газ (н.у.);
— при сливании растворов из пробирок 2 и 3 наблюдается помутнение.
Установите соответствие. Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность, например: А2Б3В4Г1.
Видео-объяснение:
Больше таких заданий из ЦТ по химии вы можете посмотреть, нажав на эту строку
Из ЕГЭ по химии:
Видео-объяснение:
Больше таких заданий из ЕГЭ по химии вы можете посмотреть, нажав на эту строку
Если что-то было упущено в этой статье или есть ошибки (опечатки), то пишите об этом в комментариях.
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ и ЦТ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Больше заданий РТ вы можете найти здесь, нажав на эту строку
- Больше заданий ЦТ вы можете найти здесь, нажав на эту строку
- Посмотреть все пробные варианты ЦТ вы можете здесь, нажав на эту строку
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Если вы сдаёте ЦТ по химии, то посмотреть видео-объяснения каждого задания ЦТ, РТ и ДРТ всех лет вы можете получив полный доступ к сайту кликнув здесь «Получить все материалы сайта»