При выполнении различных заданий ЕГЭ по химии (например, задачи 34 или задания 32 «мысленный эксперимент») могут пригодиться знания о том, какие вещества при нагревании разлагаются и как они разлагаются.
Рассмотрим термическую устойчивость основных классов неорганических веществ. Я не указываю в условиях температуру протекания процессов, так как в ЕГЭ по химии такая информация, как правило, не встречается. Если возможны различные варианты разложения веществ, я привожу наиболее вероятные, на мой взгляд, реакции.
Разложение оксидов
При нагревании разлагаются оксиды тяжелых металлов:
2Ag2O = 4Ag + O2
2HgO = 2Hg + O2
4CrO3 = 2Cr2O3 + O2
2Mn2O7 = 4MnO2 + 3O2
Разложение гидроксидов
Как правило, при нагревании разлагаются нерастворимые гидроксиды. Исключением является гидроксид лития, он растворим, но при нагревании в твердом виде разлагается на оксид и воду:
2LiOH = Li2O + H2O
Гидроксиды других щелочных металлов при нагревании не разлагаются.
Гидроксиды серебра (I) и меди (I) неустойчивы:
2AgOH = Ag2O + H2O
2CuOH = Cu2O + H2O
Гидроксиды большинства металлов при нагревании разлагаются на оксид и воду.
В инертной атмосфере (в отсутствии кислорода воздуха) гидроксиды хрома (III) марганца (II) и железа (II) распадаются на оксид и воду:
2Cr(OH)3 = Cr2O3 + 3H2O
Mn(OH)2 = MnO + H2O
Fe(OH)2 = FeO + H2O
Большинство остальных нерастворимых гидроксидов металлов также при нагревании разлагаются:
2Fe(OH)3 = Fe2O3 + 3H2O
2Al(OH)3 = Al2O3 + 3H2O
Разложение кислот
При нагревании разлагаются нерастворимые кислоты.
Например, кремниевая кислота:
H2SiO3 = H2O + SiO2
Некоторые кислоты неустойчивы и подвергаются разложению в момент образования. Большая часть молекул сернистой кислоты и угольной кислоты распадаются на оксид и воду в момент образования:
H2SO3 = H2O + SO2↑
H2CO3 = H2O + CO2↑
В ЕГЭ по химии лучше эти кислоты записывать в виде оксида и воды.
Например, при действии водного раствора углекислого газа на карбонат калия в качестве реагента мы указываем не угольную кислоту, а оксид углерода (IV) и воду, но подразумеваем угольную кислоту при этом:
K2CO3 + H2O + CO2 = 2KHCO3
Азотистая кислота на холоде или при комнатной температуре частично распадается уже в водном растворе, реакция протекает обратимо:
2HNO2 = H2O + NO2↑ + NO↑
При нагревании выше 100оС продукты распада несколько отличаются:
3HNO2 = H2O + HNO3↑ + 2NO↑
Азотная кислота под действием света или при нагревании частично обратимо разлагается:
4HNO3 = 2H2O + 4NO2 + O2
Разложение солей
Разложение хлоридов
Хлориды щелочных, щелочноземельных металлов, магния, цинка, алюминия и хрома при нагревании не разлагаются.
Хлорид серебра (I) разлагается под действием света:
2AgCl → Ag + Cl2
Хлорид аммония при нагревании выше 340 оС разлагается:
NH4Cl → NH3 + HCl
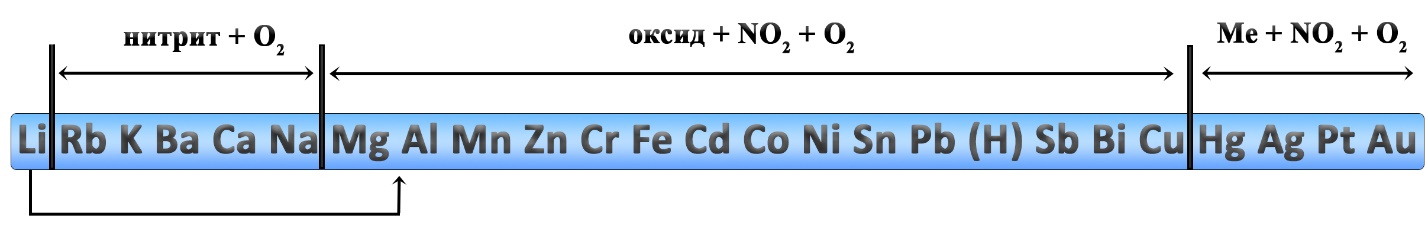
Разложение нитратов
Нитраты щелочных металлов при нагревании разлагаются до нитрита металла и кислорода.
Например, разложение нитрата калия:
2KNO3 → 2KNO2 + O2
Видеоопыт разложения нитрата калия можно посмотреть здесь.
Нитраты магния, стронция, кальция и бария разлагаются до нитрита и кислорода при нагревании до 500 оС:
Ca(NO3)2 → Ca(NO2)2 + O2
Mg(NO3)2 → Mg(NO2)2 + O2
Ba(NO3)2 → Ba(NO2)2 + O2
Sr(NO3)2 → Sr(NO2)2 + O2
При более сильном нагревании (выше 500оС) нитраты магния, стронция, кальция и бария разлагаются до оксида металла, оксида азота (IV) и кислорода:
2Ca(NO3)2 → 2CaО + 4NO2 + O2
2Mg(NO3)2 → 2MgО + 4NO2 + O2
2Sr(NO3)2 → 2SrО + 4NO2 + O2
2Ba(NO3)2 → 2BaО + 4NO2 + O2
Нитраты металлов, расположенных в ряду напряжений после магния и до меди (включительно) + нитрат лития разлагаются при нагревании до оксида металла, диоксида азота и кислорода:
2Cu(NO3)2 → 2CuО + 4NO2 + O2
2Pb(NO3)2 → 2PbО + 4NO2 + O2
4Al(NO3)3 → 2Al2O3 + 12NO2 + 3O2
4LiNO3 → 2Li2O + 4NO2 + O2
Нитраты серебра и ртути разлагаются при нагревании до металла, диоксида азота и кислорода:
2AgNO3 → 2Ag + 2NO2 + O2
Hg(NO3)2 → Hg + 2NO2 + O2
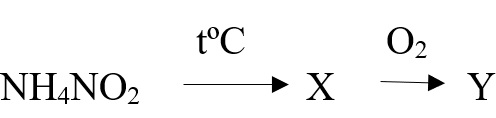
Нитрат аммония разлагается при небольшом нагревании до 270оС оксида азота (I) и воды:
NH4NO3 → N2O + 2H2O
При более высокой температуре образуются азот и кислород:
2NH4NO3 → 2N2 + O2 + 4H2O
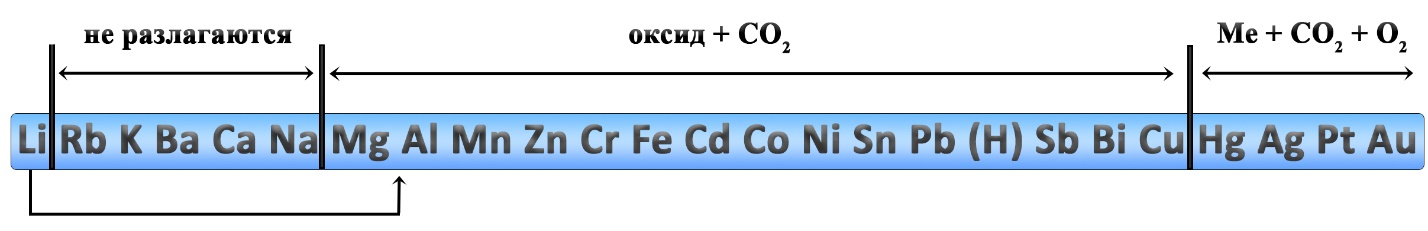
Разложение карбонатов и гидрокарбонатов
Карбонаты натрия и калия плавятся при нагревании.
Карбонаты лития, щелочноземельных металлов и магния разлагаются на оксид металла и углекислый газ:
Li2CO3 → Li2O + CO2
CaCO3 → CaO + CO2
MgCO3 → MgO + CO2
Карбонат аммония разлагается при 30оС на гидрокарбонат аммония и аммиак:
(NH4)2CO3 → NH4HCO3 + NH3
Гидрокарбонат аммония при дальнейшем нагревании разлагается на аммиак, углекислый газ и воду:
NH4HCO3 → NH3 + CO2 + H2O
Гидрокарбонаты натрия и калия при нагревании разлагаются на карбонаты, углекислый газ и воду:
2NaHCO3 → Na2CO3 + H2O + CO2
2KHCO3 → K2CO3 + H2O + CO2
Гидрокарбонат кальция при нагревании до 100оС разлагается на карбонат, углекислый газ и воду:
Ca(HCO3)2 → CaCO3 + H2O + CO2
При нагревании до 1200оС образуются оксиды:
Ca(HCO3)2 → CaO + H2O + 2CO2
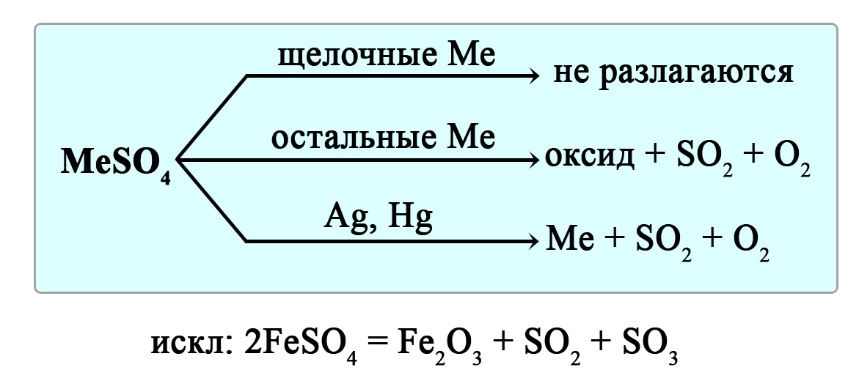
Разложение сульфатов
Сульфаты щелочных металлов при нагревании не разлагаются.
Сульфаты алюминия, щелочноземельных металлов, меди, железа и магния разлагаются до оксида металла, диоксида серы и кислорода:
2MgSO4 → 2MgO + 2SO2 + O2
2CuSO4 → 2CuO + 2SO2 + O2
2BaSO4 → 2BaO + 2SO2 + O2
2Al2(SO4)3 → 2Al2O3 + 6SO2 + 3O2
2Fe2(SO4)3 → 2Fe2O3 + 6SO2 + 3O2
Сульфаты серебра и ртути разлагаются до металла, диоксида серы и кислорода:
Ag2SO4 → 2Ag + SO2 + O2
2HgSO4 → 2Hg + 2SO2 + O2
Разложение фосфатов, гидрофосфатов и дигидрофосфатов
Эти реакции, скорее всего, в ЕГЭ по химии не встретятся! Гидрофосфаты щелочных и щелочноземельных металлов разлагаются до пирофосфатов:
2Na2HPO4 → H2O + Na4P2O7
2K2HPO4 → H2O + K4P2O7
2CaHPO4 → H2O + Ca2P2O7
Ортофосфаты при нагревании не разлагаются (кроме фосфата аммония).
Разложение сульфитов
Сульфиты щелочных металлов разлагаются до сульфидов и сульфатов:
4Na2SO3 → Na2S + 3Na2SO4
Разложение солей аммония
Некоторые соли аммония, не содержащие анионы кислот-сильных окислителей, обратимо разлагаются при нагревании без изменения степени окисления. Это хлорид, бромид, йодид, дигидрофосфат аммония:
NH4Cl → NH3 + HCl
NH4Br → NH3 + HBr
NH4l → NH3 + Hl
NH4H2PO4 → NH3 + H3PO4
Cоли аммония, образованные кислотами-окислителями, при нагревании также разлагаются. При этом протекает окислительно-восстановительная реакция. Это дихромат аммония, нитрат и нитрит аммония:
NH4NO3 → N2O + 2H2O
NH4NO2 → N2 + 2H2O
Видеоопыт разложения нитрита аммония можно посмотреть здесь.
(NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O
Разложение перманганата калия
2KMnO4 → K2MnO4 + MnO2 + O2
Разложение хлората и перхлората калия
Хлорат калия при нагревании разлагается до перхлората и хлорида:
4KClO3 → 3KClO4 + KCl
При нагревании в присутствии катализатора (оксид марганца (IV)) образуется хлорид калия и кислород:
2KClO3 → 2KCl + 3O2
Перхлорат калия при нагревании разлагается до хлорида и кислорода:
KClO4 → KCl + 2O2
Разложение веществ
Материал по химии
- Реакции разложения солей
- Разложение нитратов
- Особые реакции разложения нитратов
- Разложение солей аммония
- Разложение карбонатов
- Разложение гидрокарбонатов
- Разложение гидросульфитов
- Разложение сульфитов
- Разложение сульфатов
- Уравнения реакций разложения комплексных солей
- Реакция разложения дихромата калия и перманганата калия
- Разложение бертолетовой соли
- Разложение гидроксидов
- Разложение органических веществ
- Разложение кислот
Реакции разложения солей
Термическому разложению подвергаются многие соли – карбонаты, нитраты, нитриты, сульфаты, кислые, основные и комплексные соли. Рассмотрим наиболее популярные уравнения разложения солей. Разложение солей часто встречается в ЕГЭ по химии в линии заданий 31, это задание считается одним из самых сложных заданий экзамена.
Разложение нитратов
При установлении продуктов термического разложения нитратов удобно пользоваться рядом активности металлов, однако к нему следует добавить некоторые уточнения: литий и магний, обычно относятся к активным металлам, но разложение нитратов этих двух металлов происходит как у металлов средней активности. Медь относится к неактивным металлам, но разложение нитрата меди II идёт как разложение нитрата металла средней активности. Данные реакции являются весьма популярными в химии. На ЕГЭ задачи по разложению нитратов встречаются в заданиях линии 7 и 31.
Уравнения разложения нитратов активных металлов (кроме лития и магния):
- 2KNO3 → 2KNO2 + O2↑ ‒ разложение нитрата калия
- 2NaNO3 → 2NaNO2 + O2↑ ‒ разложение нитрата натрия
- 2CsNO3 → 2CsNO2 + O2↑ ‒ разложение нитрата цезия
- 2RbNO3 → 2RbNO2 + O2↑ ‒ разложение нитрата рубидия
- Ca(NO3)2 → Ca(NO2)2 + O2↑ ‒ разложение нитрата кальция
- Ba(NO3)2 → Ba(NO2)2 + O2↑ ‒ разложение нитрата бария
- Sr(NO3)2 → Sr(NO2)2 + O2↑ ‒ разложение нитрата стронция
Уравнения разложения нитратов металлов средней активности, нитрата лития и нитрата меди II:
- 4LiNO3 → 2Li2O + 4NO2↑ + O2↑ ‒ разложение нитрата лития
- 2Mg(NO3)2 → 2MgO + 4NO2↑ + O2↑ ‒ разложение нитрата магния
- 2Zn(NO3)2 → 2ZnO + 4NO2↑ + O2↑ ‒ разложение нитрата цинка
- 2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑ ‒ разложение нитрата меди II
- 4Al(NO3)3 → 2Al2O3 + 12NO2↑ + 3O2↑ ‒ разложение нитрата алюминия
- 4Fe(NO3)3 → 2Fe2O3 + 12NO2↑ + 3O2↑ ‒ разложение нитрата железа III
- 4Cr(NO3)3 → 2Cr2O3 + 12NO2↑ + 3O2↑ ‒ разложение нитрата хрома III
Во всех приведенных реакциях степень окисления металла не изменяется. Это характерно для нитратов, содержащих металл в высшей или наиболее устойчивой степени окисления. Если же нитрат образован переходным металлом в низшей степени окисления, то при разложении этого нитрата происходит окисление еще и металла.
Особые реакции разложения нитратов
Разложение нитрата железа II:
- 4Fe(NO3)2 → 2Fe2O3 + 8NO2↑ + O2↑
В данной реакции два восстановителя – железа поднимает степень окисления с +2 до +3, кислород с ‒2 до 0. Окислитель – азот +5.
Аналогично идет реакция термического разложения нитрата хрома II:
- 4Cr(NO3)2 → 2Cr2O3 + 8NO2↑ + O2↑
Разложение нитрата марганца II идет иначе, так как для марганца следующей после +2 устойчивой степенью окисления является не +3, а +4:
- Mn(NO3)2 → MnO2 + 2NO2↑
Обратите внимание на то, что кислород в этой реакции не выделяется!
Задание в формате ЕГЭ с ответом:
Установите соответствие между названием вещества и продуктами его разложения: к каждой позиции, обозначенной буквой подберите позицию, обозначенную цифрой.
- нитрат железа II
- нитрат меди II
- нитрат ртути II
- нитрат магния
- нитрат калия
- нитрат серебра
- MeNO2 + O2
- MeO + NO2 + O2
- Me + NO2 + O2
- Me2O3 + NO2 + O2
Пример задания из КИМ ЕГЭ:
Установите соответствие между формулой вещества и продуктами его разложения: к каждой позиции, обозначенной буквой подберите позицию, обозначенную цифрой.
- LiNO3
- Cu(NO3)2
- RbNO2
- Zn(NO3)2
- Hg(NO3)2
- Al(NO2)3
- MeNO2 + O2
- MeO + NO2 + O2
- Me + NO2 + O2
- Me2O + NO2 + O2
- Me2O3 + NO2 + O2
Разложение нитрата аммония будет рассмотрено ниже, в реакциях разложения солей аммония.
Разложение солей аммония
При разложении солей аммония чаще всего образуется аммиак, исключения составляют соли, в которых анион проявляет окислительные свойства. Например, хлорид, бромид, йодид, сульфиды, карбонаты и фосфаты разлагаются без изменения степеней окисления (без ОВР). Процессы идут при нагревании:
- NH4Cl → NH3↑ + HCl↑ ‒ разложение хлорида аммония
- NH4Br → NH3↑ + HBr↑ ‒ разложение бромида аммония
- NH4I → NH3↑ + HI↑ ‒ разложение йодида аммония
- (NH4)2S → 2NH3↑ + H2S↑ ‒ разложение сульфида аммония
- NH4HS → NH3↑ + H2S↑ ‒ разложение гидросульфида аммония
- (NH4)3PO4 → 3NH3↑ + H3PO4 ‒ разложение фосфата аммония
- (NH4)2HPO4 → 2NH3↑ + H3PO4 ‒ разложение гидрофосфата аммония
- NH4H2PO4 → NH3↑ + H3PO4 ‒ разложение дигидрофосфата аммония
- (NH4)2CO3 → 2NH3↑ + CO2↑ + H2O↑ ‒ разложение карбоната аммония
- NH4HCO3 → NH3↑ + CO2↑ + H2O↑ ‒ разложение гидрокарбоната аммония
Разложение солей аммония с изменением степени окисления:
Разложение нитрита и нитрата аммония легко запомнить вместе, отнимите от этих солей всю воду и получите нужный продукт:
- NH4NO3 → 2H2O + N2O ‒ разложение нитрата аммония
- NH4NO2 → 2H2O + N2 ‒ разложение нитрита аммония
Задание по образцу ФИПИ:
Задана следующая схема превращений веществ. Определите, какие из указанных веществ являются веществами X и Y. В ответ запишите соответствующую последовательность цифр без пробелов и дополнительных знаков, сначала вещество Х, затем вещество Y.
- NH3
- NO
- NH4NO3
- N2
- N2O
Азот окисляется до NO
Удобно запоминать вместе и разложение дихромата и перманганата аммония, так как образуются сходные продукты – азот, оксид и соль:
- (NH4)2Cr2O7 → N2↑ + Cr2O3 + 4H2O↑ ‒ разложение дихромата аммония
- 2NH4MnO4 → N2↑ + 2MnO2 + 4H2O↑ ‒ разложение перманганата аммония
Попробуйте решить задание ЕГЭ:
Установите соответствие между названием вещества и продуктами его разложения: к каждой позиции, обозначенной буквой подберите позицию, обозначенную цифрой.
- нитрит аммония
- нитрат аммония
- дихромат аммония
- хлорид аммония
- N2 + Cr2O3 + H2O
- NH3 + Cl2 + H2
- N2 + H2O
- NO2 + Cr2O3 + H2O
- NH3 + HCl
- N2O + H2O
Разложение карбонатов
Реакции разложения карбонатов также происходит при нагревании. Карбонаты щелочных металлов (IА-группа), кроме карбоната лития, не разлагаются. Большинство других карбонатов разлагаются до оксидов, карбонат серебра и карбонат ртути разлагаются с выделением свободного металла.
- Li2CO3 → Li2O + CO2↑ ‒ разложение карбоната лития
- MgCO3 → MgO + CO2↑ ‒ разложение карбоната магния
- CaCO3 → CaO + CO2↑ ‒ разложение карбоната кальция
- CuCO3 → CuO + CO2↑ ‒ разложение карбоната меди II
- 2HgCO3 → 2Hg + 2CO2↑ + O2↑ ‒ разложение карбоната ртути II
- 2Ag2CO3 → 4Ag + 2CO2↑ + O2↑ ‒ разложение карбоната серебра
Какие из перечисленных карбонатов разлагаются?
- Na2CO2
- MgCO3
- CaCO3
- K2CO3
- Cs2CO3
- CuCO3
При разложении каких карбонатов образуется оксид металла?
- Na2CO3
- HgCO3
- Li2CO3
- CaCO3
- Ag2CO3
- FeCO3
Разложение гидрокарбонатов
Гидрокарбонаты разлагаются до соответствующих карбонатов:
- 2NaHCO3 → Na2CO3 + CO2↑ + H2O↑ ‒ разложение гидрокарбоната натрия
- Ca(HCO3)2 → CaCO3 + CO2↑ + H2O↑ ‒ разложение гидрокарбоната кальция
При длительном нагревании происходит более глубокое разложение (это не качается гидрокарбонатов щелочных металлов, они в любом случае остаются карбонатами).
Например, в некоторых задачах может встретиться следующая фраза «гидрокарбонат нагревали до постоянной массы» или «смесь гидрокарбоната и карбоната нагревали до постоянной массы», какие реакции следует указать?
Если нагревают гидрокарбонат щелочного металла, то реакция одна:
- 2KHCO3 → K2CO3 + CO2↑ + H2O↑
Если нагревают другие гидрокарбонаты, то нужно писать две реакции:
- Ba(HCO3)2 → BaCO3 + CO2↑ + H2O↑ ‒ нагревание
- BaCO3 → BaO + CO2↑ ‒ при продолжении нагревания
Разложение гидросульфитов
Идет сходным с разложением гидрокарбонатов образом, при термическом размножении этих солеи образуются сульфиты и выделяется газ:
- 2KHSO3 → K2SO3 + SO2↑ + H2O↑ ‒ разложение гидросульфита калия
- Ba(HSO3)2 → BaSO3 + SO2↑ + H2O↑ ‒ разложение гидросульфита бария
Разложение сульфитов
В отличие от реакция термического разложения карбонатов, большинство сульфитов разлагаются при нагревании со сменой степени окисления (происходит реакция самоокисления-самовосстановления или диспропорционирования). При нагревании сульфита образуется смесь сульфидов и сульфатов:
- 4Na2SO3 → 3Na2SO4 + Na2S ‒ термическое разложение сульфита натрия
- 4CaSO3 → 3CaSO4 + CaS ‒ термическое разложение сульфита кальция
Разложение сульфатов
Сульфаты щелочных металлов не разлагаются при нагревании. Сульфаты серебра и ртути разлагаются до свободного металла, сульфаты остальных металлов разлагаются до оксида металла, сернистого газа и кислорода.
Уравнения реакция разложения сульфатов:
- 2CaSO4 → 2CaO + 2SO2↑ + O2↑ ‒ реакция разложения сульфата кальция
- Ag2SO4 → 2Ag + 2SO2↑ + O2↑ ‒ реакция разложения сульфата серебра
Уравнения реакций разложения комплексных солей
При нагревании комплексные соли теряют воду, превращаясь в средние соли, степени окисления при этом не изменяются:
- Na[Al(OH)4] → NaAlO2 + 2H2O↑ ‒ разложение тетрагидроксоалюмината натрия
- K2[Zn(OH)4] → K2ZnO2 + 2H2O↑ ‒ разложение тетрагидроксоцинката калия
- Ca[Be(OH)4] → CaBeO2 + 2H2O↑ ‒ разложение тетрагидроксобериллата кальция
- Ba[Al(OH)4]2 → Ba(AlO2)2 + 4H2O↑ ‒ разложение тетрагидроксоалюмината бария
Реакция разложения дихромата калия и перманганата калия
На ЕГЭ по химии реакции разложения дихромата калия и перманганата калия часто встречаются в заданиях линии 29 и 31.Эти две реакции похожи, поэтому их удобно запоминать сразу парой:
- 4K2Cr2O7 → 4K2CrO4 + 2Cr2O3 + 3O2↑ ‒ уравнение термического разложения дихромата калия
- 2KMnO4 → K2MnO4 + MnO2 + O2↑ ‒ уравнение термического разложение перманганата калия
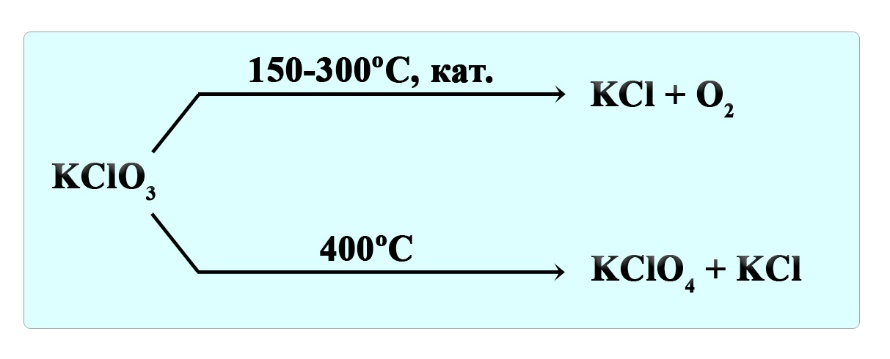
Разложение бертолетовой соли
Бертолетова соль или хлорат калия разлагается на разные продукты в зависимости от условий. При нагревании до 150-300ºС в присутствие катализатора образуется хлорид калия и кислород:
- 2KClO3 → 2KCl + 3O2↑
Сходным образом разлагается перхлорат калия:
- KClO4 → KCl + 2O2↑
При температуре 400ºС бертолетова соль разлагается на перхлорат калия и хлорид калия:
- 4KClO3 → 3KClO4 + KCl
Флэш-карточки с разложением солей. Перед Вами лицевая сторона карточки с формулой соли, попробуйте вспомнить основные продукты разложения этой соли и нажмите на карточку, чтобы проверить реакцию:
-
-
(NH4)2Cr2O7
N2 + Cr2O3 + H2O
-
-
KClO3 (400 градусов)
KClO4 + KCl
-
K2Cr2O7
K2CrO4 + Cr2O3 + O2
-
-
-
-
-
Разложение гидроксидов
Еще одна популярная тема в разложении веществ – термическое разложение гидроксидов. Большинство нерастворимых гидроксидов неустойчивы, разлагаются на оксид и воду. При этом степень окисления металла не меняется. Растворимые гидроксиды (щелочи) не разлагаются, за исключением неустойчивого гидроксида аммония (который не является щелочью).
- 2Al(OH)3 → Al2O3 + 3H2O ‒ разложение гидроксида алюминия
- Zn(OH)2 → ZnO + H2O ‒ разложение гидроксида цинка
- Cu(OH)2 → CuO + H2O ‒ разложение гидроксида меди II
- 2Fe(OH)3 → Fe2O3 + 3H2O ‒ разложение гидроксида железа III
- NH4OH → NH3↑ + H2O или NH3·H2O → NH3↑ + H2O ‒ разложение гидроксида аммония
Разложение органических веществ
Сходным образом происходит и разложение органических веществ – гидроксидов метиламмония, диметиламмония, триметиламмония и некоторых других.
- [CH3-NH3]OH → CH3-NH2↑ + H2O ‒ разложение гидроксида метиламмония
- [(CH3)2-NH2]OH → (CH3)2-NH↑ + H2O ‒ разложение гидроксида диметиламмония
- [(CH3)3-NH]OH → (CH3)3-N↑ + H2O ‒ разложение гидроксида триметиламмония
Разложение кислот
Неустойчивыми кислотами являются угольная, сернистая кислота и азотистая кислота, они разлагаются даже при небольшом нагревании:
- H2CO3 → CO2↑ + H2O ‒ разложение угольной кислоты
- H2SO3 → SO2↑ + H2O ‒ разложение сернистой кислоты
- 2HNO2 → NO↑ + NO2↑ + H2O ‒ разложение азотистой кислоты без нагревания
- 3HNO2 → HNO3 + 2NO↑ + H2O – разложение азотистой кислоты при нагревании
Разложение остальных кислот требует нагревания:
- 4HNO3 → 4NO2 + O2↑ + 2H2O ‒ разложение азотной кислоты
- H2SiO3 → SiO2 + H2O – разложение кремниевой кислоты
Реакции разложения
При выполнении различных заданий ЕГЭ по химии (например, задачи 34 или задания 32 «мысленный эксперимент») могут пригодиться знания о том, какие вещества при нагревании разлагаются и как они разлагаются.
Рассмотрим термическую устойчивость основных классов неорганических веществ. Я не указываю в условиях температуру протекания процессов, так как в ЕГЭ по химии такая информация, как правило, не встречается. Если возможны различные варианты разложения веществ, я привожу наиболее вероятные, на мой взгляд, реакции.
Разложение оксидов
При нагревании разлагаются оксиды тяжелых металлов:
2HgO = 2Hg + O2
Разложение гидроксидов
Как правило, при нагревании разлагаются нерастворимые гидроксиды. Исключением является гидроксид лития, он растворим, но при нагревании в твердом виде разлагается на оксид и воду:
2LiOH = Li2O + H2O
Гидроксиды других щелочных металлов при нагревании не разлагаются.
Гидроксиды серебра (I) и меди (I) неустойчивы:
2AgOH = Ag2O + H2O
2CuOH = Cu2O + H2O
Гидроксиды большинства металлов при нагревании разлагаются на оксид и воду.
В инертной атмосфере (в отсутствии кислорода воздуха) гидроксиды хрома (III) марганца (II) и железа (II) распадаются на оксид и воду:
Большинство остальных нерастворимых гидроксидов металлов также при нагревании разлагаются:
Разложение кислот
При нагревании разлагаются нерастворимые кислоты.
Например , кремниевая кислота:
Некоторые кислоты неустойчивы и подвергаются разложению в момент образования. Большая часть молекул сернистой кислоты и угольной кислоты распадаются на оксид и воду в момент образования:
В ЕГЭ по химии лучше эти кислоты записывать в виде оксида и воды.
Например , при действии водного раствора углекислого газа на карбонат калия в качестве реагента мы указываем не угольную кислоту, а оксид углерода (IV) и воду, но подразумеваем угольную кислоту при этом:
Азотистая кислота на холоде или при комнатной температуре частично распадается уже в водном растворе, реакция протекает обратимо:
При нагревании выше 100 о С продукты распада несколько отличаются:
Азотная кислота под действием света или при нагревании частично обратимо разлагается:
Разложение солей
Разложение хлоридов
Хлориды щелочных, щелочноземельных металлов, магния, цинка, алюминия и хрома при нагревании не разлагаются.
Хлорид серебра (I) разлагается под действием света:
2AgCl → Ag + Cl2
Хлорид аммония при нагревании выше 340 о С разлагается:
Разложение нитратов
Нитраты щелочных металлов при нагревании разлагаются до нитрита металла и кислорода.
Например , разложение нитрата калия:
Видеоопыт разложения нитрата калия можно посмотреть здесь.
Нитраты магния, стронция, кальция и бария разлагаются до нитрита и кислорода при нагревании до 500 о С:
При более сильном нагревании (выше 500 о С) нитраты магния, стронция, кальция и бария разлагаются до оксида металла, оксида азота (IV) и кислорода:
Нитраты металлов, расположенных в ряду напряжений после магния и до меди (включительно) + нитрат лития разлагаются при нагревании до оксида металла, диоксида азота и кислорода:
Нитраты серебра и ртути разлагаются при нагревании до металла, диоксида азота и кислорода:
Нитрат аммония разлагается при небольшом нагревании до 270 о С оксида азота (I) и воды:
При более высокой температуре образуются азот и кислород:
Разложение карбонатов и гидрокарбонатов
Карбонаты натрия и калия плавятся при нагревании.
Карбонаты лития, щелочноземельных металлов и магния разлагаются на оксид металла и углекислый газ:
Карбонат аммония разлагается при 30 о С на гидрокарбонат аммония и аммиак:
Гидрокарбонат аммония при дальнейшем нагревании разлагается на аммиак, углекислый газ и воду:
Гидрокарбонаты натрия и калия при нагревании разлагаются на карбонаты, углекислый газ и воду:
Гидрокарбонат кальция при нагревании до 100 о С разлагается на карбонат, углекислый газ и воду:
При нагревании до 1200 о С образуются оксиды:
Разложение сульфатов
Сульфаты щелочных металлов при нагревании не разлагаются.
Сульфаты алюминия, щелочноземельных металлов, меди, железа и магния разлагаются до оксида металла, диоксида серы и кислорода:
Сульфаты серебра и ртути разлагаются до металла, диоксида серы и кислорода:
Разложение фосфатов, гидрофосфатов и дигидрофосфатов
Эти реакции, скорее всего, в ЕГЭ по химии не встретятся! Гидрофосфаты щелочных и щелочноземельных металлов разлагаются до пирофосфатов:
Ортофосфаты при нагревании не разлагаются (кроме фосфата аммония).
Разложение сульфитов
Сульфиты щелочных металлов разлагаются до сульфидов и сульфатов:
Разложение солей аммония
Некоторые соли аммония, не содержащие анионы кислот-сильных окислителей, обратимо разлагаются при нагревании без изменения степени окисления. Это хлорид, бромид, йодид, дигидрофосфат аммония:
Cоли аммония, образованные кислотами-окислителями, при нагревании также разлагаются. При этом протекает окислительно-восстановительная реакция. Это дихромат аммония, нитрат и нитрит аммония:
Видеоопыт разложения нитрита аммония можно посмотреть здесь.
Разложение перманганата калия
Разложение хлората и перхлората калия
Хлорат калия при нагревании разлагается до перхлората и хлорида:
4KClO3 → 3KClO4 + KCl
При нагревании в присутствии катализатора (оксид марганца (IV)) образуется хлорид калия и кислород:
2KClO3 → 2KCl + 3O2
Перхлорат калия при нагревании разлагается до хлорида и кислорода:
Разложение солей при нагревании
Разложение солей при нагревании

При этом, как правило, выделяется NH3
* Нитраты металлов, стоящих в ряду напряжений до (левее, выше) Mg, разлагаются до нитритов (кроме LiNO3).
Иногда вместо NH3 выделяется N2 или N2O
Характер образующихся продуктов зависит от того, каким металлом образована соль, но во всех случаях выделяется O2.
* Нитраты металлов, стоящих в ряду напряжений до (левее, выше) Mg, разлагаются до нитритов (кроме LiNO3)
* Нитраты металлов, стоящих в ряду напряжений от Mg до Cu (включительно), разлагаются до оксида металла:
* Нитраты металлов, стоящих после Cu, разлагаются до металла:
При этом в результате диспропорционирования образуется сульфид и сульфат.
Гидросульфиты разлагаются до дисульфитов.
· Практически все соли угольной кислоты (карбонаты).
Исключения составляют только карбонаты щелочных металлов (кроме Li2CO3).
Гидрокарбонаты разлагаются все – сначала до соответствующего карбоната, а при более высокой температуре до оксида металла и CO2
Гидрокарбонаты щелочных металлов разлагаются до карбонатов. Исключение LiHCO3
· Многие соли серной кислоты (сульфаты).
Следует помнить, что разложение сульфатов происходит только при t > 700–800 ̊С. При это образуется оксид металла и SO3 или SO2+O2, т. к. при такой температуре SO3 разлагается
Сульфаты щелочных металлов и щелочноземельных металлов термостойки.
Гидросульфаты при прокаливании разлагаются сначала до дисульфатов, а затем до сульфатов.
(например, марганцовой HMnO4, двухромовой H2Cr2O7. Хлорноватой HClO3 и тд.)
При нагревании (кипячении) растворов разлагаются все комплексные соли, образованные амфотерными металлами.
При прокаливании разлагаются многие основные соли.
Некоторые соли разлагаются под действием света (фотохимические реакции).
Термостойки (плавятся без разложения)
фосфорной кислоты – фосфаты,
галогеноводородных кислот – фториды, хлориды, бромиды, иодиды.
Большинство солей щелочных металлов.
Химические свойства солей
О чем эта статья:
Соли — это сложные вещества, в состав которых входят катионы металла и анионы кислотного остатка. Иногда в состав солей входят водород или гидроксид-ион.
Классификация и номенклатура солей
Так как соли — это продукт полного или частичного замещения металлом атома водорода в кислоте, по составу их можно классифицировать следующим образом.
Кислые соли
Образованы неполным замещением атомов водорода на металл в кислоте.
В наименованиях кислых солей указывают количество водорода приставками «гидро-» или «дигидро-», название кислотного остатка и название металла. Если металл имеет переменную валентность, то в скобках указывают валентность.
Примеры кислых солей и их наименования:
LiHCO3 — гидрокарбонат лития,
NaHSO4 — гидросульфат натрия,
NaH2PO4 — дигидрофосфат натрия.
Средние соли
Образованы полным замещением атомов водорода в кислоте на металл.
Наименования средних солей складываются из названий кислотного остатка и металла. При необходимости указывают валентность.
Примеры средних солей с названиями:
CuSO4 — сульфат меди (II),
CaCl2 — хлорид кальция.
Основные соли
Продукт неполного замещения гидроксогрупп на кислотный остаток.
В наименованиях основных солей указывают количество гидроксид-ионов приставкой «гидроксо-» или «дигидроксо-», название кислотного остатка и название металла с указанием валентности.
Пример: Mg(OH)Cl — гидроксохлорид магния.
Двойные соли
В состав входят два разных металла и один кислотный остаток.
Наименование складывается из названия аниона кислотного остатка и названий металлов с указанием валентности (если металл имеет переменную валентность).
Примеры двойных солей и их наименования:
KNaSO4 — сульфат калия-натрия,
Смешанные соли
Содержат один металл и два разных кислотных остатка.
Наименования смешанных солей складываются из названия кислотных остатков (по усложнению) и названия металла с указанием валентности (при необходимости).
Примеры смешанных солей с наименованиями:
CaClOCl — хлорид-гиполхорит кальция,
PbFCl — фторид-хлорид свинца (II).
Комплексные соли
Образованы комплексным катионом или анионом, связанным с несколькими лигандами.
Называют комплексные соли по схеме: координационное число + лиганд с окончанием «-о» + комплексообразователь с окончанием «-ат» и указанием валентности + внешняя сфера, простой ион в родительном падеже.
Пример: K[Al(OH)4] — тетрагидроксоалюминат калия.
Гидратные соли
В состав входит молекула кристаллизационной воды.
Число молекул воды указывают численной приставкой к слову «гидрат» и добавляют название соли.
Пример: СuSO4∙5H2O — пентагидрат сульфата меди (II).
Получение солей
Получение средних солей
Средние соли можно образовать в ходе следующих реакций:
Так получают только соли бескислородных кислот.
Металл, стоящий левее H2 в ряду активности, с раствором кислоты:
Mg + 2HCl = MgCl2 + H2
Металл с раствором соли менее активного металла:
Основный оксид + кислотный оксид:
Основный оксид и кислота:
Основание с кислотным оксидом:
Основание с кислотой (реакция нейтрализации):
Взаимодействие соли с кислотой:
Взаимодействие возможно, если одним из продуктов реакции будет нерастворимая соль, вода или газ.
Реакция раствора основания с раствором соли:
Взаимодействие растворов двух солей с образованием новых солей:
Получение кислых солей
Кислые соли образуются при взаимодействии:
Кислот с металлами:
Кислот с оксидами металлов:
Гидроксидов металлов с кислотами:
Кислот с солями:
Аммиака с кислотами:
Получение кислых солей возможно, если кислота в избытке.
Также кислые соли образуются в ходе реакции основания с избытком кислотного оксида:
Получение основных солей
Взаимодействие кислоты с избытком основания:
Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов:
Взаимодействие солей слабых кислот со средними солями:
Получение комплексных солей
Реакции солей с лигандами:
Получение двойных солей
Двойные соли получают совместной кристаллизацией двух солей:
Химические свойства солей
Химические свойства средних солей
Растворимые соли являются электролитами, следовательно, могут распадаться на ионы. Средние соли диссоциируют сразу:
Нитраты разлагаются в зависимости от активности металла соли:
| Металл | Левее Mg, кроме Li | От Mg до Cu | Правее Cu |
| Продукты | MeNO3 + O2 | MexOy + NO2 + O2 | Me + NO2 + O2 |
| Пример | 2NaNO3 = 2NaNO2 + O2 | 2Cu(NO3)2 = 2CuO + 4NO2 + O2 | 2AgNO3= 2Ag + 2NO2 + O2 |
Соли аммония разлагаются с выделением азота или оксида азота (I), если в составе анион, проявляет окислительные свойства. В остальных случаях разложение солей аммония сопровождается выделением аммиака:
Взаимодействие солей с металлами:
Более активные металлы вытесняют менее активные металлы из растворов солей.
Некоторые соли подвержены гидролизу:
Обменные реакции соли и кислоты, соли с основаниями и взаимодействие солей с солями:
Окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона:
Химические свойства кислых солей
Диссоциация. Кислые соли диссоциируют ступенчато:
Термическое разложение с образованием средней соли:
Взаимодействие солей со щелочью. В результате образуется средняя соль:
Химические свойства основных солей
Реакции солей с кислотами — образование средней соли:
Диссоциация — так же как и кислые соли, основные соли диссоциируют ступенчато.
Химические свойства комплексных солей
Избыток сильной кислоты приводит к разрушению комплекса и образованию двух средних солей и воды:
Недостаток сильной кислоты приводит к образованию средней соли активного металла, амфотерного гидроксида и воды:
Взаимодействие слабой кислоты с солью образует кислую соль активного металла, амфотерный гидроксид и воду:
При действии углекислого или сернистого газа получаются кислая соль активного металла и амфотерный гидроксид:
Реакция солей, образованных сильными кислотами с катионами Fe3+, Al3+ и Cr3+, приводит к взаимному усилению гидролиза. Продукты реакции — два амфотерных гидроксида и соль активного металла:
Разлагаются при нагревании:
Вопросы для самопроверки
С чем взаимодействуют средние соли?
Назовите типичные реакции солей.
Из предложенного списка солей выберите те, которые не реагируют с цинком: нитрит калия, бромид железа, карбонат цезия, сульфат меди.
Формула какого вещества пропущена в уравнении реакции:
источники:
http://pandia.ru/text/80/351/81348.php
http://skysmart.ru/articles/chemistry/khimicheskie-svojstva-solej
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
2.7. Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка).
Химические свойства средних солей
Взаимодействие средних солей с металлами
Реакция соли с металлом протекает в том случае, если исходный свободный металл более активен, чем тот, который входит в состав исходной соли. Узнать о том, какой металл более активен, можно, воспользовавшись электрохимическим рядом напряжений металлов.
Так, например, железо взаимодействует с сульфатом меди в водном растворе, поскольку является более активным, чем медь (левее в ряду активности):
В то же время железо не реагирует с раствором хлорида цинка, поскольку оно менее активно, чем цинк:
Следует отметить, что такие активные металлы, как щелочные и щелочноземельные, при их добавлении к водным растворам солей будут прежде всего реагировать не с солью, а входящей в состав растворов водой.
Взаимодействие средних солей с гидроксидами металлов
Оговоримся, что под гидроксидами металлов в данном случае понимаются соединения вида Me(OH)x.
Для того чтобы средняя соль реагировала с гидроксидом металла, должны одновременно (!) выполняться два требования:
- в предполагаемых продуктах должен быть обнаружен осадок или газ;
- исходная соль и исходный гидроксид металла должны быть растворимы.
Рассмотрим пару случаев, для того чтобы усвоить данное правило.
Определим, какие из реакций ниже протекают, и напишем уравнения протекающих реакций:
- 1) PbS + KOH
- 2) FeCl3 + NaOH
Рассмотрим первое взаимодействие сульфида свинца и гидроксида калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», обозначив таким образом, что пока не известно, протекает ли реакция на самом деле:
В предполагаемых продуктах мы видим гидроксид свинца (II), который, судя по таблице растворимости, нерастворим и должен выпадать в осадок. Однако, вывод о том, что реакция протекает, пока сделать нельзя, так как мы не проверили удовлетворение еще одного обязательного требования – растворимости исходных соли и гидроксида. Сульфид свинца – нерастворимая соль, а значит реакция не протекает, так как не выполняется одно из обязательных требований для протекания реакции между солью и гидроксидом металла. Т.е.:
Рассмотрим второе предполагаемое взаимодействие между хлоридом железа (III) и гидроксидом калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», как и в первом случае:
В предполагаемых продуктах мы видим гидроксид железа (III), который нерастворим и должен выпадать в осадок. Однако сделать вывод о протекании реакции пока еще нельзя. Для этого надо еще убедиться в растворимости исходных соли и гидроксида. Оба исходных вещества растворимы, значит мы можем сделать вывод о том, что реакция протекает. Запишем ее уравнение:
Реакции средних солей с кислотами
Средняя соль реагирует с кислотой в том случае, если образуется осадок или слабая кислота.
Распознать осадок среди предполагаемых продуктов практически всегда можно по таблице растворимости. Так, например, серная кислота реагирует с нитратом бария, поскольку в осадок выпадает нерастворимый сульфат бария:
Распознать слабую кислоту по таблице растворимости нельзя, поскольку многие слабые кислоты растворимы в воде. Поэтому список слабых кислот следует выучить. К слабым кислотам относят H2S, H2CO3, H2SO3, HF, HNO2, H2SiO3 и все органические кислоты.
Так, например, соляная кислота реагирует с ацетатом натрия, поскольку образуется слабая органическая кислота (уксусная):
Следует отметить, что сероводород H2S является не только слабой кислотой, но и плохо растворим в воде, в связи с чем выделяется из нее в виде газа (с запахом тухлых яиц):
Кроме того, обязательно следует запомнить, что слабые кислоты — угольная и сернистая — являются неустойчивыми и практически сразу же после образования разлагаются на соответствующий кислотный оксид и воду:
Выше было сказано, что реакция соли с кислотой идет в том случае, если образуется осадок или слабая кислота. Т.е. если нет осадка и в предполагаемых продуктах присутствует сильная кислота, то реакция не пойдет. Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
Однако, если брать не концентрированную серную кислоту и твердый хлорид натрия, а растворы этих веществ, то реакция действительно не пойдет:
Реакции средних солей с другими средними солями
Реакция между средними солями протекает в том случае, если одновременно (!) выполняются два требования:
- исходные соли растворимы;
- в предполагаемых продуктах есть осадок или газ.
Например, сульфат бария не реагирует с карбонатом калия, поскольку несмотря на то что в предполагаемых продуктах есть осадок (карбонат бария), не выполняется требование растворимости исходных солей.
В то же время хлорид бария реагирует с карбонатом калия в растворе, поскольку обе исходные соли растворимы, а в продуктах есть осадок:
Газ при взаимодействии солей образуется в единственном случае – если смешивать при нагревании раствор любого нитрита с раствором любой соли аммония:
Причина образования газа (азота) заключается в том, что в растворе одновременно находятся катионы NH4+ и анионы NO2— , образующие термически неустойчивый нитрит аммония, разлагающийся в соответствии с уравнением:
Реакции термического разложения солей
Разложение карбонатов
Все нерастворимые карбонаты, а также карбонаты лития и аммония термически неустойчивы и разлагаются при нагревании. Карбонаты металлов разлагаются до оксида металла и углекислого газа:
а карбонат аммония дает три продукта – аммиак, углекислый газ и воду:
Разложение нитратов
Абсолютно все нитраты разлагаются при нагревании, при этом тип разложения зависит от положения металла в ряду активности. Схема разложения нитратов металлов представлена на следующей иллюстрации:
Так, например, в соответствии с этой схемой уравнения разложения нитрата натрия, нитрата алюминия и нитрата ртути записываются следующим образом:
Также следует отметить специфику разложения нитрата аммония и нитрата железа (II):
Реакция разложения нитрата железа (II) снова стала встречаться в ЕГЭ по химии. В заданиях фигурирует формулировка о его разложении в токе воздуха, однако, что в токе воздуха, что без него, уравнение будет одинаковым. Писать оксид FeO при разложении нитрата железа (II) будет ошибкой.
Разложение солей аммония
Термическое разложение солей аммония чаще всего сопровождается образованием аммиака:
В случае, если кислотный остаток обладает окислительными свойствами, вместо аммиака образуется какой-либо продукт его окисления, например, молекулярный азот N2 или оксид азота (I):
Разложение хлората калия
Реакция разложения хлората калия может протекать по-разному. В присутствии катализатора (как правило MnO2), реакция приводит к образованию хлорида калия и кислорода:
Без катализатора, реакция будет протекать по типу диспропорционирования:
Химические свойства кислых солей
Отношение кислых солей к щелочам и кислотам
Кислые соли реагируют с щелочами. При этом, если щелочь содержит тот же металл, что и кислая соль, то образуются средние соли:
Также, если в кислотном остатке кислой соли осталось два или более подвижных атомов водорода, как, например, в дигидрофосфате натрия, то возможно образование как средней:
так и другой кислой соли с меньшим числом атомов водорода в кислотном остатке:
Важно отметить, что кислые соли реагируют с любыми щелочами, в том числе и теми, которые образованы другим металлом. Например:
Кислые соли, образованные слабыми кислотами, реагируют с сильными кислотами аналогично соответствующим средним солям:
Более подробно, с разбором алгоритмов составления уравнений, взаимодействие кислых солей (в частности, гидрокарбонатов, дигидрофосфатов и гидрофосфатов) со щелочами рассмотрено в данной публикации.
Термическое разложение кислых солей
Все кислые соли при нагревании разлагаются. В рамках программы ЕГЭ по химии из реакций разложения кислых солей следует усвоить, как разлагаются гидрокарбонаты. Гидрокарбонаты металлов разлагаются уже при температуре более 60 оС. При этом образуются карбонат металла, углекислый газ и вода:
Последние две реакции являются основной причиной образования накипи на поверхности водонагревательных элементов в электрических чайниках, стиральных машинах и т.д.
Гидрокарбонат аммония разлагается без твердого остатка с образованием двух газов и паров воды:
Химические свойства основных солей
Основные соли всегда реагируют со всеми сильными кислотами. При этом могут образоваться средние соли, если использовались кислота с тем же кислотным остатком, что и в основной соли, или смешанные соли, если кислотный остаток в основной соли отличается от кислотного остатка реагирующей с ней кислоты:
Также для основных солей характерны реакции разложения при нагревании, например:
Химические свойства комплексных солей (на примере соединений алюминия и цинка)
В рамках программы ЕГЭ по химии следует усвоить химические свойства таких комплексных соединений алюминия и цинка, как тетрагидроксоалюминаты и третрагидроксоцинкаты.
Тетрагидроксоалюминатами и тетрагидроксоцинкатами называют соли, анионы которых имеют формулы [Al(OH)4]— и [Zn(OH)4]2- соответственно. Рассмотрим химические свойства таких соединений на примере солей натрия:
Данные соединения, как и другие растворимые комплексные, хорошо диссоциируют, при этом практически все комплексные ионы (в квадратных скобках) остаются целыми и не диссоциируют дальше:
Действие избытка сильной кислоты на данные соединения приводит к образованию двух солей:
При действии же на них недостатка сильных кислот в новую соль переходит только активный металл. Алюминий и цинк в составе гидроксидов выпадают в осадок:
Осаждение гидроксидов алюминия и цинка сильными кислотами не является удачным выбором, поскольку сложно добавить строго необходимое для этого количество сильной кислоты, не растворив при этом часть осадка. По этой причине для этого используют углекислый газ, обладающий очень слабыми кислотными свойствами и благодаря этому не способный растворить осадок гидроксида:
В случае тетрагидроксоалюмината осаждение гидроксида также можно проводить, используя диоксид серы и сероводород:
В случае тетрагидроксоцинката осаждение сероводородом невозможно, поскольку в осадок вместо гидроксида цинка выпадает его сульфид:
При упаривании растворов тетрагидроксоцинката и тетрагидроксоалюмината с последующим прокаливанием данные соединения переходят соответственно в цинкат и алюминат:
…
Сероводород
Получение
сероводорода
- Получение из простых веществ:
S + Н2 = H2S
- Взаимодействие минеральных кислот и сульфидов металлов, расположенных в ряду напряжений левее железа:
FeS + 2HCI = H2S↑ + FeCl2
- Действие концентрированной H2SO4 (без избытка) на щелочные и щелочно-земельные металлы:
5H2SO4(конц.) + 8Na = H2S↑ + 4Na2SO4 + 4H2О
- Гидролиз некоторых сульфидов:
AI2S3 + 6Н2О = 3H2S↑ + 2Аl(ОН)3↓
- Нагревание парафина с серой:
C40H82 + 41S = 41Н2S+40С
Видео Получение и обнаружение сероводорода
Физические
свойства и строение сероводорода
Сероводород H2S – это бинарное летучее водородное соединение соединение с серой. H2S — бесцветный ядовитый газ, с неприятным удушливым
запахом тухлых яиц. При концентрации > 3 г/м3 вызывает смертельное отравление.
Сероводород тяжелее воздуха и легко конденсируется в бесцветную жидкость. Растворимость в воде H2S при обычной температуре составляет 2,5.
В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы сероводорода представляет собой сцепленные между собой атомы H-S-H с валентным углом 92,1о.
Качественная реакция для обнаружения сероводорода
Для
обнаружения анионов S2- и сероводорода используют
реакцию газообразного H2S с Pb(NO3)2:
H2S + Pb(NO3)2 = 2HNO3 + PbS↓ черный
осадок.
Влажная бумага, смоченная в растворе Pb(NO3)2 чернеет в присутствии H2S из-за получения черного осадка PbS.
Химические свойства серы
H2S является сильным восстановителем
При взаимодействии H2S с окислителями образуются различные вещества — S, SО2, H2SO4
- Окисление кислородом воздуха:
2H2S + 3О2(избыток) = 2SО2↑ + 2Н2О
2H2S + О2(недостаток) = 2S↓ + 2Н2О
- Окисление галогенами:
H2S + Br2 = S↓ + 2НВr
H2S + Cl2 → 2HCl + S↓
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
- Взаимодействие с кислотами-окислителями:
3H2S + 8HNО3(разб.) = 3H2SO4 + 8NO + 4Н2О
H2S + 8HNО3(конц.) = H2SO4 + 8NО2↑ + 4Н2О
H2S + H2SO4(конц.) = S↓ + SО2↑ + 2Н2О
- Взаимодействие со сложными окислителями:
5H2S + 2KMnO4 + 3H2SO4 = 5S↓ + 2MnSO4 + K2SO4 + 8Н2О
5H2S + 6KMnO4 + 9H2SO4 = 5SО2 + 6MnSO4 + 3K2SO4 + 14Н2О
H2S + 2FeCl3 = S↓ + 2FeCl2 + 2HCl
2H2S + SO2 = 2H2O + 3S
3H2S + K2Cr2O7 + 4H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 7H2O
- Сероводородная кислота H2S двухосновная кислота и диссоциирует по двум ступеням:
1-я ступень:
H2S → Н+ + HS—
2-я ступень:
HS— → Н+ + S2-
H2S очень слабая
кислота, несмотря на это имеет характерные для кислот химические свойства. Взаимодействует:
- с активными металлами
H2S + Mg = Н2↑ + MgS
- с малоактивными металлами (Аg, Си, Нg) при совместном присутствии окислителей:
2H2S + 4Аg + O2 = 2Ag2S↓ + 2Н2O
- с основными оксидами:
H2S + ВаО = BaS + Н2O
- со щелочами:
H2S + NaOH(недостаток) = NaHS + Н2O
H2S + 2NaOH(избыток) → Na2S + 2H2O
- с аммиаком:
H2S + 2NH3(избыток) = (NH4)2S
- с некоторыми солями сильных кислот, если образующийся сульфид металла нерастворим в воде и в сильных кислотах:
CuSO4 + H2S = CuS↓ + H2SO4
H2S + Pb(NO3)2 → PbS↓ + 2HNO3
Реакция
с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видео Взаимодействие сероводорода с нитратом свинца
Сульфиды
Получение сульфидов
- Непосредственно из простых веществ:
S + Fe → FeS
S + Mg → MgS
S + Ca → CaS
- Взаимодействие H2S с растворами щелочей:
H2S + 2NaOH = 2H2O + Na2S
H2S + NaOH = H2O + NaHS
- Взаимодействие H2S или (NH4)2S с растворами солей:
H2S + CuSO4 = CuS↓ + H2SO4
H2S + 2AgNO3 = Ag2S↓ + 2HNO3
Pb(NO3)2 + Н2S → PbS↓ + 2НNO3
ZnSO4 + Na2S → ZnS↓ + Na2SO4
- Восстановление сульфатов при прокаливании с углем:
Na2SO4 + 4С = Na2S + 4СО
Физические свойства сульфидов
Сульфиды – это бинарные соединения серы с элементами с меньшей электроотрицательностью, в том числе с некоторыми неметаллами (С, Si, Р, As и др.).
По растворимости
в воде и кислотах сульфиды классифицируют
на:
- растворимые в воде — сульфиды щелочных металлов и аммония;
- нерастворимые в воде, но растворимые в минеральных кислотах — сульфиды металлов, расположенных до железа в ряду активности (белые и цветные сульфиды ZnS, MnS, FeS, CdS);
- нерастворимые ни в воде, ни в минеральных кислотах — черные сульфиды (CuS, HgS, PbS, Ag2S, NiS, CoS)
- гидролизуемые водой — сульфиды трехвалентных металлов (алюминия и хрома (III))
По цвету сульфиды можно разделить на:
- Чёрные – HgS, Ag2S, PbS, CuS, FeS,
NiS; - Коричневые – SnS, Bi2S3;
- Оранжевые – Sb2S3, Sb2S5;
- Жёлтые – As2S3, As2S5,
SnS2, CdS; - Розовые — MnS
- Белые – ZnS, Al2S3, BaS,
CaS;
Химические свойства сульфидов
Обратимый гидролиз сульфидов
- Хорошо растворимыми в воде являются сульфиды щелочных металлов и аммония, но в водных растворах они в значительной степени подвергаются гидролизу. Реакция среды — сильнощелочная:
K2S + H2O ⇄ KHS + KOH
S2- + H2O → HS— + ОН—
- Сульфиды щелочно-земельных металлов и Mg, при взаимодействии с водой подвергаются полному гидролизу и переходят в растворимые кислые соли — гидросульфиды:
2CaS + 2НОН
= Ca(HS)2 + Са(ОН)2
При нагревании растворов сульфидов гидролиз протекает и по 2-й ступени:
HS— + H2O → H2S↑ + ОН—
Необратимый
гидролиз сульфидов
- Сульфиды некоторых металлов (Cr2S3, Fe2S3, Al2S3) подвергаются необратимому гидролизу, полностью разлагаясь в водных растворах:
Al2S3 + 6H2O = 3H2S↑ + 2AI(OH)3↓
Нерастворимые
сульфиды гидролизу не подвергаются
NiS + HСl ≠
- Некоторые из сульфидов растворяются в сильных кислотах:
FeS + 2HCI =
FeCl2 + H2S↑
ZnS + 2HCI =
ZnCl2 + H2S↑
CuS + 8HNO3 → CuSO4 + 8NO2 + 4H2O
CuS + 4H2SO4(конц. гор.) → CuSO4 + 4SO2 + 4H2O
MnS + 3HNO3 = MnSO4 + 8NO2 + 4H2O
- Сульфиды Ag2S, HgS, Hg2S, PbS, CuS не pacтворяются не только в воде, но и во многих кислотах.
- Сульфиды обладают восстановительными свойствами и вступают в реакции с окислителями:
PbS + 4H2O2 → PbSO4 + 4H2O
СuS + Cl2 → CuCl2 + S
- Окислительный обжиг сульфидов является
важной стадией переработки сульфидного сырья в различных производствах
2ZnS + 3O2 = 2ZnO + 2SO2
4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑
2CuS + 3O2 → 2CuO + 2SO2
2Cr2S3 + 9O2 → 2Cr2O3 + 6SO2
Взаимодействия
сульфидов с растворимыми солями свинца, серебра, меди являются качественными на ион S2−:
Na2S + Pb(NO3)2 → PbS↓ + 2NaNO3
Na2S + 2AgNO3 → Ag2S↓ + 2NaNO3
Na2S + Cu(NO3)2 → CuS↓ + 2NaNO3
Оксид серы
(IV), диоксид серы, сернистый газ, сернистый ангидрид (SO2)
Способы получения сернистого газа
- Окисление серы, сероводорода и сульфидов кислородом воздуха:
S + O2 → SO2
2H2S + 3O2 → 2SO2 + 2H2O
2CuS + 3O2 → 2SO2 + 2CuO
- Действие высокой температуры на сульфиты (термическое разложение):
CaSO3 = СаО + SO2↑
- Действие сильных кислот на сульфиты:
Na2SO3 + 2HCl = SO2 + Н2O + 2NaCI
- Взаимодействие концентрированной H2SO4 с восстановителями, например с неактивными металлами:
2H2SO4 + Сu = SO2↑ + CuSO4 + 2Н2O
Физические
свойства сернистого газа
При обычной температуре SO2 — газ с резким запахом без цвета. В воде растворим хорошо — при 20°С в 1 л воды растворяется 40 л SO2.
Химические свойства сернистого газа
SO2 – типичный кислотный оксид. За счет того, что сера находится в промежуточной степени окисления (+4) SO2 может проявлять свойства как окислителя так и восстановителя.
- При растворении в воде SO2 частично соединяется с молекулами воды с образованием слабой сернистой кислоты.
SO2 + H2O ↔ H2SO3
- Как
кислотный оксид, SO2 вступает
в реакции с щелочами и оксидами щелочных и щелочноземельных металлов:
SO2 + СаО = CaSO3
SO2 + Na2O → Na2SO3
SO2 + NaOH = NaHSO3
SO2 + 2NaOH = Н2O + Na2SO3
- При взаимодействии с окислителями SO2 проявляет восстановительные свойства. При этом степень окисления серы повышается:
2SO2 + O2 ↔ 2SO3
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
SO2 + 2HNO3 → H2SO4 + 2NO2
SO2 + O3 → SO3 + O2
SO2 + PbO2 → PbSO4
5SO2 + 2H2O + 2KMnO4 → 2H2SO4 + 2MnSO4 + K2SO4
Обесцвечивание раствора перманганата калия KMnO4 является качественной реакцией для обнаружения сернистого газа и сульфит-иона
- SO2 проявляет окислительные свойства при взаимодействии с сильными восстановителями, восстанавливаясь чаще всего до свободной серы:
SO2 + 2Н2S → 3S↓ + 2H2O
SO2 + 2CO → S↓ +2СО2
SO2 + С → S↓ + СO2
Оксид серы (VI), триоксид серы, серный ангидрид (SO3)
Способы получения серного ангидрида
- SO3 можно получить из SO2 путем каталитического окисления последнего кислородом:
2SO2 + O2 ↔ 2SO3
- Окислением SO2 другими окислителями:
SO2 + O3 → SO3 + O2
SO2 + NO2 → SO3 + NO
- Разложением сульфата железа (III):
Fe2(SO4)3 → Fe2O3 + 3SO3
Физические
свойства серного ангидрида
При обычных условиях SO3 представляет собой бесцветную жидкость с характерным резким
запахом. На воздухе SO3 «дымит» и сильно
поглощает влагу.
SO3 – тяжелее
воздуха, хорошо растворим в воде.
SO3 ядовит!
Химические свойства серного
ангидрида
Оксид серы (VI) – это кислотный оксид.
- Хорошо поглощает влагу и реагирует с водой образуя серную кислоту:
SO3 + H2O → H2SO4
- Как кислотный оксид, SO3 взаимодействует с щелочами и
основными оксидами, образуются средние или кислые соли:
SO3 + 2NaOH(избыток) → Na2SO4 + H2O
SO3 + NaOH(избыток) → NaHSO4
SO3 + MgO → MgSO4 (при сплавлении):
SO3 + ZnO = ZnSO4
- SO3 проявляет сильные окислительные свойства, так
как сера в находится в максимальной степени окисления (+6).
Вступает в реакции с восстановителями:
SO3 + 2KI → I2 + K2SO3
3SO3 + H2S → 4SO2 + H2O
5SO3 + 2P → P2O5 + 5SO2
- При растворении в концентрированной
серной кислоте образует олеум (раствор
SO3 в H2SO4).
Сернистая кислота (H2SO3)
Способы
получения сернистой кислоты
При растворении в воде SO2 образует слабую сернистую кислоту, которая сразу частично разлагается:
SO2 + H2O ↔ H2SO3
Физические
свойства сернистой кислоты
Сернистая кислота H2SO3 – двухосновная кислородсодержащая кислота. При обычных условиях неустойчива.
Валентность серы
в сернистой кислоте равна IV, а степень окисления +4.
Химические свойства сернистой кислоты
Общие свойства
кислот
- Сернистая кислота – слабая кислота, диссоциирует в две стадии. Образует два типа солей:
- кислые – гидросульфиты
H2SO3 ↔ HSO3— + H+
- средние – сульфиты
HSO3—↔ SO32- + H+
- Сернистая кислота самопроизвольно распадается на SO2 и H2O:
H2SO3 ↔ SO2 + H2O
Соли сернистой кислоты, сульфиты и гидросульфиты
Способы
получения сульфитов
Соли сернистой кислоты получаются при взаимодействии SO2 с щелочами и оксидами щелочных и щелочноземельных металлов:
SO2 + СаО = CaSO3
SO2 + Na2O → Na2SO3
SO2 + NaOH = NaHSO3
SO2 + 2NaOH = Н2O + Na2SO3
Физические
свойства сульфитов
Сульфиты
щелочных металлов и аммония растворимы в воде, сульфиты остальных металлов — нерастворимы
или не существуют.
Гидросульфиты
металлов хорошо растворимы в Н2O, а некоторые из
них, такие как Ca(HSO3)2 существуют
только в растворе.
Химические свойства сульфитов
Cернистая кислота – двухосновная, образует нормальные (средние) соли — сульфиты Mex(SO3)y и кислые соли — гидросульфиты Me(HSO3)x.
- Водные растворы сульфитов подвергаются гидролизу. Реакция среды – щелочная (окрашивают лакмус в синий цвет):
SO3— + Н2O = HSO3— + ОН—
Na2SO3 + Н2O = NaHSO3 + NaOH
Реакции, протекающие без изменения степени окисления:
- Реакция с сильными кислотами:
Na2SO3 + 2HCl = 2NaCl +
SO2↑ + Н2O
NaHSO3 + HCl = NaCl + SO2↑ + Н2O
- Термическое разложение сульфитов:
CaSO3 = СаО + SO2↑
- Нормальные сульфиты в водных растворах, при избытке SO2, переходят в гидросульфиты:
CaSO3 + SO2 + Н2O = Ca(HSO3)2
- Ионно-обменные реакции с другими солями, протекающие с образованием нерастворимых сульфитов:
Na2SO3 + ZnCl2 = ZnSO3↓ + 2NaCl
Окислительно-восстановительные реакции
Сульфиты, также как и SO2, могут быть как восстановителями, так и окислителями, т.к. атомы серы в анионах находятся в промежуточной степени окисления +4
- Окисление водных растворов сульфитов, и гидросульфитов до сульфатов:
Na2SO3 + Вr2 + Н2O = Na2SO4 + 2НВr
5K2SO3 + 2КМnO4 + 3H2SO4 = 6K2SO4 + 2MnSO4 + 3Н2O
Na2SO3 + HNO3 = 2NaNO3 + SO2 + H2O
- Твердые сульфиты при хранении на воздухе также медленно окисляются до сульфатов:
2Na2SO3 + O2 = 2Na2SO4
- При нагревании сухих сульфитов с активными восстановителями (С, Mg, Al, Zn) сульфиты превращаются в сульфиды:
Na2SO3 + ЗС = Na2S + ЗСО
- При нагревании сухих сульфитов до высоких температур сульфиты диспропорционируют, превращаются в смесь сульфатов и сульфидов:
4K2SO3 = 3K2SO4 + K2S
Серная кислота (H2SO4)
Способы
получения серной кислоты
В промышленности серную кислоту производят из серы, сульфидов
металлов, сероводорода и др.
Наиболее часто серную кислоту получают из пирита FeS2.
Основные стадии получения серной кислоты включают:
1.Обжиг пирита в кислороде в печи для обжига с получением сернистого газа:
4FeS2 +
11O2 → 2Fe2O3 +
8SO2 + Q
2. Очистка полученного сернистого газа от примесей в циклоне, электрофильтре.
3. Осушка сернистого газа в сушильной башне
4. Нагрев очищенного газа в теплообменнике.
5. Окисление сернистого газа в серный ангидрид в контактном аппарате:
2SO2 + O2 ↔ 2SO3 + Q
6. Поглощение серного ангидрида серной кислотой в поглотительной башне – получение олеума.
Физические
свойства, строение серной кислоты
При обычных условиях серная кислота – тяжелая бесцветная маслянистая жидкость, хорошо растворимая в воде. Максимальная плотность равна 1,84 г/мл
При растворении серной кислоты в воде выделяется большое количество теплоты. Поэтому, по правилам безопасности в лаборатории при приготовлении разбавленного раствора серной кислоты во избежание разбрызгивания необходимо наливать серную кислоту в воду тонкой струйкой по стеклянной палочке при постоянном перемешивании. Но не наоборот!
Валентность серы в серной кислоте равна VI.
Качественные
реакции для обнаружения серной кислоты и сульфат ионов
Для обнаружения сульфат-ионов используют реакцию с растворимыми солями бария. В результате взаимодействия, образуется белый кристаллический осадок сульфата бария:
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
Видео Взаимодействие хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион).
Химические свойства серной кислоты
Серная кислота — сильная двухосновная кислота, образует два типа солей: средние – сульфаты, кислые – гидросульфаты.
- Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени и достаточно по второй ступени:
H2SO4 ⇄ H+ + HSO4–
HSO4– ⇄ H+ + SO42–
Характерны все свойства кислот:
- Реагирует с основными оксидами, основаниями, амфотерными оксидами, амфотерными гидроксидами и аммиаком:
H2SO4 + MgO → MgSO4 + H2O
H2SO4 + КОН → KHSО4 + H2O
H2SO4 + 2КОН → К2SО4 + 2H2O
3H2SO4 + 2Al(OH)3 → Al2(SO4)3 + 6H2O
H2SO4 + NH3 → NH4HSO4
- Вытесняет более слабые кислоты из их солей в растворе (карбонаты, сульфиды и др.) и летучие кислоты из их солей (кроме солей HBr и HI):
Н2SO4 + 2NaHCO3 → Na2SO4 + CO2 + H2O
H2SO4 + Na2SiO3 → Na2SO4 + H2SiO3
- Концентрированная серная кислота реагирует с твердыми солями, например нитратом натрия, хлорида натрия.
NaNO3(тв.) + H2SO4 → NaHSO4 + HNO3
NaCl(тв.) + H2SO4 → NaHSO4 + HCl
- Вступает в обменные реакции с солями:
H2SO4 + BaCl2 → BaSO4 + 2HCl
- Взаимодействует с металлами:
Разбавленная серная кислота взаимодействует с металлами, расположенными в ряду напряжения металлов до водорода. В результате реакции образуются соль и водород:
H2SO4(разб.) + Fe → FeSO4 + H2
H2SO4 + Zn = ZnSO4 + H2
Концентрированная серная кислота — сильный окислитель. Реакция с металлами протекает без вытеснения водорода из кислоты. В зависимости от активности металла образуются различные продукты реакции:
- Активные металлы и цинк при обычной температуре с концентрированной серной кислотой образуют соль, сероводород (или серу) и воду:
H2SO4 + Na = Na2SO4 + Н2S↑ + H2O
5H2SO4(конц.) + 4Zn → 4ZnSO4 + H2S↑ + 4H2O
- Металлы средней активности с концентрированной H2SO4 образуют соль, серу и воду:
4H2SO4 + 3Mg → 3MgSO4 + S + 4H2O
- Такие металлы, как железо Fe,
алюминий Al, хром Cr пассивируются концентрированной
серной кислотой на холоде. При нагревании,
при удалении оксидной пленки реакция возможна.
6H2SO4(конц.) + 2Fe → Fe2(SO4)3 + 3SO2 + 6H2O
6H2SO4(конц.) + 2Al → Al2 (SO4)3 + Н2S↑ + 6H2O
- Неактивные металлы восстанавливают концентрированную серную кислоту до сернистого газа:
2H2SO4(конц.) + Cu → CuSO4 + SO2 ↑ + 2H2O
2H2SO4(конц.) + Hg → HgSO4 + SO2 ↑ + 2H2O
2H2SO4(конц.) + 2Ag → Ag2SO4 + SO2↑+ 2H2O
- В реакциях с неметаллами концентрированная серная кислота также проявляет окислительные свойства:
5H2SO4(конц.) + 2P → 2H3PO4 + 5SO2↑ + 2H2O
2H2SO4(конц.) + С → СО2↑ + 2SO2↑ + 2H2O
2H2SO4(конц.) + S → 3SO2 ↑ + 2H2O
3H2SO4(конц.) + 2KBr → Br2↓ + SO2↑ + 2KHSO4 + 2H2O
5H2SO4(конц.) + 8KI → 4I2↓ + H2S↑ + K2SO4 + 4H2O
H2SO4(конц.) + 3H2S → 4S↓ + 4H2O (комнатная температура)
H2SO4(конц.) + H2S = S↓ + SО2↑ + 2Н2О (при нагревании)
H2SO4(конц.) + 2HBr = Br2 + SO2 + 2H2O
- Концентрированная серная кислота широко используется в химических процессах как водоотнимающий агент, т.к. проявляет сильное водоотнимающее действие. В органической химии ее используют при получении спиртов, простых и сложных эфиров, альдегидов и т.д.
Соли серной кислоты, сульфаты, гидросульфаты
Способы
получения солей серной кислоты
Сульфаты можно получить при взаимодействии серной кислоты с металлами,
оксидами, гидроксидами (см. Химические свойства серной кислоты). А также при
взаимодействии с другими солями, если продуктом реакции является нерастворимое
соединение.
Физические
свойства солей серной кислоты
Кристаллы разного цвета. Многие средние и кислые сульфаты растворимы
в воде. Плохо растворяются или не растворяются в воде сульфаты многозарядных
щёлочноземельных металлов (BaSO4, RaSO4), сульфаты лёгких
щёлочноземельных металлов (CaSO4, SrSO4) и сульфат свинца.
Средние сульфаты щелочных металлов термически устойчивы. Кислые
сульфаты щелочных металлов при нагревании разлагаются.
Многие средние сульфаты образуют устойчивые кристаллогидраты:
Na2SO4 ∙ 10H2O − глауберова
соль
CaSO4 ∙ 2H2O − гипс
2CaSO4 xH2O –
алебастр
CuSO4 ∙ 5H2O − медный купорос
FeSO4 ∙ 7H2O − железный купорос
ZnSO4 ∙ 7H2O − цинковый купорос
Na2CO3 ∙ 10H2O −
кристаллическая сода
KАl(SO4)2 x 12H2O
– алюмокалиевые квасцы.
Химические свойства солей серной кислоты
Разложение сульфатов на различные классы соединений в зависимости от металла, входящего в состав соли.
- Сульфаты щелочных металлов плавятся без разложения.
- Кислые сульфаты щелочных металлов разлагаются с отщеплением воды:
2KHSO4 → K2S2O7 + H2O↑.
- Сульфаты металлов средней активности разлагаются на соответствующие оксиды:
ZnSO4 = ZnO + SO3
FeSO4 = 2Fe2O3 + 4SO2 + O2
2CuSO4 → 2CuO + SO2 + O2 (SO3)
2Al2(SO4)3 → 2Al2O3 + 6SO2 + 3O2
2Cr2(SO4)3 → 2Cr2O3 + 6SO2 + 3O2
- Сульфаты тяжёлых или малоактивных металлов разлагаются с образованием металла и кислорода:
HgSO4 = Hg + SO2 + O2
- Некоторые сульфаты проявляют окислительные свойства и вступают в реакции с простыми веществами:
CaSO4 +
C = CaO + SO2 + CO
BaSO4 +
4C = BaS + 4CO