При выполнении различных заданий ЕГЭ по химии (например, задачи 34 или задания 32 «мысленный эксперимент») могут пригодиться знания о том, какие вещества при нагревании разлагаются и как они разлагаются.
Рассмотрим термическую устойчивость основных классов неорганических веществ. Я не указываю в условиях температуру протекания процессов, так как в ЕГЭ по химии такая информация, как правило, не встречается. Если возможны различные варианты разложения веществ, я привожу наиболее вероятные, на мой взгляд, реакции.
Разложение оксидов
При нагревании разлагаются оксиды тяжелых металлов:
2Ag2O = 4Ag + O2
2HgO = 2Hg + O2
4CrO3 = 2Cr2O3 + O2
2Mn2O7 = 4MnO2 + 3O2
Разложение гидроксидов
Как правило, при нагревании разлагаются нерастворимые гидроксиды. Исключением является гидроксид лития, он растворим, но при нагревании в твердом виде разлагается на оксид и воду:
2LiOH = Li2O + H2O
Гидроксиды других щелочных металлов при нагревании не разлагаются.
Гидроксиды серебра (I) и меди (I) неустойчивы:
2AgOH = Ag2O + H2O
2CuOH = Cu2O + H2O
Гидроксиды большинства металлов при нагревании разлагаются на оксид и воду.
В инертной атмосфере (в отсутствии кислорода воздуха) гидроксиды хрома (III) марганца (II) и железа (II) распадаются на оксид и воду:
2Cr(OH)3 = Cr2O3 + 3H2O
Mn(OH)2 = MnO + H2O
Fe(OH)2 = FeO + H2O
Большинство остальных нерастворимых гидроксидов металлов также при нагревании разлагаются:
2Fe(OH)3 = Fe2O3 + 3H2O
2Al(OH)3 = Al2O3 + 3H2O
Разложение кислот
При нагревании разлагаются нерастворимые кислоты.
Например, кремниевая кислота:
H2SiO3 = H2O + SiO2
Некоторые кислоты неустойчивы и подвергаются разложению в момент образования. Большая часть молекул сернистой кислоты и угольной кислоты распадаются на оксид и воду в момент образования:
H2SO3 = H2O + SO2↑
H2CO3 = H2O + CO2↑
В ЕГЭ по химии лучше эти кислоты записывать в виде оксида и воды.
Например, при действии водного раствора углекислого газа на карбонат калия в качестве реагента мы указываем не угольную кислоту, а оксид углерода (IV) и воду, но подразумеваем угольную кислоту при этом:
K2CO3 + H2O + CO2 = 2KHCO3
Азотистая кислота на холоде или при комнатной температуре частично распадается уже в водном растворе, реакция протекает обратимо:
2HNO2 = H2O + NO2↑ + NO↑
При нагревании выше 100оС продукты распада несколько отличаются:
3HNO2 = H2O + HNO3↑ + 2NO↑
Азотная кислота под действием света или при нагревании частично обратимо разлагается:
4HNO3 = 2H2O + 4NO2 + O2
Разложение солей
Разложение хлоридов
Хлориды щелочных, щелочноземельных металлов, магния, цинка, алюминия и хрома при нагревании не разлагаются.
Хлорид серебра (I) разлагается под действием света:
2AgCl → Ag + Cl2
Хлорид аммония при нагревании выше 340 оС разлагается:
NH4Cl → NH3 + HCl
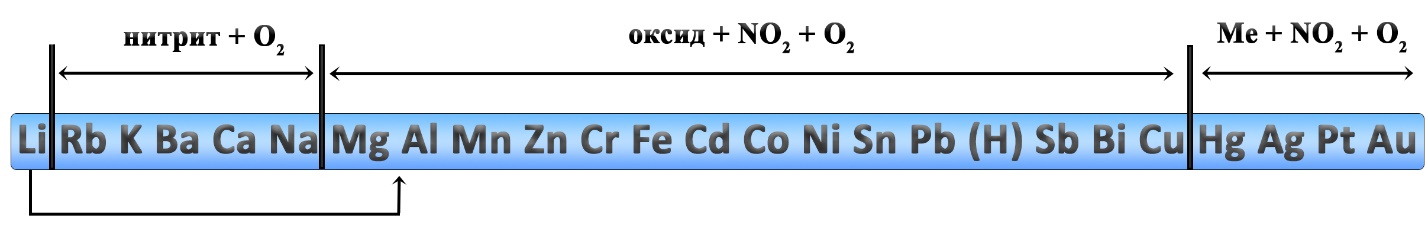
Разложение нитратов
Нитраты щелочных металлов при нагревании разлагаются до нитрита металла и кислорода.
Например, разложение нитрата калия:
2KNO3 → 2KNO2 + O2
Видеоопыт разложения нитрата калия можно посмотреть здесь.
Нитраты магния, стронция, кальция и бария разлагаются до нитрита и кислорода при нагревании до 500 оС:
Ca(NO3)2 → Ca(NO2)2 + O2
Mg(NO3)2 → Mg(NO2)2 + O2
Ba(NO3)2 → Ba(NO2)2 + O2
Sr(NO3)2 → Sr(NO2)2 + O2
При более сильном нагревании (выше 500оС) нитраты магния, стронция, кальция и бария разлагаются до оксида металла, оксида азота (IV) и кислорода:
2Ca(NO3)2 → 2CaО + 4NO2 + O2
2Mg(NO3)2 → 2MgО + 4NO2 + O2
2Sr(NO3)2 → 2SrО + 4NO2 + O2
2Ba(NO3)2 → 2BaО + 4NO2 + O2
Нитраты металлов, расположенных в ряду напряжений после магния и до меди (включительно) + нитрат лития разлагаются при нагревании до оксида металла, диоксида азота и кислорода:
2Cu(NO3)2 → 2CuО + 4NO2 + O2
2Pb(NO3)2 → 2PbО + 4NO2 + O2
4Al(NO3)3 → 2Al2O3 + 12NO2 + 3O2
4LiNO3 → 2Li2O + 4NO2 + O2
Нитраты серебра и ртути разлагаются при нагревании до металла, диоксида азота и кислорода:
2AgNO3 → 2Ag + 2NO2 + O2
Hg(NO3)2 → Hg + 2NO2 + O2
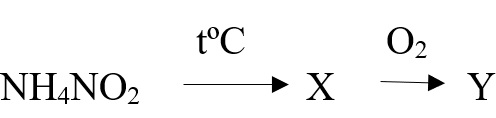
Нитрат аммония разлагается при небольшом нагревании до 270оС оксида азота (I) и воды:
NH4NO3 → N2O + 2H2O
При более высокой температуре образуются азот и кислород:
2NH4NO3 → 2N2 + O2 + 4H2O
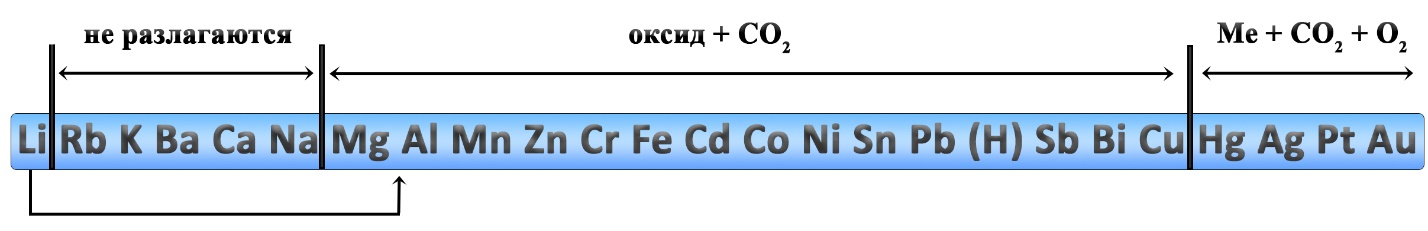
Разложение карбонатов и гидрокарбонатов
Карбонаты натрия и калия плавятся при нагревании.
Карбонаты лития, щелочноземельных металлов и магния разлагаются на оксид металла и углекислый газ:
Li2CO3 → Li2O + CO2
CaCO3 → CaO + CO2
MgCO3 → MgO + CO2
Карбонат аммония разлагается при 30оС на гидрокарбонат аммония и аммиак:
(NH4)2CO3 → NH4HCO3 + NH3
Гидрокарбонат аммония при дальнейшем нагревании разлагается на аммиак, углекислый газ и воду:
NH4HCO3 → NH3 + CO2 + H2O
Гидрокарбонаты натрия и калия при нагревании разлагаются на карбонаты, углекислый газ и воду:
2NaHCO3 → Na2CO3 + H2O + CO2
2KHCO3 → K2CO3 + H2O + CO2
Гидрокарбонат кальция при нагревании до 100оС разлагается на карбонат, углекислый газ и воду:
Ca(HCO3)2 → CaCO3 + H2O + CO2
При нагревании до 1200оС образуются оксиды:
Ca(HCO3)2 → CaO + H2O + 2CO2
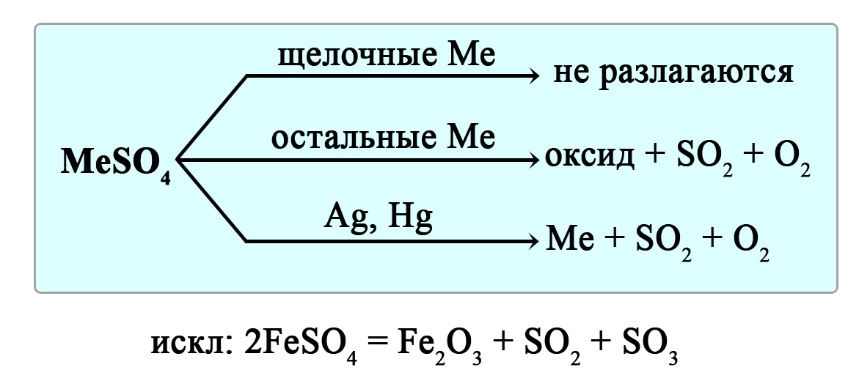
Разложение сульфатов
Сульфаты щелочных металлов при нагревании не разлагаются.
Сульфаты алюминия, щелочноземельных металлов, меди, железа и магния разлагаются до оксида металла, диоксида серы и кислорода:
2MgSO4 → 2MgO + 2SO2 + O2
2CuSO4 → 2CuO + 2SO2 + O2
2BaSO4 → 2BaO + 2SO2 + O2
2Al2(SO4)3 → 2Al2O3 + 6SO2 + 3O2
2Fe2(SO4)3 → 2Fe2O3 + 6SO2 + 3O2
Сульфаты серебра и ртути разлагаются до металла, диоксида серы и кислорода:
Ag2SO4 → 2Ag + SO2 + O2
2HgSO4 → 2Hg + 2SO2 + O2
Разложение фосфатов, гидрофосфатов и дигидрофосфатов
Эти реакции, скорее всего, в ЕГЭ по химии не встретятся! Гидрофосфаты щелочных и щелочноземельных металлов разлагаются до пирофосфатов:
2Na2HPO4 → H2O + Na4P2O7
2K2HPO4 → H2O + K4P2O7
2CaHPO4 → H2O + Ca2P2O7
Ортофосфаты при нагревании не разлагаются (кроме фосфата аммония).
Разложение сульфитов
Сульфиты щелочных металлов разлагаются до сульфидов и сульфатов:
4Na2SO3 → Na2S + 3Na2SO4
Разложение солей аммония
Некоторые соли аммония, не содержащие анионы кислот-сильных окислителей, обратимо разлагаются при нагревании без изменения степени окисления. Это хлорид, бромид, йодид, дигидрофосфат аммония:
NH4Cl → NH3 + HCl
NH4Br → NH3 + HBr
NH4l → NH3 + Hl
NH4H2PO4 → NH3 + H3PO4
Cоли аммония, образованные кислотами-окислителями, при нагревании также разлагаются. При этом протекает окислительно-восстановительная реакция. Это дихромат аммония, нитрат и нитрит аммония:
NH4NO3 → N2O + 2H2O
NH4NO2 → N2 + 2H2O
Видеоопыт разложения нитрита аммония можно посмотреть здесь.
(NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O
Разложение перманганата калия
2KMnO4 → K2MnO4 + MnO2 + O2
Разложение хлората и перхлората калия
Хлорат калия при нагревании разлагается до перхлората и хлорида:
4KClO3 → 3KClO4 + KCl
При нагревании в присутствии катализатора (оксид марганца (IV)) образуется хлорид калия и кислород:
2KClO3 → 2KCl + 3O2
Перхлорат калия при нагревании разлагается до хлорида и кислорода:
KClO4 → KCl + 2O2
Разложение веществ
Материал по химии
- Реакции разложения солей
- Разложение нитратов
- Особые реакции разложения нитратов
- Разложение солей аммония
- Разложение карбонатов
- Разложение гидрокарбонатов
- Разложение гидросульфитов
- Разложение сульфитов
- Разложение сульфатов
- Уравнения реакций разложения комплексных солей
- Реакция разложения дихромата калия и перманганата калия
- Разложение бертолетовой соли
- Разложение гидроксидов
- Разложение органических веществ
- Разложение кислот
Реакции разложения солей
Термическому разложению подвергаются многие соли – карбонаты, нитраты, нитриты, сульфаты, кислые, основные и комплексные соли. Рассмотрим наиболее популярные уравнения разложения солей. Разложение солей часто встречается в ЕГЭ по химии в линии заданий 31, это задание считается одним из самых сложных заданий экзамена.
Разложение нитратов
При установлении продуктов термического разложения нитратов удобно пользоваться рядом активности металлов, однако к нему следует добавить некоторые уточнения: литий и магний, обычно относятся к активным металлам, но разложение нитратов этих двух металлов происходит как у металлов средней активности. Медь относится к неактивным металлам, но разложение нитрата меди II идёт как разложение нитрата металла средней активности. Данные реакции являются весьма популярными в химии. На ЕГЭ задачи по разложению нитратов встречаются в заданиях линии 7 и 31.
Уравнения разложения нитратов активных металлов (кроме лития и магния):
- 2KNO3 → 2KNO2 + O2↑ ‒ разложение нитрата калия
- 2NaNO3 → 2NaNO2 + O2↑ ‒ разложение нитрата натрия
- 2CsNO3 → 2CsNO2 + O2↑ ‒ разложение нитрата цезия
- 2RbNO3 → 2RbNO2 + O2↑ ‒ разложение нитрата рубидия
- Ca(NO3)2 → Ca(NO2)2 + O2↑ ‒ разложение нитрата кальция
- Ba(NO3)2 → Ba(NO2)2 + O2↑ ‒ разложение нитрата бария
- Sr(NO3)2 → Sr(NO2)2 + O2↑ ‒ разложение нитрата стронция
Уравнения разложения нитратов металлов средней активности, нитрата лития и нитрата меди II:
- 4LiNO3 → 2Li2O + 4NO2↑ + O2↑ ‒ разложение нитрата лития
- 2Mg(NO3)2 → 2MgO + 4NO2↑ + O2↑ ‒ разложение нитрата магния
- 2Zn(NO3)2 → 2ZnO + 4NO2↑ + O2↑ ‒ разложение нитрата цинка
- 2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑ ‒ разложение нитрата меди II
- 4Al(NO3)3 → 2Al2O3 + 12NO2↑ + 3O2↑ ‒ разложение нитрата алюминия
- 4Fe(NO3)3 → 2Fe2O3 + 12NO2↑ + 3O2↑ ‒ разложение нитрата железа III
- 4Cr(NO3)3 → 2Cr2O3 + 12NO2↑ + 3O2↑ ‒ разложение нитрата хрома III
Во всех приведенных реакциях степень окисления металла не изменяется. Это характерно для нитратов, содержащих металл в высшей или наиболее устойчивой степени окисления. Если же нитрат образован переходным металлом в низшей степени окисления, то при разложении этого нитрата происходит окисление еще и металла.
Особые реакции разложения нитратов
Разложение нитрата железа II:
- 4Fe(NO3)2 → 2Fe2O3 + 8NO2↑ + O2↑
В данной реакции два восстановителя – железа поднимает степень окисления с +2 до +3, кислород с ‒2 до 0. Окислитель – азот +5.
Аналогично идет реакция термического разложения нитрата хрома II:
- 4Cr(NO3)2 → 2Cr2O3 + 8NO2↑ + O2↑
Разложение нитрата марганца II идет иначе, так как для марганца следующей после +2 устойчивой степенью окисления является не +3, а +4:
- Mn(NO3)2 → MnO2 + 2NO2↑
Обратите внимание на то, что кислород в этой реакции не выделяется!
Задание в формате ЕГЭ с ответом:
Установите соответствие между названием вещества и продуктами его разложения: к каждой позиции, обозначенной буквой подберите позицию, обозначенную цифрой.
- нитрат железа II
- нитрат меди II
- нитрат ртути II
- нитрат магния
- нитрат калия
- нитрат серебра
- MeNO2 + O2
- MeO + NO2 + O2
- Me + NO2 + O2
- Me2O3 + NO2 + O2
Пример задания из КИМ ЕГЭ:
Установите соответствие между формулой вещества и продуктами его разложения: к каждой позиции, обозначенной буквой подберите позицию, обозначенную цифрой.
- LiNO3
- Cu(NO3)2
- RbNO2
- Zn(NO3)2
- Hg(NO3)2
- Al(NO2)3
- MeNO2 + O2
- MeO + NO2 + O2
- Me + NO2 + O2
- Me2O + NO2 + O2
- Me2O3 + NO2 + O2
Разложение нитрата аммония будет рассмотрено ниже, в реакциях разложения солей аммония.
Разложение солей аммония
При разложении солей аммония чаще всего образуется аммиак, исключения составляют соли, в которых анион проявляет окислительные свойства. Например, хлорид, бромид, йодид, сульфиды, карбонаты и фосфаты разлагаются без изменения степеней окисления (без ОВР). Процессы идут при нагревании:
- NH4Cl → NH3↑ + HCl↑ ‒ разложение хлорида аммония
- NH4Br → NH3↑ + HBr↑ ‒ разложение бромида аммония
- NH4I → NH3↑ + HI↑ ‒ разложение йодида аммония
- (NH4)2S → 2NH3↑ + H2S↑ ‒ разложение сульфида аммония
- NH4HS → NH3↑ + H2S↑ ‒ разложение гидросульфида аммония
- (NH4)3PO4 → 3NH3↑ + H3PO4 ‒ разложение фосфата аммония
- (NH4)2HPO4 → 2NH3↑ + H3PO4 ‒ разложение гидрофосфата аммония
- NH4H2PO4 → NH3↑ + H3PO4 ‒ разложение дигидрофосфата аммония
- (NH4)2CO3 → 2NH3↑ + CO2↑ + H2O↑ ‒ разложение карбоната аммония
- NH4HCO3 → NH3↑ + CO2↑ + H2O↑ ‒ разложение гидрокарбоната аммония
Разложение солей аммония с изменением степени окисления:
Разложение нитрита и нитрата аммония легко запомнить вместе, отнимите от этих солей всю воду и получите нужный продукт:
- NH4NO3 → 2H2O + N2O ‒ разложение нитрата аммония
- NH4NO2 → 2H2O + N2 ‒ разложение нитрита аммония
Задание по образцу ФИПИ:
Задана следующая схема превращений веществ. Определите, какие из указанных веществ являются веществами X и Y. В ответ запишите соответствующую последовательность цифр без пробелов и дополнительных знаков, сначала вещество Х, затем вещество Y.
- NH3
- NO
- NH4NO3
- N2
- N2O
Азот окисляется до NO
Удобно запоминать вместе и разложение дихромата и перманганата аммония, так как образуются сходные продукты – азот, оксид и соль:
- (NH4)2Cr2O7 → N2↑ + Cr2O3 + 4H2O↑ ‒ разложение дихромата аммония
- 2NH4MnO4 → N2↑ + 2MnO2 + 4H2O↑ ‒ разложение перманганата аммония
Попробуйте решить задание ЕГЭ:
Установите соответствие между названием вещества и продуктами его разложения: к каждой позиции, обозначенной буквой подберите позицию, обозначенную цифрой.
- нитрит аммония
- нитрат аммония
- дихромат аммония
- хлорид аммония
- N2 + Cr2O3 + H2O
- NH3 + Cl2 + H2
- N2 + H2O
- NO2 + Cr2O3 + H2O
- NH3 + HCl
- N2O + H2O
Разложение карбонатов
Реакции разложения карбонатов также происходит при нагревании. Карбонаты щелочных металлов (IА-группа), кроме карбоната лития, не разлагаются. Большинство других карбонатов разлагаются до оксидов, карбонат серебра и карбонат ртути разлагаются с выделением свободного металла.
- Li2CO3 → Li2O + CO2↑ ‒ разложение карбоната лития
- MgCO3 → MgO + CO2↑ ‒ разложение карбоната магния
- CaCO3 → CaO + CO2↑ ‒ разложение карбоната кальция
- CuCO3 → CuO + CO2↑ ‒ разложение карбоната меди II
- 2HgCO3 → 2Hg + 2CO2↑ + O2↑ ‒ разложение карбоната ртути II
- 2Ag2CO3 → 4Ag + 2CO2↑ + O2↑ ‒ разложение карбоната серебра
Какие из перечисленных карбонатов разлагаются?
- Na2CO2
- MgCO3
- CaCO3
- K2CO3
- Cs2CO3
- CuCO3
При разложении каких карбонатов образуется оксид металла?
- Na2CO3
- HgCO3
- Li2CO3
- CaCO3
- Ag2CO3
- FeCO3
Разложение гидрокарбонатов
Гидрокарбонаты разлагаются до соответствующих карбонатов:
- 2NaHCO3 → Na2CO3 + CO2↑ + H2O↑ ‒ разложение гидрокарбоната натрия
- Ca(HCO3)2 → CaCO3 + CO2↑ + H2O↑ ‒ разложение гидрокарбоната кальция
При длительном нагревании происходит более глубокое разложение (это не качается гидрокарбонатов щелочных металлов, они в любом случае остаются карбонатами).
Например, в некоторых задачах может встретиться следующая фраза «гидрокарбонат нагревали до постоянной массы» или «смесь гидрокарбоната и карбоната нагревали до постоянной массы», какие реакции следует указать?
Если нагревают гидрокарбонат щелочного металла, то реакция одна:
- 2KHCO3 → K2CO3 + CO2↑ + H2O↑
Если нагревают другие гидрокарбонаты, то нужно писать две реакции:
- Ba(HCO3)2 → BaCO3 + CO2↑ + H2O↑ ‒ нагревание
- BaCO3 → BaO + CO2↑ ‒ при продолжении нагревания
Разложение гидросульфитов
Идет сходным с разложением гидрокарбонатов образом, при термическом размножении этих солеи образуются сульфиты и выделяется газ:
- 2KHSO3 → K2SO3 + SO2↑ + H2O↑ ‒ разложение гидросульфита калия
- Ba(HSO3)2 → BaSO3 + SO2↑ + H2O↑ ‒ разложение гидросульфита бария
Разложение сульфитов
В отличие от реакция термического разложения карбонатов, большинство сульфитов разлагаются при нагревании со сменой степени окисления (происходит реакция самоокисления-самовосстановления или диспропорционирования). При нагревании сульфита образуется смесь сульфидов и сульфатов:
- 4Na2SO3 → 3Na2SO4 + Na2S ‒ термическое разложение сульфита натрия
- 4CaSO3 → 3CaSO4 + CaS ‒ термическое разложение сульфита кальция
Разложение сульфатов
Сульфаты щелочных металлов не разлагаются при нагревании. Сульфаты серебра и ртути разлагаются до свободного металла, сульфаты остальных металлов разлагаются до оксида металла, сернистого газа и кислорода.
Уравнения реакция разложения сульфатов:
- 2CaSO4 → 2CaO + 2SO2↑ + O2↑ ‒ реакция разложения сульфата кальция
- Ag2SO4 → 2Ag + 2SO2↑ + O2↑ ‒ реакция разложения сульфата серебра
Уравнения реакций разложения комплексных солей
При нагревании комплексные соли теряют воду, превращаясь в средние соли, степени окисления при этом не изменяются:
- Na[Al(OH)4] → NaAlO2 + 2H2O↑ ‒ разложение тетрагидроксоалюмината натрия
- K2[Zn(OH)4] → K2ZnO2 + 2H2O↑ ‒ разложение тетрагидроксоцинката калия
- Ca[Be(OH)4] → CaBeO2 + 2H2O↑ ‒ разложение тетрагидроксобериллата кальция
- Ba[Al(OH)4]2 → Ba(AlO2)2 + 4H2O↑ ‒ разложение тетрагидроксоалюмината бария
Реакция разложения дихромата калия и перманганата калия
На ЕГЭ по химии реакции разложения дихромата калия и перманганата калия часто встречаются в заданиях линии 29 и 31.Эти две реакции похожи, поэтому их удобно запоминать сразу парой:
- 4K2Cr2O7 → 4K2CrO4 + 2Cr2O3 + 3O2↑ ‒ уравнение термического разложения дихромата калия
- 2KMnO4 → K2MnO4 + MnO2 + O2↑ ‒ уравнение термического разложение перманганата калия
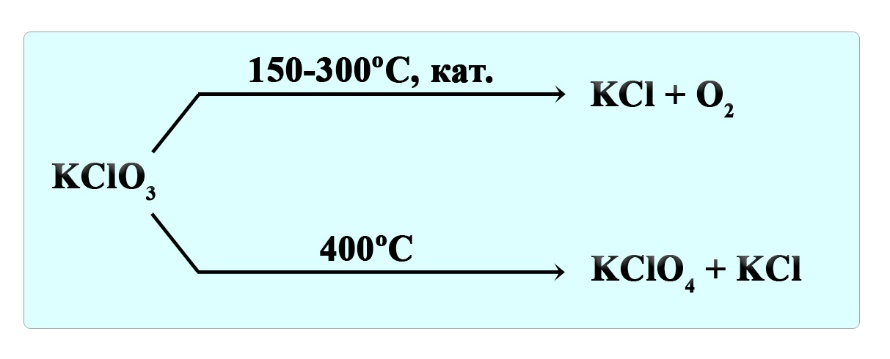
Разложение бертолетовой соли
Бертолетова соль или хлорат калия разлагается на разные продукты в зависимости от условий. При нагревании до 150-300ºС в присутствие катализатора образуется хлорид калия и кислород:
- 2KClO3 → 2KCl + 3O2↑
Сходным образом разлагается перхлорат калия:
- KClO4 → KCl + 2O2↑
При температуре 400ºС бертолетова соль разлагается на перхлорат калия и хлорид калия:
- 4KClO3 → 3KClO4 + KCl
Флэш-карточки с разложением солей. Перед Вами лицевая сторона карточки с формулой соли, попробуйте вспомнить основные продукты разложения этой соли и нажмите на карточку, чтобы проверить реакцию:
-
-
(NH4)2Cr2O7
N2 + Cr2O3 + H2O
-
K2Cr2O7
K2CrO4 + Cr2O3 + O2
-
-
-
-
-
-
KClO3 (400 градусов)
KClO4 + KCl
-
Разложение гидроксидов
Еще одна популярная тема в разложении веществ – термическое разложение гидроксидов. Большинство нерастворимых гидроксидов неустойчивы, разлагаются на оксид и воду. При этом степень окисления металла не меняется. Растворимые гидроксиды (щелочи) не разлагаются, за исключением неустойчивого гидроксида аммония (который не является щелочью).
- 2Al(OH)3 → Al2O3 + 3H2O ‒ разложение гидроксида алюминия
- Zn(OH)2 → ZnO + H2O ‒ разложение гидроксида цинка
- Cu(OH)2 → CuO + H2O ‒ разложение гидроксида меди II
- 2Fe(OH)3 → Fe2O3 + 3H2O ‒ разложение гидроксида железа III
- NH4OH → NH3↑ + H2O или NH3·H2O → NH3↑ + H2O ‒ разложение гидроксида аммония
Разложение органических веществ
Сходным образом происходит и разложение органических веществ – гидроксидов метиламмония, диметиламмония, триметиламмония и некоторых других.
- [CH3-NH3]OH → CH3-NH2↑ + H2O ‒ разложение гидроксида метиламмония
- [(CH3)2-NH2]OH → (CH3)2-NH↑ + H2O ‒ разложение гидроксида диметиламмония
- [(CH3)3-NH]OH → (CH3)3-N↑ + H2O ‒ разложение гидроксида триметиламмония
Разложение кислот
Неустойчивыми кислотами являются угольная, сернистая кислота и азотистая кислота, они разлагаются даже при небольшом нагревании:
- H2CO3 → CO2↑ + H2O ‒ разложение угольной кислоты
- H2SO3 → SO2↑ + H2O ‒ разложение сернистой кислоты
- 2HNO2 → NO↑ + NO2↑ + H2O ‒ разложение азотистой кислоты без нагревания
- 3HNO2 → HNO3 + 2NO↑ + H2O – разложение азотистой кислоты при нагревании
Разложение остальных кислот требует нагревания:
- 4HNO3 → 4NO2 + O2↑ + 2H2O ‒ разложение азотной кислоты
- H2SiO3 → SiO2 + H2O – разложение кремниевой кислоты
Разложение неорганических веществ при нагревании
1.Разложение оксидов.
При нагревании разлагаются оксиды тяжелых металлов:
2Ag2O = 4Ag + O2
2HgO = 2Hg + O2
4CrO3 = 2Cr2O3 + O2
2Mn2O7 = 4MnO2 + 3O2
2.Разложение гидроксидов металлов.
Как правило, при нагревании разлагаются нерастворимые гидроксиды. Исключением является гидроксид лития, он растворим, но при нагревании в твердом виде разлагается на оксид и воду:
2LiOH = Li2O + H2O
Гидроксиды других щелочных металлов при нагревании не разлагаются.
Гидроксиды серебра (I) и меди (I) неустойчивы:
2AgOH = Ag2O + H2O
2CuOH = Cu2O + H2O
Гидроксиды большинства металлов при нагревании разлагаются на оксид и воду.
В инертной атмосфере (в отсутствии кислорода воздуха) гидроксиды хрома (III) марганца (II) и железа (II) распадаются на оксид и воду:
2Cr(OH)3 = Cr2O3 + 3H2O
Mn(OH)2 = MnO + H2O
Fe(OH)2 = FeO + H2O
Большинство остальных нерастворимых гидроксидов металлов также при нагревании разлагаются:
2Fe(OH)3 = Fe2O3 + 3H2O
2Al(OH)3 = Al2O3 + 3H2O
3.Разложение кислот
При нагревании разлагаются нерастворимые кислоты.
Например, кремниевая кислота:
H2SiO3 = H2O + SiO2
Некоторые кислоты неустойчивы и подвергаются разложению в момент образования. Большая часть молекул сернистой кислоты и угольной кислоты распадаются на оксид и воду в момент образования:
H2SO3 = H2O + SO2↑
H2CO3 = H2O + CO2↑
В ЕГЭ по химии эти кислоты стоит записывать в виде оксида и воды.
Например, при действии водного раствора углекислого газа на карбонат калия в качестве реагента мы указываем не угольную кислоту, а оксид углерода (IV) и воду, но подразумеваем угольную кислоту при этом:
K2CO3 + H2O + CO2 = 2KHCO3
Азотистая кислота на холоде или при комнатной температуре частично распадается уже в водном растворе, реакция протекает обратимо:
2HNO2 = H2O + NO2↑ + NO↑
При нагревании выше 100оС продукты распада несколько отличаются:
3HNO2 = H2O + HNO3↑ + 2NO↑
Азотная кислота под действием света или при нагревании частично обратимо разлагается:
4HNO3 = 2H2O + 4NO2 + O2
4.Разложение солей
Разложение хлоридов
Хлориды щелочных, щелочноземельных металлов, магния, цинка, алюминия и хрома при нагревании не разлагаются.
Хлорид серебра (I) разлагается под действием света:
2AgCl → Ag + Cl2
Хлорид аммония при нагревании выше 340оС разлагается:
NH4Cl → NH3 + HCl
Разложение нитратов
Нитраты щелочных металлов при нагревании разлагаются до нитрита металла и кислорода.
Например, разложение нитрата калия:
2KNO3 → 2KNO2 + O2
Нитраты магния, стронция, кальция и бария разлагаются до нитрита и кислорода при нагревании до 500оС:
Ca(NO3)2 → Ca(NO2)2 + O2
Mg(NO3)2 → Mg(NO2)2 + O2
Ba(NO3)2 → Ba(NO2)2 + O2
Sr(NO3)2 → Sr(NO2)2 + O2
При более сильном нагревании (выше 500оС) нитраты магния, стронция, кальция и бария разлагаются до оксида металла, оксида азота (IV) и кислорода:
2Ca(NO3)2 → 2CaО + 4NO2 + O2
2Mg(NO3)2 → 2MgО + 4NO2 + O2
2Sr(NO3)2 → 2SrО + 4NO2 + O2
2Ba(NO3)2 → 2BaО + 4NO2 + O2
Нитраты металлов, расположенных в ряду напряжений после магния и до меди (включительно) + нитрат лития разлагаются при нагревании до оксида металла, диоксида азота и кислорода:
2Cu(NO3)2 → 2CuО + 4NO2 + O2
2Pb(NO3)2 → 2PbО + 4NO2 + O2
4Al(NO3)3 → 2Al2O3 + 12NO2 + 3O2
4LiNO3 → 2Li2O + 4NO2 + O2
Нитраты серебра и ртути разлагаются при нагревании до оксида металла, диоксида азота и кислорода:
2AgNO3 → 2Ag + 2NO2 + O2
Hg(NO3)2 → Hg + 2NO2 + O2
Нитрат аммония разлагается при небольшом нагревании до 270оС оксида азота (I) и воды:
NH4NO3 → N2O + 2H2O
При более высокой температуре образуются азот и кислород:
2NH4NO3 → 2N2 + O2 + 4H2O
Разложение карбонатов и гидрокарбонатов
Карбонаты натрия и калия плавятся при нагревании. Но, могут при 10000 С разлагаться на оксид металла и углекислый газ:
Карбонаты лития, щелочноземельных металлов и магния разлагаются на оксид металла и углекислый газ:
Li2CO3 → Li2O + CO2
CaCO3 → CaO + CO2
MgCO3 → MgO + CO2
Карбонат аммония разлагается при 30оС на гидрокарбонат аммония и аммиак:
(NH4)2CO3 → NH4HCO3 + NH3
Гидрокарбонат аммония при дальнейшем нагревании разлагается на аммиак, углекислый газ и воду:
NH4HCO3 → NH3 + CO2 + H2O
Гидрокарбонаты натрия и калия при нагревании разлагаются на карбонаты, углекислый газ и воду:
2NaHCO3 → Na2CO3 + H2O + CO2
2KHCO3 → K2CO3 + H2O + CO2
Гидрокарбонат кальция при нагревании до 100оС разлагается на карбонат, углекислый газ и воду:
Ca(HCO3)2 → CaCO3 + H2O + CO2
При нагревании до 1200оС образуются оксиды:
Ca(HCO3)2 → CaO + H2O + 2CO2
Разложение сульфатов
Сульфаты щелочных металлов при нагревании не разлагаются.
Сульфаты алюминия, щелочноземельных металлов, меди, железа и магния разлагаются до оксида металла, диоксида серы и кислорода:
2MgSO4 → 2MgO + 2SO2 + O2
2CuSO4 → 2CuO + 2SO2 + O2
2BaSO4 → 2BaO + 2SO2 + O2
2Al2(SO4)3 → 2Al2O3 + 6SO2 + 3O2
2Fe2(SO4)3 → 2Fe2O3 + 6SO2 + 3O2
Сульфаты серебра и ртути разлагаются до металла, диоксида серы и кислорода:
Ag2SO4 → 2Ag + SO2 + O2
2HgSO4 → 2Hg + 2SO2 + O2
Разложение фосфатов, гидрофосфатов и дигидрофосфатов
Гидрофосфаты щелочных и щелочноземельных металлов разлагаются до пирофосфатов:
2Na2HPO4 → H2O + Na4P2O7
2K2HPO4 → H2O + K4P2O7
2CaHPO4 → H2O + Ca2P2O7
Ортофосфаты при нагревании не разлагаются (кроме фосфата аммония).
Разложение сульфитов
Сульфиты щелочных металлов разлагаются до сульфидов и сульфатов:
4Na2SO3 → Na2S + 3Na2SO4
Разложение солей аммония
Некоторые соли аммония, не содержащие анионы кислот-сильных окислителей, обратимо разлагаются при нагревании без изменения степени окисления. Это хлорид, бромид, йодид, дигидрофосфат аммония:
NH4Cl → NH3 + HCl
NH4Br → NH3 + HBr
NH4l → NH3 + Hl
NH4H2PO4 → NH3 + H3PO4
Cоли аммония, образованные кислотами-окислителями, при нагревании также разлагаются. При этом протекает окислительно-восстановительная реакция. Это дихромат аммония, нитрат и нитрит аммония:
NH4NO3 → N2O + 2H2O
NH4NO2 → N2 + 2H2O
(NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O «Вулкан» — Разложение дихромата аммония
Разложение перманганата калия
2KMnO4 → K2MnO4 + MnO2 + O2
Разложение хлората и перхлората калия
Хлорат калия при нагревании разлагается до перхлората и хлорида:
4KClO3 → 3KClO4 + KCl
При нагревании в присутствии катализатора (оксид марганца (IV)) образуется хлорид калия и кислород:
2KClO3 → 2KCl + 3O2
Перхлорат калия при нагревании разлагается до хлорида и кислорода:
KClO4 → KCl + 2O2
Разлагаются некоторые комплексные соли:
Na[Al(OH)4] = NaAlO2 + 2Н2O
[Cu(NH3)4]Cl2 = CuCl2 + 4NH3↑
Разлагаются кристаллогидраты:
CuSO4·5Н2O = CuSO4 + 5Н2O↑
Соли карбоновых кислот (Ва, Са) разлагаются до карбонатов и кетонов:
(СН3ОО)2Са= СН3СОСН3 + СаСО3
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
- Соединения
- Разложения
- Замещения
- Обмена
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно
сложное вещество. Примеры:
4Na + O2 = 2Na2O
P2O5 + 3H2O = 2H3PO4
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
2KMnO4 = K2MnO4 + MnO2 + 2O2
Сa(OH)2 = CaO + H2O
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
CuSO4 + Fe = FeSO4 + Cu
2KI + Cl2 = 2KCl + I2
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами.
Часто обмен происходит анионами/катионами:
2KOH + MgCl2 = Mg(OH)2↓ + 2KCl
AgF + NaCl = AgCl↓ + NaF
Реакция нейтрализации — реакция обмена между основанием и кислотой, в ходе которой получаются соль и вода:
KOH + H2SO4 = K2SO4 + H2O

Окислительно-восстановительные реакции (ОВР)
Это те химические реакции, в процессе которых происходит изменение степеней окисления химических элементов, входящих в состав
исходных веществ. ОВР подразделяются на:
- Межмолекулярные — атомы окислителя и восстановителя входят в состав разных молекул. Примеры:
- Внутримолекулярные — атомы окислителя и восстановителя в составе одного сложного вещества. Примеры:
- Диспропорционирование — один и тот же атом является и окислителем, и восстановителем
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
K2SO3 + K2Cr2O7 + H2SO4 → K2SO4
+ Cr2(SO4)3 + H2O
KMnO4 → K2MnO4 + MnO2 + O2
KClO3 → KCl + O2
KOH + Cl2 → (t) KCl + KClO3 + H2O
KOH + Cl2 → KCl + KClO + H2O

Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО,
принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
От обилия информации можно запутаться. Я рекомендую сформулировать четко: «Окислитель — понижает СО, восстановитель — повышает СО». Запомнив
эту информацию таким образом, вы не будете путаться.

ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Обратимые реакции — такие химические реакции, которые протекают одновременно в двух противоположных направлениях: прямом и обратном.
При записи реакции в таких случаях вместо знака «=» ставят знак обратимости «⇆».
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
N2 + 3H2 ⇆ 2NH3
CH3COOH + C2H5OH ⇆ CH3COOC2H5 + H2O
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от
обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Иногда сложно бывает отличить обратимую реакцию от необратимой, однако я дам несколько советов, которые советую взять на вооружение.
В результате необратимых реакций:
- Образуются малодиссоциирующие вещества (например — вода, однако есть исключения — реакция этерификации)
- Реакция сопровождается выделение большого количества тепла
- В ходе реакции образуется газ или выпадает осадок
Примеры необратимых реакций:
BaCl2 + H2SO4 = BaSO4↓ + 2HCl (выпадает осадок)
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)

Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому
составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой,
твердой и газообразной.
Все реакции можно разделить на гетеро- и гомогенные. Гетерогенные реакции (греч. heterogenes — разнородный) — реакции, протекающие на
границе раздела фаз, в неоднородной среде. Скорость таких реакций зависит от площади соприкосновения реагирующих веществ.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество,
твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
Zn(тв.) + 2HCl(р-р.) = ZnCl2(р-р.) + H2(газ.)↑

Гомогенные реакции (греч. homogenes — однородный) — реакции, протекающие между веществами, находящимися в одной фазе.
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером
такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
NaOH(р-р.) + CH3COOH(р-р.) = CH3COONa(р-р.) + H2O(р-р.)

Реакции и их тепловой эффект
Все реакции можно разделить на те, в ходе которых тепло поглощается, или, наоборот, тепло выделяется. Представьте пробирку, охлаждающуюся
или нагревающуюся в вашей руке — это и есть тот самый тепловой эффект. Иногда тепла выделяется так много, что реакции сопровождаются
воспламенением или взрывом (натрий с водой).
- Экзотермические реакции
- Эндотермические реакции
Экзотермические реакции (греч. exo — вне) — химические реакции, сопровождающиеся потерей энергии системой и выделением тепла (той самой
энергии) во внешнюю среду. При написании химических реакций в конце экзотермических ставят «+ Q» (Q — тепло), иногда бывает указано точное
количество выделяющегося тепла. Например:
2Mg + O2 = 2MgO + Q
Большинство реакций нейтрализации относятся к экзотермическим:
NaOH + HCl = NaCl + H2O + 56 кДж

К экзотермическим реакциям часто относятся реакции горения, соединения.
4NH3 + 5O2 = 4NO + 6H2O + Q
Исключением является взаимодействие азота и кислорода, при
котором тепло поглощается:
N2 + O2 ⇄ 2NO — Q
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому
не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания»
в реакции вместо явного +Q при экзотермической реакции могут написать ΔH < 0. Например:
2Na + 2H2O = 2NaOH + H2; ΔH < 0 (это значит, что тепло выделяется — реакция экзотермическая)

Эндотермические реакции (греч. ἔνδον — внутри) — химические реакции, сопровождающиеся поглощением тепла, в результате которых образуются
вещества с более высоким энергетическим уровнем (их внутренняя энергия увеличивается).
К таким реакциям наиболее часто относятся реакции разложения. При написании эндотермических реакций в конце ставят «-Q», либо указывают точное
количество поглощенной энергии. Примеры таких реакций:
2HgO = Hg + O2 — Q
CaCO3 = CaO + CO2↑ — Q
С целью «запутывания» может быть дана энтальпия, она при таких реакциях всегда: ΔH > 0, так как внутренняя
энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)

Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик»)
является примером экзотермического разложения, при котором тепло выделяется.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
1.4.1. Классификация химических реакций в неорганической и органической химии.
Классификация химических реакций на основании их признаков.
Классификационный признак |
Тип реакции |
Число и состав реагентов и продуктов |
соединенияв результате таких реакций из двух или более исходных веществ образуется только один продукт, например: С + O2 = CO2 4NO2 + O2 + 2H2O = 4HNO3 |
разложенияв таких реакциях из одного вещества образуется два или больше других веществ: 2KMnO4 = K2MnO4 + MnO2 + O2 CaCO3 = CaO + CO2 |
|
замещенияВсе реакции, в результате которых из простого и сложного веществ образуется другое простое и другое сложное вещества. Например: Zn + CuSO4 = ZnSO4 + Cu
|
|
обменаРеакциями обмена называют такие реакции, в результате которых вещества меняются своими составными частями. Например: 2NaOH + CuCl2 = 2NaCl + Cu(OH)2 Частный случай реакции обмена между кислотой и основанием носит также название реакции нейтрализации: NaOH + HCl = NaCl + H2O
|
|
Изменение степеней окисления химических элементов |
окислительно-восстановительныев результате таких реакций изменяются степени окисления одного или более химических элемента. Например: |
Реакции, протекающие с сохранением степеней окисления атомов всех химических элементов |
|
Обратимость |
обратимыетакие реакции обладают способностью протекать как в прямом, так и обратном направлении. Реакции, про которые обязательно нужно знать, что они обратимые: |
необратимыеТакие реакции протекают только в прямом направлении. Если речь идет о реакциях между электролитами, то необратимой реакция является в том случае, если образуется осадок, газ или малодиссоциирующее вещество. Например: Na2CO3 + 2HCl = 2NaCl + H2O + CO2 В качестве малодиссоциирующих веществ в реакциях ионного обмена могут образоваться вода, слабые кислоты, гидроксид аммония. |
|
Тепловой эффект |
экзотермическиеВ результате таких реакций выделяется энергия в виде теплоты. Обозначают такие реакции, добавляя «+Q» к уравнению реакции, например: |
эндотермическиеПри протекании таких реакций поглощается тепло. Для обозначения таких реакций пишут «-Q» в уравнении реакции. Практически все реакции разложения являются эндотермическими: Исключения: реакции разложения HI и NO являются экзотермическими. |
|
Количество фаз |
гомогенныеГомогенными реакциями называют такие реакции, реагенты в которых находятся в одной фазе. Примерами таких реакций могут быть многие реакции протекающие в растворах, реакции между газообразными веществами: NaOH (р-р) + HCl(р-р) = NaCl + H2O 2CO + O2 = 2CO2 В гомогенных реакциях не наблюдаются границы раздела между реагентами |
гетерогенныегетерогенными реакциями называют такие реакции, в которых реагирующие вещества находятся в разных фазах. Примерами таких реакций являются, взаимодействие цинка с раствором соляной кислоты, взаимодействие углекислого газа с известковой водой, и т.д.: |
|
По участию катализатора |
каталитическиереакции, протекающие в присутствии катализатора:
|
некаталитическиереакции, протекающие без катализатора: |
Классификация химических реакций в органической химии:
Реакции присоединения |
В зависимости от того, какое соединение присоединяется органическим веществом различают:
Гидрирование — присоединение водорода:Гидратация — присоединение воды:Гидрогалогенирование — присоединение галогеноводорода:
|
Реакции замещения |
Под реакциями замещения в органической химии подразумевают такие реакции, в результате протекания которых происходит замена одного заместителя (или атома водорода) непосредственно прикрепленного к углеродному скелету на другой заместитель. Так, например, реакциями замещения являются: Галогенирование алканов:Нитрование углеводородов:Реакция спиртов с галогеноводородными кислотами:C2H5OH + HBr = C2H5Br + H2O и т.д. |
Реакции отщепления (элиминирования) |
Все реакции, в названии которых присутствует приставка «де-«: дегидрирование:дегидратация:дегидрогалогенирование:(от исходной молекулы бромэтана отщепляется бромоводород, который нейтрализуется щелочью) дегалогенирование:Также к реакциям отщепления (элиминирования) относят крекинг — процесс термического превращения углеводородов в соединения с меньшей длинной углеродного скелета. Например, крекинг алканов, уравнение которого в общем виде можно записать как: |
Окислительно-восстановительные реакции |
Реакции, при которых изменяется степень окисления одного или нескольких атомов углерода углеродного скелета. Окисление органического соединенияВ таких реакциях отдельные атомы углерода повышают свою степень окисления. Например: Восстановление органического соединенияЧаще всего под восстановлением органических веществ понимают их взаимодействие с водородом. Например: CH3-CH=O + H2 => CH3-CH2-OH |
Реакции с сохранением качественного и количественного состава веществ |
Изомеризация |
Реакции протекающие по тем или иным механизмам |
Реакции протекающие по ионному механизмуВ таких реакциях активными действующими частицами являются ионы. Следует помнить, что по ионному механизму протекают такие реакции как:
|
Реакции протекающие по радикальному механизмуВ таких реакциях активными действующими частицами являются свободные радикалы:
|
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.