Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Состав комплексных соединений
Номенклатура комплексных соединений
Реакции образования комплексных соединений
Реакции разрушения комплексных соединений
Диссоциация комплексных соединений
Примеры решения задач
Задачи для самостоятельного решения
Состав комплексных соединений
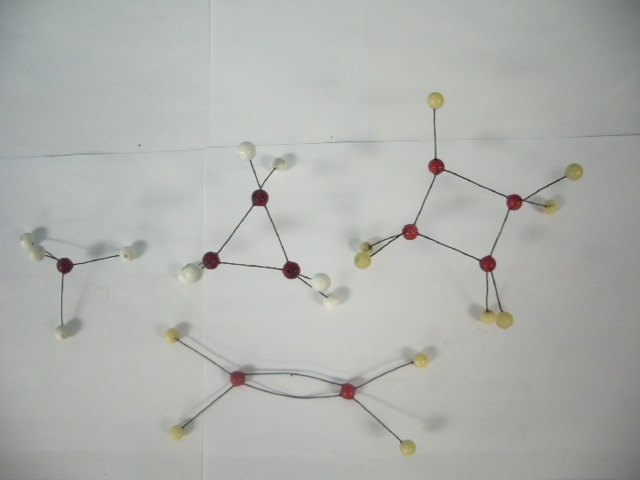
Рис. 1. Состав комплексного соединения
Комплексное соединение, рисунок 1, состоит из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды, называется комплексообразователем. Число лигандов комплексообразователя называется координационным числом.
Номенклатура комплексных соединений
Комплексное соединение может состоять из комплексного катиона, комплексного аниона или может быть нейтральным.
Соединения с комплексными катионами. Вначале называют внешнесферный анион, затем перечисляют лиганды, затем называют комплексообразователь в родительном падеже (ему дается русское название данного элемента). После названия комплексообразователя в скобках римской цифрой указывается его степень окисления.
К латинскому названию анионного лиганда добавляется окончание “о” (F— — фторо, Cl— -хлоро, ОН— — гидроксо, CN— — циано и т.д). Аммиак обозначают термином “аммин”, СО – карбонил, NO – нитрозил, H2O – аква.
Число одинаковых лигандов называют греческим числительным: 2 –ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта и т.д.
[Cu(NH3)4]SO4 – сульфат тетраамминмеди (II),
[Ni(H2O)6]Cl2 – хлорид гексаакваникеля (II).
Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные. Например,
[Pt(NH3)5Cl]Cl3 – хлорид хлоропентаамминплатины (IV) .
Если в комплексе имеются несколько лигандов одинакового знака заряда, то они называются в алфавитном порядке:
[CoCl2(H2O)(NH3)3]Cl – хлорид дихлороакватриамминкобальта (III).
Соединения с комплексными анионами. Вначале называют комплексный анион в именительном падеже: перечисляют лиганды, затем комплексообразователь (ему дается латинское название и к названию добавляется окончание “ат”). После названия комплексообразователя указывается его степень окисления. Затем в родительном падеже называется внешнесферный катион.
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия;
K4[Fe(CN)6] – гексацианоферрат (II) калия;
K2[СuCl4] – тетрахлорокупрат (II) калия.
Соединения без внешней сферы. Вначале называют лиганды, затем комплексообразователь в именительном падеже с указанием его степени окисления. Все название пишется слитно.
[Ni(CО)4] – тетракарбонилникель (0);
[Pt(NH3)2Cl4] – тетрахлородиамминплатина (IV).
Реакции образования комплексных соединений
Комплексные соединения обычно получают действием избытка лигандов на содержащее комплексообразователь соединение. Координационное число, как правило, в 2 раза больше степени окисления комплексообразователя. Из этого правила бывают, однако, исключения.
Образование гидроксокомплексов.
AlCl3 + 6NaOH(изб) = Na3[Al(OH)6] + 3NaCl
AlCl3 + 4NaOH(изб) = Na[Al(OH)4] + 3NaCl
ZnSO4 + 4NaOH(изб) = Na2[Zn(OH)4] + Na2SO4
Образование комплексных солей.
Если комплексообразователем является Fe2+ или Fe3+, то координационные числа в обоих случаях равны шести:
FeCl2 + 6KCN(изб) = K4[Fe(CN)6] + 2KCl
Fe2(SO4)3 + 12KCN(изб) = 2 K3[Fe(CN)6] + 3K2SO4
Координационные числа ртути и меди, как правило, равны четырем:
Hg(NO3)2 + 4KI(изб) = K2[HgI4] + 2KNO3
CuCl2 + 4NH3(изб) = [Cu(NH3)4]Cl2
Для большинства аква- и амминных комплексов ионов d-элементов координационное число равно шести:
NiCl2 + 6NH3 (изб) = [Ni(NH3)6]Cl2
Реакции разрушения комплексных соединений
Разрушение комплексных соединений происходит в результате:
-
-
- образования малорастворимого соединения с комплексообразователем:
-
[Cu(NH3)4]SO4 + Na2S = CuS↓ + 4NH3↑ + Na2SO4
-
-
- образования более прочного комплексного соединения с комплексообразователем или с лигандом:
-
[Cu(NH3)4]SO4 + 4KCN(изб) = K2[Cu(CN)4] + 4NH3↑ + K2SO4
[Cu(NH3)4]SO4 + 4HCl = 4NH4Cl + CuSO4
-
-
- образования малодиссоциированного электролита:
-
Na2[Zn(OH)4] + 4HCl(изб) = 2NaCl + ZnCl2 + 4H2O
-
-
- действия любой сильной кислоты на гидрокомплексы; в этом случае образуется соль и вода:
-
К3[Al(OH)6] + 6HCl(изб) = 3KCl + AlCl3 + 6H2O
-
-
- нагревания некоторых комплексных соединений:
-
[Cu(NH3)4]SO4 → CuSO4 + 4NH3↑
Na[Al(OH)4] → NaAlO2 + 2H2O
-
-
- окислительно-восстановительных реакций:
-
2Na[Ag(CN)2] + Zn = Na2[Zn(CN)4] + 2Ag
6K4[Fe(CN)6] +K2Cr2O7 +7H2SO4=6K3[Fe(CN)6] +Cr2(SO4)3 +4K2SO4 +7H2O
Диссоциация комплексных соединений
Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы. В то же время комплексный ион диссоциирует в незначительной степени как ассоциированный электролит. Количественной характеристикой диссоциации внутренней сферы в растворе является константа нестойкости, представляющая собой константу равновесия процесса диссоциации комплексного иона.
Например, в растворе комплексное соединение [Ni(NH3)6]SO4 диссоциирует следующим образом:
[Ni(NH3)6]SO4 = [Ni(NH3)6]2+ + SO42-
Для комплексного иона [Ni(NH3)6]2+, диссоциирующего по уравнению
[Ni(NH3)6]2+ → Ni2+ + 6NH3
константа равновесия процесса диссоциации носит название константы нестойкости Кн. Для рассматриваемого процесса Кн равна
Кн = [Ni2+]·[NH3]6 / [[Ni(NH3)6]2+] (1)
Величина, обратная Кн, называется константой устойчивости:
Ку = 1/Кн (2)
Она представляет собой константу равновесия процесса образования комплексного иона:
Ni2+ + 6NH3 ↔ [Ni(NH3)6]2+
Константа нестойкости Кн связана с изменением энергии Гиббса процесса диссоциации комплекса уравнением:
ΔGTо = — RTln Кн (3)
Примеры решения задач:
Задача 1. Вычислите:
1) Концентрацию ионов NO3— в 0,01 М растворе [Ag(NH3)2]NO3.
2) Концентрацию Ag+ в 0,01 М растворе [Ag(NH3)2]NO3, содержащем 2 моль/л избыточного аммиака,
если Кн[Ag(NH3)2]+ = 5,7× 10— 8 при 298 К.
3) Величину ΔGo298 процесса диссоциации комплексного иона.
Решение:
1)
[Ag(NH3)2]NO3 = [Ag(NH3)2]+ + NO3—
[NO3— ] = 0,01М, поскольку комплекс диссоциирует как сильный электролит на комплексный ион и ионы внешней сферы.
2) Комплексный ион диссоциирует незначительно:
[Ag(NH3)2]+ → Ag+ + 2NH3
Положение равновесия комплексного иона в присутствии избытка NH3 еще больше смещено влево.
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Ag+ и 2x моль/л аммиака. Суммарная концентрация аммиака равна (2x+2) моль/л. Концентрация недиссоциированного комплексного иона [Ag(NH3)2]+ составляет: (0,01–x) моль/л.
Концентрация аммиака, связанная с диссоциацией комплексного иона, ничтожно мала по сравнению с избытком аммиака. Доля комплексного иона, подвергшегося диссоциации, также ничтожно мала. Значит,
x = 1,43× 10— 10
Следовательно, [Ag+] = 1,43× 10— 10 моль/л.
Константа нестойкости связана с изменением энергии Гиббса процесса диссоциации [Ag(NH3)2]+ уравнением:
ΔGоT = — RTln Кн .
Значит, при Т = 298 К получаем:
ΔGо298 = — 8,314× 298× ln5,7× 10— 8 = 41326 Дж = 413,3 кДж.
Задача 2. Произойдет ли осаждение AgCl при сливании 0,01М раствора [Ag(NH3)2]NO3, содержащего 2 моль/л избыточного NH3, с равным объемом 0,5М раствора KCl, если при 298 К ПР(AgCl) = 1,73× 10— 10, Кн.[Ag(NH3)2]+ = 5,7× 10— 8.
Решение. Осадок выпадет при условии: [Ag+][Сl— ] > ПР(AgCl), т.е. если произведение концентраций ионов Ag+ и Сl— в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
После смешения равных объемов растворов концентрации [Ag(NH3)2]NO3, NH3 и KCl уменьшатся в 2 раза и станут равными 5× 10-3, 1 и 0,25 М соответственно.
Найдем концентрацию [Ag+] тем же способом, что и в предыдущей задаче,
откуда x = 2,85× 10— 10.
Значит, [Ag+] = 2,85× 10— 10 моль/л, а [Сl— ] = 0,25 моль/л.
Следовательно, произведение концентраций ионов равно:
[Ag+][Сl— ] = 2,85× 10— 10× 0,25 = 7,1× 10— 11(моль/л)2.
Поскольку [Ag+][Сl— ] = 7,1× 10— 11 < 1,73× 10— 10, то осадок не выпадет.
Задача 3. При какой концентрации ионов S2- начнется выпадение осадка CdS из 0,6М раствора Na2[Cd(CN)4], содержащего 0,04 моль/л избыточного NaCN, если ПР(CdS) = 7,9× 10— 27, Кн[Cd(CN)4]2- = 7,8× 10— 18.
Решение. Осадок выпадет при условии: [Cd2+][S2- ] > ПР(CdS), т.е. если произведение концентраций ионов Cd2+ и S2- в растворе будет больше ПР. Следовательно, выпадение осадка начнется при [S2-] > ПР(CdS):[Cd2+].
Na2[Cd(CN)4] = [Cd(CN)4]2- + 2Na+
Комплексный ион диссоциирует незначительно:
[Cd(CN)4]2- → Cd2+ + 4CN—
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Cd2+ и 4x моль/л ионов CN— . Суммарная концентрация ионов CN— равна (4x + 0,04) моль/л. Концентрация недиссоциированного комплексного иона [Cd(CN)4]2- составляет: (0,6 – x) моль/л.
Кн[Cd(CN)4]2- = [Cd2+ ] · [CN—]4/ [[Cd(CN)4]2-]
x = 1,8·10— 12 .
Следовательно, [Cd2+] = 1,8·10— 12 моль/л.
Выпадение осадка начнется при [S2- ] > 7,9·10— 27: 1,8·10— 12 > 4,39·10— 15 моль/л.
Задачи для самостоятельного решения
1. Назовите следующие комплексные соединения:
Na2[Pt(CN)4Cl2],
[Cu(NH3)4](NO3)2,
[Cu(H2O)4]SO4
|
Na2[Pt(CN)4Cl2] – дихлоротетрацианоплатинат (IV) натрия; [Cu(NH3)4](NO3)2 – нитрат тетраамминмеди (II); [Cu(H2O)4]SO4 – сульфат тетрааквамеди (II); |
2. Назовите следующие комплексные соединения
[Co(H2O)3Cl3],
[Ni(NH3)6][PtCl4].
|
[Co(H2O)3Cl3] – трихлоротриаквакобальт (III); [Ni(NH3)6][PtCl4] – тетрахлороплатинат (II) гексаамминникеля (II). |
3. Составьте уравнение химической реакции:
Cr2(SO4)3 + NaOH (изб.)→
4. Составьте уравнение химической реакции:
Cd(NO3)2 + Na2SO3 (изб.)→
5. Составьте уравнение химической реакции:
[Ag(NH3)2]NO3 + Na2S →
6. Составьте уравнение химической реакции:
[Ag(NH3)2]NO3 -t→
7. Составьте уравнение химической реакции:
K4[Fe(CN)6] + Н2O2 + H2SO4 →
8. Сколько граммов серебра содержится в виде ионов в 0,04М растворе K[Ag(CN)2], содержащем в избытке 1,3 г KCN в 1 л раствора. Константа нестойкости иона [Ag(CN)2] — равна 1,4·10— 20.
9. Произойдет ли осаждение сульфида ртути, если к 1 л 0,3 М раствора K2[HgI4], содержащему избыточных 0,01 моль KI, добавить 1·10— 4 моль K2S? ПР(HgS) = 1,6·10— 52, Кн [HgI4]2- = 1,5·10— 31.
10. При какой концентрации ионов Cl— начнется выпадение осадка AgCl из 0,6М раствора [Ag(NH3)2]NO3, содержащего 1,2 моль/л избыточного аммиака, если ПР(AgCl) = 1,73·10—10, Кн [Ag(NH3)2]+ = 5,7·10— 8.
ПОДГОТОВКА К ЕГЭ ПО ХИМИИ
Дорогие читатели!
Первый номер наступившего года мы хотим
отметить рождением новой рубрики в нашей
газете – «Подготовка к ЕГЭ по химии».
Надеемся, что на ее страницах вы сможете
рассказать о своих наработках в этой области,
поделиться опытом и мыслями об организации и
проведении единого государственного экзамена
(ЕГЭ) в вашем регионе, написать нам о своем
отношении к этой новой форме государственной
(итоговой) аттестации выпускников 11-х классов.
Образование и разрушение
комплексных солей на примере
гидроксокомплексов
В нашем городе ЕГЭ по химии сдают уже с 2003 г.
За прошедшие пять лет накоплен определенный опыт
работы. Двое моих учеников имели наивысшие по
области баллы – 97 (2004) и 96 (2007). Задания уровня С
выходят далеко за рамки двухчасовой школьной
программы, например, составление уравнений
окислительно-восстановительных реакций или
уравнений реакций по разрушению комплексных
солей. Найти ответы на некоторые вопросы порой не
удается ни в одном учебнике или пособии.
Одно из заданий высокого уровня сложности
(уровня С) проверяет знания об амфотерных
свойствах веществ. Для успешного выполнения
этого задания нужно знать в том числе и способы
разрушения комплексных солей. В учебной
литературе этому вопросу уделяется недостаточно
внимания.
Амфотерные свойства имеют оксиды и гидроксиды
многих металлов. Они нерастворимы в воде, но
взаимодействуют и с кислотами, и со щелочами. При
подготовке к ЕГЭ нужно усвоить материал о
свойствах соединений цинка, бериллия, алюминия,
железа и хрома. Рассмотрим эти свойства с
точки зрения амфотерности.
1 Основные
свойства при взаимодействии с сильными
кислотами.
Например:
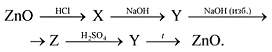
ZnO + 2HCl = ZnCl2 + H2O,
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O,
Al2O3 + 6HCl = 2AlCl3 + 3H2O,
Al(OH)3 + 3HCl = AlCl3 + 3H2O.
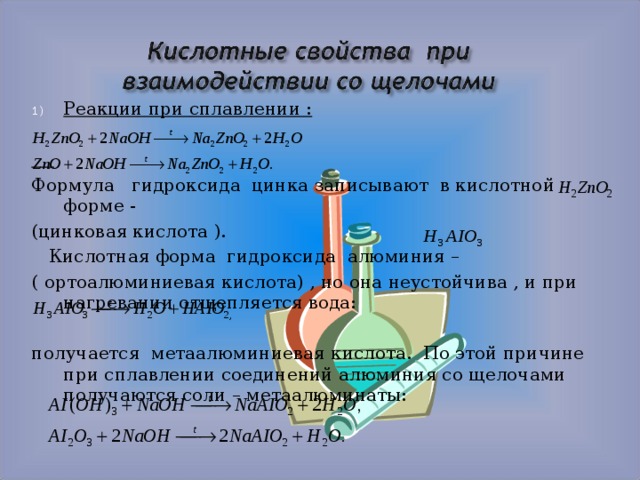
2
Кислотные свойства при взаимодействии со
щелочами.
1) Реакции при сплавлении:
Формулу гидроксида цинка записывают в
кислотной форме – H2ZnO2 (цинковая
кислота).
Кислотная форма гидроксида алюминия – H3AlO3
(ортоалюминиевая кислота), но она неустойчива, и
при нагревании отщепляется вода:
H3AlO3
H2O + HAlO2,
получается метаалюминиевая кислота. По этой
причине при сплавлении соединений алюминия со
щелочами получаются соли – метаалюминаты:
Al(OH)3 + NaOH
NaAlO2 + 2H2O,
Al2O3 + 2NaOH 2NaAlO2 + H2O.
2) Реакции в растворе происходят с образованием комплексных
солей:
Следует отметить, что при взаимодействии
соединений алюминия со щелочами в растворе
получаются разные формы комплексных солей:
Na3[Al(OH)6] – гексагидроксоалюминат
натрия;
Na[Al(H2O)2(OH)4] –
тетрагидроксодиакваалюминат натрия.
Форма соли зависит от концентрации щелочи.
Соединения бериллия (ВеО и Ве(ОН)2)
взаимодействуют со щелочами аналогично
соединениям цинка, соединения хрома(III) и
железа(III) (Cr2O3, Cr(OH)3, Fe2O3,
Fe(OH)3) – аналогично соединениям алюминия, но
оксиды этих металлов взаимодействуют со
щелочами только при сплавлении.
При взаимодействии гидроксидов этих металлов
со щелочами в растворе получаются комплексные
соли с координационным числом 6.
Гидроксид хрома(III) легко растворяется в
щелочах:
Гидроксид железа(III) имеет очень слабые
амфотерные свойства, взаимодействует только с
горячими концентрированными растворами щелочей:
3
Металлические бериллий, цинк и алюминий
взаимодействуют с растворами щелочей, вытесняя
из них водород:
Железо и хром с растворами щелочей не
реагируют, образование солей возможно только при
сплавлении с твердыми щелочами.
4 При
рассмотрении способов разрушения гидроксокомплексов
можно выделить несколько случаев.
1) При действии избытка сильной кислоты
получаются две средних соли и вода:
Na[Al(OH)4] + 4HCl (изб.) = NaCl + AlCl3
+ 4H2O,
K3[Cr(OH)6] + 6HNO3 (изб.) = 3KNO3
+ Cr(NO3)3 + 6H2O.
2) При действии сильной кислоты (в недостатке)
получаются средняя соль активного металла,
амфотерный гидроксид и вода:
Na[Al(OH)4] + HCl = NaCl + Al(OH)3 + H2O,
K3[Cr(OH)6] + 3HNO3 = 3KNO3
+ Cr(OH)3 + 3H2O.
3) При действии слабой кислоты получаются
кислая соль активного металла, амфотерный
гидроксид и вода:
Na[Al(OH)4] + H2S = NaHS + Al(OH)3 + H2O,
K3[Cr(OH)6] + 3H2CO3 = 3KHCO3
+ Cr(OH)3 + 3H2O.
4) При действии углекислого или сернистого газа
получаются кислая соль активного металла и
амфотерный гидроксид:
Na[Al(OH)4] + CO2 = NaHCO3 + Al(OH)3,
K3[Cr(OH)6]+ 3SO2 = 3KHSO3 +
Cr(OH)3.
5) При действии солей, образованных сильными
кислотами и катионами Fe3+, Al3+ и Cr3+,
происходит взаимное усиление гидролиза,
получаются два амфотерных гидроксида и соль
активного металла:
3Na[Al(OH)4] + FeCl3 = 3Al(OH)3 + Fe(OH)3
+ 3NaCl,
K3[Cr(OH)6] + Al(NO3)3 =
Al(OH)3 + Cr(OH)3
+ 3KNO3.
6) При нагревании гидроксокомплексов щелочных
металлов выделяется вода:
Na[Al(OH)4] NaAlO2
+ 2H2O,
K3[Cr(OH)6] KCrO2 + 2H2O
+ 2KOH.
5 Задания
для отработки умения составлять уравнения
реакций образования и разрушения
гидроксокомплексов.
1) Составьте уравнения четырех возможных
реакций между растворами следующих соединений:
гексагидроксохромат(III) калия, хлорид алюминия,
сероводород, соляная кислота.
П р и м е р р е ш е н и я
а) K3[Cr(OH)6] + AlCl3 = Cr(OH)3 +Al(OH)3
+ 3KCl;
б) K3[Cr(OH)6] + 3H2S = 3KHS + Cr(OH)3 + 3H2O;
в) K3[Cr(OH)6] + 6HCl (изб.) = 3KCl + CrCl3 + 6H2O;
г) K3[Cr(OH)6] + 3HCl (нед.) = 3KCl + Cr(OH)3 + 3H2O.
2) Даны водные растворы гексагидроксохромата(III)
натрия, сернистого газа, бромида железа(III),
гидроксида натрия.
Напишите уравнения четырех возможных реакций
между ними.
3) Напишите уравнения четырех возможных реакций
между растворами гексагидроксоалюмината калия,
карбоната калия, угольной кислоты, хлорида
хрома(III).
4) Осуществите превращения:
5) Осуществите превращения:
Г.С.ОСНОВСКАЯ,
учитель химии средней школы № 7
(г. Великие Луки, Псковская обл.)
2.7. Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка).
Химические свойства средних солей
Взаимодействие средних солей с металлами
Реакция соли с металлом протекает в том случае, если исходный свободный металл более активен, чем тот, который входит в состав исходной соли. Узнать о том, какой металл более активен, можно, воспользовавшись электрохимическим рядом напряжений металлов.
Так, например, железо взаимодействует с сульфатом меди в водном растворе, поскольку является более активным, чем медь (левее в ряду активности):
В то же время железо не реагирует с раствором хлорида цинка, поскольку оно менее активно, чем цинк:
Следует отметить, что такие активные металлы, как щелочные и щелочноземельные, при их добавлении к водным растворам солей будут прежде всего реагировать не с солью, а входящей в состав растворов водой.
Взаимодействие средних солей с гидроксидами металлов
Оговоримся, что под гидроксидами металлов в данном случае понимаются соединения вида Me(OH)x.
Для того чтобы средняя соль реагировала с гидроксидом металла, должны одновременно (!) выполняться два требования:
- в предполагаемых продуктах должен быть обнаружен осадок или газ;
- исходная соль и исходный гидроксид металла должны быть растворимы.
Рассмотрим пару случаев, для того чтобы усвоить данное правило.
Определим, какие из реакций ниже протекают, и напишем уравнения протекающих реакций:
- 1) PbS + KOH
- 2) FeCl3 + NaOH
Рассмотрим первое взаимодействие сульфида свинца и гидроксида калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», обозначив таким образом, что пока не известно, протекает ли реакция на самом деле:
В предполагаемых продуктах мы видим гидроксид свинца (II), который, судя по таблице растворимости, нерастворим и должен выпадать в осадок. Однако, вывод о том, что реакция протекает, пока сделать нельзя, так как мы не проверили удовлетворение еще одного обязательного требования – растворимости исходных соли и гидроксида. Сульфид свинца – нерастворимая соль, а значит реакция не протекает, так как не выполняется одно из обязательных требований для протекания реакции между солью и гидроксидом металла. Т.е.:
Рассмотрим второе предполагаемое взаимодействие между хлоридом железа (III) и гидроксидом калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», как и в первом случае:
В предполагаемых продуктах мы видим гидроксид железа (III), который нерастворим и должен выпадать в осадок. Однако сделать вывод о протекании реакции пока еще нельзя. Для этого надо еще убедиться в растворимости исходных соли и гидроксида. Оба исходных вещества растворимы, значит мы можем сделать вывод о том, что реакция протекает. Запишем ее уравнение:
Реакции средних солей с кислотами
Средняя соль реагирует с кислотой в том случае, если образуется осадок или слабая кислота.
Распознать осадок среди предполагаемых продуктов практически всегда можно по таблице растворимости. Так, например, серная кислота реагирует с нитратом бария, поскольку в осадок выпадает нерастворимый сульфат бария:
Распознать слабую кислоту по таблице растворимости нельзя, поскольку многие слабые кислоты растворимы в воде. Поэтому список слабых кислот следует выучить. К слабым кислотам относят H2S, H2CO3, H2SO3, HF, HNO2, H2SiO3 и все органические кислоты.
Так, например, соляная кислота реагирует с ацетатом натрия, поскольку образуется слабая органическая кислота (уксусная):
Следует отметить, что сероводород H2S является не только слабой кислотой, но и плохо растворим в воде, в связи с чем выделяется из нее в виде газа (с запахом тухлых яиц):
Кроме того, обязательно следует запомнить, что слабые кислоты — угольная и сернистая — являются неустойчивыми и практически сразу же после образования разлагаются на соответствующий кислотный оксид и воду:
Выше было сказано, что реакция соли с кислотой идет в том случае, если образуется осадок или слабая кислота. Т.е. если нет осадка и в предполагаемых продуктах присутствует сильная кислота, то реакция не пойдет. Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
Однако, если брать не концентрированную серную кислоту и твердый хлорид натрия, а растворы этих веществ, то реакция действительно не пойдет:
Реакции средних солей с другими средними солями
Реакция между средними солями протекает в том случае, если одновременно (!) выполняются два требования:
- исходные соли растворимы;
- в предполагаемых продуктах есть осадок или газ.
Например, сульфат бария не реагирует с карбонатом калия, поскольку несмотря на то что в предполагаемых продуктах есть осадок (карбонат бария), не выполняется требование растворимости исходных солей.
В то же время хлорид бария реагирует с карбонатом калия в растворе, поскольку обе исходные соли растворимы, а в продуктах есть осадок:
Газ при взаимодействии солей образуется в единственном случае – если смешивать при нагревании раствор любого нитрита с раствором любой соли аммония:
Причина образования газа (азота) заключается в том, что в растворе одновременно находятся катионы NH4+ и анионы NO2— , образующие термически неустойчивый нитрит аммония, разлагающийся в соответствии с уравнением:
Реакции термического разложения солей
Разложение карбонатов
Все нерастворимые карбонаты, а также карбонаты лития и аммония термически неустойчивы и разлагаются при нагревании. Карбонаты металлов разлагаются до оксида металла и углекислого газа:
а карбонат аммония дает три продукта – аммиак, углекислый газ и воду:
Разложение нитратов
Абсолютно все нитраты разлагаются при нагревании, при этом тип разложения зависит от положения металла в ряду активности. Схема разложения нитратов металлов представлена на следующей иллюстрации:
Так, например, в соответствии с этой схемой уравнения разложения нитрата натрия, нитрата алюминия и нитрата ртути записываются следующим образом:
Также следует отметить специфику разложения нитрата аммония и нитрата железа (II):
Реакция разложения нитрата железа (II) снова стала встречаться в ЕГЭ по химии. В заданиях фигурирует формулировка о его разложении в токе воздуха, однако, что в токе воздуха, что без него, уравнение будет одинаковым. Писать оксид FeO при разложении нитрата железа (II) будет ошибкой.
Разложение солей аммония
Термическое разложение солей аммония чаще всего сопровождается образованием аммиака:
В случае, если кислотный остаток обладает окислительными свойствами, вместо аммиака образуется какой-либо продукт его окисления, например, молекулярный азот N2 или оксид азота (I):
Разложение хлората калия
Реакция разложения хлората калия может протекать по-разному. В присутствии катализатора (как правило MnO2), реакция приводит к образованию хлорида калия и кислорода:
Без катализатора, реакция будет протекать по типу диспропорционирования:
Химические свойства кислых солей
Отношение кислых солей к щелочам и кислотам
Кислые соли реагируют с щелочами. При этом, если щелочь содержит тот же металл, что и кислая соль, то образуются средние соли:
Также, если в кислотном остатке кислой соли осталось два или более подвижных атомов водорода, как, например, в дигидрофосфате натрия, то возможно образование как средней:
так и другой кислой соли с меньшим числом атомов водорода в кислотном остатке:
Важно отметить, что кислые соли реагируют с любыми щелочами, в том числе и теми, которые образованы другим металлом. Например:
Кислые соли, образованные слабыми кислотами, реагируют с сильными кислотами аналогично соответствующим средним солям:
Более подробно, с разбором алгоритмов составления уравнений, взаимодействие кислых солей (в частности, гидрокарбонатов, дигидрофосфатов и гидрофосфатов) со щелочами рассмотрено в данной публикации.
Термическое разложение кислых солей
Все кислые соли при нагревании разлагаются. В рамках программы ЕГЭ по химии из реакций разложения кислых солей следует усвоить, как разлагаются гидрокарбонаты. Гидрокарбонаты металлов разлагаются уже при температуре более 60 оС. При этом образуются карбонат металла, углекислый газ и вода:
Последние две реакции являются основной причиной образования накипи на поверхности водонагревательных элементов в электрических чайниках, стиральных машинах и т.д.
Гидрокарбонат аммония разлагается без твердого остатка с образованием двух газов и паров воды:
Химические свойства основных солей
Основные соли всегда реагируют со всеми сильными кислотами. При этом могут образоваться средние соли, если использовались кислота с тем же кислотным остатком, что и в основной соли, или смешанные соли, если кислотный остаток в основной соли отличается от кислотного остатка реагирующей с ней кислоты:
Также для основных солей характерны реакции разложения при нагревании, например:
Химические свойства комплексных солей (на примере соединений алюминия и цинка)
В рамках программы ЕГЭ по химии следует усвоить химические свойства таких комплексных соединений алюминия и цинка, как тетрагидроксоалюминаты и третрагидроксоцинкаты.
Тетрагидроксоалюминатами и тетрагидроксоцинкатами называют соли, анионы которых имеют формулы [Al(OH)4]— и [Zn(OH)4]2- соответственно. Рассмотрим химические свойства таких соединений на примере солей натрия:
Данные соединения, как и другие растворимые комплексные, хорошо диссоциируют, при этом практически все комплексные ионы (в квадратных скобках) остаются целыми и не диссоциируют дальше:
Действие избытка сильной кислоты на данные соединения приводит к образованию двух солей:
При действии же на них недостатка сильных кислот в новую соль переходит только активный металл. Алюминий и цинк в составе гидроксидов выпадают в осадок:
Осаждение гидроксидов алюминия и цинка сильными кислотами не является удачным выбором, поскольку сложно добавить строго необходимое для этого количество сильной кислоты, не растворив при этом часть осадка. По этой причине для этого используют углекислый газ, обладающий очень слабыми кислотными свойствами и благодаря этому не способный растворить осадок гидроксида:
В случае тетрагидроксоалюмината осаждение гидроксида также можно проводить, используя диоксид серы и сероводород:
В случае тетрагидроксоцинката осаждение сероводородом невозможно, поскольку в осадок вместо гидроксида цинка выпадает его сульфид:
При упаривании растворов тетрагидроксоцинката и тетрагидроксоалюмината с последующим прокаливанием данные соединения переходят соответственно в цинкат и алюминат:
Общая формула соли М
n
Ac
m
, где М – металл, Ас – кислотный остаток, n – число атомов металла, равное заряду иона кислотного остатка, m – число ионов кислотного остатка, равное заряду иона металла.
Средними солями
называют продукты полного замещения атомов водорода в молекуле кислоты атомами металла или полного замещения гидроксогрупп в молекуле основания кислотными остатками.
Например, H
3
PO
4
– Na
3
PO
4
;
Cu(OH)
2
– CuSO
4
.
Кислыми солями
называют продукты неполного замещения атомов водорода в молекулах многоосновных кислот атомами металла.
Например, H
2
SO
4
– NaHSO
4
,
H
3
PO
4
– Na
2
HPO
4
– NaH
2
PO
4
.
Основными солями
называют продукты неполного замещения гидроксогрупп в многокислотных основаниях кислотными остатками.
Например, Ca(OH)
2
– CaOHCl;
Fe(OH)
3
– Fe(OH)
2
Cl – FeOHCl
2
.
Кислые соли вступают в реакции с щелочами с образованием средних солей.
KHCO
3
+ KOH = K
2
CO
3
+ H
2
O
Некоторые кислые соли, например, угольной кислоты разлагаются под действием более сильных кислот:
KHCO
3
+ HCl = KCl + CO
2
+ H
2
O
Основные соли вступают в реакции с кислотами:
Cu(OH)Cl + HCl = CuCl
2
+ H
2
O
Свойства комплексных солей (способы разрушения комплексных солей)
1) Комплексные соли реагируют с сильными кислотами, продукты реакции зависят от соотношения между реагентами. При действии избытка сильной кислоты получается две средних соли и вода. При действии недостатка сильной кислоты получается средняя соль активного металла, амфотерный гидроксид и вода, например:
K
3
[Al(OH)
6
] + 3HCl = 3KCl + Al(OH)
3
↓ + 3H
2
O
K
3
[Al(OH)
6
] + 6HClизб = 3KCl + AlCl
3
+ 6H
2
O
K
2
[Zn(OH)
4
] + 2HBr = 2KBr + Zn(OH)
2
↓ + 2H
2
O
K
2
[Zn(OH)
4
] + 4HBr изб = 2KBr + ZnBr
2
+ 4H
2
O
K
3
[Cr(OH)
6
] + 6HNO
3
изб
.
= 3KNO
3
+ Cr(NO
3
)
3
+ 6H
2
O
2) При нагревании комплексные соли теряют воду:
K[Al(OH)
4
] = KAlO
2
+ 2H
2
O
K
3
[Cr(OH)
6
] = KCrO
2
+ 2H
2
O + 2KOH
3) При действии углекислого газа, сернистого газа или сероводорода получается соль активного металла и амфотерный гидроксид:
Na[Al(OH)
4
] + CO
2
= NaHCO
3
+ Al(OH)
3
↓
K
3
[Cr(OH)
6
]+ 3SO
2
= 3KHSO
3
+ Cr(OH)
3
↓
Na[Al(OH)
4
] + H
2
S = NaHS + Al(OH)
3
↓+ H
2
O
4) При действии солей, образованных катионами Fe
3+
, Al
3+
и Cr
3+
происходит взаимное усиление гидролиза, получается два амфотерных гидроксида и соль активного металла:
3Na[Al(OH)
4
] + FeCl
3
= 3Al(OH)
3
↓ + Fe(OH)
3
↓ + 3NaCl
K
3
[Cr(OH)
6
] + Al(NO
3
)
3
= Al(OH)
3
↓
+ Cr(OH)
3
↓+ 3KNO
3
Комплексные соединения
Материалы портала onx.distant.ru
Состав комплексных соединений
Номенклатура комплексных соединений
Реакции образования комплексных соединений
Реакции разрушения комплексных соединений
Диссоциация комплексных соединений
Примеры решения задач
Задачи для самостоятельного решения
Состав комплексных соединений
Рис. 1. Состав комплексного соединения
Комплексное соединение, рисунок 1, состоит из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды, называется комплексообразователем. Число лигандов комплексообразователя называется координационным числом.
Номенклатура комплексных соединений
Комплексное соединение может состоять из комплексного катиона, комплексного аниона или может быть нейтральным.
Соединения с комплексными катионами . Вначале называют внешнесферный анион, затем перечисляют лиганды, затем называют комплексообразователь в родительном падеже (ему дается русское название данного элемента). После названия комплексообразователя в скобках римской цифрой указывается его степень окисления.
К латинскому названию анионного лиганда добавляется окончание “о” (F — — фторо, Cl — -хлоро, ОН — — гидроксо, CN — — циано и т.д). Аммиак обозначают термином “аммин”, СО – карбонил, NO – нитрозил, H2O – аква.
Число одинаковых лигандов называют греческим числительным: 2 –ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта и т.д.
Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные. Например,
[Pt(NH3)5Cl]Cl3 – хлорид хлоропентаамминплатины (IV) .
Если в комплексе имеются несколько лигандов одинакового знака заряда, то они называются в алфавитном порядке:
Соединения с комплексными анионами. Вначале называют комплексный анион в именительном падеже: перечисляют лиганды, затем комплексообразователь (ему дается латинское название и к названию добавляется окончание “ат”). После названия комплексообразователя указывается его степень окисления. Затем в родительном падеже называется внешнесферный катион.
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия;
K4[Fe(CN)6] – гексацианоферрат (II) калия;
K2[СuCl4] – тетрахлорокупрат (II) калия.
Соединения без внешней сферы. Вначале называют лиганды, затем комплексообразователь в именительном падеже с указанием его степени окисления. Все название пишется слитно.
[Ni(CО)4] – тетракарбонилникель (0);
Реакции образования комплексных соединений
Комплексные соединения обычно получают действием избытка лигандов на содержащее комплексообразователь соединение. Координационное число, как правило, в 2 раза больше степени окисления комплексообразователя. Из этого правила бывают, однако, исключения.
Образование комплексных солей.
Если комплексообразователем является Fe 2+ или Fe 3+ , то координационные числа в обоих случаях равны шести:
Координационные числа ртути и меди, как правило, равны четырем:
Для большинства аква- и амминных комплексов ионов d-элементов координационное число равно шести:
Реакции разрушения комплексных соединений
Разрушение комплексных соединений происходит в результате:
-
-
- образования малорастворимого соединения с комплексообразователем:
-
-
-
- образования более прочного комплексного соединения с комплексообразователем или с лигандом:
-
-
-
- действия любой сильной кислоты на гидрокомплексы; в этом случае образуется соль и вода:
-
Диссоциация комплексных соединений
Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы. В то же время комплексный ион диссоциирует в незначительной степени как ассоциированный электролит. Количественной характеристикой диссоциации внутренней сферы в растворе является константа нестойкости, представляющая собой константу равновесия процесса диссоциации комплексного иона.
Например , в растворе комплексное соединение [Ni(NH3)6]SO4 диссоциирует следующим образом:
Для комплексного иона [Ni(NH3)6] 2+ , диссоциирующего по уравнению
константа равновесия процесса диссоциации носит название константы нестойкости Кн. Для рассматриваемого процесса Кн равна
Кн = [Ni 2+ ]·[NH3] 6 / [[Ni(NH3)6] 2+ ] (1)
Величина, обратная Кн, называется константой устойчивости:
Она представляет собой константу равновесия процесса образования комплексного иона:
Константа нестойкости Кн связана с изменением энергии Гиббса процесса диссоциации комплекса уравнением:
ΔGT о = — RTln Кн (3)
Примеры решения задач:
Задача 1. Вычислите:
1) Концентрацию ионов NO3 — в 0,01 М растворе [Ag(NH3)2]NO3.
2) Концентрацию Ag + в 0,01 М растворе [Ag(NH3)2]NO3, содержащем 2 моль/л избыточного аммиака,
если Кн[Ag(NH3)2] + = 5,7× 10 — 8 при 298 К.
3) Величину ΔG o 298 процесса диссоциации комплексного иона.
[NO3 — ] = 0,01М, поскольку комплекс диссоциирует как сильный электролит на комплексный ион и ионы внешней сферы.
2) Комплексный ион диссоциирует незначительно:
Положение равновесия комплексного иона в присутствии избытка NH3 еще больше смещено влево.
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Ag + и 2x моль/л аммиака. Суммарная концентрация аммиака равна (2x+2) моль/л. Концентрация недиссоциированного комплексного иона [Ag(NH3)2] + составляет: (0,01–x) моль/л.
Концентрация аммиака, связанная с диссоциацией комплексного иона, ничтожно мала по сравнению с избытком аммиака. Доля комплексного иона, подвергшегося диссоциации, также ничтожно мала. Значит,
Следовательно, [Ag + ] = 1,43× 10 — 10 моль/л.
Константа нестойкости связана с изменением энергии Гиббса процесса диссоциации [Ag(NH3)2] + уравнением:
Значит, при Т = 298 К получаем:
ΔG о 298 = — 8,314× 298× ln5,7× 10 — 8 = 41326 Дж = 413,3 кДж.
Задача 2. Произойдет ли осаждение AgCl при сливании 0,01М раствора [Ag(NH3)2]NO3, содержащего 2 моль/л избыточного NH3, с равным объемом 0,5М раствора KCl, если при 298 К ПР(AgCl) = 1,73× 10 — 10 , Кн.[Ag(NH3)2] + = 5,7× 10 — 8 .
Решение. Осадок выпадет при условии: [Ag + ][Сl — ] > ПР(AgCl), т.е. если произведение концентраций ионов Ag + и Сl — в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
После смешения равных объемов растворов концентрации [Ag(NH3)2]NO3, NH3 и KCl уменьшатся в 2 раза и станут равными 5× 10 -3 , 1 и 0,25 М соответственно.
Найдем концентрацию [Ag + ] тем же способом, что и в предыдущей задаче,
откуда x = 2,85× 10 — 10 .
Значит, [Ag + ] = 2,85× 10 — 10 моль/л, а [Сl — ] = 0,25 моль/л.
Следовательно, произведение концентраций ионов равно:
[Ag + ][Сl — ] = 2,85× 10 — 10 × 0,25 = 7,1× 10 — 11 (моль/л) 2 .
Поскольку [Ag + ][Сl — ] = 7,1× 10 — 11 — 10 , то осадок не выпадет.
Задача 3. При какой концентрации ионов S 2- начнется выпадение осадка CdS из 0,6М раствора Na2[Cd(CN)4], содержащего 0,04 моль/л избыточного NaCN, если ПР(CdS) = 7,9× 10 — 27 , Кн[Cd(CN)4] 2- = 7,8× 10 — 18 .
Решение. Осадок выпадет при условии: [Cd 2+ ][S 2- ] > ПР(CdS), т.е. если произведение концентраций ионов Cd 2+ и S 2- в растворе будет больше ПР. Следовательно, выпадение осадка начнется при [S 2- ] > ПР(CdS):[Cd 2+ ].
Комплексный ион диссоциирует незначительно:
[Cd(CN)4] 2- → Cd 2+ + 4CN —
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Cd 2+ и 4x моль/л ионов CN — . Суммарная концентрация ионов CN — равна (4x + 0,04) моль/л. Концентрация недиссоциированного комплексного иона [Cd(CN)4] 2- составляет: (0,6 – x) моль/л.
Кн[Cd(CN)4] 2- = [Cd 2+ ] · [CN — ] 4 / [[Cd(CN)4] 2- ]
Следовательно, [Cd 2+ ] = 1,8·10 — 12 моль/л.
Выпадение осадка начнется при [S 2- ] > 7,9·10 — 27 : 1,8·10 — 12 > 4,39·10 — 15 моль/л.
Задачи для самостоятельного решения
1. Назовите следующие комплексные соединения:
Na2[Pt(CN)4Cl2] – дихлоротетрацианоплатинат (IV) натрия;
2. Назовите следующие комплексные соединения
[Ni(NH3)6][PtCl4] – тетрахлороплатинат (II) гексаамминникеля (II).
3. Составьте уравнение химической реакции:
4. Составьте уравнение химической реакции:
5 . Составьте уравнение химической реакции:
6. Составьте уравнение химической реакции:
7. Составьте уравнение химической реакции:
2.7. Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка).
Химические свойства средних солей
Взаимодействие средних солей с металлами
Реакция соли с металлом протекает в том случае, если исходный свободный металл более активен, чем тот, который входит в состав исходной соли. Узнать о том, какой металл более активен, можно, воспользовавшись электрохимическим рядом напряжений металлов.
Так, например, железо взаимодействует с сульфатом меди в водном растворе, поскольку является более активным, чем медь (левее в ряду активности):
В то же время железо не реагирует с раствором хлорида цинка, поскольку оно менее активно, чем цинк:
Следует отметить, что такие активные металлы, как щелочные и щелочноземельные, при их добавлении к водным растворам солей будут прежде всего реагировать не с солью, а входящей в состав растворов водой.
Взаимодействие средних солей с гидроксидами металлов
Оговоримся, что под гидроксидами металлов в данном случае понимаются соединения вида Me(OH)x.
Для того чтобы средняя соль реагировала с гидроксидом металла, должны одновременно (!) выполняться два требования:
- в предполагаемых продуктах должен быть обнаружен осадок или газ;
- исходная соль и исходный гидроксид металла должны быть растворимы.
Рассмотрим пару случаев, для того чтобы усвоить данное правило.
Определим, какие из реакций ниже протекают, и напишем уравнения протекающих реакций:
Рассмотрим первое взаимодействие сульфида свинца и гидроксида калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», обозначив таким образом, что пока не известно, протекает ли реакция на самом деле:
В предполагаемых продуктах мы видим гидроксид свинца (II), который, судя по таблице растворимости, нерастворим и должен выпадать в осадок. Однако, вывод о том, что реакция протекает, пока сделать нельзя, так как мы не проверили удовлетворение еще одного обязательного требования – растворимости исходных соли и гидроксида. Сульфид свинца – нерастворимая соль, а значит реакция не протекает, так как не выполняется одно из обязательных требований для протекания реакции между солью и гидроксидом металла. Т.е.:
Рассмотрим второе предполагаемое взаимодействие между хлоридом железа (III) и гидроксидом калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», как и в первом случае:
В предполагаемых продуктах мы видим гидроксид железа (III), который нерастворим и должен выпадать в осадок. Однако сделать вывод о протекании реакции пока еще нельзя. Для этого надо еще убедиться в растворимости исходных соли и гидроксида. Оба исходных вещества растворимы, значит мы можем сделать вывод о том, что реакция протекает. Запишем ее уравнение:
Реакции средних солей с кислотами
Средняя соль реагирует с кислотой в том случае, если образуется осадок или слабая кислота.
Распознать осадок среди предполагаемых продуктов практически всегда можно по таблице растворимости. Так, например, серная кислота реагирует с нитратом бария, поскольку в осадок выпадает нерастворимый сульфат бария:
Распознать слабую кислоту по таблице растворимости нельзя, поскольку многие слабые кислоты растворимы в воде. Поэтому список слабых кислот следует выучить. К слабым кислотам относят H2S, H2CO3, H2SO3, HF, HNO2, H2SiO3 и все органические кислоты.
Так, например, соляная кислота реагирует с ацетатом натрия, поскольку образуется слабая органическая кислота (уксусная):
Следует отметить, что сероводород H2S является не только слабой кислотой, но и плохо растворим в воде, в связи с чем выделяется из нее в виде газа (с запахом тухлых яиц):
Кроме того, обязательно следует запомнить, что слабые кислоты — угольная и сернистая — являются неустойчивыми и практически сразу же после образования разлагаются на соответствующий кислотный оксид и воду:
Выше было сказано, что реакция соли с кислотой идет в том случае, если образуется осадок или слабая кислота. Т.е. если нет осадка и в предполагаемых продуктах присутствует сильная кислота, то реакция не пойдет. Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
Однако, если брать не концентрированную серную кислоту и твердый хлорид натрия, а растворы этих веществ, то реакция действительно не пойдет:
Реакции средних солей с другими средними солями
Реакция между средними солями протекает в том случае, если одновременно (!) выполняются два требования:
- исходные соли растворимы;
- в предполагаемых продуктах есть осадок или газ.
Например, сульфат бария не реагирует с карбонатом калия, поскольку несмотря на то что в предполагаемых продуктах есть осадок (карбонат бария), не выполняется требование растворимости исходных солей.
В то же время хлорид бария реагирует с карбонатом калия в растворе, поскольку обе исходные соли растворимы, а в продуктах есть осадок:
Газ при взаимодействии солей образуется в единственном случае – если смешивать при нагревании раствор любого нитрита с раствором любой соли аммония:
Причина образования газа (азота) заключается в том, что в растворе одновременно находятся катионы NH4 + и анионы NO2 — , образующие термически неустойчивый нитрит аммония, разлагающийся в соответствии с уравнением:
Реакции термического разложения солей
Разложение карбонатов
Все нерастворимые карбонаты, а также карбонаты лития и аммония термически неустойчивы и разлагаются при нагревании. Карбонаты металлов разлагаются до оксида металла и углекислого газа:
а карбонат аммония дает три продукта – аммиак, углекислый газ и воду:
Разложение нитратов
Абсолютно все нитраты разлагаются при нагревании, при этом тип разложения зависит от положения металла в ряду активности. Схема разложения нитратов металлов представлена на следующей иллюстрации:
Так, например, в соответствии с этой схемой уравнения разложения нитрата натрия, нитрата алюминия и нитрата ртути записываются следующим образом:
Также следует отметить специфику разложения нитрата аммония и нитрата железа (II):
Реакция разложения нитрата железа (II) снова стала встречаться в ЕГЭ по химии. В заданиях фигурирует формулировка о его разложении в токе воздуха, однако, что в токе воздуха, что без него, уравнение будет одинаковым. Писать оксид FeO при разложении нитрата железа (II) будет ошибкой.
Разложение солей аммония
Термическое разложение солей аммония чаще всего сопровождается образованием аммиака:
В случае, если кислотный остаток обладает окислительными свойствами, вместо аммиака образуется какой-либо продукт его окисления, например, молекулярный азот N2 или оксид азота (I):
Разложение хлората калия
Реакция разложения хлората калия может протекать по-разному. В присутствии катализатора (как правило MnO2), реакция приводит к образованию хлорида калия и кислорода:
Без катализатора, реакция будет протекать по типу сопропорционирования:
Химические свойства кислых солей
Отношение кислых солей к щелочам и кислотам
Кислые соли реагируют с щелочами. При этом, если щелочь содержит тот же металл, что и кислая соль, то образуются средние соли:
Также, если в кислотном остатке кислой соли осталось два или более подвижных атомов водорода, как, например, в дигидрофосфате натрия, то возможно образование как средней:
так и другой кислой соли с меньшим числом атомов водорода в кислотном остатке:
Важно отметить, что кислые соли реагируют с любыми щелочами, в том числе и теми, которые образованы другим металлом. Например:
Кислые соли, образованные слабыми кислотами, реагируют с сильными кислотами аналогично соответствующим средним солям:
Более подробно, с разбором алгоритмов составления уравнений, взаимодействие кислых солей (в частности, гидрокарбонатов, дигидрофосфатов и гидрофосфатов) со щелочами рассмотрено в данной публикации.
Термическое разложение кислых солей
Все кислые соли при нагревании разлагаются. В рамках программы ЕГЭ по химии из реакций разложения кислых солей следует усвоить, как разлагаются гидрокарбонаты. Гидрокарбонаты металлов разлагаются уже при температуре более 60 о С. При этом образуются карбонат металла, углекислый газ и вода:
Последние две реакции являются основной причиной образования накипи на поверхности водонагревательных элементов в электрических чайниках, стиральных машинах и т.д.
Гидрокарбонат аммония разлагается без твердого остатка с образованием двух газов и паров воды:
Химические свойства основных солей
Основные соли всегда реагируют со всеми сильными кислотами. При этом могут образоваться средние соли, если использовались кислота с тем же кислотным остатком, что и в основной соли, или смешанные соли, если кислотный остаток в основной соли отличается от кислотного остатка реагирующей с ней кислоты:
Также для основных солей характерны реакции разложения при нагревании, например:
Химические свойства комплексных солей (на примере соединений алюминия и цинка)
В рамках программы ЕГЭ по химии следует усвоить химические свойства таких комплексных соединений алюминия и цинка, как тетрагидроксоалюминаты и третрагидроксоцинкаты.
Тетрагидроксоалюминатами и тетрагидроксоцинкатами называют соли, анионы которых имеют формулы [Al(OH)4] — и [Zn(OH)4] 2- соответственно. Рассмотрим химические свойства таких соединений на примере солей натрия:
Данные соединения, как и другие растворимые комплексные, хорошо диссоциируют, при этом практически все комплексные ионы (в квадратных скобках) остаются целыми и не диссоциируют дальше:
Действие избытка сильной кислоты на данные соединения приводит к образованию двух солей:
При действии же на них недостатка сильных кислот в новую соль переходит только активный металл. Алюминий и цинк в составе гидроксидов выпадают в осадок:
Осаждение гидроксидов алюминия и цинка сильными кислотами не является удачным выбором, поскольку сложно добавить строго необходимое для этого количество сильной кислоты, не растворив при этом часть осадка. По этой причине для этого используют углекислый газ, обладающий очень слабыми кислотными свойствами и благодаря этому не способный растворить осадок гидроксида:
В случае тетрагидроксоалюмината осаждение гидроксида также можно проводить, используя диоксид серы и сероводород:
В случае тетрагидроксоцинката осаждение сероводородом невозможно, поскольку в осадок вместо гидроксида цинка выпадает его сульфид:
При упаривании растворов тетрагидроксоцинката и тетрагидроксоалюмината с последующим прокаливанием данные соединения переходят соответственно в цинкат и алюминат:
Получение и химические свойства комплексных соединений
Получение комплексных соединений
Комплексные соединения можно получить различными способами:
1. В результате реакций соединения:
2. По реакции замещения лиганда во внутренней сфере:
Некоторые комплексы способны к быстрому замещению лигандов. Такие комплексы называются лабильными. У других же этот процесс происходит очень медленно – это инертные комплексы.
3. С помощью окислительно-восстановительных реакций:
4. С помощью реакций, использующих реакции трансвлияния лигандов:
Некоторые лиганды оказывают трансвлияние, т.е. способствуют замещению групп, расположенных в транс-положении. Лиганды расположены в ряд по уменьшению их трансвлияния:
CN — ≈ CO ≈ C2H4 > NO2 — > I — > Br — > Cl — > NH3 > OH — > H2O
При воздействии NH3 на K2[PtCl4], сначала один из четырех лигандов замещается молекулой аммиака:
При дальнейшем воздействии аммиака замещается еще один лиганд. Ионы Cl — , находящиеся в транс-положении не замещаются, т.к. их трансвлияние больше, чем молекулы NH3, и тем самым, они сильнее связаны с комплексообразователем:
Процессы образования комплексных соединений влияют на свойства всех частиц, образующих комплекс.
Химические свойства комплексных соединений
Для комплексных соединений проявление химической и биологической активности заключается в наличии свободных орбиталей комплексообразователя (координационная ненасыщенность) и наличии свободных электронных пар лигандов. Комплекс будет обладать электрофильными и нуклеофильными свойствами, отличающимися от свойств комплексообразователя и лигандов.
В целом, комплексным соединениям присущи свойства, аналогичные другим классам соединений:
1. Диссоциация:
Первичная (как сильные электролиты):
Вторичная (как слабые электролиты):
2. Реакции обмена
Обмен ионами внешней сферы:
Обмен ионов внутренней сферы:
3. Образование более прочного комплексного соединения:
4. Окислительно-восстановительные реакции:
Без разрушения комплекса:
С разрушением комплекса:
5. Разрушение комплексного соединения:
Чем более прочно связаны лиганд и комплексообразователь, тем менее заметно проявляются их свойства в растворе и тем больше сказываются особенности комплекса.
источники:
http://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/himicheskie-svojstva-solej
http://zadachi-po-khimii.ru/obshaya-himiya/poluchenie-i-ximicheskie-svojstva-kompleksnyx-soedinenij.html
Категория: Химия.
Методические рекомендации для подготовки учащихся к ЕГЭ по химии. Решение заданий С 2
(Основной источник – сайт педагогического университета ИД « 1 сентября», методические рекомендации О. С. Габриеляна)
Выполнение задания С2 предполагает углубленное изучение свойств неорганических веществ и понимание взаимосвязей между различными классами и группами веществ.
При выполнении этого задания анализ возможных превращений следует осуществлять по двум направлениям: 1. Реакции без изменения степени окисления (кислотно-основные свойства, реакции иного обмена) и 2. Возможность протекания окислительно-восстановительного взаимодействия между веществами.
Задание С2, проверяет знания о свойствах веществ, в том числе и амфотерных свойствах.
Иногда в заданиях встречаются задания на амфотерные свойства о которых мало где рассказывается.
Поэтому для успешного выполнения этого задания нужно знать еще и способы разрушения комплексных солей.
Оксиды и гидроксиды многих переходных металлов имеют амфотерные свойства. Они нерастворимы в воде, но взаимодействуют и с кислотами, и со щелочами. При подготовке к ЕГЭ нужно усвоить материал о свойствах соединений цинка, бериллия, алюминия, железа, хрома. Рассмотрим некоторые реакции на примере цинка, алюминия и их соединений.
Основные свойства при взаимодействии с сильными кислотами:
ZnO + 2HCl = ZnCl2 + 2H2O
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Кислотные свойства при взаимодействии со щелочами:
а) Реакции при сплавлении.
Формулу гидроксида цинка записывают в кислотной форме H2ZnO2 (цинковая кислота).
H2ZnO2 + 2NaOH = Na2ZnO2 + 2H2O (цинкат натрия)
ZnO + 2NaOH = Na2ZnO2 + H2O
Кислотная форма гидроксида алюминия H3AlO3 (ортоалюминиевая кислота), но она неустойчива, и при нагревании отщепляется вода: H3AlO3 – H2O = HAlO2, получается метаалюминиевая кислота.
По этой причине при сплавлении соединений алюминия со щелочами получаются соли – метаалюминаты:
Al(OH)3 + NaOH = NaAlO2 + 2H2O
Al2O3 + 2NaOH = 2NaAlO2 + H2O
б) Реакции в растворе происходят с образованием комплексных солей: Zn(OH)2 + 2NaOH = Na2 [Zn(OH)4]
ZnO + 2NaOH + 2H2O = Na2[Zn(OH)4] —
тетрагидроксоцинкат натрия.
Al(OH)3 + NaOH = Na[Al(OH)4]
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4] —
тетрагидроксоалюминат натрия.
При взаимодействии соединений алюминия со щелочами в растворе получаются разные формы комплексных солей:
Na[Al(OH)4] – тетрагидроксоалюминат натрия,
Na3[Al(OH)6] – гексагидроксоалюминат натрия,
Na[Al(OH)4 (H2O)2] – диакватетрагидроксоалюминат натрия.
Форма соли зависит от концентрации щелочи.
Соединения бериллия – ВеО и Ве(ОН)2 – взаимодействуют со щелочами аналогично соединениям цинка, соединения хрома (III) и железа (III) – Cr2O3, Cr(OH)3, Fe2O3, Fe(OH)3 – аналогично соединениям алюминия, но оксиды этих металлов взаимодействуют со щелочами только при сплавлении.
Cr2O3 + NaOH = NaCrO2 + H2O —
метахромит натрия, хромат (III) натрия.
Fe2O3 + 2NaOH = 2NaFeO2 + H2O —
феррит натрия, феррат (III) натрия.
При взаимодействии гидроксидов этих металлов со щелочами в растворе получаются комплексные соли с координационным числом 6.
Гидроксид хрома (III) легко растворяется в щелочах.
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6 —
гексагидроксохромат (III) натрия.
Гидроксид железа (III) имеет очень слабые амфотерные свойства, взаимодействует только с горячими концентрированными растворами щелочей: Fe(OH)3 + 3NaOH = Na3[Fe(OH)6] —
тетрагидроксоферрат (III) натрия.
Из рассматриваемых металлов с растворами щелочей взаимодействуют только Ве, Zn, Al:
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2 —
тетрагидроксобериллат натрия.
2n + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Железо и хром с растворами щелочей не реагируют, эти реакции возможны только при сплавлении с твёрдыми щелочами.
При рассмотрении способов разрушения комплексных солей можно выделить несколько случаев:
При действии избытка сильной кислоты получается две средних соли и вода:
NaAl(OH)4 + 4HClизб. = NaCl + AlCl3 + H2O
K3Cr(OH)6 + 6HNO3 изб. = 3KNO3 + Cr(NO3)3 + 6H2O
При действии недостатка сильной кислоты получается средняя соль активного металла, амфотерный гидроксид и вода:
NaAl(OH)4 + HClнед. = NaCl + Al(OH)3 + H2O
K3Cr(OH)6 + 3HNO3 нед. = 3KNO3 + Cr(OH)3 + 3H2O
При действии слабой кислоты получается кислая соль активного металла, амфотерный гидроксид и вода:
NaAl(OH)4 + H2S = NaHS + Al(OH)3 + H2O
K3Cr(OH)6 + 3H2CO3 = 3KHCO3 + Cr(OH)3 + 3H2O
При действии углекислого или сернистого газа получается кислая соль активного металла и амфотерный гидроксид:
NaAl(OH)4 + CO2 = NaHCO3 + Al(OH)3
K3Cr(OH)6+ 3SO2 = 3KHSO3 + Cr(OH)3
При действии солей, образованных сильными кислотами и катионами Fe3+, Al3+ и Cr3+ происходит взаимное усиление
гидролиза, получается два амфотерных гидроксида и соль активного металла:
3NaAl(OH)4 + FeCl3 = 3Al(OH)3 + Fe(OH)3 + 3NaCl
K3Cr(OH)6 + Al(NO3)3 = Al(OH)3 + Cr(OH)3 + 3KNO3
6. При нагревании выделяется вода:
NaAl(OH)4 = NaAlO2 + 2H2O
K3Cr(OH)6 = KCrO2 + 2H2O + 2KOH
Литература:
1. Неорганическая химия. В 2 томах.
2. Неорганическая химия. В 2 томах.
Том 1: Д. Шрайвер, П. Эткинс – Москва, Мир, 2009 г. – 680с.
Том 2: Д. Шрайвер, П. Эткинс – Санкт-Петербург, Мир, 2009 г. -488 с.
3. Неорганическая химия: Д. А. Князев, С. Н. Смарыгин – Москва, Дрофа, 2004 г. – 592 с.
4. Общая и неорганическая химия в вопросах: Р. А. Лидин, Л. Ю. Аликберова, Г. П. Логинова – Санкт-Петербург, Дрофа, 2004 г. – 304 с.
5. Общая и неорганическая химия: Н. Н. Павлов – Санкт-Петербург, Дрофа, 2002 г. – 448 с.
6. Общая химия: Н. Л. Глинка – Москва, Интеграл-Пресс, 2008 г. – 728 с.
7. Общая химия: Т. И. Дробашева – Москва, Феникс, 2004 г. – 448 с.
Сборник задач и упражнений по общей и неорганической химии: – Санкт-Петербург, Дрофа, 2005 г. – 240 с.
9. Химический атлас: Л. Д. Борзова, Н. Ю. Черникова, В. В. Якушев – Москва, Издательство Российского Университета дружбы народов, 2004 г. – 224 с.
10. Химия. Экзаменационные ответы: – Санкт-Петербург, Буклайн, 2006 г. – 32 с.
А. М. Галенко, МОУ СОШ № 67, г. Волгоград
Учитель сош № 21: Сукнева Л.Е .
- При подготовке к ЕГЭ по химии задания уровня С выходят далеко за рамки двухчасовой школьной программы, например составление уравнений окислительно-восстановительных реакций или уравнений реакций по разрушению комплексных солей. Найти ответы на некоторые вопросы порой не удается ни в одном учебнике или пособии .
- Одно из заданий высокого уровня сложности ( уровня С) проверяет знания об амфотерных свойствах веществ. Для успешного выполнения этого задания нужно знать в том числе и способы разрушения комплексных солей. В учебной литературе этому вопросу уделяется мало внимания. Амфотерные свойства имеют оксиды и гидроксиды многих металлов. Они не растворяются в воде, но растворяются в кислотах и щелочах.При подготовке к ЕГЭ нужно усвоить материал о свойствах соединений алюминия, цинка, бериллия, железа и хрома.
- Одно из заданий высокого уровня сложности ( уровня С) проверяет знания об амфотерных свойствах веществ. Для успешного выполнения этого задания нужно знать в том числе и способы разрушения комплексных солей. В учебной литературе этому вопросу уделяется мало внимания. Амфотерные свойства имеют оксиды и гидроксиды многих металлов. Они не растворяются в воде, но растворяются в кислотах и щелочах.При подготовке к ЕГЭ нужно усвоить материал о свойствах соединений алюминия, цинка, бериллия, железа и хрома.
- Амфотерные свойства имеют оксиды и гидроксиды многих металлов. Они не растворяются в воде, но растворяются в кислотах и щелочах.При подготовке к ЕГЭ нужно усвоить материал о свойствах соединений алюминия, цинка, бериллия, железа и хрома.
Например:
Zn O + 2 HCI= Zn CI 2 + H 2 O ,
Zn(OH) 2 + 2 HCI = ZnCI 2 + 2 H 2 O ,
AI 2 O 3 +6HCI = 2 AICI 3 + 3H 2 o ,
AI (OH) 3 + 3HCI =AICI 3 + 3H 2 O
- Реакции при сплавлении :
Формула гидроксида цинка записывают в кислотной форме —
(цинковая кислота ).
Кислотная форма гидроксида алюминия –
( ортоалюминиевая кислота) , но она неустойчива , и при нагревании отщепляется вода:
получается метаалюминиевая кислота. По этой причине при сплавлении соединений алюминия со щелочами получаются соли – метаалюминаты:
Следует отметить , что при взаимодействии соединений алюминия со щелочами ( рН = 14) в растворе получаются разные формы комплексных солей ( к.ч.(А I ) =6)
т.е. гексагидроксоалюминат натрия
и тетрагидроксодиакваалюминат натрия.
Соединения бериллия ( ВеО и Ве(ОН) 2 ) взаимодействуют со щелочами аналогично соединениям цинка, соединения хрома ( III) и железа ( III) ( Cr 2 O 3 , Cr(OH) 3 , Fe 2 O 3 , Fe(OH) 3 ) — аналогично соединениям алюминия, но оксиды этих металлов взаимодействуют только при сплавлении.
Cr 2 O 3 + 2Na OH = 2NaCrO 2 +H 2 O
метахромит натрия ( хромат( III) натрия)
Fe 2 O 3 +2NaOH =2NaFeO 2 +H 2 O .
феррит натрия (ферр а т ( III) натрия)
При взаимодействии гидроксидов этих металлов со щелочами в растворе образуются комплексные соли с координационным числом 6.
Гидроксид хрома ( III) легко растворяется в щелочах:
Гидроксид железа ( III) имеет очень слабые амфотерные свойства взаимодействует только с горячими концентрированными растворами щелочей:
Железо и хром с растворами щелочей не реагируют , образование солей возможно только при сплавлении с твердыми щелочами.
1) При действии избытка сильной кислоты получаются две средних соли и вода:
2) При действии сильной кислоты ( в недостатке ) получаются средняя соль активного металла , амфотерный гидроксид и вода:
3) При действии слабой кислоты получается кислая соль активного металла , амфотерный гидроксид и вода:
4) При действии углекислого или сернистого газа получается кислая соль активного металла и амфотерный гидроксид:
5)При действии солей , образованных сильными кислотами и катионами , происходит взаимное усиление гидролиза получаются два амфотерных гидроксида и соль активного металла:
6)При нагревании гидроксокомплексов щелочных металлов выделяется вода:
1)Составьте уравнения четырех возможных реакций между растворами следующих соединений: гексагидроксохромат (III) калия, хлорид алюминия , сероводород , соляная кислота.
Пример решения
3) Напишите уравнения четырех возможных реакций между растворами гексагидроксоалюмината калия, карбоната калия, угольной кислоты, хлорида хрома( III) .
Применение таблиц-схем и моделей на уроках химии
Химические свойства оснований
щелочи
+ кислота
c оль + H 2 O
NaOH + HCl = NaCl + H 2 O
2 NaOH + H 2 SiO 3 = Na 2 SiO 3 + 2H 2 O
+ кислота
c оль + H 2 o
Cu(OH) 2 + H 2 SO 4 = CuSO 4 + 2 H 2 O
разлагаются при t = оксид + вода
t
Fe ( OH ) 2 = FeO + H 2 O
Нерастворимые
в воде
амфотерные
+ кислота = соль + H 2 O
Al(OH) 3 + 3HCl = AlCl 3 + 3H 2 O
= щелочь = соль + H 2 O
HAlO 2 + NaOH = NaAlO 2 + H 2 O
Образования гидроксокомплексов
Al(OH) 3 + KOH = K[Al(OH) 4 ]
Zn(OH) 2 + 2KOH = K 2 [Zn(OH) 4 ]
Be(OH) 2 + 2NaOH = Na 2 [Be(OH) 4 ]
Sn(OH) 2 + 2KOH = K 2 [Sn(OH) 4 ]
В сильнощелочных растворах ( pH приб14 ) возможно образования и более сложных комплексов.
Al(OH) 3 + 3NaOH = Na 3 [Al(OH) 6 ]
Fe(OH) 3 + 3KOH = K 3 [Fe(OH) 6 ]
Cr(OH) 3 + 3NaOH = Na 3 [Cr(OH) 6 ]
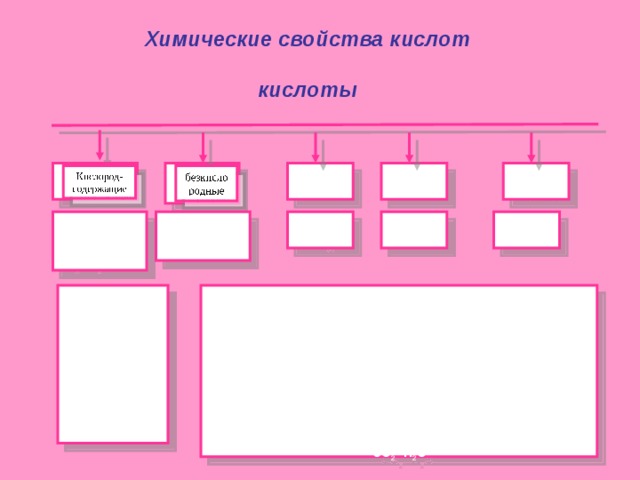
Химические свойства кислот
кислоты
двух
трехос-
новные
одно
HNO 3
HCl
H 2 SO 4
H 3 PO 4
H 2 SO 4 , HNO 3 , H 2 CO 3, H 2 SO 3
H 3 PO 4
HCl, HJ, HBr,
H 2 S, HF
P-p
кислоты
+ Me→ соль + H 2 (3)
Mg+2HCl→MgCl 2 +H 2 ↑
+ основной (амфотерный) оксид → соль + H 2 O ( O )
CaO + H 2 SO 4 → CaSO 4 +H 2 O
+ основная → соль + H 2 O ( O , H )
2NaOH + H 2 SO 4 → Na 2 SO 4 + 2H 2 O
+ соль слабой кислоты → соль + кислота (о)
K 2 CO 3 + 2HNO 3 → 2KNO 3 +H 2 CO 3 (O)
↓ ↓
CO 2 H 2 O
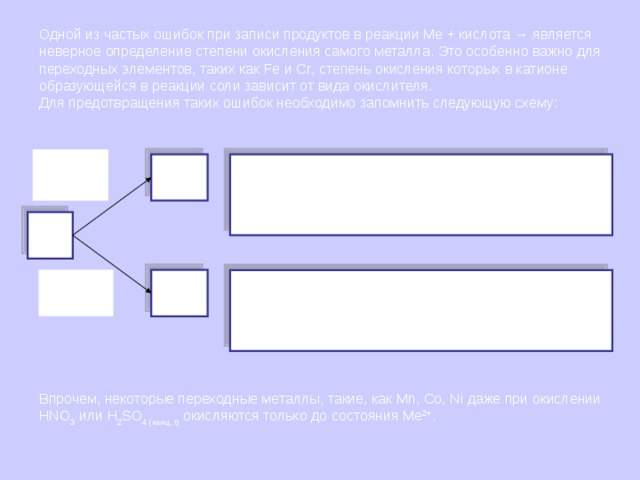
Одной из частых ошибок при записи продуктов в реакции Me + кислота → является неверное определение степени окисления самого металла. Это особенно важно для переходных элементов, таких как Fe и Cr , степень окисления которых в катионе образующейся в реакции соли зависит от вида окислителя.
Для предотвращения таких ошибок необходимо запомнить следующую схему:
Слабые
окислители
Fe +2
(Cr +2 )
Fe + 2H С l = FeCl 2 + Н 2 ↑
Cr +H 2 SO 4( разб ) = CrSO 4 + H 2 ↑
Fe + S → FeS
и т.п.
Fe
(Cr)
Сильные
окислители
Fe +3
(Cr +3 )
2Fe + 3Cl 2 = 2FeCl 3
4Cr + 3O 2 = 2Cr 2 O 3
2Fe +6H 2 SO 4 ( конц ) = Fe 2 (SO 4 ) 3 + 3SO 2 +6H 2 O
Cr + 4HNO 3( разб ) =Cr(NO 3 ) 3 + 2H 2 O +NO
Впрочем, некоторые переходные металлы, такие, как Mn , Co , Ni даже при окислении HNO 3 или H 2 SO 4 (конц, t ) окисляются только до состояния Me 2+ .
Взаимодействие концентрированной H 2 SO 4 c Me
Менее
активные
Me : Cu , Hg , Ag
Me средней активности от H 2 — Mn
SO 2
Me — активные
S
(при ком. t )
SO 2
(при t )
H 2 S
Не реагирует с
Al , Cr , Fe , Ni
Разбавленная
HNO 3
Концентрированная
С тяжелыми металлами
С щелочно-
земельными металлами, а также с Zn и Fe
С другими тяжелыми металлами
На Fe, Cr, Al, Au, Pt, Jr, Ta не действует
С щелочными и щелочноземельными металлами
NO 2
N 2 O
NO
NH 3 (NH 4 NO 3 )
Взаимодействие HNO 3 с Me
HNO 3
концентр.
Менее активные Me : Cu , Hg , Ag
и слабые восстановители
HNO 3
разбав.
c редней активности
от H 2 — Mn
NO 2
NO
Сильные
восстановители и
активные Me
от Li — Al
NO 2
HNO 3
NO
N 2
N 2 O
NH 4 NO 3
не реагирует с
Cr , Al , Fe , Ni , Jr , Ta
NH 4 NO 3
( ком . t) Fe(NO 3 ) 2
Fe
t Fe(NO 3 ) 3
NH 4 NO 3
Термическое разложение некоторых солей.
2KClO 3 → 2KCl +3O 2 ↑
2KMnO 4 → K 2 MnO 4 +MnO 2 + O 2 ↑
4KClO 3 → 3KClO 4 +KCl
4Na 2 SO 3 → Na 2 S + Na 2 SO 4
Оксиды.
(не разлагаются все оксиды, кроме)
2HgO → 2Hg +O 2
2PbO 2 → 2Pb +O 2
Кислоты.
(не разлагаются все кислоты, кроме)
H 2 CO 3 → H 2 O↑ + CO 2 ↑
H 2 SiO 3 → SiO 2 + H 2 O↑
H 2 SO 3 → H 2 O↑ + SO 2 ↑
2HNO 2 → NO↑ + NO 2 ↑ + H 2 O↑
4HNO 3 → 4NO 2 ↑ + O 2 ↑ + 2H 2 O
HCOOH→ CO↑ + H 2 O↑
H 2 C 2 O 4 → HCOOH + CO 2 ↑
Термическое разложение
левее Mg Me(NO 2 ) n + O 2 ↑
Me(NO 3 ) n Mg – Cu Me 2 O n + NO 2 ↑ + O 2 ↑
правее Me + NO 2 ↑ + O 2 ↑
Все соли аммония по схеме
NH 4 Cl → NH 3 ↑ + HCl ↑
(NH 4 ) 2 CO 3 → 2NH 3 ↑ + CO 2 ↑ +H 2 O
(NH 4 ) 2 SO 4 → 2NH 3 ↑ + H 2 SO 4
(NH 4 ) 3 PO 4 → 3NH 3 ↑ + H 3 PO 4
NH 4 NO 2 → N 2 ↑ + 2H 2 O↑
NH 4 NO 3 → N 2 O↑ + 2H 2 O↑
(NH 4 ) 2 Cr 2 O 7 → Cr 2 O 3 + N 2 ↑ + 4H 2 O↑
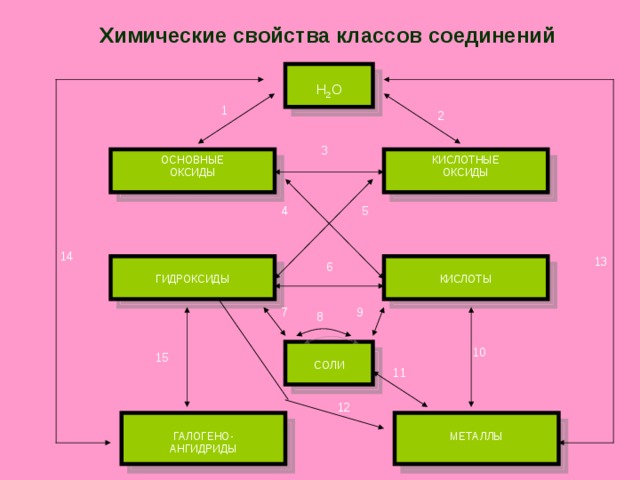
Химические свойства классов соединений
H 2 O
1
2
3
КИСЛОТНЫЕ
ОКСИДЫ
ОСНОВНЫЕ
ОКСИДЫ
4
5
1 4
1 3
6
ГИДРОКСИДЫ
КИСЛОТЫ
9
7
8
10
СОЛИ
15
11
12
ГАЛОГЕНО-
АНГИДРИДЫ
МЕТАЛЛЫ
№
Продукты реакции
1
Условия протекания
Гидроксид
2
Только для восьми оксидов: Li 2 O , Na 2 O , K 2 O , Rb 2 O , Cs 2 O , CaO , SrO , BaO
Кислота
3
4
Соль
Кислота, растворимая в воде
Соль + H 2 O
5
Ограничений нет (проблемы с растворимостью нет)
1)кислота, растворимая в воде
2)желательно, чтобы соль была растворима в воде
Соль + H 2 O
6
7
1) Гидроксид растворим в воде
Соль + H 2 O
8
Новая соль + новый гидроксид
1)Хотя бы одно из исходных веществ, растворима в воде
9
соль + соль
1)оба исходных соединений растворимы в воде
2)образуется газ, осадок, H 2 O ,принцип Ле — Шателье
10
1) Также как и 7
Новая соль + новая кислота
11
1)Исходная кислота растворима в воде (искл. H 2 SiO 3 )
2)Как правило, более сильная кислота вытесняет более слабую
3) принцип Ле — Шателье
Соль + H 2
12
1)кислота растворима в воде
2) Me активнее H 2
3)факт ограничения: Me ( Fe ) → +2 ; HNO 3 ; H 2 SO 4(к) → H 2 не выделяется
Соль + Me
13
1)Обе соли растворимы в воде
2)более акт. Ме вытесняет менее акт. Ме
3)примечания 8 Me (5 щ. Me и 3щ. з. Me не брать, одновременно идет 13
Соль амфотерного гидроксида (гидроксокомплекс) и H 2
14
1)Только для амфотерных металлов ( Al , Cr , Zn , Be , Pb , Sn )
гидроксид + H 2
15
1)8 Me , т.е 5щ. и 3щ.з. Ме
Смесь двух кислот + H 2 O
SO 2 Cl 2 + H 2 O → 2 HCl + H 2 SO 4 без ограничений
сульфорил хлорид
Две соли
SO 2 Cl 2 + 4KOH → K 2 SO 4 + 2KCl + 2H 2 O
Галогеноангриды
( 5 класс неорганических соединений , т.е производные кислот, которые
образуются при замене OH группы на галогены.)
H 2 SO 4 HSO 3 Х — галогенсульфоновые кислоты
SO 2 X 2 — сульфил
H 2 SO 3 SOX 2 – тионил ( галогенид )
HNO 2 NOX — нитрозил
H 3 PO 4 POX 3 – фосфорил
HPO 2 X 2
H 2 PO 3 X
H 2 CO 3 COX 2 — карбонил
( COCl 2 — фосген )
H 2 CrO 4 CrO 2 X 2 – хромил
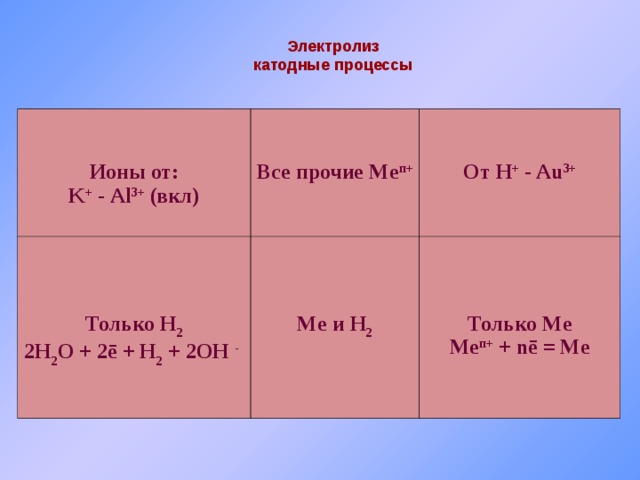
Электролиз
катодные процессы
Ионы от:
K + — Al 3+ (вкл)
Все прочие Me п+
Только H 2
2H 2 O + 2 ē + H 2 + 2OH —
От H + — Au 3+
Me и H 2
Только Me
Me п + + nē = Me
Анодные процессы
S 2- , J — , Br — , Cl — , Se 2- , Te 2- , As 3-
OH — , F — , CO 3 2- , SO 4 2- , NO 3 — …
X m- — mē = X
4 OH — — 4ē → O 2 ↑ + 2 H 2 O
или точнее:
2 H 2 O + 4ē = O 2 ↑ + 4 H +
Направление химических реакций
OH — H + ( кислая среда )
K 2 MnO 4 ← → Mn +2
(темно-зеленый) +1ē (фиолет) +5ē (бесцветный)
KMnO 4
+3ē ↓ + H 2 O
MnO 2 ↓
1) H 2 S + 2KMnO 4 + 2KOH → 2K 2 MnO 4 + S + 2H 2 O
- 1) H 2 S + 2KMnO 4 + 2KOH → 2K 2 MnO 4 + S + 2H 2 O
2) 2KMnO 4 + 5H 2 S + 3H 2 SO 4 → 5S + 2MnSO 4 + K 2 SO 4 + 8H 2 O
- 2) 2KMnO 4 + 5H 2 S + 3H 2 SO 4 → 5S + 2MnSO 4 + K 2 SO 4 + 8H 2 O
KMnO 4 в среде H 2 SO 4 реагирует с различными восстановителями.
окислитель
Продукты, разные для каждой реакции
K 2 SO 4
S
N 2
J 2
Fe 2 (SO 4 ) 3
CO 2
CO 2
Продукты, общие
для всех реакций
K 2 SO 4
+ +
MnSO 4
+
H 2 O
К 2 SO 3
H 2 S
NH 3
KJ
FeSO 4
C 6 H 12 O 6
C 2 H 2 O 4
KMnO 4 + H 2 SO 4
OH — H +
H 2 O ← H 2 O -1 2 → H 2 O + O 2
+2e -2 ē
3H 2 O 2 + K 2 Cr 2 O 7 + 4H 2 SO 4 → K 2 SO 4 +Cr 2 (SO 4 ) 3 + 3O 2 +7H 2 O
PH 3 + 4H 2 O 2 +3KOH → K 3 PO 4 + 7H 2 O
Хроматное равновесие
Cr 2 O 2- 7 + H 2 O 2 CrO 2- 4 + 2 H +
(Бихромат анион ( Cr 2 O 2- 7 ) в кислой среде → Cr 3+ )
(В щелочной среде Cr 2 O 2- 7 → в Cr +3 , т.е ( K 3 [ Cr ( OH ) 6 ])
Cr 2 O 2- 7 + H 2 O = 2CrO 2- 4 + 2H +
K 2 CrO 4 ↔ K 2 Cr 2 O 7
(OH — ) (H + )
Хромат калия существует в щелочной воде
Бихромат калия существует только в кислой среде
( оранж . K 2 Cr 2 O 7 + капли щелочи → желтый ( хромат ))
- 3PH 3 +4K 2 Cr 2 O 7 + 16H 2 SO 4 → 3H 3 PO 4 + 4Cr 2 (SO 4 ) 3 + 4K 2 SO 4 + 16H 2 O
- 3PH 3 +4K 2 Cr 2 O 7 + 16H 2 SO 4 → 3H 3 PO 4 + 4Cr 2 (SO 4 ) 3 + 4K 2 SO 4 + 16H 2 O
2) 3PH 3 + 8 K 2 Cr O 4 + 17KOH + 11H 2 O → 3K 3 PO 4 +8K 3 [Cr(OH) 6 ]
- 2) 3PH 3 + 8 K 2 Cr O 4 + 17KOH + 11H 2 O → 3K 3 PO 4 +8K 3 [Cr(OH) 6 ]
Реакции дихромата калия в кислой среде
Продукты, разные для каждой реакции
KNO 3
K 2 SO 4
S
N 2
J 2
Fe 2 (SO 4 ) 3
CO 2
Продукты, общие для всех реакций
K 2 SO 4
+
Cr 2 (SO 4 ) 3 +
+
H 2 O
KNO 2
K 2 SO 3
H 2 S
NH 3
KJ
FeSO 4
C 6 H 12 O 6
K 2 Cr 2 O 7 + H 2 SO 4 +



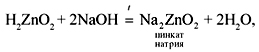
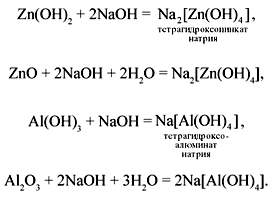
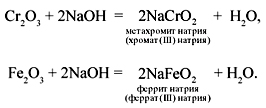
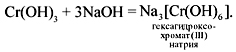
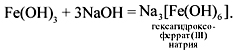
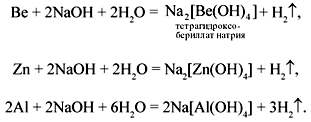
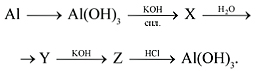

















![Образования гидроксокомплексов Al(OH) 3 + KOH = K[Al(OH) 4 ] Zn(OH) 2 + 2KOH = K 2 [Zn(OH) 4 ] Be(OH) 2 + 2NaOH = Na 2 [Be(OH) 4 ] Sn(OH) 2 + 2KOH = K 2 [Sn(OH) 4 ] В сильнощелочных растворах ( pH приб14 ) возможно образования и более сложных комплексов. Al(OH) 3 + 3NaOH = Na 3 [Al(OH) 6 ] Fe(OH) 3 + 3KOH = K 3 [Fe(OH) 6 ] Cr(OH) 3 + 3NaOH = Na 3 [Cr(OH) 6 ]](https://fsd.multiurok.ru/html/2018/02/13/s_5a82401803f86/img16.jpg)









![Хроматное равновесие Cr 2 O 2- 7 + H 2 O 2 CrO 2- 4 + 2 H + (Бихромат анион ( Cr 2 O 2- 7 ) в кислой среде → Cr 3+ ) (В щелочной среде Cr 2 O 2- 7 → в Cr +3 , т.е ( K 3 [ Cr ( OH ) 6 ])](https://fsd.multiurok.ru/html/2018/02/13/s_5a82401803f86/img32.jpg)
![Cr 2 O 2- 7 + H 2 O = 2CrO 2- 4 + 2H + K 2 CrO 4 ↔ K 2 Cr 2 O 7 (OH - ) (H + ) Хромат калия существует в щелочной воде Бихромат калия существует только в кислой среде ( оранж . K 2 Cr 2 O 7 + капли щелочи → желтый ( хромат )) 3PH 3 +4K 2 Cr 2 O 7 + 16H 2 SO 4 → 3H 3 PO 4 + 4Cr 2 (SO 4 ) 3 + 4K 2 SO 4 + 16H 2 O 3PH 3 +4K 2 Cr 2 O 7 + 16H 2 SO 4 → 3H 3 PO 4 + 4Cr 2 (SO 4 ) 3 + 4K 2 SO 4 + 16H 2 O 2) 3PH 3 + 8 K 2 Cr O 4 + 17KOH + 11H 2 O → 3K 3 PO 4 +8K 3 [Cr(OH) 6 ] 2) 3PH 3 + 8 K 2 Cr O 4 + 17KOH + 11H 2 O → 3K 3 PO 4 +8K 3 [Cr(OH) 6 ]](https://fsd.multiurok.ru/html/2018/02/13/s_5a82401803f86/img33.jpg)