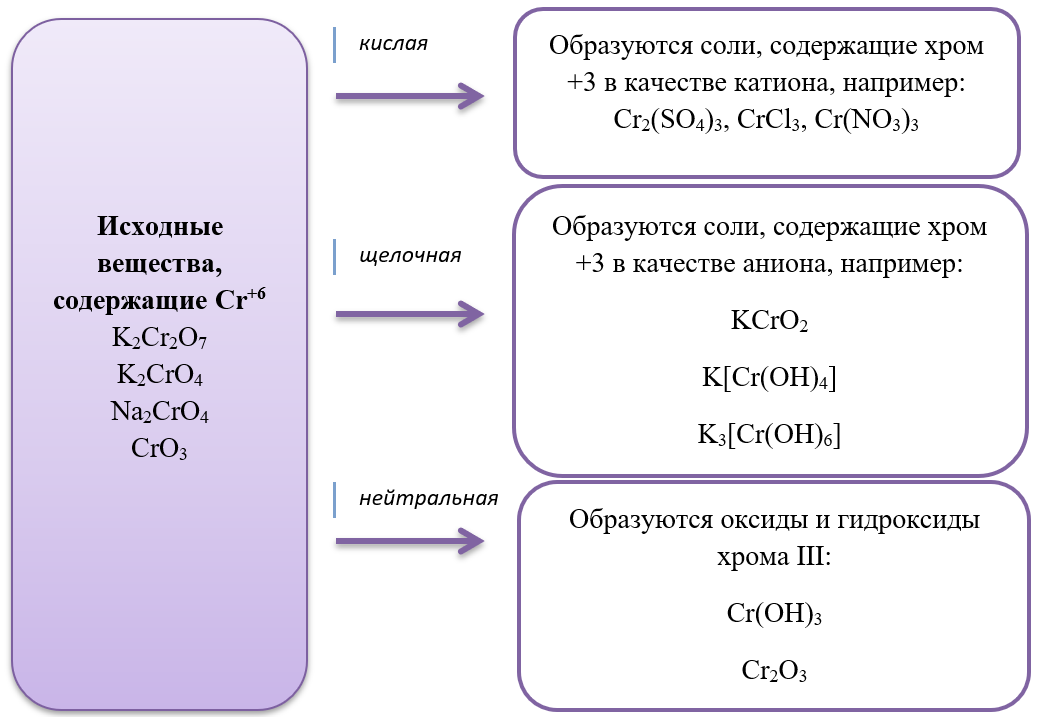
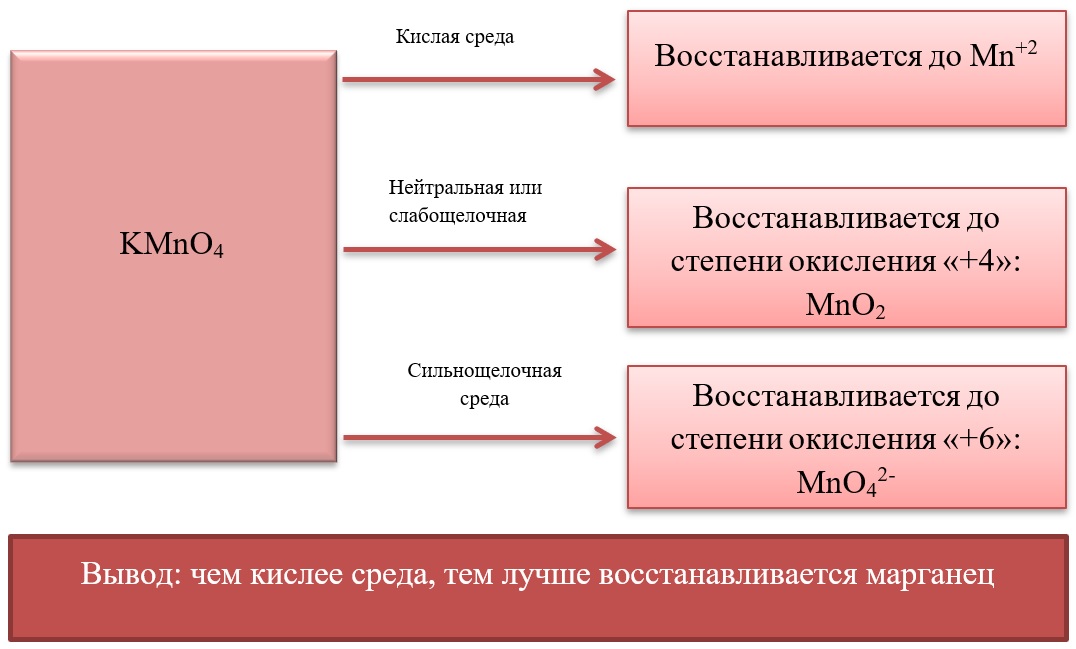
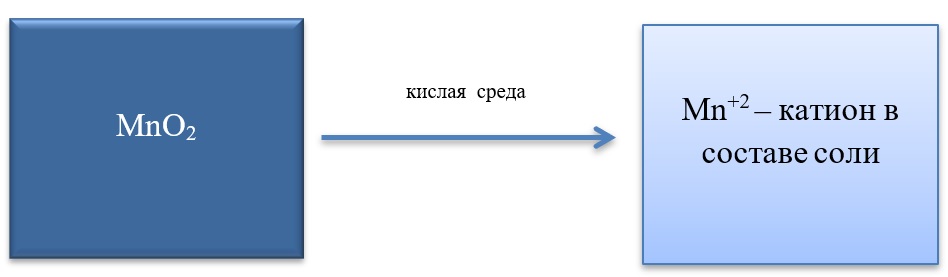
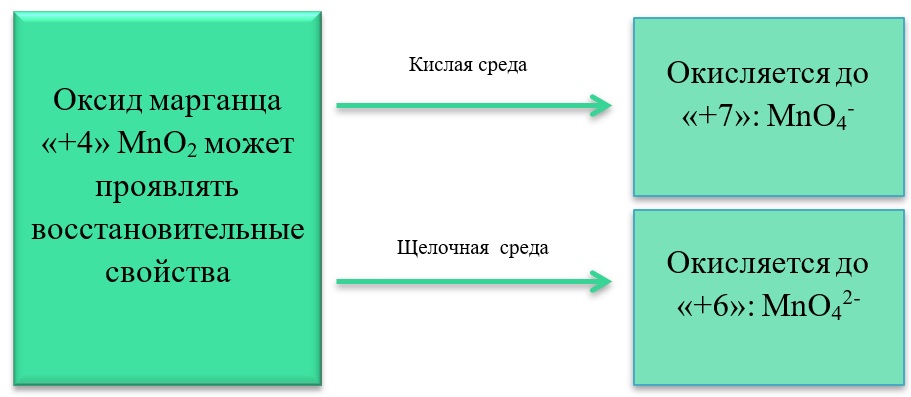
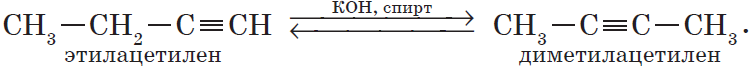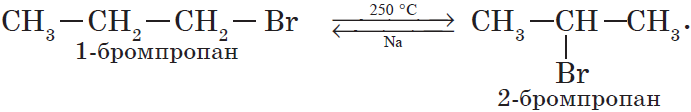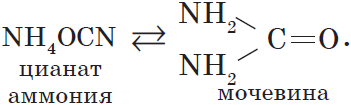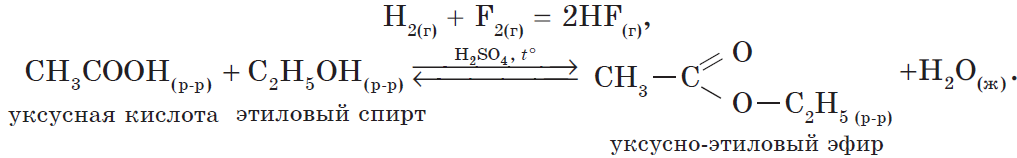Все реакции из заданий 32, которые могут вызвать затруднения при составлении. На ЕГЭ 99% реакций в заданиях 32 будут либо они, либо аналогичные.
1) Si + 2Cl2 SiCl4
2) SiCl4 + 3H2O H2SiO3 + 4HCl
3) Ca3(PO4)2 + 5C + 3SiO2 2P + 5CO + 3CaSiO3
4) Ca3N2 + 6H2O 3Ca(OH)2 + 2NH3↑
5) 2NH3 + 3CuO 3Cu + 3H2O + N2↑
6) Cu + 4HNO3(конц.) Cu(NO3)2 + 2NO2↑ + 2H2O
7) 2Cu(NO3)2 2CuO + 4NO2 + O2↑

2Fe2O3 + 4SO2↑
9) 2H2S + SO2 3S↓ + 2H2O
10) S + 6HNO3 H2SO4 + 6NO2↑ + 2H2O
11) 4Al(NO3)3 2Al2O3 + 12NO2↑ + 3O2↑
12) 2Al2O3 4Al + 3O2↑ (электролиз раствора Al2O3 в расплаве криолита)
13) 3KNO3 + 8Al + 5KOH + 18H2O 3NH3↑ + 8K[Al(OH)4]
14) CrO3 + 2KOH K2CrO4 + H2O
15) 2K2CrO4 + H2SO4 K2Cr2O7 + K2SO4 + H2O
16) 14HBr + K2Cr2O7 2CrBr3 + 3Br2 + 7H2O + 2KBr
17) H2S + Br2 S↓ + 2HBr
18) 3Mg + N2 Mg3N2
19) Mg3N2 + 6H2O 3Mg(OH)2↓ + 2NH3↑
20) Cr2(SO4)3 + 6NH3 + 6H2O 2Cr(OH)3↓ + 3(NH4)2SO4
21) 2Cr(OH)3 + 4KOH + 3H2O2 2K2CrO4 + 8H2O
22) 2Ag + 2H2SO4(конц.) Ag2SO4 + SO2↑ + 2H2O
23) 2KClO3 2KCl + 3O2↑ (в присутствии кат-ра)
24) 3Fe + 2O2 Fe3O4
25) Fe3O4 + 8HCl FeCl2 + 2FeCl3 + 4H2O
26) 6FeCl2 + 14HCl + K2Cr2O7 6FeCl3 + 2CrCl3 + 2KCl + 7H2O
27) 2Na + H2 2NaH
28) NaH + H2O NaOH + H2↑
29) 2NO2 + 2NaOH NaNO2 + NaNO3 + H2O
30) 2Al + 2NaOH + 6H2O 2Na[Al(OH)4] + 3H2↑
31) Cu + 2H2SO4 CuSO4 + SO2↑ + 2H2O
32) 2CuSO4 + 4KI 2CuI↓ + I2↓ + 2K2SO4
33) 2NaCl + 2H2O H2↑ + Cl2↑ + 2NaOH (электролиз раствора)
34) Fe2O3 + 6HI 2FeI2 + I2↓ + 3H2O
35) Na[Al(OH)4] + CO2 NaHCO3 + Al(OH)3↓
36) Al2O3 + Na2CO3 (тв.) 2NaAlO2 + CO2↑ (сплавление)
37) Al4C3 + 12HBr 4AlBr3 + 3CH4↑
38) 2AlBr3 + 3K2SO3 + 3H2O 2Al(OH)3↓ + 3SO2↑ + 6KBr
39) 3SO2 + K2Cr2O7 + H2SO4 K2SO4 + Cr2(SO4)3 + H2O
40) Zn + 2KOH + 2H2O K2[Zn(OH)4] + H2↑
41) K2[Zn(OH)4] K2ZnO2 + 2H2O
42) K2ZnO2 + 4HCl 2KCl + ZnCl2 + 2H2O
43) HI + KHCO3 KI + H2O + CO2↑
44) 6KI + K2Cr2O7 + 7H2SO4 4K2SO4 + 3I2↓ + Cr2(SO4)3 + 7H2O
45) 2AlI3 + 3Na2S + 6H2O 2Al(OH)3↓ + 3H2S↑ + 6NaI
46) Fe3O4 + 10HNO3 3Fe(NO3)3 + NO2↑ + 5H2O
47) Fe2O3 + Fe 3FeO
48) 2Na + O2 Na2O2 (горение)
49) Na2O2 + 4HCl 2NaCl + 2H2O + Cl2↑
50) 3Cl2 + 10KOH + Cr2O3 2K2CrO4 + 6KCl + 5H2O
51) K2CrO4 + BaCl2 BaCrO4↓ + 2KCl
52) 2Cu(NO3)2 + 2H2O 2Cu + O2↑ + 4HNO3 (электролиз раствора)
53) 6KOH + 3S K2SO3 + 2K2S + 3H2O
54) 6KHCO3 + Fe2(SO4)3 2Fe(OH)3↓ + 3K2SO4 + 6CO2↑
55) KH + H2O KOH + H2↑
56) K2ZnO2 + 2H2SO4 K2SO4 + ZnSO4 + 2H2O
57) FeSO4 + 2NH3 + 2H2O Fe(OH)2↓ + (NH4)2SO4
58) Fe(OH)2 + 4HNO3(конц.) Fe(NO3)3 + NO2↑ + 3H2O
59) 2Fe(NO3)3 + 3K2CO3 + 3H2O 2Fe(OH)3↓ + 3CO2↑ + 6KNO3
60) 4NO2 + 2Ca(OH)2 Ca(NO3)2 + Ca(NO2)2 + 2H2O
61) 3Ca + 2P Ca3P2
62) Ca3P2 + 6H2O 3Ca(OH)2 + 2PH3↑
63) PH3 + 8NaMnO4 + 11NaOH 8Na2MnO4 + Na3PO4 + 7H2O
64) Na2MnO4 + Na2SO3 + H2O MnO2↓ + Na2SO4 + 2NaOH
65) P + 5HNO3 H3PO4 + 5NO2↑ + H2O
66) 4Zn + 2NO2 4ZnO + N2↑
67) 2NaNO3 2NaNO2 + O2↑
68) NaNO2 + NH4I NaI + N2↑ + 2H2O
69) 2NaI + H2O2 + H2SO4 Na2SO4 + I2↓ + 2H2O
70) 3I2 + 6NaOH(р−р) NaIO3 + 5NaI + 3H2O
71) H2O2 + Ag2O 2Ag↓ + O2↑ + H2O
72) 2ZnS + 3O2 2ZnO + 2SO2↑
73) Na2[Zn(OH)4] Na2ZnO2 + 2H2O
74) 3Cu2O + Na2Cr2O7 + 10H2SO4 6CuSO4 + Cr2(SO4)3 + Na2SO4 + 10H2O
75) NaHCO3 + NaOH Na2CO3 + H2O
76) K2Cr2O7(тв.) + 14HCl(конц.) 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
77) 3NaNO2 + 2KMnO4 + H2O 2MnO2↓ + 2KOH + 3NaNO3
78) MnO2 + 4HCl(конц.) MnCl2 + Cl2↑ + 2H2O
79) 2Fe(OH)3 + 6HI 2FeI2 + I2↓ + 6H2O
80) 3Na2CO3 + 2CrBr3 + 3H2O 2Cr(OH)3↓ + 6NaBr + 3CO2↑
81) 5FeCl2 + KMnO4 + 8HCl 5FeCl3 + MnCl2 + KCl + 4H2O
82) K2SiO3(р—р) + 2H2O + 2CO2 H2SiO3↓ + 2KHCO3
83) Ba(OH)2 + 2NaHCO3 = Na2CO3 + BaCO3↓ + 2H2O (при избытке NaHCO3)
либо
Ba(OH)2 + NaHCO3 = BaCO3 + NaOH + H2O (при избытке Ba(OH)2)
84) 6KOH + 3Cl2 KClO3 + 5KCl + 3H2O
85) Cr2O3 + KClO3 + 4KOH 2K2CrO4 + KCl + 2H2O
86) 4NH3 + 5O2 4NO + 6H2O (кат. Pt, Cr2O3, t, p)
87) 2NO + O2 2NO2
88) NaNO2 + 2KMnO4 + 2KOH 2K2MnO4 + NaNO3 + H2O
89) 8KI(тв.) + 9H2SO4(конц.) 8KHSO4 + 4I2↓ + H2S↑ + 4H2O
90) Al2O3 + 2NaOH + 3H2O 2Na[Al(OH)4]
91) Na[Al(OH)4] + 4HNO3 NaNO3 + Al(NO3)3 + 4H2O
92) 2Ca(OH)2 + 4NO2 + O2 2Ca(NO3)2 + 2H2O
93) K[Al(OH)4] + SO2 KHSO3 + Al(OH)3↓
94) 8KOH + PCl5 K3PO4 + 5KCl + 4H2O
95) 2KBr(тв) + 2H2SO4(конц., гор.) K2SO4 + Br2 + SO2↑ + 2H2O
96) 3Br2 + 6KOH 5KBr + KBrO3 + 3H2O
97) Br2 + K2SO3 + 2NaOH 2NaBr + K2SO4 + H2O
98) Fe2O3 + 6HI 2FeI2 + I2 + 3H2O
99) Fe2O3 + 2NaOH(тв.) 2NaFeO2 + H2O (сплавление)
100) 4NO2 + O2 + 2H2O 4HNO3
101) NaFeO2 + 4HNO3(изб.) NaNO3 + Fe(NO3)3 + 2H2O
102) FeO + 4HNO3(конц.) Fe(NO3)3 + NO2↑ + 2H2O
103) Ca2Si + 4H2O 2Ca(OH)2 + SiH4↑
104) 3Na2SO3 + Na2Cr2O7 + 4H2SO4 Cr2(SO4)3 + 4Na2SO4 + 4H2O
105) 4Mg + 5H2SO4(конц.) 4MgSO4 + H2S↑ + 4H2O
106) CuS + 10HNO3 Cu(NO3)2 + H2SO4 + 8NO2 + 4H2O
либо (одинаково верно)
CuS + 8HNO3(конц.) CuSO4 + 8NO2↑ + 4H2O
107) 3Cu + 8HNO3(разб.) 3Cu(NO3)2 + 2NO↑ + 4H2O
108) 2Cu(NO3)2 + 2H2O 2Cu↓ + O2↑ + 4HNO3 (электролиз раствора)
109) Cu2O + 3H2SO4(конц.) 2CuSO4 + SO2↑ + 3H2O
110) 2NaI + 2NaMnO4 I2↓ + 2Na2MnO4 (в щелочном растворе)
111) 2Na2O2 + 2CO2 2Na2CO3 + O2
112) 8NaOH(р-р, изб.) + Al2S3 2Na[Al(OH)4] + 3Na2S
113) 4Ca + 5H2SO4(конц.) H2S↑ + 4CaSO4↓ + 4H2O
114) 2Fe(OH)2 + H2O2 2Fe(OH)3
115) Na2O2 + 2H2O(хол.) H2O2 + 2NaOH
116) Ag2S + 10HNO3(конц.) = 2AgNO3 + H2SO4 + 8NO2 + 4H2O
либо (одинаково верно)
Ag2S + 8HNO3 → Ag2SO4 + 8NO2 + 4H2O
Реакции, которые встречаются в ЕГЭ по химии
Подготовили список реакций, которые часто встречаются и в первой, и во второй части ЕГЭ по химии! Не забывай, что без коэффициентов реакции не засчитываются и баллы не ставятся, поэтому обрати на них особое внимание!

Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter. Мы обязательно поправим!
Вам также будет интересно
Что такое ДЕТАЛЬ?
🔎 На самом деле деталь — это важный элемент, который может сказать о литературном персонаже или…
Социальный конфликт
У социального конфликта существует огромное множество определений, но мы попытаемся сформулировать…
Критерии вида
1️⃣ С самого начала нам рассказывают, где живёт эта мышка, то есть ареал её обитания. Вам всегда…
0 комментария
Авторизуйтесь, чтобы оставить комментарий.
-
Главная
-
Теория ЕГЭ
-
Химия — теория ЕГЭ
-
Неорганические реакции в ЕГЭ по химии
Неорганические реакции в ЕГЭ по химии
- 20.01.2020
Сборник неорганических реакций из реальных заданий ЕГЭ прошлых лет (по химии).
Собрано более 100 реакций, а также правильных ответов к ним.
Ценность в том, что задания взяты именно из реальных кимов ЕГЭ.
- Другая теория по химии для ЕГЭ
Смотреть в PDF:
Или прямо сейчас: cкачать в pdf файле.
Сохранить ссылку:
Комментарии (0)
Добавить комментарий
Добавить комментарий
Комментарии без регистрации. Несодержательные сообщения удаляются.
Имя (обязательное)
E-Mail
Подписаться на уведомления о новых комментариях
Отправить
100 ОВР, котрые помогут учащимся при сдаче ЕГЭ по химии.
1) 2KMnO4 + 3MnSO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4
2) 2KMnO4 + 16HCl = 2MnCl2 + 5Cl2 + 8H2O + 2KCl
3) 5NaNO2 + 2KMnO4 + 3H2SO4 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
4) 10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
5) 2KMnO4 + 5H2S + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O
6) 2KMnO4 + 5Na2SO3 + 3H2SO4 = MnSO4 + K2SO4 + 5Na2SO4 + 3H2O
7)SO2 + 2KMnO4 + 4KOH = K2SO4 + 2K2MnO4 + 2H2O

9) K2Cr2O7 + 3NaNO2 + 4H2SO4 = 3NaNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
10) K2Cr2O7 + 6KI + 7H2SO4 = 3I2 + Cr2(SO4)3 + 4K2SO4 + 7H2O
11) 4Mg + 10HNO3(оч.разб.) = 4Mg(NO3)2 + NH4NO3 + 3H2O
12) Cr2(SO4)3 + 3Br2 + 16NaOH = 6NaBr + 2Na2CrO4 + 3Na2SO4 + 8H2O
13)Al2S3 + 30HNO3(конц.) = 2Al(NO3)3 + 3H2SO4 + 24NO2 + 12H2O
14) 6FeSO4 + 2HNO3 + 3H2SO4 = 3Fe2(SO4)3 + 2NO + 4H2O
15) FeCl2 + 4HNO3(конц.) = Fe(NO3)3 + 2HCl + NO2 + H2O
16) AlP + 11HNO3(конц.) = H3PO4 + 8NO2 + Al(NO3)3 + 4H2O
17) 6FeSO4 + KClO3 + 3H2SO4 = 3Fe2(SO4)3 + KCl + 3H2O
18) 3MnSO4 + 2KClO3 + 12KOH = 3K2MnO4 + 2KCl + 3K2SO4 + 6H2O
19) 2Al + K2Cr2O7 + 7H2SO4 = Al2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
20) 3P2O3 + 2HClO3 + 9H2O = 6H3PO4 + 2HCl
21) Cr2(SO4)3 + 6KMnO4 + 16KOH = 2K2CrO4 + 6K2MnO4 + 3K2SO4 + 8H2O
22) Cr2O3 + 3KNO3 + 4KOH = 2K2CrO4 + 3KNO2 + 2H2O
23) 2NaNO2 + 2NaI + 2H2SO4 = 2NO + I2 + 2Na2SO4 + 2H2O
24) 8KI + 9H2SO4(конц.) = 4I2 + H2S + 8KHSO4 + 4H2O
25) Cu + 2FeCl3 = CuCl2 + 2FeCl2
26) 3PH3 + 4HClO3 = 3H3PO4 + 4HCl
27) 3NO2 + H2O = NO + 2HNO3
28) I2 + K2SO3 + 2KOH = 2KI + K2SO4 + H2O
29) 2NH3 + 3KClO = N2 + 3KCl + 3H2O
30) 6P + 5HClO3 + 9H2O = 5HCl + 6H3PO4
31) 3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
32) Ca(ClO)2 + 4HCl = CaCl2 + 2Cl2 + 2H2O
33) 3H2S + HClO3 = 3S + HCl + 3H2O
34) Fe2(SO4)3 + 2KI = 2FeSO4 + I2 + K2SO4
35) 2KMnO4 + KI + H2O = 2MnO2 + KIO3 + 2KOH
36) I2 + 10HNO3(конц.) = 2HIO3 + 10NO2 + 4H2O
37) 3As2S3 + 28HNO3 + 4H2O = 6H3AsO4 + 28NO + 9H2SO4
38) 4Mg + 5H2SO4(конц.) = 4MgSO4 + H2S + 4H2O
39) MnO2 + 2KBr + 2H2SO4 = MnSO4 + Br2 + K2SO4 + 2H2O
40) 5HCOH + 4KMnO4 + 6H2SO4 = 5CO2 + 2K2SO4 + 4MnSO4 + 11H2O
41) 3KNO2 + 2KMnO4 + H2O = 3KNO3 + 2MnO2 + 2KOH
42) NaClO + 2KI + H2SO4 = I2 + NaCl + K2SO4 + H2O
43) 2KNO3 + 6KI + 4H2SO4 = 2NO + 3I2 + 4K2SO4 + 4H2O
44) 14HCl + K2Cr2O7 = 3Cl2 + 2CrCl3 + 2KCl + 7H2O
45) 2Cr(OH)3 + 3Cl2 + 10KOH = 2K2CrO4 + 6KCl + 8H2O
46) K2MnO4 + 8HCl = MnCl2 + 2Cl2 + 2KCl + 4H2O
47) K2Cr2O7 + 3Na2SO3 + 4H2O = 2Cr(OH)3 + 3Na2SO4 + 2KOH
48) 2KMnO4 + 10KBr + 8H2SO4 = 2MnSO4 + 5Br2 + 6K2SO4 + 8H2O
49) 4Zn + KNO3 + 7KOH = NH3 + 4K2ZnO2 + 2H2O
50) 2Fe(OH)3 + 3Br2 + 10KOH = 2K2FeO4 + 6KBr + 8H2O
51) P2O3 + 6KOH + 2NO2 = 2NO + 2K3PO4 + 3H2O
52) 2KMnO4 + 2NH3 = 2MnO2 + N2 + 2KOH + 2H2O
53) 3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 + 2KOH
54) 3NaNO2 + Na2Cr2O7 + 8HNO3 = 5NaNO3 + 2Cr(NO3)3 + 4H2O
55) B + HNO3(конц.) + 4HF = NO + HBF4 + 2H2O
56) 2CuCl2 + SO2 + 2H2O = 2CuCl + 2HCl + H2SO4
57) PH3 + 8AgNO3 + 4H2O = 8Ag + H3PO4 + 8HNO3
58) 2NH3 + 6KMnO4 + 6KOH = N2 + 6K2MnO4 + 6H2O
59) 5Zn + 2KMnO4 + 8H2SO4 = 5ZnSO4 + 2MnSO4 + K2SO4 + 8H2O
60) 3KNO2 + K2Cr2O7 + 8HNO3 = 5KNO3 + 2Cr(NO3)3 + 4H2O
61) FeS + 12HNO3(конц.) = Fe(NO3)3 + H2SO4 + 9NO2 + 5H2O
62) KIO3 + 5KI + 3H2SO4 = 3I2 + 3K2SO4 + 3H2O
63) 2NaCrO2 + 3Br2 + 8NaOH = 2Na2CrO4 + 6NaBr + 4H2O
64) Fe2(SO4)3 + Na2SO3 + H2O = 2FeSO4 + Na2SO4 + H2SO4
65) 3P2O3+ 2H2Cr2O7 + H2O = 2H3PO4 + 4CrPO4
66) 3Si + 4HNO3 + 18HF = 3H2SiF6 + 4NO + 8H2O
67) 5Na2SO3(нед.) + 2KIO3 + H2SO4 = I2 + K2SO4 + 5Na2SO4 + H2O
68) 2CrBr3 + 3H2O2 + 10NaOH = 2Na2CrO4 + 6NaBr + 8H2O
69) 8 KMnO4 + 5 PH3 + 12H2SO4 = 5H3PO4 + 8MnSO4 + 4K2SO4 + 12H2O
70) 3SO2 + K2Cr2O7 + H2SO4 = K2SO4 + Cr2(SO4)3 + H2O
71) 3P2O3 + 4HNO3 + 7H2O = 6H3PO4 + 4NO
72) 2NO + 3KClO + 2KOH = 2KNO3 + 3KCl + H2O
73) 5PH3 + 8KMnO4 + 12H2SO4 = 5H3PO4 + 4K2SO4 + 8MnSO4 + 12H2O
74) 5AsH3 + 8KMnO4 + 12H2SO4 = 5H3AsO4 + 4K2SO4 + 8MnSO4 + 12H2O
75) 2CuI + 4H2SO4(конц.) = 2CuSO4 + I2 + 4H2O + 2SO2
76) Si + 2KOH + H2O = K2SiO3 + 2H2 (to)
77) B + 3HNO3 = H3BO3 + 3NO2
78) 8NH3 + 3Br2 = N2 + 6NH4Br
79) P4 + 3KOH + 3H2O = PH3 + 3KH2PO2
80) Al2O3 + 3C + 3Cl2 = 2AlCl3 + 3CO(to)
81) H2S + HClO = S + HCl + H2O
82) 5KNO3(расплав) + 2P = 5KNO2 + P2O5
83) I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl
84) H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl
85) 8Zn + 5H2S2O7 = 8ZnSO4 + 2H2S + 3H2O
86) 2FeCl3 + 3Na2S = 2FeS + S + 6NaCl
87) Na2S + 8NaNO3 + 9H2SO4 = 10NaHSO4 + 8NO2 + 4H2O
88) Cr2O3 + 3NaNO3 + 2Na2CO3 = 2Na2CrO4 + 3NaNO2 + 2CO2
89) 5C + Ca3(PO4)2 + 3SiO2 = 2P + 5CO + 3CaSiO3 (to)
90) 2NaI + H2O2 + H2SO4 = Na2SO4 + I2 + 2H2O
91) 14HBr + K2Cr2O7 = 2CrBr3 + 3Br2 + 7H2O + 2KBr
92) 2NH3 + 2KMnO4(тв.) = N2 + 2MnO2 + 2KOH + 2H2O (to)
93) 2FeCl3 + SO2 + 2H2O = 2FeCl2 + H2SO4 + 2HCl
94) 2HMnO4 + 5H2S + 2H2SO4 = 5S + 2MnSO4 + 8H2O
95) 3KNO3 + 8Al + 5KOH + 18H2O = 3NH3 + 8K[Al(OH)4]
96) 5H2O2 + 2KMnO4 + 3H2SO4 = 5O2 + 2MnSO4 + K2SO4 + 8H2O
97) P4 + 20HNO3 = 4H3PO4 + 20NO2 + 4H2O
98) 3NaClO + 4NaOH + Cr2O3 = 2Na2CrO4 + 3NaCl + 2H2O
99) Na2SO3 + 2KMnO4 + 2KOH = 2K2MnO4 + Na2SO4 + H2O
100) Cr2(SO4)3 + 3H2O2 + 10NaOH = 2Na2CrO4 + 3Na2SO4 +8H2O
Материал по химии
- Какие реакции нужно знать, чтобы решить ЕГЭ по химии?
- 1) Взаимодействие металлов с кислородом
- 2) Взаимодействие металлов с водой
- 3) Амфотерные металлы
- 4) Амфотерные оксиды и гидроксиды
- 5) Комплексные соли
- 6) Амфотерные соли
- 7) Углерод на ЕГЭ
-
Азот на ЕГЭ
- 9) Фосфор на ЕГЭ
- 10) Сера на ЕГЭ
- 11) Замещение неметаллов
- 12) Взаимодействие неметаллов с другими неметаллами
- 13) Медь и её соединения
- 14) Серебро и его соединения
- 15) Хром и его соединения
- 16) Железо и его соединения
- 17) Соединения марганца
- 18) Неметаллы с щелочами
- 19) Кислотные оксиды с щелочами
- 20) Гидриды, фосфиды, нитриды, сульфиды, карбиды
- 21) Гидролиз бинарных соединений с ковалентной полярной связью
- 22) Взаимный гидролиз
В данном материале мы рассмотрим только те реакции неорганической химии, что выходят за пределы свойств классов (солей, кислот, оксидов, оснований) и часто встречаются в 8 задании. В материале Вы познакомитесь с самыми популярными реакциями, которые встречаются на экзамене.
Какие реакции нужно знать, чтобы решить ЕГЭ по химии?
1) Взаимодействие металлов с кислородом
- Натрий, как и другие щелочные металлы (кроме лития), а также барий, при взаимодействии с кислородом образуют пероксиды или надпероксиды:
2Na + O2 = Na2O2
Причем, для натрия более характерен пероксид, а для калия – надпероксид:
K + O2 = KO2
- Пероксиды реагируют с холодной и горячей водой по-разному: с холодной водой происходит реакция обмена:
Na2O2 + 2H2O = 2NaOH + H2O2
В горячей воде происходит окислительно-восстановительная реакция:
2Na2O2 + H2O = 4NaOH + O2↑
2) Взаимодействие металлов с водой
Основные продукты при взаимодействии металлов с водой можно представить в виде следующей схемы:
Задание 8 ЕГЭ по химии
- Активные металлы, такие как натрий, калий, кальций, легко реагируют с водой, вытесняя водород. Реакции относятся к экзотермическим (проходят с выделением большого количества тепла), натрий и калий так активно реагируют с водой, что при контакте происходит их возгорание.
2Na + 2H2O = 2NaOH + H2↑
- Магний и алюминий тоже образуют гидроксиды, но для реакции необходимо нагревание. Алюминий берут в виде амальгамы.
Mg + 2H2O = Mg(OH)2 + H2↑
- Металлы средней активности требуют нагревания для взаимодействия с водой, при этом образуется оксид, а не гидроксид:
Zn + H2O = ZnO + H2↑
- Железо при взаимодействии с водой образует окалину (смесь оксида железа II и оксида железа III):
3Fe + 4H2O = Fe3O4 + 4H2
- На влажном воздухе железо превращается в бурый гидроксид железа III:
2Fe + 3H2O + 3O2 = 2Fe(OH)3
Задание в формате ЕГЭ с ответом:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- K + H2O →
- K2O + H2O →
- K + O2 →
- K2O2 + H2Oхолод. →
- KOH
- K2O
- KOH + H2O2
- KOH + H2
- KO2
Пример задания из КИМ ЕГЭ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Ba + O2 →
- BaO + H2O →
- Ba + H2O →
- BaO2 + H2O (горяч.) →
- Ba(OH) 2 + O2
- BaO2
- Ba(OH) 2
- BaO
- Ba(OH) 2 + H2
От активности металла зависит продукт реакции
3) Амфотерные металлы
Алюминий, цинк и бериллий отличаются от других металлов тем, что могут вступать во взаимодействие с концентрированными растворами щелочей, понятие «амфотерные металлы» использовано для облегчения поиска, такое понятие не совсем верно.
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2
4) Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды реагируют с концентрированными растворами щелочей, причем продукт зависит от агрегатного состояния исходной щелочи: если она твердая, то применяют сплавление и образуется средняя соль, если же щелочь дана в растворенном виде, то образуется комплексная соль. Эти различия очень часто встречаются в задании 8 на ЕГЭ по химии!
- При сплавлении:
Al2O3 + 2NaOH = 2NaAlO2 + H2O↑
Al(OH)3 + NaOH = NaAlO2 + 2H2O↑
- При растворении в концентрированной щелочи:
BeO + 2KOH + H2O = K2[Be(OH)4]
Be(OH)2 + 2KOH = K2[Be(OH)4]
Можно брать любую щелочь и любой амфотерный оксид или гидроксид.
- Амфотерные оксиды, при сплавлении с солями, вытесняют летучие кислотные оксиды:
Na2CO3 + Al2O3 = 2NaAlO2 + CO2↑
K2SO3 + ZnO = K2ZnO2 + SO2↑
Задание по образцу ФИПИ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Be + KOH р-р →
- BeO + KOH р-р →
- BeO + KOH тв. →
- Be(OH) 2 + KOH тв. →
- K2 [Be(OH) 4] + H2O
- K2 [Be(OH) 4] + H2
- K2O + Be(OH) 2
- K2 [Be(OH) 4]
- K2BeO2 + H2O
5) Комплексные соли
- Комплексные соли разлагаются при нагревании с потерей воды:
Na[Al(OH)4] = NaAlO2 + 2H2O
K2[Zn(OH)4] = K2ZnO2 + 2H2O
- Комплексные соли реагируют с сильными кислотами в двух вариантах (при избытке и при недостатке кислоты):
Na[Al(OH)4] + HCl = NaCl + H2O + Al(OH)3↓ (при недостатке кислоты)
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + 4H2O (при избытке кислоты)
- Комплексные соли реагируют со слабыми кислотами и летучими кислотными оксидами, получаемые сульфиды, карбонаты, сульфиты алюминия неустойчивы, поэтому вместо них записывают гидроксид амфотерного металла:
2Na[Al(OH)4] + H2S = Na2S + 2Al(OH)3 + 2H2O (при недостатке сероводородной кислоты)
Na[Al(OH)4] + H2S = NaHS + Al(OH)3 + H2O (при избытке сероводородной кислоты)
2Na[Al(OH)4] + CO2 = Na2CO3 + 2Al(OH)3 + H2O (при недостатке углекислого газа)
Na[Al(OH)4] + CO2 = NaHCO3 + Al(OH)3 (в условиях избытка углекислого газа)
Попробуйте решить задание ЕГЭ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Na2 [Zn(OH) 4] нагревание →
- Na2 [Zn(OH) 4] + H2S изб. →
- Na2 [Zn(OH) 4] + H2S нед. →
- NaOH тв. + Zn(OH) 2 →
- NaHS + ZnS + H2O
- Na2S + Zn(OH) 2 + H2O
- Na2ZnO2 + H2O
- Na2S + Zn + H2O
- Na2ZnO2 + H2
6) Амфотерные соли
Термин «амфотерные соли» некорректен, однако за последний месяц было более четырех тысяч запросов с таким сочетанием слов, под амфотерными солями школьник понимает соли, в анионе которого стоит амфотерный металл, а также комплексные соли, описанные выше. На самом деле, соли в которых амфотерный металл принадлежит аниону следует относить к самым обычным средним солям. Рассмотрим свойства некоторых из них, например, цинката натрия (Na2ZnO2) и алюмината калия (KAlO2).
- Реагируют с сильными кислотами:
Na2ZnO2 + 4HCl = 2NaCl + ZnCl2 + 2H2O
2KAlO2 + 4H2SO4 = K2SO4 + Al2(SO4)3 + 4H2O
Б) Растворяются в воде с образованием соответствующей комплексной соли:
KAlO2 + 2H2O = K[Al(OH)4]
- Также под амфотерными солями школьники подразумевают соли, содержащие в катионе металл в третьей валентности (что тоже является неверным, это средние соли) или цинк и бериллий, такие соли могут по-разному реагировать с растворами щелочей, например:
AlCl3 + 3NaOH = 3NaCl + Al(OH)3 (недостаток щелочи, разбавленный раствор щелочи)
AlCl3 + 4NaOH = NaCl + Na[Al(OH)4] (избыток щелочи, концентрированный раствор щелочи)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Na2BeO2 + H2SO4 →
- Na2 [Be(OH) 4] + H2SO4 изб. →
- Na2 [Be(OH) 4] + H2SO4 нед. →
- Na2BeO2 + H2O →
- Na2SO4 + BeSO4 + H2O
- Na2SO4 + Be(OH) 2
- Na2SO4 + Be(OH) 2 + H2O
- Na2 [Be(OH) 4]
- NaOH + BeSO4 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- AlCl3 + KOH разб. →
- AlCl3 + K2CO3 р-р →
- AlCl3 + KOH конц. →
- Al2O3 + K2CO3 тв. →
- Al(OH) 3 + KCl
- KCl + KAlO2 + H2O
- KAlO2 + CO2
- K[Al(OH) 4] + KCl
- Al(OH) 3 + KCl + CO2
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Ba(OH) 2 нед. + AlCl3 →
- Ba(OH) 2 изб. + AlCl3 →
- Ba(AlO2)2 + HCl →
- Ba[Al(OH) 4]2 + HCl изб. →
- Ba(OH) 2 + AlCl3 + H2O
- BaCl2 + Ba[Al(OH) 4]2
- BaCl2 + AlCl3 + H2O
- BaCl2 + Al(OH) 3 + H2O
- BaCl2 + Al(OH) 3
7) Углерод на ЕГЭ
В задании 8 часто встречаются гидрокарбонаты, рассмотрим их важнейшие свойства на примере гидрокарбоната кальция.
Гидрокарбонаты, как и другие кислые соли, при взаимодействии с щелочами, оксидами, солями, кислотами и при нагревании часто превращаются в средние соли.
- Разложение при нагревании:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
- Взаимодействие с щелочами:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O
Ca(HCO3)2 + 2NaOH → CaCO3 + Na2CO3 + 2H2O
- Взаимодействие с кислотами:
Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 + 2H2O
- Реакция с карбонатами. Эти реакции идут с образованием кислых солей, необходимый для их образования водород поступает из воды, поэтому составители используют такие обозначения как CO2 р-р или CaCO3 влажн., реакция идет по следующей схеме:
CaCO3 + CO2 + H2O → Ca(HCO3)2
- Углекислый газ
Восстановление углерода активными металлами и углеродом:
CO2 + 2Mg → 2MgO + C
CO2 + C → 2CO
- Реакции с монооксидом углерода:
- CO или угарный газ – хороший восстановитель, реагирует с окислителями:
CO + CuO = CO2 + Cu
CO + Cl2 = COCl2
CO + Br2 = COBr2
2CO + O2 = 2CO2
- Монооксид углерода проявляет и окислительные свойства:
СO + H2 = CH3OH
- Вступает в реакции без изменения степени окисления:
CO + NaOHтв. = HCOONa (при сплавлении)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- KHCO3 + Ca(OH) 2 →
- Mg(HCO3)2 + H2CrO4 →
- MgCO3 + H2CrO4 →
- Ca(HCO3)2 + KOH →
- Cr2O3 + MgCO3 + H2O
- KOH + Ca(HCO3)2
- CaCO3 + K2CO3 + H2O
- MgCrO4 + H2O + CO2
- CaO + K2CO3 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Mg + CO2 →
- MgO + CO2 →
- Mg(HCO3)2 + NaOH →
- MgCl2 + Na2CO3 →
- MgO + C
- MgCO3
- Mg + CO
- MgCO3 + Na2CO3 + H2O
- MgCO3 + NaCl
 Азот на ЕГЭ
Азот на ЕГЭ
Очень популярной в заданиях ЕГЭ по химии является азотная кислота, в отличие от обычных кислот, в качестве окислителя выступает не протон водорода, а азот в высшей степени окисления.
В общем, схему реакции кислоты с металлами можно представить в следующем виде:
HNO3 + Me → Me+x(NO3)x + H2O + особый продукт
Особые продукты зависят от характера металла, приведем из в виде таблицы:
Таблица – свойства азотной кислоты
|
Реагент |
HNO3 концентрированная |
HNO3 разбавленная |
|
Активные металлы (металлы IA и IIА-группы в таблице Менделеева) |
N2O (редко NO) |
NH4NO3 (редко N2 или NH3) |
|
Неактивные металлы Cu, Ag, Hg |
NO2 |
NO |
|
Cr, Al, Fe |
На холоде реакция не идёт в следствие пассивации, При нагревании образуется NO2, а металл приобретает степень окисления +3 |
NO (редко N2, N2O) |
|
Металлы средней активности (все остальные металлы, например, Zn, Ni, Co) |
NO2 |
NO (редко N2, N2O) |
|
Au, Pt |
Реакция не идет |
Реакция не идет |
- Примеры реакций металлов с азотной кислотой:
4HNO3 разб. + Al = Al(NO3)3 + NO + 2H2O (при любой температуре)
6HNO3 конц. + Al = Al(NO3)3 + 3NO2 + 3H2O (реакция идет только при нагревании)
10HNO3 разб. + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
10HNO3 конц. + 4Mg = 4Mg(NO3)2 + N2O + 5H2O
- C другими восстановителями азотные кислоты ведут себя аналогичным образом: у концентрированной продуктом является NO2, а у разбавленной – NO:
FeO + 4HNO3 конц. = Fe(NO3)3 + NO2 + 2H2O
3FeO + 10HNO3 разб. = 3Fe(NO3)3 + NO + 5H2O
- Азотная кислота реагирует и с неметаллами, например, с серой и углеродом:
6HNO3 конц. + S = H2SO4 + 6NO2 + 2H2O
4HNO3 конц. + С = CO2 + 4NO2 + 2H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- CuO + HNO3 конц. →
- CuO + HNO3 разб. →
- Cu + HNO3 конц. →
- Cu + HNO3 разб. →
- Cu(NO3)2 + H2O + NO2
- CuO + NO2 + O2
- Cu(NO3)2 + H2O
- Cu(NO3)2 + H2O + NO
- CuNO3 + H2O + NO
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- FeO + HNO3 конц. →
- Fe + HNO3 конц. tºC →
- Fe(NO3)2 + HNO3 конц. →
- FeO + HNO3 разб. →
- Fe(NO3)2 + H2O + NO2
- Fe(NO3)3 + H2O + NO2
- Fe(NO3)2 + H2O + NO
- Fe(NO3)3 + H2O + NO
- Fe(NO3)2 + H2O
9) Фосфор на ЕГЭ
- Фосфор выступает в роли окислителя и восстановителя в реакции с щелочами:
4P + 3NaOH + 3H2O → 3NaH2PO2 + PH3↑
Это одна из самых популярных окислительно-восстановительных реакций с фосфором на ЕГЭ по химии.
- оксид фосфора III реагирует с холодными растворами щелочей и водой без изменения степени окисления:
P2O3 + 2KOH + H2O → 2KH2PO3
P2O3 + 3H2O → 2H3PO3 (или HPO2)
- Соединения фосфора III – хорошие восстановители, стремятся превратиться в соединения фосфора V:
P2O3 + окислитель → PO43‒ + продукты восстановления
P2O3 + 4KMnO4 + 10KOH → 2K3PO4 + 4K2MnO4 + 5H2O
P2O3 + 4HNO3 + H2O → 2H3PO4 + 4NO2
- Оксид фосфора V реагирует с водой, образуя ряд кислот:
P2O5 + H2O → 2HPO3 – метафосфорная (в сильном недостатке воды)
P2O5 + 2H2O → H4P2O7 – пирофосфорная (в небольшом недостатке воды)
P2O5 + 3H2O → 2H3PO4 – ортофосфорная (в избытке воды)
- Фосфаты могут образовывать кислые соли, при взаимодействии с фосфорной кислотой:
2K3PO4 + H3PO4 → 3K2HPO4
K3PO4 + 2H3PO4(большой избыток) → 3KH2PO4
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaH2PO4 + NaOH нед. →
- NaH2PO4 + NaOH изб. →
- NaH2PO4 изб. + NaOH →
- NaH2PO4 нед. + NaOH →
- Na3PO4 + H2O
- NaH2PO3 + H2O
- Na3PO4 + P2O5
- NaH2PO2 + H2O
- Na2HPO4 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- P2O5 + H2O нед. →
- P2O3 + KOH →
- P + KOH →
- P2O5 нед. + H2O →
- K2HPO3 + H2O
- KH2PO2 + PH3
- HPO3
- H3PO4
- HPO2
10) Сера на ЕГЭ
Таблица ‒ Серная кислота
|
Свойства |
Разбавленная H2SO4 |
Концентрированная H2SO4 |
|
Окислительные свойства |
Окислитель за счет протона водорода |
Окислитель за счет серы |
|
Активные металлы |
2Na + H2SO4 = Na2SO4 + H2 |
8Na + 5H2SO4 = 4Na2SO4 + 4H2O + H2S↑ |
|
Металлы средней активности |
Zn + H2SO4 = ZnSO4 + H2 |
3Zn + 4H2SO4 = 3ZnSO4 + 4H2O + S↓ (в зависимости от концентрации кислоты может выделиться SO2 или H2S) |
|
Al, Cr, Fe |
Как с другими металлами до водорода: Fe + H2SO4 = FeSO4 + H2 |
На холоде реакция не идет (пассивация), при нагревании: 2Fe + 6H2SO4 = Fe2(SO4)3 + 6H2O + 3SO2 |
|
Металлы средней активности |
Реакция не идет, так как эти металлы не могут вытеснить водород |
Cu + 2H2SO4 = CuSO4 + 2H2O + SO2 |
- Обменная реакция с концентрированной серной кислотой:
NaCl + H2SO4 конц. = NaHSO4 + HCl↑ (при сильном нагревании)
Остальные обменные реакции стандартны и в этом материале рассмотрены не будут.
- Сероводород:
SO2 + 2H2S = 3S↓ + 2H2O
2H2S + 3O2 = 2H2O + 2SO2 (кислород в избытке)
2H2S + O2 = 2H2O + 2S↓ (кислород в недостатке)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- KCl тв. + H2SO4 конц. →
- KI + H2SO4 конц. →
- Fe + H2SO4 конц. tºC →
- FeO + H2SO4 конц. →
- Cl2 + K2SO4 + H2O
- KHSO4 + HI
- KHSO4 + HCl
- I2 + K2SO4 + H2S
- Fe2 (SO4)2 + H2O + SO2
- FeSO4 + H2O
11) Замещение неметаллов
Часто в задании 8 ЕГЭ по химии встречается замещение брома на хлор, или йода на хлор или бром. Галогены могут вытеснять друг друга и другие неметаллы из соединений. Чтобы понимать, какие неметаллы могут вытеснить другие неметаллы, нужно помнить о том, что в ПС Д.И. Менделеева элементы стоят таким образом, что чем правее и выше стоит элемент, тем сильнее проявляются его неметаллические свойства, и тем выше его электроотрицательность. Более электроотрицательные неметаллы могут вытеснять менее электроотрицательные. Так, хлор и бром стоят выше в таблице Менделеева, чем йод, поэтому могут вытеснить его из соединений:
2NaI + Br2 = 2NaBr + I2
2KI + Cl2 = 2KCl + I2
Хлор может вытеснить бром:
2NaBr + Cl2 = 2NaCl + Br2
Йод не может вытеснить другие галогены, так как расположен в ПС ниже хлора, брома и фтора, но йод может вытеснить те элементы-неметаллы, что стоят левее в Периодической системе, например, серу:
H2S + I2 = 2HI + S
Можно использовать ряд электроотрицательности неметаллов, на реальном ЕГЭ его не будет, легче запомнить Периодический закон, тем более что эти знания также нужны для выполнения задания 2 ЕГЭ по химии.
12) Взаимодействие неметаллов с другими неметаллами
Более электроотрицательные неметаллы могут окислить менее электроотрицательные неметаллы. То есть те элементы, которые стоят в ПС выше и правее отнимают электроны у тех неметаллов, которые стоят ниже и левее.
Например, хлор, бром и фтор могут окислить йод, серу, фосфор (наиболее популярные на ЕГЭ реакции). В таблице представлены наиболее популярные продукты:
Таблица – взаимодействие неметаллов
|
Восстановители |
Окислители |
|||||
|
F2 |
Cl2 |
Br2 |
I2 |
O2 |
S |
|
|
I2 |
IF7 IF5 |
ICl5 ICl3 ICl |
IBr5 IBr3 IBr |
‒ |
‒ |
‒ |
|
S |
SF6 |
SCl4 |
SBr4 |
‒ |
SO2 |
‒ |
|
P |
PF5 |
PCl5 PCl3 |
PBr5 PBr3 |
PI3 |
P2O3 P2O5 |
P2S3 P2S5 |
|
Si |
SiF4 |
SiCl4 |
SiBr4 |
SiI4 |
SiO2 |
SiS2 |
|
H2 |
HF |
HCl |
HBr |
HI |
H2O |
H2S |
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- S + O2 →
- SO2 + O2 →
- H2S + SO2 →
- S + P →
- S + H2O
- SO2
- P2S3
- SO3
- S3P2
13) Медь и её соединения
2CuCl2 + 4KI = 2CuI↓ + I2 + 4KCl
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2 – темно-синий комплекс
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH – прозрачный раствор
3CuO + 2NH3 = 3Cu + N2 + 3H2O
14) Серебро и его соединения
AgCl + 2NH3 = [Ag(NH3)2]Cl
8AgNO3 + PH3 + 4H2O = H3PO4 + 8Ag + 8HNO3
15) Хром и его соединения
- Соединения хрома II – хорошие восстановители, при взаимодействии с окислителями превращаются в соединения хрома III
4CrO + O2 = 2Cr2O3
CrO + 4HNO3 = Cr(NO3)3 + 2H2O + NO2
- соединения хрома III проявляют как окислительные, так и восстановительные свойства:
2Na3[Cr(OH)6] + 3Br2 + 4NaOH = 6NaBr + 8H2O + 2Na2CrO4 (хром в степени окисления +3 является восстановителем)
2CrCl3 + H2 = 2CrCl2 + 2HCl (хром в степени окисления +3 является восстановителем)
- Дихроматы – соли, окрашивающие растворы в оранжевый цвет и хроматы – соли желтого цвета устойчивы в разных средах: в кислой среде устойчивы оранжевые дихроматы, а в щелочной – желтые хроматы. В зависимости от среды, они могут взаимно превращаться:
Хромат превращается в дихромат в кислой среде, раствор меняет цвет с желтого на оранжевый.
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Дихромат превращается в хромат в щелочной среде, раствор меняет цвет с оранжевого на желтый.
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
В ЕГЭ по химии стали уже традиционными задания с соединениями хрома, особенно с дихроматами, в основном встречается их окислительно-восстановительные свойства:
16) Железо и его соединения
- Железо реагирует с концентрированной азотной и серной кислотой только при нагревании, с разбавленными кислотами реагирует при нормальных условиях, например:
Fe + 6HNO3 конц = Fe(NO3)3 + 3NO2 + 3H2O (при нагревании)
- Взаимодействие железа с галогенами и галогенводородами:
Таблица – Железо с галогенами и галогеноводородами
|
С галогенами |
С галогенводородом |
|
2Fe + 3Cl2 = 2FeCl3 |
Fe + 2HCl = FeCl2 + H2 |
|
2Fe + 3Br2 = 2FeBr3 |
Fe + 2HBr = FeBr2 + H2 |
|
Fe + I2 = FeI2 |
Fe + 2HI = FeI2 + H2 |
- Соединения двухвалентного железа – хорошие восстановители, с окислителями превращаются в соединения трехвалентного железа:
FeO + 4HNO3 конц = Fe(NO3)3 + NO2 + 2H2O
2FeCl2 + Cl2 = 2FeCl3
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
- Железная окалина – двойной оксид Fe3O4 или FeO·Fe2O3, проявляет как окислительные (за счет оксида железа III), так и восстановительные (за счет железа II) свойства, а также растворяется в кислотах, образуя две соли (железа II и железа III)
Fe3O4 + 4H2SO4 разб. = FeSO4 + Fe2(SO4)3 + 4H2O (оксиды железа растворились в разбавленной серной кислоте без изменения степени окисления)
Fe3O4 + 8KI + 4H2SO4 = 3FeI2 + 4K2SO4 + I2 + 4H2O (железная окалина проявляет окислительные свойства за счет наличия железа III)
Fe3O4 + 10HNO3конц = 3Fe(NO3)3 + NO2 + 5H2O (железная окалина проявляет восстановительные свойства за счет железа II)
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Fe + I2 →
- Fe + Cl2 →
- Fe + HCl →
- Fe + O2 →
- FeI3
- FeCl2
- FeI2
- FeCl3
- FeO
- Fe3O4
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Fe + CuSO4 →
- Fe + H2SO4 р-р →
- Fe + H2SO4 конц. tºC →
- Fe + H2O + O2 →
- FeSO4 + Cu
- FeSO4 + H2
- Fe2(SO4)3 + Cu
- Fe2 (SO4)3 + H2
- Fe2(SO4)3 + SO2 + H2O
- Fe(OH) 3
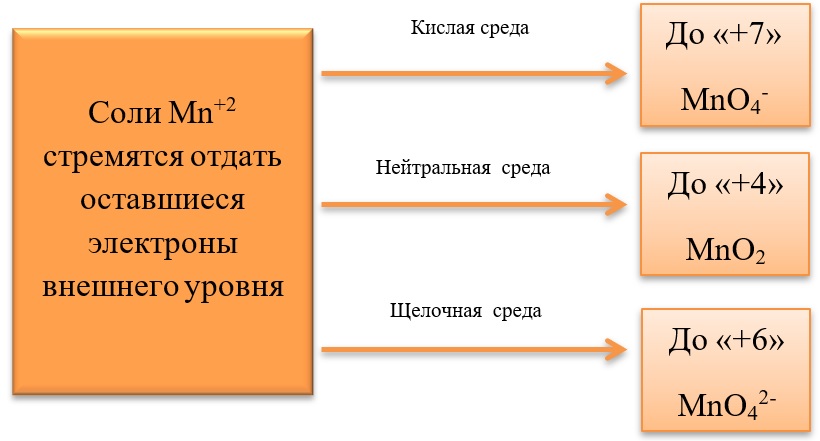
17) Соединения марганца
- Марганец в степени окисления +7 проявляет окислительные свойства. Продукты его восстановления зависят от среды:
Примеры реакция перманганата калия:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2KMnO4 + 6KI + 4H2O = 2MnO2 + 3I2 + 8KOH
2KMnO4 + SO2 + 4KOH = K2SO4 + 2K2MnO4 + 2H2O
- Марганец в степени окисления +4 проявляет как окислительные. Так и восстановительные свойства.
Окислительные свойства чаще проявляет в кислой среде, восстанавливаясь до катиона +2.
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
MnO2 + 2KI + 2H2SO4 = MnSO4 + I2 + K2SO4 + 2H2O
MnO2 + H2O2 + H2SO4 → O2 + MnSO4 + 2H2O
В) Марганец в степени окисления +4 проявляет и восстановительные свойства, окисляясь до +6 в щелочной среде, и до +7 в кислой:
MnO2 + Br2 + 4KOH = K2MnO4 + 2KBr + 2H2O
- Соединения марганца II, например, MnSO4 проявляет как окислительные, так и восстановительные свойства.
Окислительные свойства проявляет в реакциях с более активными металлами, например, с алюминием:
3MnSO4 + 2Al = 3Mn + Al2(SO4)3
Восстановительные свойства проявляет при взаимодействии с типичными окислителями.
2MnSO4 + 5PbO2 + 3H2SO4 = 2HMnO4 + 5PbSO4 + 2H2O
3MnSO4 + 2KMnO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4
3MnSO4 + 2KClO3 + 12KOH = 3K2MnO4 + 2KCl + 3K2SO4 + 6H2O
18) Неметаллы с щелочами
- Галогены с щелочами:
Хлор, бром и йод реагируют с щелочами при разных условиях. На холоде окисления галогена происходит чаще до степени окисления +1 (восстановление в любых условиях происходит до степени окисления ‒1). Описать данную реакцию можно уравнением:
Г2 + 2NaOH = NaГ + NaГO + H2O (вместо гидроксида натрия можно взять любую щелочь, содержащую одновалентный металл: K, Cs, Rb)
2Г2 + 2Ca(OH)2 = CaГ2 + Ca(ГO)2 + 2H2O (вместо гидроксида кальция можно брать гидроксид бария и стронция).
Где Г = I, Cl, Br
Например:
Cl2 + 2NaOH = NaCl + NaClO + H2O
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
При нагревании окисление галогена часто проходит до степени окисления +5:
3Г2 + 6NaOH = 5NaГ + NaГO3 + 3H2O
6Г2 + 6Ca(OH)2 = 5CaГ2 + Ca(ГO3)2 + 6H2O
Например:
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O
6Cl2 + 6Ca(OH)2 = 5CaCl2 + Ca(ClO3)2 + 6H2O
Обращайте внимание на температуру, от Вашей внимательности зависят Ваши баллы на ЕГЭ по химии!
- Сера, селен и теллур тоже реагируют с щелочами по одной схеме:
3Э + 6NaOH = 2Na2Э + Na2ЭO3 + 3H2O
3Э + 3Ca(OH)2 = 2CaЭ + CaЭO3 + 3H2O
Например:
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
3S + 3Ca(OH)2 = 2CaS + CaSO3 + 3H2O
- Фосфор с щелочами:
4P + 3NaOH + 3H2O = 3NaH2PO2 + PH3↑
- Кремний с щелочами:
Si + 2NaOH + H2O = Na2SiO3 + 2H2
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- S + NaOH →
- SO2 + NaOH →
- SO3 + NaOH →
- H2S + NaOH →
- NaHS + S + H2O
- Na2SO4 + H2O
- Na2S + Na2SO3 + H2O
- Na2SO3 + H2O
- Na2S + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- P + NaOH →
- P2O3 + NaOH →
- P2O5 + NaOH изб. →
- P2O5 + NaOH нед. →
- NaH2PO2
- NaH2PO3
- Na3P
- Na3PO4
- NaH2PO4
19) Кислотные оксиды с щелочами
Кислотные оксиды реагируют с щелочами, образуя соль и воду, к нестандартным реакциям относят взаимодействие диоксида азота с щелочами, продукты которого зависят от наличия в среде кислорода:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
4NO2 + 4NaOH + O2 = 4NaNO3 + 2H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaOH + Cl2O →
- NaOH + NO2 + O2 →
- NaOH + Cl2O3 →
- NaOH + HNO3 →
- NaClO + H2O
- NaCl + HCl
- NaClO2 + H2O
- NaNO3 + H2O
- NaNO2 + NaNO3 + H2O
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- NaOH + SO2 →
- NaOH + SO3 →
- NaOH + NO2 →
- NaOH + P2O5 →
- NaNO3 + NaNO2 + H2O
- Na2SO4 + H2O
- NaNO2 + H2O
- NaH2PO4
- NaH2PO3
- Na2SO3 + H2O
20) Гидриды, фосфиды, нитриды, сульфиды, карбиды
Многие неметаллы реагируют с активными металлами, образуя соли или солеподобные вещества, легко гидролизующиеся в воде или кислотах.
Для начала рассмотрим схемы образования этих веществ. В них неметалл часто проявляет низшую степень окисления (значение низшей степени окисления легко определяется по номеру группы: для этого от номера группы нужно отнять 8, например, для азота это будет 5 ‒ 8 = ‒3)
Таблица – Степени окисления, которые принимают неметаллы при взаимодействии с активными металлами:
|
С |
Si |
N и P |
S, Se, Te |
F, Cl, Br, I |
|
‒4 (с Na, K, Al) ‒1 (с Ca, Mg) |
‒4 |
‒3 |
‒2 |
‒1 |
|
Карбиды |
Силициды |
Нитриды и фосфиды |
Сульфиды, селениды, теллуриды |
Фториды, хлориды, бромиды, йодиды |
Степени окисления активных металлов равны номеру группы, в которой они стоят в ПС.
4Na + C = Na4C
4Al + 3C = Al4C3
Ca + 2C = CaC2
4K + Si = K4Si
3Ca + N2 = Ca3N2
3K + P = K3P
2Al + 3S = Al2S3
Ba + Cl2 = BaCl2
Практически все эти вещества, за исключением некоторых сульфидов и галогенидов (хлоридов, бромидов, йодидов, фторидов) неустойчивы в растворах и подвергаются мгновенному гидролизу, который стоит рассматривать как обычную обменную реакцию с водой:
K3P + 3HOH = 3KOH + PH3↑
Na4Si + 4HOH = 4NaOH + SiH4↑
Ca3N2 + 6HOH = 3Ca(OH)2 + 2NH3↑
Продукт гидролиза карбидов зависит от степени окисления углерода в исходном веществе: если она равна ‒1, то образуется ацетилен (C2H2), а если ‒4, то метан (CH4).
Al4C3 + 12HOH = 4Al(OH)3 + 3CH4↑
CaC2 + 2HOH = Ca(OH)2 + C2H2↑
Так же происходит их кислотный гидролиз:
Al4C3 + 12HCl = 4AlCl3 + 3CH4↑
Ba3P2 + 3H2SO4 = 3BaSO4 + 2PH3↑
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- MgC2 + H2O →
- Na4C + H2O →
- Mg3P2 + H2O →
- Na3P + H2O →
- NaOH + C2H2
- Mg(OH) 2 + CH4
- Mg(OH) 2 + PH3
- NaOH + CH4
- Mg(OH) 2 + C2H2
- NaOH + PH3
21) Гидролиз бинарных соединений с ковалентной полярной связью
При гидролизе бинарных соединений неметаллов важно помнить, что степень окисления неметаллов не изменяется, из неметалла с положительной степенью окисления образуется кислотный гидроксид (кислородсодержащая кислота), из отрицательно заряженного неметалла образуется бескислородная кислота:
PCl5 + 4H2O = H3PO4 + 5HCl
SF6 + 4H2O = H2SO4 + 6HF
ICl3 + 2H2O = HIO2 + 3HCl
Для образования гидроксидов неметаллов можно воспользоваться следующей таблицей:
|
Степень окисления неметалла |
Э+1 |
Э+3 |
Э+4 |
Э+5 |
Э+6 |
Э+7 |
|
Соответствующая кислота (кислотный гидроксид) |
НЭО |
HЭO2 Или H3ЭO3 |
H2ЭO3 |
HЭO3 Или H3ЭO4 |
H2ЭO4 |
HЭO4 |
|
Примеры |
HClO |
HClO2 H3PO3 |
H2SO3 |
HIO3 H3PO4 |
H2SO4 |
HClO4 |
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- ICl + H2O →
- ICl3 + H2O →
- ICl5 + H2O →
- ICl7 + H2O →
- HClO3 + HI
- HIO + HCl
- HIO4 + HCl
- HIO2 + HCl
- HIO3 + HCl
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- PCl3 + H2O →
- SCl4 + H2O →
- SiCl4 + H2O →
- PCl5 + H2O →
- H2SO4 + HCl
- H2SiO3 + HCl
- H3PO3 + HCl
- SO2 + HCl
- HPO3 + HCl
22) Взаимный гидролиз
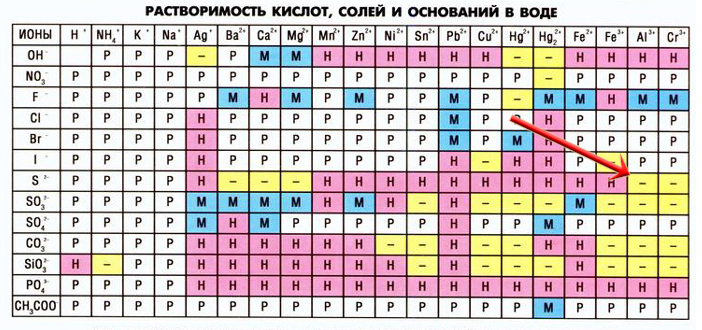
При взаимодействии некоторых солей могут образоваться новые соли, неустойчивые в растворах, в таких случаях в таблице растворимости на пересечении катиона и аниона мы видим прочерк (не существует или необратимо разлагается водой), например, сульфид алюминия:
Сульфид алюминия образуется в реакциях между растворимыми сульфидами и солями алюминия:
3Na2S + 2AlCl3 = 6NaCl + Al2S3
Но данная запись неверна, так как сульфида алюминия не существует в растворах, записываем уравнение гидролиза этой соли:
Al2S3 + 6HOH = 2Al(OH)3↓ + 3H2S↑
Объединим первое уравнение со вторым(левую часть первого уравнение соединяем с левой частью второго уравнения, а правую с правой, все коэффициенты сохраняем):
3Na2S + 2AlCl3 + Al2S3 + 6H2O = 6NaCl + Al2S3 + 2Al(OH)3↓ + 3H2S↑
Сокращаем сульфид алюминия, так как он есть и в правой части реакции, и в левой:
3Na2S + 2AlCl3 + 6H2O = 6NaCl + 2Al(OH)3↓ + 3H2S↑ — так выглядит реакция взаимодействия растворов сульфида натрия и хлорида алюминия.
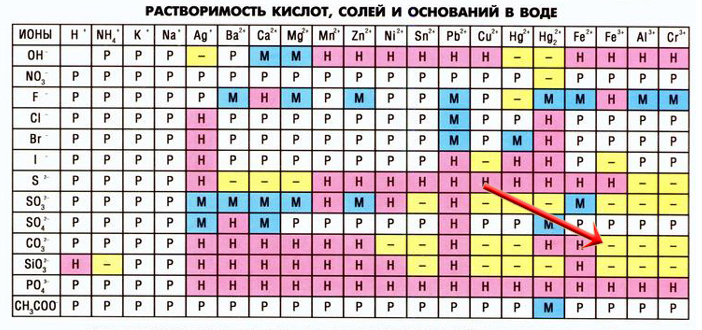
Рассмотрим еще один пример — взаимодействие карбоната калия и нитрата железа III:
3K2CO3 + 2Fe(NO3)3 = Fe2(CO3)3 + 6KNO3
Образовавшийся карбонат железа III разлагается в воде:
Fe2(CO3)3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑
Соединяем два уравнения:
3K2CO3 + 2Fe(NO3)3 + Fe2(CO3)3 + 3H2O = Fe2(CO3)3 + 6KNO3 + 2Fe(OH)3↓ + 3CO2↑
Сокращаем карбонат железа III с обеих сторон:
3K2CO3 + 2Fe(NO3)3 + 3H2O = 6KNO3 + 2Fe(OH)3↓ + 3CO2↑
Взаимный гидролиз попался мне на реальном досрочном ЕГЭ по химии 2022 во второй части!
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- CrCl3 + NaOH изб. →
- CrCl3 + NaOH нед. →
- CrCl3 + Na2S р-р →
- Cr2O3 + Na2SO3 →
- Cr(OH) 3 + NaCl + SO2
- NaCl + Cr(OH) 3
- Cr(OH) 3 + NaCl + H2S
- NaCrO2 + SO2
- Na3 [Cr(OH) 6] + NaCl
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- AlCl3 + K2CO3 р-р →
- AlCl3 + KOH изб. →
- AlCl3 + KOH нед. →
- Al2O3 + K2CO3 →
- KCl + K[Al(OH) 4]
- Al(OH) 3 + KCl + CO2
- Al2 (CO3)3 + KCl
- KAlO2 + CO2
- Al(OH) 3 + KCl
Химические реакции, или химические явления, — это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению.
При химических реакциях обязательно происходит изменение веществ, при котором рвутся старые и образуются новые связи между атомами.
Химические реакции следует отличать от ядерных реакций. В результате химической реакции общее число атомов каждого химического элемента и его изотопный состав не меняются. Иное дело ядерные реакции — процессы превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами, например, превращение алюминия в магний:
$↙{13}↖{27}{Al}+ {}↙{1}↖{1}{H}={}↙{12}↖{24}{Mg}+{}↙{2}↖{4}{He}$
Классификация химических реакций многопланова, т.е. в ее основу могут быть положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Рассмотрим классификацию химических реакций по различным признакам.
Классификация химических реакций по числу и составу реагирующих веществ. Реакции, идущие без изменения состава вещества
В неорганической химии к таким реакциям можно отнести процессы получения аллотропных модификаций одного химического элемента, например:
$С_{(графит)}⇄С_{(алмаз)}$
$S_{(ромбическая)}⇄S_{(моноклинная)}$
$Р_{(белый)}⇄Р_{(красный)}$
$Sn_{(белое олово)}⇄Sn_{(серое олово)}$
$3О_{2(кислород)}⇄2О_{3(озон)}$.
В органической химии к этому типу реакций могут быть отнесены реакции изомеризации, которые идут без изменения не только качественного, но и количественного состава молекул веществ, например:
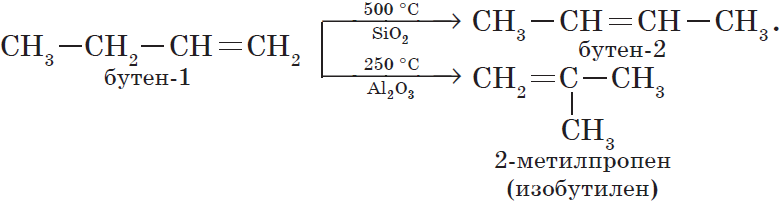
1. Изомеризация алканов.
Реакция изомеризации алканов имеет большое практическое значение, т.к. углеводороды изостроения обладают меньшей способностью к детонации.
2. Изомеризация алкенов.
3. Изомеризация алкинов (реакция А. Е. Фаворского).
4. Изомеризация галогеналканов (А. Е. Фаворский).
5. Изомеризация цианата аммония при нагревании.
Впервые мочевина была синтезирована Ф. Велером в 1882 г. изомеризацией цианата аммония при нагревании.
Реакции, идущие с изменением состава вещества
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена.
1. Реакции соединения — это такие реакции, при которых из двух и более веществ образуется одно сложное вещество.
В неорганической химии все многообразие реакций соединения можно рассмотреть на примере реакций получения серной кислоты из серы:
1) получение оксида серы (IV):
$S+O_2=SO_2$ — из двух простых веществ образуется одно сложное;
2) получение оксида серы (VI):
$2SO_2+O_2{⇄}↖{t,p,кат.}2SO_3$ — из простого и сложного веществ образуется одно сложное;
3) получение серной кислоты:
$SO_3+H_2O=H_2SO_4$ — из двух сложных веществ образуется одно сложное.
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты:
$4NO_2+O_2+2H_2O=4HNO_3$.
В органической химии реакции соединения принято называть реакциями присоединения. Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
1) реакция гидрирования — присоединение водорода:
$CH_2{=}↙{этен}CH_2+H_2{→}↖{Ni,t°}CH_3{-}↙{этан}CH_3;$
2) реакция гидратации — присоединение воды:
$CH_2{=}↙{этен}CH_2+H_2O{→}↖{H_3PO_4,t°}{C_2H_5OH}↙{этанол};$
3) реакция полимеризации:
${nCH_2=CH_2}↙{этилен}{→}↖{p,кат.,t°}{(-CH_2-CH_2-)_n}↙{полиэтилен}$
2. Реакции разложения — это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
В неорганической химии все многообразие таких реакций можно рассмотреть на примере блока реакций получения кислорода лабораторными способами:
1) разложение оксида ртути (II):
$2HgO{→}↖{t°}2Hg+O_2↑$ — из одного сложного вещества образуются два простых;
2) разложение нитрата калия:
$2KNO_3{→}↖{t°}2KNO_2+O_2↑$ — из одного сложного вещества образуются одно простое и одно сложное;
3) разложение перманганата калия:
$2KMnO_4{→}↖{t°}K_2MnO_4+MnO_2+O_2↑$ — из одного сложного вещества образуются два сложных и одно простое, т.е. три новых вещества.
В органической химии реакции разложения можно рассмотреть на примере блока реакций получения этилена в лаборатории и промышленности:
1) реакция дегидратации (отщепления воды) этанола:
$C_2H_5OH{→}↖{H_2SO_4,t°}CH_2=CH_2+H_2O;$
2) реакция дегидрирования (отщепления водорода) этана:
$CH_3—CH_3{→}↖{Cr_2O_3,500°C}CH_2=CH_2+H_2↑;$
3) реакция крекинга (расщепления) пропана:
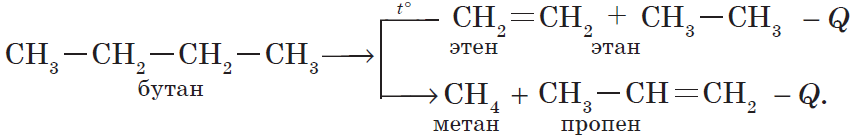
$CH_3-CH_2CH_3{→}↖{t°}CH_2=CH_2+CH_4↑.$
3. Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы какого-либо элемента в сложном веществе.
В неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов:
1) взаимодействие щелочных и щелочноземельных металлов с водой:
$2Na+2H_2O=2NaOH+H_2↑$
2) взаимодействие металлов с кислотами в растворе:
$Zn+2HCl=ZnCl_2+H_2↑$;
3) взаимодействие металлов с солями в растворе:
$Fe+CuSO_4=FeSO_4+Cu;$
4) металлотермия:
$2Al+Cr_2O_3{→}↖{t°}Al_2O_3+2Cr$.
Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, — способность его атомов водорода замещаться на атомы галогена:
$CH_4+Cl_2{→}↖{hν}{CH_3Cl}↙{хлорметан}+HCl$,
$CH_3Cl+Cl_2→{CH_2Cl_2}↙{дихлорметан}+HCl$,
$CH_2Cl_2+Cl_2→{CHCl_3}↙{трихлорметан}+HCl$,
$CHCl_3+Cl_2→{CCl_4}↙{тетрахлорметан}+HCl$.
Другой пример — бромирование ароматического соединения (бензола, толуола, анилина):
$C_6H_6Br_2{→}↖{FeBr_3}{C_6H_5Br}↙{бромбензол}+HBr$.
Обратим внимание на особенность реакций замещения у органических веществ: в результате таких реакций образуются не простое и сложное вещества, как в неорганической химии, а два сложных вещества.
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например, нитрование бензола:
$C_6H_6+{HNO_3}↙{бензол}{→}↖{H_2SO_4(конц.),t°}{C_6H_5NO_2}↙{нитробензол}+H_2O$
Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
4. Реакции обмена — это такие реакции, при которых два сложных вещества обмениваются своими составными частями.
Эти реакции характеризуют свойства электролитов и в растворах протекают по правилу Бертолле, т.е. только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, $Н_2О$).
В неорганической химии это может быть блок реакций, характеризующих, например, свойства щелочей:
1) реакция нейтрализации, идущая с образованием соли и воды:
$NaOH+HNO_3=NaNO_3+H_2O$
или в ионном виде:
$OH^{–}+H^{+}=H_2O$;
2) реакция между щелочью и солью, идущая с образованием газа:
$2NH_4Cl+Ca(OH)_2=CaCl_2+2NH_3↑+2H_2O$
или в ионном виде:
$NH_4^{+}+OH^{–}=NH_3↑+H_2O$;
3) реакция между щелочью и солью, идущая с образованием осадка:
$CuSO_4+2KOH=Cu(OH)_2↓+K_2SO_4$
или в ионном виде:
$Cu^{2+}+2OH^{-}=Cu(OH)_2↓$
В органической химии можно рассмотреть блок реакций, характеризующих, например, свойства уксусной кислоты:
1) реакция, идущая с образованием слабого электролита — $H_2O$:
$CH_3COOH+NaOH⇄NaCH_3COO+H_2O$
или
$CH_3COOH+OH^{-}⇄CH_3COO^{-}+H_2O$;
2) реакция, идущая с образованием газа:
$2CH_3COOH+CaCO_3=2CH_3COO^{–}+Ca^{2+}+CO_2↑+H_2O$;
3) реакция, идущая с образованием осадка:
$2CH_3COOH+K_2SiO_3=2KCH_3COO+H_2SiO_3↓$
или
$2CH_3COOH+SiO_3^{−}=2CH_3COO^{−}+H_2SiO_3↓$.
Классификация химических реакций по изменению степеней окисления химических элементов, образующих вещества
Реакции, идущие с изменением степеней окисления элементов, или окислительно-восстановительные реакции.
К ним относится множество реакций, в том числе все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество, например:
1.${Mg}↖{0}+{2H}↖{+1}+SO_4^{-2}={Mg}↖{+2}SO_4+{H_2}↖{0}↑$
${{Mg}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Mg}↖{+2}$
${{2H}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{H_2}↖{0}$
2.${2Mg}↖{0}+{O_2}↖{0}={2Mg}↖{+2}{O}↖{-2}$
${{Mg}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Mg}↖{+2}|4|2$
${{O_2}↖{0}+4{e}↖{-}}↙{окислитель}{→}↖{восстановление}{2O}↖{-2}|2|1$
Как вы помните, сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса:
${2Fe}↖{0}+6H_2{S}↖{+6}O_{4(k)}={Fe_2}↖{+3}(SO_4)_3+3{S}↖{+4}O_2+6H_2O$
${{Fe}↖{0}-3{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Fe}↖{+3}|2$
${{S}↖{+6}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{S}↖{+4}|3$
В органической химии ярким примером окислительно-восстановительных реакций могут служить свойства альдегидов:
1. Альдегиды восстанавливаются в соответствующие спирты:
${CH_3-{C}↖{+1} {}↖{O↖{-2}}↙{H↖{+1}}+{H_2}↖{0}}↙{text»уксусный альдегид»}{→}↖{Ni,t°}{CH_3-{C}↖{-1}{H_2}↖{+1}{O}↖{-2}{H}↖{+1}}↙{text»этиловый спирт»}$
${{C}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{C}↖{-1}|1$
${{H_2}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}2{H}↖{+1}|1$
2. Альдегиды окисляются в соответствующие кислоты:
${CH_3-{C}↖{+1} {}↖{O↖{-2}}↙{H↖{+1}}+{Ag_2}↖{+1}{O}↖{-2}}↙{text»уксусный альдегид»}{→}↖{t°}{CH_3-{Ag}↖{0}{C}↖{+3}{O}↖{-2}{OH}↖{-2+1}+2{Ag}↖{0}↓}↙{text»этиловый спирт»}$
${{C}↖{+1}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{C}↖{+3}|1$
${2{Ag}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}2{Ag}↖{0}|1$
Реакции, идущие без изменения степеней окисления химических элементов.
К ним, например, относятся все реакции ионного обмена, а также:
- многие реакции соединения:
$Li_2O+H_2O=2LiOH;$
- многие реакции разложения:
$2Fe(OH)_3{→}↖{t°}Fe_2O_3+3H_2O;$
- реакции этерификации:
$HCOOH+CH_3OH⇄HCOOCH_3+H_2O$.
Классификация химических реакций по тепловому эффекту
По тепловому эффекту реакции делят на экзотермические и эндотермические.
Экзотермические реакции.
Эти реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота (II) из азота и кислорода и реакция газообразного водорода с твердым иодом:
$N_2+O_2=2NO – Q$,
$H_{2(г)}+I{2(т)}=2HI – Q$.
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения, например:
$4P+5O_2=2P_2O_5+Q,$
$CH_4+2O_2=CO_2+2H_2O+Q$.
Гидрирование этилена — пример экзотермической реакции:
$CH_2=CH_2+H_2{→}↖{Pt}CH_3-CH_3+Q$
Она идет при комнатной температуре.
Эндотермические реакции
Эти реакции протекают с поглощением энергии.
Очевидно, что к ним относятся почти все реакции разложения, например:
а) обжиг известняка:
$CaCO_3{→}↖{t°}CaO+CO_2↑-Q;$
б) крекинг бутана:
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением, например:
$H_{2(г)}+Cl_{2(г)}=2HCl_{(г)}+92.3 кДж,$
$N_{2(г)}+О_{2(г)}=2NO_{(г)} – 90.4 кДж$.
Классификация химических реакций по агрегатному состоянию реагирующих веществ (фазовому составу)
Гетерогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах):
$2Al_{(т)}+3CuCl_{2(р-р)}=3Cu_{(т)}+2AlCl_{3(р-р)}$,
$СаС_{2(т)}+2Н_2О_{(ж)}=С_2Н_2↑+Са(ОН)_{2(р-р)}$.
Гомогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе):
Классификация химических реакций по участию катализатора
Некаталитические реакции.
Некаталитические реакции идут без участия катализатора:
$2HgO{→}↖{t°}2Hg+O_2↑$,
$C_2H_4+3O_2{→}↖{t°}2CO_2+2H_2O$.
Каталитические реакции.
Каталитические реакции идут с участием катализатора:
$2KClO_3{→}↖{MnO_2,t°}2KCl+3O_2↑,$
${C_2H_5OH}↙{этанол}{→}↖{H_2SO-4,t°}{CH_2=CH_2}↙{этен}↑+H_2O$
Так как все биологические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы — ферментов, все они относятся к каталитическим или, точнее, ферментативным.
Следует отметить, что более $70%$ химических производств используют катализаторы.
Классификация химических реакций по направлению
Необратимые реакции.
Необратимые реакции протекают в данных условиях только в од ном направлении.
К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды), и все реакции горения.
Обратимые реакции.
Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях.
Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия-антонимы процессов:
- гедрирование — дегидрирование;
- гидратация — дегидратация;
- полимеризация — деполимеризация.
Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит название гидролиза) и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость лежит в основе важнейшего процесса в живом организме — обмена веществ.
Смотреть видео:
#химия #химияпросто #неорганика #егэпохимии #химияогэ #химик #егэхимия #химияегэ #репетиторпохимии
Свежая информация для ЕГЭ и ОГЭ по Химии (листай):
С этим видео ученики смотрят следующие ролики:

Самые сложные реакции в ЕГЭ по химии | ХИМИЯ ЕГЭ | Лия Менделеева
Лия Менделеева — ЕГЭ химия

Самые сложные ОВР в задании 29 | Химия ЕГЭ | Parta
Parta химия ЕГЭ

Хром и марганец — самые сложные элементы | Химия ЕГЭ 2022 | Parta
Parta химия ЕГЭ

Хром и марганец — самые сложные элементы | Химия ЕГЭ 2023 | Parta
Parta химия ЕГЭ
Облегчи жизнь другим ученикам — поделись! (плюс тебе в карму):
15.05.2022