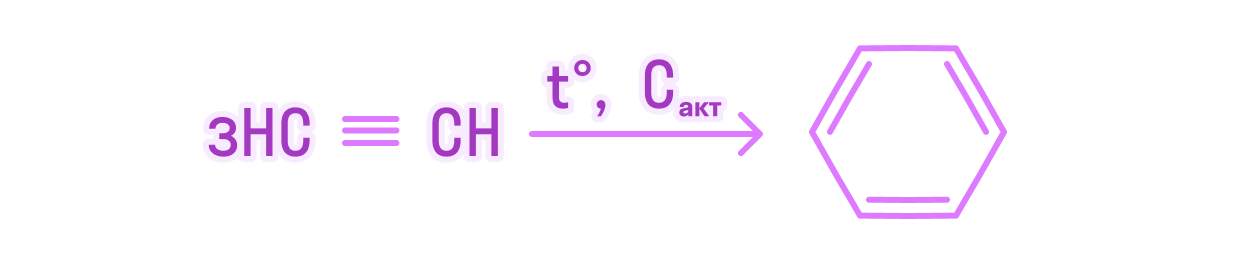Подготовка к ЕГЭ по химии
Как проходит ЕГЭ по химии в 2023 году
На ЕГЭ по химии, как и в случае с большинством других предметов, ученик 11 класса должен будет справиться с 2 частями экзамена:
-
1-я часть: 28 заданий с кратким ответом;
-
2-я часть: 6 заданий с развернутым ответом.
Чтобы решить все 34 задания единого государственного экзамена, у ученика будет 210 минут. За это время нужно будет успеть ответить на вопросы обеих частей, подготовить полное решение для задач 2-й части и перенести ответы в бланк.
Кстати, в отличие от ОГЭ, на ЕГЭ по химии не будет задания-эксперимента. Только обычные химические задания разной сложности. В таблице ниже можно посмотреть, сколько будет легких, средних и сложных вопросов.
| Уровень сложности заданий на ЕГЭ по химии | |
|---|---|
| Базовая | 17 |
| Повышенная | 11 |
| Высокая | 6 |
Если вы хотите больше узнать об особенностях экзамена и подготовки к нему, советуем заглянуть в раздел «Демоверсии, спецификации, кодификаторы» сайта ФИПИ. Там вы найдете всю актуальную информацию о ЕГЭ по химии и методические рекомендации. Все это поможет распланировать подготовку к экзамену так, чтобы сдать его на 100 баллов.
Изменения в ЕГЭ по химии
По сравнению с 2022 годом экзамен по химии немного изменится. Вот список нововведений:
-
Немного поменялось условие задания 23, в котором нужно рассчитать концентрацию веществ. Теперь данные в нем будут записаны текстом, а не в таблице.
-
Задания 33 и 34 поменялись местами.
-
Задания 9, 12 и 16 теперь станут повышенной сложности.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Демоурок по подготовке к экзаменам
Составим ваш личный путь к высоким баллам — учтем сроки, уровень знаний и цель.
Как хорошо сдать ЕГЭ по химии: разбор сложных задач
Как мы узнали из таблицы в предыдущем разделе, экзамен по химии — один из самых сложных. На 34 задания в нем приходится целых 11 повышенной сложности и 6 — высокой. Но если вы хотите поступить в вуз мечты, советуем научиться их решать так, чтобы не упустить ни одного балла. А потому предлагаем начать подготовку прямо сейчас и вместе разобрать несколько таких задач.
Задание 7
Это задание проверяет буквально все ваши знания в области неорганической химии. Здесь нужно знать как химические свойства простых соединений, так и химические свойства сложных соединений. Давайте разберем одно из таких заданий, чтобы понять, как их решать, чтобы сдать ЕГЭ по химии.
Установите соответствие между веществом и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| Вещество | Реагенты |
|---|---|
| А) S | 1) AgNO3, K3PO4, Cl2 |
| Б) SO3 | 2) BaO, NaOH, H2O |
| В) Zn(OH)2 | 3) H2, Cl2, O2 |
| Г) ZnBr2 | 4) HBr, LiOH, CH3COOH (p-p) |
| 5) H3PO4 (p-p), BaCl2, CuO |
Решение:
-
Вариант под буквой А — простое вещество, сера. Как правило, простые вещества взаимодействуют с другими простыми веществами, значительно реже со сложными веществами. Под это описание подходит вариант № 3.
-
Вещество под буквой Б — кислотный оксид. Кислотные оксиды не реагируют с кислотами, поэтому смело вычеркиваем варианты, где присутствует хоть одна кислота. Остаются варианты № 1–3. Реагенты под цифрой 3 тоже можем вычеркнуть, так как кислотный оксид уже в своей максимальной степени окисления и дальше взаимодействовать с кислородом не может. Остаются варианты № 1 и № 2. Оксид серы (VI) может реагировать с основным оксидом с образованием соли, со щелочью с образованием соли и воды, и с водой, при этом образуя кислоту. Выбираем № 2.
-
Амфотерный нерастворимый в воде гидроксид цинка может взаимодействовать только с теми, что способны его растворить. Единственно верный вариант под № 4, где указаны кислоты и щелочь.
-
При взаимодействии соли с другими сложными веществами надо помнить про три признака протекания химической реакции: выпадения осадка, выделение газа и образование малодиссоциирующего вещества — воды. Под это описание подходит вариант под № 1. Но как же хлор? Дело в том, что вышестоящие в группе галогены способны вытеснить нижестоящие из их солей.
Ответ: 3241.
Задание 15
Это задание Единого государственного экзамена проверит ваши знания химических свойств органических соединений. Чтобы справиться с ним, нужно по записанным словами реагирующим веществам составить уравнение реакции и выбрать из перечня один из получившихся продуктов. Давайте рассмотрим на примере, как решать такую задачу.
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| Реагирующие вещества | Продукт взаимодействия |
|---|---|
| А) уксусная кислота и сульфид калия | пропионат калия |
| Б) муравьиная кислота и гидроксид калия | этилат калия |
| В) муравьиный альдегид и гидроксид меди (II) при нагревании | формиат меди (II) |
| Г) этанол и калий | формиат калия |
| ацетат калия | |
| углекислый газ |
Решение:
-
Органические кислоты могут реагировать с солями, если те имеют летучий анион. В результате взаимодействия образуется соль уксусной кислоты и сероводород (летучее соединение). Соль, которая образована в таких условиях, — ацетат калия. Это вещество № 5.
-
Муравьиная кислота проявляет свойства неорганической кислоты и может взаимодействовать с щелочами с образованием соли и воды. Соль муравьиной кислоты — формиат. Правильный ответ № 4.
-
Под буквой В описана качественная реакция на альдегиды с образованием соответствующей кислоты, оксида меди (I) и воды. Исключение — муравьиный альдегид. Он окисляется до углекислого газа, а остальные продукты реакции те же. Соответственно, правильный ответ № 6.
-
Калий как активный металл может замещать протон водорода в гидроксогруппе у спиртов с образованием алкоголята. Правильный ответ: № 2.
Ответ: 5462.
Задание 16
Это задание всё так же проверяет ваши знания по химическим свойствам и, как следствие, умение записывать превращения в рамках органической химии. Однако оно усложняется тем, что теперь вам самим нужно подобрать такой реактив, чтобы произошло уже известное превращение. Давайте попробуем решить один из вариантов такой задачи вместе — это повысит ваши шансы сдать ЕГЭ на 100 баллов.
Задана схема превращений веществ:
Определите, какие из указанных веществ являются веществами х и у:
-
2-бромбутан;
-
этаналь;
-
этен;
-
метилпропан;
-
хлорэтан.
Решение:
Посмотрим, что случилось с известными нам веществами.
-
У спирта исчезла ОН-группа, затем что-то произошло, и углеродная цепочка увеличилась вдвое. Мы помним, что когда цепочка увеличивается вдвое, то, скорее всего, это реакция Вюрца. А в неё вступают только галогеналканы. Ищем нужный нам вариант. Он находится под номером 5. Первое вещество найдено.
-
Бутан подвергают нагреванию с использованием катализатора. Нужно помнить, что в таких условиях проводится изомеризация алканов. Из бутана получается метилпропан. Ответ: № 4.
Ответ: 54.
Задание 26
Теперь разберем задачи, которые заканчивают тестовую часть ЕГЭ по химии. Рассмотрим условие одной из них на нахождение массы соли, которую необходимо добавить для получения раствора с новой заданной массовой долей.
Вычислите массу нитрата калия (в граммах), которую следует растворить в 160 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%. Ответ округлите до десятых.
Чтобы решить эту задачу, вспомним основную формулу нахождения массовой доли:
-
Найдем массу изначально растворенного нитрата калия в растворе, выразив из формулы выше:
подставим значения:
-
Чтобы увеличить массовую долю соли в растворе, необходимо ее добавить еще. Но мы не знаем сколько, поэтому примем массу добавляемой соли за Х и подставим в исходную формулу нахождения массовой доли с учетом новых значений:
-
Далее в дело вступает чистая математика. Разделим обе части уравнения на 100%:
-
По пропорции перемножим крест-накрест:
0,12 * (160 + X) = 16 + X.
-
Раскроем скобки:
19,2 + 0,12Х = 16 + Х.
-
Приведем подобные: с Х в одну сторону, без Х — в другую:
3,2 = 0,88Х.
-
Найдем Х:
Масса нитрата калия, которую необходимо добавить для увеличения массовой доли раствора до 12%, равна 3,6 граммам.
Ответ: 3,6.
Задание 28
Эта задача может встретиться на экзамене в нескольких вариантах. Давайте разберем один из них — задание на нахождение доли выхода продукта реакции.
В результате реакции тримеризации ацетилена объемом 26,88 л (н.у) получили 24,96 г бензола. Вычислите массовую долю выхода продукта реакции от теоретически возможного.
Решение:
-
Для начала напишем формулу, по которой считается доля выхода продукта:
Как определить, какая масса практическая, а какая — теоретическая? Значения, которые даются после слова «получили», — это практическая масса. Та, которая получилась в результате проведения химической реакции в реальных условиях. Масса теоретическая — та, которую рассчитывают из уравнения реакции, зная массу исходных реагентов.
-
Напишем уравнение химической реакции тримеризации ацетилена:
-
Найдем количество вещества ацетилена:
подставим значения:
-
Перейдем на количество вещества бензола, получаемого из ацетилена:
-
Зная количество вещества бензола, найдем его массу:
подставим значения:
m = 0,4 * 78 = 31,2 грамма.
-
Масса, рассчитываемая по уравнению реакции, является теоретической. Масса практическая дана нам по условию. Подставим полученные данные по массам в формулу для нахождения доли выхода продукта реакции:
Доля выхода бензола из данного объема ацетилена составляет 80%.
Ответ: 80.
Как оценивают готовые работы на ЕГЭ по химии
1-я часть
В 1-й части Единого государственного экзамена по химии задания 1–5, 9–13, 16–21, 25–28 оценивают 1 баллом, если вы запишете верный ответ по эталону. При этом в заданиях 1, 3, 4, 11, 12, 13, 17 и 18 ответ — это ряд цифр. То, в каком порядке вы их запишете, не влияет на оценку. Например, если в задании верны варианты под номерами 1 и 4, их можно записать как 14 или как 41. И в обоих случаях ответ засчитают как верный.
За правильные ответы в заданиях 6, 7, 8, 14, 15, 22, 23 и 24 можно получить по 2 балла. Если ваш ответ отличается от эталона на один символ, его оценят в 1 балл. Во всех остальных случаях задание считают выполненным неверно и ставят 0 баллов.
2-я часть
В этой части нужно записать не только ответ, но и решение. А значит, и оценивать такие задания будут сразу по нескольким критериям. Зато за верный ответ в некоторых вопросах можно получить больше баллов, чем за любое задание 1-й части. Максимум — 5 баллов. А теперь давайте разберемся, как именно их будут оценивать.
| Задание № 29 | Баллы |
|---|---|
| Ответ верный и полный: ученик выбрал вещества и записал уравнение химической реакции, составил электронный баланс, указал окислитель и восстановитель | 2 |
| Есть только один верный элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 2 |
| Задание № 30 | Баллы |
|---|---|
| Ответ верный и полный: ученик выбрал вещества, записал все нужные уравнения реакции | 2 |
| Есть только один верный элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 2 |
| Задание № 31 | Баллы |
|---|---|
| Правильно записаны 4 уравнения реакции | 4 |
| Правильно записаны 3 уравнения реакции | 3 |
| Правильно записаны 2 уравнения реакции | 2 |
| Правильно записано 1 уравнение реакции | 1 |
| Все уравнения реакции записаны неверно | 0 |
| Максимальный балл | 4 |
| Задание № 32 | Баллы |
|---|---|
| Правильно записаны 5 уравнений реакции | 5 |
| Правильно записаны 4 уравнения реакции | 4 |
| Правильно записаны 3 уравнения реакции | 3 |
| Правильно записаны 2 уравнения реакции | 2 |
| Правильно записано 1 уравнение реакции | 1 |
| Все уравнения реакции записаны неверно | 0 |
| Максимальный балл | 5 |
| Задание № 33 | Баллы |
|---|---|
| Ответ верный и полный, записаны все 3 элемента | 3 |
| Правильно записаны только 2 элемента ответа | 2 |
| Правильно записан только 1 элемент ответа | 1 |
| Все элемента ответа записаны неверно | 0 |
| Максимальный балл | 3 |
| Задание № 34 | Баллы |
|---|---|
| Ответ верный и полный, записаны все 4 элемента | 4 |
| Правильно записаны только 3 элемента ответа | 3 |
| Правильно записаны только 2 элемента ответа | 2 |
| Правильно записан только 1 элемент ответа | 1 |
| Все элемента ответа записаны неверно | 0 |
| Максимальный балл | 4 |
Как сдать ЕГЭ по химии на 3, 4 и 5
Мы уже познакомились с критериями, по которым будут оценивать работы на ЕГЭ. А теперь давайте разберемся, сколько баллов нужно получить для оценок 3, 4 или 5. Официально ЕГЭ не оценивают по пятибалльной системе с 2008 года. Если вам так проще оценить свои знания, их можно перевести. Но это будет лишь примерный перевод.
Будьте внимательны: баллы из таблиц выше — первичные, а требования к абитуриентам на поступление выражены в тестовых. Чтобы понять, сколько заданий точно нужно решить, чтобы поступить, надо перевести баллы из одной системы в другую. Это можно сделать по таблице ниже.
| Первичные баллы | Тестовые баллы | Оценка |
|---|---|---|
| <11 | <36 | 2 |
| 11–25 | 36–55 | 3 |
| 26–38 | 56–72 | 4 |
| 39–56 | 73–100 | 5 |
6 рекомендаций, как подготовиться к ЕГЭ по химии
Единый государственный экзамен — это ответственная задача, от результатов подготовки к которой иногда многое зависит. Чтобы немного облегчить для вас этот путь, мы собрали 6 простых, но рабочих советов от наших преподавателей. Следуйте им и тогда сможете подготовиться к экзамену по химии как можно лучше.
-
Узнайте все о структуре ЕГЭ и научитесь работать с КИМами.
-
Начинайте готовиться заранее. Но если получилось так, что осталось мало времени, составьте новый экспресс-план с помощью вашего преподавателя.
-
Ведите календарь подготовки к экзамену. Отмечайте на нем запланированные темы, разные методики, занятия у репетитора, пробные ЕГЭ и самоподготовку.
-
Распределяйте время на темы, исходя из ваших знаний. Больше учите то, что «западает», остальное — повторяйте.
-
Советуйтесь с учителем. Это может быть ваш преподаватель по химии или репетитор. Круто, если он сможет поделиться с вами опытом подготовки к ЕГЭ.
-
Заботьтесь о своем здоровье, не забывайте отдыхать, не лишайте себя живого общения. Все это может сказаться на вашем самочувствии, а значит, и баллах тоже.
Если вы хотите сдать ЕГЭ по химии на 100 баллов, советуем тщательно продумать, как вы будете готовиться к нему. Лучший из них — совмещать самостоятельную работу и дополнительные занятия.
На курсах подготовки к ЕГЭ по химии в Skysmart школьники отрабатывают все типы задач и разбирают критерии оценок. Для каждого из них мы составляем индивидуальный план, который приведет к нужным баллам. Он учитывает уровень знаний ученика и время до экзамена, что позволяет «выжать» максимум из подготовки. А еще мы рассказываем о ЕГЭ без «страшилок» и прикрас, чтобы школьник точно знал, что его ждет на экзамене. Ждем на первом бесплатном занятии!
Химия — один из самых сложных предметов для сдачи ЕГЭ. Задания меняются каждый год: то, что раньше казалось трудным, нынешние выпускники должны успевать за пару минут. Несмотря на это экзамен необходим будущим врачам, фармацевтам и, конечно же, химикам. Давайте обсудим, как устроен ЕГЭ по химии 2023 и что нужно выучить для успешной сдачи!
Структура ЕГЭ по химии 2023
ЕГЭ по химии состоит из двух частей. В первой выпускникам предлагают решить 28 заданий — нужен краткий ответ в виде одного числа или последовательности чисел. Во второй части — 6 заданий с развернутым ответом. В них нужно записывать уравнения химических реакций и решать сложные математические задачи. Если выполнить работу без ошибок, можно набрать 56 первичных баллов.
Нововведение ЕГЭ по химии 2023 — сокращение количества заданий и появление новых прототипов.
Изменения в ЕГЭ по химии 2023
Задание № 23. В прошлом году ребята впервые решали задание на расчет равновесных и исходных концентраций. Оно представляло собой уравнение химической реакции, а также таблицу с концентрациями каждого участника. В этом году таблицы не будет, вместо нее предлагается найти исходные данные в тексте. Советуем вам не отходить от уже отработанного алгоритма и самостоятельно составлять таблицы. Немного практики и навык владения калькулятором помогут получить за этот номер максимальные баллы даже с новым условием.
Задания № 9, 12 и 16. Эти задания не изменились на вид. В №9 и 16 предстоит разобраться с небольшими цепочками превращений – неорганической и органической соответственно. А в задании 12 выпускников вновь ожидают химические свойства органических веществ и неизвестное количество правильных ответов. Но в этом году задания станут сложнее, их переносят в разряд заданий повышенного уровня сложности. К сожалению, при неизменном 1 балле за каждый из номеров.
Задания № 33 и 34. Каждый выпускник накануне ЕГЭ по химии очень хочет знать, чему будут посвящены задачи 33 и 34. Конечно же, тайну нам не открыли, но зато эти задания поменяли местами. Теперь №33 – это задача на установление органической формулы, а №34 – сложная расчетная задача, основанная на неорганических превращениях.
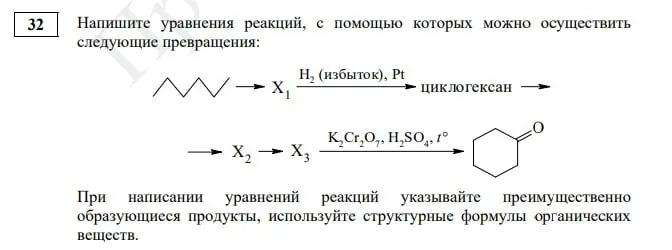
Задание № 32. Эта органическая цепочка существенно не изменилась, ребятам предстоит записать пять уравнений химических реакций. Но стоит обратить пристальное внимание на изображение гексана, с такими формулами мы в ЕГЭ еще не сталкивались, но есть вероятность, что видеть их мы теперь будем чаще.
Это главные изменения ЕГЭ по химии 2023. Но для того, чтобы получить высокий балл, просто знать о них недостаточно. Когда ФИПИ обновляет формулировки заданий, может измениться и способ их решения и критерии оценивания. Если не учитывать это во время подготовки к ЕГЭ, то можно потерять немало баллов. Обидно!
Это — лишь малая часть ловушек экзамена, которые составители расставляют выпускникам. На своих занятиях по подготовке ЕГЭ по химии я показываю ученикам их все. Мы учимся обходить каждую из них и делать такие решения заданий, к которым никто не придерется. А еще я всегда делюсь лайфхаками быстрого и правильного решения типичных задач — так можно сэкономить много времени на более сложные вещи.
Всему этому я могу научить и вас! Приходите ко мне на уроки, и я подготовлю вас к ЕГЭ по химии на 80+ 💪🤓
Какие темы есть в ЕГЭ по химии?
Чтобы успешно сдать ЕГЭ по химии 2023, нужно освоить пять разделов этой науки.
Теоретические основы химии
Этот блок включает в себя информацию о строении атомов, об их существовании в молекулах вещества. Выпускникам нужно продемонстрировать навыки работы с таблицей химических элементов Д.И. Менделеева. Этот раздел поможет решить задания 1-4, 18-20, 23 в первой части, а также задание 29 во второй части.
Неорганическая химия
Этой теме посвящены задания 5-9, 17, 21 (первая часть), 30, 31 (вторая часть). Вас ждут любые свойства неорганических соединений: от простых веществ-металлов и неметаллов до комплексных солей и кристаллогидратов. Чтобы получить высокие баллы, необходимо также знать правила номенклатуры, способы получения и основы процессов гидролиза и электролиза.
Органическая химия
В заданиях 10-16 и 32 вы столкнетесь с органической химией. Ученики, которые готовятся самостоятельно, часто стараются выучить все классы веществ по стандартному плану: название класса, номенклатура, физические и химические свойства, способы получения и применение. На самом деле можно значительно облегчить себе жизнь и начать со строения органических молекул. Как только вы поймете, что кратные связи можно разорвать одним набором реактивов, в группе –ОН замещают атом водорода, а –NH2 группа реагирует с кислотами, классы органических веществ и их реакции покажутся однотипными.
Химия и жизнь
Название этого раздела кажется простым и понятным. К сожалению, именно здесь ученики чаще всего теряют баллы. В задании 24 необходимо мысленно представить эксперимент и написать, что произойдет при смешивании заданных веществ. Например, может выпасть осадок, выделиться газ, а может вообще ничего не произойти. В задании 25 нужно определить, где используют то или иное химическое соединение. Ответом может быть химическая промышленность, медицина, сельское хозяйство и, конечно, повседневная жизнь человека.
Решение расчетных задач
Очень важная часть экзамена по химии. В заданиях 26, 27 и 28 в первой части нужно дать ответ в виде числа, не записывая решение. Обычно эти задачи решаются в одно действие — они проверяют не знания химических процессов, а навыки работы с калькулятором.
Задание 34, по мнению многих учеников — самое сложное во всем экзамене. Чтобы его решить, нужно знать химические свойства веществ, уметь составлять причинно-следственные связи в химических системах, понимать, какие вещества реагируют без остатка и почему. Кроме того, в последние годы все чаще встречаются задачи, которые необходимо решать с помощью линейных уравнений или их систем.
В задаче 32 нужно выполнить расчеты, которые позволят установить молекулярную формулу некоторого органического вещества. Далее, используя описание, необходимо представить эту формулу в структурном виде, показывая связи между атомами. Обязательно запишите в ответе уравнение реакции, о которой идет речь в условии!
Как подготовиться к ЕГЭ по химии 2023?
По структуре экзамена видно, что вам придется повторить или освоить заново весь курс химии за год. С какой темы начать? За что взяться в первую очередь?
Скачайте кодификатор по химии 2023 года. Обычно он находится вместе в демоверсией. В этом документе перечислены все темы, которые необходимо хорошо подготовить. Этот перечень охватывает все задания ЕГЭ, в нем нет ничего лишнего.
Подружитесь с таблицами. Периодическая система химических элементов Д. И. Менделеева, таблица растворимости кислот, солей и оснований, ряд активности металлов – это отличные шпаргалки, которые раздают вместе с вариантами на ЕГЭ. Если правильно ими воспользоваться, можно не только понять, протекает ли реакция между веществами, но даже установить среду раствора, силу кислоты и цвет осадка. И это еще не все!
Грамотно распределите время. Учите теорию, но и не забывайте практиковаться. Если вы не нарешаете тренировочных вариантов, время может сыграть злую шутку на реальном экзамене. 210 минут не хватает на размышления, решения, красивую запись и перепроверку. Необходимо работать в хорошем темпе!
Не оставляйте подготовку на конец года. Несмотря на распределение заданий по разделам химии, старайтесь решать их с самого начала подготовки, постепенно усложняя условия. И помните, что задачи второй части ЕГЭ оцениваются по критериям. Даже если вы не знаете, как решить задание полностью, вы всегда можете заработать 1-2 первичных балла, записав без ошибок уравнения химических реакций и проведя простейшие расчеты.
Прорешивайте как можно больше заданий. Это, пожалуй, самый главный совет. Чем больше вы будете тренироваться и решать типовые задачи, тем выше шансы получить на экзамене высокий балл. Все потому, что вы поймете алгоритм решения и сможете находить правильный ответ намного быстрее, чем другие выпускники.
Когда я готовлю к ЕГЭ по химии в MAXIMUM Education, мы посвящаем немало времени решению всех заданий экзамена. Мы разбираем все части экзамена и учимся правильно оформлять ответы, чтобы не потерять ни одного балла. Чтобы проверить, все ли понятно ученикам, я провожу срезы знаний и даже пробный экзамен. После него я разбираю ошибки с каждым учеником отдельно, и дополнительно объясняю сложные темы.
После такой подготовки мои выпускники пишут настоящий экзамен уверенно и получают высокие баллы. Точно выше среднего балла по стране 🙃 Хотите так же? Приходите на мои занятия, и я научу вас всему, что знаю!
Как сдать ЕГЭ по химии: рекомендации и советы экспертов
Если вы выбрали химию как предмет для сдачи ЕГЭ, то вам пригодятся советы и рекомендации наших экспертов. С нашими советами вы сможете получить высокий балл на экзамене.
ЕГЭ по химии – не обязательный предмет для сдачи в 11 классе. Но его часто выбирают ученики, которые планируют поступать в вуз на специальность, связанную с этим предметом. И надеяться только на школьную программу и подготовку здесь не стоит. Это сложный предмет с большим количеством информации и тем, которые нужно не просто выучить наизусть, но и понять.
Некоторые готовятся к ЕГЭ самостоятельно. Они штудируют учебники и пособия, изучают примеры работ с прошлых лет и проходят их, обращаются со своими вопросами к школьному учителю. Другие же ученики идут по более простому пути – посещают курсы подготовки либо онлайн занятия по химии с репетитором. Преподаватель здесь помогает восполнить пробелы в знаниях и понять материал всей школьной программы, а также проводит тестовые ЕГЭ.
Какой бы вариант вы ни выбрали, вам все равно придётся разобраться с тем, как устроен и оценивается ЕГЭ по химии. Мы решили вам в этом помочь.
В этом материале:
- Как оценивается ЕГЭ по химии
- Как подготовиться к экзамену: советы экспертов
- Организационные моменты
- Советы экспертов как решать задачи
Как оценивается ЕГЭ по химии
На онлайн занятиях по химии репетитор поможет разобраться, как делать то или иное задание, даст массу типовых вариантов каждого вопроса и найдёт вместе с вами правильные ответы. Также он расскажет, как и за что будут начислены баллы.
Всего на ЕГЭ по химии 34 вопроса. 28 из них считаются простыми (но это не так) – в них нужно выбрать правильные варианты ответов из предложенных составителями экзамена. В шести оставшихся заданиях ученику придется самостоятельно формулировать ответ на вопрос и аргументировать его.
За первые 28 заданий можно получить по 1 или 2 балла – всё зависит от номера вопроса. Например, за задания 1-5 дают всего 1 балл, а за 6,7,8 вопрос можно получить 2 балла. За вопросы, где ученик должен дать расширенный ответ и самостоятельно сформулировать свои мысли, можно получить от 2 до 5 баллов за каждый.
Если ученик допустил ошибку, то за вопрос ему начисляется 0 баллов. То же самое происходит, если школьник пропустил вопрос или ответ дан не по правилам экзамена. Например, не вписан в нужные клеточки.
Первый урок в Учи.Дома — бесплатно! Это отличная возможность познакомиться с преподавателем, методикой и провести время с пользой. Записаться на урок можно по ссылке:
Если вы обратились для подготовки к ЕГЭ к репетитору и начали посещать онлайн занятия по химии хотя бы за 4-6 месяцев до экзамена, всё просто. Учитель сам подберёт для вас программу обучения, выявит ваши слабые места и темы, которые нуждаются в особом внимании. Главно здесь:
- найти хорошего преподавателя;
- много заниматься с ним и самостоятельно;
- следовать его рекомендациям;
- много практиковаться в решении примеров ЕГЭ.
Когда дело обстоит иначе и вы решили обойтись без онлайн занятий по химии, все сложнее. Но если у вас хороший уровень владения предметом, вы точно справитесь. В этом случае эксперты рекомендуют:
- Изучить школьные учебники и пособия для подготовки к ЕГЭ. Также важно прочитать кодификатор и спецификацию для ЕГЭ по химии. Вы можете их найти на сайте ФИПИ. Здесь будут указаны все темы, а также приведена таблица с точным количеством баллов за каждое задание и критерии оценивания результатов.
- Решать легкие и сложные задачи. Чем больше практики, тем лучше. Не стесняйтесь показывать свои результаты школьному учителю. Он может вас направить, показать, что ещё нужно изучить и где вы делаете ошибки.
- Решать много тестов, примеров ЕГЭ по химии и заданий прошлых лет. Причём важно не только давать правильные ответы, соблюдать все правила экзамена, но также укладываться в отведённое для него время. Правда, стоит отметить, что в 2022 году экзамен обновился. Составители усложнили некоторые вопросы, добавили новые задания. А потому хотя бы несколько онлайн занятий по химии лишними точно не будут. Главное, выбирать репетитора с большим опытом подготовки к ЕГЭ.
- Не зацикливаться на одном формате вопросов. Даже если больше всего сложностей вызывают задания, где нужно самостоятельно формулировать ответы, всё равно решайте как можно больше и других вопросов. Практика никогда не будет лишней. Старайтесь уделять внимание и практическим ответам (задачам), и теории предмета.
- Используйте наглядность. Рисуйте майнд-карты, схемы, таблицы, пользуйтесь чужими наработками, которых много в интернете. Это поможет вам запомнить сложные темы, дать правильные ответы на экзамене.
- Используйте гаджеты. Да, вы не ослышались. Телефон или компьютер можно использовать для повышения уровня своих знаний. Это не только онлайн занятия по химии, но и различные полезные приложения. Теперь даже в метро или на прогулке вы сможете повторять сложные моменты, которые требуют вашего внимания.
Организационные моменты
Особого внимания заслуживают организационные моменты в подготовке к ЕГЭ и на самом экзамене. На онлайн занятиях по химии вы много раз опробуете свои силы, поймёте, сколько времени примерно нужно на решение вопросов.
Всего на экзамене у ученика будет три с половиной часа. Этого времени вполне достаточно для ответа на все вопросы (еще и остаться может лишнее). Но это при условии хорошей подготовки к ЕГЭ.
Кроме того, ученику разрешено во время экзамена использовать различных «помощников». Это обычный и инженерный калькулятор. Главное, чтобы он не был программируемым – иначе на экзамен с ним пройти не получится.
Также можно использовать периодическую таблицу Менделеева. Но на экзамене она будет отличаться от той, что вы использовали на онлайн занятиях по химии и в школе. На ней не будет ярких цветов, а главная и побочная подгруппы будут не подписаны. Определять их по принципу справа и слева не стоит – это окажется неверно.
Также на экзамене можно пользоваться электрохимическим рядом напряжений металлов, таблицей растворимости солей, кислот, оснований в воде. А это уже мощное подспорье на экзамене. Ведь огромный пласт информации не нужно заучивать – он может быть перед вашими глазами.
Во время подготовки на онлайн занятиях по химииили самостоятельно помните, что нужно оставить время для переноса ответов в чистовик и дополнительной проверки. Черновики на ЕГЭ не оцениваются, даже если там дан правильный ответ.
Если вас не устроил результат экзамена, можно подать апелляцию. Правда, первая часть экзамена не может быть оспорена. Пересмотреть комиссия согласна лишь ту часть, где ученик сам формулирует ответы на вопросы. Но если вы решили подать апелляцию, помните, комиссия пересмотрит не один вопрос, а все из второй части. А значит, может не только вернуть баллы, но и снизить их за другие ответы.
Получить желаемую профессию возможно только при удачной сдаче ЕГЭ. Помогут в сдаче ЕГЭ по химии репетиторы нашей онлайн школы. Записывайтесь на первый пробный урок:
Советы экспертов как решать задачи
- внимательно читайте условия задачи и записывайте на черновик номера выбранных вариантов;
- соблюдайте последовательность вариантов ответа, если она требуется в вопросе;
- при решении задач по неорганической химии помните как взаимодействует каждый элемент с другими веществами, а не только реакции и свойства целого класса;
- даже если вам кажется, что вариант точно ошибочный, перепроверьте его;
- при записи уравнений всегда уравнивайте все элементы или ищите ошибку, если равенство не получилось;
- если нужно написать 1 вариант ответа, а вы видите несколько – пишите тот, в котором точно уверены;
- в развернутых ответах давайте лишь один вариант и подкрепляйте его аргументом или решением;
- всегда пишите в задачах второй части «Дано», так как это поможет упорядочить мысли и условие задания;
- если вы не знаете ответ и ни один из вариантов не кажется вам верным, выберите любой наугад – вам может повезти, а это плюс драгоценные баллы.
Помните, на онлайн занятиях по химии на самом экзамене не стоит ограничиваться только знаниями предмета. Включите фантазию, логическое мышление, память и знания из других наук. Не паникуйте и концентрируйтесь на вопросах. Не задерживайтесь на сложных местах и не спешите. У вас есть 3,5 часа и этого должно хватить на все, включая проверку. Желаем вам успехов!
Методические рекомендации по обеспечению качества
подготовки учащихся к сдаче ЕГЭ по химии
Данные
рекомендации содержат обобщающий материал в виде отбора основного содержания,
обобщающих таблиц, кластеров, схем по некоторым темам и тренировочные тестовые задания
с ответами в конце каждой темы.
Материалы
учителя смогут использовать как на этапе обучения, так и для организации
системы текущего контроля.
Учащиеся и
выпускники школы могут самостоятельно, используя обобщающие таблицы, получить
необходимую информацию для повторения, а различный уровень сложности и тип
тестовых заданий помогут им самостоятельно проверить и оценить уровень своей
подготовки по темам данного курса.
Анализ результатов аттестации выпускников средней
школы в форме единого государственного экзамена (ЕГЭ) позволил выявить ряд
недостатков в освоении учащимися знаний и умений, составляющих основу их химической
подготовки. В связи с этим встала необходимость дальнейшего совершенствования
методики обучения химии и подготовки учащихся к ЕГЭ.
В процессе изучения курса химии уже в основной
школе необходимо обратить большое внимание на закрепление и обобщение материала
в краткой лаконичной форме. В учебном процессе следует уделять больше внимания
формированию общеучебных умений и навыков. Целесообразно сделать акцент на работу
с текстом, рисунками, схемами, извлечение и анализ информации из различных
источников. Выполнение заданий с различного
рода схемами заставляет школьников более серьезно относиться к иллюстрациям
учебника, использовать их не только для конкретизации учебного материала, но и
в качестве дополнительного источника знаний.
Особое внимание следует обратить на
формирование у школьников умения кратко, четко, по существу вопроса устно и
письменно излагать свои знания.
При организации текущего и тематического контроля
знаний учащихся использовать задания в тестовой форме разного типа и уровня
сложности, аналогичные заданиям ЕГЭ: с выбором одного или нескольких верных
ответов, на установление соответствия и последовательности процессов и явлений
природы.
При подготовке вариантов использован открытый сегмент
Федерального банка экзаменационных материалов, размещенный на сайте
Федерального института педагогических измерений (www.fipi.ru) –
официального разработчика тестовых заданий ЕГЭ.
Рекомендации по выполнению тестовых заданий
Прежде чем начать что-то делать, необходимо прочитать
инструкцию по выполнению данного задания, так как инструкция всегда содержит
полезную информацию!
Затем внимательно надо прочитать задание до конца и
выделить вопрос, на который требуется ответить. Далее стоит посмотреть на
варианты ответа, вполне возможно, что, рассуждая логически, можно будет
отбросить лишнее и определить правильный ответ.
Задания лучше выполнять по порядку. Но если вы
чувствуете, что не можете ответить на вопрос, то не стоит тратить драгоценное
время, следует перейти к следующему заданию.
Один и тот же элемент знаний проверяется в нескольких
заданиях, поэтому при подготовке надо обратить внимание, прежде всего на те
темы, без знания которых не обойтись при выполнении максимального числа
заданий. Именно такие темы по общей и неорганической химии рассмотрены в данном
пособии.
Для того, чтобы рационально организовать повторение
материала при подготовке к экзамену по химии, целесообразно поддерживаться
следующей его последовательности:
1)
состав атома, его свойства
(радиус, электроотрицательность, окислительно-восстановительные свойства), их
зависимость от положения химического элемента в Периодической системе и изменение
этих свойств в главных подгруппах и периодах;
2)
способы образования
молекул, виды связи, влияние вида связи на свойства веществ;
3)
типы химических реакций,
способы составления уравнений ОВР и реакций с участием ионов (на примерах
свойств неорганических и органических веществ важнейших классов);
4)
основные закономерности
химических реакций;
5)
способы получения
неорганических и органических веществ важнейших классов, основанные на их
свойствах;
6)
алгоритмы решения
расчетных задач.
Тема. Строение вещества
Проверяемые элементы содержания в КИМах ЕГЭ. Химическая связь: ковалентная (полярная и неполярная),
ионная, металлическая, водородная. Способы образования ковалентной связи.
Характеристики ковалентной связи: длина и энергия связи. Образование ионной
связи. Понятие об электроотрицательности химических элементов. Заряды ионов.
Степень окисления.
Вещества молекулярного и немолекулярного строения.
Зависимость свойств веществ от особенностей их кристаллической решетки.
Таблица. Характеристика связей
|
Признаки сравнения |
Ионная связь |
Металлическая связь |
|
Определение |
Связь между ионами |
Связь в металлах между ионами за счет обобществленных электронов |
|
Соединяющиеся частицы |
Ионы |
Ион-атомы и электроны |
|
Какие элементы участвуют |
Атомы элементов с большой разностью в ЭО. Ме + неМе |
Атомы металлов |
|
Частицы в узлах кристаллической решетки |
Ионы |
Ион-атомы |
|
Тип кристаллической решетки |
Ионная |
Металлическая |
|
Характер связи между частицами |
Электростатическое взаимодействие |
Связь между ион-атомами и свободными электронами |
|
Прочность связи |
Прочная |
Разной прочности |
|
Характерные физические свойства |
Твердые, тугоплавкие, многие растворимы в воде. Растворы и расплавы |
Твердое агрегатное состояние (кроме ртути), металлический блеск, |
|
Примеры |
MgF2, |
Fe, |
|
Ковалентная связь |
||
|
Неполярная |
Полярная |
|
|
Определение |
Связь, образованная за счет общих электронных пар |
|
|
Соединяющиеся частицы |
Атомы |
|
|
Какие элементы участвуют |
Разница в ЭО отсутствует. Атомы одного химического элемента |
Разница в ЭО небольшая; неМе + неМе |
|
Механизм образования |
Обменный: каждый атом по одному е Донорно-акцепторный: один атом имеет неподеленную пару е, другой – |
|
|
Виды |
σ – образована при перекрывании атомных орбиталей по линии, π — образована при перекрывании атомных орбиталей вне линии, |
|
|
Частицы в узлах кристаллической решетки |
Атомы, молекулы |
|
|
Тип кристаллической решетки |
Атомная, молекулярная |
|
|
Характер связи между частицами |
Атомная – ковалентные связи Молекулярная – силы межмолекулярного взаимодействия |
|
|
Прочность связи |
Атомная – очень прочная; молекулярная — слабая |
|
|
Характерные физические свойства |
Атомная: очень твердые, тугоплавкие, нерастворимые в воде. Молекулярная: при обычных условиях – любое агрегатное состояние, |
|
|
Примеры |
Атомная: С (алмаз) Молекулярная: Cl2, O2 |
Атомная: SiO2 Молекулярная: HCl, CO2 |
|
Водородная связь |
||
|
Определение |
Связь между положительно поляризованными атомами водорода одной |
|
|
Соединяющиеся частицы |
Межмолекулярная Внутримолекулярная |
|
|
Какие элементы участвуют |
Н и F, O, N |
|
|
Характер связи |
Электростатическое притяжение полярных молекул |
|
|
Прочность связи |
Малоустойчивая, легко разрывается |
|
|
Характерные физические свойства |
Температуры кипения и плавления веществ выше, чем у подобных веществ |
|
|
Примеры |
Межмолекулярная: HF, H2O, NH3, спирты, амины, аминокислоты Внутримолекулярная: белки, ДНК и др. |
Тестовые задания
А1. Вещество,
молекула которого обладает ковалентной полярной связью:
1) вода, 2) хлор, 3) алмаз, 4) фосфор.
А2. Наиболее
выражен характер ионной связи в соединении:
1) NaCl 2) LiCl 3) KCl 4) HCl
А3. Вещество
с ионным типом связи:
1) SO3 2) SiF4 3) HCl 4)
RbF
А4. Ковалентная
неполярная связь характерна для соединения:
1) CrO3 2) P2O5 3) SO2
4) F2
А5. Химическая
связь в бромиде калия:
1) ионная 2) ковалентная
полярная
3) ковалентная неполярная 4) металлическая
А6. Химическая
связь между атомами элементов с порядковыми номерами 8 и 16:
1) ионная 2) ковалентная
полярная
3) ковалентная неполярная 4) водородная
А7. Связь
в соединении, образованном атомом водорода и элементом, распределение
электронов в атоме которого 2,8,6:
1) ионная 2) ковалентная
полярная
3) ковалентная неполярная 4) водородная
А8. В
молекуле С2Н5ОН наиболее полярная связь образуется между
атомами:
1) С и О 2) О и Н 3) С и Н 4) С и С
А9. Соединениями
с ковалентной полярной и ковалентной неполярной связью являются,
соответственно:
1) вода и сероводород 2) бромид калия и азот
3) аммиак и водород 4) кислород и метан
А10. Водородная
связь образуется между молекулами веществ:
1) С2Н6 2) С2Н5ОН 3)
СН3ОСН3 4) СН3СОСН3
А11. Химическая
связь между молекулами воды:
1) ковалентная полярная 2) ковалентная неполярная
3) водородная 4) ионная
А12. В
аммиаке и хлориде бария химическая связь соответственно:
1) ионная и ковалентная полярная
2) ковалентная полярная и ионная
3) ковалентная неполярная и металлическая
4) ковалентная неполярная и ионная
А13. Вещества
только с ионной связью приведены в ряду:
1) F2,
CCl4,
KCl 2) NaBr, Nа2O, KI 3)
SO2,
P4,
CаF2 4)
H2S, Br2, K2S
А14. Соединение
с ионной связью образуется при взаимодействии:
1) CH4
и O2 2)
NH3 и
HCl 3) C2H6 и HNO3 4)
SO3
и H2O
А15. SP2-гибридизация
электронных облаков углерода наблюдается в молекуле:
1) бензола 2) метана 3) ацетилена 4)
пропана
А16. Наиболее
выражены кислотные свойства в соединении:
1) HF 2) HCl 3) HBr 4) HI
А17. Кратность
связи в молекуле кислорода равна:
1) 1 2) 2 3) 3 4) 4
А18. Тройная
связь имеется в веществе состава:
1) NH3 2) CaCl2 3) O3 4)
CO
А19. В
молекуле какого вещества имеет место π-связь?
1) бутан 2) пропин 3) вода 4) аммиак
А20. Число
σ-связей в молекуле бензола равно:
1) 12 2) 6 3) 3 4) 4
А21. Наиболее
прочная химическая связь имеет место в молекуле:
1) F2 2)
Cl2 3)
O2 4)
N2
А22. Число
σ-связей в молекуле хлорметана:
1) 1 2) 2 3) 3 4) 4
А23. В
ковалентных водородных соединениях состава НЭ число общих электронных пар
равно:
1) 1 2) 2 3) 5 4) 4
А24.
Длина связи в молекулах H2Te
H2Se H2S
1) не изменяется 2) увеличивается
3) уменьшается 4) сначала уменьшается, а потом
увеличивается.
А25. По
донорно-акцепторному механизму образована одна из ковалентных связей в
молекуле:
1) О2 2) О3 3) Н2О 4)
Н2О2
А26. Вещество
с молекулярной кристаллической решеткой:
1) железо, 2) алмаз 3) хлорид натрия 4) углекислый
газ
А27.
Какие из утверждений являются верными?
А. Вещества с молекулярной кристаллической решеткой имеют низкие
температуры плавления и низкую электропроводность.
Б. Вещества с атомной кристаллической решеткой пластичны и обладают
высокой электропроводностью.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба утверждения
неверны
А28. Для
веществ с атомной кристаллической решеткой характерна:
1) высокая твердость 2) низкая
температура плавления
3) низкая температура кипения 4) летучесть
А29. Веществами
молекулярного строения являются все вещества ряда:
1) сера, поваренная соль, сахар; 2) поваренная соль,
сахар, глицерин;
3) сахар, глицерин, медный купорос; 4) сера, сахар, глицерин.
А30. К
веществам молекулярного строения относится:
1) CaO 2) C6H12O6 3) KF 4) C2H5ONa
А31. Немолекулярное
строение имеет:
1) P4 2)
O3 3)
B 4) I2
А32. Кристаллическая
решетка графита:
1) ионная 2) молекулярная 3) атомная 4) металлическая
А33. Молекулярное
строение имеет:
1) вода 2) оксид натрия 3) хлорид калия 4) алмаз
А34. Нафталин
– легкоплавкое кристаллическое вещество, потому что имеет кристаллическую
решетку:
1) молекулярную 2) ионную 3) металлическую 4) атомную
А35. Для
вещества с металлической кристаллической решеткой нехарактерным свойством
является:
1) низкая температура кипения 2) теплопроводность
3) хрупкость 4)
пластичность
А36. Кристаллическую
структуру, подобную структуре алмаза имеет:
1) кремнезем SiO2 2) оксид натрия
Na2O
3) оксид углерода (II)СО 4) белый фосфор Р4
А37. Молекулярную
кристаллическую решетку имеет соединение:
1) HBr 2) Li2O 3) BaO 4) KCl
А38. Молекулярную
кристаллическую решетку имеет каждое из двух веществ:
1) графит и алмаз 2) кремний и йод
3) хлор и углекислый газ 4) хлорид бария и оксид бария
А39. Кристаллические
решетки алмаза и графита:
1) атомные 2) металлические 3) ионные 4)
молекулярные
А40. Для
веществ с атомной кристаллической решеткой характерна:
1) высокая твердость 2) низкая температура
плавления
3) низкая температура кипения 4) летучесть
А41. Кристаллическая
решетка галогенов:
1) атомная 2) ионная 3) молекулярная 4) металлическая
А42. Молекулярное
строение имеет:
1) графит 2) сульфат железа (III)
3) оксид железа (III) 4) оксид углерода (IV)
А43. Молекулярное
строение имеет:
1) натрий 2) фруктоза 3) фосфат натрия 4) оксид
натрия
А44. Молекулярное
строение имеет:
1) Cl2 2) CaO 3) ZnCl2 4) NaBr
А45. Немолекулярное
строение имеет:
1) H2O 2) NH3 3) SiO2 4) CO2
А46. Число
σ-связей в молекуле уксусной кислоты равно:
1) четырем; 2) пяти; 3)
шести; 4) семи.
В1.
Установите соответствие между названием вещества и типом кристаллической
решетки
НАЗВАНИЕ ВЕЩЕСТВА ТИП КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ
1) графит а) ионная
2) «сухой лед» б) молекулярная
3) хлорид калия в) атомная
4) оксид кремния (IV) г) металлическая
В2.
Установите соответствие между формулой вещества и длиной связи в его молекуле:
ФОРМУЛА ВЕЩЕСТВА ДЛИНА СВЯЗИ
1)
HF а)
0,162 нм
2)
HCl б)
0,128 нм
3)
HBr в) 0,
092 нм
4)
HI г)
0,141 нм
В3. Установите
соответствие между названием химического соединения и видом связи между атомами
в этом соединении:
НАЗВАНИЕ СОЕДИНЕНИЯ ВИД СВЯЗИ
1)
Цинк а)
ионная
2)
Азот б)
металлическая
3)
Аммиак в)
ковалентная полярная
4)
хлорид кальция г)
ковалентная неполярная
В4.
Установите соответствие между видом связи в веществе и формулой химического
соединения:
ВИДЫ СВЯЗИ ФОРМУЛЫ СОЕДИНЕНИЙ
1)
ионная а)
H2
2)
металлическая б)
Ва
3)
ковалентная полярная в)
HF
4)
ковалентная неполярная г)
BaF2
В5.
Установите соответствие между формулой вещества и числом π-связей в его
молекуле:
ФОРМУЛА ВЕЩЕСТВА ЧИСЛО π-СВЯЗЕЙ В МОЛЕКУЛЕ
1)
H2SO3 а)
0
2)
C2Cl6 б) 1
3)
CH3COOH в) 2
4)
CS2 г)
3
д) 4
е) 5
В6.
Установите соответствие между формулой вещества и числом π-связей в его
молекуле:
ФОРМУЛА ВЕЩЕСТВА ЧИСЛО π-СВЯЗЕЙ В МОЛЕКУЛЕ
1)
HCOOH а) 0
2)
CO2 б)
1
3)
C2H2 в) 2
4)
HNO2 г)
3
д) 4
Тема. Химические реакции
Проверяемые элементы содержания в КИМах ЕГЭ. Классификация химических реакций. Окислительно-восстановительные
реакции.
Понятие о скорости
химической реакции. Факторы, влияющие на изменение скорости химической реакции.
(Приложение 2)
Обратимые и
необратимые химические реакции. Химическое равновесие и условия его смещения.
Электролитическая
диссоциация неорганических и органических кислот, щелочей, солей. Степень
диссоциации. Реакции ионного обмена.
Гидролиз солей.
Электролиз растворов и расплавов солей. Коррозия металлов.
Кластер «Классификация химических реакций»
Окислительно-восстановительные реакции
Кластер «Классификация ОВР»
Таблица «Важнейшие окислители и
восстановители»
|
Важнейшие окислители |
||
|
Элемент |
Высшая степень окисления |
Примеры окислителей |
|
N |
+5 |
HNO3 |
|
Mn |
+7 |
KMnO4 |
|
Cr |
+6 |
K2Cr2O7 K2CrO4 |
|
Pb |
+4 |
PbO2 |
|
F |
0 |
F2 |
|
Bi |
+5 |
KBiO3 |
|
S |
+6 |
H2SO4 |
|
Важнейшие восстановители |
||
|
Элемент |
Низшая степень окисления |
Примеры восстановителей |
|
N |
-3 |
NH3 |
|
S |
-2 |
H2S |
|
Cl Br I |
-1 |
HCl HBr HI |
|
P |
-3 |
PH3 |
|
H |
-1 |
NaH CaH2 |
|
металлы |
0 |
Al Zn Mg |
|
Вещества, проявляющие окислительно – восстановительную двойственность |
||
|
Элемент |
Степень окисления |
Примеры |
|
N |
0 +3 |
N2 HNO2 |
|
S |
0 +4 |
S SO2 H2SO3 |
|
Fe |
+2 |
FeCl2 |
Классификация химических реакций
А1.
Реакцию, протекающую с поглощением тепла, называют:
1.
экзотермической 3.
реакцией соединения
2.
реакцией обмена 4.
эндотермической
А2.
Реакцию, уравнение которой 2Н2О + 2Na = 2NaOH + H2 ↑+ Q, относят к реакциям:
1.
замещения, экзотермическим
2.
разложения,
экзотермическим
3.
присоединения,
эндотермическим
4.
обмена, эндотермическим
А3. Реакцию, уравнение которой 3Н2 + N2
NH3 + Q, относят к реакциям:
1.
обратимым, экзотермическим
2.
необратимым,
экзотермическим
3.
обратимым, эндотермическим
4.
необратимым,
эндотермическим
А4.
Среди перечисленных реакций:
СuO + H2
= Cu + H2O
Fe + H2O + O2 = Fe(OH)3
KOH + HCl = KCl + H2O
CaO + H2SO4 = CaSO4 + H2O, число окислительно-восстановительных реакций
равно:
1.
1 2. 2 3.
3 4.4
А5.
Реакция, протекающая на границе раздела двух фаз, называется:
1.
гетерогенной
2.
окислительно-восстановительной
3.
гомогенной
4.
каталитической
А6.
Эндотермический является реакция:
1.
2Mg + O2 = 2MgO
2.
CaO + H2O = Ca(OH)2
3.
2KMnO4 = K2MnO4
+ MnO2 + O2
4.
H2 + Cl2 =
2HCl
А7. Укажите уравнение, соответствующее полному сгоранию
нитропропана в кислороде без катализатора:
1.
4 С3Н7NO2 + 19 O2 = 12 CO2
+ 14 Н2O + 4 NO2
2.
4 С3Н7NO2 + 15 O2 = 12 CO2
+ 14 Н2O + 2 N2
3.
2 С3Н7NO2 + 8 O2 = 6 CO2 +
7 Н2O + NO2
4.
4 С3Н7NO2 + 17 O2 = 12 CO2
+ 14 Н2O + 4 NO
А8. Химическая реакция является экзотермической, если
разница между суммарной энергией связей в исходных веществах и суммарной
энергией связей в продуктах реакции:
1.
больше нуля 3.
меньше нуля
2.
равна нулю 4.
может быть положительно и отрицательной
А9. Среди приведённых реакций обратимой является:
1.
KOH + HCl = KCl + H2O
2.
N2
+ 3H2 =
2NH3
3.
FeCl3
+ 3NaOH = Fe(OH)3 + 3NaCl
4.
Na2O + 2HCl = 2NaCl
+ H2O
А10. Необратимой реакцией является:
1.
2SO2 + O2 =
2SO3
2.
N2 + 3H2 =
2NH3
3.
4NH3 + 3O2 =
2N2 + 6H2O
4.
C2H4 + H2
= C2H6
А11. Реакция горения аммиака 4 NH3 (г)+ 3O2(г) = 2 N2(г) + 6H2O(ж) + Q является реакцией:
1.
соединения,
каталитической, эндотермической
2.
замещения, каталитической,
экзотермической
3.
окислительно-восстановительной,
некаталитической, экзотермической
4.
обмена, некаталитической,
эндотермической
А12. Среди перечисленных реакций: а)
С + О2 = СО2
б) СаСО3 = СаО + СО2
в) Са(ОН)2 = СаО + Н2О
г) Н2 + Сl2 = 2HCl
количество эндотермических реакций равно:
1.
1 2. 2 3.
3 4. 4
А13. Взаимодействие железа с сульфатом меди (II)
относится к реакции:
1) соединения 2) разложения 3) замещения 4) обмена
А14. Из перечисленных типов всегда
окислительно-восстановительными бывают реакции:
1) соединения 2) разложения 3) замещения 4) обмена
А15. К реакциям ионного обмена относятся реакции
1) разложения 2) замещения
3) нейтрализации 4) соединения
А16. Реакцией нейтрализации является:
1) 2HCl + BaCO3 = BaCl2
+ H2O + CO2
2) CaCl2
+ Na2CO3 = CaCO3
+ 2NaCl
3) Ba(OH)2 + H2SO4 = BaSO4 + 2 H2O
4) 3 NaOH + FeCl3 = Fe(OH)3 + 3 NaCl
А17. Взаимодействие карбоната натрия с гидроксидом
кальция относится к реакции:
1) обмена 2) соединения 3) разложения 4) замещения
А18. Взаимодействие кальция с соляной кислотой
является реакцией:
1) соединения и экзотермической
2) замещения и экзотермической
3) обмена и экзотемической
4) замещения и эндотермической
А19. Реакциям обмена и замещения соответствуют
схемы превращений:
1)
HCl + CuO = … и NaOH + SO2 = …
2)
HNO3 + Al(OH)3 = … и C3H8 + O2
= …
3) С2H2Br2 = … и HNO3 + CaO =…
4) MgO +HCl =… и С2H6 + Br2
=…
А20. Взаимодействие этилена с бромоводородом
является реакцией:
1) соединения, обратимой
2) замещения, необратимой
3) обмена, необратимой
4)
соединения, необратимой
А21. Согласно термохимическому уравнению реакции
СН4(г) + 2О2(г) = СО2(г)
+ 2Н2О(г) + 802 кДж количество теплоты, выделившейся при
сжигании 24г метана, равно:
1.
1604 кДж 2. 1203
кДж 3. 601,5 кДж 4. 401 кДж
А22. В результате реакции, термохимическое
уравнение которой
С2Н5ОН
+ 3О2= 2СО2 + 3Н2О + 1374 кДж выделилось 687
кДж теплоты. Количество вещества этанола равно:
1.
0,5 моль 2. 1
моль 3. 1,5 моль 4. 2 моль
А23. Согласно термохимическому уравнению 2NO + O2 = 2NO2 + 113,7 кДж при образовании 1 моль NO2:
1.
выделяется 113,7 кДж
теплоты
2.
поглощается 56,9 к Дж
теплоты
3.
выделяется 56,9 кДж
теплоты
4.
поглощается 113,7 кДж
теплоты
В1.
Установите соответствие между реагирующими веществами и продуктами их
взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ
ВЗАИМОДЕЙСТВИЯ
А) Fe2O3 + SO3 = 1)
FeSO4
Б) Fe2O3
+ H2SO4 = 2)
Fe(NO3)3 +H2O
В) Fe2O3
+ N2O5 = 3)
Fe2(SO4)3
Г) Fe2O3
+ HNO3 = 4) Fe2(SO4)3
+ H2O
5)
Fe(NO3)2 + H2O
6)
Fe(NO3)3
В2.
Установите соответствие между реагирующими веществами и продуктами их
взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ
ВЗАИМОДЕЙСТВИЯ
А) Na2CO3 + HCl 1)
NaCl + CaCO3
Б) Na2CO3
+ CO2 + H2O 2) NaHCO3
В) Na2CO3
+ H2O 3) NaHCO3
+ HCl
Г) Na2CO3
+ CaCl2 4) NaOH + CO2
+ H2O
5) NaOH + NaHCO3
6)
NaCl + CO2 + H2O
В3.
Установите соответствие между реагирующими веществами и продуктами их
взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ
ВЗАИМОДЕЙСТВИЯ
А) KOH + SO3 (изб.) = 1)
KHSO4
Б) KOH + SO3
(недост.) = 2)
K2SO3
В) KOH + СO2 (изб.) = 3) K2CO3 и H2O
Г) Б) KOH + СO2 (недост.) = 4) K2SO4 и H2O
5)
KHCO3
6)
KHSO3
В4.
Установите соответствие между реагирующими веществами и продуктами их
взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ
ВЗАИМОДЕЙСТВИЯ
А) KHCO3
+ KOH = 1) KNO3 + CO2
+ H2O
Б) KHCO3
+ HCl = 2) KCl + Na2CO3
В) K2CO3
+ HNO3 = 3) K2CO3
+ H2O
Г) K2CO3
+ BaCl2 = 4) KCl + H2O
+ CO2
5) BaCO3 + KCl
В5.
При растворении карбоната кальция в избытке соляной кислоты выделилось 5,6
л (н.у.) газа. Масса карбоната кальция равна ________ г. (Запишите число с
точностью до целых).
В6.
Масса соли, образовавшейся при растворении оксида железа (III) массой 80
г в избытке азотной кислоты, равна ___________ г. (Запишите число с точностью
до целых).
Скорость химических реакций. Химическое равновесие.
А1. Сумма коэффициентов в молекулярном уравнении реакции
между гидроксидом алюминия и соляной кислотой равна:
1.
7 2. 8 3.
6 4. 4
А2.
В ходе химических реакций тепловая энергия реакционной системы:
1.
не изменяется 3.
поглощается
2.
выделяется 4.
может поглощаться или выделяться
А3.
Скорость химической реакции характеризует:
1.
изменение количества
веществ за единицу времени в единице объёма или единице площади
2.
время, за которое
заканчивается химическая реакция
3.
число структурных единиц
вещества, вступивших в химическую реакцию
4.
движение молекул или ионов
реагирующих веществ относительно друг друга
А4.
Скорость химической реакции между медью и азотной кислотой зависит от:
1.
массы меди 3.
объёма кислоты
2.
концентрации кислоты 4.
объёма колбы
А5.
Скорость химической реакции между цинком и азотной кислотой зависит от:
1.
изменения давления 3.
природы кислоты
2.
изменения температуры 4.
присутствия индикатора
А6. При увеличении температуры на 30оС
скорость реакции возрастает в 8 раз. Чему равен температурный коэффициент
реакции?
1.
8 2. 2 3.
3 4. 4
А7. С наибольшей скоростью при комнатной температуре
протекает реакция взаимодействия:
1.
углерода с кислородом
2.
железа с раствором
уксусной кислоты
3.
железа с соляной кислотой
4.
растворов гидроксида
натрия и серной кислоты
А8.
Увеличение температуры проведения реакции:
1.
не влияет на её скорость,
так как теплота не может быть участником превращения веществ
2.
увеличивает скорость
реакции, так как увеличивается число эффективных соударений молекул
3.
уменьшает скорость
реакции, так как увеличивается число упругих соударений молекул
4.
не влияет на скорость
реакции, так как в равной мере увеличивается число эффективных и упругих
соударений молекул
А9.
Скорость химической реакции горения угля в кислороде уменьшается при:
1.
увеличении концентрации
кислорода
2.
повышении температуры
3.
понижении температуры
4.
повышении давления
А10. Молекулы оксида азота (IV)
(бурого цвета) могут в определённых условиях димеризоваться, образовав
бесцветную жидкость N2O4:
2NO2 ↔ N2O4 + 55 кДж/моль.
Чтобы оксид азота (IV)
максимально перевести в бесцветный димер, необходимо систему:
1.
охладить
2.
нагреть
3.
подвергнуть облучению
солнечным светом
4.
выдержать при комнатной
температуре длительное время
А11. Химическое равновесие в системе C4H10(г) ↔ С4Н8(г) + Н2(г)
– Q можно сместить в сторону продуктов реакции:
1.
повышением температуры и
повышением давления
2.
повышением температуры и
понижением давления
3.
понижением температуры и
повышением давления
4.
понижением температуры и
понижением давления
А12.
Сумма коэффициентов в уравнении реакции горения пропана равна:
1.
6 2. 12 3.
13 4. 24
А13.
В ходе химической реакции энергия:
1.
всегда выделяется
2.
всегда поглощается
3.
может выделяться или
поглощаться
4.
не выделяется и не
поглощается
А15. Скорость
прямой реакции N2 + 3H2
= 2NH3
+ Q возрастает при:
1.
увеличении концентрации
азота
2.
уменьшении концентрации
азота
3.
увеличении концентрации
аммиака
4.
уменьшении концентрации
аммиака
А16. При повышении температуры равновесие химической реакции смещается в
сторону:
1.
продуктов реакции
2.
исходных веществ
3.
эндотермической реакции
4.
экзотермической реакции
А17.Реакция,
которая соответствует краткому ионному уравнению
Н+ + ОН— ↔ Н2О?
1.
ZnCl2 + 2NaOH = Zn(OH)2
+ 2NaCl
2.
H2SO4 +
Cu(OH)2 = CuSO4 + 2H2O
3.
NaOH + HNO3 = NaNO3
+ H2O
4.
H2SO4 +
Ba(OH)2 = BaSO4 + 2H2O
А18. Фактор, не оказывающий влияния на скорость
химической реакции в растворах
1.
концентрация веществ
2.
использование катализатора
3.
использование индикатора
4.
объём реакционного сосуда
А19. Для увеличения выхода аммиака по уравнению
реакции
N2 + 3H2 ↔ 2NH3
+ Q необходимо одновременно:
1.
повысить температуру,
понизить давление
2.
повысить давление,
понизить температуру
3.
повысить давление и
температуру
4.
понизить давление и
температуру
А20. Уравнение реакции CuCl2 + 2KOH = Cu(OH)2 ↓+ 2KCl
соответствует сокращённое ионное уравнение:
1.
CuCl2 + 2OH = Cu2+
+ 2OH— + 2Cl—
2.
Cu2+ + KOH = Cu(OH)2
+ K+
3.
2Cl— + 2K+ =
2KCl
4.
Cu2+ + 2OH—
= Cu(OH)2↓
А21. В сокращённом ионном уравнении реакции
азотной кислоты с гидроксидом меди (II) сумма коэффициентов равна:
1.
5 2.
6 3. 3 4. 4
А22.
Скорость химической реакции между металлом и серой не зависит от:
1.
температуры
2.
площади поверхности
соприкосновения веществ
3.
давления
4.
природы металла
А23.
До конца идёт реакция:
1.
Na2SO4 + KCl→ 3. H2SO4
+ BaCl2→
2.
KNO3
+ NaOH→ 4. CuCl2 + Na2SO4→
А24.
С наименьшей скоростью протекает реакция между:
1.
железным гвоздём и 4%-ным
раствором CuSO4
2.
железной стружкой и 4%-ным
раствором CuSO4
3.
железным гвоздём и 10%-ным
раствором CuSO4
4.
железной стружкой и
10%-ным раствором CuSO4
А25.
При химическом равновесии концентрации веществ:
1.
не изменяются
2.
увеличиваются для
продуктов, уменьшаются для исходных веществ
3.
уменьшаются для продуктов,
увеличиваются для исходных веществ
4.
не изменяются для
продуктов, уменьшаются для исходных веществ
А26. Химическим реакциям С + О2 = СО2
и С + СО2 = 2СО соответствуют тепловые эффекты:
1.
+ Q и
– Q 2. + Q и + Q 3.
— Q
и – Q 4. — Q и — Q
А27. На скорость реакции между уксусной кислотой и
этанолом не влияет:
1.
катализатор
2.
температура проведения
реакции
3.
концентрация исходных
веществ
4.
давление
А28. На состояние химического равновесия реакции N2 + O2 ↔2NO – Q не влияет:
1.
изменение температуры
2.
повышение давления
3.
увеличение концентрации
кислорода
4.
уменьшение концентрации
оксида азота (II)
А29. Веществом, вступившим в реакцию, сокращённое ионное уравнение
которой …+2H+ = Cu2+ + 2H2O:
1.
оксид меди (II) 3.
карбонат меди (II)
2.
нитрат меди (II) 4.
гидроксид меди (II)
А30.Для увеличения скорости химической реакции
FeO(тв) + CO(г) = Fe(тв) + CO2(г) + 17 кДж необходимо:
1.
увеличить концентрациюСО2
2.
уменьшить концентрацию СО2
3.
уменьшить температуру
4.
увеличить степень измельчения
FeO
А31. Для увеличения скорости химической реакции
2CuS(тв)
+ 3O2(г)
= 2CuO (тв)
+ 2SO2(г)
+ 2920 кДж необходимо:
1.
увеличить концентрацию SО2
2.
уменьшить концентрацию SО2
3.
уменьшить температуру
4.
увеличить степень
измельчения CuS
А32. Изменение давления смещает равновесие в
системе:
1.
H2(г)
+ S(тв) ↔ H2S(г)
2.
3H2(г)
+ N2(г) ↔ 2NH3(г)
3.
N2(г)
+ O2(г) ↔ 2NO(г)
4.
H2(г)
+ Cl2(г) ↔ 2HCl(г)
А33. При понижении давления химическое равновесие смещается влево в
реакции, уравнение которой:
1.
2СО(г) + О2(г)
↔ 2СО2(г) + Q
2.
N2(г) + O2(г) ↔ 2NO(г) – Q
3.
H2(г)
+ Cl2(г)
↔ 2HCl(г)
+ Q
4.
SO2Cl2(г) ↔ SO2(г) + Cl2(г) – Q
А34. Химическое равновесие в системе СО2(г) + Н2О(ж)
↔ Н2СО3(ж) + Q сместится вправо при:
1.
понижении температуры
2.
введении катализатора
3.
понижении давления
4.
уменьшении концентрации СО2
А35. Для увеличения скорости взаимодействия
железа с соляной кислотой следует:
1.
добавить ингибитор 3.
понизить температуру
2.
повысить давление 4.
увеличить концентрацию HCl
А36. С наибольшей скоростью с водой реагирует:
1.
Pb 3. Mg
2.
K 4. Fe
А37. С наибольшей скоростью с кислородом при
комнатной температуре реагирует:
1.
Fe 3. Al
2.
Zn 4. Na
А38. С наибольшей скоростью с водородом
реагирует:
1.
Cl2 3. F2
2.
S 4.
C
А39. Скорость реакции водорода с азотом увеличится
при:
1.
понижении температуры
2.
понижении давления
3.
разбавлении смеси воздухом
4.
использовании катализатора
А40. В реакции С2Н6(г) ↔ С2Н4(г)
+ Н2(г) – Q увеличить выход С2Н4
можно:
1.
повысив давление
2.
повысив температуру
3.
повысив концентрацию Н2
4.
применив катализатор
А41. Скорость реакции угарного газа с
кислородом уменьшится при:
1.
понижении температуры
2.
понижении давления
3.
повышении концентрации
кислорода
4.
понижении концентрации
углекислого газа
А42. В реакции С3Н6(г) + Н2(г)=
С3Н8(г) – Q увеличить выход С3Н8
можно:
1.
понизив температуру
2.
применив катализатор
3.
понизив концентрацию Н2
4.
повысив давление
А44. Давление влияет на скорость реакции между:
1.
гидроксидом меди(II) и
серной кислотой
2.
цинком и соляной кислотой
3.
азотом и кислородом
4.
серой и железом
А45. Давление не влияет на равновесие в реакции:
1.
N2(г)
+ 3H2(г) ↔ 2NH3(г)
2.
N2(г)
+ O2(г) ↔ 2NO(г)
3.
C(тв) + CO(г)
↔ 2CO(г)
4.
CO2(г) + H2O(ж) ↔ H2CO3(р—р)
А46. Скорость реакции Fe + H2SO4 = FeSO4 + H2
+ Q понизится при:
1.
повышении температуры
2.
понижении давления
3.
повышении давления
4.
разбавлении раствора кислоты
А47. С наибольшей скоростью при обычных условиях
протекает реакция:
1.
Zn + HCl (5% р-р)
2.
Zn + HCl (10% р-р)
3.
Zn + HCl (20% р-р)
4.
NaOH (5% р-р) + HCl(5% р-р)
Общая и неорганическая химия
По итогам прошлого года можно выделить задания, в которых большинство выпускников допустили ошибки. Из блока «Общая и неорганическая химия» это задания 19, 20, 24, 30, 31, 32 (соответственно, № 17, 18, 22, 29, 30, 31 в нумерации 2022 года).
Задание «Классификация химических реакций в неорганической и органической химии»
Большие трудности вызвало выполнение задания «Классификация химических реакций в неорганической и органической химии». Вероятная причина снижения результативности — изменение формы ответа: вместо фиксированных двух ответов необходимо выбрать все правильные (а их число может быть от двух до четырех).
При выполнении этого задания нужно внимательно анализировать каждое предложенное утверждение, а иногда подбираться к ответу от обратного: «это утверждение точно неверно».
Обратите внимание, что в ЕГЭ 2022 года таких заданий с открытым ответом стало три: №12, №17, №18.
Задание «Скорость химической реакции, ее зависимость от различных факторов»
По-видимому, та же причина привела и к низкой результативности выполнения задания «Скорость химической реакции, ее зависимость от различных факторов» (№18 в новом формате ЕГЭ). При выполнении нужно помнить, что все факторы, влияющие на скорость реакции, условно можно отнести к левой части уравнения. То есть продукты реакции на скорость не влияют никак. Важно не путать скорость реакции и смещение равновесия, помнить, что слово «катализатор» относится к скорости, но никак не к равновесию. А при повышении температуры реакция всегда идет с большей скоростью.
Павел Лисицын/РИА Новости
Задание «Обратимые и необратимые химические реакции. Химическое равновесие и его смещение под действием различных факторов»
Задание №22 — это задание на соответствие, то есть к каждому фактору нужно подобрать направление смещения равновесия.
Особые сложности вызывает анализ ответной реакции равновесной системы на внешнее воздействие, если это воздействие вызвано добавлением твердых веществ в растворы. В этом случае в растворе появляются дополнительные ионы, способные влиять на состояние химического равновесия. Здесь речь идет о факторе «концентрация». Но важно понять, будет ли менять концентрацию добавленное вещество.
Если в систему вносят нерастворимое вещество, то оно никак не смещает равновесие. Точно так же не смещает равновесие и растворимое вещество, если оно не принимает участия в реакции.
Но если растворимое вещество в своем составе содержит те же ионы, какие есть в уравнении, то нужно смотреть, с какой стороны увеличивается их концентрация, а равновесие, соответственно, смещается в другую сторону.
И еще один случай, когда добавленное растворимое вещество смещает равновесие — если оно реагирует с ионами, которые находятся в обратимой реакции, и уменьшает их концентрацию.
Задание «Реакции окислительно-восстановительные»
В задании №29 нужно продемонстрировать умение составлять уравнение окислительно-восстановительной реакции с учетом коэффициентов и электронный баланс к этой реакции. Но часто участники экзамена баланс не засчитывают, так как он составлен к уравнению, не отвечающему условиям задания.
Также выпускники допускают традиционные ошибки:
• неверно выбирают окислитель и восстановитель для реакции;
• записывают уравнения несуществующих химических реакций, которые теоретически не противоречат окислительно-восстановительным превращениям, но практически не осуществимы;
• записывают уравнения реакций, которые не отвечают условиям задания;
• не учитывают характер среды и возможные взаимодействия между продуктами (например, кислота+щелочь) или продуктов с исходными веществами.
При выполнении этого задания нужно учитывать, что не допускается использовать воду в качестве реагента, так как это оговорено в условии задания.
Баллы снимаются, если в балансе неверно определены или записаны степени окисления (сначала пишется знак, а потом цифра).
Также частая ошибка — это неверно записанные процессы окисления и восстановления и, соответственно, неверно определенные окислитель и восстановитель.
Помните: окислитель-грабитель окисляет, забирает электроны, понижает свою степень окисления. Досадной ошибкой, лишающей балла, становится отсутствие множителей в балансе, без которых не будет и самого баланса. Ведь баланс — это равенство, которое должно заключаться в том, что число отданных электронов равно числу принятых. Без множителей запись будет неверной.
Aleksander Polyakov/Global Look Press
Задание «Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена»
В задании №30 сразу снижает результативность, если в списке веществ для проведения реакции ионного обмена появляются кислые соли.
Следует придерживаться такого принципа: если для реакции взяли кислую соль, в продуктах никогда не получится основание, так как любая кислая соль будет сразу реагировать с основанием.
Если вы будете контролировать себя таким образом, это поможет вам избежать ошибок.
Выпускники часто допускают следующие типичные ошибки:
• неверно выбирают реагенты, например, выбирают вещества, взаимодействие которых не удовлетворяет условиям протекания реакций ионного обмена до конца;
• не сокращают коэффициенты в сокращенном ионном уравнении;
• неверно записывают формулы ионов;
• неправильно определяют и записывают заряды ионов (записывать нужно так, как в таблице растворимости: сначала цифру, потом знак).
Задание «Реакции, подтверждающие взаимосвязь классов неорганических веществ»
При выполнении задания №31 школьники часто невнимательно читают описание конкретного химического эксперимента. Следовательно, неверно записывают продукты реакции, что приводит к нарушению отражения генетической связи, идея которой заложена в задании.
Например, при смешивании твердых гидроксида натрия и иодида аммония и дальнейшем нагревании образуется только газообразный аммиак (гидрат не образуется!)
Часто не учитываются специфические свойства представителей различных классов неорганических веществ, например, соединений хрома, алюминия. Уравнение считается записанным неверно, если в нем пропущен даже один коэффициент, или ошибочно записан хотя бы один индекс в формуле. К сожалению, типичной является ошибка, когда вместо формулы сульфита пишут сульфид. Учите номенклатуру!
Комбинированная расчетная задача
Традиционно самым сложным заданием с самым низким процентом выполнения является комбинированная расчетная задача (№33).
Она сложная, ее выполнение требует целого комплекса знаний и умений, в том числе:
• умения анализировать условия;
• понимать суть химических процессов, отраженных в условии;
• составлять уравнения химических реакций (согласно данным условия задачи), необходимых для выполнения стехиометрических расчетов;
• выстраивать алгоритм решения веществ, выполнять расчеты, необходимые для нахождения ответа;
• логически обосновывать все этапы решения.
Кроме того, участники экзамена часто допускают арифметические ошибки, не указывают размерности физических величин, путаются в обозначениях.
Немаловажное значение имеет грамотная запись данных, извлеченных из условия задания, которая отражает обоснованный логический подход к решению задачи. Но многие выпускники этого не делают.
Если во время подготовки к экзамену вы чувствуете, что не можете решить ни одну из задач подобного типа, может быть, лучше уделить больше внимания другим заданиям?
Органическая химия
В блоке «Органическая химия» наибольшее число ошибок было допущено в заданиях №11 (Гомология и изомерия. Гибридизация), №13 (Свойства азотсодержащих органических веществ), №32 (Взаимосвязь органических веществ), №34 (Установление молекулярной и структурной формулы вещества).
Aleksander Polyakov/Global Look Press
Гомология и изомерия. Гибридизация
При выполнении задания №11 помните: гомологи — это всегда представители одного класса с разным числом атомов, а изомеры могут принадлежать и к одному классу, и к разным, но общая формула, то есть число атомов, у них всегда одинаковое.
Задание, проверяющее знание свойств азотсодержащих органических веществ, часто вызывает проблемы при выполнении. Возможно, это связано с тем, что, изучая свойства кислородсодержащих веществ, школьники обращают внимание на их кислотные свойства. А с азотом все наоборот: аминогруппа проявляет основные свойства за счет не поделенной электронной пары на атоме азота. И чем больше смещена электронная плотность к азоту, тем сильнее основные свойства.
Выполняя задания, относящиеся к органической химии, следует иметь в виду, что химические свойства веществ одного класса являются способами получения веществ другого класса.
И если вы вдруг забыли, с чем реагируют спирты, то, возможно, вспомните, из чего могут быть получены альдегиды.
Внимательно читайте текст задания! Не исключено, что вы найдете в нем подсказки для себя.
Цепочка превращений органических веществ
Задание №32 из года в год вызывает типичные ошибки. Выпускники неверно записывают формулы органических веществ:
• вместо структурной появляется молекулярная формула,
• добавление лишней черточки к азоту образует несуществующий пятивалентный азот,
• бензольное кольцо отображают с указанными сверху атомами углерода.
Помимо ошибочно написанных продуктов реакции, пропускаются коэффициенты, теряются побочные продукты. А еще иногда вместо уравнения реакции бывает записана схема, а это неправильно, потому что в схеме реагенты, а иногда и побочные продукты, записаны не в строке, а над стрелочкой.
Установление молекулярной и структурной формулы вещества
При выполнении задания №34 нужно:
• установить молекулярную формулу органического вещества на основании вычислений с использованием физических величин;
• установить структурную формулу по указанным свойствам или способам получения;
• составить уравнение реакции.
Типичные ошибки здесь такие:
1. вместо молекулярной формулы выводится простейшее соотношение, не позволяющее составить правильную структурную формулу органического вещества;
2. неполный анализ условия задачи приводит к составлению не существующей, придуманной формулы без ориентации на указанные в задании свойства или способы получения вещества.
Для выполнения этой задачи необходимо знать свойства органических веществ.
При повторении органики начните с углеводородов, усвойте для себя, как особенности строения влияют на свойства веществ. Далее — кислородсодержащие. Как их можно получить из углеводородов? В чем проявляется окисление кислородсодержащих веществ по ряду спирт-альдегид-кислота?
Окисление в органике — это появление в молекуле атомов кислорода и двойной связи перед ним.
Свойства азотсодержащих органических веществ
Повторяя свойства азотсодержащих, помните, что аминогруппа — основание. А если в аминокислотах присутствует и аминогруппа, и карбоксильная группа, значит, они являются амфотерными соединениями и реагируют как с кислотами, так и с основаниями.
Поскольку самое главное, что определяет свойства органических веществ, — это их строение, запомните, что реакции идут по функциональным группам или по особенностям связи (одинарные связи алканов позволяют протекать только реакциям замещения, а кратными связями обусловлены реакции присоединения).
Таким образом, при подготовке к экзамену по химии важно уметь выделять нужную информацию, анализировать ее и фиксировать этапы решения задачи.
Полезные ссылки для подготовки к ЕГЭ по химии
• Чтобы хорошо сдать экзамен по химии нужно готовиться, повторять теорию и выполнять практические задания. Найти их можно в открытом банке заданий на сайте Федерального института педагогических измерений.
• Полезными будут и записи вебинаров по разбору заданий ЕГЭ на сайте РЦОИ города Москвы.
• Другой вид подготовки — диагностика в формате ЕГЭ. Проверить свои знания и потренироваться в заполнении экзаменационных бланков школьники могут в Центре независимой диагностики Московского центра качества образования. Записаться на них можно в разделе Центра на сайте МЦКО.
• Кроме того, в Библиотеке «Московской электронной школы» есть виртуальная лаборатория по химии, в которой учащиеся могут проводить безопасные научные опыты с помощью компьютера или планшета, а затем использовать полученные знания на практике. Также выпускники могут проходить неограниченное количество раз самодиагностику.
ЕГЭ по химии состоит из тестовой и письменной частей. Из 34 заданий 28 тестовых и 6 письменных. Всего на экзамене по химии можно набрать 56 баллов — 36 в первой части и 20 во второй. Чтобы оставить себе место для ошибки, рекомендуем решать всю первую и всю вторую части. В статье разберем пять полезных советов преподавателей, чтобы успешно сдать экзамен.
Содержание:
- Лайфхак №1. Тренируйтесь в решении заданий блоками
- Лайфхак № 2. Ищите сходства и придумывайте ассоциации в неорганике
- Лайфхак №3. Заучивайте исключения
- Лайфхак №4. Тайм-менеджмент
- Лайфхак №5. Пользуйтесь шпаргалками из КИМа
- Что нужно взять на ЕГЭ по химии в 2023?
- Вывод
Лайфхак №1. Тренируйтесь в решении заданий блоками
В спецификаторах на сайте ФИПИ указаны темы, знание которых будет проверяться на экзамене. Экзаменационный материал разделен на следующие блоки:
- Теоретические основы химии (Общая химия).
- Неорганическая химия:
- оксиды;
- основания;
- амфотерные гидроксиды;
- кислоты;
- соли;
- соединения галогенов, кислорода, азота, фосфора, серы, углерода, кремния, металлов IA- и IIA-групп, алюминия, цинка, хрома, марганца, железа, меди, серебра.
- Органическая химия:
- алканы;
- алкены;
- алкины;
- алкадиены;
- циклоалканы;
- циклоалкены;
- арены;
- одноатомные и многоатомные спирты;
- фенолы;
- альдегиды;
- кетоны;
- карбоновые кислоты;
- амины;
- аминокислоты;
- жиры;
- белки;
- углеводы.
- Химия и жизнь.
- Расчетные задания / Математика.
Рассмотрим подробнее, что проверяют задания. Красным цветом отмечены задания, за которые дается 1 балл, желтым — 2 балла, зеленым 3 и более баллов.
| № | Общая химия | Неорганическая химия | Органическая химия | Расчетные задания |
| 1 | электронная конфигурация | |||
| 2 | закономерности таблицы Менделеева | |||
| 3 | валентность и степень окисления | |||
| 4 | химические связи и кристаллические решетки | |||
| 5 | номенклатура (тривиальная и международная) | |||
| 6 | свойства простых веществ
реакции ионного обмена (РИО) |
|||
| 7 | соотнесение вещества с рядом веществ | |||
| 8 | составление уравнения реакции | |||
| 9 | взаимосвязь неорганических веществ | |||
| 10 | номенклатура (тривиальная и международная) | |||
| 11 | гомологи и изомеры в органике | |||
| 12 | свойства УВ и кислородсодержащих производных | |||
| 13 | свойства азотсодержащих производных БИО | |||
| 14 | составление уравнения (углеводороды) | |||
| 15 | свойства кислородсодержащих производных УВ | |||
| 16 | составление уравнений (производные УВ) | |||
| 17 | классификация химических реакций | |||
| 18 | скорость химической реакции | |||
| 19 | окислительно-восстановительные реакции | |||
| 20 | электролиз | |||
| 21 | гидролиз | |||
| 22 | химическое равновесие | |||
| 23 | расчеты по уравнению обратимой реакции | |||
| 24 | качественные реакции | качественные реакции | ||
| 25 | блок «Химия и жизнь»: вещества и области их применения | |||
| 26 | расчеты массовой доли | |||
| 27 | расчет теплового эффекта реакции | |||
| 28 | расчеты по уравнению реакции | |||
| 29 | окислительно-восстановительные реакции | |||
| 30 | реакции ионного обмена | |||
| 31 | цепочка из четырех реакций (4 балла) | |||
| 32 | цепочка из пяти реакций (5 баллов) | |||
| 33 | органическая расчетная задача (3 балла) | |||
| 34 | неорганическая расчетная задача (4 балла) |
Рекомендуем расписать подготовку к сдаче ЕГЭ таким образом, чтобы наращивать знания от простого к сложному. Начните с общей химии. Это база, без знания которой можно потерять баллы на заданиях, посвященных органической и неорганической химии. О расписании расскажем в лайфхаке №4.
Лайфхак № 2. Ищите сходства и придумывайте ассоциации в неорганике
Вы могли заметить, что в органической химии больше логики, чем в неорганической. Однако в неорганике также можно проследить аналогии. Например, если вы знаете классификацию веществ, вам проще определить свойства конкретного вещества:
- способность реагировать с другими веществами;
- способность к разложению;
- способность к диссоциации.
Ассоциации — это более творческий подход к запоминанию материала. Вы можете продумать ассоциации для конкретного вещества или группы веществ, наделяя их «характером», манерой поведения или другими образными признаками. Рисуйте на их основе схемы, иллюстрации, придумывайте рифму, используйте свой творческий потенциал, чтобы облегчить обучение и сделать подготовку увлекательнее и интереснее.
Обратите внимание, подготовка к сдаче ЕГЭ часто сводится к выводу четких алгоритмов решений, которые проще вспомнить и применить на экзамене. Тем не менее в экзамене по химии прослеживается тенденция к тому, чтобы оценивать, как ученик понимает материал, а не владеет алгоритмами.
Лайфхак №3. Заучивайте исключения
Многие составители и преподаватели объединяют два первых раздела общую и неорганическую химию. Однако здесь важно учитывать следующее: в теоретических основах химии есть четкие алгоритмы, как заучивать материал при подготовке. При этом в ЕГЭ по химии много заданий построено на исключениях. Преимущественно они сконцентрированы именно в блоке неорганической химии.
Помните, что без знания теоретических основ очень сложно решать задания на неорганическую химию, но не пренебрегайте исключениями при подготовке к экзамену. Запомнить их можно, прибегая к ассоциациям, о которых мы говорили в предыдущем лайфхаке.
Лайфхак №4. Тайм-менеджмент
Сколько нужно готовиться к ЕГЭ по химии?
Период подготовки зависит от уровня знаний о предмете и расписания. С нуля рекомендуется начинать готовиться за 2 года до экзамена. Если у вас есть база, начните готовиться к экзамену с сентября одиннадцатого класса.
Подготовку эксперты рекомендуют разделить по месяцам:
| Месяц | Теория | Практика |
| Сентябрь | Основы общей химии | |
| Октябрь | Неорганическая химия | |
| Ноябрь | Органическая химия | |
| Декабрь | Расчетные задачи | |
| Январь | Комплексные задачи* | |
| Февраль | Основы общей химии | |
| Март | Неорганическая химия | |
| Апрель | Органическая химия | |
| Май | Повторение всего изученного материала | Письменная часть экзамена |
*К комплексным задачам рекомендуется переходить после того, как освоили разделы общей, неорганической и органической химии и математики.
Что если до подготовки к экзамену остался один триместр. Можно ли подготовиться к ЕГЭ по химии за 3 месяца?
Если до экзамена осталось три месяца, их желательно посвятить повторению пройденного материала на практике. Подготовка к ЕГЭ по химии за 3 месяца с нуля потребует высокого темпа ежедневной тренировки, изучения большого объема теории и его отработке. Чтобы подготовиться к ЕГЭ за 3 месяца найдите компетентного специалиста — частного репетитора или курсы.
Специалист поможет выстроить программу обучения. Вне зависимости от сроков это необходимый этап подготовки. Важно составить подробную схему — какие темы изучаете, в какой последовательности и сколько по времени. Заранее выстроенная логика прохождения материала позволит без стресса и спешки готовиться к экзамену.
Следует уделять подготовке 1,5—2 часа в день 3—4 раза в неделю.
Чтобы приучить себя к структуре экзамена, важно не только решать задания из пособий, демоверсии 2023 года и вариантов экзамена, которые сдавали выпускники 2022 года и предыдущих лет. Необходимо максимально приблизить условия экзамена во время тренировки — не подглядывать и не списывать, а также четко отводить 3 ч 30 мин на написание экзамена.
Другой метод работы со временем, которые советуют эксперты — фиксировать время, потраченное на каждое задание. Это позволит отследить, какие задания являются для вас наиболее времязатратными.
Лайфхак №5. Пользуйтесь шпаргалками из КИМа
- ручка;
- документ, удостоверяющий личность;
- лекарства и питание при необходимости;
- непрограммируемый калькулятор.
Остальные необходимые материалы для экзамена выпускникам выдаст организатор. В КИМах помимо бланков можно будет найти Периодическую систему, Таблицу растворимости и Электрохимический ряд напряжений.
Рассмотрим, как они помогут на экзамене.
Периодическая система химических элементов Д.И. Менделеева
Помимо периода, группы и порядкового номера по таблице можно сказать многое. Например:
- количество протонов, электронов в атоме элемента;
- количество оболочек;
- распределение электронов по оболочкам;
- количество электронов на валентной оболочке;
- подгруппу элемента;
- химические свойства простого вещества;
- сведения о соединении элемента.
Периодическая система нужна преимущественно для решения первых четырех заданий: №1 — строение атома, № 2 — периодический закон, №3 — электроотрицательность и степень окисления, №4 — связи и кристаллические решетки.
Электрохимический ряд напряжений
Он показывает:
- как от лития Li до золота Au уменьшается активность металлов;
- поведение оксидов в пирометаллургии;
- поведение солей в гидрометаллургии;
- взаимодействие простого вещества с кислотами;
- поведение соли в гидролизе и электролизе;
- поведение нитрата при разложении.
Эта шпаргалка пригодится во всех заданиях блока неорганической химии — №5—9; задания на электролиз и гидролиз №20, 21; качественные реакции — №24; химия и жизнь — 25; неорганические цепочки — №31.
Таблица растворимости кислот, солей и оснований в воде
В этой таблице собрано большое количество важной информации, например:
- заряд иона;
- степень окисления элемента в ионе;
- поведение при гидролизе;
- поведение в реакциях ионного обмена;
- поведение в качественных реакциях.
Таблица будет полезна для решения заданий на степень окисления в ионе — №3, 19, 29. Для решения всего блока неорганической химии — №5—9; задания на гидролиз — №21, качественные реакции — 24, реакции ионного обмена 30, неорганические цепочки — №31 и сложной комплексной задачи — №34.
Вывод
Мы рассмотрели 5 лайфхаков для ЕГЭ по химии от экспертов и преподавателей. Они помогут ученикам продумать и построить верный курс к успешной сдаче ЕГЭ. Резюмируя, мы предлагаем при подготовке разделить задания экзамена на тематические блоки:
- общую химию;
- неорганическую химию;
- органическую химию;
- математику;
- химию и жизнь (задание №25).
На основе выявленных блоков мы рекомендуем вам составить четкое расписание. При подготовке важно идти по запланированному пути — знать, с чего начинать готовиться, и как последовательно выстроить темы. Кроме того, мы выявили, что эксперты рекомендуют подбирать ассоциации, продумывать аналогии при изучении и повторении материала.
Последнее, чему важно научиться в процессе подготовки — это пользоваться тремя ключевыми таблицами:
- Периодической системой;
- Таблицей растворимости;
- Электрохимическим рядом напряжений металлов.
Рекомендуем сразу скачать те варианты таблиц, что будут в КИМах. Их можно найти на сайте ФИПИ в разделе «Демоверсии, спецификаторы и кодификаторы». Умение работать с этими материалами позволит существенно сэкономить время на экзамене.
Главное при подготовке к экзамену — научиться понимать задачи, а не только зазубривать теорию и структуру. Если вы видите, что не понимаете определенные темы, задавайте вопросы учителю химии в школе, подберите репетитора или курсы. Компетентный специалист построит программу с учетом ваших пробелов в определенных темах и поможет успешно сдать ЕГЭ по химии.
Сегодняшняя статья полезна для всех будущих Менделеевых, ведь мы будем говорить о ЕГЭ по химии. Что представляет из себя экзамен и какие знания понадобятся для успешной сдачи расскажем сегодня. Не спешите закрывать статью, ведь дальше будет много полезного. Поехали!
Кстати, ЕГЭ по химии уже давно признается одним из самых сложных и наиболее сдаваемых предметов, так как нужен он и будущим врачам, и фармацевтам, и ученым, и нефтяникам. Короче, спрос действительно велик, поэтому давайте разбираться, с чем же совсем скоро предстоит иметь дело.
Структура экзамена
И начинаем мы, как обычно, со структуры – основополагающего фактора, не разобравшись в котором справиться с КИМом на высокие баллы невозможно.
ЕГЭ по химии состоит из двух частей:
- Первая часть – тестовая, предусматривает краткий ответ в виде одного числа или последовательности чисел. Состоит из 28 заданий;
- Вторая часть требует подробного решения на бланках ответа №2 и состоит из 6 заданий
То есть всего экзамен состоит из 34 заданий, за безошибочное решение которых можно получить 56 первичных баллов.
Подробнее о баллах
После разговора о структуре предлагаем уточнить “цену” каждого задания. Ну, то есть вы нас, конечно же, поняли, разберемся сколько и за что баллов начисляют при проверке.
- Задания в 1 балл:
К этой группе относим номера 1-5, 9-13, 16-21 и 25-28. При их выполнении нельзя забывать о правилах заполнения бланка, ведь копилка пополнится только если вы запишете верно заданную последовательность цифр;
- Задания в 2 балла:
Тут говорим о номерах 6-8, 14, 15, 22-24. Максимальное количество баллов начисляется, если учащийся верно решил и записал последовательность цифр согласно правилам. Если допущена 1 ошибка, ставится 1 балл, если 2 и более – 0 баллов.
- Задания в 2-5 баллов:
Сюда относится вся вторая часть, требующая развернутого ответа. Здесь очень важно прописывать каждый шаг решения, чтобы экзаменатор понимал ход ваших мыслей и не хотел к чему-нибудь придраться. Ну и, конечно, задачи должны быть оформлены и решены верно согласно критериям.
Какие темы встречаются на ЕГЭ по химии?
Следующей важной частью нашего разговора об успешной сдачи ЕГЭ по химии является непосредственно материал, который вам следует изучить. Думаем, наши читатели уже знают, что два их ближайших друга – это кодификатор и сайт ФИПИ, на котором вы как раз можете его найти.
А мы разберем важные разделы нелегкой науки, которые вам обязательно нужно постигнуть:
- Теоретические основы химии
Строение атомов и молекул, периодическая таблица Менделеева, с которой обязан уметь работать каждый, кто планирует сдавать ЕГЭ по химии, – все это относится к данному разделу, который встречается как во многих заданиях первой, так и в 29 номере второй части.
- Неорганическая химия
Этот раздел химии изучает свойства химических элементов и неорганических соединений: металлы, неметаллы, оксиды, кислоты, соли, основания и т.д. Скажем честно, на высокие баллы придется попыхтеть, ведь теоретического материала сложного характера очень много. Обязательно повторите правила номенклатуры, способы получения веществ и основы процессов гидролиза и электролиза.
- Органическая химия
Говоря максимально понятным языком, органическая химия – это раздел изучающий соединения углерода кроме его оксидов, угольной кислоты и ее солей. Кстати, небольшой лайфхак: не чуждайтесь схем строения органических молекул и не откладывайте их изучение в долгий ящик. Начав с них, вы сильно упростите понимание более сложных тем, а также заметите закономерность: кратные связи можно разорвать одним набором реактивов, в группе –ОН замещают атом водорода, а –NH2 группа реагирует с кислотами. Вот такие, оказывается, классы органических веществ и их реакции, однотипные.
- Химия в “быту”
Самый адаптированный к жизни раздел обычно собирает больше всего промахов. Простое название вовсе не означает, что изучать здесь нечего. Так, в задании 24 вам необходимо мысленно представить эксперимент и написать, что произойдет при смешивании заданных веществ. Например, может выпасть осадок, выделиться газ, а может вообще ничего не произойти. А в номере 25 придется поднапрячься и вспомнить, в каких отраслях промышленности, сельского хозяйства и медицины используется то или иное вещество.
- Расчетные задачи
Порой главным камнем преткновения на пути к высоким баллам становятся именно задачи, без которых не было бы второй части ЕГЭ по химии. Они бывают различной степени сложности и проверяют сразу несколько навыков:
- умение работать с калькулятором;
- знание химических свойств веществ;
- понимание процессов;
- грамотное установление причинно-следственных связей;
- умение представлять формулы в структурном виде;
и т.п.
Что нужно знать и учитывать, чтобы сдать на высокие баллы
И в заключении предлагаем пройтись по основным моментам, которые заложат крепкий фундамент уровневой сдачи ЕГЭ по химии:
- Ознакомьтесь со всеми материалами с сайта ФИПИ;
- Грамотно распланируйте время и составьте удобный график подготовки, чтобы успеть охватить и отработать весь материал;
- Настройтесь морально: вы нисколько не хуже других, вы все можете и достойны лучшего;
- Готовьтесь по актуальным заданиям, так как ЕГЭ по химии претерпел в 2022 году ряд изменений;
- Иногда выходите за рамки ЕГЭ и разбирайтесь в сложных задачах, чтобы экзаменационные уже никогда не смогли напугать вас или тем более поставить в тупик;
- Не забывайте про исключения: порой они играют более важную роль, чем классические свойства. Соберите волю в кулак и выучите их раз и навсегда;
- При написании пробников соблюдайте тайминг, 3 с половиной часов вполне достаточно для решения, переноса ответов в бланк и перепроверки;
- Начинайте пользоваться разрешенными шпаргалками уже при подготовке: периодическая система химических элементов Д. И. Менделеева, таблица растворимости кислот, солей и оснований, ряд активности металлов будут получены вами вместе с КИМами. Ваша задача – не запутаться и воспользоваться ими (просто сам Бог велел).
- Научитесь управляться с калькулятором и возьмите на экзамен две “счетные машины”: инженерную и обычную. Дело в том, что на ЕГЭ разрешены только непрограммируемые калькуляторы, а мир техники – всегда загадка. Поэтому, чтобы не тратить время на расчеты в столбик, запаситесь самым обыкновенным “аппаратом”;
- Ничего не бойтесь и верьте в себя, как бы ни было сложно!
Надеемся, что сегодня вы узнали для себя что-то новое и полезное. Вперед, юные Менделеевы, мы в вас верим! Желаем удачи, ваш Умскул.