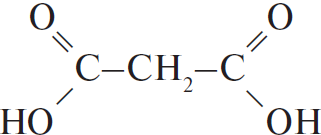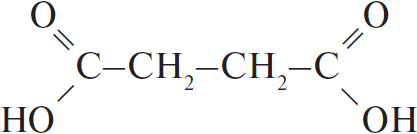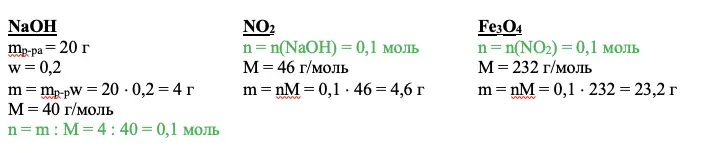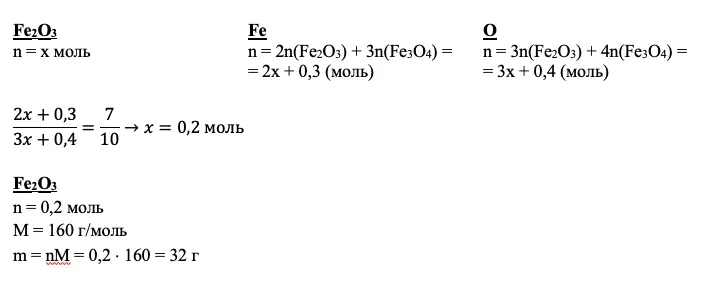За это задание ты можешь получить 3 балла. На решение дается около 15 минут. Уровень сложности: высокий.
Средний процент выполнения: 28.1%
Ответом к заданию 33 по химии может быть развернутый ответ (полная запись решения с обоснованием выполненных действий).
Разбор сложных заданий в тг-канале
Задачи для практики
Задача 1
При полном сгорании углеводорода образовалось 8,96 л (н. у.) диоксида углерода и 5,4 г воды. Молярная масса углеводорода в 27 раз больше молярной массы водорода. При исследовании химических свойств этого вещества установлено, что оно обесцвечивает бромную воду, присоединяя атомы брома по четырем разным атомам углерода.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с недостатком бромной воды (используйте структурные формулы органических веществ).
Решение
1) Находим количественный состав вещества.
Формула вещества — $C_xH_y$.
а) n(C) = n($CO_2$) = 8.96 / 22.4 = 0.4 моль
б) n(H) = 2n($H_2O$) = 2 · 5.4 / 18 = 0.6 моль
2) Определяем молекулярную формулу вещества:
а) $M_{ист.}(C_xH_y) = D(по H_2) · M(H_2)$ = 27 · 2 = 54 г/моль
б) x : y = n(C) : n(H) = 0.4 : 0.6 = 2 : 3 = 4 : 6
Вычисленная формула — $C_4H_6$.
$M_{выч.}(C_4H_6)$ = 54 г/моль
в) $M_{ист.}(C_xH_y)$ / $M_{выч.}(C_4H_6)$ = 54 / 54 = 1
Молекулярная формула исходного вещества — $C_4H_6$.
3) Структурная формула вещества — $CH_2=CH–CH=CH_2$ — бутадиен-1,3.
4) Записываем уравнение реакции вещества с бромом:
$CH_2=CH–CH=CH_2 + Br_2 → CH_2Br–CH=CH–CH_2Br$
Ответ:
Задача 2
При сгорании монобромпроизводного органического вещества массой 6,15 г образовался углекислый газ, 2,7 мл воды и бромоводород объёмом 1,12 л (н. у.). Известно, что данное вещество было получено при взаимодействии органического вещества с бромом при освещении.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу монобромпроизводного органического вещества;
- составьте структурную формулу этого органического вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции этого вещества с водным раствором гидроксида натрия (используйте структурные формулы органических веществ).
Решение
Допустим, что в веществе не содержится кислород, т. е. формула — $C_xH_yBr$.
1) Находим количественный состав образца:
а) n(Br) = n(H) = n(HBr) = 1.12 / 22.4 = 0.05 моль
m(Br) = 0.05 · 80 = 4 г
б) m($H_2O$) = 2.7 · 1 = 2.7 г; n(H) = 2n($H_2O$) = 2 · 2.7 / 18 = 0.3 моль
$n(H)_{общее}$ = 0.05 + 0.3 = 0.35 моль
m(H) = 1 · 0.35 = 0.35 г
в) m(C) = 6.15 – (4 + 0.35) = 1.8 г; n(C) = 1.8 / 12 = 0.15 моль
2) Находим молекулярную формулу вещества:
а) $M(C_xH_yBr)$ = 6.15 / 0.05 = 123 г/моль
б) x : y : z = n(C) : n(H) : n(Br) = 0.15 : 0.35 : 0.05 = 3 : 7 : 1
Вычисленная формула — $C_3H_7Br$.
$M(C_3H_7Br)$ = 36 + 7 + 80 = 123 г/моль
$M(C_xH_yBr)$ / $M(C_3H_7Br)$ = 123 / 123 = 1
Формула галогенпроизводного — $C_3H_7Br$
3) Структурная формула — $CH_3–CH(Br)–CH_3$
4) Уравнение реакции вещества с водным раствором гидроксида натрия:
$CH_3–CHBr–CH_3 + NaOH → NaBr + CH_3–CH(OH)–CH_3$
Ответ:
Задача 3
В результате сплавления органического вещества с гидроксидом калия был получен углеводород, 1,17 г паров которого занимают объём 336 мл (н. у.). Известно, что исходное вещество относится к классу солей. В этом соединении число атомов кислорода равно числу атомов водорода.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с гидроксидом калия при сплавлении (используйте структурные формулы органических веществ).
Решение
1) Находим молярную массу углеводорода.
Пусть формула полученного углеводорода $C_xH_y$.
$n = V_г$ / $V_M$; $n(C_xH_y)$ = 0.336 / 22.4 = 0.015 моль
$M(C_xH_y) = m_{в-ва}$ / n = 1.17 / 0.015 = 78 г/моль
2) Находим молекулярную формулу углеводорода:
12x + y = 78
если x = 6, y = 6
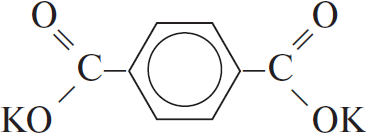
Формула углеводорода — $C_6H_6$, молекулярная формула исходного вещества $C_8H_4O_4K_2$.
3) Составляем структурную формулу соли:
4) Уравнение реакции:
$KOOC–C_6H_4–COOK + 2KOH → 2K_2CO_3 + C_6H_6$
Ответ:
Задача 4
Вещество, которое содержит 61,54 % кислорода, 34,62 % углерода и 3,84 % водорода по массе, было получено при взаимодействии углеводорода состава $С_5H_8$ с раствором перманганата калия в присутствии серной кислоты.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного углеводорода с подкисленным раствором перманганата калия (используйте структурные формулы органических веществ).
Решение
Пусть формула вещества — $C_xH_yO_z$.
1) Находим количественный состав вещества.
Пусть $m_{в-ва}$ = 100 г, тогда:
а) m(C) = 34.62 г, n(C) = 34.62 / 12 ≈ 2.89 моль
б) m(H) = 3.84 г, n(H) = 3.84 / 1 = 3.84 моль
в) m(O) = 61.54 г, n(O) = 61.54 / 16 ≈ 3.85 моль
2) Находим молекулярную формулу вещества:
x : y : z = n(C) : n(H) : n(O) = 2.89 : 3.84 : 3.85 ≈ 1 : 1.33 : 1. 33 ≈ 3 : 4 : 4.
Молекулярная формула — $C_3H_4O_4$.
3) Структурная формула —
4) Уравнение реакции окисления углеводорода:
$CH_2=CH–CH_2–CH=CH_2 + 4KMnO_4 + 6H_2SO_4 → 2K_2SO_4 + 4MnSO_4 + 8H_2O + 2CO_2 +$
Ответ:
Задача 5
При сгорании 1,8 г органического вещества, не содержащего кислорода, получили углекислый газ, 2,52 г воды и 448 мл (н. у.) азота. Известно, что вещество не может быть получено восстановлением соответствующего нитросоединения, но вступает в реакцию c хлорэтаном.
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с хлорэтаном (используйте структурные формулы органических веществ).
Решение
Формула вещества — $C_xH_yN_z$.
1) Количественный состав образца:
М(C) = 12 г/моль, М(H) = 1 г/моль, М(N) = 14 г/моль, M($H_2O$) = 18 г/моль
n(H) = 2n($H_2O$) = 2 · 2.52 / 18 = 0.28 моль; m(H) = 0.28 · 1 = 0.28 г
n(N) = 2n($N_2$) = 2 · 0.448 / 22.4 = 0.04 моль; m(N) = 0.04 · 14 = 0.56 г
m(C) = 1.8 – 0.28 – 0.56 = 0.96 г; n(C) = 0.96 / 12 = 0.08 моль
2) Вычисленная формула:
x : y : z = n(C) : n(H) : n(N) = 0.08 : 0.28 : 0.04 = 2 : 7 : 1
Вычисленная формула — $C_2H_7N$.
3) Структурная формула — $CH_3–NH–CH_3$
4) Уравнение реакции: $CH_3–NH–CH_3 + C_2H_5Cl → [(CH_3)_2NH(C_2H_5)]^{+}Cl^{–}$
Ответ:
Задача 6
Некоторое вещество было получено при окислении циклического углеводорода, не содержащего заместителей в цикле, перманганатом калия в присутствии серной кислоты. Это вещество содержит 40,68 % углерода, 54,24 % кислорода и 5,08 % водорода по массе.
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу полученного вещества;
- составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного органического вещества с перманганатом калия в присутствии серной кислоты (используйте структурные формулы органических веществ).
Решение
Формула вещества — $C_xH_yO_z$.
1) Находим количественный состав образца.
Пусть $m_{в-ва}$ = 100 г, тогда
m(C) = 40.68 г; n(C) = 40.68 / 12 = 3.39 моль
m(H) = 5.08 г; n(H) = 5.08 / 1 = 5.08 моль
m(O) = 54.24 г; n(O) = 54.24 / 16 = 3.39 моль
2) Находим молекулярную формулу:
x : y : z = n(C) : n(H) : n(O) =
= 3.39 : 5.08 : 3.39 =
= 1 : 1.5 : 1 = (умножаем на 2)
= 2 : 3 : 2 = (умножаем на 2)
= 4 : 6 : 4
Вычисленная формула — $C_4H_6O_4$.
3) Структурная формула вещества —
4) Уравнение реакции окисления циклического углеводорода:
5 
Ответ:
Задача 7
При сгорании 11,6 г органического вещества выделилось 13,44 л (н. у.) углекислого газа и 10,8 мл воды. Плотность паров этого вещества равна 2,59 г/л. Вещество реагирует с гидроксидом меди(II).
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с свежеосажденным гидроксидом меди(II) (используйте структурные формулы органических веществ).
Решение
Пусть формула вещества — $C_xH_yO_z$.
1) Находим количественный состав образца:
а) n(C) = n($CO_2$) = 13.44 / 22.4 = 0.6 моль
m(C) = 0.6 · 12 = 7.2 г
б) m($H_2O$) = 1 · 10.8 = 10.8 г; n(H) = 2n($H_2O$) = 2 · 10.8 / 18 = 1.2 моль
m(H) = 1 · 1.2 = 1.2 г
в) m(O) = 11.6 – 7.2 – 1.2 = 3.2 г; n(O) = 3.2 / 16 = 0.2 моль
2) Находим молекулярную формулу вещества:
а) x : y : z = n(C) : n(H) : n(O) = 0.6 : 1.2 : 0.2 = 3 : 6 : 1
Вычисленная формула — $C_3H_6O$.
M($C_3H_6O$) = 12 · 3 + 6 + 16 = 58 г/моль
б) M($C_xH_yO_z$) = 2.59 · 22.4 / 1 = 58,016 ≈ 58 г/моль
в) M($C_xH_yO_z$) / M($C_3H_6O$) = 58 : 58 = 1
Молекулярная формула — $C_3H_6O$.
3) Структурная формула вещества — $CH_3–CH_2–CHO$
4) Составляем уравнение реакции окисления пропаналя:
$CH_3–CH_2CHO + 2Cu(OH)_2 → CH_3–CH_2–COOH + Cu_2O + 2H_2O$
Ответ:
Задача 8
Массовая доля водорода 2,06, углерода 24,74 %, кислорода 32,99 %, калия 40,21 %. Вещество реагирует с гидроксидом калия с образованием углеводорода.
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с гидроксидом калия (используйте структурные формулы органических веществ).
Решение
1) Находим молекулярную формулу вещества.
Пусть формула вещества — $C_xH_yO_zK_t$ и $m_{образца}$ = 100 г, тогда
а) m(C) = 24.74 г, n(C) = 24.74 / 12 ≈ 2.06 моль
m(H) = 2.06 г, n(H) = 2.06 / 1 = 2.06 моль
m(O) = 32.99 г, n(O) = 32.99 / 16 ≈ 2.06 моль
m(K) = 40.21 г, n(K) = 40.21 / 39 ≈ 1.03 моль
б) x : y : z : t = n(C) : n(H) : n(O) : n(K) = 2.06 : 2.06 : 2.06 : 1.03 =
= (2.06 / 1.03) : (2.06 / 1.03) : (2.06 / 1.03) : (1.03 / 1.03) ≈ 2 : 2 : 2 : 1 =
= 4 : 4 : 4 : 2
Молекулярная формула — $C_4H_4O_4K_2$.
2) Структурная формула — $KO–CO–CH_2–CH_2–CO–OK$ или $(KOOC–CH_2CH_2–COOK)$
3) Уравнение реакции:
$KO–CO–CH_2–CH_2–CO–OK + 2KOH → 2K_2CO_3 + CH_3–CH_3$
Ответ:
Задача 9
Органическое вещество содержит 45,45 % углерода, 6,06 % водорода и 48,48 % кислорода. Известно, что при нагревании с раствором гидроксида натрия образуется несколько новых веществ, причём одно из них имеет разветвлённое строение. На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с водным раствором гидроксида натрия (используйте структурные формулы органических веществ).
Решение
Вариант ответа:
Пусть формула вещества $C_xH_yO_z$ и $m_{образца}$ = 100 г, тогда:
а) m(C) = 45,45 г, n(C) = 45,45/12 ≈ 3,79 моль
m(H) = 6,06 г, n(H) = 6,06/1 = 6,06 моль
m(O) = 48,48 г, n(O) = 48,48/16 ≈ 3,03 моль
б) x : y : z = n(C) : n(H) : n(O) = 3,79 : 6,06 : 3,03 = (3,79/3,03) : (6,06/3,03) : (3,03/3,03) ≈ 1,25 : 2 : 1 = 5 : 8 : 4
Молекулярная формула вещества: $C_5H_8O_4$.
Структурная формула: $HO–CO–CO–OCH(CH_3)_2$
$(HOOC–COO–CH(CH_3)_2)$
Уравнение щелочного гидролиза сложного эфира:
$HO–CO–CO–OCH(CH_3)_2 + 2NaOH_{(водн.)} → CH_3–CH(OH)–CH_3 + NaO–CO–CO–ONa + H_2O$
Ответ:
Рекомендуемые курсы подготовки
Ни для кого не секрет, что задача 33 (она же бывшая задача 34) в ЕГЭ по химии — самое сложное задание, а судя по статистике (только 8,3% выпускников справляются с ним), она еще и практически невыполнимая. Поэтому значительное число выпускников даже не читают условие этой задачи. А зря. Если вы пришли на экзамен по химии, то уж точно сможете записать несколько уравнений, ведь так?
Задача 33 по химии: суть и критерии оценивания
Задание № 33 в ЕГЭ по химии — это расчетная задача высокого уровня сложности. Чтобы успешно решить ее, вам необходимо знать химические свойства веществ, уметь устанавливать логические связи между реакциями, применять расчетные формулы для нахождения количества вещества, массы и объема, массовой доли вещества в смеси.
Для получения максимально возможных 4 баллов за задачу 33 вам предстоит:
- записать все уравнения реакций, описанных в тексте (1 балл);
- рассчитать количества вещества всех известных и искомых веществ (1 балл);
- провести анализ и рассчитать искомые величины (1 балл);
- дать правильный ответ и безошибочно оформить решение (1 балл; снимается за отсутствие размерных величин — больше трех, также за математические ошибки)
Но слова в сторону, нам нужна успешная пошаговая стратегия: что делать, чтобы не получить за этот номер 0?
ЕГЭ по химии — в принципе достаточно сложный экзамен. Чтобы получить за него высокий балл, нужно хорошо постараться. Так, необходимо хорошо знать теорию и формулы, уметь выводить уравнения без ошибок, понимать, как правильно читать задания (в них могут быть ловушки!) и оформлять ответы по критериям. И все это — за ограниченный период времени.
Чтобы не стрессовать на экзамене и показать лучший результат, записывайтесь ко мне на курсы подготовки к ЕГЭ по химии. Мы изучим только то, что гарантированно пригодится вам на экзамене: ничего лишнего, только актуальные знания. А пробные экзамены, которые мы обязательно проводим, помогут понять, что ЕГЭ — совсем не такое страшное. Приходите к нам — за знаниями и спокойствием!
Пошаговый разбор реального задания 33
Уровень «Новичок»
Вы выбрали химию для поступления и готовилист к ЕГЭ минимум год. Вам абсолютно под силу записать уравнения реакций, описанных в тексте. Чаще всего здесь встречаются реакции обмена, замещения и разложения, ОВР, электролиз и совместный гидролиз. Правильно записанные реакции с расставленными коэффициентами дают 1 первичный балл за 33 задачу в ЕГЭ по химии.
ШАГ 1. Запишите все уравнения реакций, о которых идет речь в тексте
Если возможны вариации одной и той же реакции, рассмотрите их на черновике (например, получение средних/кислых солей, образование амфотерного гидроксида/ комплексной соли и т.п.). Какую реакцию оставить, вы поймете после получения первых результатов расчета.
Совет: повторите перед экзаменом тривиальные названия. Например, если вы не знаете, что такое «железная окалина», то ни записать реакцию, ни решить данную задачу не удастся 🙃
Смесь железной окалины и оксида железа III растворяют в азотной концентрированной кислоте. Запишем их по очереди. Железная окалина содержит железо в степени окисления +2, отсюда и протекание окислительно-восстановительной реакции: железо повышает степень окисления до +3, а азот изменяет свою степень окисления с +5 до +4. Вторая реакция представляет собой классическую реакцию обмена:
Fe3O4 + 10HNO3 = 3Fe(NO3)3 + NO2 + 5H2O
Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O
Образовавший газ (это NO2, полученный в первой реакции) взаимодействует с гидроксидом натрия:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
ИТОГО: +1 балл
С одним пунктом вы справились. Далее запишите «дано». Баллов за эту запись вам не добавят, но при этом вы сможете увидеть все известные величины и помнить, что необходимо найти.
Дано:
N(Fe) : N(O) = 7 : 10
mp-p(HNO3) = 500 г
mp-p(NaOH) = 20 г
w(NaOH) = 20%
Найти:
w(Fe(NO3)3) — ?
Уровень «Мастер»
Вы готовы сделать больше, чем записать уравнения реакции. Вы помните основные расчетные формулы и можете найти количество вещества по заданной массе и объему.
ШАГ 2. Используйте известные числовые значения, чтобы рассчитать количества вещества всех необходимых участников реакций
Переходим к действию. Нужно найти вещество, о котором мы все знаем. В приведенном примере это гидроксид натрия. Необходимо рассчитать количество вещества. Используем для этого основные расчетные формулы:
NaOH
mp-pa = 20 г
w = 0,2
m = mp-pw = 20 × 0,2 = 4 г
М = 40 г/моль
n = m : M = 4 : 40 = 0,1 моль
Задаем себе вопрос: что нам дает это значение? Каждый ответ должен вести к следующему действию. Так, мы можем рассчитать количество оксида азота IV – NO2, а благодаря ему получим количество вещества Fe3O4.
Совет: в задаче 33 по химии рассчитывайте сразу и количество вещества, и массу любого соединения, с которым работаете. Эти массы пригодятся при нахождении итогового раствора. А если не пригодятся, не переписывайте их в чистовик.
ИТОГО: +1 балл
Уровень «Гуру»
Вас не пугает уравнение с иксом в химии. Более того, вы можете его и составить, и решить.
ШАГ 3. Продумайте, как от найденных количеств вещества дойти по цепочке до искомого соединения
Что нужно найти дополнительно, чтобы получить ответ в задаче 33 по химии? Здесь может пригодиться работа с переменными, пропорции, соотношения и даже составление системы уравнений с двумя неизвестными.
Работаем!
Мы получили количества вещества нескольких соединений. Но так и не добрались до второй реакции и Fe2O3. Кроме того, мы не использовали соотношение атомов. Если вам ничего не дано для вещества по условию, а также вам не удалось подойти к нему через промежуточные расчеты, дело за уравнением. За х всегда принимайте количество неизвестного вещества.
Для нашего примера получим:
Совет: не пытайтесь принять за х все, что не получается рассчитать. Чаще всего задача 33 по химии решается без каких-либо переменных.
ИТОГО: +1 балл
Уровень «Профессионал»
Самое сложное уже позади. Теперь вам остается грамотно довести до конца. Обычно в завершении задачи требуется рассчитать массу полученного раствора и массовую долю вещества в нем. Чтобы не допустить ошибку на последнем этапе, помним, что в раствор входят все вещества, описанные в условии задачи, за исключением веществ, участвующих в реакциях сплавления, разложения и горения. Также обязательно нужно вычесть из этой массы потери. Потерями считаем осадки, газы, выпаренную воду, непрореагировавшие металлы и их оксиды.
ШАГ 4. Внимательно прочитайте вопрос задачи и рассчитайте искомую величину
Чаще всего необходимо вычислять массовую долю вещества в растворе. Предварительно вычислите массу полученного раствора с учетом всех потерь — осадков, газов и т.п.
В приведенном примере в раствор входит смесь железной окалины и оксида железа (III) и раствор азотной кислоты. Потеря — газообразное вещество NO2 (он же бурый газ).
mp-pa = m(Fe3O4) + m(Fe2O3) + mp-p(HNO3) – m(NO2) = 23,2 + 32 + 500 – 4,6 = 550,7 г
Зная количества вещества оксидов, вычислим количество вещества и массу искомой соли, а также ее массовую долю:
ИТОГО: +1 балл
Вот вы и решили 33 задачу в ЕГЭ по химии. Сложная ли она? Безусловно. Но можно ли с ней побороться? Да! Помните, что это задание, как и любое другое из второй части, оценивают согласно критериям. Не оставляйте его совсем без решения. Вы сможете остановиться на любом этапе и при этом принести в свою копилку больше, чем 0 баллов. А в пересчете на 100-балльную шкалу это будет уже весомо!
А если хотите научиться пошагово решать и другие задания из ЕГЭ по химии, записывайтесь ко мне на курсы подготовки к экзамену. Мы разберемся во всей теории, будем тренироваться в практических заданиях и научимся оформлять ответы в полном соответствии с критериями. Не теряйте возможность получить 80+ за ЕГЭ по химии — записывайтесь.
22 июня 2022
В закладки
Обсудить
Жалоба
Подборка задач 33 и 34 с прошедшего ЕГЭ 2022 по химии.
→ 33 с ответами и уравнениями описанных реакций: 33.pdf
→ 34 c ответами: 34.pdf
Источник: vk.com/examtop
Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Тип 34 № 44
К раствору гидроксида натрия массой 1200 г прибавили 490 г 40%-ного раствора серной кислоты. Для нейтрализации получившегося раствора потребовалось 143 г кристаллической соды Na2CO3·10H2O. Рассчитайте массу и массовую долю гидроксида натрия в исходном растворе.
Источник: Демонстрационная версия ЕГЭ—2012 по химии
2
Определите массовые доли (в%) сульфата железа (II) и сульфида алюминия в смеси, если при обработке 25 г этой смеси водой выделился газ, который полностью прореагировал с 960 г 5%-ного раствора сульфата меди.
Источник: Демонстрационная версия ЕГЭ—2013 по химии
3
Смесь хлорида натрия и бромида натрия может прореагировать с 4,48 л хлора (н. у.) или с 850 г 10%-ного раствора нитрата серебра. Определите массовую долю бромида натрия в исходной смеси.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 1
4
Если смесь хлоридов калия и кальция добавить к избытку раствора карбоната натрия, то образуется 10 г осадка. Если ту же смесь добавить к избытку раствора нитрата серебра, то образуется 57,4 г осадка. Определите массовую долю хлорида калия в исходной смеси.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 2
5
Смесь натрия и оксида натрия растворили в воде. При этом выделилось 4,48 л (н. у.) газа и образовалось 240 г раствора с массовой долей гидроксида натрия 10%. Определите массовую долю натрия в исходной смеси.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 4
Пройти тестирование по этим заданиям
Задание 33 ЕГЭ по химии практика, тренировочные задания с ответами с реального ЕГЭ прошлых лет, данные задания вы можете решить онлайн на сайте или скачать, в этой подборке собраны сложные и легкие типы задания, а в конце страницы опубликован новый тренировочный вариант ЕГЭ 2023 года по химии.
Скачать задания
Скачать задания с ответами
ЕГЭ химия задание 33 решения и ответы
ответы-егэ-задание-33-химия
Выдержка из формулировки каждого варианта этого задания: «На основании данных условия задания:
- 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
- 2) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;»
1. При сгорании 17,5 г органического вещества получили 28 л (н.у.) углекислого газа и 22,5 мл воды. Плотность паров этого вещества (н.у.) составляет 3,125 г/л. Известно также, что это вещество было получено в результате дегидратации третичного спирта. Напишите уравнение реакции получения данного вещества дегидратацией соответствующего третичного спирта.
2. При сгорании 20 г органического вещества нециклического строения получили 66 г углекислого газа и 18 мл воды. Известно, что 1 моль этого органического вещества в присутствии катализатора присоединяет только 1 моль воды и данное вещество реагирует с аммиачным раствором оксида серебра. Напишите уравнение реакции данного вещества с аммиачным раствором оксида серебра.
3. При сгорании 27,6 г органического вещества получили 26,88 л (н.у.) углекислого газа и 32,4 г воды. Известно, что это вещество реагирует с оксидом меди(II). Напишите уравнение реакции данного вещества с оксидом меди(II).
4. При сгорании 9 г органического вещества получили 10,08 л (н.у.) углекислого газа и 10,8 г воды. Известно, что это вещество может быть получено из соответствующего альдегида в одну стадию. Напишите уравнение реакции получения данного вещества из соответствующего альдегида.
5. При сгорании 48 г органического вещества получили 105,6 г углекислого газа и 57,6 мл воды. Известно, что это вещество преимущественно образуется при гидратации соответствующего непредельного углеводорода. Напишите уравнение реакции получения данного вещества гидратацией соответствующего непредельного углеводорода.
6. При сгорании органического вещества, не содержащего кислорода, получили 61,6 г углекислого газа, 10,8 г воды и 4,48 л (н.у.) хлороводорода. Известно, что это вещество может быть получено взаимодействием соответствующего углеводорода с хлором на свету. Напишите уравнение реакции получения данного вещества взаимодействием соответствующего углеводорода с хлором на свету.
7. При сгорании некоторого амина получили 40,32 л (н.у.) углекислого газа, 48,6 г воды и 6,72 л (н.у.) азота. Известно, что в молекуле этого амина нет атомов водорода, связанных с атомами азота. Напишите уравнение реакции избытка данного амина с серной кислотой.
8. При сгорании 6,15 г органического вещества, не содержащего кислорода, получили углекислый газ, 2,7 мл воды и 1,12 л (н.у.) бромоводорода. Известно, что это вещество преимущественно образуется при взаимодействии соответствующего углеводорода с бромом на свету. Напишите уравнение реакции получения данного вещества взаимодействием соответствующего углеводорода с бромом на свету.
9. Некоторое органическое соединение содержит 69,6% кислорода по массе. Молярная масса этого соединения в 1,586 раза больше молярной массы воздуха. Известно также, что это вещество способно вступать в реакцию этерификации с пропанолом-2. Напишите уравнение реакции этого вещества с пропанолом-2.
10. При сгорании 4,48 л (н.у.) газообразного органического вещества получили 35,2 г углекислого газа и 10,8 мл воды. Плотность этого вещества составляет 2,41 г/л (н.у.). Известно также, что это вещество не реагирует с аммиачным раствором оксида серебра, а при реакции его с избытком бромной воды происходит присоединение атомов брома только ко вторичным атомам углерода. Напишите уравнение реакции этого вещества с избытком бромной воды.
11. При сгорании 8,64 г органического вещества получили 21,12 г углекислого газа и 8,64 г воды. Известно, что это вещество не реагирует с гидроксидом меди(II) и может быть получено в результате окисления соответствующего спирта оксидом меди(II). Напишите уравнение реакции получения данного вещества окислением соответствующего спирта оксидом меди(II).
12. При сгорании 43,4 г органического вещества получили 61,6 г углекислого газа и 37,8 мл воды. Известно, что это вещество может быть получено окислением соответствующего углеводорода водным раствором перманганата калия на холоду. Напишите уравнение реакции получения данного вещества окислением соответствующего углеводорода водным раствором перманганата калия на холоду.
13. При сгорании 18,8 г органического вещества получили 26,88 л (н.у.) углекислого газа и 10,8 мл воды. Известно, что это вещество реагирует как с гидроксидом натрия, так и с бромной водой. Напишите уравнение реакции данного вещества с бромной водой.
14. При сгорании 5,4 г органического вещества получили 15,4 г углекислого газа и 3,6 г воды. Известно, что это вещество реагирует с раствором гидроксида натрия, а при реакции его с бромной водой образуется трибромпроизводное этого вещества. Напишите уравнение реакции данного вещества с бромной водой.
15. Некоторое органическое соединение содержит 62,1% углерода и 27,6% кислорода по массе. Известно, что это соединение может быть получено в результате термического разложения кальциевой соли соответствующей карбоновой кислоты. Напишите уравнение реакции получения данного вещества термическим разложением кальциевой соли соответствующей карбоновой кислоты.
16. Некоторое органическое соединение содержит 40,0% углерода и 53,3% кислорода по массе. Известно, что это соединение реагирует с оксидом меди(II). Напишите уравнение реакции этого вещества с оксидом меди(II).
17. При сгорании 11,6 г органического вещества получили 13,44 л (н.у.) углекислого газа и 10,8 мл воды. Плотность паров этого вещества – 2,59 г/л (н.у.). Известно, что это вещество реагирует с гидроксидом меди(II). Напишите уравнение реакции данного вещества с гидроксидом меди(II).
18. При сгорании 12 г газообразного органического вещества получили 17,6 г углекислого газа и 7,2 г воды. Известно, что это вещество способно вступать в реакцию восстановления с водородом. Напишите уравнение реакции данного вещества с водородом.
19. При сгорании 24 г органического вещества получили 17,92 л (н.у.) углекислого газа и 14,4 г воды. Известно, что это вещество не окисляется аммиачным раствором оксида серебра, но реагирует с карбонатом кальция. Напишите уравнение реакции данного вещества с карбонатом кальция.
20. При сгорании 9 г органического вещества получили 13,2 г углекислого газа и 5,4 г воды. Известно, что это вещество не взаимодействует с карбонатом кальция, но реагирует с водным раствором гидроксида натрия. Напишите уравнение реакции данного вещества с водным раствором гидроксида натрия.
21. При сгорании 8,8 г органического вещества получили 17,6 г углекислого газа и 7,2 г воды. Известно, что это вещество реагирует с аммиачным раствором оксида серебра. Напишите уравнение реакции этого вещества с аммиачным раствором оксида серебра.
22. При сгорании 18 г органического вещества, не содержащего кислорода, получили углекислый газ, 25,2 мл воды и 4,48 л азота (н.у.). Известно, что это вещество реагирует с иодметаном и не может быть получено восстановлением соответствующего нитросоединения. Напишите уравнение реакции данного вещества с иодметаном.
23. При сгорании органического вещества, не содержащего кислорода, получили 6,72 л (н.у.) углекислого газа, 3,6 г воды и 7,3 г хлороводорода. Известно, что это вещество может быть получено взаимодействием соответствующего ациклического углеводорода с хлорной водой. Напишите уравнение реакции получения данного вещества взаимодействием соответствующего углеводорода с хлорной водой.
24. При сгорании 32,4 г органического вещества получили 47,04 л (н.у.) углекислого газа и 21,6 г воды. Известно, что это вещество не взаимодействует с водным раствором гидроксида натрия, но реагирует с уксусной кислотой. Напишите уравнение реакции этого вещества с уксусной кислотой.
25. При сгорании 10,4 г органического вещества нециклического строения получили 35,2 г углекислого газа и 7,2 г воды. Известно, что 1 моль этого органического вещества в присутствии катализатора присоединяет только 1 моль воды и данное вещество реагирует с аммиачным раствором оксида серебра. Напишите уравнение реакции данного вещества с аммиачным раствором оксида серебра.
26. Некоторое органическое соединение, не содержащее кислорода, содержит 77,42% углерода и 15,05% азота по массе. Известно, что это вещество может быть получено восстановлением соответствующего нитросоединения водородом в присутствии катализатора. Напишите уравнение реакции получения данного вещества восстановлением соответствующего нитросоединения водородом в присутствии катализатора.
27. При сгорании 36,6 г органического вещества получили 47,04 л углекислого газа (н.у.) и 16,2 г воды. Известно, что это вещество может взаимодействовать как с кальцием, так и с оксидом кальция. Напишите уравнение реакции данного вещества с оксидом кальция.
28. При сгорании 32 г органического вещества нециклического строения получили 105,6 г углекислого газа и 28,8 г воды. Известно, что 1 моль этого органического вещества в присутствии катализатора присоединяет только 1 моль воды и данное вещество реагирует с аммиачным раствором оксида серебра. Напишите уравнение реакции данного вещества с аммиачным раствором оксида серебра.
29. При сгорании 5,4 г органического вещества нециклического строения получили 8,96 л (н.у.) углекислого газа и 5,4 г воды. Известно, что 1 моль этого органического вещества в присутствии катализатора присоединяет только 1 моль воды и данное вещество не реагирует с аммиачным раствором оксида серебра. Напишите уравнение реакции гидратации органического вещества.
30. При сгорании 37,8 г органического вещества нециклического строения получили 123,2 г углекислого газа и 37,8 г воды. Известно, что в результате присоединения 1 моль брома к 1 моль этого вещества преимущественно образуется соединение, содержащее атомы брома, связанные с первичными атомами углерода. Напишите уравнение реакции 1 моль этого вещества с 1 моль брома.
31. При сгорании 18,4 г органического вещества получили 17,92 л углекислого газа (н.у.) и 21,6 г воды. Известно, что это вещество вступает в реакцию замещения с хлороводородом. Напишите уравнение реакции этого вещества с хлороводородом.
32. При сгорании 4,7 г органического вещества получили 6,72 л (н.у.) углекислого газа и 2,7 г воды. Известно, что это вещество реагирует и с гидроксидом натрия, и с натрием. Напишите уравнение реакции данного вещества с гидроксидом натрия.
33. При сгорании 15,68 л (н.у.) газообразного органического вещества получили 123,2 г углекислого газа и 37,8 г воды. Плотность паров этого вещества (н.у.) составляет 2,4107 г/л. Известно также, что это вещество не реагирует с аммиачным раствором оксида серебра, а 1 моль этого вещества может присоединить в присутствии катализатора только 1 моль воды. Напишите уравнение реакции этого вещества с водой.
34. При сжигании образца органического вещества массой 2,04 г получили 2,24 л (н.у.) углекислого газа и 1,8 г воды. Известно, что данное вещество вступает в реакцию с раствором гидроксида бария при нагревании, один из продуктов этой реакции имеет состав C6H10O4Ba. Напишите уравнение реакции данного вещества с раствором гидроксида бария при нагревании.
35. При сжигании образца некоторого органического соединения массой 14,8 г получено 35,2 г углекислого газа и 18,0 г воды. Известно, что относительная плотность паров этого вещества по водороду равна 37. В ходе исследования химических свойств этого вещества установлено, что при взаимодействии этого вещества с оксидом меди(II) образуется кетон. Напишите уравнение реакции этого вещества с оксидом меди(II).
36. При сгорании 8,4 г органического вещества, молекула которого содержит один третичный атом углерода, получили 13,44 л углекислого газа (н.у.) и 10,8 г воды. Относительная плотность паров этого вещества по воздуху равна 2,897. Известно, что это вещество не взаимодействует с водой, реагирует с бромом на свету. Напишите уравнение реакции вещества с бромом.
37. Углеводород, в молекуле которого отсутствуют третичные и четвертичные атомы углерода, содержит 85,7% углерода по массе. Относительная плотность паров этого вещества по метану равна 5,25. Известно, что данное вещество вступает с хлором только в реакцию замещения. Напишите уравнение реакции этого вещества с хлором.
201. При сгорании 4,32 г органического вещества А образуется 5,04 л (н.у.) углекислого газа, 2,43 г воды и 1,59 г карбоната натрия. Вещество А образуется при действии раствора щёлочи на вещество Б, три заместителя в молекуле которого расположены у нечётных атомов углерода. Напишите уравнение реакции получения вещества А при действии раствора щёлочи на вещество Б.
202. При сгорании 29,2 г органического вещества А образовалось 26,88 л (н.у.) оксида углерода(IV), 4,48 л (н.у.) азота и 25,2 г воды. Известно, что молекула вещества А имеет неразветвлённый углеродный скелет, содержит три функциональные группы, при этом азотсодержащие группы максимально удалены друг от друга. Вещество А способно реагировать как с соляной кислотой, так и гидроксидом натрия. Напишите уравнение реакции вещества А с избытком соляной кислоты.
203. Некоторое органическое вещество А содержит по массе 66,67% углерода, 11,11% водорода и 22,22% кислорода. Известно, что оно взаимодействует со свежеосаждённым гидроксидом меди(II) и образуется при мягком окислении вещества Б холодным водным раствором перманганата калия. Молекула вещества Б имеет только два заместителя, расположенных у атомов углерода при кратной связи. Напишите уравнение реакции получения вещества А окислением вещества Б раствором перманганата калия.
204. Органическое вещество А, содержащее по массе 51,9% углерода, 4,3% водорода, 19,8% кислорода и калий, образуется при действии раствора щёлочи на вещество Б. Известно, что 1 моль вещества Б может прореагировать с 2 моль калия, а заместители в молекуле вещества Б расположены у первого и третьего атомов углерода. Напишите уравнение реакции получения вещества А при действии раствора щёлочи на вещество Б.
205. Органическое вещество А, содержащее по массе 57,5% углерода, 4,8% водорода, 21,9% кислорода и натрий, образуется при действии раствора щёлочи на вещество Б. Известно, что 1 моль вещества Б может прореагировать с 2 моль натрия, а заместители в молекуле вещества Б расположены у первого и третьего атомов углерода. Напишите уравнение получения вещества А при действии раствора щёлочи на вещество Б.
206. Органическое вещество А, содержащее по массе 51,9% углерода, 4,3% водорода, 19,8% кислорода и калий, образуется при действии раствора щёлочи на вещество Б. Известно, что 1 моль вещества Б реагирует с 2 моль натрия, а в его молекуле заместители располагаются у соседних атомов углерода. Напишите уравнение получения вещества А при действии раствора щёлочи на вещество Б.
207. При сгорании 3,24 г органического вещества А образуется 2,912 л (н.у.) углекислого газа, 1,26 г воды и 1,38 г карбоната калия. Вещество А образуется при действии раствора щёлочи на вещество Б. Известно, что вещество Б реагирует с бромоводородом, а в его молекуле заместители располагаются у соседних атомов углерода. Напишите уравнение получения вещества А при действии раствора щёлочи на вещество Б.
208. При сгорании 1,44 г органического вещества А образуется 1,68 л (н.у.) углекислого газа, 0,81 г воды и 0,53 г карбоната натрия. Вещество А образуется при действии раствора щёлочи на вещество Б, два заместителя в молекуле которого максимально удалены друг от друга. Напишите уравнение реакции получения вещества А при действии раствора щёлочи на вещество Б.
209. При сгорании 2,16 г органического вещества А образуется 2,52 л (н.у.) углекислого газа, 1,215 г воды и 0,795 г карбоната натрия. Вещество А образуется при действии гидроксида натрия на вещество Б, два заместителя в молекуле которого расположены у соседних атомов углерода. Напишите уравнение реакции получения вещества А при действии натрия на вещество Б.
210. При сгорании 2,03 г органического вещества А образуется 1,904 л (н.у.) углекислого газа, 0,9 г воды, 0,112 л (н.у.) азота и 0,69 г карбоната калия. Известно, что в веществе А азотсодержащая функциональная группа находится в α-положении по отношению к кислородсодержащей, а в ароматическом ядре замещён только один атом водорода. Напишите уравнение взаимодействия вещества А с избытком соляной кислоты.
211. При сгорании 2,88 г органического вещества А образуется 3,584 л (н.у.) углекислого газа и 2,88 г воды. Известно, что вещество А взаимодействует со свежеосаждённым гидроксидом меди(II) и образуется при мягком окислении вещества Б холодным водным раствором перманганата калия. Молекула вещества Б имеет только два заместителя, расположенных у атомов углерода при кратной связи. Напишите уравнение реакции получения вещества А окислением вещества Б раствором перманганата калия.
212. При сгорании 3,045 г органического вещества А образуется 5,61 г углекислого газа, 1,35 г воды, 168 мл (н.у.) азота и 1,035 г карбоната калия. Вещество A образуется при взаимодействии органического вещества B с гидроксидом калия. Известно, что в молекуле вещества В азотсодержащая функциональная группа находится в α-положении по отношению к кислородсодержащей, а в ароматическом кольце замещён только один атом водорода. Напишите уравнение взаимодействия вещества B с гидроксидом калия.
213. Вещество A содержит 57,75% углерода, 7,49% азота, 17,11% кислорода, 12,30% натрия по массе, остальное водород. Вещество A образуется при взаимодействии вещества B с гидроксидом натрия. Известно, что в молекуле вещества В азотсодержащая функциональная группа находится в α-положении по отношению к кислородсодержащей, а в ароматическом кольце замещён только один атом водорода. Напишите уравнение реакции получения вещества A из вещества B и гидроксида натрия.
214. При сгорании 7,35 г органического вещества А образуется 5,6 л (н.у.) углекислого газа, 4,05 г воды, 0,56 л (н.у.) азота. Известно, что вещество А имеет неразветвлённый углеродный скелет, содержит три функциональные группы, при этом азотсодержащая группа находится в αположении к одной из кислородсодержащих групп. Вещество A может реагировать как с гидроксидом калия, так и с соляной кислотой. Напишите уравнение реакции вещества А с избытком гидроксида калия.
215. Вещество A содержит 39,13% углерода, 17,39% кислорода, 15,22% азота, 21,20% калия по массе, остальное водород. Вещество A образуется при взаимодействии вещества B с гидроксидом калия. Известно, что молекула вещества B имеет неразветвлённый углеродный скелет, содержит три функциональные группы, при этом азотсодержащие функциональные группы максимально удалены друг от друга. Напишите уравнение получения вещества A при взаимодействии вещества B с гидроксидом калия.
Тренировочный вариант №1 ЕГЭ 2023 по химии задания с ответами
ПОДЕЛИТЬСЯ МАТЕРИАЛОМ
Ниже приведен подробный разбор демоверсии ЕГЭ-2023 по химии, проектная версия. Задания разобраны от 1 до 34 подряд, приведена логика рассуждения по каждому из них. Если есть желание разобраться более детально, то переходите по ссылкам в тексте или записывайтесь к нам на курс.
Для выполнения первого задания всегда рекомендую расписать электронно-графические формулы элементов (с ячейками). В большинстве случаев достаточно изобразить внешний и предвнешний уровень. Напомню также, что для элементов дальше IV периода не нужно изображать формулу целиком, а можно воспользоваться аналогией строения валентных подуровней с соседом из подгруппы. По приведенным элементам:
- Цезий находится в первой группе, главной подгруппе, аналог натрия по строению внешнего уровня. Имеет 1 электрон на 6s-подуровне, он же является неспаренным.
- Углерод находится в четвертой группе, главной подгруппе. На внешнем уровне имеет 4 электрона, из них неспаренных два, которые находятся на 2р-подуровне.
- Кислород находится в шестой группе, главной подгруппе. На внешнем уровне имеет 6 электронов, из них неспаренных два, которые находятся на 2р-подуровне.
- Хром находится в шестой группе, побочной подгруппе. Необходимо вспомнить о проскоке электрона, за счет которого на внешнем уровне, 4s-подуровне, имеет 1 электрон, а не предвнешнем, 3d-подуровне, – пять. Итого 6 неспаренных.
- Азот находится в пятой группе, главной подгруппе. На внешнем уровне имеет 5 электронов, из них неспаренных три, которые находятся на 2р-подуровне.
Выбираем углерод и кислород, у обоих по два неспаренных электрона.
Ответ: 23
Необходимо вспомнить, что к р-элементам можно отнести элементы главных подгрупп шести последних групп в периоде. Представители первых двух относятся к s-элементам, а элементы побочных подгрупп относим к d-элементам. Исходя из приведенных соображений, выбираем пункты 2), 3), 5).
Атомный радиус уменьшается направо по периоду, поэтому располагаем выбранные ранее элементы в порядке 2), 5), 3).
Ответ: 253
Для выполнения такого рода заданий рекомендую выписать на лист бумаги высшую и низшую степени окисления для каждого из элементов.
- Цезий имеет высшую степень окисления +1, низшую – 0. Разность 1.
- Углерод имеет высшую степень окисления +4, низшую – -4. Разность 8.
- Кислород имеет высшую степень окисления +2, низшую – -2. Разность 4.
- Хром имеет высшую степень окисления +6, низшую – 0. Разность 6.
- Азот имеет высшую степень окисления +5, низшую – -3. Разность 8.
Таким образом, выбираем углерод и азот.
Ответ: 25
В задании, по сути, есть два фильтра: по типу строения и по характеру связи. Начнем с типа строения. Поскольку необходимо выбрать вещества молекулярного строения, то сразу можно исключить соли и иные соединения, имеющие ионные связи. Убираем из рассмотрения пункты 1) и 4). Среди оставшихся нужно найти вещества с ковалентной полярной связью. Вспомним, что такая связь может возникать между атомами разных неметаллов (или сильно различающихся фрагментов в органических молекулах). По такому принципу можно исключить пункт 5). Остаются вещества 2) и 3).
Ответ: 23
К двухосновным кислотам относятся те из них, которые содержат в молекуле 2 атома водорода, способных замещаться на катионы металлов. Подобным требованиям отвечает сернистая кислота, пункт 4).
К средним можно отнести соли, не содержащие способных к замещению атомов водорода, фрагментов ОН, комплексных ионов и подобного. Из приведенного списка можно взять аммиачную селитру, тривиальное название нитрата аммония.
К амфотерным гидроксидам можно отнести гидроксиды металлов в степенях окисления +3 и +4, также гидроксиды бериллия, цинка, свинца, олова. Подойдет пункт 2).
Ответ: 482
Попробуем найти в приведенном списке сильные кислоты. Пункт 1) подходит, поскольку в пункте 3) находится слабая кислота. Таким образом X уже установлен.
Среди оставшихся пунктов нужно найти вещество, которое при добавлении вызовет растворение гидроксида алюминия. Поскольку гидроксид является амфотерным, то сможет прореагировать с кислотой, кроме наиболее слабых, или щелочью. Среди приведенных соединений можно взять 4), поскольку гидроксид калия является щелочью.
Ответ: 14
Для выполнения подобных заданий советую следующий порядок действий:
- Берем вещество из левого столбика
- Классифицируем его, вспоминаем характерные типы реакций для такого класса соединений
- Оцениваем его с точки зрения кислотно-основных и окислительно-восстановительных свойств
- Подбираем вещества и правого столбика, противоположные по свойствам и способные реагировать с веществом из правого столбика
Пункт А):
Сера относится к простым веществам-неметаллам, средняя по активности. Способна вступать в реакцию со щелочами, сильными окислителями и активными восстановителями. С водой и кислотами, кроме кислот-окислителей, реакции нет.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 3) водород выступит против серы в качестве восстановителя, хлор и кислород – окислители. Подходит.
В пункте 4) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 5) нет реакции уже с первым веществом, дальше не продолжаем.
Пункт Б):
Оксид серы (VI) относится к кислотным оксидам, реагирует с водой, большинством веществ основной и амфотерной природы. Восстановительных свойств не проявляет, может быть окислителем.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) оксид бария – основный, КОН – щелочь, с водой реакция тоже есть. Подходит.
В пункте 3) хлор и кислород – окислители, не подходит.
В пункте 4) нет реакции с уксусной кислотой, не подходит.
В пункте 5) нет реакции уже со вторым веществом, дальше не продолжаем.
Пункт В):
Гидроксид цинка относится к амфотерным гидроксидам, может реагировать со щелочами, кислотами. Выраженных окислительных или восстановительных свойств не проявляет. В воде нерастворим, с солями не обменивается.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) нет реакции с водой, не подходит.
В пункте 3) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 4) реагирует с кислотами и щелочью. Подходит.
В пункте 5) нет реакции с хлоридом бария, не подходит.
Пункт Г):
Бромид цинка относится к солям, может вступать в реакции обмена со щелочами и солями. Может проявлять восстановительные свойства за счет бромид-иона.
В пункте 1) обмен имеет смысл с первым и вторым веществам, с третьим будет ОВР. Подходит.
В пункте 2) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 3) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 4) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 5) нет реакции уже с первым веществом, дальше не продолжаем.
Ответ: 3241
Для ответа на вопрос имеет смысл оценить свойства веществ в каждой паре, а при необходимости записать уравнение реакции между ними. Сделаем и то, и другое.
В пункте А) магний является сильным восстановителем, а концентрированная серная кислота – окислителем. Магний способен восстановить серу до низшей степени окисления:
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
В пункте Б) встречаются основный оксид и кислота, произойдет обмен:
MgO + H2SO4 = MgSO4 + H2O
В пункте В) сера выступает в качестве восстановителя, а концентрированная серная кислота – окислитель. Произойдет ОВР:
S + 2H2SO4 = 3SO2 + 2H2O
В пункте Г) сероводород выступает в качестве восстановителя, а кислород – окислитель. Произойдет ОВР:
2H2S + 3O2 = 2SO2 + 2H2O
Ответ: 5144
Обратим внимание, что железо в одну стадию переходит в степень окисления +3. Для этого нам нужен сильный окислитель- хлор.
2Fe + 3Cl2 = 2FeCl3
Во второй реакции железо понижает степень окисления до +2, поэтому необходимо найти восстановитель. Им тут может быть только йодид калия.
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
Ответ: 43
Для установления соответствия имеет смысл найти в структурах из левого столбика характерные функциональные группы и фрагменты.
В структуре А) видим фрагмент -NH-, который можно отнести ко вторичному амину. Циклическая структура молекулы в данном случае ничего не значит.
В структуре Б) есть аминогруппа и карбоксильная группа. Соответственно, вещество можно отнести к аминокислотам.
В структуре В) есть структурный фрагмент -С(О)NH- и просматриваются два остатка от аминокислот, что указывает на дипептид.
Ответ: 231
К решению подобных заданий может быть несколько подходов. Можно для начала определить молекулярную формулу бутена-1, а затем сравнить ее с молекулярными формулами предложенных вариантов. Изомеры по определению должны иметь одинаковые молекулярные формулы.
Бутен-1 – С4Н8
- С4Н10
- С4Н8
- С4Н6
- С4Н6
- С4Н8
Ответ: 25
Поскольку подкисленный раствор перманганата проявляет сильные окислительные свойства, следует поискать вещества, которые могут окисляться с образованием карбоновой кислоты. Прокомментируем все предложенные пункты:
- Окисляется с разрывом кратной связи, кислота будет
- Не окисляется
- Окисляется по боковой цепи, кислота будет
- Не окисляется
- Окисляется до кислоты
Ответ: 135
Метиламин относится к первичным алифатическим аминам, проявляет выраженные основные свойства, вступает в реакции алкилирования, реагирует с азотистой кислотой. Прокомментируем все предложенные пункты:
- Алкан, низкая активность, реакции нет
- Хлоралкан, реакция алкилирования, реагирует
- Водород, гидрировать нечего, не реагирует
- Основание, не реагирует
- Кислота, образование соли, реагирует
Ответ: 25
Для решения имеет смысл записать классы соединений из левого столбика, далее оценить происходящие изменения:
А) 1,2-дигалогеналкан – алкен
Б) моногалогеналкан – алкен
В) моногалогеналкан – алкан
Г) 1,2-дигалогеналкан – алкин
По изменениям назвать тип происходящей реакции и подобрать к ней подходящий реагент:
А) дегалогенирование, магний
Б) дегидрогалогенирование, спиртовой раствор щелочи
В) реакция Вюрца, натрий
Г) дегидрогалогенирование, спиртовой раствор щелочи
Ответ: 1252
Для надежности перед выбором ответа имеет смысл преобразовать названия веществ в формулы и прописать предложенные реакции. Попробуем это сделать:
А) 2CH3COOH + Na2S = 2CH3COONa + H2S
Б) HCOOH + NaOH = HCOONa + H2O
В) HCOH + 4Cu(OH)2 = 2Cu2O + CO2 + 5H2O
Г) 2CH3CH2OH + 2Na = 2CH3CH2ONa + H2
Ответ: 5462
При рассмотрении цепочек превращений бывает полезно посмотреть через одну стадию и оценить, как можно осуществить такое превращение. Также очень полезно сравнить число атомов углерода в исходной молекуле и продукте, может навести на мысль.
В первых двух реакциях цепочки число атомов углерода удваивается, что наводит на мысль о реакции Вюрца. Если рассуждение верное, то веществом Х должен быть галогеналкан. Действительно, его можно получить в одну стадию из спирта, а затем превратить в алкан.
Следующее превращение можно понять, если посмотреть на условия реакции. Нагревание линейного алкана в присутствии хлорида алюминия приводит к его изомеризации в разветвленный алкан.
Ответ: 54
Для решения можно переписать вещества в парах в виде формул, оценить их окислительно-восстановительные свойства и возможность реакции между ними:
- K2S – восстановитель, KMnO4 – окислитель, имеет смысл
- H2SO4 – окислитель, NaCl – очень слабый восстановитель, не ОВР
- NH4Cl – очень слабый восстановитель, NaNO2 – окислитель, специфический случай обмена, сопровождаемого ОВР
- SiO2 – выраженных окислительно-восстановительных свойств не проявляет, Na2CO3 — выраженных окислительно-восстановительных свойств не проявляет, не ОВР
- HI – восстановитель, Na2Cr2O7 – сильный окислитель, имеет смысл
Для надежности можно записать уравнения реакций между ними:
- 2KMnO4 + 3K2S + 4H2O = 2MnO2 + 3S + 8KOH
- NaCl + H2SO4 = NaHSO4 + HCl
- NaNO2 + NH4Cl = NaCl + N2 + 2H2O
- Na2CO3 + SiO2 = Na2SiO3 + CO2
- Na2Cr2O7 + 14HI = 2NaI + 2CrI3 + 3I2 + 7H2O
Ответ: 135
Изменение давления не будет влиять на скорость реакций, в которых нет газообразных реагентов. Среди приведенных пунктов это будут 2), 3), 5).
Ответ: 235
Для решения подобных заданий нужно расставить степени окисления на атомах азота до и после реакции.
Если степень не меняется, то азот не проявляет окислительно-восстановительных свойств. Так будет в пункте А) (переход -3 в -3).
Если степень увеличится, то азот проявляет восстановительные свойства. Так будет в пунктах Б) (переход -3 в 0) и В) (переход -3 в +2).
Ответ: 422
В первом случае для решения необходимо вспомнить зависимость продуктов электролиза от состава соли:
А) соль образована катионом активного металла и кислородсодержащим анионом, на электродах выделятся водород и кислород.
Б) соль образована катионом активного металла и галогенид-ионом, на электродах выделятся водород и галоген.
В) соль образована катионом малоактивного металла и галогенид-ионом, на электродах выделятся металл и галоген.
Ответ: 342
Во втором случае нужно помнить, что алюминий получают при электролизе раствора оксида в расплаве криолита. Калий и подобные наиболее активные металлы только из расплавов галогенидов. Кислород в данном случае можно получить при электролизе водного раствора фторида калия.
Ответ: 124
Для начала имеет смысл определить класс каждого из соединений:
- Средняя соль
- Средняя соль
- Средняя соль
- Сильная кислота
Исходя из этого уже можно сказать, что наиболее низкое значение рН (самая кислая среда) будет в пункте 4).
Как разобраться с солями? Нужно оценить их способность к гидролизу и потенциальное влияние на среду раствора:
- Соль сильной кислоты и сильного основания, не гидролизуется, среда нейтральная
- Соль слабого основания и сильной кислоты, гидролиз по катиону, среда кислая
- Соль сильного основания и слабой кислоты, гидролиз по аниону, среда щелочная
Ответ: 4213
В задании на равновесие следует учитывать разные факторы. Пройдем по каждому из пунктов:
А) кислота при диссоциации может дать дополнительное количество ионов Н+, которые участвуют в равновесии. При увеличении их концентрации равновесие сместится в сторону обратной реакции.
Б) давление в данном случае не окажет влияния, поскольку нет участников-газов
В) повышение температуры сместит равновесие в сторону эндотермической реакции. В данном случае – прямой.
Г) твердая щелочь может раствориться и прореагировать с Н+, уменьшая концентрацию таких ионов в системе. Равновесие сместится в сторону прямой реакции.
Ответ: 2311
Задания подобного типа удобнее всего решать с помощью таблицы. Данный подход к решению задания ЕГЭ-2023 на равновесие в реакторе можно посмотреть по ссылке ниже:
Способ, на мой взгляд, наиболее оптимальный и доступный каждому.
Ответ: 25
В первом случае нужно подобрать такое вещество из правого столбика, которое реагирует с одним или двумя веществами из пары в левом столбике. При этом очень важно, чтобы реакция сопровождалась видимыми признаками:
Пара А):
- Есть реакция с азотной кислотой, сопровождается выделением газа и растворением твердого вещества. Нитрат натрия не реагирует. Подходит.
- Есть реакция с азотной кислотой, но внешних признаков нет. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
Пара Б):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с гидроксидом калия, но внешних признаков нет. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с гидроксидом натрия, сопровождается образованием осадка. Хлорид калия не реагирует. Подходит.
Пара В):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с хлоридом бария, сопровождается образованием осадка. Хлорид натрия не реагирует. Подходит.
Пара Г):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Специфический случай, поскольку один из изначально образовавшихся нерастворимых гидроксидов (Al(OH)3) может раствориться снова при избытке щелочи. Подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
В заданиях второго типа имеет смысл записать происходящие реакции и попытаться себе их представить. Как может выглядеть и что увидим:
- 2CH3CH2COOH + 2Li = 2CH3CH2COOLi + H2
- 2CH3CH(OH)CH3 + 2K = 2CH3CH(OK)CH3 + H2
- Zn(OH)2 + 2CH3COOH = Zn(CH3COO)2 + 2H2O
- C2H2 + 2Br2 = CHBr2-CHBr2
В первом и втором случаях наблюдаем выделение газообразного водорода. В третьем наблюдаем растворение осадка гидроксида цинка. В четвертом исчезнет окраска брома, наблюдается обесцвечивание.
Ответ: 4415
Задание 25 охватывает несколько совершенно разнородных тем, каждая из которых требует отдельного блока знаний. Приведу здесь ссылки на полезные материалы по заданию, поскольку многое здесь нужно просто выучить.
По первому блоку следует знать, что сопряженные алкадиены используются для производства каучуков, а алкены – пластмасс. Метан в составе природного газа используют в качестве топлива.
По второму блоку можно относительно легко соотнести мономер и полимер, если представить себе структуру молекулы мономера. В молекуле этена всего два атома углерода, поэтому элементарное звено формулы полимера тоже содержит два атома углерода. По той же логике здесь можно действовать и для пропена с дивинилом.
Третий блок нужно просто выучить. По переработке углеводородов можно заглянуть сюда. Хорошее описание технологических процессов можно посмотреть здесь.
Ответ: 234; 214; 312
Для решения подобных заданий на растворы рекомендую использовать метод таблиц, подробно описанный здесь.
В итоге решение задачи сводится к уравнению вида
(15+х)/(150+х) = 0,12
15+х = 18+0,12х
0,88х = 3
х = 3,4
Ответ: 3,4 г
Задания такого типа сводятся к решению пропорции. Для начала переведем известный объем аммиака в количество:
n(NH3) = V(NH3)/Vm = 0,56/22,4 = 0,025 (моль)
2 моль – 92 кДж
0,025 моль – х кДж
х = 1,15 кДж
Ответ: 1,15 кДж
Для решения первой задачи запишем уравнение протекающей реакции:
CaCO3 + 2HNO3 = Ca(NO3)2 + CO2 + H2O
Далее вычислим количество нитрата кальция:
n(Ca(NO3)2) = m(Ca(NO3)2)/M(Ca(NO3)2) = 196800/164 = 1200 (моль)
Вычислим массу чистого карбоната кальция, который содержался в известняке:
m(CaCO3) = n(Ca(NO3)2)·M(Ca(NO3)2) = 1200·100 = 120000 (г) = 120 (кг)
Вычислим массу примесей в известняке:
m(примеси) = m(известняка) – m(CaCO3) = 150 — 120 = 30 (кг)
Определим массовую долю примеси в известняке:
ω(примеси) = m(примеси)/m(известняка)·100% = 30/150·100% = 20%
Ответ: 20%
Для решения второй задачи запишем уравнение протекающей реакции:
3С2Н2 = С6Н6
Вычислим количества ацетилена и практически полученного бензола:
n(С2Н2) = V(С2Н2)/Vm = 26,88/22,4 = 1,2 (моль)
n(С6Н6 практ.) = m(С6Н6)/M(С6Н6) = 23,4/78 = 0,3 (моль)
Вычислим теоретически возможное количество бензола и сравним его с практическим:
n(С6Н6 теор.) = n(С2Н2)/3 = 1,2/3 = 0,4 (моль)
η(С6Н6) = n(С6Н6 практ.)/n(С6Н6 теор.)·100% = 0,3/0,4·100% = 75%
Ответ: 75%
При выполнении заданий 29 и 30 имеет смысл записать все представленные вещества в виде молекулярных формул:
KMnO4, NaHCO3, Na2SO3, BaSO4, KOH, H2O2
Далее следует внимательно прочитать описание реакции. Поскольку должно происходить изменение цвета раствора, нужно найти окрашенный реагент. Из предложенных это может быть только KMnO4. Это вещество проявляет сильные окислительные свойства, поэтому нужно подобрать восстановитель. Осадка в ходе реакции образоваться не должно, поэтому брать нейтральную среду нельзя. В противном случае выпадет осадок MnO2. Среда может быть кислой или щелочной. Кислоты в предложенном наборе нет, поэтому выберем гидроксид калия для создания среды. Восстановителей в предложенном наборе два: сульфит натрия и пероксид водорода. Пероксид брать нельзя, поскольку по описанию реакции газа образоваться не должно. Таким образом приходим к выводу, что нужно взять сульфит, перманганат и щелочь. Приведем соответствующую реакцию и электронный баланс:
2KMnO4 + Na2SO3 + 2KOH = 2K2MnO4 + Na2SO4 + H2O
2∙ | Mn+7 + 1ē → Mn+6
1∙ | S+4 – 2ē → S+6
марганец в степени окисления +7 (или перманганат калия) является окислителем.
сера в степени окисления +4 (или сульфит натрия) – восстановителем.
Есть хороший инструмент для отработки данного задания, рекомендую.
При выполнении заданий 29 и 30 имеет смысл записать все представленные вещества в виде молекулярных формул:
KMnO4, NaHCO3, Na2SO3, BaSO4, KOH, H2O2
Далее следует внимательно прочитать описание реакции. К кислым солям здесь относится только NaHCO3. В обмен с ней вступит только гидроксид калия, поскольку кислое и щелочь точно смогут прореагировать. Приведем молекулярное, полное и сокращенное ионные уравнения:
2NaHCO3 + 2KOH = Na2CO3 + K2CO3 + 2H2O
2Na+ + 2HCO3− + 2K+ + 2OH− = 2Na+ + CO32− + 2K+ + CO32− + 2H2O
HCO3− + OH− = CO32− + H2O
Решение 31 номера сводится к знанию неорганической химии, свойств и реакций отдельных веществ. Приведем уравнения протекающих процессов:
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
SO2 + 2H2S = 3S + 2H2O
3S + 6KOH = K2SO3 + 2K2S + 3H2O
При рассмотрении цепочек превращений бывает полезно посмотреть через одну стадию и оценить, как можно осуществить такое превращение. Также очень полезно сравнить число атомов углерода в исходной молекуле и продукте, может навести на мысль.
Начнем с циклогексана. Получить его путем гидрирования можно, например, из бензола. Его, в свою очередь, можно получить из гексана по реакции дегидроциклизации. Х1 – бензол. Далее в цепочке много неизвестных веществ, заглянем в самый конец. Циклогексанон относится к кетонам, получить его можно из вторичного спирта. Условия последней реакции на это указывают, поскольку там дан сильный окислитель в кислой среде. Тогда Х3 – циклогексанол. Получить такой спирт в две стадии нужно из циклоалкана. Тогда можно предположить последовательно галогенирование и замещение полученного галогенпроизводного под действием водного раствора щелочи. Тогда Х2 – хлорциклогексан, можно бромциклогексан. Последовательность реакций получается следующей:
Решение задачи начинается с анализа и расчета молекулярной формулы. Поскольку продуктами сгорания являются только углекислый газ и вода, можно приписать веществу формулу CxHyOz. Вычислим количества углекислого газа и воды:
n(H2O) = m(H2O)/M(H2O) = 1,8/18 = 0,1 (моль)
n(СО2) = V(CO2)/Vm = 4,48/22,4 = 0,2 (моль)
Тогда можно определить количества и массы элементов, входивших в состав исходного вещества:
n(С) = n(СО2) = 0,2 моль
m(С) = n(С)·M(С) = 0,2·12 = 2,4 г
n(H) = 2n(H2O) = 0,2 моль
m(H) = n(H)·M(H) = 0,2·1 = 0,2 г
m(О) = m(CxHyOz) − m(С) − m(H) = 3,4 − 2,4 − 0,2 = 0,8 (г)
n(O) = m(O)/M(O) = 0,8/16 = 0,05 (моль)
Вычислим молекулярную формулу неизвестного вещества:
x : y : z = n(С) : n(H) : n(O) = 0,2 : 0,2 : 0,05 = 4 : 4 : 1
Поскольку по условию один из фрагментов молекулы должен содержать 7 атомов углерода, разумным будет удвоить простейшее соотношение и получить формулу C8H8O2.
С8Н8О2 – молекулярная формула
Вещество по условию реагирует со щелочью, процесс гидролиза с образованием соли и спирта. В остатке кислоты 7 атомов углерода и малое количество атомов водорода, что вполне соответствует бензоату. Тогда на спирт приходится всего один атом углерода, что соответствует метанолу. Тогда можно предложить структуру метилбензоата:
Запишем уравнение его реакции с гидроксидом лития:
К заданию 34 следует приступать только после ПОЛНОГО выполнения и проверки всех остальных заданий КИМа. Убедитесь также, что все прочие задания перенесены в бланк ответов, а не остались на черновике. Времени на это задание нужно больше всего, поэтому велик риск потерять остальное и не успеть что-то перенести в бланк.
Для решения следует внимательно прочитать условие и написать реакции, которые сразу же очевидны, без дополнительных расчетов. Здесь их можно записать две:
Ca + 2HCl = CaCl2 + H2
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
Поскольку напрямую ничего не известно про массу и количество кальция и карбоната кальция, можно сказать, что кальция было х моль, а его карбоната у моль. Тогда в ходе реакций выделилось х моль водорода и у моль углекислого газа. Выразим массы указанных веществ:
m(Ca) = n·M = 40х г
m(CaCO3) = n·M = 100у г
m(Н2) = n·M = 2х г
m(CO2) = n·M = 44у г
Выразим массу раствора после добавления исходной твердой смеси к соляной кислоте:
m(р-ра) = m(Ca) + m(CaCO3) + m(р-ра HCl) − m(Н2) − m(CO2)
m(р-ра) = 40х + 100у + 300 − 2х − 44у = 330 (г)
38х + 56у = 30
Первое уравнение системы готово. Второе составим по массовой доле кальция в исходной смеси:
m(смеси) = m(Ca) + m(CaCO3) = 40х + 100у (г)
m(Ca) = 40х + 40у (г)
ω(Са) = m(Ca)/m(смеси)·100% = (40х+40у)/(40х+100у)·100% = 50%
(40х+40у)/(40х+100у) = 0,5
Составим и решим систему уравнений:
38х + 56у = 30
(40х + 40у)/(40х + 100у) = 0,5
38х + 56у = 30
(2х + 2у)/(2х + 5у) = 0,5
38х + 56у = 30
2х + 2у = х + 2,5у
38х + 56у = 30
х = 0,5у
75у = 30
у = 0,4
х = 0,2
n(Ca) = 0,2 моль
n(CaСО3) = 0,4 моль
Далее вычислим количество и массу углекислого газа:
n(СО2) = n(CaСО3) = 0,4 моль
m(СО2) = n(СО2)·M(СО2) = 0,4·44 = 17,6 г
Вычислим массу и количество гидроксида натрия:
m(NaOH) = m(р-ра NaOH)·ω(NaOH)/100% = 400·4%/100% = 16 (г)
n(NaOH) = m(NaOH)/M(NaOH) = 16/40 = 0,4 (моль)
Далее нужно сравнить количества щелочи и углекислого газа, чтобы понять, какая будет реакция между ними:
n(СО2)/n(NaOH) = 0,4/0,4 = 1:1
Соотношение 1:1, поэтому образуется кислая соль:
NaOH + CO2 = NaHCO3
Вычислим массу образовавшейся соли и массу раствора:
n(NaHCO3) = n(СО2) = 0,4 моль
m(NaHCO3) = n·M = 0,4·84 = 33,6 г
m(р-ра конечн.) = m(р-ра NaOH) + m(CO2) = 400 + 17,6 = 417,6 (г)
Вычислим массовую долю гидрокарбоната натрия в полученном растворе:
ω(NaHCO3) = m(NaHCO3)/m(р-ра конечн.)·100% = 33,6/417,6·100% = 8,05%
Ответ: 8,05%
Решение расчётных задач по химии подчиняется логике и проводится по определенным алгоритмам. Прежде всего, нужно внимательно прочитать и проанализировать условие задачи, написать необходимые уравнения химических реакций. Важно осознать ключевой (главный) вопрос в задаче и понять, количество какого вещества следует найти и по количеству какого вещества будет производиться расчёт. На основе анализа условия определить причинно-следственные связи и составить план последовательности решения задачи. Почему мы главным вопросом задачи считаем нахождение количества вещества? По количеству вещества всегда можно найти его массу, объём и массу раствора (массу и объём газа) и ответить на возможные дополнительные вопросы, содержащиеся в задаче.
В рассматриваемых примерах мы не будем пояснять выполнение формальных расчётов, предполагая, что вы проводите их без затруднений.
Пример 1. Электролиз 470 г 5%-ного раствора нитрата меди(II) прекратили после того, как масса раствора уменьшилась на 8 г. Из полученного раствора отобрали порцию массой 92,4 г. Вычислите массу 11,2 %-ного раствора едкого кали, необходимого для полного осаждения меди из отобранной порции раствора.
А) Проводим анализ условия
(составляем уравнения химических реакций, о которых упоминается в условии задачи).
1-й фрагмент.
«Электролиз 470 г 5%-ного раствора нитрата меди(II) прекратили… ».

При проведении этого этапа стараемся не обращать внимания на численные значения, а выделяем только химическую часть условия – она выделена в тексте фрагмента полужирным шрифтом.
2-й фрагмент.
«…Из полученного раствора отобрали порцию массой 92,4 г. Вычислите массу 11,2 %-ного раствора едкого кали, необходимого для полного осаждения меди из отобранной порции раствора».

Необходимо понять: в смеси после реакции находятся продукты реакции (Cu, O2, HNO3) и исходные вещества, которые не прореагировали, были «в избытке» (Cu(NO3)2, H2O), и следует рассматривать возможность взаимодействия каждого из этих веществ с добавляемым реагентом.
Б) Устанавливаем логические связи (формулируем главный вопрос задачи, т.е. находим вещество, количество которого необходимо рассчитать, и логическую цепочку, связывающую количество этого вещества с веществами, количество которых мы знаем или можем вычислить).
Главный вопрос – найти количество KOH (прореагировавшего с HNO3 и Cu(NO3)2, находящимися в отобранной части раствора).

Выводы (логическая цепочка):
При проведении расчётов будем использовать уменьшение массы раствора на 8 г (единственная количественная величина, относящаяся к протеканию реакции), которое происходит за счёт осаждения меди и выделения кислорода.
1) Количество KOH связано с количеством Cu(NO3)2 и HNO3 в порции раствора (уравнения (2) и (3)).
2) Количество HNO3 связано с количеством Cu и O2, которые образовались в процессе электролиза (уравнение (1)).
3) Количество Cu(NO3)2 в растворе после электролиза (избыток Cu(NO3)2) связано с количеством выделившихся Cu и O2.
В) План решения задачи.
1) Найти количество Cu(NO3)2 до электролиза.
2) Найти количество образовавшейся HNO3 по количеству выделившихся Cu и O2 (уравнение 1).
3) По уменьшению массы (т.е. по количеству выделившихся Cu и O2) найти количество прореагировавшего Cu(NO3)2 по уравнению (1).
4) Найти количество непрореагировавшего Cu(NO3)2.
5) Найти количество Cu(NO3)2 и HNO3в отобранной порции раствора.
6) По количеству Cu(NO3)2 и HNO3 в порции найти количество прореагировавшего KOH.
7) Вычислить массу раствора KOH.
Г) Решение.
1) Находим количество вещества Cu(NO3)2 до электролиза.

2) По уравнению (1) находим количество прореагировавшего Cu(NO3)2:

Пусть прореагировало x моль Cu(NO3)2, тогда

г) 
3) По уравнению (1) находим количество прореагировавшего HNO3:
г) 
4) Находим количество вещества Cu(NO3)2 и HNO3 в отобранной порции раствора.
а) 
б) находим количество вещества Cu(NO3)2 с помощью пропорции – концентрация вещества одинакова как во всём растворе, так и в любой его части
а) 
в) находим количество вещества HNO3 в отобранной порции:
а) 
5) Находим количество KOH и массу добавленного раствора KOH.
а) По уравнению (2).

б) По уравнению (3).

в) 
Пример 2. Насыщенный раствор нитрата алюминия получили, растворив кристаллогидрат Al(NO3)3·12H2O (растворимость 241 г в 100 г воды при 25 ºС) в 250 г воды. Полученный раствор разделили на две части. В первую добавили раствор Na2CO3 (избыток), во вторую 400 г раствора аммиака (избыток). Во второй колбе осадок в 4 раза тяжелее, чем в первой. Найдите концентрацию соли во второй колбе.
В ответе приведите уравнения реакций, которые указаны в условии задачи, и все необходимые вычисления (указывайте единицы измерения искомых физических величин).
А) Проводим анализ условия
Разбиваем условие на смысловые фрагменты, выделяем ключевые слова и понятия и составляем уравнения реакций (химическая часть задачи).
1-й фрагмент:
«Насыщенный раствор нитрата алюминия получили, растворив кристаллогидрат Al(NO3)3·12H2O (растворимость 241 г в 100 г воды при 25 ºС) в 250 г воды. Полученный раствор разделили на две части».

2-й фрагмент:
« В первую добавили раствор Na2CO3 (избыток), …»

3-й фрагмент:
«во вторую 200 г раствора аммиака (избыток)»

4-й фрагмент:
«Во второй колбе осадок в 4 раза тяжелее, чем в первой. Найдите концентрацию соли во второй колбе».
Химических превращений нет.
Б) Устанавливаем логические связи (формулируем главный вопрос задачи, т.е. находим вещество, количество которого необходимо рассчитать, и логическую цепочку, связывающую количество этого вещества с веществами, количество которых мы знаем или можем вычислить).
Главный вопрос – найти количество NH4NO3.

Выводы (логическая цепочка):
Единственная цифра, которую можно использовать при проведении расчётов, это «4» – отношение масс Al(OH)3, образовавшихся во 2-й и 1-й колбах.

В) План решения задачи.
1) Найти количество Al(NO3)3(общее).
2) Найти количество Al(NO3)3 в 1-й части (уравнение (1) по Al(OH)3.
3) Найти количество Al(NO3)3 во 2-й части (уравнение 2) по Al(OH)3.
4) Найти количество NH4NO3 (по уравнению (3)) по количеству AlCl3 (2-я часть)).
5) Найти ω(NH4NO3) по уравнению (3).
Г) Решение
1) Находим количество Al(NO3)3 в исходном растворе.
а) находим количество Al(NO3)3·12H2O, которое растворилось в 250 г воды:
Используя данные по растворимости (растворимость 241 г в 100 г воды при 25 ºС), составляем пропорцию,

б) 
2) Находим количество Al(NO3)3, прореагировавшего по уравнениям (2) и (3):
Пусть по уравнению (1) прореагировало x моль Al(NO3)3, по уравнению (2) – y моль Al(NO3)3, тогда
а) x + y = 1,4
б) по уравнению (2):

в) по уравнению (3):

г)

3) По уравнению (3) находим количество NH4NO3:
а) 
4) По уравнению (3) находим количество образовавшегося Al(OH)3:

5) Находим массу 2-й части раствора Al(NO3)3.
Концентрация вещества в растворе и в любой его части одинакова, следовательно

6) Находим массовую долю NH4NO3 в растворе:
а) 
б)