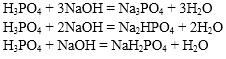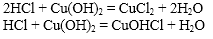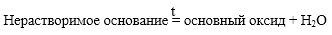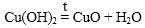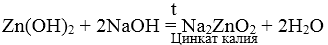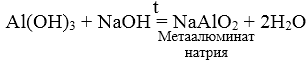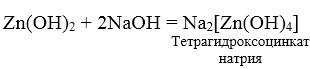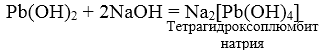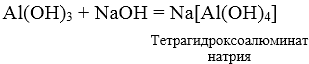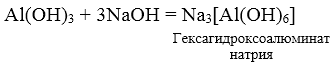в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 35 1–20 | 21–35
Добавить в вариант
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задания Д8 № 111
Разбавленная серная кислота реагирует лишь с одним из двух веществ
1) медь и оксид кремния (IV)
2) оксид алюминия и магний
3) оксид цинка и оксид меди (II)
4) гидроксид натрия и оксид углерода (II)
Источник: Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 2.
Задания Д8 № 283
Серная кислота (разб.) реагирует с каждым из двух веществ:
1)
2)
3)
4)
Задания Д8 № 842
С ортофосфорной кислотой взаимодействует каждое из веществ, указанных в ряду:
1)
2)
3)
4)
С разбавленной серной кислотой взаимодействует
1) медь
2) цинк
3) ртуть
4) кремний
Разбавленная серная кислота реагирует с каждым из двух веществ:
1)
2)
3)
4)
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 1
В двух пробирках находился твёрдый гидроксид меди(II). В одну пробирку добавили водный раствор вещества X, а в другую — водный раствор вещества Y. В обеих пробирках вещество растворилось, в первой пробирке раствор приобрёл сине-фиолетовый цвет, а во второй — голубой. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1)
2)
3)
4)
5)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Источник: СтатГрад: Тренировочная работа 09.11.2022. Вариант ХИ2210201.
Задания Д8 № 627
Концентрированная азотная кислота реагирует с каждым из двух веществ:
1)
2)
3)
4)
И с серной, и с фосфорной кислотой реагирует
1)
2)
3)
4)
Разбавленная серная кислота реагирует с каждым из двух веществ:
1) железо и оксид серы(IV)
2) азотная кислота и оксид цинка
3) оксид углерода(IV) и оксид меди(II)
4) хлорид бария и цинк
Источник: ЕГЭ по химии 24.04.2014. Досрочная волна. Вариант 2
Образование водорода происходит при взаимодействии
1) ) и
2) и
3) и
4) и
Источник: ЕГЭ по химии 24.04.2014. Досрочная волна. Вариант 3
Какие две кислоты могут реагировать друг с другом?
Водород не выделяется при взаимодействии металлов с
1) муравьиной кислотой
2) разбавленной серной кислотой
3) концентрированной серной кислотой
4) соляной кислотой
В пробирку с разбавленным раствором вещества Х добавили твёрдое вещество Y. В результате реакции наблюдали выделение бесцветного газа.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1)
2)
3)
4) (разб.)
5) (разб.)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
В двух пробирках находился разбавленный раствор серной кислоты. В первую пробирку добавили твёрдое простое вещество Х, а во вторую – раствор вещества Y. В обеих пробирках выделился газ. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1)
2)
3)
4)
5)
Запишите в таблицу номера выбранных веществ под соответствующими буквами
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
В двух химических стаканах находился порошок сульфида алюминия. В первый стакан добавили избыток раствора вещества Х, а во второй – избыток раствора вещества Y. В первом стакане порошок полностью растворился без выделения газа, а во втором порошок тоже растворился, но с образованием газа. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1)
2)
3)
4)
5)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Задания Д8 № 412
С разбавленной серной кислотой взаимодействует
1) серебро
2) магний
3) ртуть
4) кремний
Всего: 35 1–20 | 21–35
в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 35 1–20 | 21–35
Добавить в вариант
Какая кислота при нагревании легко превращается в ангидрид?
1) H3PO4
2) HNO3
3) H2SiO3
4) CH3COOH
При комнатной температуре концентрированная серная кислота реагирует с каждым из двух веществ:
1) алюминием и хлоридом натрия
2) оксидом кремния и гидроксидом натрия
3) магнием и карбонатом калия
4) железом и оксидом углерода(IV)
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 1
Превращение осуществляется при взаимодействии с
1)
2)
3)
4)
Какое вещество реагирует с разбавленным раствором с выделением водорода?
1)
2)
3)
4)
Соляная кислота реагирует с каждым из двух веществ:
1) и
2) и
3) и
4) и
Уксусная кислота реагирует с каждым из двух веществ:
1) и
2) и
3) и
4) и
Концентрированная серная кислота при обычных условиях взаимодействует с:
1) железом
2) алюминием
3) цинком
4) оксидом кремния(IV)
5) гидроксидом меди(II)
Запишите номера выбранных ответов.
Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Источник: СтатГрад: Тренировочная работа 06.02.2023. Вариант ХИ2210301.
И разбавленная, и концентрированная серная кислота при комнатной температуре реагирует с
1) железом
2) медью
3) карбонатом кальция
4) хлоридом натрия
Фосфорная кислота реагирует в водном растворе с каждым из двух веществ
1) Са и Са(ОН)2
2) Сu и СuСl2
3) NaOH и NaNO3
4) SO2 и K2SO3
Концентрированный раствор серной кислоты реагирует с каждым веществом пары
1) Au и BaCl2
2) NaOH и CO2
3) Ca(OH)2 и P2O5
4) S и FeO
С уксусной кислотой реагирует
1)
2)
3)
4)
Разбавленная соляная кислота реагирует с каждым из двух веществ
1) и
2) и
3) и
4) и
Серная кислота реагирует с каждым из двух веществ:
1) и
2) и
3) и
4) и
Разбавленная серная кислота при обычных условиях взаимодействует с:
1) серой
2) алюминием
3) медью
4) оксидом кремния(IV)
5) гидроксидом цинка
Запишите номера выбранных ответов.
Всего: 35 1–20 | 21–35
Перед изучением этого раздела рекомендую прочитать следующую статью:
Классификация неорганических веществ
Кислоты – сложные вещества, которые при взаимодействии с водой образуют в качестве катионов только ионы Н+ (или Н3О+).
По растворимости в воде кислоты можно поделить на растворимые и нерастворимые. Некоторые кислоты самопроизвольно разлагаются и в водном растворе практически не существуют (неустойчивые). Подробно про классификацию кислот можно прочитать здесь.
Получение кислот
1. Взаимодействие кислотных оксидов с водой. При этом с водой реагируют при обычных условиях только те оксиды, которым соответствует кислородсодержащая растворимая кислота.
кислотный оксид + вода = кислота
Например, оксид серы (VI) реагирует с водой с образованием серной кислоты:
SO3 + H2O → H2SO4
При этом оксид кремния (IV) с водой не реагирует:
SiO2 + H2O ≠
2. Взаимодействие неметаллов с водородом. Таким образом получают только бескислородные кислоты.
Неметалл + водород = бескислородная кислота
Например, хлор реагирует с водородом:
H20 + Cl20 → 2H+Cl—
3. Электролиз растворов солей. Как правило, для получения кислот электролизу подвергают растворы солей, образованных кислотным остатком кислородсодержащих кислот. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например, электролиз раствора сульфата меди (II):
2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2
4. Кислоты образуются при взаимодействии других кислот с солями. При этом более сильная кислота вытесняет менее сильную.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
CaCO3 + H2SO4 → CaSO4 + H2O + CO2
5. Кислоты можно получить окислением оксидов, других кислот и неметаллов в водном растворе кислородом или другими окислителями.
Например, концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
P + 5HNO3 → H3PO4 + 5NO2 + H2O
Химические свойства кислот
1. В водных растворах кислоты диссоциируют на катионы водорода Н+ и анионы кислотных остатков. При этом сильные кислоты диссоциируют почти полностью, а слабые кислоты диссоциируют частично.
Например, соляная кислота диссоциирует почти полностью:
HCl → H+ + Cl–
Если говорить точнее, происходит протолиз воды, и в растворе образуются ионы гидроксония:
HCl + H2O → H3O+ + Cl–
Многоосновные кислоты диссоциируют cтупенчато.
Например, сернистая кислота диссоциирует в две ступени:
H2SO3 ↔ H+ + HSO3–
HSO3– ↔ H+ + SO32–
2. Кислоты изменяют окраску индикатора. Водный раствор кислот окрашивает лакмус в красный цвет, метилоранж в красный цвет. Фенолфталеин не изменяет окраску в присутствии кислот.
3. Кислоты реагируют с основаниями и основными оксидами.
С нерастворимыми основаниями и соответствующими им оксидами взаимодействуют только растворимые кислоты.
нерастворимое основание + растворимая кислота = соль + вода
основный оксид + растворимая кислота = соль + вода
Например, гидроксид меди (II) взаимодействует с растворимой бромоводородной кислотой:
Cu(OH)2 + 2HBr → CuBr2 + 2H2O
При этом гидроксид меди (II) не взаимодействует с нерастворимой кремниевой кислотой.
Cu(OH)2 + H2SiO3 ≠
С сильными основаниями (щелочами) и соответствующими им оксидами реагируют любые кислотами.
Щёлочи взаимодействуют с любыми кислотами — и сильными, и слабыми. При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации. Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
Например, гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
NaOH + H3PO4 → NaH2PO4 + H2O
При мольном соотношении количества щелочи и кислоты 1:2 образуются гидрофосфаты:
2NaOH + H3PO4 → Na2HPO4 + 2H2O
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
3NaOH + H3PO4 → Na3PO4 + 3H2O
4. Растворимые кислоты взаимодействуют с амфотерными оксидами и гидроксидами.
Растворимая кислота + амфотерный оксид = соль + вода
Растворимая кислота + амфотерный гидроксид = соль + вода
Например, уксусная кислота взаимодействует с гидроксидом алюминия:
3CH3COOH + Al(OH)3 → (CH3COO)3Al + 3H2O
5. Некоторые кислоты являются сильными восстановителями. Восстановителями являются кислоты, образованные неметаллами в минимальной или промежуточной степени окисления, которые могут повысить свою степень окисления (йодоводород HI, сернистая кислота H2SO3 и др.).
Например, йодоводород можно окислить хлоридом меди (II):
4HI— + 2Cu+2 Cl2 → 4HCl + 2Cu+I + I20
6. Кислоты взаимодействуют с солями.
Кислоты реагируют с растворимыми солями только при условии, что в продуктах реакции присутствует газ, вода, осадок или другой слабый электролит. Такие реакции протекают по механизму ионного обмена.
Кислота1 + растворимая соль1 = соль2 + кислота2/оксид + вода
Например, соляная кислота взаимодействует с нитратом серебра в растворе:
Ag+NO3— + H+Cl— → Ag+Cl—↓ + H+NO3—
Кислоты реагируют и с нерастворимыми солями. При этом более сильные кислоты вытесняют менее сильные кислоты из солей.
Например, карбонат кальция (соль угольной кислоты), реагирует с соляной кислотой (более сильной, чем угольная):
CaCO3 + 2HCl → CaCl2 + H2O + CO2
7. Кислоты взаимодействуют с кислыми и основными солями. При этом более сильные кислоты вытесняют менее сильные из кислых солей. Либо кислые соли реагируют с кислотами с образованием более кислых солей.
кислая соль1 + кислота1 = средняя соль2 + кислота2/оксид + вода
Например, гидрокарбонат калия реагирует с соляной кислотой с образованием хлорида калия, углекислого газа и воды:
KHCO3 + HCl → KCl + CO2 + H2O
Ещё пример: гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия:
H3PO4 + K2HPO4 → 2KH2PO4
При взаимодействии основных солей с кислотами образуются средние соли. Более сильные кислоты также вытесняют менее сильные из солей.
Например, гидроксокарбонат меди (II) растворяется в серной кислоте:
2H2SO4 + (CuOH)2CO3 → 2CuSO4 + 3H2O + CO2
Основные соли могут взаимодействовать с собственными кислотами. При этом вытеснения кислоты из соли не происходит, а просто образуются более средние соли.
Например, гидроксохлорид алюминия взаимодействует с соляной кислотой:
Al(OH)Cl2 + HCl → AlCl3 + H2O
8. Кислоты взаимодействуют с металлами.
При этом протекает окислительно-восстановительная реакция. Однако минеральные кислоты и кислоты-окислители взаимодействуют по-разному.
К минеральным кислотам относятся соляная кислота HCl, разбавленная серная кислота H2SO4, фосфорная кислота H3PO4, плавиковая кислота HF, бромоводородная HBr и йодоводородная кислоты HI и др.
Такие кислоты взаимодействуют только с металлами, расположенными в ряду активности до водорода:
При взаимодействии минеральных кислот с металлами образуются соль и водород:
минеральная кислота + металл = соль + H2↑
Например, железо взаимодействует с соляной кислотой с образованием хлорида железа (II):
Fe + 2H+Cl → Fe+2Cl2 + H20
Кислоты-окислители (азотная кислота HNO3 любой концентрации и серная концентрированная кислота H2SO4(конц)) при взаимодействии с металлами водород не образуют, т.к. окислителем выступает не водород, а азот или сера. Продукты восстановления азотной или серной кислот бывают различными. Определять их лучше по специальным правилам. Эти правила подробно разобраны в статье Окислительно-восстановительные реакции. Я настоятельно рекомендую выучить их наизусть.
9. Некоторые кислоты разлагаются при нагревании.
Угольная H2CO3, сернистая H2SO3 и азотистая HNO2 кислоты разлагаются самопроизвольно, без нагревания:
H2CO3 → H2O + CO2
H2SO3 → H2O + SO2
2HNO2 → NO + H2O + NO2
Кремниевая H2SiO3, йодоводородная HI кислоты разлагаются при нагревании:
H2SiO3 → H2O + SiO2
2HI → H2 + I2
Азотная кислота HNO3 разлагается при нагревании или на свету:
4HNO3 → O2 + 2H2O + 4NO2
Химические свойства кислот
1. Сила кислот уменьшается в ряду:
HI → HClO4 → HBr → HCl → H2SO4 → H2SeO4 → HNO3 → HClO3 → HIO3 →
H2SO3 → HClO2 → H3PO4 → HF → HNO2 → CH3COOH → H2CO3 → H2S → H2SiO3.
Некоторые реакции, подтверждающие ряд кислот:
2HCl + Na2CO3 → 2NaCl + CO2 + H2O т.е. H2CO3 слабее, чем HCl
K2CO3 + SO2 → K2SO3 + CO2 т.е. H2CO3 слабее, чем H2SO3
CH3COOH + NaHCO3 → CH3COONa + CO2 + H2O т.е. H2CO3 слабее, чем CH3COOH
Na2SiO3 + CO2 + H2O → H2SiO3 + Na2CO3 т.е. H2SiO3 слабее, чем H2CO3
3H2SO4 + 2K3PO4 → 3K2SO4 + 2H3PO4 т.е. H3PO4 слабее, чем H2SO4
Во всех этих реакциях образуются либо осадок, либо (более) слабая кислота.
Если осадка не образуется и обе кислоты сильные (т.е. кислота, которая вступила в реакцию, и кислота, которая образовалась в результате реакции), то в растворе такие реакции не идут. Подобные реакции возможны только в случае образования сильных летучих кислот (HNO3 и HCl) в реакциях с твердыми солями, а не растворами:
NaCl(тв.) + H2SO4(к) → NHSO4 + HCl
NaNO3(тв.) + H2SO4(к) → NaHSO4 + HNO3
Аналогичным образом можно получить и слабую плавиковую кислоту:
KF(тв.) + H2SO4(к) → KHSO4 + HF
HBr и HI (они также являются летучими) таким образом получать не удается, так как они окисляются концентрированной серной кислотой:
8KI + 5H2SO4(конц.) → 4I2 + H2S + 4K2SO4 + 4H2O
2KBr + 2H2SO4(конц.) → Br2 + SO2 + K2SO4 + 2H2O
2. Летучесть кислот
Следующие кислоты являются летучими: HNO3, HF, HCl, HBr, HI, H2S, H2Se.
Остальные кислоты являются нелетучими.
3. Сила кислот (способность к диссоциации)
Сильные: HNO3, H2SO4, HCl, HBr, HI, HClO4, HClO3.
Слабые (все остальные): HF, H2CO3, H2SO3, HNO2, H3PO4, H2S, H2SiO3, все органические кислоты и другие.
4. Растворимость кислот в воде
Нерастворимыми кислотами являются: H2SiO3 и все высшие жирные кислоты, т.е. кислоты, содержащие 10 атомов углерода и больше. Например, C17H35COOH (стеариновая кислота).
5. Термическое разложение кислот
При нагревании разлагаются следующие кислоты:
H2CO3 → CO2 + H2O
H2SO3 → SO2 + H2O
4HNO3 → 4NO2 + O2 + 2H2O
H2SiO3 → SiO2 + H2O
Неустойчивыми являются H2CO3 и H2SO3.
6. Взаимодействие с основаниями (реакция нейтрализации)
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
2HCl + Mg(OH)2 → MgCl2 + 2H2O
Эти реакции идут, только если образующаяся соль существует в водном растворе, т.е. в таблице растворимости не должен стоять прочерк:
H2S + Al(OH)3 → реакция не идет, т.к. Al2S3 в водной среде разлагается (по сути, идет обратная реакция)
H2S + Cr(OH)3 → реакция не идет по той же причине.
Особенность кремниевой кислоты: из оснований она реагирует только с щелочами:
H2SiO3 + 2NaOH → Na2SiO3 + 2H2O
H2SiO3 + Cu(OH)2 → реакция не идет
H2SiO3 + Al(OH)3 → реакция не идет.
7. Взаимодействие с солями
Реакции с солями идут, если выделяется газ, выпадает осадок или образуется более слабая кислота:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
AgNO3 + HCl → AgCl + HNO3
K3PO4 + HCl → NaCl + H3PO4 (слабая кислота)
8. Взаимодействие кислот-неокислителей с металлами
Металлы, стоящие в ряду активности металлов до водорода, взаимодействуют с кислотами-неокислителями с выделением водорода:
H2SO4(р) + Zn → ZnSO4 + H2
6HCl + 2Fe → 2FeCl3 + 3H2
Cu + HCl → реакция не идет.
9. Взаимодействие кислот-окислителей (H2SO4(к), HNO3(к) и HNO3(р)) с простыми и сложными веществами
9.1) Серная кислота
9.2) Азотная кислота
Тематический тест на характерные химические свойства кислот.
Задание №1
Из приведенного списка веществ выберите те, которые относятся к кислотам. Количество верных ответов может оказаться любым
- 1. NaH
- 2. HCl
- 3. HNO3
- 4. H2O
- 5. H2SO4
Решение
Ответ: 235
Задание №2
Из приведенного списка веществ выберите те, которые относятся к кислотам. Количество верных ответов может оказаться любым
- 1. HF
- 2. KHS
- 3. LiCl
- 4. HCl
- 5. H3PO4
Решение
Ответ: 145
Задание №3
Из приведенного списка веществ выберите те, которые относятся к кислотам. Количество верных ответов может оказаться любым
- 1. CO2
- 2. NaOH
- 3. HClO
- 4. Zn(OH)Cl
- 5. HMnO4
Решение
Ответ: 35
Задание №4
Из приведенного списка веществ выберите те, которые относятся к кислотам. Количество верных ответов может оказаться любым
- 1. HI
- 2. H2SiO3
- 3. SO3
- 4. NaHCO3
- 5. H2CO3
Решение
Ответ: 125
Задание №5
Из приведенного списка веществ выберите те, которые относятся к кислотам. Количество верных ответов может оказаться любым
- 1. H2
- 2. SiH4
- 3. H2S
- 4. H2SO3
- 5. HI
Решение
Ответ: 345
Задание №6
Из приведенного списка кислот выберите те, которые относятся к неустойчивым. Количество верных ответов может оказаться любым
- 1. HNO3
- 2. H2S
- 3. HCl
- 4. H2CO3
- 5. HClO4
Решение
Ответ: 4
Задание №7
Из приведенного списка кислот выберите те, которые относятся к неустойчивым. Количество верных ответов может оказаться любым
- 1. H3PO4
- 2. HI
- 3. H2SO3
- 4. H2CO3
- 5. HNO3
Решение
Ответ: 34
Задание №8
Из приведенного списка кислот выберите те, которые относятся к одноосновным. Количество верных ответов может оказаться любым
- 1. H2SO4
- 2. H2SO3
- 3. H2SiO3
- 4. H2CO3
- 5. HNO3
Решение
Ответ: 5
Задание №9
Из приведенного списка кислот выберите те, которые относятся к двухосновным. Количество верных ответов может оказаться любым
- 1. H2SO4
- 2. H3PO4
- 3. HPO3
- 4. HNO3
- 5. H2CO3
Решение
Ответ: 15
Задание №10
Из приведенного списка кислот выберите те, которые относятся к трехосновным. Количество верных ответов может оказаться любым
- 1. H2SiO3
- 2. H3PO4
- 3. HPO3
- 4. HNO2
- 5. H2CO3
Решение
Ответ: 2
[adsp-pro-3]
Задание №11
Из приведенного списка кислот выберите те, которые относятся к кислотам-окислителям. Количество верных ответов может оказаться любым
- 1. H2SO4(конц.)
- 2. H3PO4(конц.)
- 3. HPO3
- 4. HNO3
- 5. H2CO3
Решение
Ответ: 14
Задание №12
Из приведенного списка кислот выберите те, которые не относятся к кислотам-окислителям. Количество верных ответов может оказаться любым
- 1. H2SO4(конц)
- 2. HF(конц)
- 3. H2SO3
- 4. HNO3
- 5. H2CO3
Решение
Ответ: 235
Задание №13
Из приведенного списка кислот выберите те, которые относятся к кислотам-окислителям. Количество верных ответов может оказаться любым
- 1. H2SO4(разб.)
- 2. H2S
- 3. HBr(конц.)
- 4. HNO3(разб.)
- 5. HBr(разб.)
Решение
Ответ: 4
Задание №14
Из приведенного списка кислот выберите те, которые не относятся к кислотам-окислителям. Количество верных ответов может оказаться любым
- 1. HI(конц.)
- 2. HCl(конц.)
- 3. HNO3
- 4. H2SiO3
- 5. H2CO3
Решение
Ответ: 1245
Задание №15
Из приведенного списка кислот выберите те, которые относятся к окислителям. Количество верных ответов может оказаться любым
- 1. H2SO4(конц.)
- 2. H3PO4(конц.)
- 3. HNO3(разб.)
- 4. HNO3(конц.)
- 5. H2SO4(разб.)
Решение
Ответ: 134
Задание №16
Из приведенного списка кислот выберите те, которые относятся к сильным. Количество верных ответов может оказаться любым
- 1. H2SO4
- 2. H3PO4
- 3. H3PO3
- 4. HNO3
- 5. H2CO3
Решение
Ответ: 14
Задание №17
Из приведенного списка кислот выберите те, которые не относятся к сильным. Количество верных ответов может оказаться любым
- 1. H2SO4
- 2. H2SO3
- 3. H2SiO3
- 4. H2CO3
- 5. HNO3
Решение
Ответ: 234
Задание №18
Из приведенного списка кислот выберите те, которые относятся к слабым. Количество верных ответов может оказаться любым
- 1. HNO3
- 2. H2S
- 3. HCl
- 4. H2CO3
- 5. HClO4
Решение
Ответ: 24
Задание №19
Из приведенного списка кислот выберите те, которые не относятся к слабым. Количество верных ответов может оказаться любым
- 1. H2SiO3
- 2. HI
- 3. H2SO3
- 4. HNO2
- 5. HNO3
Решение
Ответ: 25
Задание №20
Из приведенного списка кислот выберите те, которые относятся к сильным. Количество верных ответов может оказаться любым
- 1. HF
- 2. HI
- 3. H2SO3
- 4. HCl
- 5. HBr
Решение
Ответ: 245
[adsp-pro-3]
Задание №21
Из приведенного списка кислот выберите те, которые могут диссоциировать ступенчато. Количество верных ответов может оказаться любым
- 1. HClO3
- 2. HI
- 3. H2SO3
- 4. HCl
- 5. HBr
Решение
Ответ: 3
Задание №22
Из приведенного списка кислот выберите те, которые не могут диссоциировать ступенчато. Количество верных ответов может оказаться любым
- 1. HNO3
- 2. H2SO4
- 3. H2SO3
- 4. H3PO4
- 5. HF
Решение
Ответ: 15
Задание №23
Из приведенного списка кислот выберите те, которые могут диссоциировать ступенчато. Количество верных ответов может оказаться любым
- 1. H2S
- 2. HI
- 3. H2SO3
- 4. HNO2
- 5. HClO4
Решение
Ответ: 13
Задание №24
Из приведенного списка кислот выберите те, которые не могут диссоциировать ступенчато. Количество верных ответов может оказаться любым
- 1. HIO3
- 2. HI
- 3. H2CO3
- 4. HCl
- 5. H2CrO4
Решение
Ответ: 124
Задание №25
Из приведенного списка кислот выберите те, которые могут реагировать с медью. Количество верных ответов может оказаться любым
- 1. HNO3
- 2. HI
- 3. H2SO3
- 4. HCl
- 5. HBr
Решение
Ответ: 1
Задание №26
Из приведенного списка кислот выберите те, которые не могут реагировать с медью. Количество верных ответов может оказаться любым
- 1. HNO3
- 2. H2S
- 3. HCl
- 4. H2CO3
- 5. HBr
Решение
Ответ: 2345
Задание №27
Из приведенного списка кислот выберите те, которые могут реагировать с серебром. Количество верных ответов может оказаться любым
- 1. H2SO4(конц.)
- 2. H3PO4(конц.)
- 3. HNO3(разб.)
- 4. HNO3(конц.)
- 5. H2SO4(разб.)
Решение
Ответ: 134
Задание №28
Из приведенного списка кислот выберите те, которые не могут реагировать с серебром. Количество верных ответов может оказаться любым
- 1. H2SO4(конц.)
- 2. HF(конц.)
- 3. H2SO3
- 4. HNO3
- 5. H2CO3
Решение
Ответ: 235
Задание №29
Из приведенного списка кислот выберите те, которые могут реагировать с цинком. Количество верных ответов может оказаться любым
- 1. H2SO4
- 2. H2SO3
- 3. H2SiO3
- 4. HClO3
- 5. HNO3
Решение
Ответ: 1245
Задание №30
Из приведенного списка кислот выберите те, которые могут реагировать с железом при обычных условиях. Количество верных ответов может оказаться любым
- 1. H2SO4(конц.)
- 2. HCl(конц.)
- 3. HCl(разб.)
- 4. HNO3(конц.)
- 5. H2SO4(разб.)
Решение
Ответ: 235
[adsp-pro-3]
Задание №31
Из приведенного списка кислот выберите те, которые могут реагировать с железом только при нагревании. Количество верных ответов может оказаться любым
- 1. H2SO4(конц.)
- 2. H3PO4(конц.)
- 3. HBr(разб.)
- 4. HNO3(конц.)
- 5. H2SO4(разб.)
Решение
Ответ: 14
Задание №32
Из приведенного списка кислот выберите те, которые не могут реагировать с хромом при обычных условиях. Количество верных ответов может оказаться любым
- 1. H2SO4(конц.)
- 2. HI(конц.)
- 3. HNO3(разб.)
- 4. HNO3(конц.)
- 5. H2SO4(разб.)
Решение
Ответ: 14
Задание №33
Из приведенного списка кислот выберите те, которые могут реагировать с алюминием только при нагревании. Количество верных ответов может оказаться любым
- 1. H2SO4(конц.)
- 2. HCl(конц.)
- 3. HCl(разб.)
- 4. HNO3(конц.)
- 5. H2SO4(разб.)
Решение
Ответ: 14
Задание №34
Из приведенного соединений выберите те, которые могут реагировать с соляной кислотой. Количество верных ответов может оказаться любым
1) водород
2) азот
3) железо
4) медь
5) оксид алюминия
Решение
Ответ: 35
Задание №35
Из приведенного соединений выберите те, которые могут реагировать с бромоводородной кислотой. Количество верных ответов может оказаться любым
1) иод
2) цинк
3) сера
4) хлор
5) поташ
Решение
Ответ: 245
Задание №36
Из приведенного соединений выберите те, которые могут реагировать с плавиковой кислотой. Количество верных ответов может оказаться любым
1) поваренная соль
2) угарный газ
3) железная окалина
4) песок
5) гашеная известь
Решение
Ответ: 345
Задание №37
Из приведенного соединений выберите те, которые могут реагировать с разбавленной серной кислотой. Количество верных ответов может оказаться любым
1) медь
2) хром
3) хлорид бария
4) хлорид калия
5) карбонат аммония
Решение
Ответ: 235
Задание №38
Из приведенного соединений выберите те, которые могут реагировать с концентрированной серной кислотой при обычных условиях. Количество верных ответов может оказаться любым
1) железо
2) цинк
3) алюминий
4) песок
5) хром
Решение
Ответ: 2
Задание №39
Из приведенного соединений выберите те, которые могут реагировать с фосфорной кислотой. Количество верных ответов может оказаться любым
1) едкий натр
2) сера
3) калий
4) азот
5) хлор
Решение
Ответ: 13
Задание №40
Из приведенного соединений выберите те, которые не могут реагировать с бромоводородной кислотой. Количество верных ответов может оказаться любым
1) марганец
2) магний
3) оксид свинца(II)
4) медь
5) оксид меди(I)
Решение
Ответ: 4
[adsp-pro-3]
Задание №41
Из приведенного соединений выберите те, которые не могут реагировать с угольной кислотой. Количество верных ответов может оказаться любым
1) сульфат калия
2) карбонат натрия
3) гидроксид алюминия
4) гидроксид цезия
5) оксид кальция
Решение
Ответ: 13
Задание №42
Из приведенного соединений выберите те, которые не могут реагировать с сероводородной кислотой. Количество верных ответов может оказаться любым
1) нитрат магния
2) нитрат свинца
3) нитрат серебра
4) хлорид цинка
5) бромид аммония
Решение
Ответ: 145
Задание №43
Из приведенного соединений выберите те, которые могут реагировать с концентрированной азотной кислотой только при нагревании. Количество верных ответов может оказаться любым
1) серебро
2) железо
3) оксид хрома(II)
4) оксид хрома(III)
5) хром
Решение
Ответ: 25
Задание №44
Из приведенного соединений выберите те, которые могут реагировать с концентрированной азотной кислотой. Количество верных ответов может оказаться любым
1) фосфор
2) угарный газ
3) сера
4) сульфат калия
5) магний
Решение
Ответ: 135
Задание №45
Из приведенного соединений выберите те, которые могут реагировать с концентрированной серной кислотой. Количество верных ответов может оказаться любым
1) азот
2) сера
3) медь
4) золото
5) оксид серы(VI)
Решение
Ответ: 23
Задание №46
В заданной схеме превращений
Fe FeSO4
Fe2(SO4)3
веществами X и Y являются соответственно
1) сернистая кислота
2) концентрированная серная кислота
3) сероводородная кислота
4) сера
5) разбавленная серная кислота
Решение
Ответ: 52
Задание №47
В заданной схеме превращений
HBr HCl
AgCl
веществами X и Y являются соответственно
1) серебро
2) хлорид калия
3) соляная кислота
4) нитрат серебра
5) хлор
Решение
Ответ: 54
Задание №48
В заданной схеме превращений
CaF2 HF
CuF2
веществами X и Y, необходимыми для последовательного осуществления превращений, являются соответственно
1) серная кислота
2) хлор
3) плавиковая кислота
4) медь
5) гидроксид меди
Решение
Ответ: 15
Задание №49
В заданной схеме превращений
S H2SO4
BaSO4
веществами X и Y, необходимыми для последовательного осуществления превращений, являются соответственно
1) вода
2) карбонат бария
3) серная кислота
4) азотная кислота конц
5) хлороводородная кислота
Решение
Ответ: 42
Задание №50
В заданной схеме превращений
H2SO4(конц.) H2S
PbS
веществами X и Y, необходимыми для последовательного осуществления превращений, являются соответственно
1) карбонат свинца
2) нитрат свинца
3) магний
4) медь
5) оксид цинка
Решение
Ответ: 32
[adsp-pro-3]
Задание №51
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства. Если никакая из реакций не протекает вставьте в поле ответа знак минус (-).
- 1. HCl + SO2
- 2. HCl + CO
- 3. HCl + NO
- 4. HCl + BeO
- 5. HCl + P2O3
Решение
Ответ: 2HCl + BeO = BeCl2 + H2O
Задание №52
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства. Если никакая из реакций не протекает вставьте в поле ответа знак минус (-).
- 1. HBr + N2O
- 2. HBr + Li2O
- 3. HBr + SiO2
- 4. HBr + NO
- 5. HBr + P2O5
Решение
Ответ: 2HBr + Li2O = 2LiBr + H2O
Задание №53
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства. Если никакая из реакций не протекает вставьте в поле ответа знак минус (-).
- 1. HI + CO
- 2. HI + CO2
- 3. HI + FeO
- 4. HI + B2O3
- 5. HI + SO2
Решение
Ответ: 2HI + FeO = FeI2 + H2O
Задание №54
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства. Если никакая из реакций не протекает вставьте в поле ответа знак минус (-).
- 1. HF + Cl2
- 2. HF + Br2
- 3. HF + I2
- 4. HF + O2
- 5. HF + N2
Решение
Ответ: —
Задание №55
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства.
- 1. HBr + I2
- 2. HBr + Cl2
- 3. HBr + Br2
- 4. HBr + S
- 5. HBr + C
Решение
Ответ: 2HBr + Cl2 = 2HCl + Br2
Задание №56
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства.
- 1. HI + Br2
- 2. HI + H2
- 3. HI + P
- 4. HI + C
- 5. HI + N2
Решение
Ответ: 2HI + Br2 = 2HBr + I2
Задание №57
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства.
1) разбавленная серная кислота + железо
2) концентрированная серная кислота + азот
3) разбавленная серная кислота + медь
4) концентрированная серная кислота + золото
5) разбавленная серная кислота + графит
Решение
Ответ: H2SO4 + Fe = FeSO4 + H2
Задание №58
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие при обычных условиях. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства.
- 1. HNO3(конц.) + Al
- 2. HNO3(разб.) + H2
- 3. HNO3(конц.) + P
- 4. HNO3(разб.) + O2
- 5. HNO3(конц.) + N2
Решение
Ответ: 5HNO3 + P = H3PO4 + 5NO2 + H2O
Задание №59
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства. Если никакая реакция не протекает введите в поле ответа знак минус (-).
1) концентрированная серная кислота + золото
2) разбавленная серная кислота + серебро
3) концентрированная серная кислота + хром
4) разбавленная серная кислота + медь
5) концентрированная серная кислота + N2
Решение
Ответ: —
Задание №60
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства. Если никакая реакция не протекает введите в поле ответа знак минус (-).
- 1. HCl(конц.) + Cu
- 2. HBr(разб.) + Ag
- 3. HI(конц.) + P
- 4. H2SO4(разб.) + Al
- 5. H3PO4(конц.) + Cu
Решение
Ответ: 3H2SO4 + 2Al = Al2(SO4)3 + 3H2
[adsp-pro-3]
Задание №61
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства. Если никакая реакция не протекает введите в поле ответа знак минус (-).
- 1. H2SiO3 + Si
- 2. H3PO4 + P
- 3. HCl + Cl2
- 4. HBr + Br2
- 5. HF + O2
Решение
Ответ: —
Задание №62
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства. Если никакая реакция не протекает введите в поле ответа знак минус (-).
- 1. HNO3 (конц.) + S
- 2. H2SO4 (конц.) + N2
- 3. H3PO4 (конц.) + Cl2
- 4. HI + CO
- 5. HBr + NO
Решение
Ответ: 6HNO3 + S = H2SO4 + 6NO2 + 2H2O
Задание №63
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства. Если никакая реакция не протекает введите в поле ответа знак минус (-).
- 1. H3PO4 + SO3
- 2. H2SO4 + Al(OH)3
- 3. HCl + SO2(OH)2
- 4. H2SiO3 + SO2
- 5. H3PO4 + CO2
Решение
Ответ: 3H2SO4 + 2Al(OH)3 = Al2(SO4)3 + 6H2O
Задание №64
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства. Если никакая реакция не протекает введите в поле ответа знак минус (-).
1) соляная кислота + кремнезем
2) угольная кислота + пищевая сода
3) фосфорная кислота + медь
4) серная кислота + сернистый газ
5) плавиковая кислота + веселящий газ
Решение
Ответ: —
Задание №65
Из приведенных пар веществ выберите ту, в которой возможно химическое взаимодействие. В ответ запишите уравнение реакции, используя в качестве разделителя левой и правой частей знак равенства. Если никакая реакция не протекает введите в поле ответа знак минус (-).
1) азотная кислота + платина
2) бромоводородная кислота + йод
3) сернистая кислота + углекислый газ
4) хлороводородная кислота + магний
5) фосфорная кислота + сера
Решение
Ответ: Mg + 2HCl = MgCl2 + H2
Задание №66
Запишите уравнение реакции, протекающей при взаимодействии соляной кислоты с оксидом алюминия
Решение
Ответ: 6HCl + Al2O3 = 2AlCl3 + 3H2O
Задание №67
Запишите уравнение реакции, протекающей при взаимодействии серной кислоты с гидроксидом железа (III)
Решение
Ответ: 3H2SO4 + 2Fe(OH)3 = Fe2(SO4)3 + 6H2O
Задание №68
Запишите уравнение реакции, протекающей при взаимодействии азотной кислоты с оксидом кальция
Решение
Ответ: 2HNO3 + CaO = Ca(NO3)2 + H2O
Задание №69
Запишите уравнение реакции, протекающей при взаимодействии иодоводородной кислоты с гидроксидом бария
Решение
Ответ: 2HI + Ba(OH)2 = BaI2 + 2H2O
Задание №70
Запишите уравнение реакции, протекающей при взаимодействии бромоводородной кислоты с хлором
Решение
Ответ: 2HBr + Cl2 = 2HCl + Br2
[adsp-pro-3]
Задание №71
Запишите уравнение реакции, протекающей при взаимодействии иодоводородной кислоты с бромом
Решение
Ответ: 2HI + Br2 = 2HBr + I2
Задание №72
Запишите уравнение реакции, протекающей при взаимодействии концентрированной серной кислоты с углеродом
Решение
Ответ: 2H2SO4 + C = CO2 + 2SO2 + 2H2O
Задание №73
Запишите уравнение реакции, протекающей при взаимодействии концентрированной азотной кислоты с графитом
Решение
Ответ: 4HNO3 + С = СO2 + 4NO2 + 2H2O
Задание №74
Запишите уравнение реакции, протекающей при взаимодействии концентрированной серной кислоты с серой
Решение
Ответ: 2H2SO4 + S = 3SO2 + 2H2O
Задание №75
Запишите уравнение реакции, протекающей при взаимодействии концентрированной азотной кислоты с серой
Решение
Ответ: 6HNO3 + S = H2SO4 + 6NO2 + 2H2O
Задание №76
Запишите уравнение реакции, протекающей при взаимодействии концентрированной серной кислоты с фосфором
Решение
Ответ: 5H2SO4 + 2P = 2H3PO4 + 5SO2 + 2H2O
Задание №77
Запишите уравнение реакции, протекающей при взаимодействии концентрированной азотной кислоты с фосфором
Решение
Ответ: 5HNO3 + P = H3PO4 + 5NO2 + H2O
Задание №78
Запишите уравнение реакции, протекающей при взаимодействии горячей концентрированной серной кислоты с железом
Решение
Ответ: 6H2SO4 + 2Fe = Fe2(SO4)3 + 3SO2 + 6H2O
Задание №79
Запишите уравнение реакции, протекающей при взаимодействии концентрированной серной кислоты с медью
Решение
Ответ: 2H2SO4 + Cu = CuSO4 + SO2 + 2H2O
Задание №80
Запишите уравнение реакции, протекающей при взаимодействии разбавленной серной кислоты с железом
Решение
Ответ: H2SO4 + Fe = FeSO4 + H2
[adsp-pro-3]
Задание №81
Запишите уравнение реакции, протекающей при взаимодействии концентрированной азотной кислоты с медью
Решение
Ответ: 4HNO3 + Cu = Cu(NO3)2 + 2NO2 + 2H2O
Задание №82
Запишите уравнение реакции, протекающей при взаимодействии разбавленной азотной кислоты с медью
Решение
Ответ: 8HNO3 + 3Cu = 3Cu(NO3)2 + 2NO + 4H2O
Задание №83
Запишите уравнение реакции, протекающей при взаимодействии сильно разбавленной азотной кислоты с магнием
Решение
Ответ: 10HNO3 + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
Задание №84
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) HBr Б) HF В) H2SO4(конц.) |
1) S, KOH, Zn 2) NaOH, Cl2, Fe 3) KOH, H2, Zn 4) CsOH, Al2O3, SiO2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 241
Задание №85
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) HF Б) HI В) HNO3(конц.) |
1) RbOH, Al(OH)3, Br2 2) SrO, ZnO, CuS 3) KOH, SiO2, Ca(OH)2 4) AgNO3, NaOH, BaCl2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 312
Задание №86
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) кремнезем Б) серная кислота (конц.) В) сероводородная кислота |
1) гидрид лития, кислород, азот 2) хлор, бром, гидроксид натрия 3) едкое кали, фтороводород, гашеная известь 4) гидроксид цинка, фосфор, оксид натрия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 342
Задание №87
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) соляная кислота Б) азотная кислота (разб.) В) плавиковая кислота |
1) оксид алюминия, оксид лития, песок 2) нитрат свинца, поташ, нитрат серебра 3) сода, цинк, медь 4) сернистый газ, вода, сера |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 231
Задание №88
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
|
А) HNO3(конц.) Б) H2S В) HCl |
1) NaHS, Cu(OH)2, CuSO4 2) NaOH, CsOH, AgNO3 3) MnO, Mg(OH)2, SiO2 4) KOH, Al2O3, P |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 422
Задание №89
Вычислите объем газа, который выделится при взаимодействии 15 г цинкового порошка и 20 г 18,25% раствора соляной кислоты. Ответ приведите в литрах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 1,12
Задание №90
Определите массу осадка, оставшегося после смешивания 100 мл 10% раствора гидроксида натрия (плотность 1,1 г/мл) и 30 г кремниевой кислоты. Ответ приведите в граммах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 19,28
[adsp-pro-3]
Задание №91
Рассчитайте массу газа, выделившегося при взаимодействии 15,5 г фосфора и избытка горячего концентрированного раствора азотной кислоты. Ответ приведите в граммах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 115
Задание №92
Вычислите массовую долю соли в растворе, полученном при смешивании 100 мл 10% раствора едкого натра (плотность 1,1 г/мл) и 100 мл 30% раствора бромоводородной кислоты (плотность 1,25 г/мл). Ответ приведите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 12,05
Задание №93
Определите объем 10% раствора HNO3 (плотность 1,05 г/см3), необходимого для полной нейтрализации смеси 10 мл 20% раствора гидроксида натрия (плотность 1,2 г/см3) и 400 г 0,5% раствора гашеной извести. Ответ приведите в миллилитрах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 68,4
Задание №94
Рассчитайте объем 80% раствора азотной кислоты (плотность 1,4 г/см3), необходимого для растворения навески смеси серы и фосфора массой 6,3 г. Массовая доля фосфора в смеси 49,2%. Ответ приведите в миллилитрах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 62
Задание №95
Вычислите массу 96% раствора серной кислоты, необходимой для полного растворения 13,2 г медного порошка, содержащего 3% инертных примесей по массе. Ответ приведите в граммах и округлите до десятых. В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 40,8
Пояснение:
Запишем уравнение реакции:
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
Масса примесей:
m(примесей) = m(Cu с прим.) · ω(примесей) / 100% = 13,2 г · 0,03 = 0,396 г
m(Cu) = m(Cu с прим.) — m(примесей) = 13,2 г — 0,396 г = 12, 804 г
ν(Cu) = m(Cu)/ M(Cu) = 12,804 г / 64 г/моль = 0,2000625 моль
Из уравнения реакции следует, что:
ν(H2SO4) = 2·ν(Cu) = 2 · 0,2 моль = 0,400125 моль
m(H2SO4) = ν(H2SO4) · M(H2SO4) = 0,400125 моль · 98 г/моль = 39,21225 г
mр—ра(H2SO4) = 100% · m(H2SO4) / ω(H2SO4) = 39,21225 г / 0,96 = 40,8 г
Задание №96
Навеску смеси железных и медных опилок массой 1,2 г обработали избытком соляной кислоты. При этом выделилось 224 мл газа. Вычислите объем газа, который выделится при обработке такой же навески избытком горячего 70% раствора азотной кислоты. Ответ приведите в литрах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 1,12
Задание №97
Раствор массой 200 г, содержащий соляную и бромоводородную кислоту, может прореагировать с 42 г пищевой соды. Такой же по массе раствор может прореагировать с 2,24 л хлора. Определите суммарную массовую долю кислот в растворе. Ответ приведите в процентах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 13,6
Задание №98
Навеску кремниевой кислоты массой 39 г добавили к 200 г 40% раствора едкого натра. Далее к полученному раствору добавили 146 г 30% раствора соляной кислоты. Определите массовую долю хлорида натрия в полученном растворе. Ответ приведите в процентах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 18,6
Задание №99
Определите массовую долю азотной кислоты в растворе, если известно, что 300 г такого раствора могут прореагировать с 24 г медного порошка, а в ходе реакции наблюдается выделение бесцветного газа. Ответ приведите в процентах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 21
Задание №100
Рассчитайте массовую долю соли в растворе, полученном при полной нейтрализации 100 мл 20% раствора серной кислоты (плотность 1,15 г/см3) необходимым количеством поташа. Ответ приведите в процентах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Решение
Ответ: 29,8
[adsp-pro-10]
Физические свойства кислот
Твердые кислоты: H3PO4 (ортофосфорная кислота), H3BO3 (борная кислота), HIO4 (йодная кислота).
Жидкие кислоты: H2SO4, HNO3.
Большинство кислот растворяются в воде. Некоторые кислоты являются растворами газов в воде, например, HCl и H2S).
Химические свойства кислот
1. Кислоты взаимодействуют с основаниями с образованием соли и воды (реакция нейтрализации).
Если в реакциях нейтрализации участвуют многоосновные кислоты или многокислотные основания, то продуктами реакции могут быть не только средние соли.
2. Кислоты взаимодействуют с основными оксидами с образованием соли и воды.
Кислота + Основный оксид = соль + H2O
2HCl + CaO = CaCl2 + H2O
3. Кислоты взаимодействуют с амфотерными оксидами с образованием соли и воды.
Кислота + амфотерный оксид = соль + H2O
2HNO3 + ZnO = Zn(NO3)2 + H2O
4. Кислоты взаимодействуют с амфотерными гидроксидами с образованием соли и воды.
Кислота + амфотерный гидроксид = соль + H2O
3HCl + Cr(OH)3 = CrCl3 + 3H2O
5. Кислоты взаимодействуют с некоторыми средними солями с образованием новой соли новой кислоты.
Эти реакции возможно в том случае если в результате их образуется слабая кислота (в виде газа) или выпадает осадок (нерастворимая соль)
Кислота + соль = соль1 + Кислота1
HCl + AgNO3 = AgCl ↓+ HNO3
2CH3COOH + Na2CO3 = 2CH3COONa + CO2 ↑ + H2O
6. Кислоты взаимодействуют с металлами. Характер продуктов этих реакций зависит от природы и концентрации кислоты и от активности металла.
Активность металла определяется его положением в электрохимическом ряду напряжений.
Взаимодействие металлов с серной концентрированной кислотой:
|
Металлы |
Активные |
Средней активности |
Неактивные |
|
H2SO4 (конц.) |
Соль + H2O + H2S 8Na + 5H2SO4 = 4Na2SO4 + H2S +4H2O |
Соль + H2O + S 4H2SO4 + 3Zn = 3ZnSO4+4H2O+S |
Cоль + H2O + SO2 2H2SO4 + 2Ag = Ag2SO4+2H2O+SO2 |
Получение кислот
1. Бескислородоные кислоты получают путем синтеза водородных соединений неметаллов из простых веществ и последующего растворения полученных продуктов в воде.
Неметалл + H2 = водородное соединение неметалла;
Неметаллы: F2, Cl2, Br2, I2, S, Se
2. Оксокислоты получают взаимодействием кислотных оксидов с водой.
Кислотный оксид + H2O = оксокислота
SO3 + H2O = H2SO4
3. Большинство кислот можно получить взаимодействием солей с кислотами.
Соль + кислота = Соль1 + кислота1
2NaCl(тв.) + H2SO4(конц.) = 2HCl + Na2SO4
Основания
Физические свойства оснований
Все неорганические основания —твердые вещества, кроме NH4OH
Основание имеют разный цвет: гидроксид калия (KOH) — белого цвета, гидроксид меди (II) (Cu(OH)2) — голубого цвета
Некоторые растворимые в воде основания называются едкими щелочами:
NaOH — едкий натр
KOH — едкий кали
Химические свойства оснований
1. Основания взаимодействуют с кислотами с образованием соли и воды – реакция нейтрализации.
Основание + кислота = соль + H2O
KOH + HCl = KCl + H2O
2. Щелочи взаимодействуют с кислотными оксидами с образованием соли и воды.
Щелочь + кислотный оксид = Соль + H2O
Ca(OH)2 + CO2 = CaCO3 ↓ + H2O
3. Растворы щелочей взаимодействуют с растворами солей, если в результате образуется нерастворимое основание (или выделяется газ) или соль.
Раствор щелочи + раствор соли = основание2 + соль2
2NaOH + CuSO4 = Cu(OH)2 ↓ + Na2SO4
4. Нерастворимые в воде основание при нагревании разлагаются на основный оксид и воду.
5. Растворы щелочей взаимодействуют с металлами, которые образуют амфотерные оксиды и гидроксиды.
Zn + 2NaOH + 2 H2O = Na2[Zn(OH)4] + H2
Получение оснований
1. Взаимодействие щелочных и щелочноземельных металлов с водой.
2Na + 2H2O = 2NaOH + H2
2. Взаимодействие оксидов щелочных и щелочноземельных металлов с водой.
BaO + H2O = Ba(OH)2
3. Получение нерастворимых оснований действием щелочей на растворимые соли металлов
Раствор щелочи + раствор соли = нераствор. основание + соль1
2NaOH + FeSO4 = Fe(OH)2 ↓ + Na2SO4
Амфотерные гидроксиды
Физические свойства
Все амфотерные гидроксиды — твердые вещества, не растворимые в воды. Окраска амфотерных гидроксидов зависит от характера входящих в их состав катионов металлов.
Химические свойства
Амфотерные гидроксиды реагируют как с кислотами, так и со щелочами.
1. Взаимодействие амфотерных гидроксидов с кислотами.
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Pb(OH)2 + 2HNO3 = Pb(NO3)2 + 2 H2O
Cr(OH)3 + 3HNO3 = Cr(NO3)3 + 3H2O
2. Сплавление твердых гидроксидов с твердыми щелочами.
3. При взаимодействии амфотерных гидроксидов с избытком растворов щелочей образуются комплексы.
Химические свойства кислот
1. Серная кислота реагирует с каждым из двух веществ:
1) и
2)
и
3)
и
4)
и
2. Соляная кислота реагирует с каждым из двух веществ:
1) и
2)
и
3)
и
4)
и
3. Уксусная кислота реагирует с каждым из двух веществ:
1) и
2)
и
3)
и
4)
и
4. Концентрированная серная кислота при обычных условиях взаимодействует с:
1) железом 2) алюминием 3) цинком
4) оксидом кремния(IV) 5) гидроксидом меди(II)
5. Разбавленная серная кислота при обычных условиях взаимодействует с:
1) серой 2) алюминием 3) медью
4) оксидом кремния(IV) 5) гидроксидом цинка
6. Концентрированная азотная кислота реагирует с каждым из двух веществ:
1) 2)
3)
4)
7. С ортофосфорной кислотой взаимодействует каждое из веществ, указанных в ряду:
1) 2)
3) 4)
8. В пробирку с разбавленным раствором вещества Х добавили твёрдое вещество Y. В результате реакции наблюдали выделение бесцветного газа.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
1) 2)
3)
4)
(разб.) 5)
(разб.)
9. В двух пробирках находился разбавленный раствор серной кислоты. В первую пробирку добавили твёрдое простое вещество Х, а во вторую – раствор вещества Y. В обеих пробирках выделился газ. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) 2)
3)
4)
5)
10. Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
ФОРМУЛА ВЕЩЕСТВА РЕАГЕНТЫ
А) 1)
Б) 2)
В) 3)
Г) 4)
5)
11. Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) 1)
Б) 2)
В) 3)
Г) 4)
5)
6)
12. В двух химических стаканах находился порошок сульфида алюминия. В первый стакан добавили избыток раствора вещества Х, а во второй – избыток раствора вещества Y. В первом стакане порошок полностью растворился без выделения газа, а во втором порошок тоже растворился, но с образованием газа. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) 2)
3)
4)
5)
13. При комнатной температуре концентрированная серная кислота реагирует с каждым из двух веществ:
1) алюминием и хлоридом натрия 2) оксидом кремния и гидроксидом натрия
3) магнием и карбонатом калия 4) железом и оксидом углерода(IV)
14. Превращение осуществляется при взаимодействии с
1) 2)
3)
4)
15. Какие две кислоты могут реагировать друг с другом?
|
1) |
2) |
3) |
4) |