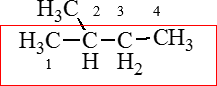3.3. Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная).
Классификация органических веществ
В зависимости от типа строения углеродной цепи органические вещества подразделяют на:
- ациклические и циклические.
- предельные (насыщенные) и непредельные (ненасыщенные).
- карбоциклические и гетероциклические.
- алициклические и ароматические.
Ациклические соединения — органические соединения, в молекулах которых отсутствуют циклы и все атомы углерода соединены друг с другом в прямые или разветвленные открытые цепи.
В свою очередь среди ациклических соединений выделяют предельные (или насыщенные), которые содержат в углеродном скелете только одинарные углерод-углеродные (С-С) связи и непредельные (или ненасыщенные), содержащие кратные — двойные (С=С) или тройные (С≡С) связи.
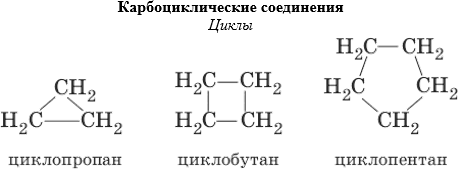
Циклические соединения — химические соединения, в которых присутствует три или более связанных атомов, образующие кольцо.
В зависимости от того, какими атомами образованы циклы различают карбоциклические соединения и гетероциклические соединения.
Карбоциклические соединения (или изоциклические) содержат в своих циклах только атомы углерода. Эти соединения в свою очередь делятся на алициклические соединения (алифатические циклические) и ароматические соединения.
Гетероциклические соединения содержат в составе углеводородного цикла один или несколько гетероатомов, чаще всего которыми являются атомы кислорода, азота или серы.
Простейшим классом органических веществ являются углеводороды – соединения, которые образованы исключительно атомами углерода и водорода, т.е. формально не имеют функциональных групп.
Поскольку углеводороды, не имеют функциональных групп для них возможна только классификация по типу углеродного скелета. Углеводороды в зависимости от типа их углеродного скелета делят на подклассы:
1) Предельные ациклические углеводороды носят название алканы. Общая молекулярная формула алканов записывается как CnH2n+2, где n — количество атомов углерода в молекуле углеводорода. Данные соединения не имеют межклассовых изомеров.
2) Ациклические непредельные углеводороды делятся на:
а) алкены — в них присутствует только одна кратная, а именно одна двойная C=C связь, общая формула алкенов CnH2n,
б) алкины – в молекулах алкинов также присутствует только одна кратная, а именно тройная С≡С связь. Общая молекулярная формула алкинов CnH2n-2
в) алкадиены – в молекулах алкадиенов присутствуют две двойные С=С связи. Общая молекулярная формула алкадиенов CnH2n-2
3) Циклические предельные углеводороды называются циклоалканы и имеют общую молекулярную формулу CnH2n.
Остальные органические вещества в органической химии рассматривают как производные углеводородов, образуемые при введении в молекулы углеводородов так называемых функциональных групп, которые содержат другие химические элементы.
Таким образом, формулу соединений с одной функциональной группой можно записать как R-X, где R – углеводородный радикал, а Х – функциональная группа. Углеводородным радикалом называют фрагмент молекулы какого-либо углеводорода без одного или нескольких атомов водорода.
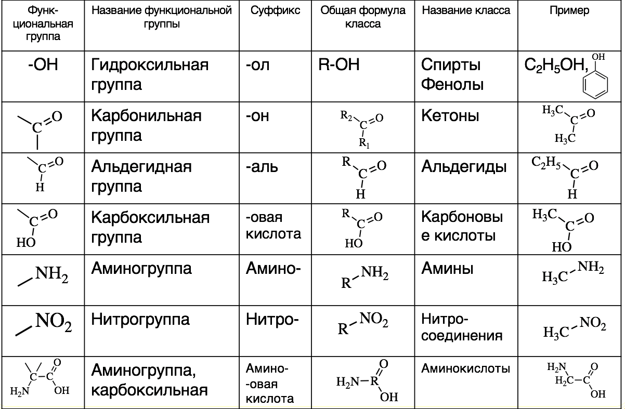
По наличию тех или иных функциональных групп соединения подразделяют на классы. Основные функциональные группы и классы соединений, в состав которых они входят, представлены в таблице:
Таким образом, различные комбинации типов углеродных скелетов с разными функциональными группами дают большое разнообразие вариантов органических соединений.
Галогенпроизводные углеводородов
Галогенпроизводными углеводородов называют соединения, получаемые при замене одного или нескольких атомов водорода в молекуле какого-либо исходного углеводорода на один или несколько атомов какого-либо галогена соответственно.
Пусть некоторый углеводород имеет формулу CnHm, тогда при замене в его молекуле X атомов водорода на X атомов галогена формула галогенпроизводного будет иметь вид CnHm-XHalX. Таким образом, монохлорпроизводные алканов имеют формулу CnH2n+1Cl, дихлорпроизводные CnH2nCl2 и т.д.
Спирты и фенолы
Спирты – производные углеводородов, один или несколько атомов водорода в которых заменены на гидроксильную группу -OH. Спирты с одной гидроксильной группой называют одноатомными, с двумя – двухатомными, с тремя трехатомными и т.д. Например:
Спирты с двумя и более гидроксильными группами называют также многоатомными спиртами. Общая формула предельных одноатомных спиртов CnH2n+1OH или CnH2n+2O. Общая формула предельных многоатомных спиртов CnH2n+2Ox , где x – атомность спирта.
Спирты могут быть и ароматическими. Например:
Общая формула таких одноатомных ароматических спиртов CnH2n-6O.
Однако, следует четко понимать, что производные ароматических углеводородов, в которых на гидроксильные группы заменены один или несколько атомов водорода при ароматическом ядре не относятся к спиртам. Их относят к классу фенолы. Например, это данное соединение является спиртом:
А это представляет собой фенол:
Причина, по которой фенолы не относят к спиртам, кроется в их специфических химических свойствах, сильно отличающих их от спиртов. Как легко заметить, однотомные фенолы изомерны одноатомным ароматическим спиртам, т.е. тоже имеют общую молекулярную формулу CnH2n-6O.
Амины
Аминами называют производные аммиака, в которых один, два или все три атома водорода замещены на углеводородный радикал.
Амины, в которых только один атом водорода замещен на углеводородный радикал, т.е. имеющие общую формулу R-NH2, называют первичными аминами.
Амины, в которых два атома водорода замещены на углеводородные радикалы, называют вторичными аминами. Формулу вторичного амина можно записать как R-NH-R’. При этом радикалы R и R’ могут быть как одинаковые, так и разные. Например:
| СH3-NH-CH3 | СH3-NH-CH2-CH3 |
| диметиламин | метилэтиламин |
Если в аминах отсутствуют атомы водорода при атоме азота, т.е. все три атома водорода молекулы аммиака замещены на углеводородный радикал, то такие амины называют третичными аминами. В общем виде формулу третичного амина можно записать как:
При этом радикалы R, R’, R’’ могут быть как полностью одинаковыми, так и все три разные.
Общая молекулярная формула первичных, вторичных и третичных предельных аминов имеет вид CnH2n+3N.
Ароматические амины с только одним непредельным заместителем имеют общую формулу CnH2n-5N
Альдегиды и кетоны
Альдегидами называют производные углеводородов, у которых при первичном атоме углерода два атома водорода заменены на один атом кислорода, т.е. производные углеводородов в структуре которых имеется альдегидная группа –СН=О. Общую формулу альдегидов можно записать как R-CH=O. Например:
Кетонами называют производные углеводородов, у которых при вторичном атоме углерода два атома водорода заменены на атом кислорода, т.е. соединения, в структуре которых есть карбонильная группа –C(O)-.
Общая формула кетонов может быть записана как R-C(O)-R’. При этом радикалы R, R’ могут быть как одинаковыми, так и разными.
Например:
Как можно заметить, альдегиды и кетоны весьма схожи по строению, однако их все-таки их различают как классы, поскольку они имеют существенные различия в химических свойствах.
Общая молекулярная формула предельных кетонов и альдегидов одинакова и имеет вид CnH2nO
Карбоновые кислоты
Карбоновыми кислотами называют производные углеводородов, в которых есть карбоксильная группа –COOH.
Если кислота имеет две карбоксильные группы, такую кислоту называют дикарбоновой кислотой.
Предельные монокарбоновые кислоты (с одной группой -COOH) имеют общую молекулярную формулу вида CnH2nO2
Ароматические монокарбоновые кислоты имеют общую формулу CnH2n-8O2
Простые эфиры
Простые эфиры – органические соединения, в которых два углеводородных радикала опосредованно соединены через атом кислорода, т.е. имеют формулу вида R-O-R’. При этом радикалы R и R’ могут быть как одинаковыми, так и разными.
Например:
| CH3-O-CH3 | CH3-O-C2H5 |
| диметиловый эфир | метилэтиловый эфир |
Общая формула предельных простых эфиров такая же, как у предельных одноатомных спиртов, т.е. CnH2n+1OH или CnH2n+2О.
Сложные эфиры
Сложные эфиры – класс соединений на основе органических карбоновых кислот, у которых атом водорода в гидроксильной группе замещен на углеводородный радикал R. Фомулу сложных эфиров в общем виде можно записать как:
Например:
Нитросоединения
Нитросоединения – производные углеводородов, у которых один или несколько атомов водорода заменены на нитрогруппу –NO2.
Предельные нитросоединения с одной нитрогруппой имеют общую молекулярную формулу CnH2n+1NO2
Аминокислоты
Соединения, имеющие в своей структуре одновременно две функциональные группы – амино NH2 и карбоксильную – COOH. Например,
NH2-CH2-COOH
Предельные аминокислоты с одной карбоксильной и одной аминогруппой изомерны соответствующим предельными нитросоединениям т.е. как и они имеют общую молекулярную формулу CnH2n+1NO2
В заданиях ЕГЭ на классификацию органических веществ важно уметь записывать общие молекулярные формулы гомологических рядов разных типов соединений, зная особенности строения углеродного скелета и наличия тех или иных функциональных групп. Для того, чтобы научиться определять общие молекулярные формулы органических соединений разных классов, будет полезен материал по этой теме.
Номенклатура органических соединений
Особенности строения и химических свойств соединений находят отражение в номенклатуре. Основными типами номенклатуры считаются систематическая и тривиальная.
Систематическая номенклатура фактически прописывает алгоритмы, в соответствии с которыми то или иное название составляется в строгом соответствии с особенностями строения молекулы органического вещества или, грубо говоря, его структурной формулы.
Рассмотрим правила составления названий органических соединений по систематической номенклатуре.
При составлении названий органических веществ по систематической номенклатуре наиболее важным является правильно определить число атомов углерода в наиболее длинной углеродной цепи или посчитать число атомов углерода в цикле.
В зависимости от количества атомов углерода в основной углеродной цепи, соединения, будут иметь в своем названии различный корень:
|
Количество атомов С в главной углеродной цепи |
Корень названия |
|
1 |
мет- |
|
2 |
эт- |
|
3 |
проп- |
|
4 |
бут- |
|
5 |
пент- |
|
6 |
гекс- |
|
7 |
гепт- |
|
8 |
окт- |
|
9 |
нон- |
|
10 |
дек(ц)- |
Вторая важная составляющая, учитываемая при составлении названий, — наличие/отсутствие кратных связей или функциональной группы, которые перечислены в таблице выше.
Попробуем дать название веществу, имеющему структурную формулу:
1. В главной (и единственной) углеродной цепи данной молекулы содержится 4 атома углерода, поэтому название будет содержать корень бут-;
2. В углеродном скелете отсутствуют кратные связи, следовательно, суффикс, который нужно использовать после корня слова будет -ан, как и у соответствующих предельных ациклических углеводородов (алканов);
3. Наличие функциональной группы –OH при условии, что нет более старших функциональных групп добавляет после корня и суффикса из п.2. еще один суффикс – «ол»;
4. В молекулах содержащих кратные связи или функциональные группы, нумерация атомов углерода главной цепи начинается с той стороны молекулы, к которой они ближе.
Рассмотрим еще один пример:
Наличие в главной углеродной цепи четырех атомов углерода говорит нам о том, что основой названия является корень «бут-», а отсутствие кратных связей говорит о суффиксе «-ан», который будет следовать сразу после корня. Старшая группа в данном соединении – карбоксильная, она и определяет принадлежность этого вещества к классу карбоновых кислот. Следовательно, окончание у названия будет «-овая кислота». При втором атоме углерода находится аминогруппа NH2—, поэтому данное вещество относится к аминокислотам. Также при третьем атоме углерода мы видим углеводородный радикал метил (CH3—). Поэтому по систематической номенклатуре данное соединение называется 2-амино-3-метилбутановая кислота.
Тривиальная номенклатура, в отличие от систематической, как правило, не имеет связи со строением вещества, а обусловлена по большей части его происхождением, а также химическими или физическими свойствами.
| Формула | Название по систематической номенклатуре | Тривиальное название |
| Углеводороды | ||
| CH4 | метан | болотный газ |
| CH2=CH2 | этен | этилен |
| CH2=CH-CH3 | пропен | пропилен |
| CH≡CH | этин | ацетилен |
| CH2=CH-CH= CH2 | бутадиен-1,3 | дивинил |
| 2-метилбутадиен-1,3 | изопрен | |
| метилбензол | толуол | |
| 1,2-диметилбензол | орто-ксилол (о-ксилол) |
|
| 1,3-диметилбензол | мета-ксилол (м-ксилол) |
|
| 1,4-диметилбензол | пара-ксилол (п-ксилол) |
|
| винилбензол | стирол | |
| Спирты | ||
| CH3OH | метанол | метиловый спирт, древесный спирт |
| CH3CH2OH | этанол | этиловый спирт |
| CH2=CH-CH2-OH | пропен-2-ол-1 | аллиловый спирт |
| этандиол-1,2 | этиленгликоль | |
| пропантриол-1,2,3 | глицерин | |
| фенол (гидроксибензол) |
карболовая кислота | |
| 1-гидрокси-2-метилбензол | орто-крезол (о-крезол) |
|
| 1-гидрокси-3-метилбензол | мета-крезол (м-крезол) |
|
| 1-гидрокси-4-метилбензол | пара-крезол (п-крезол) |
|
| фенилметанол | бензиловый спирт | |
| Альдегиды и кетоны | ||
| метаналь | формальдегид | |
| этаналь | уксусный альдегид, ацетальдегид | |
| пропеналь | акриловый альдегид, акролеин | |
| бензальдегид | бензойный альдегид | |
| пропанон | ацетон | |
| Карбоновые кислоты | ||
| метановая кислота | муравьиная кислота (соли и сложные эфиры — формиаты) |
|
| этановая кислота | уксусная кислота
(соли и сложные эфиры — ацетаты) |
|
| пропановая кислота | пропионовая кислота (соли и сложные эфиры — пропионаты) |
|
| C15H31COOH | гексадекановая кислота | пальмитиновая кислота (соли и сложные эфиры — пальмитаты) |
| C17H35COOH | октадекановая кислота | стеариновая кислота (соли и сложные эфиры — стеараты) |
| пропеновая кислота | акриловая кислота (соли и сложные эфиры — акрилаты) |
|
| HOOC-COOH | этандиовая кислота | щавелевая кислота (соли и сложные эфиры — оксалаты) |
| 1,4-бензолдикарбоновая кислота | терефталевая кислота | |
| Сложные эфиры | ||
| HCOOCH3 | метилметаноат | метилформиат, метиловый эфир мурвьиной кислоты |
| CH3COOCH3 | метилэтаноат | метилацетат, метиловый эфир уксусной кислоты |
| CH3COOC2H5 | этилэтаноат | этилацетат, этиловый эфир уксусной кислоты |
| CH2=CH-COOCH3 | метилпропеноат | метилакрилат, метиловый эфир акриловый кислоты |
| Азотсодержащие соединения | ||
| аминобензол, фениламин |
анилин | |
| NH2-CH2-COOH | аминоэтановая кислота | глицин, аминоуксусная кислота |
| 2-аминопропионовая кислота | аланин |
Органические соединения классифицирует по двум признакам:
- строение углеродного скелета (последовательность химически связанных между собой углеродов);
- наличие и строение функциональных групп.
Углеводороды (УВ) – это простейшие органические вещества, молекулы которых состоят из атомов только двух элементов: C и H.
Гомологический ряд – это ряд органических соединений, в котором каждый следующий член ряда отличается от предыдущего на группу CH2.
Строение углеродного скелета
1. Ациклические соединения — соединения с открытой углеродной цепью.
Среди них различают предельные и непредельные.
Классификация веществ по функциональным группам
Правило называния органических веществ по номенклатуре ИЮПАК:
1. Находим самую длинную углеродную цепь
2. Называем все заместители (включая двойную связь), так чтобы эти элементы приобрели наименьшее число.
3. Называем остаток УВ по количеству углеродов в молекуле.
Пример
1. Нашли самую длинную углеродную цепь.
2. Ко второму атому углерода есть метильный радикал называем его: 2-метил…
3. 4 атому углерода – бутан.
Углеводороды
Классификация органических веществ
А 1. Общая форула алкенов:
1) C
n
H
2n+2
2) C
n
H
2n
3) C
n
H
2n-2
4) C
n
H
2n-6
А 2. Вещества с общей формулой C
n
H
2n
могут относиться к классам
1) алкинов и алкенов 2) алкинов и алкодиенов
3) алкенов и алкодиенов 4) алкенов и циклопарафинов
А 3. Ароматическим углеводородам соответствует общая формула
1) С
ņ
Н
2ņ-2
3) С
ņ
Н
2ņ+2
2) С
ņ
Н
2ņ-6
4) С
ņ
Н
2ņ
Гомологи
А 4. Гомологом этилена не является
1) СН
2
=СН—СН
2
—СН
3
2) СН
2
=СН—СН
2
—СН
2
—СН
3
3) СН
2
=СН—СН
3
4) СН
3
—СН
2
—СН
3
А 5. Гомолог вещества, формула которого СН
2
=СН—СН—СН
2
—СН
3
ﺍ
СН
3
1) 2 – метилгексан 2) гептан
3) гекан 4) 3 — метилгекен
А 6. Гомологами являются
1) пентин—1 и пентин-2 2) бутин—1 и бутен-1
3) 2-метилгексен—2 и 3—метилгексан 4)2,3-диметилпентин—1 и 2,3—диметилгексин-1
А 7. Гомологом ацетилена не является
1) СН
≡ С – СН
2
– СН
3
2) СН
3
– С ≡ СН
3) СН
2
= СН – СН
3
4) СН ≡ С – СН
2
– СН
2
– СН
3
Изомеры и их названия
А 8. Изомером вещества, формула которого СН
2
=СН—СН
2
—СН
3
, является:
1) 2-метилбутен-2 2) бутен-2
3) бутан 4) пентин-1
А 9. Число нециклических изомеров углеводорода С
4
Н
8
равно
1) 1 2) 3
3) 2 4) 4
А 10. Структурным изомером пентена – 1 является
1) циклопентан 2) пентен – 2
3) 2 – метилбутен 4) 2 – метилпентен 1
А 11. Как называется углеводород:
СН
3
– СН –СН — С ≡ С – СН – СН
3
│ │ │
СН
3
СН
3
С
2
Н
5
1) 2 – этил— 5,6 –диметилгептин – 3 2) 2,4 – диметил— 6 – этилгептин – 4
3) 1,4,5 – триметил – 1 – этилгексин – 2 4) 2,3,6 – триметилоктин – 4
Строение
А 12. Число σ связей в молекуле этилена равно
1) 1 2) 3
3) 5 4) 4
А 13. Номера атом, находящихся в состоянии sp
2
— гибридизации в молекуле бутена – 2
1) 1 и 2 2) 2 и 3
3) 3 и 4 4) 1 и 4
А 14. Вещество, являющееся исходным в реакции полимеризации, называется:
1) мономер 2) полимер
3) димер 4) тример
А 15. Только σ — связи имеются в молекуле
1) бутена 2) пропилена
3) этилена 4) пентана
А 16. Число σ связей в молекуле ацетилена равно
1) 1 2) 3
3) 5 4) 4
А 17. Число π—связей в молекуле пропина равно
1) 1 2) 3
3) 2 4) 4
Химические свойства
А 18. Вещество, для которого характерна реакция гидрирования:
1) пропан 2) пропен
3) этан 4) 2- метилпропан
А 19. Для получения углеводорода с более длинной углеродной цепью применяют
реакцию:
1) Вюрца 2) Зайцева
3) Кучерова 4) Марковникова
А 20. Условия проведения реакции Кучерова – это:
1) H
2
,(Ni) 2) Сl
2
,(h )
3) Pt, 5атм 4) р—р HgSO
4
А 21. Катализатором тримеризации ацетилена в бензол служит:
1) СuСl 2) С (актив)
3) АlСl
3
4) Рt.
А 22. Формулы веществ, вступающих в реакцию друг с другом:
1) С
2
Н
4
и СН
4
2) С
3
Н
8
и Н
2
3) С
6
Н
14
и Н
2
О 4) С
2
Н
4
и Н
2
А 23. В результате реакции Вюрца из 2 – иодбутана получается:
1) н — октан 2) н — гексан
2) 2,5 – диметилгексан 4) 3,4 – диметилгексан
А 24. Отличить 2—метилпентен-2 от 2—метилпентана можно с помощью:
1) бромоводорода 2) бромной воды
3) раствора серной кислоты 4) лакмуса
А 25. Какая из реакций бензола относится к реакциям замещения?
1) нитрование 2) горение
3) гидрирование 4) взаимодействие с хлором при действии УФ —
облучения.
А 26. Органическим веществом, при пропускании которого через бромную воду раствор
обесцвечивается, является:
1) метан 2) пропилен
3) хлорметан 4) этан
А 27. Бензол не взаимодействует с
1) азотной кислотой 2) бромоводородом
3) бромом 4) хлором
А 28. При взаимодействии бутена—1 c хлороводородом атом хлора присоединяется к атому
углерода:
1) первому 2) второму
3) третьему 4) четвертому
А 29. С водородом при определенных условиях реагируют оба вещества пары:
1) бутан и бутен 2) пропен и циклопропан
3) этилен и этан 4) гексан и изобутан
А 30. И бутан и бутилен реагируют с
1) бромной водой 2) раствором KMnO
4
3) водородом 4) хлором
А 31. Продуктом реакции бутена-1 с хлором является
1) 2-хлрбутен-1 2) 1,2-дихлорбутан
3) 1,1-дихлорбутан 4) 1,2-дихлорбутен-1
А 32. При полимеризации какого углеводорода образуется полимер, структурная формула
которого
1) пропана 2) 2- метилпропана
3) 2 – метилпрпена 4) пропена
А 33. Какой тип реакции характерен для ацетилена
1) разложения 2) замещения
3) присоединения 4) обмена
А 34. Гексахлорциклогексан образуется в результате взаимодействия
1) бензола и хлора при облучении 2) бензола и хлорметана в присутствии AlCl
3
3) бензола и хлора в присутствии FeCl
3
4)бензола и хлороводорода
Получение
А 35. Формула вещества Х в цепочке превращений
t
0
+ H
2
, Ni
СН
4
→ Х → С
2
Н
4
1) СО
2
2) С
2
Н
2
3)С
3
Н
8
4) С
2
Н
6
А 36. Тип реакции С
2
Н
5
ОН → С
2
Н
4
+ Н
2
О
1) замещение 2) присоединение
3) гидрирование 4) разложение
А 37. Бензол и его гомологи выделяют из:
1) мазута 2) попутного нефтяного газа;
3) кокса 4) каменноугольной смолы
Часть В
В 1. К способам получения алкенов относят:
А) дегидрирование алканов
Б) гидрирование бензола
В) дегидратацию спиртов
Г) отщепление галогенводородов от галогеналканов
Д) ароматизацию предельных углеводородов
Е) гидратацию алкинов
Ответ: _____________________
В 2. И для метана, и для пропена характерны:
А) реакции бромирования
Б) жидкое агрегатное состояние при н.у.
В) наличие π—связи в молекулах
Г) реакции гидрирования
Д) горение на воздухе
Е) малая растворимость в воде
Ответ: _____________________
В 3. К способам получения ацетилена относят:
А) дегидратацией этилового спирта
Б) гидратацией этилена
В) дегидрирование этилена
Г) сжиганием этана
Д) гидратацией карбида кальция
Е) термическим разложением метана
Ответ: _____________________
В 4. С каким из перечисленных веществ, при соответствующих условиях реагирует
пропин:
А) водород
Б) бром
В) этен
Г) метан
Д) углекислый газ
Е) хлороводород
Ответ: _____________________
В 5. С каким из перечисленных веществ, при соответствующих условиях реагирует
бензол:
А) хлор
Б) вода
В) азотная кислота
Г) бром
Д) р—р KMnO
4
Е) хлороводород
Ответ: _____________________
В 6. Выберите признаки, характерные для этана:
А) газообразное вещество
Б) горит бледным синеватым пламенем
В) имеет резкий запах
Г) в 1,5 раз тяжелее водорода
Д) растворим в воде
Е) вступает в реакции присоединения
Ответ: _____________________
В 7. Какие углеводороды можно получить реакцией дегидрирования
А) этан
Б) бутадиен
В) пропен
Г) ацетилен
Д) бутан
Е) пентан
Ответ: _____________________
В 8. Этилен не взаимодействует с веществами:
А) HNO
3
Б) О
2
В) C
2
H
2
Г) Н
2
Д) Cl
2
Е) CH
4
Ответ: _____________________
В 9. С каким из перечисленных веществ бензол не взаимодействует:
А) H
2
Б) C
2
H
2
В) НNO
3
Г) CH
4
Д) Н
2
О
Е) Cl
2
Ответ: _____________________
В 10. Какие пары углеводородов вступают в реакции гидрирования
А) пропан и пропилен
Б) бутадиен и бензол
В) пропен и этин
Г) метан и этан
Д) пентан и пентен
Е) бензол и ацетилен
Ответ: _____________________
В 11. Для этилена характерно
А) наличие в молекулах двойной связи
Б) хорошая растворимость в воде
В) обесцвечивание бромной воды
Г) наличие в молекулах только одинарных связей
Д) реакция полимеризации
Е) наличие тройной связи
Ответ: _____________________
В 12. С раствором бромной воды реагирует
А) метан
Б) циклогексан
В) этилен
Г) ацетилен
Д) бензол
Е) пентен-2
Ответ: _____________________
В 13. Установите соответствие между названием соединения и классом, к которому оно
принадлежит
Название вещества Класс соединений
1) бутан А) алкены
2) бензол Б) алкины
3) бутен В) алканы
4) метан Г) арены
Д) циклоалканы
Е) алкадиены
В 14. Установите соответствие между названием соединения и классом, к которому оно
принадлежит
Название вещества Класс соединений
1) бутадиен А) алканы
2) этан Б) алкины
3) пропен В) алкены
4) ацетилен Г) алкадиены
Д) циклоалканы
Е) арены
В 15. Установите соответствие между формулой вещества и степенью окисления углерода
в нем:
1) СН
4
А) +2
2) СН
3
Сl
Б) -3
3) ССl
4
В) -4
4) Al
4
С
3
Г) +1
Д) +4
Е) -2
В 16. Установите соответствие между формулой вещества и коэффициентом, стоящим
перед ним в уравнении реакции:
С
3
Н
8
+ О
2
→
СО
2
+ Н
2
О
1) С
3
Н
8
А) 3
2) О
2
Б) 2
3) СО
2
В) 8
4) Н
2
О Г) 4
Д) 1
Е) 5
В 17. Установите соответствие между названием органического соединения и числом σ— и
π— связей.
Название органического соединения Число — σ— и π —связей
1) пропен А) 12 и 2
2) этин Б) 11 и 1
3) метан В) 3 и 2
4) бутадиен-1,3 Г) 8 и 1
Д) 10 и 3
Е) 4 и 0
В 18. Установите соответствие между названием органического соединения и числом σ— и
π— связей.
Название органического соединения Число σ— и π— связей
1) этан А) 3 и 2
2) этилен Б) 6 и 2
3) бутен-1 В) 11 и 1
4) ацетилен Г) 7 и 0
Е) 5 и 1
В 19. Установите соответствие между формулой вещества и коэффициентом, стоящим
перед ним в уравнении реакции:
С
6
Н
6
+ О
2
→
СО
2
+ Н
2
О
1) С
6
Н
6
А) 6
2) О
2
Б) 2
3) СО
2
В) 3
4) Н
2
О Г) 12
Д) 15
Е) 1
В 20. Установите соответствие между формулой вещества и коэффициентом, стоящим
перед ним в уравнении реакции:
С
5
Н
12
+ О
2
→
СО
2
+ Н
2
О
1) С
5
Н
12
А) 8
2) О
2
Б) 6
3) СО
2
В) 2
4) Н
2
О Г) 4
Д) 1
Е) 5
В 21. Установите соответствие между формулой вещества и коэффициентом, стоящим
перед ним в уравнении реакции:
С
4
Н
8
+ О
2
→
СО
2
+ Н
2
О
1) С
4
Н
8
а) 1
2) О
2
б) 2
3) СО
2
в) 4
4) Н
2
О г) 5
д) 6
е) 8
В 22. Установите соответствие между названием органического соединения и структурной
формулой
Название вещества Структурная формула
1) транс-5-метилгептен—2 А) СН
3
– СН
2
– С = СН – СН
2
– СН
3
|
2) 2,5-диметилгексен—1 СН
2
– СН
3
3) 2-метил-3,6-диэтилоктен-4 СН
3
Н
4) 3-этилгексен—3 Б) С=С
Н СН
2
– СН – СН
2
– СН
3
|
СН
3
В) СН
2
= С – СН
2
– СН
2
– СН – СН
2
– СН
3
| |
СН
3
СН
3
Н Н
Г) С=С
СН
3
СН
2
– СН – СН
2
– СН
3
|
СН
3
СН
3
|
Д) СН
3
– СН – СН – СН = СН – СН – СН
2
– СН
3
| |
СН
2
– СН
3
СН
2
– СН
3
В 23. Установите соответствие между структурной формулой органического соединения и
его названием
Структурная формула вещества Название вещества
1) А) 1,3,5-триметилбензол
Б) пара—метилэтилбензол
2)
В) 1-пропил-5-метил-2-этилбензол
3) Г) 1-метил-4-этилбензол
Д) пропилбензол
4)
Е) 1-метил-3-этил-4-пропилбензол
В 24. Установите соответствие между структурной формулой вещества и названием
гомологического ряда, к которому оно принадлежит
1) С
6
Н
5
— СН
2
—СН
3
2) СН
3
—С(СН
3
)
2
—СН
2
—СН
3
3) СН
2
=С=СН—СН
3
4) СН
3
—С≡С—СН
3
А) алкодиены
Б) алканы
В) арены
Г) алкены
Д) алкины
В 25. Установите соответствие между названием соединения и классом, к которому оно
принадлежит
Название вещества Класс соединений
1) гексен А) алкены
2) этан Б) алкины
3) циклобутан В) алканы
4) этилен Г) спирты
Д) циклоалканы
Е) алкадиены
В 26. Установите соответствие между структурной формулой вещества и названием
гомологического ряда, к которому оно принадлежит
1) С
6
Н
5
—СН
3
2) СН
3
—СН
2
—СН
2
— СН = СН—СН
3
3) СН
2
=СН—СН
2
—СН
3
4) СН
3
—С≡С—СН
2
—СН
3
А) алкодиены
Б) алканы
В) алкины
Г) алкены
Д) арены
В 27. Установите соответствие между исходными веществами и продуктами реакции
Вещества, вступившие в реакцию Основной продукт реакции
H
2
SO
4
(конц.)
1) + HNO
3
А) Б)
hν
2) + С1
2
В) Г)
3) AlCl
3
+ С
2
Н
5
С1
FeCl
3
4) + Cl
2
Д) Е)
В 28. Установите соответствие между названием вещества и формулой его
изомера
Название вещества Формула изомера
1) 2-метилбутен—2 А) СН
2
= СН – СН
2
– СН
2
– СН
3
2) цис-3-метилпентен-1 Н СН
3
3) бутен-1 Б) С=С
4) 2,3-диметилбутен-1 СН
3
СН
2
– СН
3
СН
3
|
В) СН
3
– С = С – СН
3
|
СН
3
СН
3
СН
3
Г) С=С
Н СН
2
– СН
3
Д) СН
3
– СН = СН – СН
3
Е) СН
3
– СН = С – СН
2
– СН
3
|
СН
2
– СН
3
В 29. Установите соответствие между исходными веществами и продуктами реакции
Вещества вступившие в реакцию Продукты реакции
1) СН
3
– С ≡ С – СН
3
+ Н
2
А) СН
3
СН
2
ОН
Б) СН
3
– СВr = СН
2
2) СН
3
– С ≡ СН + НВr В) СН
3
– СН = СН – СН
3
Г) СН
3
– СН = СНВr
3) СН ≡ СН + НОН Д) СН
3
– СНВr= СНВr- СН
3
4) СН
3
– С ≡ С – СН
3
+ Вr
2
Е) СН
3
СОН
В 30. Установите соответствие между исходными веществами и продуктами реакции
Вещества вступившие в реакцию Продукты реакции
1) СН
3
– С ≡ СН + Н
2
А) СН
2
=СН
2
Б) СН
3
– СН= СН
2
2) СН
3
– СН = СН
2
+ НВr В) СН
3
– СНВr-СН
3
Г) СН
3
– СН
2
—СНВr
3) СН ≡ СН + 2Н
2
Д) СН
3
– СНВr= СНВr- СН
3
4) СН
3
– С ≡ С – СН
3
+ Вr
2
Е) СН
3
—СН
3
Часть С
С 1. Определите формулу алкена, если известно, что 4,2 г этого алкена присоединяет 8,0 г
брома.
С 2. Осуществите следующие превращения. Запишите уравнения реакций.
+ Cl
2
+Na + Br
2
+ NaOH(спирт.) + Н
2
О
СН
3
– СН
3
→ Х
1
→ Х
2
→
Х
3
→ Х
4
→ Х
5
С 3. Осуществите следующие превращения. Запишите уравнения реакций.
С 4. Осуществите следующие превращения. Запишите уравнения реакций.
+Н
2
О, HgSO
4
С → СН
4
→ С
2
Н
2
→ Х
3
С 5. Напишите уравнения реакций, при помощи которых можно осуществить следующие
превращения, указав вещество X , и условия проведения реакций
+НNO
3
C
2
H
6
→ C
2
H
4
→ C
2
H
2
→ C
6
H
6
→
X
С 6. Осуществите следующие превращения. Запишите уравнения реакций.
+H
2
O +1мольCl
2
+Nа,t
Al
4
C
3
→X
1
→ X
2
→ X
3
С 7. Осуществите следующие превращения. Запишите уравнения реакций.
300
0
+ Cl
2
(FeCl
3
)
Гексен Гексан Х
1
Х
2
С 8. Напишите уравнения реакций, при помощи которых можно осуществить следующие
превращения, указав условия проведения реакций:
CH
4
→ C
2
H
2
→ C
2
H
4
→ C
2
H
2
→ C
6
H
6
С 9. Согласно термохимическому уравнению реакции
CH
4
+ 2O
2
→ CO
2
+ 2H
2
O + 900 кДж вычислите количество теплоты, которое
выделиться при сжигании 3,2 г метана.
С 10. Согласно термохимическому уравнению реакции
CH
4
+ 2O
2
→ CO
2
+ 2H
2
O + 900 кДж вычислите количество теплоты, которое
выделиться при сжигании 8 г метана.
С 11. Определите формулу углеводорода, массовая доля углерода в котором 85,7%, а
плотность паров по водороду 28.
С 12. Из 92 г этанола получили 33,6 л (н.у.) этилена. Вычислите выход продукта в
процентах от теоретически возможного.
С 13. Определите формулу углеводорода, массовая доля водорода в котором равна 20%.
Относительная плотность углеводорода по водороду равна 15.
С 14. Определите формулу углеводорода, при сжигании которого образовалось 1, 792л
(н.у) оксида углерода (IV ) и 1,44г воды. Относительная плотность вещества по водороду
равна 28.
С 15. Определите формулу углеводорода, при сжигании которого образовалось 4,48л
оксида углерода (IV) (н.у) и 1,8г воды. Масса 10л этого газа составляет 12,5г.
С 16. Найдите простейшую формулу углеводорода, содержащего 92,31% углерода по
массе.
С 17. Вычислите массовую долю углерода и водорода в молекуле пропана.
С 18. При нагревании иодметана массой 2,84 с избытком металлического
натрия получили 179,2 мл этана (н.у). Определите выход продукта реакции.
С 19. Определите алкан, 1 л которого при н.у. весит 2,59 г. Составьте его структурную
формулу.
С 20. Определите простейшую формулу углеводорода, при сжигании которого
образовалось 2,24л оксида углерода (IV) (н.у) и 3,6г воды.
С 21. Вычислите массу бромбензола, которую можно получить при бромировании
117 г бензола бромом массой 316 г.
С 22. Углеводород, плотность паров которого по водороду равна 15, содержит 80 %
углерода. Найдите его молекулярную формулу.
С 23. Из 7,8 г бензола получено 8,61 г нитробензола. Определите выход продукта реакции.
С 24. Технический карбид кальция массой 20 г обработали избытком воды. Какой объем
ацетилена получили, если массовая доля примесей техническом карбиде составляла 20 %.
С 25. Какая масса бромбензола образуется при взаимодействии 7,8 г бензола с избытком
брома в присутствии FeBr
3
, выход продукта реакции равен 90%?
С 26. При сжигании 29 г углеводорода образовалось 88 г оксида углерода (IV) и 45 г воды.
Выведите молекулярную формулу углеводорода.
С 27. Из 44,8 л метана получили 40 л хлорметана. Определите сколько это составляет в %
от теоретически возможного выхода.
С 28. Вычислите объем углекислого газа, выделившегося при сгорании 56 л метана в 48 л
кислорода
С 29. Из 92 г этанола получили 33,6 л (н.у.) этилена. Определите выход продукта в
процентах от теоретически возможного.
С. 30. Найдите объем этилена, необходимый для обесцвечивания 50 г 2%—ного раствора
бромной воды.