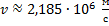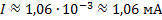Атом Бора.
Автор — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев.
Темы кодификатора ЕГЭ: постулаты Бора.
Планетарная модель атома, успешно истолковав результаты опытов по рассеянию -частиц, в свою очередь столкнулась с очень серьёзными трудностями.
Как мы знаем, любой заряд, движущийся с ускорением, излучает электромагнитные волны. Это — неоспоримый факт классической электродинамики Максвелла, подтверждаемый многочисленными наблюдениями.
Нам также хорошо известно, что электромагнитные волны несут энергию. Стало быть, ускоренно движущийся заряд, излучая, теряет энергию, которая этим излучением уносится.
А теперь давайте возьмём произвольный электрон в планетарной модели. Он двигается вокруг ядра по замкнутой орбите, так что направление его скорости постоянно меняется. Следовательно, электрон всё время имеет некоторое ускорение (например, при равномерном движении по окружности это будет центростремительное ускорение), и поэтому должен непрерывно излучать электромагнитные волны. Расходуя свою энергию на излучение, электрон будет постепенно приближаться к ядру; в конце концов, исчерпав запас своей энергии полностью, электрон упадёт на ядро.
Если исходить из того, что механика Ньютона и электродинамика Максвелла работают внутри атома, и провести соответствующие вычисления, то получается весьма озадачивающий результат: расход энергии электрона на излучение (с последующим падением электрона на ядро) потребует совсем малого времени — порядка секунды. За это время атом должен полностью «коллапсировать» и прекратить своё существование.
Таким образом, классическая физика предрекает неустойчивость атомов, устроенных согласно планетарной модели. Этот вывод находится в глубоком противоречии с опытом: ведь на самом деле ничего такого не наблюдается. Предметы нашего мира вполне устойчивы и не коллапсируют на глазах! Атом может сколь угодно долго пребывать в невозбуждённом состоянии, не излучая при этом электромагнитные волны.
Постулаты Бора.
Оставалось признать, что внутри атомов перестают действовать известные законы классической физики. Микромир подчиняется совсем другим законам.
Первый прорыв в познании законов микромира принадлежит великому датскому физику Нильсу Бору. Он предложил три постулата, резко расходящиеся с механикой и электродинамикой, но тем не менее позволяющих правильно описать простейший из атомов — атом водорода.
Классическая физика хорошо описывает непрерывные процессы — движение материальной точки, изменение состояния идеального газа, распространение электромагнитных волн… Энергия объекта, подчиняющегося механике или электродинамике, в принципе может принимать любые значения. Однако линейчатые спектры указывают на дискретность процессов, происходящих внутри атомов. Эта дискретность должна фигурировать в законах новой теории.
Первый постулат Бора. Всякий атом (и вообще, всякая атомная система) может находиться не во всех состояниях с любым, наперёд заданным значением энергии. Возможен лишь дискретный набор избранных состояний, называемых стационарными, в которых энергия атома принимает значения Находясь в стационарном состоянии, атом не излучает электромагнитные волны.
Как видим, первый постулат Бора вопиющим образом противоречит классической физике: налагается запрет на любые значения энергии, кроме избранного прерывистого набора, и признаётся, что электроны, вроде бы движущиеся ускоренно, на самом деле не излучают.
Выглядит фантастически, не правда ли? Однако в том же 1913 году, когда Бор предложил свои постулаты, существование стационарных состояний было подтверждено экспериментально — в специально поставленном опыте немецких физиков Франка и Герца. Таким образом, стационарные состояния — это не выдумка, а объективная реальность.
Значения разрешённого набора называются уровнями энергии атома. Что происходит при переходе с одного уровня энергии на другой?
Второй постулат Бора. Если атом переходит из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией
, то разность этих энергий может высвободиться в виде излучения. В таком случае излучается фотон с энергией
. (1)
Эта же формула работает и при поглощении света: в результате столкновения с фотоном атом переходит из состояния в состояние с большей энергией
, а фотон при этом исчезает.
Для примера на рис. 1 показано излучение фотона при переходе атома с энергетического уровня на уровень
. Переход заключается в том, что электрон «соскакивает» с одной орбиты на другую, расположенную ближе к ядру.
Рис. 1. Излучение фотона атомом
Формула (1) даёт качественное представление о том, почему атомные спектры испускания и поглощения являются линейчатыми.
В самом деле, атом может излучать волны лишь тех частот, которые соответствуют разностям значений энергии разрешённого дискретного набора ; соответственно, набор этих частот также получается дискретным. Вот почему спектр излучения атомов состоит из отдельно расположенных резких ярких линий.
Вместе с тем, атом может поглотить не любой фотон, а только тот, энергия которого в точности равна разности
каких-то двух разрешённых значений энергии
и
. Переходя в состояние с более высокой энергией
, атомы поглощают ровно те самые фотоны, которые способны излучить при обратном переходе в исходное состояние
. Попросту говоря, атомы забирают из непрерывного спектра те линии, которые сами же и излучают; вот почему тёмные линии спектра поглощения холодного атомарного газа находятся как раз в тех местах, где расположены яркие линии спектра испускания этого же газа в нагретом состоянии.
Качественного объяснения характера атомных спектров, однако, недостаточно. Хотелось бы иметь теорию, позволяющую вычислить частоты наблюдаемых спектров. Бору удалось это сделать в самом простом случае — для атома водорода.
Атом водорода.
Атом водорода состоит из ядра с зарядом , которое называется протоном, и одного электрона с зарядом
(через
обозначена абсолютная величина заряда электрона). При построении своей теории атома водорода Бор сделал три дополнительных предположения.
1. Прежде всего, мы ограничиваемся рассмотрением только круговых орбит электрона. Таким образом, электрон движется вокруг протона по окружности радиуса с постоянной по модулю скоростью
(рис. 2).
Рис. 2. Модель атома водорода
2. Величина , равная произведению импульса электрона
на радиус орбиты
, называется моментом импульса электрона. В каких единицах измеряется момент импульса?
Смотрим:
=кг*м/с*м=(кг*м/
)*м*с=Н*м*с=Дж*с.
Это в точности размерность постоянной Планка! Именно здесь Бор увидел появление дискретности, необходимой для квантового описания атома водорода.
Правило квантования (третий постулат Бора). Момент импульса электрона может принимать лишь дискретный набор значений, кратных «перечёркнутой» постоянной Планка:
, (2)
3. Выше мы говорили, что классическая физика перестаёт работать внутри атома. Так оно в действительности и есть, но вопреки этому мы предполагаем, что электрон притягивается к протону с силой, вычисляемой по закону Кулона, а движение электрона подчиняется второму закону Ньютона:
. (3)
Эти три предположения позволяют довольно просто получить формулы для уровней энергии атома водорода. Переписываем соотношение (3) в виде:
. (4)
Из правила квантования (2) выражаем :
,
и подставляем это в (4):
.
Отсюда получаем формулу для допустимых радиусов орбит электрона:
. (5)
Теперь перейдём к нахождению энергии электрона. Потенциальная энергия кулоновского взаимодействия электрона с ядром равна:
(Она отрицательна, так как отсчитывается от бесконечно удалённой точки, в которой достигает максимального значения.)
Полная энергия электрона равна сумме его кинетической и потенциальной энергий:
.
Вместо подставим правую часть выражения (4):
. (6)
Полная энергия, как видим, отрицательна. Если на радиус орбиты никаких ограничений не накладывается, как это имеет место в классической физике, то энергия может принимать любые по модулю значения. Но согласно (5) существует лишь дискретный набор возможных значений радиуса; подставляя их в (6), получаем соответствующий набор допустимых значений энергии атома водорода:
. (7)
Основное состояние атома водорода — это состояние с наименьшей энергией . В основном состоянии атом может находиться неограниченно долго. Вычисление даёт:
Дж
эВ:
Мы видим, что если атом находится в основном состоянии, то для выбивания электрона нужно сообщить атому энергию, равную как минимум 13,6 эВ. Эта величина носит название энергии ионизации атома водорода.
По формуле (5) легко вычислить радиус орбиты основного состояния:
см.
То есть, диаметр атома оказывается равным как раз см — величине, известной из опыта. Таким образом, теория Бора впервые смогла объяснить размер атома!
Кроме того, в рамках теории Бора удаётся получить формулы для вычисления частот (или длин волн) спектра атома водорода. Так, согласно второму постулату Бора и формуле (7) имеем:
. (8)
На практике чаще имеют дело с длинами волн. Учитывая, что , формулу (8) можно переписать так:
. (9)
Константа м
называется постоянной Ридберга. Теория Бора даёт значение этой постоянной, очень хорошо согласующееся с экспериментом.
Длины волн спектра атома водорода образуют серии, характеризующиеся фиксированным значением в формуле (9). Все длины волн данной серии излучаются при переходах на уровень
с вышележащих энергетических уровней
.
Переходы в основное состояние:
образуют серию Лаймана. Длины волн этой серии описываются формулой (9) при :
.
Линии серии Лаймана лежат в ультрафиолетовом диапазоне.
Переходы на второй уровень:
образуют серию Бальмера. Длины волн этой серии подчиняются формуле (9) при :
.
Первые четыре линии серии Бальмера лежат в видимом диапазоне (рис. 3), остальные — в ультрафиолетовом.
Рис. 3. Видимый спектр атома водорода (серия Бальмера)
Переходы на третий уровень:
образуют серию Пашена. Длины волн этой серии описываются формулой (9) при :
.
Все линии серии Пашена лежат в инфракрасном диапазоне.
Имеются ещё три «именованных» серии: это серия Брэккета (переходы на уровень), серия Пфунда (переходы на уровень
) и серия Хэмпфри (переходы на уровень
). Все линии этих серий лежат в далёкой инфракрасной области.
Достоинства и недостатки теории Бора.
О достоинствах модели атома водорода, предложенной Бором, мы так или иначе уже сказали. Резюмируем их.
— Теория Бора продемонстрировала, что для описания атомных объектов принципиально недостаточно представлений классической физики. В микромире работают другие, совершенно новые законы.
Для микромира характерно квантование — дискретность изменения величин, описывающих состояние объекта. В качестве меры квантования, как показала теория Бора, может выступать постоянная Планка , которая является универсальной константой и играет фундаментальную роль во всей физике микромира (а не только в явлениях излучения и поглощения света).
— Теория Бора впервые и совершенно точно указала на факт наличия стационарных энергетических состояний атома, образующих дискретный набор. Этот факт оказался общим свойством объектов микромира.
— В рамках модели Бора удалось получить формулы для вычисления частот спектра атома водорода и объяснить размер атома. Классическая физика была не в состоянии решить эти проблемы.
Однако теория Бора, разумеется, не могла претендовать на роль общей теории, описывающей микромир. Модель Бора обладала рядом существенных недостатков.
— Теория Бора непоследовательна. С одной стороны, она отвергает описание атома на основе классической физики, так как постулирует наличие стационарных состояний и правила квантования, непонятных с точки зрения механики и электродинамики. С другой стороны, классические законы — второй закон Ньютона и закон Кулона — используются для записи уравнения движения электрона по круговой орбите.
— Теория Бора не смогла дать адекватное описание самого простого после водорода атома гелия. Подавно не могло быть и речи о распространении теории Бора на более сложные атомы.
— Даже в самом атоме водорода теория Бора смогла описать не всё. Например, дав выражения для частот спектральных линий, модель Бора не объясняла различие в их интенсивностях. Кроме того, неясен оставался механизм образования молекулы водорода из двух атомов.
Несмотря на свои недостатки, теория Бора стала важнейшим этапом развития физики микромира. Полуклассическая-полуквантовая модель Бора послужила промежуточным звеном между классической физикой и последовательной квантовой механикой , построенной десятилетием позже — в 1920-х годах.
Разберем задачи ЕГЭ на темы: «Строение атома», «Модель Резерфорда-Бора», «Энергетические уровни», «Излучение фотона».
Задача 1.
На рисунке изображена схема низших энергетических уровней атома. В начальный момент времени атом находится в состоянии с энергией Е(2). Согласно постулатам Бора, с какой энергией данный атом может излучать фотоны? (Ответ дать в 10−19 Дж.)
Решение:
Согласно постулатам Бора, атом, находящийся в стационарных состояниях, не излучает энергии. Излучение энергии возможно при переходе атома с уровня с большим значением энергии на уровень с меньшим значением энергии. Поглощение энергии, наоборот, возможно при переходе атома с меньшим уровнем энергии на больший.
С учетом представленной диаграммы, излучение атома возможно при переходе с уровня Е(2) на уровень Е(1), так как Е(2)> Е(1). Поэтому, энергия излучаемых фотонов (hv) может быть определена, как разность энергий
Подставив численные значения, рассчитаем энергию излучаемых фотонов.
(Дж).
Ответ: 3.
Задача 2.
Электрон в атоме водорода находится в основном (самом низком, с номером n = 1) энергетическом состоянии. Атом поглощает фотон с импульсом 6,8 · 10–27 кг·м/с. Найдите номер энергетического уровня, на который в результате этого перейдёт электрон.
Дано:
n1=1;
p = 6,8·10–27 кг·м/с.
Найти:
n-?
Решение:
Уровни энергии в атоме водорода определяются формулой:
(эВ), где n=1, 2, 3… и т. д. (1)
Следовательно, атом на уровне n1=1 обладает энергией, которую можно рассчитать по формуле (1).
(эВ).
Найдем связь между импульсом фотона и его энергией:
(2)
Таким образом, энергия фотона может быть определена по формуле (2).
(Дж).
С учетом, что 1 эВ, получим
(эВ).
Атом, получив энергию от фотона, переходит в стационарное состояние с большим уровнем энергии.
(эВ).
Из формулы (1) необходимо вывести номер энергетического уровня.
Ответ: 4.
Задача 3.
На рисунке изображена упрощенная диаграмма нижних энергетических уровней атома. Нумерованными стрелками отмечены некоторые возможные переходы атома между этими уровнями. Какой из этих четырех переходов связан с поглощением света наибольшей энергии, а какой — с излучением света с наибольшей длиной волны?
Установите соответствие между процессами поглощения и испускания света и стрелками, указывающими энергетические переходы атома.
К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ПРОЦЕССЫ
А) поглощение света наибольшей энергии;
Б) излучение света с наибольшей длиной волны.
ЭНЕРГЕТИЧЕСКИЕ ПЕРЕХОДЫ
1) 1
2) 2
3) 3
4) 4
Ответ:
Решение:
По указанной диаграмме необходимо определить переходы, соответствующие поглощению и излучению света.
Переходы, указанные стрелками 1 и 2, соответствуют излучению энергии, так как атом переходит с большего уровня энергии на меньший.
Здесь надо учесть, что
и
Так как , то, согласно формуле Планка
, меньшая длина волны соответствует большему значению энергии излучения. Поэтому при переходе
будет излучаться большее количество энергии. Вторая стрелка будет соответствовать излучению света с наименьшей длиной волны.
Стрелки 3 и 4 соответствуют поглощению энергии, так как в этих случаях атом переходит на уровни, соответствующие большему значению энергии. Рассуждения, аналогичные первому случаю, приводят к следующему выводу:
и
Так как , то четвертая стрелка будет соответствовать поглощению света наибольшей энергии.
Ответ:
Задача 4.
Значения энергии электрона в атоме водорода задаются формулой: (эВ), где n=1, 2, 3… и т. д.
При переходах с верхних уровней энергии на нижние атом излучает фотон. Переходы с верхних уровней на уровень c n = 1 образуют серию Лаймана, на уровень c n = 2 – серию Бальмера и т. д. Найдите отношение γ максимальной длины волны фотона в серии Бальмера к максимальной длине волны фотона в серии Лаймана.
Решение:
Согласно формуле Планка , максимальная длина волны соответствует излучению света с наименьшим значением энергии. Поэтому для серии Лаймана это переход с уровня 2 на уровень 1 (см. рис. 1). Рассчитаем значение энергии, которая излучается в этом случае.
(эВ).
(эВ).
Длина волны, соответствующая этому переходу, может быть определена из формулы:
(1)
Аналогично для серии Бальмера, излучение с наибольшей длиной волны (наименьшей энергии излучения), соответствует переходу с уровня 3 на уровень 2 (см. рис. 2).
(эВ).
(эВ).
Длина волны, соответствующая этому переходу, может быть определена из формулы:
(2)
Тогда, для нахождения соотношения для длин волн
Разделим уравнение (2) на уравнение (1):
В расчетах значения энергий можно оставить в эВ, так как перевод в систему «СИ» ответа не изменит.
С учетом системы «СИ»:
(1 эВ Дж).
Ответ: 5,4.
Благодарим за то, что пользуйтесь нашими статьями.
Информация на странице «Атом Бора.» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать необходимые и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из разделов нашего сайта.
Публикация обновлена:
08.03.2023
Правило квантования момента импульса электрона записывается следующим образом:
$mv_nr_n = n{h}’$ , где
$mv_nr_n$ – момент импульса электрона на орбите с номером n (главное квантовое число). n = 1, 2, 3 и т. д.
${h}’= frac{h}{2 pi} = 1,05445887 cdot 10^{-34} Дж cdot с$
Далее, учитывая условие равноускоренного движения электрона вокруг ядра под действием силы Кулона и условие квантования момента импульса электрона, можно получить формулы для квантовых величин радиусов орбит или энергии атома.
$r_n = frac {4pi varepsilon_0 n^2 {h}’ } {me^2}$;
$E_n = -(1 /(4pi varepsilon_0)^2) me^4 / 2{h}^{‘2}n^2 = — (me^4 / 8h^2varepsilon_0^2) cdot (1 / n^2)$, n = 1,2,3…
где m – масса электрона, $varepsilon_0$ – диэлектрическая постоянная;
e – заряд электрона.
Энергия атома определяется как сумма кинетической энергии электрона и потенциальной энергии электрона в электростатическом поле ядра атома водорода. Потенциальная энергия имеет отрицательное значение.
$E = Е_k — E_п = (mv_n^2 / 2) — (e^2 / 4pi varepsilon_0r_n)$.
После всех расчётов получаем для энергии атома водорода:
$E_n = -(1 /(4pi varepsilon_0)^2) me^4 / 2{h}’2n^2 = — (me^4 / 8h^2varepsilon_0^2) cdot (1 / n^2)$,
n = 1,2,3…
Подставляя значения главного квантового числа 1, 2, 3 и т. д. можно получить соответствующие значения энергий:
$E_1$ = — 13,6 эВ; $E_2$ = — 3,4 эВ; $E_3$ = — 1,51 эВ и т. д.
Состояние под номером 1 называют основным состоянием атома. Чтобы ионизировать атом водорода, находящийся в основном состоянии, необходимо ему сообщить энергию ионизации, равную 13,6 эВ.
При переходе атома водорода из первого возбуждённого состояния (n = 2) в основное (n= 1) излучается фотон с энергией:
-3,4 эВ — (-13,6 эВ) =9,2 эВ.
Самостоятельная работа Планетарная модель атома. Квантовые постулаты Бора 11 класс с ответами. Самостоятельная работа представлена в двух вариантах, в каждом варианте по 3 задания.
Вариант 1
1. «Атом представляет собой шар, по всему объему которого равномерно распределен положительный заряд. Внутри этого шара находятся электроны. Каждый электрон может совершать колебательные движения. Положительный заряд шара равен по модулю суммарному отрицательному заряду электронов, поэтому электрический заряд атома в целом равен нулю». Кто из ученых предложил такую модель строения атома?
2. Какова энергия фотона, поглощаемого при переходе атома из основного состояния с энергией Е0 в возбужденное с энергией Е1?
3. Найдите изменение энергии атома водорода при испускании им волн с частотой 4,57 · 1014 Гц.
Вариант 2
1. «В центре атома находится маленькое массивное положительное ядро, а на огромном расстоянии от него находятся маленькие лёгкие электроны, определяющие размер атома». Кто из ученых предложил такую модель строения атома?
2. По какой формуле вычисляется частота фотона, излучаемого при переходе атома из возбужденного состояния с энергией Е1 в основное с энергией Е0?
3. На сколько уменьшилась энергия атома при излучении им фотона длиной волны 6,6 · 10-7 м?
Ответы на самостоятельную работу Планетарная модель атома. Квантовые постулаты Бора 11 класс
Вариант 1
1. Джозеф Джон Томсон (Дж. Дж. Томпсон)
2. E1 − E0
3. 3,3 · 10-19 Дж
Вариант 2
1. Эрнест Резерфорд
2. E1 − E0/h
3. 3,3 · 10-19 Дж
Опубликовано: 21.01.2020
Обновлено: 16.07.2020
Решение задач по теме «Модель атома Н. Бора»
Задача 1
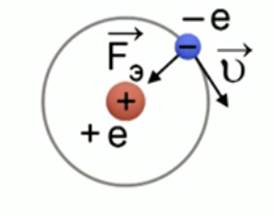
Определите скорость v и ускорение a электрона на первой боровской орбите, радиус которой определяется формулой 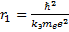
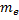
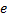
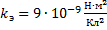
Дано: 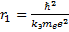
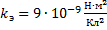
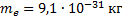
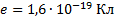
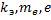
Найти: 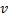
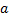
Решение
В формуле радиуса первой боровской орбиты:
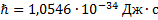
Радиус окружности, по которому происходит движение, равен:
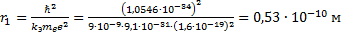
Рис. 1. Иллюстрация к задаче №1
Согласно модели Бора, вокруг ядра атома водорода, заряд которого 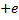
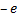
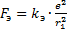
Также эта сила является центростремительной, то есть:
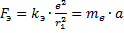
Следовательно, ускорение равно:
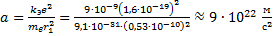
Центростремительное ускорение равно:
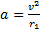
Отсюда скорость равна:
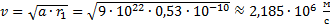
Ответ: 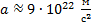
Задача 2
Найти силу электрического тока, который вызывает электрон, двигаясь по первой боровской орбите.
Дано: 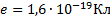
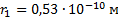
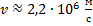
Найти: 
Решение
Известно, что сила тока равна:
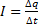
Для данной задачи:
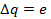
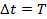
Период обращения электрона равен:
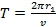
Следовательно, сила тока, возникающего при движении электрона по орбите радиусом 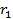
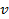
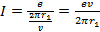
Подставим в данное выражение известные данные:
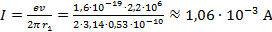
Ответ:
Задача 3
Найти максимальную частоту, максимальную длину волны и максимальный импульс фотона в видимой части спектра, излучённого при переходе электрона на второй энергетический уровень в атоме водорода.
Дано: 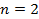
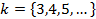
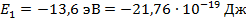
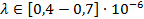
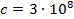
Найти: 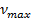
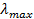
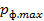
Решение
Согласно второму постулату Бора:
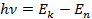
где 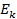
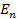
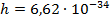
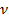
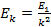
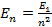
Следовательно, частота излучения фотона равна:
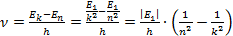
Частота и длина волны связаны следующим соотношением:
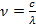
Зная световой диапазон в длинах волн (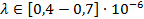
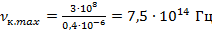
Более высокие частоты относятся к ультрафиолетовой части спектра и человеческим глазом не фиксируются.
Минимальное значение частоты при излучении будет при 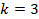
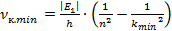
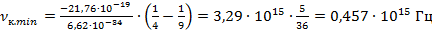
Подставим данное значение в формулу связи между длиной волны и частотой. Если частота минимальная, то значение длины волны будет максимальное:
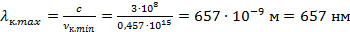
Данное значение входит в световой диапазон – это красная линия в излучении атома водорода.
Для того чтобы вычислить максимальное значение частоты фотона в видимой части спектра, необходимо подставлять значения k от 4-х и выше.
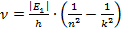
Если подставить значение 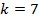
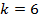
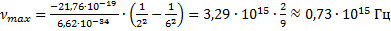
Мы попали в световой диапазон, так как он ограничивается значением 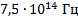
Полученная максимальная частота соответствует минимальной длине волны, равной:
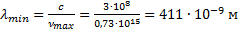
Минимальная длина волны была найдена для определения максимального импульса фотона.
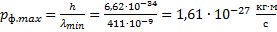
Ответ: ;
;
.