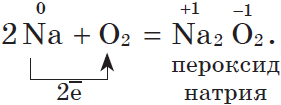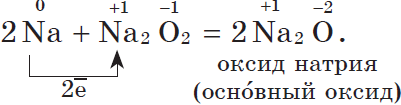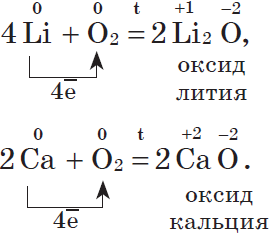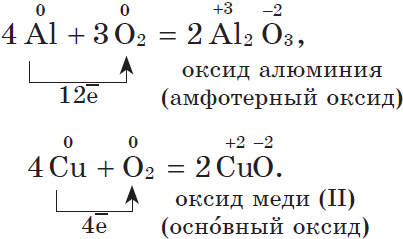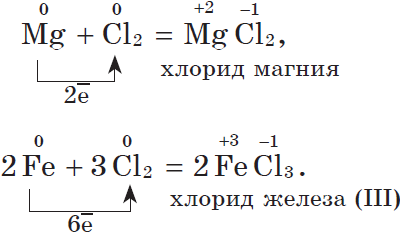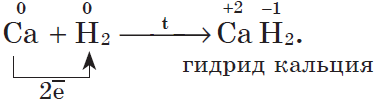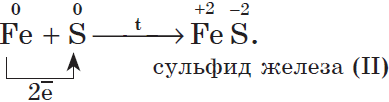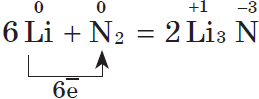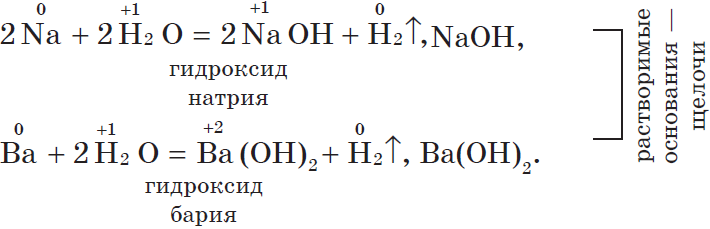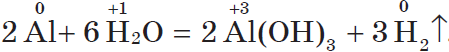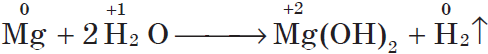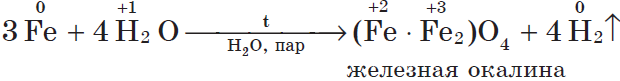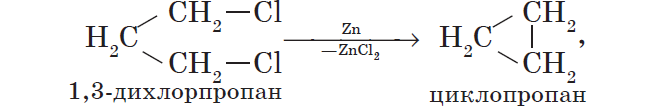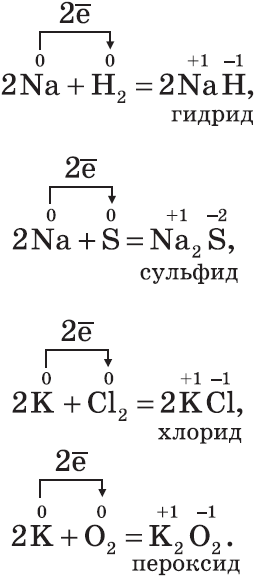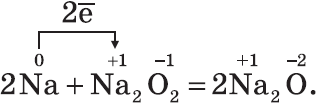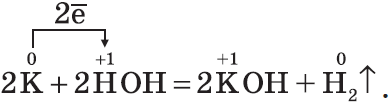Таблицы на ЕГЭ и ОГЭ по химии
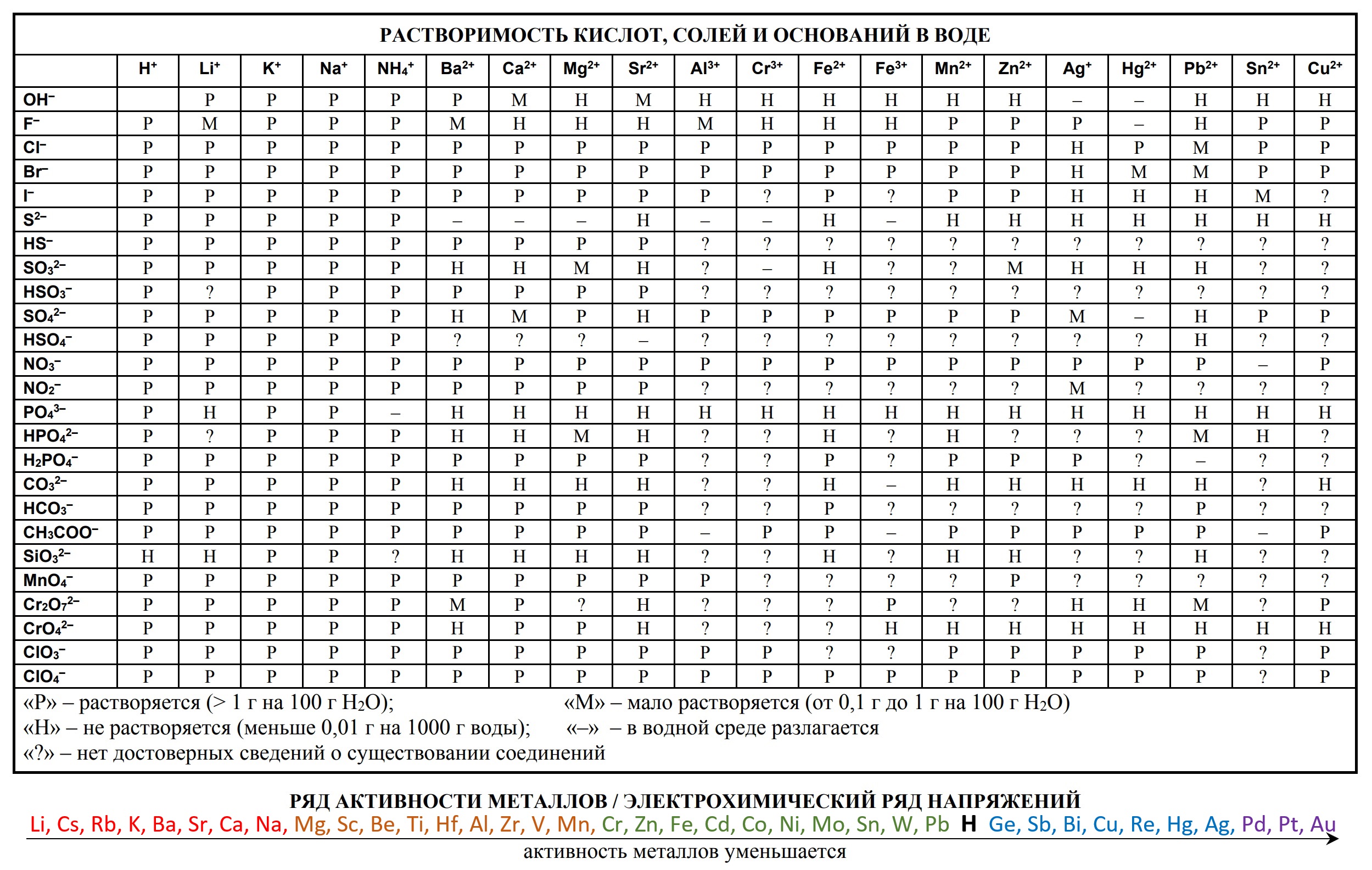
На сдаче ЕГЭ и ОГЭ по химии можно использовать три таблицы:
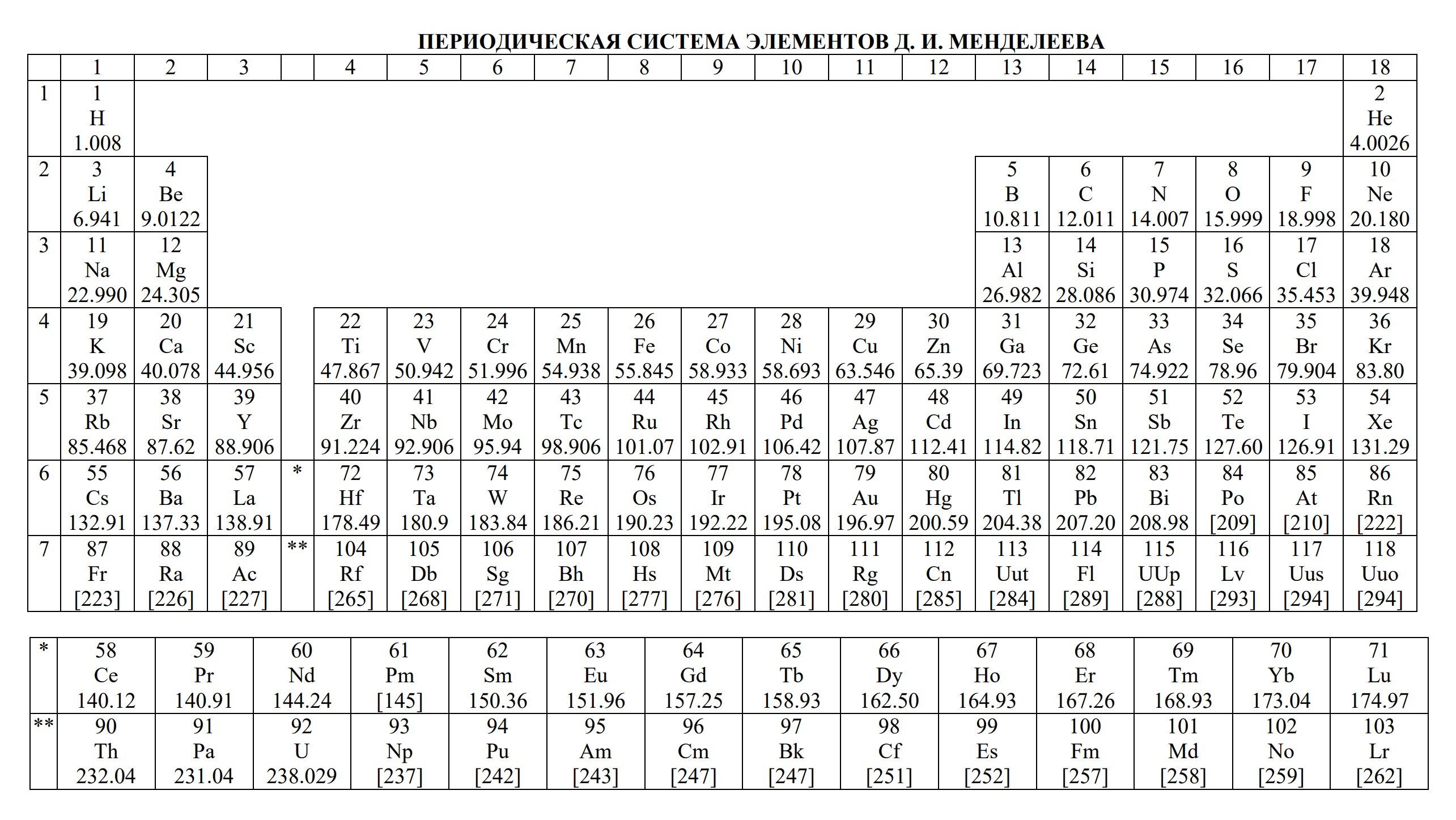
- периодическая система химических элементов Д.И. Менделеева
- таблица растворимости
- ряд активности металлов.
Они содержат в себе 80% информации, необходимой для решения большинства заданий.
Однако таблицы на форзацах разных учебников, продаваемые в книжных магазинах, располагающиеся на просторах интернета отличаются не только оформлением, но и содержанием. Что бы они оказались надёжно шпаргалкой, а не приятной неожиданностью, лучше с самого начала начинать работать с тем форматом, который официально разрешен на ЕГЭ твоего года.
Скачать эти таблицы можно ниже. А как сделать эти безликие таблицы наиболее информационными для тебя я расскажу на уроке.
- Таблица Д.И. Менделеева для ОГЭ и ЕГЭ
- Таблица растворимости и ряд активности для ОГЭ и ЕГЭ
- Таблица растворимости с расширенным рядом активности
- Таблица Д.И. Менделеева длиннопериодная для олимпиады
С развитием производства металлов (простых веществ) и сплавов связано возникновение цивилизации (бронзовый век, железный век).
Начавшаяся примерно $100$ лет назад научно-техническая революция, затронувшая и промышленность, и социальную сферу, также тесно связана с производством металлов. На основе вольфрама, молибдена, титана и других металлов начали создавать коррозионностойкие, сверхтвердые, тугоплавкие сплавы, применение которых сильно расширило возможности машиностроения. В ядерной и космической технике из сплавов вольфрама и рения делают детали, работающие при температурах до $3000°С$; в медицине используют хирургические инструменты из сплавов тантала и платины, уникальной керамики на основе оксидов титана и циркония.
И, конечно же, мы не должны забывать, что в большинстве сплавов используют давно известный металл железо, а основу многих легких сплавов составляют сравнительно «молодые» металлы — алюминий и магний.
Сверхновыми стали композиционные материалы, представляющие, например, полимер или керамику, которые внутри (как бетон железными прутьями) упрочнены металлическими волокнами из вольфрама, молибдена, стали и других металлов и сплавов — все зависит от поставленной цели и необходимых для ее достижения свойств материала.
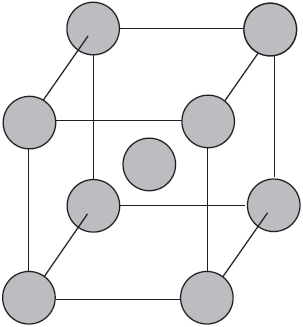
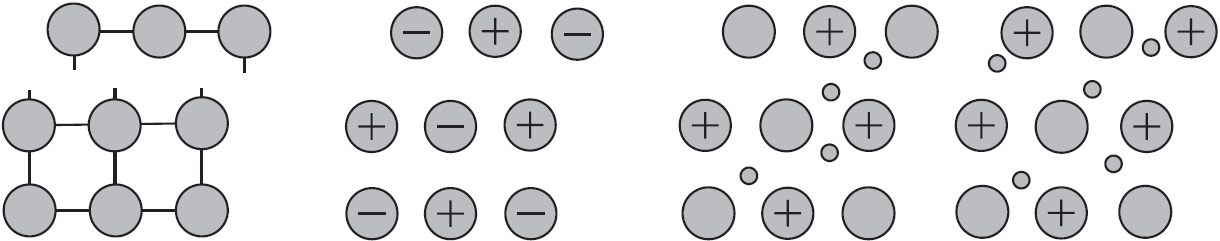
Вы уже имеете представление о природе химической связи в кристаллах металлов. Напомним на примере одного из них — натрия, как она образуется. На рисунке изображена схема кристаллической решетки натрия. В ней каждый атом натрия окружен восемью соседями. У атома натрия, как и у всех металлов, имеется много свободных валентных орбиталей и мало валентных электронов. Электронная формула атома натрия: $1s^{2}2s^{2}2p^{6}3s^{1}3p^{0}3d^{0}$, где $3s, 3p, 3d$ — валентные орбитали.
Единственный валентный электрон атома натрия $3s^1$ может занимать любую из девяти свободных орбиталей — $3s$ (одна), $3р$ (три) и $3d$ (пять), ведь они не очень отличаются по уровню энергии. При сближении атомов, когда образуется кристаллическая решетка, валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются с одной орбитали на другую, осуществляя связь между всеми атомами кристалла металла.
Такую химическую связь называют металлической. Металлическую связь образуют элементы, атомы которых на внешнем слое имеют мало валентных электронов по сравнению с большим числом внешних энергетически близких орбиталей. Их валентные электроны слабо удерживаются в атоме. Электроны, осуществляющие связь, обобществлены и перемещаются по всей кристаллической решетке в целом нейтрального металла.
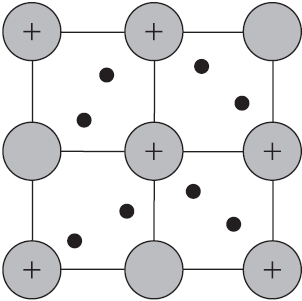
Веществам с металлической связью присущи металлические кристаллические решетки, которые обычно изображают схематически так, как показано на рисунке. Катионы и атомы металлов, расположенные в узлах кристаллической решетки, обеспечивают ее стабильность и прочность (обобществленные электроны изображены в виде черных маленьких шариков).
Металлическая связь — это связь в металлах и сплавах между атомионами металлов, расположенными в узлах кристаллической решетки, осуществляемая обобществленными валентными электронами.
Некоторые металлы кристаллизуются в двух или более кристаллических формах. Это свойство веществ — существовать в нескольких кристаллических модификациях — называют полиморфизмом.
Например, железо имеет четыре кристаллических модификации, каждая из которых устойчива в определенном температурном интервале:
- $α$ — устойчива до $768°С$, ферромагнитная;
- $β$ — устойчива от $768$ до $910°С$, неферромагнитная, т.е. парамагнитная;
- $γ$ — устойчива от $910$ до $1390°С$, неферромагнитная, т.е. парамагнитная;
- $δ$ — устойчива от $1390$ до $1539°С$ ($t°_{пл.} железа), неферромагнитная.
Олово имеет две кристаллические модификации:
- $α$ — устойчива ниже $13,2°С$ ($ρ=5,75 г/см^3$). Это серое олово. Оно имеет кристаллическую решетку типа алмаза (атомную);
- $β$ — устойчива выше $13,2°С$ ($ρ=6,55 г/см^3$). Это белое олово.
Белое олово — серебристо-белый очень мягкий металл. При охлаждении ниже $13,2°С$ он рассыпается в серый порошок, т.к. при переходе $β→α$ значительно увеличивается его удельный объем. Это явление получило название «оловянной чумы».
Конечно, особый вид химической связи и тип кристаллической решетки металлов должны определять и объяснять их физические свойства.
Каковы же они? Это металлический блеск, пластичность, высокая электрическая проводимость и теплопроводность, рост электрического сопротивления при повышении температуры, а также такие значимые свойства, как плотность, высокие температуры плавления и кипения, твердость, магнитные свойства.
Давайте попробуем объяснить причины, определяющие основные физические свойства металлов.
Почему металлы пластичны?
Механическое воздействие на кристалл с металлической кристаллической решеткой вызывает смещение слоев ион-атомов друг относительно друга, а так как электроны перемещаются по всему кристаллу, разрыв связей не происходит, поэтому для металлов характерна большая пластичность.
Аналогичное воздействие на твердое вещество с ковалентными связями (атомной кристаллической решеткой) приводит к разрыву ковалентных связей. Разрыв связей в ионной решетке приводит к взаимному отталкиванию одноименно заряженных ионов. По этому вещества с атомными и ионными кристаллическими решетками хрупкие.
Наиболее пластичные металлы — это $Au, Ag, Sn, Pb, Zn$. Они легко вытягиваются в проволоку, поддаются ковке, прессованию, прокатыванию в листы. Например, из золота можно изготовить золотую фольгу толщиной $0,003$ мм, а из $0,5$ г этого металла можно вытянуть нить длиной $1$ км.
Даже ртуть, которая, как вы знаете, при комнатной температуре жидкая, при низких температурах в твердом состоянии становится ковкой, как свинец. Не обладают пластичностью лишь $Bi$ и $Mn$, они хрупкие.
Почему металлы имеют характерный блеск, а также непрозрачны?
Электроны, заполняющие межатомное пространство, отражают световые лучи (а не пропускают, как стекло), причем большинство металлов в равной степени рассеивают все лучи видимой части спектра. Поэтому они имеют серебристо-белый или серый цвет. Стронций, золото и медь в большей степени поглощают короткие волны (близкие к фиолетовому цвету) и отражают длинные волны светового спектра, поэтому имеют светло-желтый, желтый и медный цвета.
Хотя на практике металл не всегда нам кажется светлым телом. Во-первых, его поверхность может окисляться и терять блеск. Поэтому самородная медь выглядит зеленоватым камнем. А во-вторых, и чистый металл может не блестеть. Очень тонкие листы серебра и золота имеют совершенно неожиданный вид — они имеют голубовато-зеленый цвет. А мелкие порошки металлов кажутся темно-серыми, даже черными.
Наибольшую отражательную способность имеют серебро, алюминий, палладий. Их используют при изготовлении зеркал, в том числе и в прожекторах.
Почему металлы имеют высокую электрическую проводимость и теплопроводны?
Хаотически движущиеся электроны в металле под воздействием приложенного электрического напряжения приобретают направленное движение, т. е. проводят электрический ток. При повышении температуры металла возрастают амплитуды колебаний находящихся в узлах кристаллической решетки атомов и ионов. Это затрудняет перемещение электронов, электрическая проводимость металла падает. При низких температурах колебательное движение, наоборот, сильно уменьшается и электрическая проводимость металлов резко возрастает. Вблизи абсолютного нуля сопротивление у металлов практически отсутствует, у большинства металлов появляется сверхпроводимость.
Следует отметить, что неметаллы, обладающие электрической проводимостью (например, графит), при низких температурах, наоборот, не проводят электрический ток из-за отсутствия свободных электронов. И только с повышением температуры и разрушением некоторых ковалентных связей их электрическая проводимость начинает возрастать.
Наибольшую электрическую проводимость имеют серебро, медь, а также золото, алюминий, наименьшую — марганец, свинец, ртуть.
Чаще всего с той же закономерностью, как и электрическая проводимость, изменяется теплопроводность металлов.
Она обусловлена большой подвижностью свободных электронов, которые, сталкиваясь с колеблющимися ионами и атомами, обмениваются с ними энергией. Происходит выравнивание температуры по всему куску металла.
Механическая прочность, плотность, температура плавления у металлов очень сильно отличаются. Причем с увеличением числа электронов, связывающих ион-атомы, и уменьшением межатомного расстояния в кристаллах показатели этих свойств возрастают.
Так, щелочные металлы ($Li, K, Na, Rb, Cs$), атомы которых имеют один валентный электрон, мягкие, с небольшой плотностью (литий — самый легкий металл с $ρ=0,53 г/см^3$) и плавятся при невысоких температурах (например, температура плавления цезия $29°С$). Единственный металл, жидкий при обычных условиях, — ртуть — имеет температуру плавления, равную $–38,9°С$.
Кальций, имеющий два электрона на внешнем энергетическом уровне атомов, гораздо более тверд и плавится при более высокой температуре ($842°С$).
Еще более прочной является кристаллическая решетка, образованная ионами скандия, который имеет три валентных электрона.
Но самые прочные кристаллические решетки, большие плотности и температуры плавления наблюдаются у металлов побочных подгрупп V, VI, VII, VIII групп. Это объясняется тем, что для металлов побочных подгрупп, имеющих неспаренные валентные электроны на d-подуровне, характерно образование очень прочных ковалентных связей между атомами, помимо металлической, осуществляемой электронами внешнего слоя с $s$-орбиталей.
Вспомните, что самый тяжелый металл — это осмий $Os$ с $ρ=22,5 г/см^3$ (компонент сверхтвердых и износостойких сплавов), самый тугоплавкий металл — это вольфрам $W$ с $t_{пл.}=3420°С$ (применяется для изготовления нитей накаливания ламп), самый твердый металл — это хром $Cr$ (царапает стекло). Они входят в состав материалов, из которых изготавливают металлорежущий инструмент, тормозные колодки тяжелых машин и др.
Металлы по-разному взаимодействуют с магнитным полем. Такие металлы, как железо, кобальт, никель и гадолиний выделяются своей способностью сильно намагничиваться. Их называют ферромагнетиками. Большинство металлов (щелочные и щелочноземельные металлы и значительная часть переходных металлов) слабо намагничиваются и не сохраняют это состояние вне магнитного поля — это парамагнетики. Металлы, выталкиваемые магнитным полем, — диамагнетики (медь, серебро, золото, висмут).
Напомним, что при рассмотрении электронного строения металлов мы разделили металлы на металлы главных подгрупп ($s-$ и $р-$элементы) и металлы побочных подгрупп (переходные $d-$ и $f-$элементы).
В технике принято классифицировать металлы по различным физическим свойствам:
а) плотности — легкие ($ρ < 5 г/см^3$) и тяжелые (все остальные);
б) температуре плавления — легкоплавкие и тугоплавкие.
Железо и его сплавы принято считать черными металлами, а все остальные — цветными.
Существуют классификации металлов по химическим свойствам.
Металлы с низкой химической активностью называют благородными (серебро, золото, платина и ее аналоги — осмий, иридий, рутений, палладий, родий).
По близости химических свойств выделяют щелочные (металлы главной подгруппы I группы), щелочноземельные (кальций, стронций, барий, радий), а также редкоземельные металлы (скандий, иттрий, лантан и лантаноиды, актиний и актиноиды).
Атомы металлов сравнительно легко отдают валентные электроны и переходят в положительно заряженные ионы, т.е. окисляются. В этом, как вам известно, заключается главное общее свойство и атомов, и простых веществ — металлов.
Металлы в химических реакциях всегда восстановители. Восстановительная способность атомов простых веществ — металлов, образованных химическими элементами одного периода или одной главной подгруппы Периодической системы Д.И. Менделеева, изменяется закономерно.
Электрохимический ряд напряжений металлов
Восстановительную активность металла в химических реакциях, которые протекают в водных растворах, отражает его положение в электрохимическом ряду напряжений металлов.
На основании этого ряда напряжений можно сделать следующие важные заключения о химической активности металлов в реакциях, протекающих в водных растворах при стандартных условиях ($t=25°С, р=1 атм$):
- Чем левее стоит металл в этом ряду, тем более сильным восстановителем он является.
- Каждый металл способен вытеснять (восстанавливать) из солей в растворе те металлы, которые в ряду напряжений стоят после него (правее).
- Металлы, находящиеся в ряду напряжений левее водорода, способны вытеснять его из кислот в растворе.
Восстановительная активность металла, определенная по электрохимическому ряду, не всегда соответствует положению его в Периодической системе. Это объясняется тем, что при определении положения металла в ряду напряжений учитывают не только энергию отрыва электронов от отдельных атомов, но и энергию, затрачиваемую на разрушение кристаллической решетки, а также энергию, выделяющуюся при гидратации ионов.
Металлы, являющиеся самыми сильными восстановителями (щелочные и щелочноземельные), в любых водных растворах взаимодействуют прежде всего с водой.
Например, литий более активен в водных растворах, чем натрий (хотя по положению в Периодической системе $Na$ — более активный металл). Дело в том, что энергия гидратации ионов $Li^+$ значительно больше, чем энергия гидратации $Na^+$, поэтому первый процесс является энергетически более выгодным.
Рассмотрев общие положения, характеризующие восстановительные свойства металлов, перейдем к конкретным химическим реакциям.
Взаимодействие металлов с неметаллами
1. С кислородом большинство металлов образуют оксиды — основные и амфотерные. Кислотные оксиды переходных металлов, например оксид хрома (VI) $CrO_3$ или оксид марганца(VII) $Mn_2O_7$, не образуются при прямом окислении металла кислородом. Их получают косвенным путем.
Щелочные металлы $Na, K$ активно реагируют с кислородом воздуха, образуя пероксиды:
Оксид натрия получают косвенным путем, при прокаливании пероксидов с соответствующими металлами:
Литий и щелочноземельные металлы взаимодействуют с кислородом воздуха, образуя основные оксиды:
Другие металлы, кроме золота и платиновых металлов, которые вообще не окисляются кислородом воздуха, взаимодействуют с ним менее активно или при нагревании:
2. С галогенами металлы образуют соли галогеноводородных кислот, например:
3. С водородом самые активные металлы образуют гидриды — ионные солеподобные вещества, в которых водород имеет степень окисления $–1$, например:
Многие переходные металлы образуют с водородом гидриды особого типа — происходит как бы растворение или внедрение водорода в кристаллическую решетку металлов между атомами и ионами, при этом металл сохраняет свой внешний вид, но увеличивается в объеме. Поглощенный водород находится в металле, по-видимому, в атомарном виде.
Существуют и гидриды металлов промежуточного характера.
4. С серой металлы образуют соли — сульфиды, например:
5. С азотом металлы реагируют несколько труднее, т.к. химическая связь в молекуле азота $N_2$ очень прочна; при этом образуются нитриды. При обычной температуре взаимодействует с азотом только литий:
Взаимодействие металлов со сложными веществами
1. С водой. Щелочные и щелочноземельные металлы при обычных условиях вытесняют водород из воды и образуют растворимые основания — щелочи, например:
Другие металлы, стоящие в ряду напряжений до водорода, тоже могут при определенных условиях вытеснять водород из воды. Но алюминий бурно взаимодействует с водой, только если удалить с его поверхности оксидную пленку:
Магний взаимодействует с водой только при кипячении, при этом также выделяется водород:
Если горящий магний внести в воду, то горение продолжается, т.к. протекает реакция: $2H_{2}+O_{2}=2H_2O$ (говорит водород). Железо взаимодействует с водой только в раскаленном виде:
2. С кислотами в растворе ($HCl, H_2SO_{4(разб.)}, CH_3COOH$ и др., кроме $HNO_3$) взаимодействуют металлы, стоящие в ряду напряжений до водорода. При этом образуются соль и водород.
Например:
$2Al↖{0}+6{H}↖{+1}Cl=2Al↖{+3}Cl_{3}+3{H_2}↖{0}↑,$
$2CH_3COO{H}↖{+1}+Mg↖{0}=Mg↖{+2}(CH_3COO)_2+{H_2}↖{0}↑$
А вот свинец (и некоторые другие металлы), несмотря на его положение в ряду напряжений (слева от водорода), почти не растворяется в разбавленной серной кислоте, т.к. образующийся сульфат свинца $PbSO_4$ нерастворим и создает на поверхности металла защитную пленку.
3. С солями менее активных металлов в растворе. В результате такой реакции образуется соль более активного металла и выделяется менее активный металл в свободном виде.
Например:
$Fe↖{0}+{Cu}↖{+2}SO_4=Fe↖{+2}SO_4+Cu↖{0}$
Нужно помнить, что реакция идет в тех случаях, когда образующаяся соль растворима. Вытеснение металлов из их соединений другими металлами впервые подробно изучил Н.Н. Бекетов — крупный русский физико-химик. Он расположил металлы по химической активности в «вытеснительный ряд», ставший прототипом ряда напряжений металлов.
4. С органическими веществами. Взаимодействие с органическими кислотами аналогично реакциям с минеральными кислотами. Спирты же могут проявлять слабые кислотные свойства при взаимодействии со щелочными металлами:
$2C_2H_5O{H}↖{+1}+2{Na}↖{0}→2C_2H_5O{Na}↖{+1}+{H_2}↖{0}↑$.
Аналогично реагирует и фенол:
$2C_6H_5O{H}↖{+1}+2{Na}↖{0}→2C_6H_5O{Na}↖{+1}+{H_2}↖{0}↑$.
Металлы участвуют в реакциях с галогеналканами, которые используют для получения низших циклоалканов и для синтезов, в ходе которых происходит усложнение углеродного скелета молекулы (реакция А. Вюрца):
${2CH_3Cl}↙{хлорметан}+2Na→{C_2H_6}↙{этан}+2NaCl$
5. Со щелочами в растворе взаимодействуют металлы, гидроксиды которых амфотерны.
Например:
$2Al+2KOH+6{H_2}↖{+1}O=2K[Al↖{+3}(OH)_4]+3{H_2}↖{0}↑$.
6. Металлы могут образовывать друг с другом химические соединения, которые получили общее название интерметаллических соединений. В них чаще всего не проявляются степени окисления атомов, которые характерны для соединений металлов с неметаллами. Например:
$Cu_3Au, LaNi_5, Na_2Sb, Ca_3Sb_2$ и др.
Интерметаллические соединения обычно не имеют постоянного состава, химическая связь в них в основном металлическая. Образование этих соединений более характерно для металлов побочных подгрупп.
Химические свойства щелочных металлов ($Na, K$)
Щелочные металлы — это элементы главной подгруппы I группы Периодической системы. На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемуся на большом удалении от ядра. Они легко отдают этот электрон, поэтому являются сильными восстановителями. Во всех соединениях щелочные металлы проявляют степень окисления $+1$. Все они типичные металлы, имеют серебристо-белый цвет, мягкие (режутся ножом), легкие и легкоплавкие. Активно взаимодействуют со всеми неметаллами:
Все щелочные металлы при взаимодействии с кислородом (исключение — $Li$) образуют пероксиды. В свободном виде щелочные металлы не встречаются из-за их высокой химической активности.
Оксиды — твердые вещества, имеют основные свойства. Их получают, прокаливая пероксиды с соответствующими металлами:
Гидроксиды $NaOH, KOH$ — твердые белые вещества, гигроскопичны, хорошо растворяются в воде с выделением теплоты, их относят к щелочам:
Соли щелочных металлов почти все растворимы в воде. Важнейшие из них: $Na_2CO_3$ — карбонат натрия; $Na_2CO_3·10H_2O$ — кристаллическая сода; $NaHCO_3$ — гидрокарбонат натрия, пищевая сода; $K_2CO_3$ — карбонат калия, поташ; $Na_2SO_4·10H_2O$ — глауберова соль; $NaCl$ — хлорид натрия, пищевая соль.
Химические свойства щелочноземельных металлов ($Ca, Mg$)
Кальций ($Ca$) является представителем щелочноземельных металлов, как называют элементы главной подгруппы II группы, но не все, а только начиная с кальция и вниз по группе. Это те химические элементы, которые, взаимодействуя с водой, образуют щелочи. Кальций на внеш нем энергетическом уровне содержит два электрона, степень окисления $+2$.
Физические и химические свойства кальция и его соединений представлены в таблице.
Магний ($Mg$) имеет такое же строение атома, как и кальций, степень его окисления также $+2$. Мягкий металл, но его поверхность на воздухе покрывается защитной пленкой, что немного снижает его химическую активность. Его горение сопровождается ослепительной вспышкой. $MgO$ и $Mg(OH)_2$ проявляют основные свойства. Хотя $Mg(OH)_2$ и малорастворим, но окрашивает раствор фенолфталеина в малиновый цвет.
Оксиды $MgO$ — твердые белые тугоплавкие вещества. В технике $CaO$ называют негашеной известью, а $MgO$ — жженой магнезией, их используют в производстве строительных материалов.
Реакция оксида кальция с водой сопровождается выделением теплоты и называется гашением извести, а образующийся $Ca(OH)_2$ — гашеной известью. Прозрачный раствор гидроксида кальция называется известковой водой, а белая взвесь $Ca(OH)_2$ в воде — известковым молоком.
Соли магния и кальция получают взаимодействием их с кислотами.
$CaCO_3$ — карбонат кальция, мел, мрамор, известняк. Применяется в строительстве. $MgCO_3$ — карбонат магния — применяется в металлургии для освобождения от шлаков. $CaSO_4·2H_2O$ — гипс. $MgSO_4$ — сульфат магния — называют горькой, или английской, солью, содержится в морской воде. $BaSO_4$ — сульфат бария — благодаря нерастворимости и способности задерживать рентгеновские лучи применяется в диагностике («баритовая каша») желудочно-кишечного тракта.
На долю кальция приходится $1,5%$ массы тела человека, $98%$ кальция содержится в костях.
Кальций и его соединения.
| Кальций | Оксид и гидроксид кальция | Соли кальция |
| 1. Серебристо-белый металл. 2. Активный металл, окисляется простыми веществами — неметаллами: $2Ca+O_2=2CaO$ $Ca+Cl_2=CaCl_2$ $Ca+S=CaS$ $Ca+H_2=CaH_2$ 3. Вытесняет водород из воды: $Ca+2H_2O=Ca(OH)_2+H_2↑$ 4. Вытесняет металлы из их оксидов (кальциотермия): $2Ca+ThO_2=Th+2CaO$ Получение Разложение электрическим током расплава хлорида кальция: $CaCl_2=Ca+Cl_2↑$ |
1. Порошки белого цвета. 2. Оксид кальция (негашеная известь) проявляет свойства основного оксида: а) взаимодействует с водой с образованием основания: $CaO+H_2O=Ca(OH)_2$ б) взаимодействует с кислотными оксидами: $CaO+SiO_2=CaSiO_3$ 3. Гидроксид кальция проявляет свойства сильного основания: $Ca(OH)_2=Ca^{2+}+2OH^{–}$ $Ca(OH)*2+CO_2=CaCO_3↓+H_2O$; $Ca(OH)2+Ca(HCO_3)2=2CaCO_3↓+2H_2O$$ Получение 1. Оксида — обжиг известняка: $CaCO_3=CaO+CO_2↑$ 2. Гидроксида — гашение негашеной извести: $CaO+H_2O=Ca(OH)2$ |
1. Образует нерастворимый карбонат: $Ca^{2+}+CO_3^{2−}=CaCO_3↓$ и растворимый гидрокарбонат: $CaCO{3(кр)}+CO_2+H_2O=Ca(HCO_3){2(р-р)}$ 2. Образует нерастворимый фосфат: $3Сa{2+}+2PO_4^{3−}=Ca_3(PO_4)2↓$ и растворимый дигидрофосфат: $Ca_3(PO_4){2(кр)}+4H_3PO_4=3Ca(H_2PO_4)*{2(р-р)}$ 3. Гидрокарбонат разлагается при кипячении или испарении раствора: $Ca(HCO_3)*2=CaCO_3↓+CO_2↑+H_2O$ 4. Обожженный природный гипс: $CaSO_4·2H_2O=CaSO_4·0,5H_2O+1,5H_2O$ затвердевает при взаимодействии с водой, снова образуя кристаллогидрат: $CaSO_4·0,5H_2O+1,5H_2O=CaSO_4·2H_2O$ |
Химические свойства алюминия
Алюминий ($Al$) — элемент главной подгруппы III группы Периодической системы. У него на внешнем энергетическом уровне три электрона, которые алюминий легко отдает при химических взаимодействиях. У атомов алюминия восстановительные свойства выражены ярче, чем у бора, т.к. у алюминия имеется промежуточный слой с восемью электронами ($2e↖{-}; 8e↖{-}; 3e↖{-}$), который препятствует притяжению электронов к ядру. Алюминий имеет степень окисления $+3$.
Алюминий — серебристо-белый металл, $t°*{пл}=660°С$. Это самый распространенный металл земной коры, обладает высокой коррозионной стойкостью. Малая плотность алюминия ($2,7 г/{см^3}$) в сочетании с высокой прочностью и пластичностью его сплавов делают алюминий незаменимым в самолетостроении. Высокая электропроводность алюминия (в $1.6$ раза меньше, чем у меди) позволяет заменять медные провода более легкими — алюминиевыми.
Высокая химическая активность алюминия используется в алюминотермии, с помощью которой получают хром, ванадий, титан и другие металлы.
Прочность химической связи в оксиде $Al_2O_3$ обуславливает его механическую прочность, твердость. $Al_2O_3$ — корунд, абразивный материал. Искусственный рубин — $Al_2O_3$ с добавлением оксида хрома. Химические свойства алюминия и его соединений обобщены в таблице.
Алюминий и его соединения.
| Алюминий | Соединения алюминия | |
| Оксид алюминия | Гидроксид алюминия | |
| 1. Серебристо-белый легкий металл. 2. Окисляется на воздухе с образованием защитной пленки: $4Al+3O_2=2Al_2O_3$ 3. Вытесняет водород из воды: $2Al+6H_2O=2Al(OH)_3↓+3H_2↑$ 4. Взаимодействует с кислотами: $2Al^{0}+6H^{+}=2Al^{3+}+3H_2^0{↑}$ 5. Взаимодействует с водным раствором щелочи: $2Al+2H_2O+2NaOH=2NaAlO_2+3H_2{↑}$ 6. Вытесняет металлы из их оксидов (алюминотермия): $8Al+3Fe_3O_4=9Fe+4Al_2O_3+Q$ Получение Разложение электрическим током расплава оксида алюминия (в криолите): $2Al_2O_3=4Al+3O_2{↑}–3352 кДж$ |
1. Очень твердый порошок белого цвета 2. Амфотерный оксид, взаимодействует: а) с кислотами: $Al_2O_3+6H^{+}=2Al^{3+}+3H_2O$ б) со щелочами: $Al_2O_3+2OH^{–}=2AlO_2^{−}+H_2O$ Образуется: а) при окислении или горении алюминия на воздухе: $4Al+3O_2=2Al_2O_3$ б) в реакции алюминотермии: $2Al+Fe_2O_3=Al_2O_3+2Fe$; в) при термическом разложении гидроксида алюминия: $2Al(OH)_3=Al_2O_3+3H_2O$ |
1. Белый нерастворимый в воде порошок. 2. Проявляет амфотерные свойства, взаимодействует: а) с кислотами: $Al(OH)_3+3HCl=AlCl_3+3H_2O$ $Al(OH)_3+3H^{+}=Al^{3+}+3H_2O$ б) со щелочами: $Al(OH)_3+NaOH=NaAlO_2+2H_2O$ $Al(OH)_3+OH^{–}=AlO_2^{−}+2H_2O$ 3. Разлагается при нагревании: $2Al(OH)_3=Al_2O_3+3H_2O$ Образуется при: а) взаимодействии растворов солей алюминия с растворами щелочей (без избытка): $Al^{3+}+3OH^{–}=Al(OH)_3↓$ б) взаимодействии алюминатов с кислотами (без избытка): $AlO_2^{−}+H^{+}+H_2O=Al(OH)*3↓$ Соли алюминия в водных растворах гидролизуются: $Al^{3+}+H_2O⇄AlOH^{2+}+H^{+}$ $AlOH^{2+}+H_2O⇄Al(OH)2^{+}+H^{+}$ $Al(OH)2^{+}+H_2O⇄Al(OH){3}+H^{+}$ |
Химические свойства меди
Медь ($Cu$) — элемент побочной подгруппы первой группы. Электронная формула: ($…3d^{10}4s^1$). Десятый d-электрон атома меди подвижный, т. к. переместился с $4s$-подуровня. Медь в соединениях проявляет степени окисления $+1(Cu_2O)$ и $+2(CuO)$.
Медь — мягкий, блестящий металл, имеющий красную окраску, ковкий и обладает хорошими литейными качествами, хороший тепло- и электропроводник. Температура плавления $1083°С$.
Как и другие металлы побочной подгруппы I группы Периодической системы, медь стоит в ряду активности правее водорода и не вытесняет его из кислот, но реагирует с кислотами-окислителями:
$Cu+2H_2SO{4(конц.)}=CuSO_4+SO_2↑+2H_2O$;
$Cu+4HNO*{3(конц.)}=Cu(NO_3)_2+2NO_2↑+2H_2O$.
Под действием щелочей на растворы солей меди выпадает осадок слабого основания голубого цвета — гидроксида меди (II), который при нагревании разлагается на основный оксид $CuO$ черного цвета и воду:
$Cu^{2+}+2OH^{–}=Cu(OH)_2↓; Cu(OH)_2 {→}↖{t°} CuO+H_2O$
Химические свойства цинка
Цинк ($Zn$) — элемент побочной подгруппы II группы. Его электронная формула следующая: ($…3d^{10}4s^2$). Так как в атомах цинка предпоследний $d-$подуровень полностью завершен, то цинк в соединениях проявляет степень окисления $+2$.
Цинк — металл серебристо-белого цвета, практически не изменяющийся на воздухе. Обладает коррозионной стойкостью, что объясняется наличием на его поверхности оксидной пленки.
Цинк — один из активнейших металлов, при повышенной температуре реагирует с простыми веществами:
$Zn+Cl_2→↖{t°}ZnCl_2$,
$2Zn+O_2→↖{t°}2ZnO$,
$Zn+S→↖{t°}ZnS$.
Цинк вытесняет водород из кислот:
$Zn+2Н^{+}=Zn^{2+}+H_2↑$
Гидроксид цинка амфотерен, т. е. проявляет свойства и кислоты, и основания. При постепенном приливании раствора щелочи к раствору соли цинка выпавший вначале осадок растворяется (то же происходит и с алюминием):
$ZnSO_4+2NaOH={Zn(OH)_2}↙{белый}↓+Na_2SO_4$,
$Zn(OH)*2+2NaOH={Na_2[Zn(OH)4]}↙{тетрагидроксоцинкат натрия}$
Химические свойства хрома
На примере хрома ($Cr$) можно показать, что свойства переходных элементов меняются вдоль периода не принципиально: происходит количественное изменение, связанное с изменением числа электронов на валентных орбиталях. Максимальная степень окисления хрома $+6$. Металл в ряду активности стоит левее водорода и вытесняет его из кислот:
$Cr+2H^{+}=Cr^{2+}+H{2}↑$.
При добавлении раствора щелочи к такому раствору образуется осадок $Me(OH)2$, который быстро окисляется кислородом воздуха:
$4Cr(OH)2+O_2+2H_2O=4Cr(OH)3$.
Ему соответствует амфотерный оксид $Cr_2O_3$. Оксид и гидроксид хрома (в высшей степени окисления) проявляют свойства кислотных оксидов и кислот соответственно. Соли хромовой кислоты ($H_2CrO_4$) в кислой среде превращаются в дихроматы — соли дихромовой кислоты ($H_2Cr_2O_7$). Окисление сопровождается изменением окраски, т.к. соли хроматы желтого цвета, а дихроматы — оранжевого.
$2CrO_4^{2-}+H^{+}⇄Cr_2O_7^{2-}+H_2O$
Соединения хрома обладают высокой окислительной способностью.
*
По теме: методические разработки, презентации и конспекты
Конспект урока по теме:»Металлы, их положение в Периодической системе, строение атомов металлов. Общие физические свойства металлов.»
План — конспект урока разработан для учащихся 9 класса на основе Примерной программы по химии для основной школы и на основе программы авторского курса химии для 8-11 классов О.С. Габриеляна (в …
Урок по химии в 9 классе. Тема: «Общие химические свойства металлов. Взаимодействие металлов со сложными веществами. Электрохимический ряд напряжений металлов».
Урок по химии в 9 классе. Тема: «Общие химические свойства металлов. Взаимодействие металлов со сложными веществами. Электрохимический ряд напряжений металлов».
Цели урока учебные, воспитательные и р…
Влияние тяжелых металлов на активность фермента каталазы
Презентация, позволит разнообразить урок…
Влияние тяжелых металлов на активность фермента каталазы
Экологический проект…
План урока химии по теме «Положение металлов в Периодической системе химических элементов Д.И. Менделеева, строение их атомов. Строение металлов – простых веществ. Физические свойства металлов».
План урока № 62 (9кл). Положение металлов в Периодической системе химических элементов Д.И. Менделеева, строение их атомов. Строение металлов – простых веществ. Физические свойства металлов….
«Общие химические свойства металлов. Ряд активности». разработка урока
Тип урока: урок изучения нового материалаВид урока: мультимедийныйЦель урока: систематизировать сведения о химических свойствах металлов, рассмотренных при изучении материала курса химии 8,9 классов, …
Электрохимический ряд активности металлов
Помощь в подготовке к выпускным и переводным экзаменам….
Ряд активности металлов, когда им пользоваться
Ряд напряжений (ряд активности или электрохимический ряд напряжения ЭХРН) металлов используется на практике для относительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе.
ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ МЕТАЛЛОВ
Восстановительная активность металлов (свойство отдавать электроны) уменьшается, а окислительная способность их катионов (свойство присоединять электроны) увеличивается в указанном ряду слева направо.
- Металлы, стоящие левее, являются более сильными восстановителями, чем металлы, расположенные правее: они вытесняют последние из растворов солей. Например, взаимодействие Zn + Cu 2+ → Zn 2+ + Cu возможно только в прямом направлении. Цинк вытесняет медь из водного раствора её соли. При этом цинковая пластинка растворяется, а металлическая медь выделяется из раствора.
- Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот-неокислителей; наиболее активные металлы (до алюминия включительно) — и при взаимодействии с водой.
- Металлы, стоящие в ряду правее водорода, с водными растворами кислот-неокислителей при обычных условиях не взаимодействуют.
- При электролизе металлы, стоящие правее водорода, выделяются на катоде; восстановление металлов умеренной активности сопровождается выделением водорода; наиболее активные металлы (до алюминия) невозможно при обычных условиях выделить из водных растворов солей.
Источник
Ряд активности металлов
Электрохимический ряд активности металлов (ряд напряжений, ряд стандартных электродных потенциалов) — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ 0 , отвечающих полуреакции восстановления катиона металла Me n+ : Me n+ + nē → Me
Практическое использование ряда активности металлов
Ряд напряжений используется на практике для сравнительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе:
- Металлы, стоящие левее водорода, являются более сильными восстановителями, чем металлы, расположенные правее: они вытесняют последние из растворов солей. Например, взаимодействие Zn + Cu 2+ → Zn 2+ + Cu возможно только в прямом направлении.
- Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот-неокислителей; наиболее активные металлы (до алюминия включительно) — и при взаимодействии с водой.
- Металлы, стоящие в ряду правее водорода, с водными растворами кислот-неокислителей при обычных условиях не взаимодействуют.
- При электролизе металлы, стоящие правее водорода, выделяются на катоде; восстановление металлов умеренной активности сопровождается выделением водорода; наиболее активные металлы (до алюминия) невозможно при обычных условиях выделить из водных растворов солей.
Источник
Ряд напряжений и химические свойства металлов
Ряд напряжений и химические свойства металлов
Изучая курс общей и неорганической химии мы с вами упустили очень важную тему, на который постоянно ссылаемся при изучении свойств простых веществ и их соединений, но ни разу не пояснили что это такое и почему именно так, а не иначе. Речь сегодня пойдет про ряд напряжений и химические свойства металлов. Понять, что в заданиях ЕГЭ по химии нет прямого вопроса по этой теме, но без знания и понимая электрохимического ряда вы не сможете ответить на многие вопросы правильно. Давайте разбираться вместе

Вы наверняка знаете, что атомы типичных металлов могут отдавать электроны (не принимать, а только отдавать, они – доноры). Поэтому металлы в виде простых веществ в химических реакциях играют роль восстановителей. В случае действия сильных окислителей и при соблюдении определенных условий (к примеру нагревании) практически любой металл может быть окислен до положительной степени окисления.
Различная восстановительная способность металлов дает возможность разместить их в так называемый ряд напряжений и как его еще называют электрохимический ряд металлов. В этом ряду металлы располагаются в порядке уменьшения их восстановительных свойств и возрастания окислительных свойств соответствующих гидратированных катионов (посмотрите внимательно на таблицу, которые есть в любом справочнике)
Таким образом, мы видим, что в ряду напряжений слева располагаются металлы, которые вступая в реакцию с водными растворами будут проявлять сильные восстановительные свойства. Напротив, ионы, которые образуются при окислении этих металлов, будут проявлять слабые окислительные свойства. Поэтому такие металлы легко окисляются, а отвечающие им ионы трудно восстанавливаются.
Расположение металла в ряду напряжений определяет процесс окисления металла с образованием гидратированного иона, соответствующего низшей устойчивой в водном растворе степени окисления данного металла.
Данный металл может восстанавливать из растворов их соей металлы, которые расположены справа от него в ряду напряжений. Иными словами, металл левее вытесняет из солей металл, который находится правее него.
Металлы, расположенные в электрохимическом ряду правее водорода, не могут замещать его в молекулах кислот. Эти металлы хоть и реагируют с кислотами, которые обладают сильными окислительными свойствами, но в ходе реакции выделения водорода не будет (вспоминайте предыдущую нашу статью, какие продукты реакции будут в этом случае?).
Металлы, которые у нас расположены в ряду напряжений слева от водорода, могут вступать в реакции замещения с кислотами, вытесняя из последних водород. При этом помним, что ЭДС на основании которого и устанавливается расположение металла и водорода в ряду, измеряется в строго определенных условиях.

От чего же зависит положение металла в ряд?
- От энергии ионизации атома металла.
- От энергии гидратации, получаемого иона.
- От заряда иона.
- От размеров иона.
Рассмотрим теперь кто у нас в ряду напряжений из щелочных металлов стоит первым? Правильно, литий, но почему не цезий? Ведь, по логике он электрон отдает намного быстрее, чем литий. Но мы с вами вспоминаем правило выше, которое вы должны запомнить очень хорошо: ряд напряжений отражает процесс окисления металла с образованием гидратированного иона. Чем лучше и быстрее протекает процесс окисления, тем левее будет находится металл в электрохимическом ряду.
Вернемся к нашему коварному литию. В его случае имеет значение высокая энергия гидратации иона. Маленький размер приводит к притягиванию отрицательных концов полярных молекул воды гораздо сильнее, нежели у более «громоздкого» цезия, так как расстояние между центрами отрицательного и положительного зарядов в случае лития будет меньше. В итоге общий процесс (отдача электронов с последующей гидратацией полученного иона) энергетически более выгоден у лития чем у цезия.
Окисление металлов водой и раствором щелочей
Вытеснять водород из воды в состоянии только те металлы, которые стоят в ряду напряжений перед кадмием, но тут есть нюансы: ввиду ограничений кинетических порядков (образование нерастворимой в воде оксидной пленки тех же амфотерных металлов) при комнатной температуре в реакцию с водой вступают только щелочные и щелочноземельные металлы.
А вот металлы, располагающиеся правее в ряду, могут восстанавливать водород до воды при нагревании. К примеру магний, измельченный в порошок, реагирует с горячей водой, а алюминий, тоже в виде порошка реагирует с кипящей водой.
А такие металлы как цинк и алюминий могут восстанавливать водород даже из раствора щелочи:
По какому же принципу тот или иной металл растворяется в щелочи? Как это можно определить?
- Металл должен быть сильным восстановителем и окисляться ионами водорода даже в малых концентрациях последних, находящихся в растворе щелочей.
- Ион металла в степени окисления до которой он окисляется ионами водорода, образует в щелочном растворе растворимое соединение.
Мы должны всегда помнить, что восстановительные свойства металлов в одной и безводной среде могут отличаться. А значит и порядок расположения металлов исходя из их восстановительной способности отличается. К примеру, в безводной среде сильным восстановителем будет цезий, а в водной среде – литий.
Источник
Свойства простых веществ — металлов и неметаллов
Теория к заданию 6 из ЕГЭ по химии
Характерные химические свойства простых веществ — металлов: щелочных, щелочноземельных, алюминия, переходных металлов — меди, цинка, хрома, железа
Простые вещества — металлы
С развитием производства металлов (простых веществ) и сплавов связано возникновение цивилизации (бронзовый век, железный век).
Начавшаяся примерно $100$ лет назад научно-техническая революция, затронувшая и промышленность, и социальную сферу, также тесно связана с производством металлов. На основе вольфрама, молибдена, титана и других металлов начали создавать коррозионностойкие, сверхтвердые, тугоплавкие сплавы, применение которых сильно расширило возможности машиностроения. В ядерной и космической технике из сплавов вольфрама и рения делают детали, работающие при температурах до $3000°С$; в медицине используют хирургические инструменты из сплавов тантала и платины, уникальной керамики на основе оксидов титана и циркония.
И, конечно же, мы не должны забывать, что в большинстве сплавов используют давно известный металл железо, а основу многих легких сплавов составляют сравнительно «молодые» металлы — алюминий и магний.
Сверхновыми стали композиционные материалы, представляющие, например, полимер или керамику, которые внутри (как бетон железными прутьями) упрочнены металлическими волокнами из вольфрама, молибдена, стали и других металлов и сплавов — все зависит от поставленной цели и необходимых для ее достижения свойств материала.
Вы уже имеете представление о природе химической связи в кристаллах металлов. Напомним на примере одного из них — натрия, как она образуется. На рисунке изображена схема кристаллической решетки натрия. В ней каждый атом натрия окружен восемью соседями. У атома натрия, как и у всех металлов, имеется много свободных валентных орбиталей и мало валентных электронов. Электронная формула атома натрия: $1s^<2>2s^<2>2p^<6>3s^<1>3p^<0>3d^<0>$, где $3s, 3p, 3d$ — валентные орбитали.
Единственный валентный электрон атома натрия $3s^1$ может занимать любую из девяти свободных орбиталей — $3s$ (одна), $3р$ (три) и $3d$ (пять), ведь они не очень отличаются по уровню энергии. При сближении атомов, когда образуется кристаллическая решетка, валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются с одной орбитали на другую, осуществляя связь между всеми атомами кристалла металла.
Такую химическую связь называют металлической. Металлическую связь образуют элементы, атомы которых на внешнем слое имеют мало валентных электронов по сравнению с большим числом внешних энергетически близких орбиталей. Их валентные электроны слабо удерживаются в атоме. Электроны, осуществляющие связь, обобществлены и перемещаются по всей кристаллической решетке в целом нейтрального металла.
Веществам с металлической связью присущи металлические кристаллические решетки, которые обычно изображают схематически так, как показано на рисунке. Катионы и атомы металлов, расположенные в узлах кристаллической решетки, обеспечивают ее стабильность и прочность (обобществленные электроны изображены в виде черных маленьких шариков).
Металлическая связь — это связь в металлах и сплавах между атомионами металлов, расположенными в узлах кристаллической решетки, осуществляемая обобществленными валентными электронами.
Некоторые металлы кристаллизуются в двух или более кристаллических формах. Это свойство веществ — существовать в нескольких кристаллических модификациях — называют полиморфизмом.
Например, железо имеет четыре кристаллических модификации, каждая из которых устойчива в определенном температурном интервале:
- $α$ — устойчива до $768°С$, ферромагнитная;
- $β$ — устойчива от $768$ до $910°С$, неферромагнитная, т.е. парамагнитная;
- $γ$ — устойчива от $910$ до $1390°С$, неферромагнитная, т.е. парамагнитная;
- $δ$ — устойчива от $1390$ до $1539°С$ ($t°_ <пл.>железа), неферромагнитная.
Олово имеет две кристаллические модификации:
- $α$ — устойчива ниже $13,2°С$ ($ρ=5,75 г/см^3$). Это серое олово. Оно имеет кристаллическую решетку типа алмаза (атомную);
- $β$ — устойчива выше $13,2°С$ ($ρ=6,55 г/см^3$). Это белое олово.
Белое олово — серебристо-белый очень мягкий металл. При охлаждении ниже $13,2°С$ он рассыпается в серый порошок, т.к. при переходе $β→α$ значительно увеличивается его удельный объем. Это явление получило название «оловянной чумы».
Конечно, особый вид химической связи и тип кристаллической решетки металлов должны определять и объяснять их физические свойства.
Каковы же они? Это металлический блеск, пластичность, высокая электрическая проводимость и теплопроводность, рост электрического сопротивления при повышении температуры, а также такие значимые свойства, как плотность, высокие температуры плавления и кипения, твердость, магнитные свойства.
Давайте попробуем объяснить причины, определяющие основные физические свойства металлов.
Механическое воздействие на кристалл с металлической кристаллической решеткой вызывает смещение слоев ион-атомов друг относительно друга, а так как электроны перемещаются по всему кристаллу, разрыв связей не происходит, поэтому для металлов характерна большая пластичность.
Аналогичное воздействие на твердое вещество с ковалентными связями (атомной кристаллической решеткой) приводит к разрыву ковалентных связей. Разрыв связей в ионной решетке приводит к взаимному отталкиванию одноименно заряженных ионов. По этому вещества с атомными и ионными кристаллическими решетками хрупкие.
Наиболее пластичные металлы — это $Au, Ag, Sn, Pb, Zn$. Они легко вытягиваются в проволоку, поддаются ковке, прессованию, прокатыванию в листы. Например, из золота можно изготовить золотую фольгу толщиной $0,003$ мм, а из $0,5$ г этого металла можно вытянуть нить длиной $1$ км.
Даже ртуть, которая, как вы знаете, при комнатной температуре жидкая, при низких температурах в твердом состоянии становится ковкой, как свинец. Не обладают пластичностью лишь $Bi$ и $Mn$, они хрупкие.
Почему металлы имеют характерный блеск, а также непрозрачны?
Электроны, заполняющие межатомное пространство, отражают световые лучи (а не пропускают, как стекло), причем большинство металлов в равной степени рассеивают все лучи видимой части спектра. Поэтому они имеют серебристо-белый или серый цвет. Стронций, золото и медь в большей степени поглощают короткие волны (близкие к фиолетовому цвету) и отражают длинные волны светового спектра, поэтому имеют светло-желтый, желтый и медный цвета.
Хотя на практике металл не всегда нам кажется светлым телом. Во-первых, его поверхность может окисляться и терять блеск. Поэтому самородная медь выглядит зеленоватым камнем. А во-вторых, и чистый металл может не блестеть. Очень тонкие листы серебра и золота имеют совершенно неожиданный вид — они имеют голубовато-зеленый цвет. А мелкие порошки металлов кажутся темно-серыми, даже черными.
Наибольшую отражательную способность имеют серебро, алюминий, палладий. Их используют при изготовлении зеркал, в том числе и в прожекторах.
Почему металлы имеют высокую электрическую проводимость и теплопроводны?
Хаотически движущиеся электроны в металле под воздействием приложенного электрического напряжения приобретают направленное движение, т. е. проводят электрический ток. При повышении температуры металла возрастают амплитуды колебаний находящихся в узлах кристаллической решетки атомов и ионов. Это затрудняет перемещение электронов, электрическая проводимость металла падает. При низких температурах колебательное движение, наоборот, сильно уменьшается и электрическая проводимость металлов резко возрастает. Вблизи абсолютного нуля сопротивление у металлов практически отсутствует, у большинства металлов появляется сверхпроводимость.
Следует отметить, что неметаллы, обладающие электрической проводимостью (например, графит), при низких температурах, наоборот, не проводят электрический ток из-за отсутствия свободных электронов. И только с повышением температуры и разрушением некоторых ковалентных связей их электрическая проводимость начинает возрастать.
Наибольшую электрическую проводимость имеют серебро, медь, а также золото, алюминий, наименьшую — марганец, свинец, ртуть.
Чаще всего с той же закономерностью, как и электрическая проводимость, изменяется теплопроводность металлов.
Она обусловлена большой подвижностью свободных электронов, которые, сталкиваясь с колеблющимися ионами и атомами, обмениваются с ними энергией. Происходит выравнивание температуры по всему куску металла.
Механическая прочность, плотность, температура плавления у металлов очень сильно отличаются. Причем с увеличением числа электронов, связывающих ион-атомы, и уменьшением межатомного расстояния в кристаллах показатели этих свойств возрастают.
Так, щелочные металлы ($Li, K, Na, Rb, Cs$), атомы которых имеют один валентный электрон, мягкие, с небольшой плотностью (литий — самый легкий металл с $ρ=0,53 г/см^3$) и плавятся при невысоких температурах (например, температура плавления цезия $29°С$). Единственный металл, жидкий при обычных условиях, — ртуть — имеет температуру плавления, равную $–38,9°С$.
Кальций, имеющий два электрона на внешнем энергетическом уровне атомов, гораздо более тверд и плавится при более высокой температуре ($842°С$).
Еще более прочной является кристаллическая решетка, образованная ионами скандия, который имеет три валентных электрона.
Но самые прочные кристаллические решетки, большие плотности и температуры плавления наблюдаются у металлов побочных подгрупп V, VI, VII, VIII групп. Это объясняется тем, что для металлов побочных подгрупп, имеющих неспаренные валентные электроны на d-подуровне, характерно образование очень прочных ковалентных связей между атомами, помимо металлической, осуществляемой электронами внешнего слоя с $s$-орбиталей.
Вспомните, что самый тяжелый металл — это осмий $Os$ с $ρ=22,5 г/см^3$ (компонент сверхтвердых и износостойких сплавов), самый тугоплавкий металл — это вольфрам $W$ с $t_<пл.>=3420°С$ (применяется для изготовления нитей накаливания ламп), самый твердый металл — это хром $Cr$ (царапает стекло). Они входят в состав материалов, из которых изготавливают металлорежущий инструмент, тормозные колодки тяжелых машин и др.
Металлы по-разному взаимодействуют с магнитным полем. Такие металлы, как железо, кобальт, никель и гадолиний выделяются своей способностью сильно намагничиваться. Их называют ферромагнетиками. Большинство металлов (щелочные и щелочноземельные металлы и значительная часть переходных металлов) слабо намагничиваются и не сохраняют это состояние вне магнитного поля — это парамагнетики. Металлы, выталкиваемые магнитным полем, — диамагнетики (медь, серебро, золото, висмут).
Напомним, что при рассмотрении электронного строения металлов мы разделили металлы на металлы главных подгрупп ($s-$ и $р-$элементы) и металлы побочных подгрупп (переходные $d-$ и $f-$элементы).
В технике принято классифицировать металлы по различным физическим свойствам:
Источник
Ряд напряжений (ряд активности или электрохимический ряд напряжения ЭХРН) металлов используется на практике для относительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе.

ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ МЕТАЛЛОВ
Восстановительная активность металлов (свойство отдавать электроны) уменьшается, а окислительная способность их катионов (свойство присоединять электроны) увеличивается в указанном ряду слева направо.
-
Металлы, стоящие левее, являются более сильными восстановителями, чем металлы, расположенные правее: они вытесняют последние из растворов солей. Например, взаимодействие Zn + Cu
2+
→ Zn
2+
+ Cu возможно только в прямом направлении. Цинк вытесняет медь из водного раствора её соли. При этом цинковая пластинка растворяется, а металлическая медь выделяется из раствора. - Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот-неокислителей; наиболее активные металлы (до алюминия включительно) — и при взаимодействии с водой.
- Металлы, стоящие в ряду правее водорода, с водными растворами кислот-неокислителей при обычных условиях не взаимодействуют.
-
При электролизе металлы, стоящие правее водорода, выделяются на катоде; восстановление металлов умеренной активности сопровождается выделением водорода; наиболее активные металлы (до алюминия) невозможно при обычных условиях выделить из водных растворов солей.
Катодный процесс
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
-
оксид образует только литий
4Li + O2 = 2Li2O
-
натрий образует пероксид
2Na + O2 = Na2O2
-
калий, рубидий и цезий — надпероксид
K + O2 = KO2
Остальные металлы с кислородом образуют оксиды:
2Mg + O2 = 2MgO
2Al + O2 = Al2O3
2Zn + O2 = 2ZnO (при нагревании)
4Cr + 3O2 = 2Cr2O3
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
4Fe + 3O2 (воздух) + 6H2O(влага) = 4Fe(OH)3
С галогенами металлы образуют галогениды:
2Na + Cl2 = 2NaCl
Mg + Cl2 = MgCl2
2Al + 3Br2 = 2AlBr3
Zn + Cl2 =ZnCl2
2Cr + 3Cl2 = 2CrCl3
Медный порошок реагирует с хлором и бромом (в эфире):
Cu + Cl2 = CuCl2
Cu + Br2 = CuBr2
При взаимодействии с водородом образуются гидриды:
2Na + H2 = 2NaH
Ca + H2 +СaH2
Zn + H2 =ZnH2
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
2K + S = K2S
Сa + S = CaS
2Al + 3S = Al2S3
2Cr + 3S = Cr2S3
Cu +S = CuS
Реакции с фосфором протекают до образования фосфидов (при нагревании):
3K + P = K3P
3Mg + 2P = Mg3P2
3Zn + 2P = Zn3P2
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
2Li + 2C = Li2C2
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
Ca + 2C = CaC2
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
6Li + N2 = 2Li3N
3Mg + N2 = Mg3N2
2Al + N2 = 2AlN
2Cr + N2 = 2CrN
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
2Li + 2H2O = 2LiOH + H2
Ca + 2H2O = Ca(OH)2 + H2
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Cr + H2O = Cr2O3 + H2
Zn + H2O = ZnO + H2
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Металлы IА группы:
2K + H2SO4 (раствор) = K2SO4 + H2
8K + 5H2SO4 (конц) = 4K2SO4 + H2S + 4H2O
8Na + 10HNO3 (раствор) = 8NaNO3 + NH4NO3 + 3H2O
3Na + 4HNO3 (конц) = 3NaNO3 + NO + 2H2О
Металлы IIА группы
Mg + H2SO4 (раствор) = MgSO4 + H2
4Mg + 5H2SO4 (конц) = 4MgSO4 + H2S + 4H2O
Mg+ 4HNO3 (конц) = Mg(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 (раствор) = 4Mg(NO3)2 + 2N2O + 5H2O
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
2Li + 2NH3 = 2LiNH2 + H2
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2
2K + 2C6H5OH = 2C6H5OK + H2
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
8Al + 3Fe3O4 = 4Al2O3 + 9Fe (алюмотермия)
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Вопросы для самоконтроля
-
С чем реагируют неактивные металлы?
-
С чем связаны восстановительные свойства металлов?
-
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
-
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
-
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.