Задания
Версия для печати и копирования в MS Word
Тип 13 № 11364
Из предложенного перечня выберите два вещества, с которыми реагирует целлюлоза.
1) этанол
2) уксусный ангидрид
3) азотная кислота
4) бромная вода
5) бензол
Запишите в поле ответа номера выбранных веществ в порядке возрастания.
Спрятать решение
Решение.
Целлюлоза является полисахаридом, вступает в реакцию гидролиз с водой, взаимодействует с азотной кислотой, а также вступает в реакции этерификации.
Ответ:23.
Раздел кодификатора ФИПИ: 3.8 Биологически важные вещества: жиры, белки, углеводы
Спрятать решение
·
·
Сообщить об ошибке · Помощь
Теория по теме Углеводы. Краткие конспект по углеводам. Классификация углеводов, химические свойства углеводов, способы получения углеводов. Свойства и получение моносахаридов (глюкоза, фруктоза), олигосахаридов (сахароза и др.), полисахаридов.
Углеводы (сахара) – органические соединения, имеющие сходное строение, состав большинства которых отражает формула Cx(H2O)y, где x, y ≥ 3.
Исключение составляет дезоксирибоза, которая имеют формулу С5Н10O4 (на один атом кислорода меньше, чем рибоза).
Классификация углеводов
По числу структурных звеньев
- Моносахариды — содержат одно структурное звено.
- Олигосахариды — содержат от 2 до 10 структурных звеньев (дисахариды, трисахариды и др.).
- Полисахариды — содержат n структурных звеньев.
Некоторые важнейшие углеводы:
| Моносахариды | Дисахариды | Полисахариды |
| Глюкоза С6Н12О6
Фруктоза С6Н12О6 Рибоза С5Н10О5 Дезоксирибоза С5Н10О4 |
Сахароза С12Н22О11
Лактоза С12Н22О11 Мальтоза С12Н22О11 Целлобиоза С12Н22О11 |
Целлюлоза (С6Н10О5)n
Крахмал(С6Н10О5)n |
По числу атомов углерода в молекуле
- Пентозы — содержат 5 атомов углерода.
- Гексозы — содержат 6 атомов углерода.
- И т.д.
По размеру кольца в циклической форме молекулы
- Пиранозы — образуют шестичленное кольцо.
- Фуранозы — содержат пятичленное кольцо.
Химические свойства, общие для всех углеводов
1. Горение
Все углеводы горят до углекислого газа и воды.
Например, при горении глюкозы образуются вода и углекислый газ
C6H12O6 + 6O2 → 6CO2 + 6H2O
2. Взаимодействие с концентрированной серной кислотой
Концентрированная серная кислота отнимает воду от углеводов, при этом образуется углерод С («обугливание») и вода.
Например, при действии концентрированной серной кислоты на глюкозу образуются углерод и вода
C6H12O6 → 6C + 6H2O
Моносахариды
Моносахариды – гетерофункциональные соединения, в состав их молекул входит одна карбонильная группа (группа альдегида или кетона) и несколько гидроксильных.
Моносахариды являются структурными звеньями олигосахаридов и полисахаридов.
Важнейшие моносахариды
| Название и формула | Глюкоза
C6H12O6 |
Фруктоза
C6H12O6 |
Рибоза
C5H10O5 |
| Структурная формула |  |
 |
 |
| Классификация |
|
|
|
Глюкоза
Глюкоза – это альдегидоспирт (альдоза).
Она содержит шесть атомов углерода, одну альдегидную и пять гидроксогрупп.
Глюкоза существует в растворах не только в виде линейной, но и циклических формах (альфа и бета), которые являются пиранозными (содержат шесть звеньев):
Химические свойства глюкозы
Водный раствор глюкозы
В водном растворе глюкозы существует динамическое равновесие между двумя циклическими формами — α и β и линейной формой:
Качественная реакция на многоатомные спирты: реакция со свежеосажденным гидроксидом меди (II)
При взаимодействии свежеосажденного гидроксида меди (II) с глюкозой (и другими моносахаридами происходит растворение гидроксида с образованием комплекса синего цвета.
Реакции на карбонильную группу — CH=O
Глюкоза проявляет свойства, характерные для альдегидов.
- Реакция «серебряного зеркала»
- Реакция с гидроксидом меди (II) при нагревании. При взаимодействии глюкозы с гидроксидом меди (II) выпадает красно-кирпичный осадок оксида меди (I):
- Окисление бромной водой. При окислении глюкозы бромной водой образуется глюконовая кислота:
- Также глюкозу можно окислить хлором, бертолетовой солью, азотной кислотой.
Концентрированная азотная кислота окисляет не только альдегидную группу, но и гидроксогруппу на другом конце углеродной цепи.
- Каталитическое гидрирование. При взаимодействии глюкозы с водородом происходит восстановление карбонильной группы до спиртового гидроксила, образуется шестиатомный спирт – сорбит:
- Брожение глюкозы. Брожение — это биохимический процесс, основанный на окислительно-восстановительных превращениях органических соединений в анаэробных условиях.
Спиртовое брожение. При спиртовом брожении глюкозы образуются спирт и углекислый газ:
C6H12O6 → 2C2H5OH + 2CO2
Молочнокислое брожение. При молочнокислом брожении глюкозы образуется молочная кислота:
Маслянокислое брожение. При маслянокислом брожении глюкозы образуется масляная кислота (внезапно):
- Образование эфиров глюкозы (характерно для циклической формы глюкозы).
Глюкоза способна образовывать простые и сложные эфиры.
Наиболее легко происходит замещение полуацетального (гликозидного) гидроксила.
Например, α-D-глюкоза взаимодействует с метанолом.
При этом образуется монометиловый эфир глюкозы (α-O-метил-D-глюкозид):
Простые эфиры глюкозы получили название гликозидов.
В более жестких условиях (например, с CH3-I) возможно алкилирование и по другим оставшимся гидроксильным группам.
Моносахариды способны образовывать сложные эфиры как с минеральными, так и с карбоновыми кислотами.
Например, β-D-глюкоза реагирует с уксусным ангидридом в соотношении 1:5 с образованием пентаацетата глюкозы (β-пентаацетил-D-глюкозы):
Получение глюкозы
Гидролиз крахмала
В присутствии кислот крахмал гидролизуется:
(C6H10O5)n + nH2O → nC6H12O6
Синтез из формальдегида
Реакция была впервые изучена А.М. Бутлеровым. Синтез проходит в присутствии гидроксида кальция:
6CH2=On → C6H12O6
Фотосинтез
В растениях углеводы образуются в результате реакции фотосинтеза из CO2 и Н2О:
6CO2 + 6H2O → C6H12O6 + 6O2
Фруктоза
Фруктоза — структурный изомер глюкозы. Это кетоноспирт (кетоза): она тоже может существовать в циклических формах (фуранозы).
Она содержит шесть атомов углерода, одну кетоновую группу и пять гидроксогрупп.
Фруктоза – кристаллическое вещество, хорошо растворимое в воде, более сладкое, чем глюкоза.
В свободном виде содержится в мёде и фруктах.
Химические свойства фруктозы связаны с наличием кетонной и пяти гидроксильных групп.
При гидрировании фруктозы также получается сорбит.
Дисахариды
Дисахариды – это углеводы, молекулы которых состоят из двух остатков моносахаридов, соединенных друг с другом за счет взаимодействия гидроксильных групп (двух полуацетальных или одной полуацетальной и одной спиртовой).
Сахароза (свекловичный или тростниковый сахар) С12Н22О11
Молекула сахарозы состоит из остатков α-глюкозы и β-фруктозы, соединенных друг с другом:
В молекуле сахарозы гликозидный атом углерода глюкозы связан из-за образования кислородного мостика с фруктозой, поэтому сахароза не образует открытую (альдегидную) форму.
Такие дисахариды называют невосстанавливающими, т.е. не способными окисляться.
Сахароза подвергается гидролизу подкисленной водой. При этом образуются глюкоза и фруктоза:
C12H22O11 + H2O → C6H12O6 + C6H12O6
глюкоза фруктоза
Мальтоза С12Н22О11
Это дисахарид, состоящий из двух остатков α-глюкозы, она является промежуточным веществом при гидролизе крахмала.
Мальтоза является восстанавливающим дисахаридом (одно из циклических звеньев может раскрываться в альдегидную группу) и вступает в реакции, характерные для альдегидов.
При гидролизе мальтозы образуется глюкоза.
C12H22O11 + H2O → 2C6H12O6
Полисахариды
Полисахариды — это природные высокомолекулярные углеводы, макромолекулы которых состоят из остатков моносахаридов.
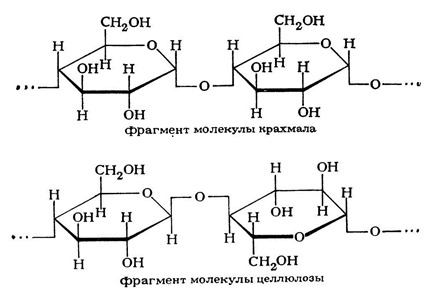
Основные представители — крахмал и целлюлоза — построены из остатков одного моносахарида — глюкозы.
Крахмал и целлюлоза имеют одинаковую молекулярную формулу: (C6H10O5)n, но совершенно различные свойства.
Это объясняется особенностями их пространственного строения.
Крахмал состоит из остатков α-глюкозы, а целлюлоза – из β-глюкозы, которые являются пространственными изомерами и отличаются лишь положением одной гидроксильной группы:
Крахмал
Крахмалом называется полисахарид, построенный из остатков циклической α-глюкозы.
В его состав входят:
- амилоза (внутренняя часть крахмального зерна) – 10-20%
- амилопектин (оболочка крахмального зерна) – 80-90%
Цепь амилозы включает 200 — 1000 остатков α-глюкозы (средняя молекулярная масса 160 000) и имеет неразветвленное строение.
Амилопектин имеет разветвленное строение и гораздо большую молекулярную массу, чем амилоза.
Свойства крахмала
- Гидролиз крахмала: при кипячении в кислой среде крахмал последовательно гидролизуется:
- Крахмал не дает реакцию “серебряного зеркала” и не восстанавливает гидроксид меди (II).
- Качественная реакция на крахмал: синее окрашивание с раствором йода.
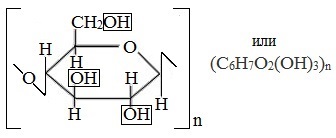
Целлюлоза
Целлюлоза (клетчатка) – наиболее распространенный растительный полисахарид. Цепи целлюлозы построены из остатков β-глюкозы и имеют линейное строение.
Свойства целлюлозы
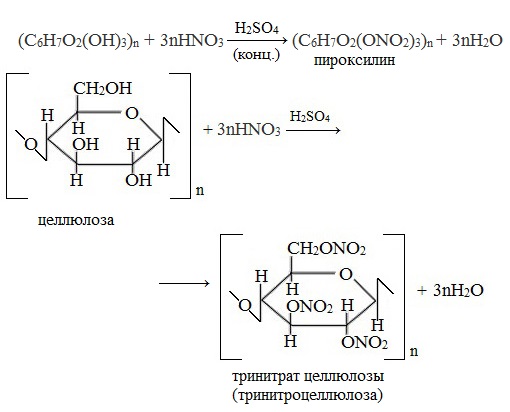
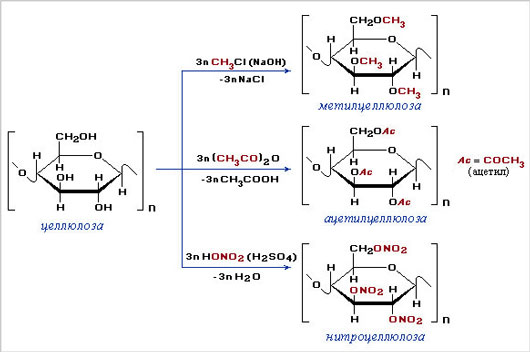
- Образование сложных эфиров с азотной и уксусной кислотами.
Нитрование целлюлозы.
Так как в звене целлюлозы содержится 3 гидроксильные группы, то при нитровании целлюлозы избытком азотной кислоты возможно образование тринитрата целлюлозы, взрывчатого вещества пироксилина:
Ацилирование целлюлозы.
При действии на целлюлозу уксусного ангидрида (упрощённо-уксусной кислоты) происходит реакция этерификации, при этом возможно участие в реакции 1, 2 и 3 групп ОН.
Получается ацетат целлюлозы – ацетатное волокно.
- Гидролиз целлюлозы.
Целлюлоза, подобно крахмалу, в кислой среде может гидролизоваться, в результате тоже получается глюкоза. Но процесс идёт гораздо труднее.
Целлюлоза (клетчатка) — растительный полисахарид, являющийся самым распространенным органическим веществом на Земле.
Этот биополимер обладает большой механической прочностью и выполняет роль опорного материала растений, образуя стенку растительных клеток.
Состав целлюлозы, так же как и крахмала, выражается формулой (C6H10O5)n.
Строение целлюлозы
Макромолекулы целлюлозы – это длинные цепи, состоящие из большого числа остатков β–глюкозы, связанных β-1,4-гликозидными связями.
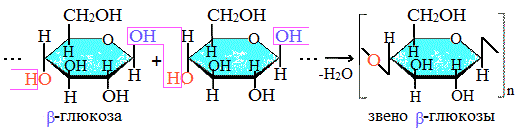
Иллюстрация. Фрагмент молекулы целлюлозы
Молекулярная масса целлюлозы — от 400 000 до 2 млн.
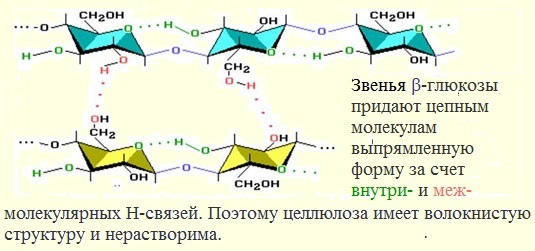
Молекулы целлюлозы, в отличие от крахмала, имеют линейное (неразветвленное) строение, вследствие чего целлюлоза легко образует волокна.
Иллюстрация. Строение целлюлозы
Нахождение в природе
Целлюлоза была обнаружена и описана французским химиком Ансельмом Пайеном в 1838 году.
В большом количестве целлюлоза содержится в тканях древесины (40-60%), в волокнах льна (60-85%) и хлопка (95-98%), в вате и фильтрованной бумаге – до 90%. Основная составная часть оболочки растительных клеток. Образуется в растениях в процессе фотосинтеза.
Иллюстрация. Бумага
Иллюстрация. Древесина
Иллюстрация. Картон
Древесина состоит на 50% из целлюлозы, а хлопок и лён, конопля практически чистая целлюлоза.

Хитин (аналог целлюлозы) – основной компонент наружного скелета членистоногих и других беспозвоночных, а также в составе клеточных стенок грибов и бактерий.
Физические свойства целлюлозы
Целлюлоза – твердое волокнистое вещество белого цвета, без вкуса и запаха, нерастворимое в воде и органических растворителях, но хорошо растворимое в аммиачном растворе гидрокисда меди (II) (реактив Швейцера). Из этого раствора кислоты осаждают целлюлозу в виде волокон (гидратцеллюлоза).
Волокна целлюлозы обладают высокой механической прочностью, так как она является основной составной частью стенок и клеток растений.
В отличие от крахмала она не может служить человеку пищей, поскольку не расщепляется в его организме под действием ферментов.
Видеоопыт «Растворение целлюлозы в аммиачном растворе гидроксида меди (II)»
Химические свойства целлюлозы
1. Гидролиз целлюлозы
Подобно крахмалу, целлюлоза при нагревании с разбавленными кислотами подвергается гидролизу. Гидролиз целлюлозы происходит при нагревании в кислой среде. Конечным продуктом гидролиза является глюкоза.
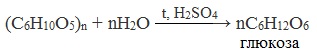
При длительном нагревании с минеральными кислотами или под действием ферментов (у жвачных животных) идет ступенчатый гидролиз целлюлозы:
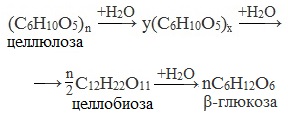
Видеоопыт «Кислотный гидролиз целлюлозы»
Гидролиз целлюлозы, иначе называемый осахариванием, — очень важное свойство целлюлозы, он позволяет получить из древесных опилок и стружек глюкозу, а сбраживанием последней – этиловый спирт. Этиловый спирт, полученный из древесины, называется гидролизным.
2. Образование сложных эфиров (реакция этерификации)
Целлюлоза также не дает реакцию «серебряного зеркала» (нет альдегидной группы), но для нее характерны реакции образования сложных эфиров.
Каждое структурное звено целлюлозы содержит три свободных гидроксила.
Следовательно, целлюлоза может вступать в реакции, характерные для многоатомных спиртов.
Наибольшее практическое значение имеют реакции с азотной кислотой и уксусным ангидридом.
а) Нитрование
При обычной температуре целлюлоза взаимодействует лишь с концентрированными кислотами.
При взаимодействии целлюлозы с концентрированной азотной кислотой в присутствии концентрированной серной кислоты в качестве водоотнимающего средства образуется сложный эфир -тринитрат целлюлозы:
Видеоопыт «Получение и свойства нитроцеллюлозы»
Полностью этерифицированная клетчатка – это тринитрат целлюлозы (пироксилин) – взрывчатое вещество, на его основе изготавливают бездымный порох.
В зависимости от условий нитрования можно получить динитрат целлюлозы, который в технике называется коллоксилином. Он так же используется при изготовлении пороха и твердых ракетных топлив. Кроме того, на основе коллоксилина изготавливают целлулоид.
в) Взаимодействие с уксусным ангидридом
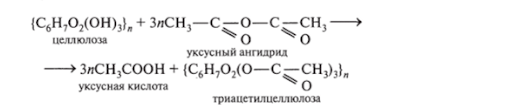
При взаимодействии целлюлозы с уксусным ангидридом в присутствии уксусной и серной кислот образуется триацетилцеллюлоза:
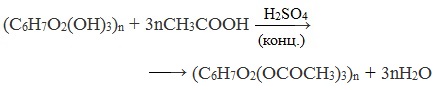
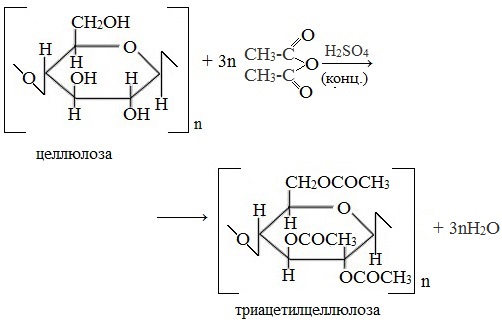
Из триацетата целлюлозы изготавливают лаки, кинопленку и ацетатное волокно.
3. Горение – полное окисление
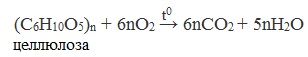
4. Термическое разложение целлюлозы без доступа воздуха
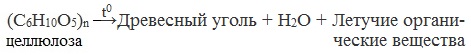
Получение целлюлозы
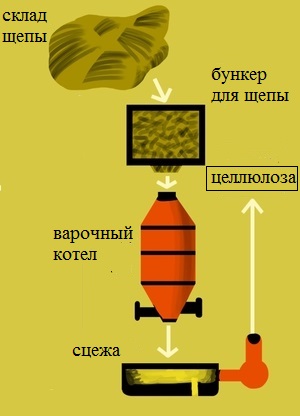
Промышленным методом целлюлозу получают методом варки щепы на целлюлозных заводах, входящих в промышленные комплексы (комбинаты). По типу применяемых реагентов различают следующие способы варки целлюлозы:
- Кислые:
- Сульфитный. Варочный раствор содержит сернистую кислоту и её соль, например гидросульфит натрия. Этот метод применяется для получения целлюлозы из малосмолистых пород древесины: ели, пихты.
- Щелочные:
- Натронный.Используется раствор гидроксида натрия. Натронным способом можно получать целлюлозу из лиственных пород древесины и однолетних растений. Преимущество данного метода — отсутствие неприятного запаха соединений серы, недостатки — высокая стоимость получаемой целлюлозы. Метод практически не используется.
- Сульфатный.Наиболее распространенный метод на сегодняшний день. В качестве реагента используют раствор, содержащий гидроксид и сульфид натрия, и называемый белым щелоком. Свое название метод получил от сульфата натрия, из которого на целлюлозных комбинатах получают сульфид для белого щёлока. Метод пригоден для получения целлюлозы из любого вида растительного сырья. Недостатком его является выделения большого количества дурно пахнущих сернистых соединений: метилмеркаптана, диметилсульфида и др. в результате побочных реакций.
Получаемая после варки техническая целлюлоза содержит различные примеси: лигнин, гемицеллюлозы. Если целлюлоза предназначена для химической переработки (например, для получения искусственных волокон), то она подвергается облагораживанию — обработке холодным или горячим раствором щелочи для удаления гемицеллюлоз.
Для удаления остаточного лигнина и придания целлюлозе белизны проводится её отбелка. Традиционная для 20 века хлорная отбелка включала в себя две ступени:
- обработка хлором — для разрушения макромолекул лигнина;
- обработка щелочью — для экстракции образовавшихся продуктов разрушения лигнина.
Применение целлюлозы
Целлюлоза используется в производстве бумаги и картона, искусственных волокон, пленок, пластмасс, лакокрасочных материалов, бездымного пороха, взрывчатки, твердого ракетного топлива, для получения гидролизного спирта и многое другое.
- Изготовление нитей, канатов, бумаги.
- Получение глюкозы, этилового спирта (для получения каучука).
- Получение ацетатного шёлка – искусственное волокно, оргстекла, негорючей плёнки из ацетилцеллюлозы.
- Получение бездымного пороха из триацетилцеллюлозы (пироксилин).
- Получение коллодия (плотная плёнка для медицины) и целлулоида (изготовление киноленты, игрушек) из диацетилцеллюлозы.
Иллюстрация. Применение природных волокон, содержащих целлюлозу
Иллюстрация. Применение сложных эфиров целлюлозы

Производные целлюлозы
К важнейшим производным целлюлозы относятся искусственные полимеры/
Метилцеллюлоза (простые метиловые эфиры целлюлозы) общей формулы
[С6Н7О2(ОН)3-х(ОСН3)х]n (х=1, 2 или 3)
Ацетилцеллюлоза (триацетат целлюлозы) – сложный эфир целлюлозы и уксусной кислоты
[С6Н7О2(ОСОСН3)3]n
Нитроцеллюлоза (нитраты целлюлозы) – сложные азотнокислые эфиры целлюлозы
[С6Н7О2(ОН)3-х(ОNO2)х]n (х=1, 2 или 3)
Вискозное волокно. Целлофан
Эти полимерные материалы состоят из практически чистой целлюлозы, но для их получения исходную целлюлозу путем химической модификации сначала превращают в растворимую форму, а затем в процессе формования восстанавливают.
Углеводы
Полисахариды
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Целлюлоза, как и крахмал, является природным полисахаридом. Она образуется в клетках растений из глюкозы и входит в состав клеточных стенок.
Молекулярная формула целлюлозы:
(C6H10O5)n
. Её макромолекула образована остатками
β
-глюкозы. В каждом структурном звене есть три гидроксильные группы.
Рис. (1). Структурное звено целлюлозы
Степень полимеризации целлюлозы намного выше по сравнению с крахмалом ((100000)–(140000)), а средняя молекулярная масса больше миллиона.
Все макромолекулы целлюлозы имеют линейное строение. Целлюлоза образует растительные волокна (льняное, хлопковое и др.).
Целлюлоза не растворяется в воде и в других растворителях.
Химические свойства
1. Гидролиз.
Гидролиз целлюлозы протекает с трудом и только при длительном кипячении с серной кислотой. Его продукт — глюкоза:
(C6H10O5)n+nH2O→H2SO4,tnC6H12O6.
2. Реакции этерификации.
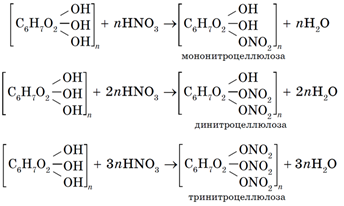
Реакции этерификации целлюлозы находят практическое применение для получения эфиров уксусной и азотной кислот.
В реакции целлюлозы с азотной кислотой в зависимости от количеств реагирующих веществ образуются мононитроцеллюлоза, динитроцеллюлоза и тринитроцеллюлоза:
C6H7O2OH3n+nHNO3→C6H7O2OH2(ONO2)n+nH2O;
C6H7O2OH3n+2nHNO3→C6H7O2OH(ONO2)2n+2nH2O;
C6H7O2OH3n+3nHNO3→C6H7O2OH(ONO2)3n+3nH2O.
Эфиры уксусной кислоты можно получить, если использовать для реакции уксусную кислоту или уксусный ангидрид. Также в зависимости соотношения количеств использованных реагентов образуются разные эфиры: моноацетилцеллюлоза, диацетилцеллюлоза, триацетилцеллюлоза:
C6H7O2OH3n+nCH3COOH→C6H7O2OH2(OCOCH3)n+nH2O;
C6H7O2OH3n+2nCH3COOH→C6H7O2OH(OCOCH3)2n+2nH2O;
C6H7O2OH3n+3nCH3COOH→C6H7O2(OCOCH3)3n+3nH2O.
3. Горение и разложение.
Целлюлоза горит:
(C6H10O5)n+6nO2→6nCO2+5nH2O.
При нагревании без доступа воздуха целлюлоза разлагается, образуются древесный уголь и смесь органических веществ, в которой содержатся метан, метанол, этанол, ацетон, уксусная кислота.
Получение и применение целлюлозы
Целлюлозу получают из древесины. В больших количествах чистая целлюлоза используется для производства бумаги.
Из целлюлозы производят искусственные волокна (ацетатное и вискозное), а также плёнки и взрывчатые вещества.
Из целлюлозы получают также технический этиловый спирт. Он содержит вредные примеси и используется в качестве растворителя или для получения каучука.
Источники:
Рис. 1. Структурное звено целлюлозы. By NEUROtiker — Own work. Public domain, https://commons.wikimedia.org/w/index.php?curid=2951910.
Целлюлоза: что такое, формула, получение, химические свойства
Содержание:
Целлюлоза, или клетчатка – это полисахарид, содержащийся в клеточных стенках растений. Ею богаты волокна хлопка, льна, конопли и др. Её содержание в растениях может достигать 95 % от общей массы. Например, древесина на 50 % состоит из клетчатки.
Строение целлюлозы
Молекулярная формула целлюлозы идентична формуле крахмала: (С6Н10О5)n, где n – степень полимеризации. Степень полимеризации у целлюлозы больше по сравнению с крахмалом. Макромолекула целлюлозы состоит из множества мономеров – остатков молекул β-глюкозы, а макромолекула крахмала – из α-глюкозы. Крахмал и целлюлоза – циклические соединения.
Структурные формулы целлюлозы и крахмала выглядят следующим образом:
| Характеристика | Крахмал | Целлюлоза |
| Остатки моносахаридов | α–глюкоза | β-глюкоза |
| Количество мономеров | Несколько тысяч | До 40 тысяч |
| Структура макромолекул | Свернуты компактно. Могут быть как разветвленными, так и неразветвленными | Имеют вид нитей. Могут быть только неразветвленными |
| Характер межмолекулярных взаимодействий | Водородные связи не образуются | Образуются прочные водородные связи |
Получение целлюлозы Клетчатку, как правило, синтезируют из древесины. В России популярен сульфитный метод синтеза целлюлозы.
В смеси технической целлюлозы, которая формируется после варки, также находятся лигнин и гемицеллюлоза. Если необходимо получить искусственные волокна, то целлюлозу облагораживают, т.е. обрабатывают щелочью для устранения гемицеллюлоз.
Чтобы удалить лигнин и придать целлюлозе белоснежный цвет, нужно провести отбелку. Например, хлорная отбелка состоит из двух стадий обработки:
Физические свойства целлюлозы
Целлюлоза не растворяется ни в воде, ни в органических растворителях. Единственное вещество, в котором растворяется клетчатка – аммиачный раствор гидроксида меди (II).
Химические свойства целлюлозы
В результате образуется глюкоза.
Реакция целлюлозы и азотной кислоты протекает при участии концентрированной серной кислоты. В результате формируются сложные эфиры.
Также целлюлоза реагирует с уксусным ангидридом при участии уксусной и серной кислот.
Целлюлоза в биологии
Целлюлоза в организме выполняет ряд функций:
Если в пище содержится клетчатка, то у человека быстрее наступает чувство сытости. Целлюлоза улучшает перистальтику кишечника.
Применение целлюлозы
Например, ацетатный шелк, негорючую пленку и органическое стекло производят из ацетилцеллюлозы. При производстве шелка ацетилцеллюлозу помещают в дихлорметан и этанол. Получившуюся смесь пропускают через колпачки с большим количеством отверстий. Порции раствора прогревают через нагретый воздух. Растворитель растворяется и триацетилцеллюлоза образует тонкие нити.
Динитроцеллюлозу применяют при производстве коллодия. Для получения коллодия динитроцеллюлозу растворяют в спирте и эфире. После испарения растворителей образуется толстая пленка – коллодий, который применяется в медицине. Динитроцеллюлоза также идет на производство целлулоида, который синтезируют путем ее сплавления с камфорой.
Источник
Целлюлоза, свойства, получение и применение
Целлюлоза – природное высокомолекулярное органическое соединение, углевод, полисахарид с формулой (C6H10O5)n.
Целлюлоза, формула, строение, вещество, характеристика:
Целлюлоза, клетчатка (фр. cellulose от лат. cellula – «клетка») – природное высокомолекулярное органическое соединение, углевод, полисахарид с формулой (C6H10O5)n.
Молекулы целлюлозы представляют собой неразветвлённые цепочки из остатков β-D-глюкозы, соединённых гликозидными (водородными) связями β-(1→4).
Строение молекулы целлюлозы, структурная формула целлюлозы:
Молекула целлюлозы образована из множества (от нескольких сотен до десятков тысяч) остатков β-D-глюкозы, связанных между собой гликозидными (водородными) связями.
Молекула целлюлозы имеет линейное строение и склонна принимать вытянутую стержневую конформацию.
Так как макромолекула целлюлозы представляет собой смесь молекул (мономерных звеньев) с различной степенью полимеризации (т.е. числом мономерных звеньев в молекуле полимера), то она неоднородна по молекулярной массе. Целлюлоза из древесины имеет типичную длину цепи от 300 до 1700 единиц мономерных звеньев C6H10O5, хлопок и другие растительные волокна, а также бактериальная целлюлоза имеют длину цепи от 800 до 10 000 единиц звеньев C6H10O5.
Молярная масса мономерного звена целлюлозы С6Н10О5 составляет 162,1406 г/моль
Целлюлоза – это растительный полисахарид, являющийся самым распространенным органическим веществом. Целлюлоза является главной составляющей частью и структурным материалом оболочки растительной клетки. Кроме целлюлозы в состав клеточных оболочек входят еще несколько других углеводов, известных под общим названием гемицеллюлозы (ксилан, маннан, галактан, арабан и др.).
Внешне целлюлоза в чистом виде представляет собой белое твердое волокнистое вещество, без вкуса и запаха.
Волокна целлюлозы обладают высокой механической прочностью.
Целлюлоза не растворяется в воде, слабых кислотах и большинстве органических растворителей. Растворяется в некоторых растворителях, например, в водных смесях комплексных соединений гидроксидов переходных металлов (Сu, Cd, Ni) с NH3 и аминами, в серной и ортофосфорной кислотах, а также в аммиачном растворе гидроксида меди (II) – реактиве Швейцера.
Хорошо впитывает воду из-за наличия гидроксильных групп в своем составе.
Подвергается разложению при участии микроорганизмов и при действии ультрафиолетовых лучей.
Не разрушается при нагревании до 200 о С.
Различные виды целлюлозы (из различных растительных материалов) структурно неоднородны, т.к. расстояние между молекулами или звеньями молекул целлюлозы, а также взаимное расположение этих молекул могут быть различны. Соответственно изменяются прочностные связи между молекулами, а также физические и химические свойства различных видов целлюлозы. Свойства также зависят от количества звеньев в молекуле целлюлозы (т.е. от степени полимеризации). Например, чем больше расстояние между молекулами или звеньями молекул и чем меньше прочность связи между ними, тем больше гигроскопичность целлюлозы, ее окрашиваемость, более реакционноспособна в процессах этерификации, протекающих в кислой среде, и т.д. Целлюлоза со степенью полимеризации менее 1000 растворима в концентрированной ортофосфорной кислоте, а целлюлоза со степенью полимеризации ниже 200 – также и в 10-12 % растворе гидроксида натрия.
Нахождение целлюлозы в природе:
В чистом виде в природе не содержится.
Целлюлоза образуется в растениях (в т.ч. водорослях) в результате сложных биохимических реакций в процессе фотосинтеза из простейших углеводов. Она представляет собой составную часть оболочки клеток растений, обеспечивая механическую прочность и эластичность растительной ткани.
В большом количестве целлюлоза содержится в волокнах хлопка – 95-98 %, льна – 60-85 %, в тканях древесины – 40-55 %, в растительных остатках, попадающих в почву (листьях, стеблях и пр.), – 40-90 %, в соломе – до 30 %.
Целлюлоза также встречается у грибов и животных: у некоторых простейших и у оболочников (Tunicata). У последних она выделяется клетками наружных покровов и образует наружную оболочку, или тунику, животного.
Целлюлоза вырабатывается также некоторыми бактериями, например, бактериями рода Acetobacter.
Физические свойства целлюлозы:
| Наименование параметра: | Значение: |
| Цвет | белый |
| Запах | без запаха |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), г/см 3 | 1,52-1,54 |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 1520-1540 |
| Температура разложения, °C | 210 |
| Температура плавления, °C | 467 |
| Температура кипения, °C | — |
| Температура воспламенения, °C | 275 |
| Температура самовоспламенения, °C | 420 |
| Удельная теплота сгорания, МДж/кг | 16,40 |
| Молярная масса мономерного звена целлюлозы С6Н10О5, г/моль | 162,1406 |
Химические свойства целлюлозы. Химические реакции целлюлозы:
Из-за наличия трёх гидроксильных групп в каждом звене целлюлоза проявляет свойства многоатомных спиртов, поэтому для нее характерны все химические реакции, свойственные спиртам: образование простых и сложных эфиров органических и неорганических кислот, получение щелочной целлюлозы и др.
Основные химические реакции целлюлозы следующие:
1. гидролиз целлюлозы:
В результате реакции образуется глюкоза.
2. реакция нитрования целлюлозы (т.е. реакция целлюлозы с азотной кислотой).
3. реакция этерификации целлюлозы с уксусной кислотой.
4. реакция пиролиза целлюлозы:
При температуре выше 350 °C в отсутствии кислорода целлюлоза подвергается пиролизу (также называемому “термолизом”), разлагаясь на твердый уголь, пары, аэрозоли и газы, такие как углекислый газ и пр. продукты сложного строения.
5. реакция горения целлюлозы:
В результате реакции происходит полное окисление целлюлозы до углекислого газа и воды.
Производство и получение целлюлозы:
Поскольку в природе в чистом виде целлюлоза не содержится, а, как правило, образуется в растениях, то ее в основном получают из древесины. Производство (получение) целлюлозы является одним из этапов производства бумаги.
Содержание целлюлозы в древесине составляет порядка 40-55 %. Остальное – гемицеллюлоза (ксилан, маннан, галактан, арабан и др.) и лигнин. Лигнин (от лат. lignum – дерево, древесина) – это вещество, характеризующее одеревеневшие стенки растительных клеток, и представляющее собой смесь ароматических полимеров родственного строения. На лигнин приходится от 18 до 24 % массы древесины лиственных пород и 23-50 % массы хвойных пород. Причем (лигнин) последний выполняет функцию связующего вещества между волокнами целлюлозы.
Если образно сравнить древесину с железобетоном, то получается, что волокна целлюлозы, обладающие высокой прочностью на растяжение, подобны арматуре в железобетоне, а лигнин, обладающий высокой прочностью на сжатие, – бетону.
Гемицеллюлоза в древесине выполняет функцию укрепления волокон целлюлозе. Она представляет собой растительные гомо- и гетерополисахариды с меньшей, чем у целлюлозы, молекулярной массой (10 000-40 000 г/моль), состоящие из остатков разных пентоз и гексоз.
Целлюлоза получается (выделяется) из древесины двумя методами: механическим и химическим. При любом методе получения целлюлозы древесина предварительно измельчается в щепу.
Механический метод получения целлюлозы:
При механическом методе получения целлюлозы древесную щепу, как правило, истирают или размалывают в водной среде в присутствии специальных реагентов. Под действием воды, тепла и специальных реагентов лигнин размягчается, и древесина распадается на отдельные волокна. Затем волокна очищаются. Однако полностью лигнин из полученных волокон не удаляется, а остается на поверхности и внутри них, что сказывается на качестве полученной целлюлозы и в будущем – на получаемых бумажных листах.
Выход «механической» древесной массы получается достаточно высоким.
Бумажные листы из «механической» древесной массы имеют низкую плотность, высокую твердость и жесткость, а также цвет исходной древесины.
Химический метод получения целлюлозы:
Химический метод получения целлюлозы заключается в том, что древесную щепу помещают в кипящий раствор, где варят в течении длительного времени.
По типу применяемых реагентов различают несколько способов варки древесной щепы:
В процессе варки получают техническую целлюлозу, которая выпадает в осадок, а лигнин взаимодействует с варочным раствором, в результате чего получаются различные химические вещества (кормовые дрожжи, сульфатный лигнин, сульфатное мыло, фитостерин, талловое масло, канифоль, сернистые соединения, метанол, скипидар и пр.).
Техническая целлюлоза для удаления гемицеллюлозы и облагораживания обрабатывается холодным или горячим раствором щелочи, а для удаления остаточного лигнина – хлором, озоном, кислородом, пероксидом водорода, после чего – щелочью. Процесс удаления лигнина также называется отбелкой целлюлозы и имеет цель придание ей белизны.
В итоге получается чистая целлюлоза. Общий объем получаемой химическим способом целлюлозы зависит от способа варки, а так же от вида древесины. Выход составляет от 40 до 65 %.
В отличие от целлюлозы, полученной механическим способом, целлюлоза, полученная химическим способом, имеет белый цвет, большую длину волокон, становится более гибкой.
Источник
С чем реагирует целлюлоза

I. Физические свойства
Это вещество белого цвета, без вкуса и запаха, нерастворимое в воде, имеющее волокнистое строение. Растворяется в аммиачном растворе гидроксида меди (II) – реактиве Швейцера.
II. Нахождение в природе
Целлюлоза была обнаружена и описана французским химиком Ансельмом Пайеном в 1838 году.
Этот биополимер обладает большой механической прочностью и выполняет роль опорного материала растений, образуя стенку растительных клеток. В большом количестве целлюлоза содержится в тканях древесины (40-55%), в волокнах льна (60-85%) и хлопка (95-98%). Основная составная часть оболочки растительных клеток. Образуется в растениях в процессе фотосинтеза.
Хитин (аналог целлюлозы) – основной компонент наружного скелета членистоногих и других беспозвоночных, а также в составе клеточных стенок грибов и бактерий.
III. Строение
IV. Получение
Промышленным методом целлюлозу получают методом варки щепы на целлюлозных заводах, входящих в промышленные комплексы (комбинаты). По типу применяемых реагентов различают следующие способы варки целлюлозы:
Получаемая после варки техническая целлюлоза содержит различные примеси: лигнин, гемицеллюлозы. Если целлюлоза предназначена для химической переработки (например, для получения искусственных волокон), то она подвергается облагораживанию — обработке холодным или горячим раствором щелочи для удаления гемицеллюлоз.
Для удаления остаточного лигнина и придания целлюлозе белизны проводится её отбелка. Традиционная для 20 века хлорная отбелка включала в себя две ступени:
V. Применение
VI. Производные целлюлозы
К важнейшим производным целлюлозы относятся:
VII. Химические свойства
1. Гидролиз
Гидролиз протекает ступенчато:
крахмал декстрины мальтоза глюкоза
2. Реакции этерификации
Целлюлоза – многоатомный спирт, на элементную ячейку полимера приходятся три гидроксильных группы. В связи с этим, для целлюлозы характерны реакции этерификации (образование сложных эфиров). Наибольшее практическое значение имеют реакции с азотной кислотой и уксусным ангидридом. Целлюлоза не дает реакции «серебряного зеркала».
2. Взаимодействие с уксусной кислотой:
При взаимодействии целлюлозы с уксусным ангидридом в присутствии уксусной и серной кислот образуется триацетилцеллюлоза.
VII. Ацетатное волокно (ацетилцеллюлоза)
Впервые на мировом рынке появилось в 1921 году, как результат трудов американских ученых и технологов под руководством Дрейфуса.
Получение относительно безвредное, отличается простотой технологического процесса и доступностью вспомогательных материалов.
Получение. Сырьем для получения ацетатного волокна служат остатки хлопкового пуха или облагороженной древесной целлюлозы, обработанные уксусным ангидритом и уксусной кислотой: получают рыхлые хлопья первичного ацетата. (“уксус” по латыни “ацетум”, от этого произошло и название “ацетатное”)
Для получения вторичного ацетата первичный ацетат омыливают – добавляют определенное количество воды; полученные белые хлопья отжимают, обрабатывают в смеси ацетона и спирта, продавливают через фильеры, и при помощи теплого воздуха испаряют смесь,от чего нити затвердевают. Из этих блестящих нитей и ткут ацетатное полотно. В сочетании с другими нитями волокно используют с шелком, вискозой, шерстью и другими смесевыми тканями.
Изделия утюжат влажным по изнаночной стороне, чтобы не образовывались ласы, нельзя чистить ацетоном, можно растворить ткань.
Применение. В настоящее время выпуск ацетатных волокон и нитей резко сократился из-за малой потребительской востребованности.
В 60-десятые годы ХХ века использовали ткани для женских платьев, блузок,. летних костюмов
Триацетатное волокно
Получают из первичного ацетата путем воздействия на него химического состава.
Формование волокна происходит так же, как ацетатного, но при низких температурах, что ведет к некоторым различиям в их свойствах: отличается низкой гигроскопичностью, белее высокой температурой плавления и глажения, его можно отбеливать и проще окрашивать, не нуждается в глажении, хорошо держит складки плиссе и гофре даже после стирки, что улучшает процесс эксплуатации; сильно осыпается.
Применение: Изготавливают ткани для галстуков (из-за низкой прочности).тюля, покрывал на кровати, кружев, юбок гофре и плиссе, сорочек
Триацетилцеллюлоза (или ацетилцеллюлоза) является ценным продуктом для изготовления негорючей кинопленки и ацетатного шелка. Для этого ацетилцеллюлозу растворяют в смеси дихлорметана и этанола и этот раствор продавливают через фильеры в поток теплого воздуха.
А сама фильера схематично выглядит так:
Растворитель испаряется и струйки раствора превращаются в тончайшие нити ацетатного шелка.
Говоря о применении целлюлозы, нельзя не сказать о том, что большое количество целлюлозы расходуется для изготовления различной бумаги. Бумага – это тонкий слой волокон клетчатки, проклеенный и спрессованный на специальной бумагоделательной машине.
Источник
Углеводы
Углеводы (сахара) – органические соединения, имеющие сходное строение, состав большинства которых отражает формула Cx(H2O)y, где x, y ≥ 3.
Исключение составляет дезоксирибоза, которая имеют формулу С5Н10O4 (на один атом кислорода меньше, чем рибоза).
Классификация углеводов
По числу структурных звеньев
Некоторые важнейшие углеводы:
| Моносахариды | Дисахариды | Полисахариды | ||||
| Глюкоза С6Н12О6
Дезоксирибоза С5Н10О4 |
Сахароза С12Н22О11
Целлобиоза С12Н22О11 |
Целлюлоза (С6Н10О5)n
По числу атомов углерода в молекулеПо размеру кольца в циклической форме молекулыХимические свойства, общие для всех углеводов1. ГорениеВсе углеводы горят до углекислого газа и воды. Например, при горении глюкозы образуются вода и углекислый газ 2. Взаимодействие с концентрированной серной кислотойКонцентрированная серная кислота отнимает воду от углеводов, при этом образуется углерод С («обугливание») и вода. Например, при действии концентрированной серной кислоты на глюкозу образуются углерод и вода МоносахаридыМоносахариды – гетерофункциональные соединения, в состав их молекул входит одна карбонильная группа (группа альдегида или кетона) и несколько гидроксильных. Моносахариды являются структурными звеньями олигосахаридов и полисахаридов. Важнейшие моносахариды
|
04-Фев-2013 | Нет комментариев | Лолита Окольнова
Пробный ЕГЭ по химии 2013
часть B
B3 Установить соответствие между формулой вещества и продуктом электролиза его раствора на катоде:
При решении такой задачи надо:
1) определить, какой заряд будет иметь катод, а значит, какие вещества будут на нем выделяться
катод — отрицательно заряженный электрод, на нем идут процессы восстановления.
2) определить процесс восстановления:
если металл, входящий в состав соли, стоит в ряду напряжений (см. таблицу растворимости) до водорода (Н), то вместо металла восстановлению будет подвергаться водород:
2H2O = H2 + 2OH—
если металл стоит после водорода, то восстанавливается он сам:
Men+ +ne— = Me
Ответ: A-1, Б-4, В-4, Г-4
B4 Указать соответствие между формулой соли и средой ее водного раствора
Пишем уравнения реакции для каждого вещества:
- Сa(NO3)2 + 2HOH = Ca(OH)2↓ + 2HNO3 после выпадения осадка в растворе остается кислота — среда кислая;
- Li2S + 2HOH = 2LiOH + H2S↑ после выделения газа в растворе остается щелочь — щелочная среда;
- Na2SO4 + 2HOH = 2NaOH + H2SO4 — реакция нейтрализации, щелочь и кислота опять реагируют между собой (реакция обратимая), получается опять соль и вода — среда нейтральная.
- СaCl2 + 2HOH = Ca(OH)2 ↓+ 2HCl после выпадения осадка в растворе остается кислота — среда кислая;
Ответ: A-2, Б — 3, В — 1, Г — 2
B5: установить соответствие между веществом и соответствующими ему реагентами:
- A) HNO3 (p-p) — не реагирует с кислотами H3PO4, H2SO4 — нам подходят варианты 3) и 5). В варианте 5) реакция с AgCl не будет идти до конца, значит, наш вариант — 3)
- Б) K2SiO3 -силикат калия — будет взаимодействовать с кислотами, с водой и растворимыми солями — вариант 2)
- В) Na2CO3 — тоже подходит вариант 2)
- Г) Сu(NO3)2(p-p) — вариант 3) — есть даже качественные реакции на медь
Ответ: A-3, Б-2, В-2, Г-3
B6: Последовательность стадий реакции бромирования.
Бромирование алкана, так же как и хлорирование, идет по шагам:
1) Хлор на свету ( и бром) распадается на радикалы: Cl2 = Cl• + Cl•
2) Радикал хлора атакует молекулу алкана: СH4 + Cl• = CH3• + HCl
3) Образовавшийся радикал метил взаимодействует с другим радикалом хлора: CH3• + Cl• = СH3Cl
Ответ: 2 3 6
B7: что образуется при гидролизе сложного эфира.
При гидролизе сложного эфира образуются кислота и спирт:
RCOOR1 + HOH = RCOOH + R1OH
ответы 1) 3) и 5) -отпадают
Ответ: 2, 4, 6
B8: с чем реагирует целлюлоза
Целлюлоза — это полимер глюкозы. Как любой углеводный полимер, она будет подвергаться гидролизу и реакции горения — 1) 3) 4)
Ответ: 1 3 4
Обсуждение: «Пробный ЕГЭ по химии 2013 часть B»
(Правила комментирования)