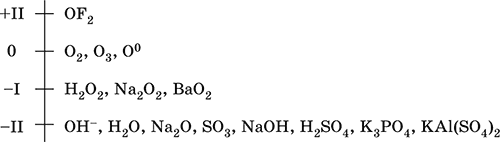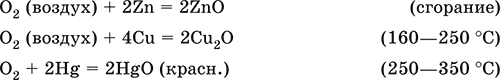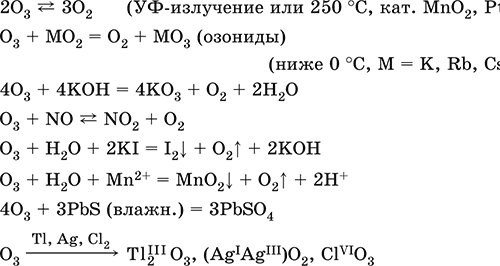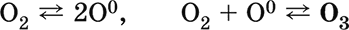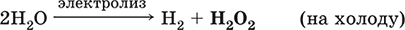1. Положение кислорода в периодической системе химических элементов
2. Электронное строение кислорода
3. Физические свойства кислорода и нахождение в природе
4. Способы получения кислорода
5. Химические свойства кислорода
5.1. Взаимодействие с простыми веществами
5.1.1. Взаимодействие с галогенами
5.1.2. Взаимодействие с серой и кремнием
5.1.3. Взаимодействие с водородом и фосфором
5.1.4. Взаимодействие с азотом
5.1.5. Взаимодействие с металлами
5.1.6. Взаимодействие с углеродом
5.2. Взаимодействие со сложными веществами
Кислород
Положение в периодической системе химических элементов
Кислород расположен в главной подгруппе VI группы (или в 16 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кислорода
Электронная конфигурация кислорода в основном состоянии:
+8O 1s22s22p4 1s 2s
2p
Атом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные электронные пары в основном энергетическом состоянии.
Физические свойства и нахождение в природе
Кислород О2 — газ без цвета, вкуса и запаха, немного тяжелее воздуха. Плохо растворим в воде. Жидкий кислород – голубоватая жидкость, кипящая при -183оС.
Озон О3 — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода.
Кислород — это самый распространённый в земной коре элемент. Кислород входит в состав многих минералов — силикатов, карбонатов и др. Массовая доля элемента кислорода в земной коре — около 47 %. Массовая доля элемента кислорода в морской и пресной воде составляет 85,82 %.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе.
Способы получения кислорода
В промышленности кислород получают перегонкой жидкого воздуха.
Лабораторные способы получения кислорода:
- Разложение некоторых кислородосодержащих веществ:
Разложение перманганата калия:
2KMnO4 → K2MnO4 + MnO2 + O2
Разложение бертолетовой соли в присутствии катализатора MnO2:
2KClO3 → 2KCl + 3O2
Разложение пероксида водорода в присутствии оксида марганца (IV):
2H2O2 → 2H2O + O2
2HgO → 2Hg + O2
2KNO3 → 2KNO2 + O2
Соединения кислорода
Основные степени окисления кислород +2, +1, 0, -1 и -2.
Соединения кислорода:
| Степень окисления | Типичные соединения |
| +2 | Фторид кислорода OF2 |
| +1 | Пероксофторид кислорода O2F2 |
| -1 | Пероксид водорода H2O2
Пероксид натрия Na2O2 и др. |
| -2 | Вода H2O
Оксиды металлов и неметаллов Na2O, SO2 и др. Кислородсодержащие кислоты Соли кислородсодержащих кислот Кислородсодержащие органические вещества Основания и амфотерные гидроксиды |
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя (с большинством химических элементов) и свойства восстановителя (только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами, и с неметаллами. Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
O2 + 2F2 → 2OF2
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
S + O2 → SO2
Si + O2 → SiO2
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
4P + 3O2 → 2P2O3
Но чаще фосфор сгорает до оксида фосфора (V):
4P + 5O2 → 2P2O5
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000оС), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
Железо, в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит, образуя оксид углерода (IV):
C + O2 → CO2
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды. При этом образуются оксиды:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Al4C3 + 6O2→ 2Al2O3 + 3CO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения (сероводород, аммиак, метан, силан гидриды. При этом также образуются оксиды:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора (сероуглерод, сульфид фосфора и др.):
CS2 + 3O2→ CO2 + 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления (оксид углерода (II), оксид железа (II) и др.):
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например, кислород окисляет гидроксид железа (II):
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Кислород окисляет азотистую кислоту:
2HNO2 + O2 → 2HNO3
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
2CH2=CH2 + O2 → 2CH3-CH=O
Кислород (лат. Oxygenium) — элемент VIa группы 2 периода периодической таблицы Д.И. Менделеева. Первым открывает
группу халькогенов — элементов VIa группы.
Газ без цвета, без запаха, составляет 21% воздуха.

Общая характеристика элементов VIa группы
Общее название элементов VIa группы O, S, Se, Te, Po — халькогены. Халькогены (греч. χαλκος — руда + γενος —
рождающий) — входят в состав многих минералов. Например, кислород составляет 50% массы земной коры.
От O к Po (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.
Среди элементов VIa группы O, S, Se — неметаллы. Te, Po — металлы.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np4:
- O — 2s22p4
- S — 3s23p4
- Se — 4s24p4
- Te — 5s25p4
- Po — 6s26p4
Основное состояние атома кислорода
У атома кислорода (как и атомы азота, фтора, неона) нет возбужденного состояния, так как отсутствует свободная орбиталь с более
высоким энергетическим уровнем, куда могли бы перемещаться валентные электроны.
Атом кислорода имеется два неспаренных электрона, максимальная валентность II.

Природные соединения
- Воздух — в составе воздуха кислород занимает 21% (это число пригодится в задачах!)
- В форме различных минералов в земной коре кислорода содержится около 50%
- В живых организмов кислород входит в состав органических веществ: белков, жиров, углеводов и нуклеиновых кислот
Получение
В промышленности кислород получают из сжиженного воздуха. Также активно применяются кислородные установки, мембрана которых
устроена как фильтр, отсеивающие кислород (мембранная технология).
В лаборатории кислород получают разложением перманганата калия (марганцовки) или бертолетовой соли при нагревании. Применяется реакция
каталитического разложения пероксида водорода.
KMnO4 → K2MnO4 + MnO2 + O2↑
KClO3 → KCl + O2↑
H2O2 → (кат. — MnO2) H2O + O2
На подводных лодках для получения кислорода применяют следующую реакцию:
Na2O2 + CO2 → Na2CO3 + O2↑

Химические свойства
Является самым активным неметаллом после фтора, образует бинарные соединения со всеми элементами кроме гелия, неона, аргона. Чаще всего реакции
с кислородом экзотермичны (горение), ускоряются при повышении температуры.
- Реакции с неметаллами
- Реакции с металлами
- Горение воды
- Окисление органических веществ
- Контролируемое окисление
Во всех реакциях, кроме взаимодействия со фтором, кислород проявляет себя в качестве окислителя.
NO + O2 → (t) NO2
S + O2 → (t) SO2
2C + O2 = (t) 2CO (неполное окисление — угарный газ, соотношение 2:1)
C + O2 = (t) CO2 (полное окисление — углекислый газ, соотношение 1:1)
F + O2 → OF2 (фторид кислорода, O+2)

В реакциях кислорода с металлами образуются оксиды, пероксиды и супероксиды. Реакции с активными металлами идут без нагревания.
Li + O2 → Li2O (оксид)
Na + O2 → Na2O2 (пероксид)
K + O2 → KO2 (супероксид)
Известна реакция горения воды во фторе.
F2 + H2O → HF + O2

Все органические вещества сгорают с образованием углекислого газа и воды.
C3H7 + O2 = CO2 + H2O

При применении катализаторов и особых реагентов в органической химии достигают контролируемого окисления: алканы окисляются
до спиртов, спирты — до альдегидов, альдегиды — до кислот.
Процесс можно остановить на любой стадии в зависимости от желаемого результата.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Кислород – элемент 2-го периода и VIA-группы Периодической системы, порядковый номер 8, относится к халькогенам (но чаще рассматривается отдельно). Электронная формула атома [2He]2s22p4, характерные степени окисления чаще 0 и – II, реже – I и +II, состояние ОII считается устойчивым.
Шкала степеней окисления кислорода:
Кислород обладает высокой электроотрицательностью (3,50, второй элемент после фтора), проявляет типичные неметаллические свойства. Образует соединения со всеми элементами, кроме Не, Ne и Ar, входит в состав многочисленных оксидов, гидроксидов, солей кислородсодержащих кислот.
Природный кислород содержит изотоп 16O с примесью изотопов 17O и 18O. В химии большинство соединений природного кислорода рассматривается как изотопно-чистые соединения кислорода-16.
Кислород – самый распространенный элемент в земной коре (55 %) и природных водах, встречается в свободном и связанном виде. Жизненно важный элемент для всех организмов.
Кислород O2. Простое вещество. Состоит из неполярных молекул О2 (дикислород) с ??-связью O=O, устойчивая аллотропная форма существования элемента в свободном виде. Бесцветный газ, в жидком состоянии – светло-голубой, в твердом – синий.
Составная часть воздуха: 20,94 % по объему, 23,13 % по массе. Из жидкого воздуха кислород выкипает после азота N2. Малорастворим в воде (31 мл/1 л Н2O при 20 °C), но несколько лучше, чем N2. При комнатной температуре обладает малой химической активностью из-за прочности двойной связи в молекулах.
Кислород поддерживает горение многих веществ. Сильный окислитель при высоких температурах, реагирует с большинством металлов и неметаллов:
Кислород вызывает ржавление (медленное окисление) железа, уравнения реакций см. в 11.3. Особенно активен атомарный кислород О0 (активность выше, чем у озона O3), обычно получаемый непосредственно в зоне реакции при термическом разложении многих веществ.
Простейшая качественная реакция – яркое загорание тлеющей древесной лучинки в атмосфере кислорода.
Получение кислорода:
а) в промышленности – фракционная дистилляция жидкого воздуха, электролиз воды (уравнения реакций см. в разд. 12);
б) в лаборатории – нагревание легко разлагающихся кислородсодержащих веществ:
2HgO = 2Hg + O2 (450–500 °C)
2КMnO4 = К2MnO4 + MnO2 + O2 (200–240 °C)
2Na2O2 = 2Na2O + O2 (400–675 °C, вакуум)
2КClO3 = 2КCl + 3O2 (150–300 °C, кат. MnO2)
2KNO3 = 2KNO2 + O2 (400–520 °C)
Кислород является важнейшим продуктом основного химического производства. Применяется как реагент в химической технологии (обжиг сульфидных руд, синтез оксидов), металлургии (производство чугуна и стали) и газификации природного угля, при сварке и резке металлов; жидкий кислород – окислитель топлива в ракетной технике.
Убыль кислорода в атмосфере в результате процессов горения, гниения и дыхания возмещается растениями при фотосинтезе. При вдыхании человеком и животными воздуха в легкие кислород связывается с гемоглобином крови и переносится в клетки, где органические вещества (в первую очередь глюкоза) с его помощью окисляются и обеспечивают жизненную энергию организмов.
Озон O3. Простое вещество (трикислород), неустойчивая аллотропная форма существования элемента. Светло-синий газ с характерным («озоновым») запахом, тяжелее воздуха. Молекула имеет строение незавершенного треугольника [: O(O)2] (sр2-гибридизация, валентный угол 117°), содержит ковалентные ??-связи O=O. Разлагается под действием ультрафиолетового излучения, катализаторов и оксидов азота (разрушение озонового слоя атмосферы Земли). Устойчив в смеси с O2 (озонированный кислород). Малорастворим в воде (285 мл/1 л Н2O), но значительно лучше, чем O2. Сильный окислитель (более сильный, чем O2, но более слабый, чем атомарный кислород O0). Окисляет при комнатной температуре многие металлы и неметаллы до высоких степеней окисления. С надпероксидами щелочных металлов (К, Rb, Cs) образует оранжево-красные озониды. Не реагирует с Au, Cu, Ni, Pt, Sn. Генерируется из кислорода O2 в специальном приборе — озонаторе.
Качественная реакция – выделение иода из раствора KI при комнатной температуре (O2 в реакцию не вступает). Уравнения важнейших реакций:
Получение: под действием электрического разряда в озонаторе:
Применяется для дезинфекции питьевой воды, при отбеливании тканей и минеральных масел, как реагент в
неорганическом и органическом синтезе. В атмосфере Земли озоновый слой (на высоте =25 км) защищает живой мир от воздействия космического ультрафиолетового излучения.
Атомарный кислород О0. Третья аллотропная форма кислорода. Более сильный окислитель по сравнению с O2 и O3. Образуется при распаде молекул O2 и O3 под действием ультрафиолетового излучения. Возникает при термическом разложении кислородсодержащих веществ (см. выше, получение O2); при отсутствии восстановителей тут же переходит снова в O2 и O3, в присутствии восстановителей окисляет их:
KNO3 = KNO2 + O0
О0 + С (графит) = СO2
Поэтому вещества, легко отщепляющие кислород при нагревании, проявляют сильные окислительные свойства.
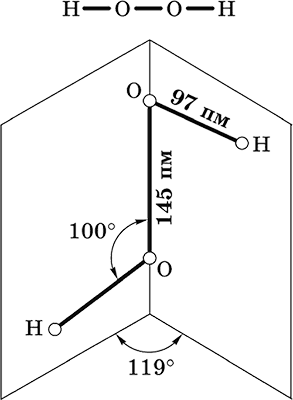
Пероксид водорода Н2O2. Бинарное соединение. Молекула Н2O2 неплоская, имеет строение с ?-связью О – О на ребре и связями Н – О на плоскостях двугранного угла. Степень окисления кислорода равна – I. Группа – О – О– называется пероксогруппой.
Бесцветная жидкость, вязкая, тяжелее воды, чувствительна к свету и примесям (стабилизатор Н3РO4). Разлагается со взрывом при слабом нагревании, на катализаторе – при комнатной температуре. Неограниченно смешивается с водой. Разбавленными щелочами нейтрализуется не полностью. Сильный окислитель, слабый восстановитель.
Пероксид водорода применяется как отбеливатель текстиля, бумаги, кож, жиров и минеральных масел, окислитель ракетного топлива, реагент в органическом синтезе, при осветлении картин старых мастеров (потемневший красочный слой из-за перехода белил – гидроксокарбонатов свинца – в черный PbS осветляют переводом в белый PbSO4). В промышленности обычно используют взрывобезопасный 30 %-ный раствор Н2O2 (пергидроль), в медицине – 3 %-ный раствор.
Уравнения важнейших реакций:
2Н2O2 = 2Н2O + O2 (выше 150 °C или на кат. MnO2)
Н2O2 (разб.) + NaOH (разб.) = NaHO2 + Н2O
Н2O2 (конц.) + 2NaOH(т) = Na2O2? + 2H2O (0 °C)
Н2O2 (3 %) + 2H+ + 2I— = I2? + 2Н2O
5Н2O2 (30 %) + I2(т) = 2НIO3 + 4Н2O
Н2O2 (10 %) + SO32- = SO32- + H2O
4Н2O2 (30 %) + PbS (черн.) = 4H2O + PbSO4 (бел.)?
3H2O2 + 2[Cr(OH)6]3- = 2CrO42- + 8H2O + 2OH—
2Н2O2 (конц.) + Са(ClO)2 = СаCl2 + 2Н2O + 2O2?
5H2O2 + 6H+ + 2MnO4— = 2Mn2+ + 5O2? + 8Н2O
Получение: в лаборатории вначале синтезируют пероксид бария ВаO2:
2ВаО + O2 (изб.) = 2ВаO2 (до 500 °C),
а затем его обрабатывают серной кислотой:
ВаO2 + H2SO4 = BaSO4? + Н2O2 (на холоду)
В промышленности (старый метод) – электролиз водного раствора H2SO4 или (NH4)2SO4 в специальных условиях; при этом кислота или соль не расходуются, а протекает электролиз воды с образованием на аноде Н2O2:
Современный промышленный способ (8O% мирового производства) – окисление сложного органического соединения 2-этилантрагидрохинон кислородом воздуха на холоду.
Кислород О
имеет атомный номер 8, расположен в главной подгруппе (подгруппе а)
VI
группе, во втором периоде. В атомах кислорода валентные электроны размещаются на 2-м энергетическом уровне, имеющем только
s
— и
p
-орбитали. Это исключает возможность перехода атомов О в возбуждённое состояние, поэтому кислород во всех соединениях проявляет постоянную валентность, равную II. Имея высокую электроотрицательность, атомы кислорода всегда в соединениях заряжены отрицательно (с.о. = -2 или -1). Исключение – фториды OF
2
и O
2
F
2
.
Для кислорода известны степени окисления -2, -1, +1, +2
Общая характеристика элемента
Кислород – самый распространенный элемент на Земле, на его долю приходится чуть меньше половины, 49 % от общей массы земной коры. Природный кислород состоит из 3 стабильных изотопов
16
О,
17
О и
18
О (преобладает
16
О). Кислород входит в состав атмосферы (20,9 % по объему, 23,2 по массе), в состав воды и более 1400 минералов: кремнезема, силикатов и алюмосиликатов, мраморов, базальтов, гематита и других минералов и горных пород. Кислород составляет 50-85% массы тканей растений и животных, т.к содержится в белках, жирах и углеводах, из которых состоят живые организмы. Общеизвестна роль кислорода для дыхания, для процессов окисления.
Кислород сравнительно мало растворим в воде – 5 объемов в 100 объемах воды. Однако, если бы весь растворенный в воде кислород перешел в атмосферу, то он занял бы огромный объем – 10 млн км
3
( н.у). Это равно примерно 1% всего кислорода в атмосфере. Образование на земле кислородной атмосферы обусловлено процессами фотосинтеза.
Открыт шведом К. Шееле ( 1771 – 1772 г.г) и англичанином Дж. Пристли ( 1774г.). Первый использовал нагревание селитры, второй – оксида ртути (+2). Название дал А.Лавуазье («оксигениум» — «рождающий кислоты»).
В свободном виде существует в двух аллотропных модификациях – «обыкновенного» кислорода О
2
и озона О
3
.

Строение молекулы озона
3О
2
= 2О
3
– 285 кДж
Озон в стратосфере образует тонкий слой, который поглощает большую часть биологически вредного ультрафиолетового излучения.
При хранении озон самопроизвольно превращается в кислород. Химически кислород О
2
менее активен, чем озон. Электроотрицательность кислорода 3,5.
Физические свойства кислорода
O
2
– газ без цвета, запаха и вкуса, т.пл. –218,7 °С, т.кип. –182,96 °С, парамагнитен.
Жидкий O
2
голубого, твердый – синего цвета. O
2
растворим в воде (лучше, чем азот и водород).
Получение кислорода
1. Промышленный способ — перегонка жидкого воздуха и электролиз воды:
2Н
2
О → 2Н
2
+ О
2
2.
В лаборатории кислород получают:
1.Электролизом щелочных водных растворов или водных растворов кислородосодержащих солей (Na
2
SO
4
и др.)
2. Термическим разложением перманганата калия KMnO
4
:
2KMnO
4
= K
2
MnO4 + MnO
2
+ O
2
↑,
Бертолетовой соли KClO
3
:
2KClO
3
= 2KCl + 3O
2
↑ (катализатор MnO
2
)
Оксида марганца (+4) MnO
2
:
4MnO
2
= 2Mn
2
O
3
+ O
2
↑ (700
o
C),
3MnO
2
= 2Mn
3
O
4
+ O
2
↑ (1000
o
C),
Пероксид бария BaO
2
:
2BaO
2
= 2BaO + O
2
↑
3. Разложением пероксида водорода:
2H
2
O
2
= H
2
O + O
2
↑ (катализатор MnO
2
)
4. Разложение нитратов:
2KNO
3
→ 2KNO
2
+ O
2
На космических кораблях и подводных лодках кислород получают из смеси K
2
O
2
и K
2
O
4
:
2K
2
O
4
+ 2H
2
O = 4KOH +3O
2
↑
4KOH + 2CO
2
= 2K
2
CO
3
+ 2H
2
O
Суммарно:
2K
2
O
4
+ 2CO
2
= 2K
2
CO
3
+ 3О
2
↑
Когда используют K
2
O
2
, то суммарная реакция выглядит так:
2K
2
O
2
+ 2CO
2
= 2K
2
CO
3
+ O
2
↑
Если смешать K
2
O
2
и K
2
O
4
в равномолярных (т.е. эквимолярных) количествах, то на 1 моль поглощенного СО
2
выделится один моль О
2.
Химические свойства кислорода
Кислород поддерживает горение.
Горение — б
ыстрый процесс окисления вещества, сопровождающийся выделением большого количества теплоты и света.
Чтобы доказать, что в склянке находится кислород, а не какой-то другой газ, надо в склянку опустить тлеющую лучинку. В кислороде тлеющая лучинка ярко вспыхивает. Горение различных веществ на воздухе – это окислительно-восстановительный процесс, в котором окислителем является кислород. Окислители – это вещества, «отбирающие» электроны у веществ-восстановителей. Хорошие окислительные свойства кислорода можно легко объяснить строением его внешней электронной оболочки.
Валентная оболочка кислорода расположена на 2-м уровне – относительно близко к ядру. Поэтому ядро сильно притягивает к себе электроны. На валентной оболочке кислорода
2s
2
2p
4
находится 6 электронов. Следовательно, до октета недостает двух электронов, которые кислород стремится принять с электронных оболочек других элементов, вступая с ними в реакции в качестве окислителя.
Кислород имеет вторую (после фтора) электроотрицательность в шкале Полинга. Поэтому в подавляющем большинстве своих соединений с другими элементами кислород имеет
отрицательную
степень окисления. Более сильным окислителем, чем кислород, является только его сосед по периоду – фтор. Поэтому соединения кислорода с фтором – единственные, где кислород имеет положительную степень окисления.
Итак, кислород – второй по силе окислитель среди всех элементов Периодической системы. С этим связано большинство его важнейших химических свойств.
С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород — окислитель.
Кислород легко реагирует с щелочными и щелочноземельными металлами:
4Li + O
2
→ 2Li
2
O,
2K + O
2
→ K
2
O
2
,
2Ca + O
2
→ 2CaO,
2Na + O
2
→ Na
2
O
2
,
2K + 2O
2
→ K
2
O
4
Мелкий порошок железа ( так называемого пирофорного железа) самовоспламеняется на воздухе, образуя Fe
2
O
3
, а стальная проволока горит в кислороде, если ее заранее раскалить:
3 Fe + 2O
2
→ Fe
3
O
4
2Mg + O
2
→ 2MgO
2Cu + O
2
→ 2CuO
С неметаллами (серой, графитом, водородом, фосфором и др.) кислород реагирует при нагревании:
S + O
2
→ SO
2
,
C + O
2
→ CO
2
,
2H
2
+ O
2
→ H
2
O,
4P + 5O
2
→ 2P
2
O
5
,
Si + O
2
→ SiO
2
, и т.д
Почти все реакции с участием кислорода O
2
экзотермичны, за редким исключением, например:
N
2
+ O
2
→
2NO – Q
Эта реакция протекает при температуре выше 1200
o
C или в электрическом разряде.
Кислород способен окислить сложные вещества, например:
2H
2
S + 3O
2
→ 2SO
2
+ 2H
2
O (избыток кислорода),
2H
2
S + O
2
→ 2S + 2H
2
O (недостаток кислорода),
4NH
3
+ 3O
2
→ 2N
2
+ 6H
2
O (без катализатора),
4NH
3
+ 5O
2
→ 4NO + 6H
2
O (в присутствии катализатора Pt ),
CH
4 (метан)
+ 2O
2
→ CO
2
+ 2H
2
O,
4FeS
2 (
пирит
)
+ 11O
2
→ 2Fe
2
O
3
+ 8SO
2
.
Известны соединения, содержащие катион диоксигенила O
2
+
, например, O
2
+
[PtF
6
]
—
(успешный синтез этого соединения побудил Н. Бартлетта попытаться получить соединения инертных газов).
Озон
Озон химически более активен, чем кислород O
2
. Так, озон окисляет иодид — ионы I
—
в растворе Kl:
O
3
+ 2Kl + H
2
O = I
2
+ O
2
+ 2KOH
Озон сильно ядовит, его ядовитые свойства сильнее, чем, например, у сероводорода. Однако в природе озон, содержащийся в высоких слоях атмосферы, выполняет роль защитника всего живого на Земле от губительного ультрафиолетового излучения солнца. Тонкий озоновый слой поглощает это излучение, и оно не достигает поверхности Земли. Наблюдаются значительные колебания в толщине и протяженности этого слоя с течением времени (так называемые озоновые дыры) причины таких колебаний пока не выяснены.
Применение кислорода O
2
: для интенсификации процессов получения чугуна и стали, при выплавке цветных металлов, как окислитель в различных химических производствах, для жизнеобеспечения на подводных кораблях, как окислитель ракетного топлива (жидкий кислород), в медицине, при сварке и резке металлов.
Применение озона О
3
:
для обеззараживания питьевой воды, сточных вод, воздуха, для отбеливания тканей.
Биологическая роль р-элементов VIA группы. Применение их соединений в медицине