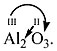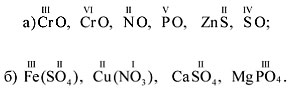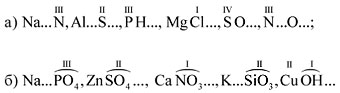САМОУЧИТЕЛЬ ПО ХИМИИ
Предлагаемый вашему вниманию Самоучитель — не обычный учебник по химии. В нём не просто излагаются какие-то факты, не просто описываются свойства веществ, как в обычном пособии. Этот курс по изучению химии объясняет и учит, особенно в тех случаях, если вы не можете или стесняетесь обратиться за разъяснениями к учителю. Данный самоучитель в виде рукописи использовался с 1991 г. школьниками, и не было ни одного ученика, который бы «провалился» на экзамене по химии и в школе, и в вузах. Большинство из них начинало с «нуля»!
Курс рассчитан на самостоятельную работу ученика. Главное, чтобы вы отвечали по ходу чтения на те вопросы, которые встречаются в тексте. Если вы не смогли ответить на вопрос, — читайте внимательнее ещё раз: все ответы имеются рядом. Желательно также выполнять все задания которые встречаются по ходу объяснения нового материала, а также задания ЕГЭ, которые взяты из реальных сборников ФИПИ разных лет издания. В этом вам помогут многочисленные обучающие алгоритмы, которые есть в каждой части Самоучителя по химии.
В интерактивном учебнике приведены, в основном, схемы химических реакций. Коэффициенты нужно расставлять самим, даже если об этом не сказано в задании. В конце каждого урока имеются упражнения, вопросы и задачи, которые проверяют степень усвоения предложенного материала. Если вы смогли, не подглядывая в текст урока, ответить на эти вопросы, сделать все упражнения, решить все задачи — замечательно. В противном случае ещё раз перечитайте урок.
В последних уроках самоучителя приведены также способы решения базовых задач по химии. В случае затруднений при решении задачи, условие которой имеется в конце главы, найдите эту задачу среди задач для самостоятельного решения в уроках 29–32, а потом посмотрите, как решается такая задача.
Изучив данный Самоучитель, вы сможете легко ответить на многие вопросы ЕГЭ и просто понять и, возможно, полюбить этот непростой, но очень интересный предмет ХИМИЯ.
Если ты готов, то дерзай! И да прибудет с тобой химия 🙂
Свойства элементов, цепочки реакций, расчётные задачи и таблица Менделеева не дают покоя: откуда брать материал, чтобы выучить всё для ЕГЭ по химии? Где отрабатывать навыки? За какими учебниками бежать в книжный? А в голове так и звучит: алканы, алкины, алкадиены, аллигаторы…
Стоп, отставить панику и крокодильчиков! В этой статье собрали все необходимые ресурсы, для успешной подготовки и сдачи ЕГЭ по химии.
📚 Пособия
Для начала отметим: среди пособий по подготовке к ЕГЭ по химии универсальной книги нет. Делать выбор придётся, исходя из индивидуальных предпочтений.
На что стоит обратить внимание, перед выбором пособия по химии:
-
Уровень подготовки
Во время подготовки к ЕГЭ по химии важно отслеживать свой уровень знаний, чтобы учебная литература полностью соответствовала вашим потребностям. Например, если вы начинаете подготовку «с нуля», не пытайтесь вчитываться в сложные учебники, а приобретите пособия базового уровня сложности, где информация изложена простым языком.
💡 Перед покупкой изучите демо-версию пособия в интернете и оцените, насколько вам понятен и приятен язык изложения выбранного вами автора.
-
Автор и его репутация
Важно учесть, насколько автор приближен к предмету: имеет ли он образование в области химии, знаком ли он с требованиями экзамена по химии, есть ли положительные отзывы о его работе среди других учеников и преподавателей.
-
Качество
Выбранное пособие должно также визуально вам нравится: удобное оформление, качество написанного текста, цвет бумаги — комфорт во время подготовки немало важен, это облегчает занятия и повышает эффективность.
Обзор на пособия для подготовки к ЕГЭ
Расскажем про самые популярные пособия для подготовки к ЕГЭ по химии. С выбором помогла преподавательница химии в онлайн-школе Вебиум Тася Фламель.
1️⃣ «Начала химии» Н.Е.Кузьменко, В.В.Еремин
 ➕ Классное дополнение к базе с подробными объяснениями
➕ Классное дополнение к базе с подробными объяснениями
➕ Углублённый уровень
➕ В качестве учебника, для прочтения после изучения тем
➖ Не связано с кодификатором ЕГЭ
➖ Много лишней информации
➖ Не подходит для изучения с нуля
Цена: 800–900 рублей
Ориентация на ЕГЭ: нет
Практика: да
Общее впечатление: 8/10
2️⃣ «Репетитор по химии» А.С.Егоров
➕ Базовый уровень
➕ Доступность изложения
➕ Много теории
➖ Мало подробного описанных реакций ( примеры на одном и том же химическом элементе)
➖ Недостаточно углубленной информации ( нюансы придется искать дополнительно самому)
Цена: 600 рублей
Ориентация на ЕГЭ: нет
Практика: да
Общее впечатление: 6/10
3️⃣ «Химия. Углубленный курс подготовки к ЕГЭ» В.Ерёмин
➕ Много практики ( задания после каждой главы)
➕ Примеры разобранных заданий
➕ Есть справочные материалы ( таблицы, качественные реакции и др.)
➖ Не подходит для изучения с базового уровня
Цена: 550–600 рублей
Ориентация на ЕГЭ: да
Практика: да
Общее впечатление: 8/10
4️⃣ «Пособие по химии для поступающих в вузы» Г.П.Хомченко, И.Г.Хомченко
➕ Представлены разборы задач
➕ Практика
➖ Очень мало теории
➖ Формат не подходит для ЕГЭ
Цена: 250–200 рублей
Ориентация на ЕГЭ: нет
Практика: да
Общее впечатление: 3/10
5️⃣ «Большой справочник для подготовки к ЕГЭ» В. Доронькин
➕ Решения задач с объяснением
➕ Большое количество представленных реакций
➕ Простой язык изложения, удобное оформление
➖ Подробно объяснены не все темы
Цена: 250–300 рублей
Ориентация на ЕГЭ: да
Практика: да
Общее впечатление: 6/10
6️⃣ «100 баллов по химии…» И.Ю.Белавин, В.В.Негребецкий
➕ Задания различной сложности
➕ Много схем, примеров
➕ Ориентировано на повторение
➖ Для изучения с нуля слишком “сухо” изложена информация
Цена: 500–550 рублей
Ориентация на ЕГЭ: да
Практика: да
Общее впечатление: 7/10
7️⃣ «Наглядная химия» Т.А.Жуляева
➕ Решения, пояснения задач
➕ Удобно для повторения
Цена: 260–300 рублей
Ориентация на ЕГЭ: да
Практика: нет
Общее впечатление: 7/10
8️⃣ Химия в таблицах Н.И.Островерхова

➕ Схемы,таблицы, рисунки
Цена: 140 рублей
Ориентация на ЕГЭ: да
Практика: нет
Общее впечатление: 6/10
9️⃣ Химия: справочник в таблицах
➕ Удобно для повторения
➕ Схемы,таблицы, рисунки
Цена: 140–246 рублей
Ориентация на ЕГЭ: нет
Практика: нет
Общее впечатление: 7/10
1️⃣0️⃣ «Химия весь школьный курс» А.И.Врублевский
➕ Хорошая база
➕ Много теории
➕ Подходит для подготовки с нуля
➕ Простой язык изложения
Цена: 600 рублей
Ориентация на ЕГЭ: да
Практика: нет
Общее впечатление: 7/10
📒 Учебники по химии для ЕГЭ
Если вы с 9 класса настроены на сдачу химии, то начните подготовку с изучения учебников с хорошей теорий и понятными объяснениями, например, от авторов И.И. Новошинского, В.В. Ерёмина, Н.Е. Кузьменко.
❗️В 11 классе учебники по химии хороши для повторения материала, но не в качестве главного инструмента подготовки к ЕГЭ.
💡Любые пособия, учебники и книги действительно работают тогда, когда ими регулярно пользуются, а не просто коллекционируют на полке. Не обязательно скупать все справочники по принципу «чем их больше, тем круче», достаточно приобрести один и проработать в хорошо закрепившиеся знания. Ведь на экзамене с собой у нас будут наши навыки, а не чемоданчик пособий.
📝 Практика
После прочтения любого материала его необходимо закрепить на практике, прорешав задания. Сделали подборку пособий по химии, чтобы отработать практическую часть для ЕГЭ.
1️⃣ «Типовые варианты» Д.Ю.Добротин
➕ Варианты от составителей ЕГЭ
➕ Формат соответствующий экзамену
➖ Средний уровень сложности
➖ Схожий формат вариантов ( задания мало отличаются друг от друга)
Цена: 300-400 рублей
Соответствие ЕГЭ: 5/5
Сложность: 3/5
2️⃣ Варианты Стадград
➖ Сложные темы, не всегда соответствующие ЕГЭ
Цена: —
Соответствие ЕГЭ: 4/5
Сложность: 4,5/5
💡 На канале Вебиума в Youtube преподавательница Таисия Фламель разбирает варианты и самые интересные задания по химии Стадград.
3️⃣ Группа в ВКонтакте «ЕГЭ на максимум»
➕ Подборка реальных вариантов заданий прошлых лет с ответами
Цена: —
Соответствие ЕГЭ: 5/5
Сложность: 3,5/5
4️⃣ Пособия, канал в Youtube, группа в ВКонтакте «Степенин и Дацук»
➕ Реальные варианты прошлых лет, авторские варианты в формате ЕГЭ
Цена: —
Соответствие ЕГЭ: 4 /5
Сложность: 4-4,5/5
5️⃣ Сайт «Наука для тебя»
➕ Хорошая практика
➕ Много заданий для нарешивания
Цена: —
Соответствие ЕГЭ: 3,5-4 /5
Сложность: 4-5/5
6️⃣ Решу ЕГЭ
➕ Варианты прошлых лет
➖ Объяснения заданий не в формате ЕГЭ
➖ Базовый уровень сложности
7️⃣ Открытый банк ФИПИ
➕ Реальные задания ЕГЭ
➖ Нет ответов к заданиям
8️⃣ Незнайка
➕Тематические задания с ответами
➕ Тесты
У нас в онлайн-школе Вебиум тоже много материалов для подготовки к ЕГЭ по химии: в группе в ВКонтакте мы выкладываем полезные памятки и материалы по темама экзамена, на канале в YouTube — разбираем задачки прошлых лет, а на сайте можно пройти бесплатные пробники и записаться на курсы по отдельным темам.
Чтобы сдать ЕГЭ по химии на максимальный балл, важно запастись полезной литературой и набрать темп подготовки. Не ограничивайтесь только одним учебником или пособием, а используется приведённые в нашей подборке ресурсы по-максимуму. И тогда сотка на ЕГЭ вам обеспечена!
А как вы предпочитаете готовиться к ЕГЭ по химии?
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter. Мы обязательно поправим!
Е.Н.ФРЕНКЕЛЬ
Самоучитель по химии
Пособие для тех, кто не знает, но хочет
узнать и понять химию
Часть I. Элементы общей химии
(первый уровень сложности)
От автора
Я, Френкель Евгения Николаевна, заслуженный
работник высшей школы РФ, выпускница химического
факультета МГУ 1972 г., педагогический стаж 34 года.
Кроме того, я мать троих детей и бабушка четырех
внуков, старший из которых школьник.Меня волнует проблема школьных учебников.
Главная беда многих из них – тяжелый язык,
который требует дополнительного «перевода» на
понятный школьнику язык изложения учебного
материала. Ко мне часто обращаются ученики
средней школы с такой просьбой: «Переведите
текст учебника, чтобы понятно было». Поэтому я
написала «Самоучитель по химии», в котором
многие сложные вопросы изложены вполне доступно
и в то же время научно. На основе этого
«Самоучителя», который был написан в 1991 г., я
разработала программу и содержание
подготовительных курсов. На них обучались сотни
школьников. Многие из них начинали с нуля и за 40
занятий понимали предмет настолько, что сдавали
экзамены на «4» и «5». Поэтому в нашем городе мои
пособия-самоучители расходятся как горячие
пирожки.Может, и другим пригодятся мои наработки?
Статья подготовлена при поддержке учебного центра «МакарОФФ». Учебный центр предлагает Вам пройти курсы маникюра в Москве недорого. Профессиональная школа маникюра проводит обучение по маникюру, педикюру, наращиванию и дизайну ногтей, а также курсы мастеров-универсалов ногтевого сервиса, наращивание ресниц, микроблейдинг, шугаринг и эпиляция воском. Центр выдаёт дипломы после обучения и гарантированное трудоустройство. Подробная информация обо всех программах обучения, цены, расписание, акции и скидки, контакты на сайте: www.akademiyauspeha.ru .
Предисловие
Уважаемые читатели! Предлагаемый вашему
вниманию «Самоучитель по химии» – не обычный
учебник. В нем не просто излагаются какие-то
факты или описываются свойства веществ.
«Самоучитель» объясняет и учит даже в том случае,
если вы, к сожалению, не знаете и не понимаете
химии, а к учителю обратиться за разъяснениями не
можете или стесняетесь. В виде рукописи эта книга
используется школьниками с 1991 г., и не было ни
одного ученика, который бы провалился на
экзамене по химии и в школе, и в вузах. Причем
многие из них совсем не знали химии.
«Самоучитель» рассчитан на самостоятельную
работу ученика. Главное – отвечать по ходу
чтения на те вопросы, которые встречаются в
тексте. Если вы не смогли ответить на вопрос, то
читайте внимательнее текст еще раз – все ответы
имеются рядом. Желательно также выполнять все
упражнения, которые встречаются по ходу
объяснения нового материала. В этом помогут
многочисленные обучающие алгоритмы, которые
практически не встречаются в других учебниках. С
их помощью вы научитесь:
составлять химические
формулы по валентности;
составлять уравнения
химических реакций, расставлять в них
коэффициенты, в том числе в уравнениях
окислительно-восстановительных процессов;
составлять электронные
формулы (в том числе краткие электронные формулы)
атомов и определять свойства соответствующих
химических элементов;
предсказывать свойства
некоторых соединений и определять, возможен
данный процесс или нет.
В пособии два уровня сложности. Самоучитель первого
уровня сложности состоит из трех частей.
I часть. Элементы общей химии (публикуемая).
II часть. Элементы неорганической химии.
III часть. Элементы органической химии.
Книг второго уровня сложности тоже три.
Теоретические основы общей химии.
Теоретические основы неорганической химии.
Теоретические основы органической химии.
СОДЕРЖАНИЕ
Глава 1. Основные понятия химии.
Упражнения к главе 1.
Глава 2. Важнейшие классы неорганических
соединений.
2.1. Оксиды.
2.2. Кислоты.
2.3. Основания.
2.4. Соли.
Упражнения к главе 2.
Глава 3. Элементарные сведения о строении
атома. Периодический закон Д.И.Менделеева.
Упражнения к главе 3.
Глава 4. Понятие о химической связи.
Глава 5. Растворы.
Глава 6. Электролитическая диссоциация.
6.1. Понятие о рН (водородном показателе).
6.2. Гидролиз солей.
Упражнения к главе 6.
Глава 7. Понятие об
окислительно-восстановительных реакциях.
Глава 8. Расчеты по химическим формулам и
уравнениям.
8.1. Основные расчетные понятия.
8.2. Задачи, решаемые по стандартным формулам.
8.2.1. Задачи по теме «Газы».
8.2.2. Задачи по теме «Способы выражения
концентрации растворов».8.2.3. Задачи по теме «Количественный состав
вещества».8.3. Задачи, решаемые по уравнениям реакций.
8.3.1. Оформление расчетов по уравнениям реакций.
8.3.2. Задачи по теме «Количественный состав
растворов и смесей».8.3.3. Задачи на установление формулы вещества.
8.4. Задачи для самостоятельного решения.
Приложение.
Глава 1. Основные понятия химии
Что такое химия? Где мы встречаемся с
химическими явлениями?
Химия – везде. Сама жизнь – это бесчисленное
множество разнообразных химических реакций,
благодаря которым мы дышим, видим голубое небо,
ощущаем изумительный запах цветов.
Что изучает химия?
Химия изучает вещества, а также химические
процессы, в которых участвуют эти вещества.
Что такое вещество?
Вещество – это то, из чего состоит окружающий
нас мир и мы сами.
Что такое химический процесс (явление)?
К химическим явлениям относятся процессы, в
результате которых изменяется состав или
строение молекул, образующих данное вещество*. Изменились молекулы –
изменилось вещество (оно стало другим),
изменились его свойства. Например, свежее молоко
стало кислым, зеленые листья стали желтыми, сырое
мясо при обжаривании изменило запах.
Все эти изменения – следствие сложных и
многообразных химических процессов. Однако
признаки простых химических реакций, в
результате которых изменяется состав и строение
молекул, такие же: изменение цвета, вкуса или
запаха, выделение газа, света или тепла,
появление осадка.
Что же такое молекулы, изменение которых влечет
за собой столь разнообразные проявления?
Молекулы – это мельчайшие частицы вещества,
отражающие его качественный и количественный
состав и его химические свойства.
Изучая состав и строение одной молекулы, можно
предсказать многие свойства данного вещества в
целом. Такие исследования – одна из главных
задач химии.
Как устроены молекулы? Из чего они состоят?
Молекулы состоят из атомов. Атомы в
молекуле соединены при помощи химических связей.
Каждый атом обозначается при помощи символа
(химического знака). Например, Н – атом водорода,
О – атом кислорода.
Число атомов в молекуле обозначают при помощи индекса
– цифры внизу справа после символа.
Например:
Примеры молекул:
О2 – это молекула вещества кислорода,
состоящая из двух атомов кислорода;
Н2О – это молекула вещества воды,
состоящая из двух атомов водорода и одного атома
кислорода.
Если атомы не связаны химической связью, то их
число обозначают при помощи коэффициента –
цифры перед символом:
Аналогично изображают число молекул:
2Н2 – две молекулы водорода;
3Н2О – три молекулы воды.
Почему атомы водорода и кислорода имеют разные
названия и разные символы? Потому что это атомы
разных химических элементов.
Химический элемент – это вид атомов с
одинаковым зарядом ядер.
Что такое ядро атома? Почему заряд ядра
является признаком принадлежности атома к
данному химическому элементу? Чтобы ответить на
эти вопросы, следует уточнить: изменяются ли
атомы в химических реакциях, из чего состоит
атом?
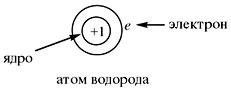
Нейтральный атом не имеет заряда, хотя и
состоит из положительно заряженного ядра и
отрицательно заряженных электронов:
В ходе химических реакций число электронов
любого атома может изменяться, а вот заряд ядра
атома не меняется. Поэтому заряд ядра
атома – своеобразный «паспорт» химического
элемента. Все атомы с зарядом ядра +1 принадлежат
химическому элементу под названием водород.
Атомы с зарядом ядра +8 относятся к химическому
элементу кислороду.
Каждому химическому элементу присвоен
химический символ (знак), порядковый номер в
таблице Д.И.Менделеева (порядковый номер равен
заряду ядра атома), определенное название, а для
некоторых химических элементов – особое
прочтение символа в химической формуле (табл. 1).
Таблица 1
Символы (знаки) химических элементов
| № п/п | № в таблице Д.И.Менделеева |
Символ | Прочтение в формуле | Название |
| 1 | 1 | H | аш | Водород |
| 2 | 6 | C | це | Углерод |
| 3 | 7 | N | эн | Азот |
| 4 | 8 | O | о | Кислород |
| 5 | 9 | F | фтор | Фтор |
| 6 | 11 | Na | натрий | Натрий |
| 7 | 12 | Mg | магний | Магний |
| 8 | 13 | Al | алюминий | Алюминий |
| 9 | 14 | Si | силициум | Кремний |
| 10 | 15 | P | пэ | Фосфор |
| 11 | 16 | S | эс | Сера |
| 12 | 17 | Cl | хлор | Хлор |
| 13 | 19 | K | калий | Калий |
| 14 | 20 | Ca | кальций | Кальций |
| 15 | 23 | V | ванадий | Ванадий |
| 16 | 24 | Cr | хром | Хром |
| 17 | 25 | Mn | марганец | Марганец |
| 18 | 26 | Fe | феррум | Железо |
| 19 | 29 | Cu | купрум | Медь |
| 20 | 30 | Zn | цинк | Цинк |
| 21 | 35 | Br | бром | Бром |
| 22 | 47 | Ag | аргентум | Серебро |
| 23 | 50 | Sn | станнум | Олово |
| 24 | 53 | I | йод | Йод |
| 25 | 56 | Ba | барий | Барий |
| 26 | 79 | Au | аурум | Золото |
| 27 | 80 | Hg | гидраргирум | Ртуть |
| 28 | 82 | Pb | плюмбум | Cвинец |
Вещества бывают простые и сложные.
Если молекула состоит из атомов одного
химического элемента, это простое вещество. Простые
вещества – Са, Сl2, О3, S8 и т. д.
Молекулы сложных веществ состоят из атомов
разных химических элементов. Сложные
вещества – H2O, NO, H3PO4, C12H22O11
и т. д.
Задание 1.1. Укажите число атомов в молекулах
сложных веществ H2O, NO, H3PO4, C12H22O11,
назовите эти атомы.
Возникает вопрос: почему для воды всегда
записывается формула Н2О, а не НО или НО2?
Опыт доказывает, что состав воды, полученной
любым способом или взятой из любого источника,
всегда соответствует формуле Н2О (речь идет
о чистой воде).
Дело в том, что атомы в молекуле воды и в
молекуле любого другого вещества соединены при
помощи химических связей. Химическая связь
соединяет как минимум два атома. Поэтому, если
молекула состоит из двух атомов и один из них
образует три химические связи, то другой также
образует три химические связи.
Число химических связей, образуемых атомом,
называют его валентностью.
Если обозначить каждую химическую связь
черточкой, то для молекулы из двух атомов АБ
получим АБ, где тремя
черточками показаны три связи, образуемые
элементами А и Б между собой.
В данной молекуле атомы А и Б трехвалентны.
Известно, что атом кислорода двухвалентен, атом
водорода одновалентен.
В о п р о с. Сколько атомов водорода может
присоединиться к одному атому кислорода?
О т в е т. Два атома. Состав воды описывают
формулой Н–О–Н, или Н2О.
П о м н и т е! В устойчивой молекуле не может быть
«свободных», «лишних» валентностей. Поэтому для
двухэлементной молекулы число химических связей
(валентностей) атомов одного элемента равно
общему числу химических связей атомов другого
элемента.
Валентность атомов некоторых химических
элементов постоянна (табл. 2).
Таблица 2
Значение постоянных валентностей
некоторых элементов
|
Валентность |
Символы элементов |
| I | H, F, Ag, Na, K |
| II | O, Ca, Мg, Ba, Zn |
| III | Аl |
Для других атомов валентность** можно определить (вычислить)
из химической формулы вещества. При этом нужно
учитывать изложенное выше правило о химической
связи. Например, определим валентность x
марганца Mn по формуле вещества MnO2:
Общее число химических связей, образуемых
одним и другим элементом (Mn и О), одинаково:
x · 1 = 4; II · 2 = 4. Отсюда х = 4, т.е. в этой
химической формуле марганец четырехвалентен.
П р а к т и ч е с к и е в ы в о д ы
1. Если один из атомов в молекуле одновалентен,
то валентность второго атома равна числу атомов
первого элемента (см. на индекс!):
2. Если число атомов в молекуле одинаково, то
валентность первого атома равна валентности
второго атома:
3. Если у одного из атомов индекс отсутствует, то
его валентность равна произведению валентности
второго атома на его индекс:
4. В остальных случаях ставьте валентности
«крест-накрест», т.е. валентность одного элемента
равна индексу другого элемента:
Задание 1.2. Определите валентности
элементов в соединениях:
CO2, CO, Mn2O7, Cl2O, P2O3,
AlP, Na2S, NH3, Mg3N2.
П о д с к а з к а. Сначала укажите валентность
атомов, у которых она постоянная. Аналогично
определяется валентность атомных групп ОН, РО4,
SО4 и др.
Задание 1.3. Определите валентности атомных
групп (в формулах подчеркнуты):
H3PO4, Ca(OH)2, Ca3(PO4)2,
H2SO4, CuSO4.
(Обратите внимание! Одинаковые группы атомов
имеют одинаковые валентности во всех
соединениях.)
Зная валентности атома или группы атомов, можно
составить формулу соединения. Для этого
пользуются следующими правилами.
• Если валентности атомов одинаковы, то и число
атомов одинаково, т.е. индексы не ставим:
• Если валентности кратны (обе делятся на одно
и то же число), то число атомов элемента с меньшей
валентностью определяем делением:
• В остальных случаях индексы определяют
«крест-накрест»:
Задание 1.4. Составьте химические формулы
соединений:
Вещества, состав которых отражают химические
формулы, могут участвовать в химических
процессах (реакциях). Графическая запись,
соответствующая данной химической реакции,
называется уравнением реакции. Например, при
сгорании (взаимодействии с кислородом) угля
происходит химическая реакция:
С + O2 = CO2.
Запись показывает, что один атом углерода С,
соединяясь с одной молекулой кислорода O2,
образует одну молекулу углекислого газа СО2.
Число атомов каждого химического элемента до и
после реакции должно быть одинаково. Это
правило – следствие закона сохранения массы
вещества. Закон сохранения массы: масса
исходных веществ равна массе продуктов реакции.
Закон был открыт в XVIII в. М.В.Ломоносовым и,
независимо от него, А.Л.Лавуазье.
Выполняя этот закон, необходимо в уравнениях
химических реакций расставлять коэффициенты
так, чтобы число атомов каждого химического
элемента не изменялось в результате реакции.
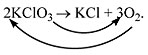
Например, при разложении бертолетовой соли KClO3
получается соль KСl и кислород О2:
KClO3 KСl + О2.
Число атомов калия и хлора одинаково, а
кислорода – разное. Уравняем их:
Теперь изменилось число атомов калия и хлора до
реакции. Уравняем их:
Наконец, между правой и левой частями уравнения
можно поставить знак равенства:
2KClO3 = 2KСl + 3О2.
Полученная запись показывает, что при
разложении сложного вещества KClO3
получаются два новых вещества – сложное KСl и
простое – кислород O2. Числа перед
формулами веществ в уравнениях химических
реакций называют коэффициентами.
При подборе коэффициентов необязательно
считать отдельные атомы. Если в ходе реакции не
изменился состав некоторых атомных групп, то
можно учитывать число этих групп, считая их
единым целым. Составим уравнение реакции веществ
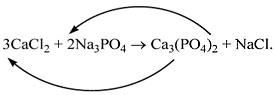
CaCl2 и Na3PO4:
CaCl2 + Na3PO4 ……………… .
П о с л е д о в а т е л ь н о с т ь д е й с т в и й
1) Определим валентность исходных атомов и
группы PO4:
2) Напишем правую часть уравнения (пока без
индексов, формулы веществ в скобках надо
уточнить):
3) Составим химические формулы полученных
веществ по валентностям составных частей:
4) Обратим внимание на состав самого сложного
соединения Ca3(PO4)2 и уравняем
число атомов кальция (их три) и число групп РО4
(их две):
5) Число атомов натрия и хлора до реакции теперь
стало равным шести. Поставим соответствующий
коэффициент в правую часть схемы перед формулой
NaCl:
3CaCl2 + 2Na3PO4 = Ca3(PO4)2
+ 6NaCl.
Пользуясь такой последовательностью, можно
уравнять схемы многих химических реакций (за
исключением более сложных
окислительно-восстановительных реакций, см.
главу 7).
Типы химических реакций. Химические
реакции бывают разных типов. Основными являются
четыре типа – соединение, разложение, замещение
и обмен.
1. Реакции соединения – из двух и более
веществ образуется одно вещество:
А + В АВ.
Например:
Са + Сl2 = CaCl2.
2. Реакции разложения – из одного вещества
получаются два вещества или более:
АВ А + В.
Например:
Ca(HCO3)2 CaCO3 + CO2 + H2O.
3. Реакции замещения – реагируют простое и
сложное вещества, образуются также простое и
сложное вещества, причем простое вещество
замещает часть атомов сложного вещества:
А + ВХ АХ + В.
Например:
Fe + CuSO4 = Cu + FeSO4.
4. Реакции обмена – здесь реагируют два
сложных вещества и получаются два сложных
вещества. В ходе реакции сложные вещества
обмениваются своими составными частями:
АВ + XY АY + XВ.
Например:
Al(OH)3 + 3HCl = AlCl3 + 3H2O.
Существуют и другие типы химических реакций.
Задание 1.5. Расставьте коэффициенты в
схемах реакций:
Na + Cl2 NaCl,
NaHCO3 Na2CO3
+ CO2 + H2O,
Fe + AgNO3 Fe(NO3)2
+ Ag,
Fe(OH)3 + HCl
FeСl3 + H2O.
Задание 1.6. Расставьте коэффициенты и
определите типы химических реакций:
Fe(OH)3 Fe2O3
+ H2O,
Al + H2SO4 Al2(SO4)3 + H2,
HNO3 + Cu(OH)2 Cu(NO3)2 + H2O,
P + O2 P2O5.
Выводы по главе 1. Вещества состоят из
молекул, молекулы состоят из атомов, атомы с
одинаковым зарядом ядра относятся к одному и
тому же химическому элементу.
Вещества бывают простые и сложные. Состав
веществ показывают при помощи химических формул.
Формулы веществ составляют, учитывая
валентности составных частей. Запись
химического процесса при помощи формул
называется уравнением химической реакции.
Химические реакции бывают разных типов: обмена,
замещения, разложения, соединения и др.
Упражнения к главе 1
1. Выучите табл. 1. Проверьте себя, напишите
химические символы: серы, цинка, олова, магния,
марганца, калия, кальция, свинца, железа и фтора.
2. Напишите символы химических элементов,
которые в формулах произносятся как: «аш», «о»,
«купрум», «эс», «пэ», «гидраргирум», «станнум»,
«плюмбум», «эн», «феррум», «це», «аргентум».
Назовите эти элементы.
3. Укажите число атомов каждого химического
элемента в формулах соединений:
Al2S3, СаS, МnО2, NH3,
Mg3P2, SO3.
4. Определите, какие из веществ – простые, а
какие – сложные:
Na2O, Na, O2, CaCl2, Cl2.
Прочитайте формулы этих веществ.
5. Выучите табл. 2. Составьте химические
формулы веществ по известной валентности
элементов и атомных групп:
6. Определите валентность химических
элементов в соединениях:
N2O, Fe2O3, PbO2, N2O5,
HBr, SiH4, H2S, MnO, Al2S3.
7. Расставьте коэффициенты и укажите типы
химических реакций:
а) Mg + O2 MgO;
б) Al + CuCl2 AlCl3
+ Cu;
в) NaNO3 NaNO2 + O2;
г) AgNO3 + BaCl2
AgCl + Ba(NO3)2;
д) Al + HCl AlCl3 + H2;
е) KOH + H3PO4 K3PO4
+ H2O;
ж) CH4 C2H2
+ H2.
* Существуют вещества,
построенные не из молекул. Но об этих веществах
речь пойдет позже (см. главу 4).
** Строго говоря, по
нижеизложенным правилам определяют не
валентность, а степень окисления (см. главу 7).
Однако во многих соединениях числовые значения
этих понятий совпадают, поэтому по формуле
вещества можно определять и валентность.
Печатается с продолжением
Сделали подборку из 25 полезных ресурсов для подготовки к ЕГЭ по химии. Среди них: базовые сайты, youtube-лекции, учебники и приложения. Все ресурсы бесплатные, без регистрации и смс.
Друзья, на связи «Сотка».
Онлайн–школа, которая подготовила к ЕГЭ более 63000 учеников👇
Ниже вы увидите список из 25 ссылок с ресурсами.
Нажмите на ссылку, чтобы узнать подробнее о ресурсе.
Нажмите кнопку «назад» в браузере, чтобы вернутся к списку.
Сайты:
- ФИПИ
- Рособрнадзор
- Калькулятор балов
- Решу ЕГЭ
- Яндекс.ЕГЭ
- Наука для тебя
- Edumedia-sciences
- Сайт учителя Кардаевой Т. А.
- Сhemege
- ХИМИК
- 4EGE
- Учебник по органической химии
- Экзамен по химии
- Сайт учителя Ким Н. В.
- Российский учебник
- Studarium
- Compundchem
- Examer
- Сайт учителя Натеткиной С. А.
Видеолекции:
- Stepenin
- Examtop100
- Химия — просто
- Ptichka_ximichka
- Thoisoi
Приложения:
- «Химия»
🗿Бонус:
- Советы для успешной подготовки к ЕГЭ по химии
- Ресурсы для подготовки по другим предметам
Подготовка к ЕГЭ по химии: базовые сервисы
Прежде чем приступим к рассмотрению основных ресурсов для подготовки к ЕГЭ по химии — остановимся на базовых сайтах. Базовыми они называются потому, что будут актуальны для любого ученика, который сдает ЕГЭ. Вне зависимости от выбранного предмета.
- ФИПИ — сайт организации, которая каждый год создает и актуализирует КИМы для ЕГЭ по всем предметам. На этом ресурсе вы найдете информацию об изменениях и нововведениях на экзамене.
- Рособрнадзор — федеральная служба следит, чтобы экзамен проходил в соответствии с правилами и нормами, которые они же и устанавливают. На ресурсе вы найдете актуальное расписание экзаменов, свежие КИМы и другую важную документацию.
- Калькулятор баллов — название сайта говорит само за себя. Когда узнаете свои баллы по химии — введите их на сайте и ознакомьтесь с перечнем ВУЗов, которые уже жду вас.
Подготовка к ЕГЭ по химии: сайты
- Решу ЕГЭ — здесь вам будут доступны тренировочные задания разного уровня сложности. После завершения тестирования — сайт автоматически покажет правильные ответы и выставит оценку.
- Яндекс.ЕГЭ — тренировочные тестовые задания по химии от разных авторов. По функционалу сайт похож на «Решу ЕГЭ». Отличие лишь в дизайне. Здесь вы также сможете прорешать онлайн тесты, понять сколько баллов вы набираете и какие ошибки допускаете.
- Наука для тебя — образовательный портал по химии. На ресурсе много теоретической информации, справочного материала, а также ответы на распространенные вопросы по разным темам. Если потребуются расчеты с участием кристаллогидратов — вам на этот сайт.
- Edumedia-sciences — ресурс примечателен тем, что объяснения задач происходит схематически, с помощью анимации. Это называется — мультимедийная энциклопедия. Подача материала таким способом на 100% эффективнее обычных лекций. Попробуйте сами.
- Сайт учителя по химии Кардаевой Т. А. — на сайте много теоретического материала по органической и неорганической химии. Здесь вы найдете теоретические основы по химии и методы ее познания.
- Сhemege — сайт репетитора по химии Степанова В. Н. Помимо теоретической информации и тестовых заданий на сайте вы сможете прорешать олимпиадные задания по химии.
- ХИМИК — популярный ресурс для тех, кто готовится к сдаче экзамена по химии. Вы можете воспользоваться онлайн-учебниками по органической, и неорганической химии. Онлайн вычисления малярных масс, игра «Таблица Менделеева» — все это на xumuk.ru.
- 4ЕГЭ — на ресурсе можно найти свежие КИМы, прорешать тесты онлайн, найти шпаргалку или презентацию по нужной теме. Листайте ленту, выбирайте нужный раздел и изучайте.
- Органическая химия — интерактивный сайт-учебник. Выбираете нужную тему для изучения — получаете теоретическое объяснение вопроса с элементами анимации, видео или аудио. Очень просто и визуально наглядно.
- Экзамен по химии — на этом ресурсе вы найдете задания с решениями. Выбираете тему из каталога и изучайте задание. Оно снабжено пояснениями в максимально возможном объеме. Это обеспечивает методическую поддержку при самостоятельной подготовке к ЕГЭ по химии.
- Сайт учителя химии Ким Н. В. — тот случайно, когда не стоит судить по дизайну. На авторском сайте Натальи Викторовны вы найдете накопленный ею материал, тесты, картинки, анимации и документацию для успешной подготовки к ЕГЭ по химии.
- Корпорация Российский учебник — ресурс с наглядным раздаточным материалом. Здесь вы сможете найти и сохранить на свой смартфон плакаты по химии. Визуализация материала очень важна в обучении:)
- Studarium — простой и визуально приятный сайт для подготовки к ЕГЭ по химии. На ресурсе вы найдете теоретическую информацию по органической, общей и неорганической химии. Материал доносится с помощью полезных и структурированных конспектов с разбивкой на темы.
- Compundchem — ресурс для тех, кто немного понимает английский. Здесь вы найдете большое количество инфорграфики. С помощью визуализации авторы ресурса отвечают на необычные вопросы, связанные с химией.
- Examer — здесь вы найдете теорию с разбивкой на темы для качественной подготовки к ЕГЭ по химии.
- Сайт учителя Натеткиной С. А. — в разделе «ЕГЭ» есть множество постов с тематическим материалом для подготовки к экзамену. Таблица качественных реакций органических веществ, важнейшие реакции железа, шпаргалки, множество инфографики и таблиц — все это на ресурсе «Химикус».
Подготовка к ЕГЭ по химии: видеолекции
- Stepenin— на канале вас ждут понятные объяснения основных принципов органической химии, качественная картинка и простое донесение информации.
- Examtop100 — автор канала — это преподаватель по химии Ермолаев И.С. Здесь вы найдете заданий за прошлые года и пробные варианты для успешной подготовки к ЕГЭ по химии. Для удобства видео собраны в тематические плейлисты.
- Химия — просто — канал с познавательными видео химических опытов и объяснениями к ним. Здесь вы найдёте много интересного, весёлого и полезного. Если вы хотите не скучно провести время и подготовится к ЕГЭ по химии — вам на этот канал.
- Ptichka_ximichka — на канале достаточно полезного материала, чтобы подготовить ученика к ЕГЭ по химии с нуля. Здесь вы найдете разборы демоверсий, основные понятия, законы и формулы.
- Thoisoi — на канале можно найти опыты по органической или неорганической химии. Для каждого опыта есть объяснения, которые будут понятны даже далеким от химии людям. Качественный и крутой контент.
Подготовка к ЕГЭ по химии: приложения
- «Химия» (Android, iOS) — с помощью этого приложения вы сможете находить химические уравнения с одним или несколькими неизвестными. Калькулятор расчета молярных масс, таблица Менделеева и таблица растворимости теперь всегда в вашем смартфоне.
Советы для успешной подготовки к ЕГЭ по химии:
Теперь когда вы знаете так много полезных сервисов для подготовки к ЕГЭ по химии, может возникнуть вопрос:
— «в каком порядке начать изучение материала? С какого ресурса начать?
Простые, но действенные советы от онлайн-школы «Сотка»👇
- Решите несколько демо-вариантов тестов, чтобы понять свой уровень подготовки и темы, которые вызывают непонимание.
- Из предложенной подборки выберите ресурсы, где есть теоретическая или практическая информация по проблемным темам.
- Целенаправленно тренируйтесь по проблемным темам, прорешивая онлайн-тесты на «Решу ЕГЭ« или »Яндекс ЕГЭ».
- У вас должен быть человек, которому вы сможете задавать вопросы. И это не обязательно должен быть репетитор. Это может быть, как школьный учитель, так и знакомый из университета, изучающий химию.
- Создайте график подготовки. Он нужен, чтобы вы понимали время и дни, когда вы будете заняты подготовкой к ЕГЭ по химии.
- Вам стоит наладить режим и не забывать отдыхать. Важно давать организму отдых и время, чтобы усвоить информацию.
Мы уверены, что вы сдадите экзамены на максимальный балл и поступите в ВУЗ своей мечты!)
💙 С заботой, ваша «Сотка».
Ресурсы для подготовки по другим предметам
Курсы ЕГЭ: 33 бесплатных сайта
Статья содержит информацию о курсах ЕГЭ по различным предметам, включая: литературу, математику, химию, русский язык, обществознание, информатику, физику, английский язык и биологию. Все курсы ЕГЭ являются бесплатными. Материал регулярно обновляется — сохраняйте в закладки.
Курсы ЕГЭ | youtube.com/c/devinf74
ЕГЭ 2023: расписание, изменения, бесплатные лекции
В статье вы найдете всю необходимую информацию по теме ЕГЭ 2023: расписание, баллы, изменения, а также бесплатные ресурсы для подготовки по любому предмету. Статья регулярно обновляется, поэтому смело добавляйте ее в Закладки.
Подготовка к ЕГЭ: 139 бесплатных сайтов
В статье вы найдете 139 бесплатных ресурсов для подготовки к ЕГЭ по следующим предметам: математика, русский язык, обществознание, информатика, физика, английский язык, литература, химия, биология. Статья регулярно обновляется — добавляйте в закладки.
🗣Уверены, что это далеко не полный список полезных сайтов для подготовки к ЕГЭ по химии, поэтому будет рады, если вы поделитесь своими рекомендациями в комментариях👇
Полный курс подготовки к ЕГЭ по химии-2023. Здесь приведена теория по каждому заданию в соответствии с спецификацией и кодификатором ЕГЭ по химии. Учебные материалы и теория, необходимые для подготовки к ЕГЭ по химии.
Вы можете поддержать работу сайта, разработку новых материалов и тестов. Донаты принимаются через форму:
Обратите внимание! Форма выше — это не оплата курса по химии, это форма для сбора донатов на работу сайта)
Кодификатор ЕГЭ по химии-2022
| 1 | ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ | |
| |
1.1. | Современные представления о строении атома |
| 1.1.1. | Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояния атомов
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами) |
|
| 1.2 | Периодический закон и Периодическая система химических элементов Д.И. Менделеева |
|
| 1.2.1. | Закономерности изменения свойств элементов и их соединений по периодам и группам
Тренировочные тесты в формате ЕГЭ по теме «Периодический закон» (задание 2 ЕГЭ по химии) ( с ответами) |
|
| 1.2.2. | Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. | |
| 1.2.3. | Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов | |
| 1.2.4. | Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов | |
| 1.3. | Химическая связь и строение вещества |
|
| 1.3.1 | Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Тренировочные тесты в формате ЕГЭ по теме «Химические связи» (задание 4 ЕГЭ по химии) ( с ответами) |
|
| 1.3.2. | Электроотрицательность. Степень окисления и валентность химических элементов
Тренировочные тесты в формате ЕГЭ по теме «Степень окисления и валентность» (задание 3 ЕГЭ по химии) ( с ответами) |
|
| 1.3.3. | Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения | |
| 1.4. | Химическая реакция | |
| 1.4.1. | Классификация химических реакций в неорганической и органической химии
Тренировочные тесты в формате ЕГЭ по теме «Классификация реакций» ( с ответами) |
|
| 1.4.2. | Тепловой эффект химической реакции. Термохимические уравнения | |
| 1.4.3. | Скорость реакции, ее зависимость от различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Скорость реакции» ( с ответами) |
|
| 1.4.4. | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Химическое равновесие реакции» ( с ответами) |
|
| 1.4.5. |
Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты | |
| 1.4.6. | Реакции ионного обмена | |
| 1.4.7. |
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Тренировочные тесты в формате ЕГЭ по теме «Гидролиз» (с ответами) |
|
| 1.4.8. |
Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Тренировочные тесты в формате ЕГЭ по теме «Окислительно-восстановительные реакции» (задание 19 ЕГЭ по химии) ( с ответами) |
|
| 1.4.9. |
Электролиз расплавов и растворов (солей, щелочей, кислот)
Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 20 ЕГЭ по химии) ( с ответами) |
|
| 1.4.10. |
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии | |
| 2 | НЕОРГАНИЧЕСКАЯ ХИМИЯ | |
| 2.1. | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами) |
|
| 2.2. | Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа) | |
| 2.3. | Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния | |
| 2.4. | Характерные химические свойства оксидов: основных, амфотерных, кислотных | |
| 2.5. | Характерные химические свойства оснований и амфотерных гидроксидов | |
| 2.6. | Характерные химические свойства кислот | |
| 2.7. | Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка) | |
| 2.8. | Взаимосвязь различных классов неорганических веществ | |
| 3. | ОРГАНИЧЕСКАЯ ХИМИЯ | |
| 3.1. | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
Тренировочные тесты в формате ЕГЭ по теме «Теория строения орг. соединений» ( с ответами) |
|
| 3.2. | Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа | |
| 3.3. | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация орг. соединений» ( с ответами) |
|
| 3.4. | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола) | |
| 3.5. | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. | |
| 3.6. | Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров | |
| 3.7. | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот
Тренировочные тесты в формате ЕГЭ по теме «Свойства азотсодержащих соединений» ( с ответами) |
|
| 3.8. | Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды) | |
| 3.9. | Взаимосвязь органических соединений | |
| 4. | МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ | |
| 4.1. | Экспериментальные основы химии | |
| 4.1.1. | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии | |
| 4.1.2. | Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ | |
| 4.1.3. | Определение характера среды водных растворов веществ. Индикаторы | |
| 4.1.4. | Качественные реакции на неорганические вещества и ионы | |
| 4.1.5. | Качественные реакции органических соединений | |
| 4.1.6. | Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений | |
| 4.1.7. | Основные способы получения углеводородов (в лаборатории): алканов, алкенов, алкинов, циклоалканов, алкадиенов, аренов | |
| 4.1.8. | Основные способы получения органических кислородсодержащие соединений (в лаборатории): спиртов, альдегидов и кетонов, карбоновых кислот | |
| 4.2.1. | Понятие о металлургии: общие способы получения металлов | |
| 4.2.2. | Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия | |
| 4.2.3. | Природные источники углеводородов, их переработка | |
| 4.2.4. | Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки | |
| 4.3. | Расчеты по химическим формулам и уравнениям реакций | |
| 4.3.1. | Расчеты с использованием понятия «массовая доля вещества в растворе» | |
| 4.3.2. | Расчеты объемных отношений газов при химических реакциях | |
| 4.3.3. | Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ | |
| 4.3.4. | Расчеты теплового эффекта реакции | |
| 4.3.5. | Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси) | |
| 4.3.6. | Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества | |
| 4.3.7. | Установление молекулярной и структурной формулы вещества | |
| 4.3.8. | Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного | |
| 4.3.9. | Расчеты массовой доли (массы) химического соединения в смеси |
1.1.1. Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояния атомов
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
1.2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Тренировочные тесты в формате ЕГЭ по теме «Периодический закон» (задание 2 ЕГЭ по химии) ( с ответами)
1.2.1. Закономерности изменения свойств элементов и их соединений по периодам и группам
1.2.2. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов
1.2.4. Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
1.3. Химическая связь и строение вещества
1.3.1. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Тренировочные тесты в формате ЕГЭ по теме «Химические связи» (задание 4 ЕГЭ по химии) ( с ответами)
1.3.2. Электроотрицательность. Степень окисления и валентность химических элементов
Тренировочные тесты в формате ЕГЭ по теме «Степень окисления и валентность» (задание 3 ЕГЭ по химии) ( с ответами)
1.3.3. Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
1.4. Химическая реакция
1.4.1. Классификация химических реакций в неорганической и органической химии
1.4.2. Тепловой эффект химической реакции. Термохимические уравнения
1.4.3. Скорость реакции, ее зависимость от различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Скорость реакции» (задание 20 ЕГЭ по химии) ( с ответами)
1.4.4. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
Тренировочные тесты в формате ЕГЭ по теме «Химическое равновесие реакции» (задание 24 ЕГЭ по химии) ( с ответами)
1.4.5. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты
1.4.6. Реакции ионного обмена
1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Тренировочные тесты в формате ЕГЭ по теме «Гидролиз» (задание 23 ЕГЭ по химии) ( с ответами)
1.4.8. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Тренировочные тесты в формате ЕГЭ по теме «Окислительно-восстановительные реакции» (задание 21 ЕГЭ по химии) ( с ответами)
1.4.9. Электролиз расплавов и растворов (солей, щелочей, кислот)
Тренировочные тесты в формате ЕГЭ по теме «Электролиз» (задание 22 ЕГЭ по химии) ( с ответами)
1.4.10. Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии
2. НЕОРГАНИЧЕСКАЯ ХИМИЯ
2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная)
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами)
2.2. Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
2.3. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
2.4. Характерные химические свойства оксидов: основных, амфотерных, кислотных
2.5. Характерные химические свойства оснований и амфотерных гидроксидов
2.6. Характерные химические свойства кислот
2.7. Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка)
2.8. Взаимосвязь различных классов неорганических веществ
3. ОРГАНИЧЕСКАЯ ХИМИЯ
3.1. Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
3.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа
3.3. Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
3.4. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола)
3.5. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола.
3.6. Характерные химические свойства альдегидов, карбоновых кислот, сложных эфиров
3.7. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот
3.8. Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды)
3.9. Взаимосвязь органических соединений
4. МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ
4.1. Экспериментальные основы химии
4.1.1. Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии
4.1.2. Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ
4.1.3. Определение характера среды водных растворов веществ. Индикаторы
4.1.4. Качественные реакции на неорганические вещества и ионы
4.1.5. Качественные реакции органических соединений
4.1.6. Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений
4.1.7. Основные способы получения углеводородов (в лаборатории): алканов, алкенов, алкинов, циклоалканов, алкадиенов, аренов
4.1.8. Основные способы получения органических кислородсодержащие соединений (в лаборатории): спиртов, альдегидов и кетонов, карбоновых кислот
4.2.1. Понятие о металлургии: общие способы получения металлов
4.2.2. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия
4.2.3. Природные источники углеводородов, их переработка
4.2.4. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки
4.3. Расчеты по химическим формулам и уравнениям реакций
4.3.1. Расчеты с использованием понятия «массовая доля вещества в растворе»
4.3.2. Расчеты объемных отношений газов при химических реакциях
4.3.3. Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ
4.3.4. Расчеты теплового эффекта реакции
4.3.5. Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси)
4.3.6. Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
4.3.7. Установление молекулярной и структурной формулы вещества
4.3.8. Расчеты массовой или объемной доли выхода продукта реакции от теоретически возможного
4.3.9. Расчеты массовой доли (массы) химического соединения в смеси
Курс подготовки к ЕГЭ или ОГЭ (ГИА) по химии:
Общая химия
Часть 1. Строение вещества
1. Строение атома. Электронные формулы атомов
2. Периодический закон
3. Строение молекул. Типы химических связей. Основные характеристики ковалентной связи. Межмолекулярные связи
4. Строение вещества (кристаллические решетки). Основные физические свойства различных кристаллов
5. Степень окисления и валентность химических элементов.
Часть 2. Основы неорганической химии
1. Классификация неорганических веществ
2. Номенклатура неорганических веществ
3. Способы получения оксидов
4. Химические свойства основных оксидов
5. Химические свойства кислотных оксидов
6. Химические свойства амфотерных оксидов
7. Химические свойства и способы получения кислот
8. Химические свойства и способы получения солей
9. Химические свойства и способы получения оснований
10. Взаимосвязь основных классов неорганических веществ
11. Бинарные соединения — гидриды.
12. Реакции разложения в неорганической химии
Часть 3. Физико-химия растворов:
1. Понятие о растворах, растворимость
2. Теория электролитической диссоциации
3. Реакции ионного обмена
4. Гидролиз.
Часть 4. Окислительно-восстановительные реакции
1. Окислительно-восстановительные реакции.
2. Электролиз солей. Электролиз солей карбоновых кислот. Коррозия.
Часть 5. Особенности работы в лаборатории
Часть 6. Химические реакции. Закономерности их протекания
1. Классификация химических реакций.
2. Кинетика (скорость) химических реакций и ее зависимость от разных факторов.
3. Термодинамика химических реакций: химическое равновесие и его смещение.
Органическая химия
1. Теория строения органических веществ. Классификация органических веществ. Гомологи и изомеры. Виды изомерии.
2. Алканы: химические и физические свойства, строение, получение, изомерия.
3. Алкены: химические и физические свойства, строение, получение, изомерия.
4. Алкины: химические и физические свойства, строение, получение, изомерия.
5. Алкадиены: химические и физические свойства, строение, получение, изомерия.
6. Арены: химические и физические свойства, строение, получение, изомерия.
7. Циклоалканы: химические и физические свойства, строение, получение, изомерия.
8. Спирты: химические и физические свойства, строение, изомерия и способы получения. Фенолы: химические свойства, способы получения, строение и изомерия.
9. Альдегиды и кетоны: химические и физические свойства, строение и изомерия, получение.
10. Карбоновые кислоты: химические и физические свойства, строение, номенклатура и изомерия, способы получения.
11. Сложные эфиры: химические и физические свойства, строение, получение, изомерия.
12. Жиры: химические и физические свойства, строение, получение.
13. Углеводы: химические и физические свойства, строение, получение.
14. Амины: химические и физические свойства, строение, получение, изомерия.
15. Аминокислоты: химические и физические свойства, строение, получение, изомерия.
16. Белки: химические и физические свойства, строение и получение.
17. Взаимосвязь разных классов органических веществ.
18. Качественные реакции в органической химии.
Характерные реакции в органической химии:
Реакция Дюма Электролиз солей карбоновых кислот Пиролиз метана Реакция Вагнера
Химия элементов
Часть 1. Химия щелочных металлов и их соединений. Пероксиды щелочных металлов. Гидроксиды щелочных металлов.
Часть 2. Химия щелочноземельных металлов. Оксиды щелочноземельных металлов. Гидроксиды щелочноземельных металлов.
Часть 3. Химия алюминия и его соединений. Оксид алюминия. Гидроксид алюминия. Соли алюминия.
Часть 4. Химия углерода. Оксид углерода (II) и оксид углерода (IV). Угольная кислота и ее соли (карбонаты и гидрокарбонаты).
Часть 5. Химия кремния. Оксид кремния (IV). Кремниевая кислота. Силан. Силикаты.
Часть 6. Химия азота и его соединений. Оксиды азота. Аммиак. Нитриды. Азотная кислота и азотистая кислота. Нитраты.
Часть 7. Химия фосфора и его соединений. Фосфин. Фосфиды металлов. Оксиды фосфора III и V. Фосфорные кислоты и их соли (фосфаты, гидрофосфаты и дигидрофосфаты, пирофосфаты и метафосфаты). Фосфористая кислота.
Часть 8. Химия кислорода и его соединений.
Часть 9. Химия серы и ее соединений. Сероводород и сульфиды. Оксиды серы – сернистый газ и серный ангидрид. Серная кислота и ее свойства. Сернистая кислота. Особенности химии сульфатов и сульфитов.
Часть 10. Химия галогенов и их соединений.
Часть 11. Химия d-элементов: железа, хрома, цинка, меди.
Часть 12. Химия водорода и его соединений.
Задачи: базовый блок
1. Атомно -молекулярное учение
2. Способы выражения концентрации в растворах: массовая доля, растворимость, молярная концентрация.
3. Расчеты по уравнению реакции
4. Задачи на избыток-недостаток
5. Задачи на примеси
6. Задачи на выход
Задачи повышенной сложности
1. Задачи на электролиз
2. Задачи на кристаллогидраты
3. Задачи на пластинки
4. Задачи на порции
5. Неполное разложение
6. Задачи на альтернативные реакции (кислые/средние соли, амфотерность)
7. Задачи на атомистику
8. Задачи на смеси и сплавы
9. Задачи на растворимость
Диагностические и тренировочные работы
Все реальные варианты КИМ ЕГЭ по химии
Тренировочная работа по химии в формате ЕГЭ 26 октября 2017 года
Тренировочная работа по химии для 11 классов 30 ноября 2017 года
Досрочный ЕГЭ по химии 25.03.2019
Видеоопыты
Видеоопыты по общей и неорганической химии
Видеоопыты по органической химии
Спецификация ЕГЭ по химии-2022
| 1 | ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ | |
| 1.1 | Современные представления о строении атома | |
| 1.1.1 | Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов. | |
| 1.2 | Периодический закон и периодическая система химических элементов Д.И. Менделеева | |
| 1.2.1 | Закономерности изменения химических свойств элементов и их соединений по периодам и группам периодической таблицы химических элементов. | |
| 1.2.2 | Общая характеристика металлов IА–IIIА групп в связи с их положением в периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. | |
| 1.2.3 | Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в периодической системе химических элементов Д.И.Менделеева и особенностям строения их атомов. | |
| 1.3 | Химическая связь и строение вещества | |
| 1.3.1 | Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь. | |
| 1.3.2 | Электроотрицательность. Степень окисления и валентность химических элементов. | |
| 1.3.3 | Вещества молекулярного и немолекулярного строения. Тип кристаллической решётки. Зависимость свойств веществ от их состава и строения. | |
| 1.4 | Химическая реакция | |
| 1.4.1 | Классификация химических реакций в неорганической и органической химии. | |
| 1.4.2 | Тепловой эффект химической реакции. Термохимические уравнения. | |
| 1.4.3 | Скорость реакции, ее зависимость от различных факторов. | |
| 1.4.4 | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов. | |
| 1.4.5 | Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. | |
| 1.4.6 | Реакции ионного обмена. | |
| Особенности взаимодействия кислых солей со щелочами. | ||
| 1.4.7 | Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная. | |
| Необратимый гидролиз бинарных соединений. | ||
| 1.4.8 | Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее. | |
| 1.4.9 | Электролиз расплавов и растворов (солей, щелочей,кислот). | |
| 2 | НЕОРГАНИЧЕСКАЯ ХИМИЯ | |
| 2.1 | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная). | |
| 2.2 | Химические свойства простых веществ — металлов | |
| 2.2.1 | Характерные химические свойства щелочных металлов. | |
| 2.2.2 | Характерные химические свойства бериллия, магния и щелочноземельных металлов. | |
| 2.2.3 | Характерные химические свойства алюминия. | |
| 2.2.4 | Химические свойства переходных металлов (меди, цинка, хрома, железа). | |
| 2.3 | Химические свойства простых веществ — неметаллов | |
| 2.3.1 | Химические свойства водорода и галогенов. | |
| 2.3.2 | Химические свойства кислорода и серы. | |
| 2.3.3 | Химические свойства азота и фосфора. | |
| 2.3.4 | Химические свойства углерода и кремния. | |
| 2.4 | Характерные химические свойства оксидов: основных, амфотерных, кислотных. | |
| 2.5 | Характерные химические свойства оснований и амфотерных гидроксидов. | |
| 2.6 | Характерные химические свойства кислот. | |
| 2.7 | Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка). | |
| 3 | ОРГАНИЧЕСКАЯ ХИМИЯ | |
| 3.1 | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. | |
| 3.2 | Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа. | |
| 3.3 | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная). | |
| 3.4 | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола). | |
| 3.5 | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. | |
| 3.6 | Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. | |
| 3.7 | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. | |
| 3.8 | Биологически важные вещества: жиры, белки, углеводы (моносахарады, дисахариды, полисахариды) | |
| 3.8.1 | Жиры. | |
| 3.8.2 | Белки. | |
| 3.8.3 | Углеводы (моносахариды, дисахариды, полисахариды). | |
| 3.9 | Взаимосвязь органических соединений. | |
| 4 | МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ | |
| 4.1 | Экспериментальные основы химии | |
| 4.1.1 | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. | |
| 4.1.2 | Методы разделения смесей и очистки веществ. | |
| 4.1.3 | Определение характера среды водных растворов веществ. Индикаторы. | |
| 4.1.4 | Качественные реакции на неорганические вещества и ионы. | |
| 4.1.5 | Качественные реакции органических соединений. | |
| 4.1.7 | Основные способы получения углеводородов. | |
| 4.1.8 | Основные способы получения кислородсодержащих соединений. | |
| 4.2 | Общие представления о промышленных способах получения важнейших веществ | |
| 4.2.1 | Понятие о металлургии: общие способы получения металлов. | |
| 4.2.2.1 | Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). | |
| 4.2.3 | Природные источники углеводородов, их переработка. | |
| 4.2.4 | Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки. | |
| 4.3 | Рачеты по химическим формулам и уравнениям реакций | |
| 4.3.1 | Расчеты с использованием понятия «массовая доля вещества в растворе». | |
| 4.3.2 | Расчеты объемных отношений газов при химических реакциях. | |
| 4.3.3 | Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ. | |
| 4.3.4 | Расчеты теплового эффекта реакции. | |
| 4.3.5 | Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси). | |
| 4.3.6 | Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества. |


 ➕ Классное дополнение к базе с подробными объяснениями
➕ Классное дополнение к базе с подробными объяснениями