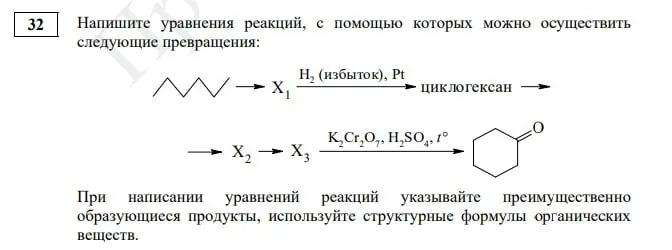
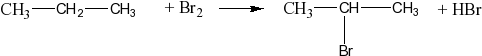
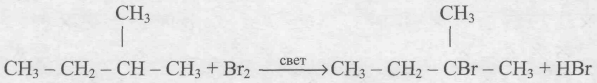
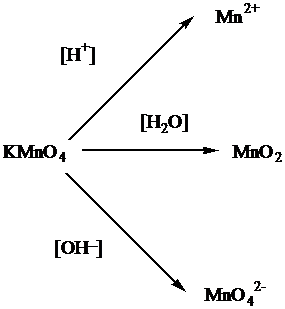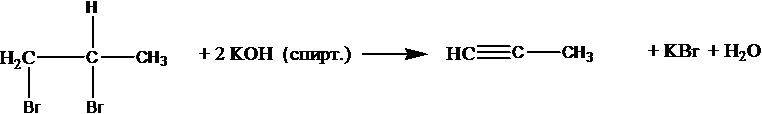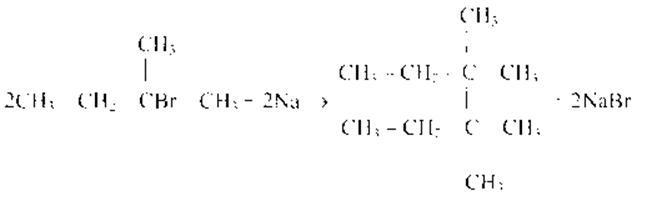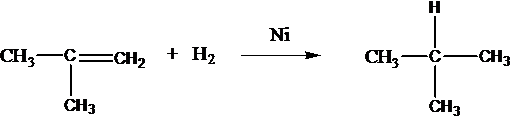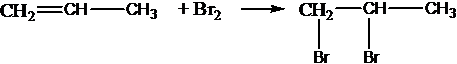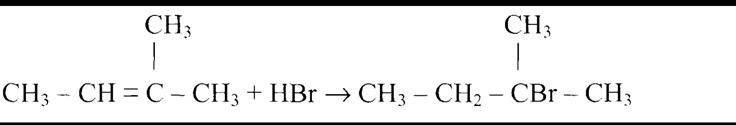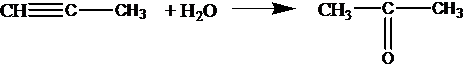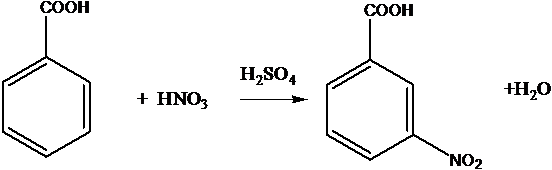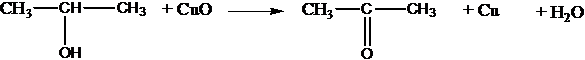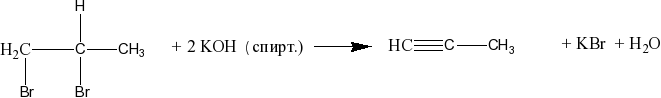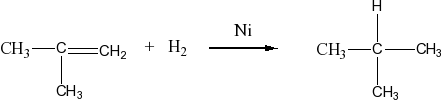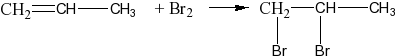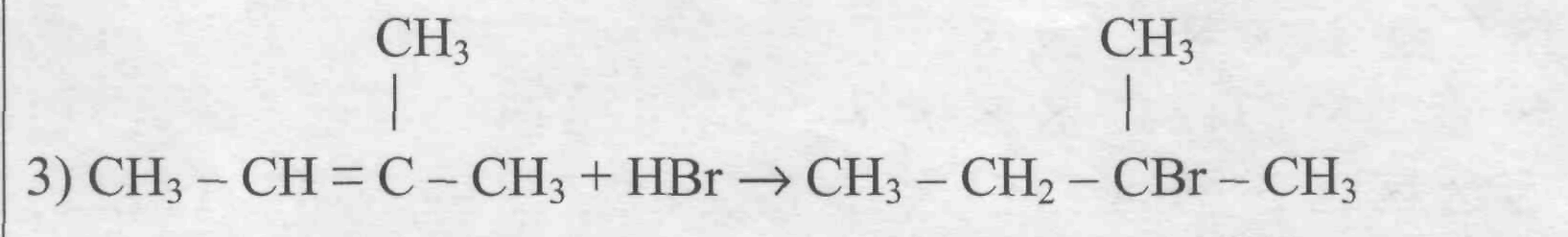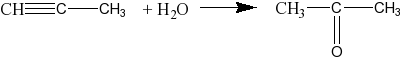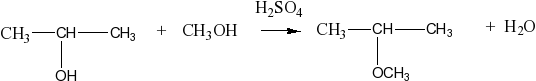Продолжая рубрику про ЕГЭ по химии, конечно же, нельзя не упомянуть о самых сложных заданиях. Разбираемся в тонкостях и узнаем лайфхаки сегодня. Поехали!
Структура экзамена
И начинаем мы, как обычно, со структуры – основополагающего фактора, не разобравшись в котором справиться с КИМом на высокие баллы невозможно.
ЕГЭ по химии состоит из двух частей:
- Первая часть – тестовая, предусматривает краткий ответ в виде одного числа или последовательности чисел. Состоит из 28 заданий;
- Вторая часть требует подробного решения на бланках ответа №2 и состоит из 6 заданий;
То есть всего экзамен состоит из 34 заданий, за безошибочное решение которых можно получить 56 первичных баллов.
Кстати, на решение экзамена вам будет отведено 3 с половиной часа. Время более, чем реальное. Опыт прошлых лет показывает, что вы успеете не просто решить все задания и перенести их в бланки ответов, но сможете даже перепроверить написанное, что не может не радовать.
Самые сложные задания ЕГЭ по химии
После того, как мы вспомнили структуру экзамена, предлагаем перейти непосредственно к наиболее каверзным заданиям КИМа по химии.
Естественно, первая часть экзамена намного проще второй, однако и с тестовыми заданиями порой возникают проблемы. Поэтому давайте обо всем по порядку.
Задания 1-3
Самой обидной трудностью на пути к получению заветного балла бывает путанница из-за измененной формулировки задания. Очень часто ребята, нарешивая десятки пробников, привыкают к определенным установкам и потом просто не понимают, что от них требуется ровно то же самое, только другими словами.
Как решить проблему:
- быть внимательнее;
- готовиться по нескольким сборникам и пособиями, чтобы узнать различные формулировки;
Задание 7
Задание на растворы, в котором также пригодится внимательность. Если в состав добавляют вещество Y, то нужно сделать нехитрый вывод, что все нерастворимые вещества из списка потенциальных Y следует вычеркнуть.
Как не допустить ошибку:
- знать на зубок, в каких случаях выделяются газы;
- научиться работать с таблицей растворимости;
- научиться грамотно составлять схемы реакций;
Задания на свойства неорганических веществ (8, 30, 31 и 32)
В заданиях 30-31 важно помнить, что даже если вы верно составите уравнение реакции, то засчитано оно будет лишь при условии абсолютного соответствия условиям задания.
Что касается теории, то для номера 30 нужно вспомнить, что такое окислитель, а что восстановитель. Кстати подробная статья об овр уже есть на нашем сайте. (можно сделать ссылку на статью) А для номера 31 придется вспомнить формулы малодиссоциирующих веществ, которые нельзя записывать в виде ионов.
Как избежать ошибок:
- тщательно проверять, какие продукты получаются у вас из исходных веществ, ведь, к примеру, из кислоты никак не может выйти основание или основная соль (советуем еще раз вспомнить подробную теорию);
Главное о номере 8: приступая к заданию, обязательно рассмотрите предложенные формулы как с позиции кислотно-основных, так и окислительно-восстановительных свойств. Это поможет сразу отсеять “затесавшиеся” списки реагентов.
Самое важное при выполнении задания 32 – запомнить палитру, то есть цвета осадков и растворов. Кстати, для лучшего запоминания уже давно придуманы забавные стишки. Ну а если дружба с поэзией не складывается, то предлагаем запастись карандашами и раскрасить таблицу растворимости, отмечая все известные цветовые признаки соединений.
Задание 13
Задание на свойства углеводородов уже давно считается одним из самых провальных.
Самое “коварное” место: определение механизма реакции.
Как избежать трудностей:
- запомнить, что ионный механизм всегда связан с присутствием разноименных заряженных частиц;
- учитывать, что вещества определенных типов вступают в свойственные им реакции: кратная связь – реакции присоединения, одинарная связь – реакции замещения;
- не забывать о температурных условиях;
Задания 15 и 17
Номера на азотосодержащие и кислородосодержащие органические вещества и углеводы. Реакции идут по двум типам:
- по функциональной группе;
- по радикалу;
Как усовершенствовать умения в решении заданий 15 и 17:
- выписывать и заучивать как можно больше уравнений каждого класса;
- решать цепочки на взаимосвязь органических веществ;
Задания 34 и 35
Вот мы и добрались до расчетных задач – самого сложного “элемента” КИМа ЕГЭ по химии, на котором ежегодно проваливается большинство одиннадцатиклассников.
Задание 34 сложно тем, что для него нет единого алгоритма решения. Есть задачи на электролиз, смеси, атомистику, а бывает, что в условии переплетается несколько типов задач. Конечно, советуем прорешать каждый из возможных типов задач, чтобы при встрече в июне вам точно было, что сказать, ой, вернее расписать)
Ошибки в задании 35 чаще всего случаются из-за неправильного определения структурной формулы. Обычно это связано с недостаточным знанием химических свойств органических веществ.
Что нужно делать: стараться каждый день выполнять хотя бы одну цепочку превращений, писать уравнения реакций.
И напоследок немного общих советов для решения расчетных задач:
- максимально сконцентрируйтесь, даже когда решаете пробник: перечитывайте условие, зачеркивайте массы веществ, уходящие из раствора на черновиках, пересчитывайте результат;
- на всякий случай повторите даже самые простые формулы, известные вам как дважды два: “лучше перебдеть, чем недобдеть”;
- внимательно следите за массами: не забывайте их складывать;
- если в начале задачи трудно определить избыток или недостаток щелочи, можно написать два возможных уравнения – образования гидроксида и образования комплексной соли;
Сегодня мы разобрали самые хитрые места ЕГЭ по химии. Уверены, что теперь ошибок в них вы точно не сделайте. Желаем удачи в постижении очень непростой, но интересной науки! Ваш Умскул.
Как показали результаты репетиционного экзамена по химии, наиболее трудными оказались задания, направленные на проверку знаний химических свойств веществ. К числу таких заданий можно отнести задание С3 – «Цепочка органических веществ», С2 – «Реакции между неорганическими веществами и их растворами».
При решении задания С3 «Цепочка органических веществ» учащийся должен написать пять уравнений химических реакций, среди которых одно является окислительно-восстановительным.
Рассмотрим составление одного из таких окислительно-восстановительных уравнений:
СН3СНО X1
Чтобы составить уравнение окислительно-восстановительной реакции с участием органических веществ, нужно научиться определять степень окисления в органическом веществе по его структурной формуле. Для этого нужно иметь знания о химической связи, знать, что такое электроотрицательность.
Структурная формула помогает оценить смещение электронов по каждой из связей. Так атом углерода метильной группы (–СН3) сместит электрон по каждой из связей к себе. Таким образом, степень окисления углерода метильной группы будет равна (-3). Атом углерода карбонильной группы (СО) отдаст 2 электрона атому кислорода, но частично компенсирует недостачу, приняв 1 электрон от атома водорода. Следовательно, его степень окисления будет равна +1:
В продукте реакции степень окисления углерода метильной группы не изменится. Карбонильная группа атомов превратится в карбоксильную с замещенным водородом на натрий, вследствие щелочной среды (-СООNa). Атом углерода карбоксильной группы сместит два электрона в сторону карбонильного кислорода и один электрон в сторону кислорода замещенной гидроксильной группы. Таким образом, степень окисления атома углерода карбоксильной группы будет равна (+3):
Следовательно, одна молекула этаналя отдает 2 электрона:
С+1-2е=С+3
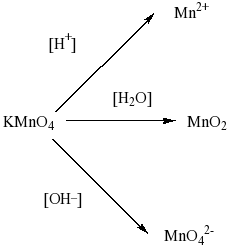
Рассмотрим теперь процессы, происходящие с перманганатом натрия. Обращает внимание, что в схеме дан перманганат натрия, а не калия. Свойства перманганата натрия должны быть аналогичны свойствам перманганта калия, который в зависимости от кислотности среды способен давать различные продукты:
Так как в нашем случае перманганат натрия используется в щелочной среде, то продуктом реакции будет манганат ион – MnO42-.
Определим степень окисления иона марганца в перманганате калия NaMnO4 пользуясь правилом равенства числа положительных и отрицательных зарядов в нейтральной структурной единице вещества. Четыре кислорода каждый по (-2) дадут восемь отрицательных зарядов, так как степень окисления у калия +1, то у марганца будет +7:
Na+1Mn+7O4-2
Записав формулу манганата натрия Na2MnO4, определим степень окисления марганца:
Na2+1Mn+6O4-2
Таким образом, марганец принял один электрон:
Mn+7+1e=Mn+6
Полученные уравнения позволяют определить множители перед формулами в уравнении химической реакции, которые называют коэффициентами:
С+1-2е=С+3 ·1
Mn+7+1e=Mn+6 ·2
Уравнение реакции приобретет следующий вид:
2NaMnO4+CH3CHO+3NaOH=CH3COONa+2Na2MnO4+2H2O
Задание С2 требует от участника ЕГЭ знание свойств разнообразных свойств неорганических веществ, связанных с протеканием как окислительно-восстановительных реакций между веществами, находящимися как в одном, так и в различных агрегатных состояниях, так и обменных реакций протекающих в растворах. Такими свойствами могут быть некоторые индивидуальный свойства простых веществ и их соединений, например, реакция лития или магния с азотом:
2Li+3N2=2Li3N
2Mg+N2=Mg2N2
горение магния в углекислом газе:
Mg+CO2=MgO+CO
2Mg+CO2=2MgO+C
Особую трудность у учащихся вызывают сложные случаи взаимодействия растворов веществ солей подвергающихся гидролизу. Так для взаимодействия раствора сульфата магния с карбонатом натрия можно записать целых три уравнения возможных процессов:
MgSO4+Na2CO3=MgCO3+Na2SO4
2MgSO4+2Na2CO3+H2O=(MgOH)2CO3¯+2Na2SO4+CO2
2MgSO4+2Na2CO3+2H2O=2Mg(OH)2¯+2Na2SO4+2CO2
Традиционно трудны для написания уравнения с участием комплексных соединений. Так растворы амфотерных гидроксидов в избытке щелочи обладают всеми свойствами щелочей. Они способны вступать в реакции с кислотами и кислотными оксидами:
Na[Al(OH)4]+HCl=NaCl+Al(OH)3¯+H2O
Na[Al(OH)4]+2HCl=NaCl+Al(OH)2Cl+2H2O
Na[Al(OH)4]+3HCl=NaCl+Al(OH)Cl2+3H2O
Na[Al(OH)4]+4HCl=NaCl+AlCl3+4H2O
Na[Al(OH)4]+CO2=NaHCO3+Al(OH)3¯
2Na[Al(OH)4]+CO2=Na2CO3+2Al(OH)3¯+H2O
Растворы солей, имеющие кислую реакцию среды, вследствие гидролиза, способны растворять активные металлы, например, магний или цинк:
Mg+MgCl2+2H2O=2MgOHCl+H2
На экзамене желательно помнить об окислительных свойствах солей трехвалентного железа:
2FeCl3+Cu=CuCl2+2FeCl2
Могут пригодиться знания об аммиачных комплексах:
CuSO4+4NH3=[Cu(NH3)4]SO4
AgCl+2NH3=[Ag(NH3)2]Cl
Традиционно вызывают затруднения, связанные с проявлением основных свойств раствором аммиака. В результате чего могут протекать обменные реакции в водных растворах:
MgCl2+2NH3+2H2O=Mg(OH)2+2NH4Cl
В заключение приведем серию уравнений химических реакций, которые нужно знать участникам ЕГЭ по химии:
ОБЩАЯ ХИМИЯ
Кислоты. Основания. Соли. Оксиды.
Кислотные оксиды (кроме SiO2) реагируют с водой, как амфотерным оксидом с образованием кислот:
P2O5 + 3H2O = 2H3PO4
SO3 + H2O = H2SO4
Для получения азотной кислоты азот оксид азота (IV) должен быть доокислен, например кислородом воздуха:
4NO2 + O2 + 2H2О = 4HNO3
Лабораторный способ получения хлороводорода: к твердому хлориду натрия приливают концентрированную серную кислоту:
NaCl + H2SO4 = NaHSO4 + HCl
Для получения бромоводорода из бромида натрия, концентрированная серная кислота не подойдет, так как выделяющийся бромоводород будет загрязнен парами брома. Можно использовать концентрированную фосфорную кислоту:
NaBr+ H3PO4 = NaH2PO4 + HBr
Кислоты реагируют с металлами, стоящими в ряду напряжений до водорода:
Fe + 2 HCl = FeCl2 + H2
И их оксидами:
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Обратите внимание на валентность переходных элементов в солях.
Щелочные и щелочноземельные металлы взаимодействуют с водой:
K + H2O = KOH + ½ H2
В условиях избытка кислоты могут образовываться и кислые соли:
2Н3РО4 + 2Na = 2NaH2PO4 + Н2
Органические кислоты также проявляют кислотные свойства:
2СН3СООН + 2Na = 2CH3COONa + Н2
СНзСООН + NaOH = CH3COONa + Н2О
Комплексные гидроксиды реагируют с кислотами с образованием солей и воды:
Na[Al(OH)4] + HCl = AlCl3 + 4H2O + NaCl
LiOH + HNO3 = LiNO3 + H2O
Многоосновные кислоты в реакции с гидроксидами могут образовывать кислые соли:
Н3РО4 + КОН = КН2РО4 + Н2О
Продуктом реакции аммиака с фосфорной кислотой может также быть кислая соль:
NH3 + H3PO4 = NH4H2PO4
Обратим внимание на свойства оснований, их взаимодействие с кислотами:
2Н3РО4 + ЗСа(ОН)2 = Са3(РО4)2¯ + 6Н2О
с кислотными оксидами:
Ca(OH)2 + CO2 = CaCO3¯ + H2O
2Ca(OH)2 + CO2=(СaOH)2CO3+H2O
Реакция гидроксидов с кислотными оксидами может приводить и к кислым солям:
KOH + CO2 = KHCO3
Основные оксиды реагируют с амфотерными оксидами:
CaO + H2O = Ca(OH)2
Средние соли в воде реагируют с кислотными оксидами с образованием кислых солей:
CaCO3 + CO2 + H2O = Ca(HCO3)2
Более сильные кислоты вытесняют более слабые из их солей:
CH3COONH4 + HCl = CH3COOH + NH4Cl
K2CO3 + H2SO4 = K2SO4 + H2O + CO2
Кислоты в присутствии серной кислоты реагируют со спиртами с образованием сложных эфиров:
CH3COOH + C2H5OH = CH3COOC2H5 + H2O
Более сильное основание вытесняет более слабое из его солей:
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl
MgCl2 + KOH = MgOHCl + KCl
NH4С1 + NaOH = NaCl + NH3 + H2O
Чтобы получить из основной соли получить среднюю соль нужно подействовать кислотой:
MgOHCl + HCl = MgCl2 + H2O
Гидроксиды металлов (кроме щелочных металлов) разлагаются при нагревании в твердом виде до оксидов:
2Al(OH)3 = Al2O3 + 3H2O
2Fe(OH)3 = Fe2O3 + 3H2O
Гидрокарбонаты при нагревании разлагаются до карбонатов:
2KHCO3 = K2CO3 + H2O + CO2
Нитраты обычно разлагаются до оксидов (обратите внимание на повышение степени окисления переходного элемента находящегося в промежуточной степени окисления):
2Fe(NO3)2 = Fe2O3 + 4NO2 + 0,5O2
2Fe(NO3)3 ® Fe2O3 + 6NO2 + 1,5 O2
2Cu(NO3)2 = 2CuO + 4NO2 + О2
Нитраты щелочных металлов разлагаются до нитритов:
NaNO3 = NaNO2 + ½ O2
Карбонаты металлов (кроме щелочных) разлагаются до оксидов:
CaCO3 = CaO + CO2
При составлении уравнений реакций ионного обмена пользуйтесь таблицей растворимости:
K2SO4 + BaCl2 = BaSO4¯ + 2KCl
[C6H5-NH3]C1 + AgNО3 = [C6H5NH3]NO3 + AgCl¯
Электролиз
Электролиз расплавов солей:
2KCl = 2K + Cl2
Электролиз растворов солей металлов, стоящих в ряду напряжения после водорода:
2HgSO4 + 2H2O = 2Hg + О2 + 2H2SO4
1) на катоде: Hg2+ + 2e = Hg°
2) на аноде: 2Н2О – 4е = О2 + 4Н+
Электролиз раствора сульфата натрия
1) на катоде: 2H2O + 2e = H2 + 2OH–
2) на аноде: 2H2O – 4e = O2 + 4H+
3) Составлено общее уравнение электролиза:
2H2O = 2H2 + O2
до водорода:
СаI2 + 2Н2О = Н2 + I2 + Са(ОН)2
1) на катоде: 2Н2О + 2e = 2ОН + Н2
2) на аноде: 2I— — 2e = I2
Сравните свойства одноэлементных и кислородсодержащих анионов.
Химические реакции, возможные при электролизе сульфата хрома (III):
1)Сг3+ + e = Сг2+
2) Cr2+ + 2e = Сг°
3) Сг3+ + 3 e= Сг°
4) 2Н+ + 2e = Н2
Электролиз водных растворов солей карбоновых кислот:
2CH3COONa + 2H2O = CH3CH3 + 2CO2 + H2 + 2NaOH
Гидролиз
Пример взаимного гидролиза солей:
A12(SO4)3 + 3K2CO3 + 3H2O = 2A1(OH)3 + 3CO2 + 3K2SO4
Амфотерность
Амфотерные гидроксиды растворяются в водных растворах щелочей:
A1(OH)3 + 3KOH = K3[A1(OH)6]
A1(OH)3 + KOH = K[Al(OH)4]
реагируют с твердыми щелочами при сплавлении:
Al(OH)3 + KOH KAlO2 + 2H2O
Амфотерные металлы реагируют с водными растворами щелочей:
Al + NaOH + 3H2O = Na[Al(OH)4] + 3/2 H2
Продукт сплавления амфотерного гидроксида со щелочью легко разлагается водой:
KAlO2 + 2H2O = KOH + Al(OH)3¯
Комплексные гидроксиды реагируют с кислотами:
K[Al(OH)4] + HCl =KCl + Al(OH)3¯ + H2O
Бинарные соединения
Способ получения:
СаО + 3С = СаС2 + СО
Бинарные соединения реагируют с кислотами:
Al2S3 + 3H2SO4 := Al2(SO4)3 + 3H2S
Mg3N2 + 8HNO3 = Mg(NO3)2 + 2NH4NO3
и водой:
A14C3 + 12Н2О = 4А1(ОН)3 + ЗСН4
PCl3 + H2O = 3H3PO3 + 3HCl
НЕОРГАНИЧЕСКАЯ ХИМИЯ
Азот
Азотная кислота является сильным окислителем:
окисляют неметаллы:
ЗР + 5HNO3 + 2Н2О = Н3РО4 + 5NO
P + 5HNO3 = H3PO4 + 5NO2 + H2O
металлы:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 = 4Mg(NO3)2 + N2O + 5H2O
оксиды переходных металлов в промежуточных степенях окисления:
3Cu2O + 14HNO3 = 6Cu(NO3)2 + 2NO+ 7H2O (возможно выделение NО2)
оксиды азота также проявляют окислительные свойства:
5N2O + 2P = 5N, + P2O
но по отношению к кислороду являются восстановителями:
2NO + O2 = 2NO2
Азот реагирует с некоторыми простыми веществами:
N2+3H2= 2NH3
N2 + O2 = 2NO
3Mg + N2 = Mg3N2
Галогены
обычно проявляют окислительные свойства:
PH3 + 4Br2 + 4Н2О = Н3РО4 + 8НВг
2P + 5Cl2 = 2PCl5
2P + 3PCl5 = 5PCl3
PH3 + 4Br2 + 4H2O = H3PO4 + 8HBr
Cl2 + H2 = 2HCl
2HCl + F2 = 2HF + Cl2
2NH3 + 3Br2 = N2 + 6HBr
Галогены в растворах щелочей диспропорционируют при комнатной температуре:
Cl2 + 2KOH = KCl + H2O + KClO
и при нагревании:
Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
Окислительные свойства перманганата калия:
5Н3РО3 + 2КМnО4 + 3H2SO4 = K2SO4 + 2MnSO4 + 5Н3РО4 + ЗН2О
2NH3 + 2KMnO4 = N2 + 2MnO2 + 2KOH + 2H2O
Сера
реагирует с простыми веществами:
S + O2 = SO2
3S + 2А1 = A12S3
оксид серы (IV) может быть доокислен кислородом:
2SO2 + O2 = 2SO3
2SO2 + O2 + 2H2O = 2H2SO4
и выступать в роли окислителя:
SO2 + 2H2S = 3S + 2H2O
Концентрированная серная кислота проявляет окислительные свойства:
Cu + H2SO4 = CuSO4 + SO2 +2H2O
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
Фосфор
получение фосфора:
Са3(Р04)2 + 5С + 3SiO2 = 3CaSiO3 + 5СО + 2Р
Металлы
реагируют с галогенами:
2Fe + 3Cl2 = 2FeCl3
Алюминий без оксидной пленки растворяется в воде:
Al (без оксидной пленки) + Н2О = Al(OH)3 + 3/2 H2
методы получения металлов:
Fe2O3 + CO = 2FeO + CO2
FeO + CO = Fe + CO2
CuO + H2 = Cu + H2O
Гидроксид железа (II) может быть легко доокислен пероксидом водорода:
2Fe(OH)2 + H2O2 = 2Fe(OH)3
обжиг пирита:
2FeS2 + O2 = Fe2O3 + 4SO2
ОРГАНИЧЕСКАЯ ХИМИЯ
Горение органических веществ
2С10Н22 + 31O2 = 20CО2 + 22H2О
Алканы
Методы получения алканов из простых веществ:
С + 2H2 = CH4
сплавлением солей щелочных металлов с щелочами:
СН3СООК + КОН ® СН4 + К2СО3
Химические свойства алканов — промышленное окисление метана:
CH4 + O2 = CH2O + H2O
Взаимодействие алканов с галогенами:
С2Н6 + Сl2 С2Н5Сl + НСl
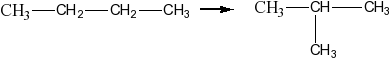
Изомеризация алканов:
Галогеналканы
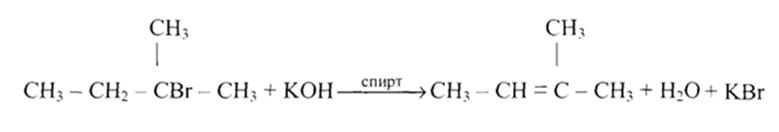
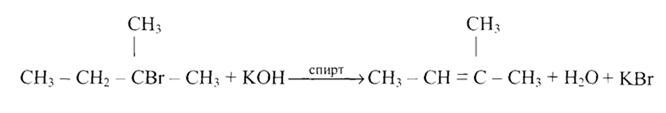
Реакция со спиртовыми растворами щелочей:
С6Н5-СНВг-СН3 + КОН  С6Н5СН=СН2 + КВг + Н2О
С6Н5СН=СН2 + КВг + Н2О
с водными растворами щелочей:
С6Н5-СНВг-СН3 + КОН (водн.) ® С6Н5-СНОН-СН3 + KBr
C6H5Br + KOH ® C6H5OH + KBr
По правилу Зайцева водород отщепляется от наименее гидрированного атома
Из дигалогеналканов можно получить алкины:
Реакция Вюрца:
Алкены
Присоединяют водород:
присоединяют галогены:
присоединяют галогенводороды:
присоединят воду:
СН2=СН2 + Н2О ® СН3СН2ОН
С водным раствором перманганата калия без нагревания образуют гликоли (двухатомные спирты)
ЗС6Н5СН=СН2 + 2КМnО4 + 4Н2О ® ЗС6Н5СН(ОН)-СН2ОН + MnO2¯ + 2KOH
Алкины
промышленный способ получения ацетилена
2СН4 ® С2Н2 + ЗН2
карбидный способ получения ацетилена:
CaC2 + 2H2O = Ca(OH)2 + C2H2
реакция Кучерова — альдегид можно получить только из ацетилена:
С2Н2 + Н2О СН3СНО
Реакция алкинов с концевой тройной связью с аммиачным раствором оксида серебра:
2CH3-CH2-CºCH + Ag2O 2CH3-CH2-CºCAg +H2O
использование полученных продуктов в органическом синтезе:
CH3-CH2-CºCAg + C2H5Br ® CH3-CH2-CºC-C2H5 + AgBr
Бензол и его производные
Получение бензола из алкенов:
из ацетилена:
3C2H2 C6H6
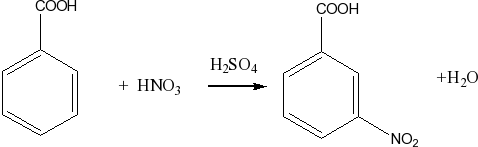
Нитрование бензола и его производных в присутствие серной кислоты
C6H6 + HNO3 ® C6H5-NO2 + H2O
карбоксильная группа является ориентантом второго рода
реакция бензола и его производных с галогенами:
C6H6 + Cl2 C6H5Cl + HCl
С6Н5С2Н5 + Вг2 С6Н5-СНВг-СН3 + НВг
галогеналканами:
C6H6 + С2Н5С1 C6H5C2H5 + НС1
алкенами:
C6H6 + CH2=CH-CH3 ® C6H5-CH(CH3)2
Окисление бензола перманганатом калия в присутствии серной кислоты при нагревании:
5C6H5-CH3 + 6KMnO4 + 9H2SO4 = 5C6H5-COOH + 3K2SO4 + 6MnSO4 + 14H2O
Спирты
Промышленный способ получения метанола:
CO + 2H2 = CH3OH
при нагревании с серной кислотой в зависимости от условий могут образовываться простые эфиры:
2С2Н5OH C2Н5ОС2Н5 + Н2О
или алкены:
2С2Н5OH CH2=CH2 + H2O
спирты реагируют с щелочными металлами:
С2Н5OH + Na ® C2H5ONa + ½ H2
с галогенводородами:
СН3СН2ОН + НСl ® CH3CH2Cl + H2O
с оксидом меди (II):
СН3СН2ОН + СuO ® CH3CHO + Cu + H2O
более сильная кислота вытесняет более слабые из их солей:
C2H5ONa + HCl ® C2H5OH + NaCl
при нагревании смеси спиртов с серной кислотой образуются несимметричные простые эфиры:
Альдегиды
Образуют с аммиачным раствором оксида серебра серебряное зеркало:
CH3CHO + Ag2O CH3COONH4 + 2Ag
реагируют со свежеосажденным гидроксидом меди (II):
CH3CHO + 2Cu(OH)2 ® CH3COOH + 2CuOH + H2O
могут быть восстановлены до спиртов:
CH3CHO + H2 ® CH3CH2OH
окисляются перманганатом калия:
ЗСН3СНО + 2КМnО4® 2СН3СООК + СН3СООН + 2МnО2 + Н2О
Амины
можно получить восстановлением нитросоединений в присутствии катализатора:
C6H5-NO2 + 3H2 = C6H5-NH2 + 2H2O
реагируют с кислотами:
C6H5-NH2 + HC1 =[C6H5-NH3]C1
Углеводы
Глюкозу можно получить гидролизом крахмала или целлюлозы:
(С6Н10О5)n + n H2O = nC6H12O6
Для глюкозы характерно спиртовое брожение:
C6H12O6 ® 2C2H5OH + 2CO2
молочнокислое брожение:
C6H12O6 ® 2СН3СН(ОН)СООН
реакция серебряного зеркала:
C6H12O6+Ag2O 2Ag¯+C6H12O7
Аминокислоты
Аминокислоты реагируют как с кислотами:
H2N-CH-COOH+HCl ® Cl— H3N+-CH-COOH
так и c щелочами:
H2N-CH-COOH+NaOH ® H2N-CH-COONa+H2O
соли аминокислот также способны участвовать в реакциях обмена в водном растворе:
Cl— H3N+-CH-COOH+NaOH ® H2N-CH-COOH +NaCl + H2O
Cl— H3N+-CH-COOH+2NaOH ® H2N-CH-COONa +NaCl + 2H2O
H2N-CH-COONa+HCl ® H2N-CH-COOH +NaCl
H2N-CH-COONa+2HCl ® Cl— H3N+-CH-COOH +NaCl
По 25 апреля проходит онлайн-марафон «ЕГЭ – это про100!», который поможет выпускникам подготовиться к единым государственным экзаменам. На вопросы школьников отвечают разработчики экзаменационных материалов, учителя, выпускники и специальные гости.
Консультации посвящены ЕГЭ по математике, информатике, английскому языку, биологии, другим школьным предметам. Сетевое издание «Учительская газета» предлагает ответы на самые популярные вопросы, которые были заданы на онлайн-консультации по подготовке к ЕГЭ по химии.
Вопрос: В вариантах ЕГЭ задачу №26 можно решать разными способами – через вычисление массовой доли вещества и с использованием растворимости. Однако, округляя величины до указанного знака, в соответствии с условием задачи, в ответе получаются разные значения. Как быть в этой ситуации?
Ответ: Задачу на растворимость можно решить только тогда, когда эта растворимость будет дана. В КИМ этого года – задач на растворимость в 26 номере нет, поэтому все задачи решаются с использованием массовой доли. Задания ЕГЭ построены так, чтобы ваш ответ не зависел от округления. Внимательно читайте условия задачи и смотрите, с какой точностью ожидается получить ответ.
Вопрос: На какие теоретические пособия должен ориентироваться выпускник при подготовке к ЕГЭ по химии?
Ответ: Есть пособия, которые рекомендованы ФИПИ, Навигатор ЕГЭ, открытый банк заданий ФИПИ, учебники для профильного изучения химии с грифом «Рекомендовано»
Вопрос: При решении 32 задания (органическая цепочка) можно не указывать условия протекания реакций, распространяется ли это на 31 задание? Будет ли реакция считаться правильной, если не указать катализатор в условии?
Ответ: Требований к тому, чтобы вы указывали условия протекания реакций, нет. Если вы убеждены в своем ответе, то записывайте его. Если у вас есть сомнения, вы можете в общем виде указать катализатор, можете не указывать ничего. Но если вы решили указать условия протекания реакции, а они будут противоречить продуктам, которые получились, ответ может быть не засчитан. С указанием условий будьте аккуратны.
Вопрос: Обязательно ли указывать орто-изомер в реакциях замещения гомологов бензола? (задание 32)
Ответ: Если речь идет о заместителях первого рода, смотрите на контекст задания и записывайте в уравнении тот продукт, который заложен последующими веществами в контексте данной конкретной цепочки. Лучше всего написать тот изомер, который заложен в дальнейших превращениях.
Вопрос: При выполнении цепочки превращения, по органической химии, необходимо ли указывать условия химических реакции?
Ответ: Необходимости в этом нет.
Вопрос: Какие темы, по вашим наблюдениям, хуже всего даются школьникам? Какие вопросы традиционно считаются самыми сложными?
Ответ: Тема является сложной тогда, когда ты ее недостаточно понимаешь. А понимание темы зависит от подготовки к экзамену. Надо повторять с самого начала, чтобы понимать, почему происходит тот или иной процесс. Традиционно сложными считаются вопросы второй части – это высокий уровень сложности.
Вопрос: Будет ли в 21 задании указываться концентрация веществ в скобках, и если будет, то, как она влияет?
Ответ: Все вещества будут одинаковой концентрации.
И еще один вопрос, заданный во время онлайн-консультации: будут ли на ЕГЭ органические ангидриды. В Рособрнадзоре ответили, что органических ангидридов в ЕГЭ не будет и посоветовали изучать кодификатор на сайте ФИПИ.
Строение алкенов. Уместно начинать с него, так как все свойства алкенов тесно связаны с особенностями их строения. У алкенов в составе электронных орбиталей находится одно негибридное облако, которое образует пи-связь с атомом углерода. Для молекул алкенов характерна геометрическая структурная изометрия: из-за того, что P-орбитали перекрываются в двух местах, затруднено вращение относительно углерод-углеродной связи. А если так, значит, есть возможность различного взаиморасположения групп (пример: цис-бутен-2, транс-бутен-2).
Химические свойства алкенов и алканов: сравнение. Наиболее характерный механизм реакции у алканов — радикальный цепной механизм, и реакция начинается с образования свободного радикала. Для алкенов же характерен ионный механизм взаимодействия. Далее, поскольку активная форма молекулы у алкена — двойная углерод-углеродная, то, в отличие от алканов, алкены относятся к ненасыщенным углеводородам и им характерна реакция присоединения. Для алканов характерна реакция замещения. Благодаря высокой химической активности, алкены вступают в реакцию при обычных условиях, а алканам нужны дополнительные факторы — свет, тепло, искра или какой-то другой внешний фактор. И алкены, и алканы реагируют с галогенами (хлор и бром), но для алкенов это реакция присоединения (радикального характера), а для алканов — замещения. Водород присоединяется к алкенам при отсутствии катализатора; алкены могут также присоединять воду и взаимодействовать с кислотами (при этом характер реакций будет ионный). Алканы ни с водой, ни с водородом не реагируют.
Правило Марковникова гласит, что при присоединении протонных кислот или воды к несимметричным алкенам атом водорода будет присоединяться к тому атому углерода, который наиболее гидрогенизирован. Удобно, что все реакции с участием алкинов типовые и запоминаются относительно легко. Научите учеников моделировать реакцию: одни и те же связи разрываются и возникают, например, при взаимодействии алкина с водородом и с бромовой водой.
Из правила Марковникова есть исключения:
1. Когда двойная связь в молекуле алкена соседствует с электронно-акцепторной группой (например, трифторметил). Электронная плотность изменяется, и продукты реакции получаются иные, чем по правилу Марковникова. Атомы фтора сильно электроотрицательны и смещают двойную P-связь.
2. Строго для гидробромирования: взаимодействие несимметричного алкена с бромоводородом при участии органической перекиси. Тогда реакция протекает по радикальному механизму.
3. Сопряженные системы: двойная углерод-углеродная связь сопряжена с двойной углерод-водородной или углерод-азотной связью. Здесь также происходит смещение электронной плотности по P-связи. На атоме углерода возникает избыточный отрицательный заряд, в результате происходит «антимарковниковский» эффект.
Всегда ли для алкенов возможны только реакции присоединения? Согласно теории Бутлерова, достаточно знать строение молекулы, чтобы предсказать свойства вещества. Рассмотрим молекулу алкена пропена. В ней отчетливо выделяются две части: первая от этилена, где атомы углерода в sp2 гибридном состоянии, вторая — от алкана (метана), в которой находится sp3 гибридный атом углерода. Следовательно, пропен сочетает в себе свойства этилена и метана; а для метана характерна реакция замещения под воздействием внешних факторов (например, внешнего облучения). Реакция замещения у пропена возможна благодаря устойчивости аллельного радикала. Для всех алкенов, начиная от пропена, возможны аналогичные реакции, хотя это и не самое характерное свойство данной группы.
Реакция полимеризации. Эта реакция имеет огромное практическое значение, потому что с ее помощью возникает целый ряд углеводородов и их производных — полимеров. Чтобы реакция началась, нужен инициатор — радикал. Он взаимодействует с молекулой, например, этилена; двойная связь в этилене распадается, образовавшаяся частица взаимодействует с другой CH-группой, затем с ещё одной, и так процесс полимеризации идет до тех пор, пока связь не оборвется (это произойдет тогда, когда встретятся два радикала).

Органическая химия в тестовых заданиях. Профильный уровень. 10–11 классы. Учебное пособие
Учебное пособие предназначено для учащихся 10-11 классов общеобразовательных учреждений. Оно окажет помощь в закреплении и углублении знаний по органической химии. В пособии предлагаются задания различной степени сложности, представленные в тестовой форме.
Купить
У учеников часто возникают трудности, когда в задании требуется написать уравнение подобной реакции. Есть простой прием: объемные заместители пишем внизу. Так формула становится нагляднее.
Окисление алкенов. С одной стороны, двойная связь всегда энергетически обязательно сильнее, чем одинарная. С другой стороны, двойная связь — это наиболее активная часть молекулы, поэтому именно двойная связь подвержена окислению. При мягком окислении разрывается двойная связь, образуются двухатомные спирты. Эта реакция проходит в нейтральной среде без нагревания.
Что ещё почитать?
- Демоверсия ЕГЭ-2019 по химии
- Методические подходы к изучению ОВР в основной школе
- Методическая помощь учителю химии
- Изучение сероорганических соединений
- К методике изучения классов неорганических соединений
Если в реакции присутствует серная кислота, происходит жесткое окисление: атом углерода максимально окружает себя атомами кислорода, но одинарные связи по-прежнему не разрушаются. Здесь основная сложность — правильно определить степени окисления и расставить коэффициенты (см. видео).
Получение алкенов. Опорой для изучения этой темы должна быть хорошо усвоенная информация о химических свойствах алканов. Дегидрирование алканов по сути и является процессом получения алкенов. Другой способ — крекинг алканов: при этой реакции всегда образуется два углеводорода, алкен и алкан; интуитивно это ясно, так как на два алкена просто не хватит атомов водорода. Другие способы получения алкенов можно изучить через повторение химических свойств самих алкенов. Например: гидратация алкенов дает спирты, а если от спирта отщепить воду, нагревая его с серной кислотой, получим алкен.
Правило Зайцева. При отщеплении воды от спирта, водород преимущественно отделяется от того атома углерода, у которого водородов меньше (то есть, от вторичного). Примерно та же ситуация наблюдается при дегидрохлорировании, однако, если хлороводород присоединяется к алкену легко, то отщепить его можно только при воздействии щелочи, растворенной в спирте.
Можно присоединить галоген к алкену, получается дигалогеналкан. Отщепить галогены тоже можно, под действием активного двухвалентного металла. Часто у учеников возникает вопрос, можно ли использовать одновалентный металл? Отвечаем: можно, но это нетипичная реакция.
Циклоалканы. Снова начнем со строения. Перед нами цикличные молекулы, изомерные алкенам, не содержащие двойных углерод-углеродных связей. Здесь возможна геометрическая изомерия. Ученикам, сдающим ЕГЭ по химии, полезно знать устойчивые конформации, свойственные тем или иным циклоалканам. Еще запомним правило: малые циклы (трехчлены и четырехчлены) — напряженные, как сжатые пружины, а большие циклы (пяти- и шестичлены) менее напряжены. Для первых характерны реакции присоединения, для вторых — замещения.
Химические свойства циклоалканов. Что могут присоединить малые циклы? Водород, галоген, галогеноводород, при определенных условиях — воду. Большие циклы реагируют примерно так же, как и большие алканы: с бромом, азотной кислотой, возможны реакции дегидрирования.
Получение циклоалканов. Здесь нужно повторить уравнения реакций при взаимодействии дигалогеналканов с активными двухвалентными металлами. Эти уравнения будут очень нужны при выполнении заданий на восстановление цепочки превращений и при решении задач на нахождение формулы вещества.
#ADVERTISING_INSERT#
Вебинар по теме
Скачать материал

Скачать материал


- Сейчас обучается 51 человек из 32 регионов




- Сейчас обучается 40 человек из 30 регионов


Описание презентации по отдельным слайдам:
-
1 слайд
Трудные вопросы ЕГЭ по химии.
Учитель химии МБОУ СОШ с углубленным изучением отдельных предметов №3 г. Лебедянь
Колюко Н.А. -
2 слайд
«Чтобы избегать ошибок, надо набираться опыта;
чтобы набираться опыта, надо делать ошибки». -
3 слайд
При проведении итоговой государственной аттестации выпускников основной школы в форме письменного экзамена по химии все его участники выполняют экзаменационную работу, в которой для контроля знаний используются различные по форме и степени сложности задания.
Главное назначение экзаменационной работы состоит в том, чтобы по результатам ее выполнения получить объективную информацию об уровне общеобразовательной подготовки выпускников и тем самым показать, насколько их зания и умения соответствуют требованиям Государственного стандарта основного общего образования по химии -
4 слайд
Экзаменационная работа строится с учетом следующих положений:
Содержание экзаменационной работы определяется на основе федерального компонента Государственного стандарта основного общего образования по химии (2004).
Содержание заданий ориентированы на проверку усвоения содержания всех ведущих тем курса химии основной школы и должны быть различного уровня сложности (базовый, повышенный и высокий уровни).
Тип и сложность каждого задания должны соответствовать требованиям стандарта к уровню усвоения проверяемого понятия, а содержание задания – тому виду деятельности, которую нужно осуществить при его выполнении.
Во всех вариантах экзаменационной работы нужно использовать задания одинакового уровня сложности.
При выполнении экзаменационной работы выпускникам необходимо не только вспомнить известные им факты и понятия, но и осуществить определенные виды деятельности: выявлять существенное, объяснять, рассуждать и т.д. -
5 слайд
ЕГЭ по химии не является обязательным для сдачи на выпускных экзаменах в школе. Его нужно будет сдавать для поступления в вузы по следующим направлениям: химия и химическая технология, медицина, строительство, биотехнология и другие. На общем фоне экзамен не очень популярный – только один ученик из десяти выпускников выбирает химию.
В 2016 году ЕГЭ по химии остается на 7-м месте по популярности среди выпускников, 3,5% сдававших в этом году выбрали экзамен по химии в качестве дополнительного. С каждым годом экзамен дается труднее, процент не сдавших растет, а средний балл опускается ниже. -
-
7 слайд
Анализ результатов выполнения заданий с выбором ответа (часть 1)
Трудности при установлении типа связи, ориентируясь на положение элементов в Периодической системе химических элементов.
Непониманием терминов «молекулярное» и «немолекулярное» строение, неумение мыслить «от противного», осуществлять корреляцию строения и свойств вещества -
8 слайд
Анализ результатов выполнения заданий с выбором ответа (часть 1)
Прогнозирование возможности реакции между веществами, трудности при выполнении заданий, в которых употреблялось отрицание.
Неумение выпускников устанавливать причинно-следственные связи между принадлежностью вещества к определенному классу соединений и его химическими свойствами. -
9 слайд
Анализ результатов выполнения заданий с выбором ответа (часть 1)
Трудность определения числа σ-связей в молекулах органических веществ (толуола или метаналя, например).
Незнание одного из основных правил – правило В.В.Марковникова, а также неумение прогнозировать результат реакции. -
10 слайд
Строение электронных оболочек
Восьмиэлектронную внешнюю оболочку имеет ион
1) P3+ 2) S2- 3) Cl5+ 4) Fe3+Ответ: 2
-
11 слайд
Характерные химические свойства неорганических веществ различных классов: простых веществ – металлов и неметаллов
Верны ли следующие суждения о неметаллах?
А. В периодической системе неметаллы расположены в правой, преимущественно верхней части.
Б. Среди неметаллов нет ни одного d- элемента.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверныОтвет: 3
-
12 слайд
Химическая связь: ковалентная (полярная и неполярная). Длина и энергия связи
В молекуле какого вещества длина связи между атомами углерода наибольшая?
1) ацетилена 2) этана
3) этена 4) бензолаОтвет: 2
-
13 слайд
Зависимость свойств веществ от особенностей их кристаллической решетки
Вещества твердые, прочные, с высокой температурой плавления, расплавы которых проводят электрический ток, имеют кристаллическую решетку
1) металлическую 2) молекулярную 3) атомную 4) ионную
Ответ: 4 -
14 слайд
Характерные химические свойства неорганических веществ различных классов: солей (средних и кислых)
С водными растворами хлороводорода, гидроксида бария и хлорида меди(II) реагирует
1) CaCO3 2) K2SO3
3) Na2SO4 4) Al2(SO4)3Ответ: 2
-
15 слайд
Органическая химия
Химические свойства основных классовС раствором NaOH не реагирует вещество, формула которого
1) С6Н5СООН 2) С6Н5ОН
3) С2Н5СООН 4) С2Н5ОНОтвет: 4
-
16 слайд
Характерные химические свойства неорганических веществ различных классов: солей (средних и кислых)
Карбонат натрия не реагирует с
1)гидроксидом бария
2) гидроксидом калия
3) серной кислотой
4) углекислым газом
Ответ: 2 -
17 слайд
Органическая химия
Химические свойства углеводородовПри взаимодействии бутина-1 с водой в присутствии солей ртути образуется преимущественно
1) бутанол-1 2) бутанол-2
3) бутаналь 4) бутанон
Ответ: 4 -
18 слайд
Органическая химия
Химические свойства основных классов органических веществМетиламин реагирует с каждым из двух веществ:
1) O2 и N2 2) FeCl2 и NH3
3) НС1 и NaCl 4) Н2O и H2SO4Ответ: 4
-
19 слайд
Органическая химия
Химические свойства углеводородовДля получения бутена-2 из 2-бромбутана следует использовать
1) водный раствор серной кислоты
2) водный раствор гидроксида калия
3) спиртовой раствор гидроксида калия при нагревании
4) никелевый катализатор
Ответ: 3 -
20 слайд
Анализ результатов выполнения заданий с кратким ответом (часть 1)
Плохая ориентация в принципах номенклатуры веществ и в соотнесении названия с формулой или классом соединений. Общей тенденцией можно считать низкий уровень владения участниками экзамена номенклатурой органических веществ.
Неумение определять характер среды при гидролизе веществ, заданных названиями, а не формулами -
21 слайд
Анализ результатов выполнения заданий с кратким ответом (часть 1)
Недостаточный уровень знаний механизмов реакций в органической химии. Традиционно сложными для выпускников остаются вопросы, связанные с устойчивостью карбокатионов.
Уровень освоения стандарта образования, связанный с химическими свойствами органических веществ, как показали результаты экзамена, низкий. -
22 слайд
Классы неорганических соединений, оксиды
Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать.
НАЗВАНИЕ ОКСИДА ФОРМУЛЫ ВЕЩЕСТВ
А) оксид кремния(IV) 1) Al, H2SO4, CO
Б) оксид азота(IV) 2) Fe2O3, H2O, NH3
В) оксид бария 3) С, КОН, СаСО3
Г) оксид железа(III) 4) NaOH, H2O, СаО .
5) Н2О, SO3, Н3РО4 .
6) Н2О, HNO3, Са(ОН)2Правильный ответ: 3451
-
23 слайд
№31. Обратимые и необратимые химические реакции. Химическое равновесие.
-
-
25 слайд
№32.Качественные реакции на неорганические вещества
и ионы. Качественные реакции органических соединений
Качественные реакции – это реакции, позволяющие доказать наличие того или иного вещества (иона) в среде или присутствие функциональной группы в веществе.
Анализируемые вещества могут находиться в различных агрегатных состояниях (твёрдом, жидком и газообразном). С точки зрения наблюдаемых эффектов все реакции обнаружения можно разделить на несколько групп:
1) образование характерных осадков,
2) растворение вещества,
3) появление (изменение) окраски,
4) выделение газов,
5) изменение запаха,
6) окрашивание пламени. -
26 слайд
№32. Установите соответствие между веществами и реагентом, с помощью которого можно различить эти вещества.
А – 5
Б – 1
В – 2
Г – 3 -
27 слайд
№32. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
А – 2
Б – 3
В – 2
Г – 2 -
28 слайд
№32. Установите соответствие между реагирующими веществами и признаком реакции, которая протекает между ними.
А – 2
Б – 5
В – 1
Г – 5 -
29 слайд
Анализ результатов выполнения заданий с развернутым ответом (часть 2)
Ошибки в определении окислителя и восстановителя, в электронном балансе и затруднения в определении пропущенных формул участников реакции.
Затруднения при написании уравнений возможных реакций, в которых принимали участие соединения хрома.
Затруднения в определении избытка одного из веществ и при вычислении массы получившегося раствора с учетом выделившегося в процессе реакции газа. -
30 слайд
Анализ результатов выполнения заданий с развернутым ответом (часть 2)
Трудности в составлении уравнений окислительно-восстановительных реакций с участием органических веществ. Выпускники по большей части плохо прогнозируют продукты реакции при окислении алкенов водным раствором КМnO4; спиртов — раствором КМnO4 в среде серной кислоты; альдегидов — раствором КМnO4 в щелочной среде и т.п. -
31 слайд
Анализ результатов выполнения заданий с развернутым ответом (часть 2)
Затруднения в определении избытка одного из веществ и при вычислении массы получившегося раствора с учетом выделившегося в процессе реакции газа.
Неумение применять знания в изменившейся ситуации. -
32 слайд
№36.Необходимые навыки
Расстановка степеней окисления
Задавать себе главный вопрос: кто в этой реакции отдаёт электроны, а кто их принимает?
Определите, в какой среде (кислой, нейтральной или щелочной) протекает реакция. если в продуктах мы видим кислоту, кислотный оксид — значит, это точно не щелочная среда, а если выпадает гидроксид металла — точно не кислая.
Проверьте, чтобы в реакции был и окислитель, и восстановитель
Если оба вещества могут проявлять свойства и восстановителя, и окислителя — надо продумать, какое из них более активный окислитель. Тогда второй будет восстановителем. -
33 слайд
Возможные ошибки
Расстановка степеней окисления:
а) степени окисления в водородных соединениях неметаллов: фосфин РН3 — степень окисления у фосфора — отрицательная;
б) в органических веществах — проверьте ещё раз, всё ли окружение атома С учтено
в) аммиак и соли аммония — в них азот всегда имеет степень окисления −3
в) кислородные соли и кислоты хлора — в них хлор может иметь степень окисления +1, +3, +5, +7;
г) двойные оксиды: Fe3O4, Pb3O4 — в них металлы имеют две разные степени окисления, обычно только одна из них участвует в переносе электронов. -
34 слайд
№36
Na2SO3 + KMnO4 + … → … + MnO2 + KOH3 S+4 — 2ē → S+6
2 Mn+7 + 3ē → Mn+43Na2SO3 + 2KMnO4 + H2O → 3Na2SO4 + 2MnO2 + 2KOH
Сера в степени окисления +4 (или сульфит натрия за счет серы в степени окисления +4) является восстановителем, а марганец в степени окисления +7 (или перманганат калия за счет марганца в степени окисления +7) – окислителем.
-
35 слайд
№36
… + KNO2 + H2SO4 → I2 + NO + … + H2O1 2I― — 2ē → I20
2 N+3 + ē → N+23KI + 2KNO2 + 2H2SO4 → I2 + 2NO + 2K2SO4 + 2H2O
Йод в степени окисления -1 (или йодид калия за счет йода в степени окисления -1) является восстановителем, а азот в степени окисления +3 (или нитрит калия за счет азота в степени окисления +3) – окислителем.
-
36 слайд
№37. Взаимосвязь различных классов неорганических веществ
-
37 слайд
Кристаллическое вещество оранжевого цвета при нагревании значительно увеличивается в объёме за счёт выделения бесцветного газа и образует твёрдое вещество тёмно-зелёного цвета. Выделившийся газ взаимодействует с литием даже при комнатной температуре. Продукт этой реакции гидролизуется водой с образованием газа с резким запахом, способного восстановить медь из её оксида. Напишите уравнения описанных реакций.
-
-
39 слайд
Нитрат меди прокалили, образовавшееся твёрдое вещество растворили в разбавленной серной кислоте. Раствор полученной соли подвергли электролизу. Выделившееся на катоде вещество растворили в концентрированной азотной кислоте. Растворение протекало с выделением бурого газа.
-
40 слайд
Элементы ответа:
Написаны четыре уравнения возможных реакций между указанными веществами: -
41 слайд
№38. Генетическая связь
между основными классами органических веществ -
42 слайд
При решении задания №38«Цепочка органических веществ» учащийся должен написать пять уравнений химических реакций, среди которых одно является окислительно-восстановительным.
-
43 слайд
Общие свойства классов органических веществ
Общие способы получения органических веществ
Специфические свойства некоторых конкретных веществОбязательный минимум знаний
-
-
-
46 слайд
Типичные ошибки при выполнении задания №38:
незнание условий протекания химических реакций, генетической связи классов органических соединений;
незнание механизмов, сущности и условий реакций с участием органических веществ, свойств и формул органических соединений;
неумение предсказать свойства органического соединения на основе представлений о взаимном влиянии атомов в молекуле;
незнание окислительно-восстановительных реакций (например, с перманганатом калия). -
47 слайд
№39. Расчёты по уравнениям реакций
-
48 слайд
Классификация задач
Задачи на смеси веществ
Расчёты по уравнениям
Задачи на «тип соли»
Нахождение массовой доли продукта в растворе
Нахождение массы одного из исходных веществ по уравнению реакции -
49 слайд
№39.Расчёты по уравнениям реакций.
Газ, выделившийся при взаимодействии 110 мл 18 % -ного раствора HCl (ρ = 1,1 г/мл) и 50 г 1,56 % — ного раствора Na2S пропустили через 64 г 10,5% — ного раствора нитрата свинца. Определите массу соли, выпавшей в осадок.
-
50 слайд
№39.Задачи на смеси веществ
На нейтрализацию 7,6 г смеси муравьиной и уксусной кислот израсходовано 35 мл 20%-ного раствора гидроксида калия (плотность 1,20 г/мл). рассчитайте массу уксусной кислоты и её массовую долю в исходной смеси кислот.
-
51 слайд
№39. Определение состава продукта реакции (задачи на «тип соли»)
Аммиак объёмом 4,48 л (н.у) пропустили через 200 г 4,9%-ного раствора ортофосфорной кислоты. Назовите соль, образующуюся в результате реакции, и определите её массу.
-
52 слайд
№39. Нахождение массовой доли одного из продуктов реакции в растворе по уравнению материального баланса
Оксид, образовавшийся при сжигании 18,6 г фосфора в 44,8 л (н.у.) кислорода, растворили в 100 мл дистиллированной воды. Рассчитайте массовую долю ортофосфорной кислоты в полученном растворе.
-
53 слайд
№39.Нахождение массы одного из исходных веществ по уравнению материального баланса
Какую массу гидрида лития нужно растворить в 200 мл воды, чтобы получить раствор с массовой долей гидроксида 10%? Какой цвет приобретёт метилоранж при добавлении его в полученный раствор? Запишите уравнение реакции и результаты промежуточных вычислений. -
54 слайд
№40. Вывод молекулярной формулы вещества
-
55 слайд
Вывод формул
По известному элементному составу
По известной общей формуле и массовой доле одного химического элемента
По уравнению реакции
По уравнениям двух реакций
По продуктам сгорания -
-
57 слайд
№40. При сжигании образца некоторого органического соединения массой 14,8 г получено 35,2 г углекислого газа и 18,0 г воды. Известно, что относительная плотность паров этого вещества по водороду равна 37. В ходе исследования химических свойств этого вещества установлено, что при взаимодействии этого вещества с оксидом меди(II) образуется кетон.
На основании данных условия задания:
1) произведите необходимые вычисления;
2) установите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции этого вещества с оксидом меди(II). -
-
59 слайд
№40. При полном сгорании образца ацетиленового углеводорода образовалось 20,16 л (н. у.) углекислого газа и 13,5 г воды. Известно, что молекула углеводорода имеет разветвлённый углеродный скелет, а сам углеводород не взаимодействует с аммиачным раствором оксида серебра. Установите молекулярную и структурную формулы углеводорода, рассчитайте массу образца.
-
-
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 155 157 материалов в базе
- Выберите категорию:
- Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Другие материалы
Рейтинг:
5 из 5
- 10.04.2017
- 4326
- 22
- 10.04.2017
- 1059
- 0


Урокпо теме : «Крепмний»
- Учебник: «Химия», Кузнецова Н.Е., Титова И.М., Гара Н.Н.
- Тема: § 34. Кремний и его свойства. Соединения кремния
- 10.04.2017
- 1002
- 0

Рейтинг:
5 из 5
- 10.04.2017
- 3232
- 26
Рейтинг:
5 из 5
- 10.04.2017
- 7821
- 103
- 10.04.2017
- 993
- 5
Вам будут интересны эти курсы:
-
Курс повышения квалификации «Химия окружающей среды»
-
Курс профессиональной переподготовки «Химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Нанотехнологии и наноматериалы в биологии. Нанобиотехнологическая продукция»
-
Курс повышения квалификации «Этика делового общения»
-
Курс повышения квалификации «Особенности подготовки к сдаче ОГЭ по химии в условиях реализации ФГОС ООО»
-
Курс профессиональной переподготовки «Биология и химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Использование активных методов обучения в вузе в условиях реализации ФГОС»
-
Курс повышения квалификации «Методы и инструменты современного моделирования»
-
Курс повышения квалификации «Современные образовательные технологии в преподавании химии с учетом ФГОС»
-
Курс профессиональной переподготовки «Политология: взаимодействие с органами государственной власти и управления, негосударственными и международными организациями»
-
Курс профессиональной переподготовки «Техническое сопровождение технологических процессов переработки нефти и газа»
-
Курс профессиональной переподготовки «Организация системы учета и мониторинга обращения с отходами производства и потребления»
-
Курс профессиональной переподготовки «Организация и управление процессом по предоставлению услуг по кредитному брокериджу»
-
Курс профессиональной переподготовки «Гражданско-правовые дисциплины: теория и методика преподавания в образовательной организации»
Химия — один из самых сложных предметов для сдачи ЕГЭ. Задания меняются каждый год: то, что раньше казалось трудным, нынешние выпускники должны успевать за пару минут. Несмотря на это экзамен необходим будущим врачам, фармацевтам и, конечно же, химикам. Давайте обсудим, как устроен ЕГЭ по химии 2023 и что нужно выучить для успешной сдачи!
Структура ЕГЭ по химии 2023
ЕГЭ по химии состоит из двух частей. В первой выпускникам предлагают решить 28 заданий — нужен краткий ответ в виде одного числа или последовательности чисел. Во второй части — 6 заданий с развернутым ответом. В них нужно записывать уравнения химических реакций и решать сложные математические задачи. Если выполнить работу без ошибок, можно набрать 56 первичных баллов.
Нововведение ЕГЭ по химии 2023 — сокращение количества заданий и появление новых прототипов.
Изменения в ЕГЭ по химии 2023
Задание № 23. В прошлом году ребята впервые решали задание на расчет равновесных и исходных концентраций. Оно представляло собой уравнение химической реакции, а также таблицу с концентрациями каждого участника. В этом году таблицы не будет, вместо нее предлагается найти исходные данные в тексте. Советуем вам не отходить от уже отработанного алгоритма и самостоятельно составлять таблицы. Немного практики и навык владения калькулятором помогут получить за этот номер максимальные баллы даже с новым условием.
Задания № 9, 12 и 16. Эти задания не изменились на вид. В №9 и 16 предстоит разобраться с небольшими цепочками превращений – неорганической и органической соответственно. А в задании 12 выпускников вновь ожидают химические свойства органических веществ и неизвестное количество правильных ответов. Но в этом году задания станут сложнее, их переносят в разряд заданий повышенного уровня сложности. К сожалению, при неизменном 1 балле за каждый из номеров.
Задания № 33 и 34. Каждый выпускник накануне ЕГЭ по химии очень хочет знать, чему будут посвящены задачи 33 и 34. Конечно же, тайну нам не открыли, но зато эти задания поменяли местами. Теперь №33 – это задача на установление органической формулы, а №34 – сложная расчетная задача, основанная на неорганических превращениях.
Задание № 32. Эта органическая цепочка существенно не изменилась, ребятам предстоит записать пять уравнений химических реакций. Но стоит обратить пристальное внимание на изображение гексана, с такими формулами мы в ЕГЭ еще не сталкивались, но есть вероятность, что видеть их мы теперь будем чаще.
Это главные изменения ЕГЭ по химии 2023. Но для того, чтобы получить высокий балл, просто знать о них недостаточно. Когда ФИПИ обновляет формулировки заданий, может измениться и способ их решения и критерии оценивания. Если не учитывать это во время подготовки к ЕГЭ, то можно потерять немало баллов. Обидно!
Это — лишь малая часть ловушек экзамена, которые составители расставляют выпускникам. На своих занятиях по подготовке ЕГЭ по химии я показываю ученикам их все. Мы учимся обходить каждую из них и делать такие решения заданий, к которым никто не придерется. А еще я всегда делюсь лайфхаками быстрого и правильного решения типичных задач — так можно сэкономить много времени на более сложные вещи.
Всему этому я могу научить и вас! Приходите ко мне на уроки, и я подготовлю вас к ЕГЭ по химии на 80+ 💪🤓
Какие темы есть в ЕГЭ по химии?
Чтобы успешно сдать ЕГЭ по химии 2023, нужно освоить пять разделов этой науки.
Теоретические основы химии
Этот блок включает в себя информацию о строении атомов, об их существовании в молекулах вещества. Выпускникам нужно продемонстрировать навыки работы с таблицей химических элементов Д.И. Менделеева. Этот раздел поможет решить задания 1-4, 18-20, 23 в первой части, а также задание 29 во второй части.
Неорганическая химия
Этой теме посвящены задания 5-9, 17, 21 (первая часть), 30, 31 (вторая часть). Вас ждут любые свойства неорганических соединений: от простых веществ-металлов и неметаллов до комплексных солей и кристаллогидратов. Чтобы получить высокие баллы, необходимо также знать правила номенклатуры, способы получения и основы процессов гидролиза и электролиза.
Органическая химия
В заданиях 10-16 и 32 вы столкнетесь с органической химией. Ученики, которые готовятся самостоятельно, часто стараются выучить все классы веществ по стандартному плану: название класса, номенклатура, физические и химические свойства, способы получения и применение. На самом деле можно значительно облегчить себе жизнь и начать со строения органических молекул. Как только вы поймете, что кратные связи можно разорвать одним набором реактивов, в группе –ОН замещают атом водорода, а –NH2 группа реагирует с кислотами, классы органических веществ и их реакции покажутся однотипными.
Химия и жизнь
Название этого раздела кажется простым и понятным. К сожалению, именно здесь ученики чаще всего теряют баллы. В задании 24 необходимо мысленно представить эксперимент и написать, что произойдет при смешивании заданных веществ. Например, может выпасть осадок, выделиться газ, а может вообще ничего не произойти. В задании 25 нужно определить, где используют то или иное химическое соединение. Ответом может быть химическая промышленность, медицина, сельское хозяйство и, конечно, повседневная жизнь человека.
Решение расчетных задач
Очень важная часть экзамена по химии. В заданиях 26, 27 и 28 в первой части нужно дать ответ в виде числа, не записывая решение. Обычно эти задачи решаются в одно действие — они проверяют не знания химических процессов, а навыки работы с калькулятором.
Задание 34, по мнению многих учеников — самое сложное во всем экзамене. Чтобы его решить, нужно знать химические свойства веществ, уметь составлять причинно-следственные связи в химических системах, понимать, какие вещества реагируют без остатка и почему. Кроме того, в последние годы все чаще встречаются задачи, которые необходимо решать с помощью линейных уравнений или их систем.
В задаче 32 нужно выполнить расчеты, которые позволят установить молекулярную формулу некоторого органического вещества. Далее, используя описание, необходимо представить эту формулу в структурном виде, показывая связи между атомами. Обязательно запишите в ответе уравнение реакции, о которой идет речь в условии!
Как подготовиться к ЕГЭ по химии 2023?
По структуре экзамена видно, что вам придется повторить или освоить заново весь курс химии за год. С какой темы начать? За что взяться в первую очередь?
Скачайте кодификатор по химии 2023 года. Обычно он находится вместе в демоверсией. В этом документе перечислены все темы, которые необходимо хорошо подготовить. Этот перечень охватывает все задания ЕГЭ, в нем нет ничего лишнего.
Подружитесь с таблицами. Периодическая система химических элементов Д. И. Менделеева, таблица растворимости кислот, солей и оснований, ряд активности металлов – это отличные шпаргалки, которые раздают вместе с вариантами на ЕГЭ. Если правильно ими воспользоваться, можно не только понять, протекает ли реакция между веществами, но даже установить среду раствора, силу кислоты и цвет осадка. И это еще не все!
Грамотно распределите время. Учите теорию, но и не забывайте практиковаться. Если вы не нарешаете тренировочных вариантов, время может сыграть злую шутку на реальном экзамене. 210 минут не хватает на размышления, решения, красивую запись и перепроверку. Необходимо работать в хорошем темпе!
Не оставляйте подготовку на конец года. Несмотря на распределение заданий по разделам химии, старайтесь решать их с самого начала подготовки, постепенно усложняя условия. И помните, что задачи второй части ЕГЭ оцениваются по критериям. Даже если вы не знаете, как решить задание полностью, вы всегда можете заработать 1-2 первичных балла, записав без ошибок уравнения химических реакций и проведя простейшие расчеты.
Прорешивайте как можно больше заданий. Это, пожалуй, самый главный совет. Чем больше вы будете тренироваться и решать типовые задачи, тем выше шансы получить на экзамене высокий балл. Все потому, что вы поймете алгоритм решения и сможете находить правильный ответ намного быстрее, чем другие выпускники.
Когда я готовлю к ЕГЭ по химии в MAXIMUM Education, мы посвящаем немало времени решению всех заданий экзамена. Мы разбираем все части экзамена и учимся правильно оформлять ответы, чтобы не потерять ни одного балла. Чтобы проверить, все ли понятно ученикам, я провожу срезы знаний и даже пробный экзамен. После него я разбираю ошибки с каждым учеником отдельно, и дополнительно объясняю сложные темы.
После такой подготовки мои выпускники пишут настоящий экзамен уверенно и получают высокие баллы. Точно выше среднего балла по стране 🙃 Хотите так же? Приходите на мои занятия, и я научу вас всему, что знаю!
ТРУДНЫЕ ЗАДАНИЯ ЕГЭ ПО ХИМИИ
Как показали результаты репетиционного экзамена по химии, наиболее трудными оказались задания, направленные на проверку знаний химических свойств веществ.
К числу таких заданий можно отнести задание
С3 – «Цепочка органических веществ»,
С2 – «Реакции между неорганическими веществами и их растворами».
При решении задания С3 «Цепочка органических веществ» учащийся должен написать пять уравнений химических реакций, среди которых одно является окислительно-восстановительным.
Рассмотрим составление одного из таких окислительно-восстановительных уравнений:
СН3СНО X1
Чтобы составить уравнение окислительно-восстановительной реакции с участием органических веществ, нужно научиться определять степень окисления в органическом веществе по его структурной формуле. Для этого нужно иметь знания о химической связи, знать, что такое электроотрицательность.
Структурная формула помогает оценить смещение электронов по каждой из связей. Так атом углерода метильной группы (–СН3) сместит электрон по каждой из связей к себе. Таким образом, степень окисления углерода метильной группы будет равна (-3). Атом углерода карбонильной группы (СО) отдаст 2 электрона атому кислорода, но частично компенсирует недостачу, приняв 1 электрон от атома водорода. Следовательно, его степень окисления будет равна +1:
В продукте реакции степень окисления углерода метильной группы не изменится. Карбонильная группа атомов превратится в карбоксильную с замещенным водородом на натрий, вследствие щелочной среды (-СООNa). Атом углерода карбоксильной группы сместит два электрона в сторону карбонильного кислорода и один электрон в сторону кислорода замещенной гидроксильной группы. Таким образом, степень окисления атома углеродакарбоксильной группы будет равна (+3)
Следовательно, одна молекула этаналя отдает 2 электрона:
С+1-2е=С+3
Рассмотрим теперь процессы, происходящие с перманганатом натрия. Обращает внимание, что в схеме дан перманганат натрия, а не калия. Свойства перманганата натрия должны быть аналогичны свойствам перманганта калия, который в зависимости от кислотности среды способен давать различные продукты:
Так как в нашем случае перманганат натрия используется в щелочной среде, то продуктом реакции будет манганат ион – MnO42-.
Определим степень окисления иона марганца в перманганате калия NaMnO4 пользуясь правилом равенства числа положительных и отрицательных зарядов в нейтральной структурной единице вещества. Четыре кислорода каждый по (-2) дадут восемь отрицательных зарядов, так как степень окисления у калия +1, то у марганца будет +7:
Na+1Mn+7O4-2
Записав формулу манганата натрия Na2MnO4, определим степень окисления марганца:
Na2+1Mn+6O4-2
Таким образом, марганец принял один электрон:
Mn+7+1e=Mn+6
Полученные уравнения позволяют определить множители перед формулами в уравнении химической реакции, которые называют коэффициентами:
С+1-2е=С+3 ·1
Mn+7+1e=Mn+6 2
Уравнение реакции приобретет следующий вид:
2NaMnO4+CH3CHO+3NaOH=CH3COONa+2Na2MnO4+2H2O
Задание С2 требует от участника ЕГЭ знание свойств разнообразных свойств неорганических веществ, связанных с протеканием как окислительно-восстановительных реакций между веществами, находящимися как в одном, так и в различных агрегатных состояниях, так и обменных реакций протекающих в растворах. Такими свойствами могут быть некоторые индивидуальный свойства простых веществ и их соединений, например, реакция лития или магния с азотом:
2Li+3N2=2Li3N
2Mg+N2=Mg2N2
горение магния в углекислом газе:
Mg+CO2=MgO+CO
2Mg+CO2=2MgO+C
Особую трудность у учащихся вызывают сложные случаи взаимодействия растворов веществ солей подвергающихся гидролизу. Так для взаимодействия раствора сульфата магния с карбонатом натрия можно записать целых три уравнения возможных процессов:
MgSO4+Na2CO3=MgCO3+Na2SO4
2MgSO4+2Na2CO3+H2O=(MgOH)2CO3+2Na2SO4+CO2
2MgSO4+2Na2CO3+2H2O=2Mg(OH)2+2Na2SO4+2CO2
Традиционно трудны для написания уравнения с участием комплексных соединений. Так растворы амфотерных гидроксидов в избытке щелочи обладают всеми свойствами щелочей. Они способны вступать в реакции с кислотами и кислотными оксидами:
Na[Al(OH)4]+HCl=NaCl+Al(OH)3+H2O
Na[Al(OH)4]+2HCl=NaCl+Al(OH)2Cl+2H2O
Na[Al(OH)4]+3HCl=NaCl+Al(OH)Cl2+3H2O
Na[Al(OH)4]+4HCl=NaCl+AlCl3+4H2O
Na[Al(OH)4]+CO2=NaHCO3+Al(OH)3
2Na[Al(OH)4]+CO2=Na2CO3+2Al(OH)3+H2O
Растворы солей, имеющие кислую реакцию среды, вследствие гидролиза, способны растворять активные металлы, например, магний или цинк:
Mg+MgCl2+2H2O=2MgOHCl+H2
На экзамене желательно помнить об окислительных свойствах солей трехвалентного железа:
2FeCl3+Cu=CuCl2+2FeCl2
Могут пригодиться знания об аммиачных комплексах:
CuSO4+4NH3=[Cu(NH3)4]SO4
AgCl+2NH3=[Ag(NH3)2]Cl
Традиционно вызывают затруднения, связанные с проявлением основных свойств раствором аммиака. В результате чего могут протекать обменные реакции в водных растворах:
MgCl2+2NH3+2H2O=Mg(OH)2+2NH4Cl
В заключение приведем серию уравнений химических реакций, которые нужно знать участникам ЕГЭ по химии:
ОБЩАЯ ХИМИЯ
Кислоты. Основания. Соли. Оксиды.
Кислотные оксиды (кроме SiO2) реагируют с водой, как амфотерным оксидом с образованием кислот:
P2O5 + 3H2O = 2H3PO4
SO3 + H2O = H2SO4
Для получения азотной кислоты азот оксид азота (IV) должен быть доокислен, например кислородом воздуха:
4NO2 + O2 + 2H2О = 4HNO3
Лабораторный способ получения хлороводорода: к твердому хлориду натрия приливают концентрированную серную кислоту:
NaCl + H2SO4 = NaHSO4 + HCl
Для получения бромоводорода из бромида натрия, концентрированная серная кислота не подойдет, так как выделяющийся бромоводород будет загрязнен парами брома. Можно использовать концентрированную фосфорную кислоту:
NaBr+ H3PO4 = NaH2PO4 + HBr
Кислоты реагируют с металлами, стоящими в ряду напряжений до водорода:
Fe + 2 HCl = FeCl2 + H2
И их оксидами:
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Обратите внимание на валентность переходных элементов в солях.
Щелочные и щелочноземельные металлы взаимодействуют с водой:
K + H2O = KOH + ½ H2
В условиях избытка кислоты могут образовываться и кислые соли:
2Н3РО4 + 2Na = 2NaH2PO4 + Н2
Органические кислоты также проявляют кислотные свойства:
2СН3СООН + 2Na = 2CH3COONa + Н2
СНзСООН + NaOH = CH3COONa + Н2О
Комплексные гидроксиды реагируют с кислотами с образованием солей и воды:
Na[Al(OH)4] + HCl = AlCl3 + 4H2O + NaCl
LiOH + HNO3 = LiNO3 + H2O
Многоосновные кислоты в реакции с гидроксидами могут образовывать кислые соли:
Н3РО4 + КОН = КН2РО4 + Н2О
Продуктом реакции аммиака с фосфорной кислотой может также быть кислая соль:
NH3 + H3PO4 = NH4H2PO4
Обратим внимание на свойства оснований, их взаимодействие с кислотами:
2Н3РО4 + ЗСа(ОН)2 = Са3(РО4)2¯ + 6Н2О
с кислотными оксидами:
Ca(OH)2 + CO2 = CaCO3 + H2O
2Ca(OH)2 + CO2=(СaOH)2CO3+H2O
Реакция гидроксидов с кислотными оксидами может приводить и к кислым солям:
KOH + CO2 = KHCO3
Основные оксиды реагируют с амфотерными оксидами:
CaO + H2O = Ca(OH)2
Средние соли в воде реагируют с кислотными оксидами с образованием кислых солей:
CaCO3 + CO2 + H2O = Ca(HCO3)2
Более сильные кислоты вытесняют более слабые из их солей:
CH3COONH4 + HCl = CH3COOH + NH4Cl
K2CO3 + H2SO4 = K2SO4 + H2O + CO2
Кислоты в присутствии серной кислоты реагируют со спиртами с образованием сложных эфиров:
CH3COOH + C2H5OH = CH3COOC2H5 + H2O
Более сильное основание вытесняет более слабое из его солей:
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl
MgCl2 + KOH = MgOHCl + KCl
NH4С1 + NaOH = NaCl + NH3 + H2O
Чтобы получить из основной соли получить среднюю соль нужно подействовать кислотой:
MgOHCl + HCl = MgCl2 + H2O
Гидроксиды металлов (кроме щелочных металлов) разлагаются при нагревании в твердом виде до оксидов:
2Al(OH)3 = Al2O3 + 3H2O
2Fe(OH)3 = Fe2O3 + 3H2O
Гидрокарбонаты при нагревании разлагаются до карбонатов:
2KHCO3 = K2CO3 + H2O + CO2
Нитраты обычно разлагаются до оксидов (обратите внимание на повышение степени окисления переходного элемента находящегося в промежуточной степени окисления):
2Fe(NO3)2 = Fe2O3 + 4NO2 + 0,5O2
2Fe(NO3)3 Fe2O3 + 6NO2 + 1,5 O2
2Cu(NO3)2 = 2CuO + 4NO2 + О2
Нитраты щелочных металлов разлагаются до нитритов:
NaNO3 = NaNO2 + ½ O2
Карбонаты металлов (кроме щелочных) разлагаются до оксидов:
CaCO3 = CaO + CO2
При составлении уравнений реакций ионного обмена пользуйтесь таблицей растворимости:
K2SO4 + BaCl2 = BaSO4 + 2KCl
[C6H5-NH3]C1 + AgNО3 = [C6H5NH3]NO3 + AgCl
Электролиз
Электролиз расплавов солей:
2KCl = 2K + Cl2
Электролиз растворов солей металлов, стоящих в ряду напряжения после водорода:
2HgSO4 + 2H2O = 2Hg + О2 + 2H2SO4
1) на катоде: Hg2+ + 2e = Hg°
2) на аноде: 2Н2О – 4е = О2 + 4Н+
Электролиз раствора сульфата натрия
1) на катоде: 2H2O + 2e = H2 + 2OH–
2) на аноде: 2H2O – 4e = O2 + 4H+
3) Составлено общее уравнение электролиза:
2H2O = 2H2 + O2
до водорода:
СаI2 + 2Н2О = Н2 + I2 + Са(ОН)2
1) на катоде: 2Н2О + 2e = 2ОН + Н2
2) на аноде: 2I— — 2e = I2
Сравните свойства одноэлементных и кислородсодержащих анионов.
Химические реакции, возможные при электролизе сульфата хрома (III):
1)Сг3+ + e = Сг2+
2) Cr2+ + 2e = Сг°
3) Сг3+ + 3 e= Сг°
4) 2Н+ + 2e = Н2
Электролиз водных растворов солей карбоновых кислот:
2CH3COONa + 2H2O = CH3CH3 + 2CO2 + H2 + 2NaOH
Гидролиз
Пример взаимного гидролиза солей:
A12(SO4)3 + 3K2CO3 + 3H2O = 2A1(OH)3 + 3CO2 + 3K2SO4
Амфотерность
Амфотерные гидроксиды растворяются в водных растворах щелочей:
A1(OH)3 + 3KOH = K3[A1(OH)6]
A1(OH)3 + KOH = K[Al(OH)4]
реагируют с твердыми щелочами при сплавлении:
Al(OH)3 + KOH KAlO2 + 2H2O
Амфотерные металлы реагируют с водными растворами щелочей:
Al + NaOH + 3H2O = Na[Al(OH)4] + 3/2 H2
Продукт сплавления амфотерного гидроксида со щелочью легко разлагается водой:
KAlO2 + 2H2O = KOH + Al(OH)3
Комплексные гидроксиды реагируют с кислотами:
K[Al(OH)4] + HCl =KCl + Al(OH)3 + H2O
Бинарные соединения
Способ получения:
СаО + 3С = СаС2 + СО
Бинарные соединения реагируют с кислотами:
Al2S3 + 3H2SO4 := Al2(SO4)3 + 3H2S
Mg3N2 + 8HNO3 = Mg(NO3)2 + 2NH4NO3
и водой:
A14C3 + 12Н2О = 4А1(ОН)3 + ЗСН4
PCl3 + H2O = 3H3PO3 + 3HCl
НЕОРГАНИЧЕСКАЯ ХИМИЯ
Азот
Азотная кислота является сильным окислителем:
окисляют неметаллы:
ЗР + 5HNO3 + 2Н2О = Н3РО4 + 5NO
P + 5HNO3 = H3PO4 + 5NO2 + H2O
металлы:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 = 4Mg(NO3)2 + N2O + 5H2O
оксиды переходных металлов в промежуточных степенях окисления:
3Cu2O + 14HNO3 = 6Cu(NO3)2 + 2NO+ 7H2O (возможно выделение NО2)
оксиды азота также проявляют окислительные свойства:
5N2O + 2P = 5N, + P2O
но по отношению к кислороду являются восстановителями:
2NO + O2 = 2NO2
Азот реагирует с некоторыми простыми веществами:
N2+3H2= 2NH3
N2 + O2 = 2NO
3Mg + N2 = Mg3N2
Галогены
обычно проявляют окислительные свойства:
PH3 + 4Br2 + 4Н2О = Н3РО4 + 8НВг
2P + 5Cl2 = 2PCl5
2P + 3PCl5 = 5PCl3
PH3 + 4Br2 + 4H2O = H3PO4 + 8HBr
Cl2 + H2 = 2HCl
2HCl + F2 = 2HF + Cl2
2NH3 + 3Br2 = N2 + 6HBr
Галогены в растворах щелочей диспропорционируют при комнатной температуре:
Cl2 + 2KOH = KCl + H2O + KClO
и при нагревании:
Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
Окислительные свойства перманганата калия:
5Н3РО3 + 2КМnО4 + 3H2SO4 = K2SO4 + 2MnSO4 + 5Н3РО4 + ЗН2О
2NH3 + 2KMnO4 = N2 + 2MnO2 + 2KOH + 2H2O
Сера
реагирует с простыми веществами:
S + O2 = SO2
3S + 2А1 = A12S3
оксид серы (IV) может быть доокислен кислородом:
2SO2 + O2 = 2SO3
2SO2 + O2 + 2H2O = 2H2SO4
и выступать в роли окислителя:
SO2 + 2H2S = 3S + 2H2O
Концентрированная серная кислота проявляет окислительные свойства:
Cu + H2SO4 = CuSO4 + SO2 +2H2O
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
Фосфор
получение фосфора:
Са3(Р04)2 + 5С + 3SiO2 = 3CaSiO3 + 5СО + 2Р
Металлы
реагируют с галогенами:
2Fe + 3Cl2 = 2FeCl3
Алюминий без оксидной пленки растворяется в воде:
Al (без оксидной пленки) + Н2О = Al(OH)3 + 3/2 H2
методы получения металлов:
Fe2O3 + CO = 2FeO + CO2
FeO + CO = Fe + CO2
CuO + H2 = Cu + H2O
Гидроксид железа (II) может быть легко доокислен пероксидом водорода:
2Fe(OH)2 + H2O2 = 2Fe(OH)3
обжиг пирита:
2FeS2 + O2 = Fe2O3 + 4SO2
ОРГАНИЧЕСКАЯ ХИМИЯ
Горение органических веществ
2С10Н22 + 31O2 = 20CО2 + 22H2О
Алканы
Методы получения алканов из простых веществ:
С + 2H2 = CH4
сплавлением солей щелочных металлов с щелочами:
СН3СООК + КОН СН4 + К2СО3
Химические свойства алканов — промышленное окисление метана:
CH4 + O2 = CH2O + H2O
Взаимодействие алканов с галогенами:
С2Н6 + Сl2 С2Н5Сl + НСl
Изомеризация алканов:
Галогеналканы
Реакция со спиртовыми растворами щелочей:
С6Н5-СНВг-СН3 + КОН С6Н5СН=СН2 + КВг + Н2О
с водными растворами щелочей:
С6Н5-СНВг-СН3 + КОН (водн.) С6Н5-СНОН-СН3 + KBr
C6H5Br + KOH C6H5OH + KBr
По правилу Зайцева водород отщепляется от наименее гидрированного атома
Из дигалогеналканов можно получить алкины:
Реакция Вюрца:
Алкены
Присоединяют водород:
присоединяют галогены:
присоединяют галогенводороды:
присоединят воду:
СН2=СН2 + Н2О СН3СН2ОН
С водным раствором перманганата калия без нагревания образуют гликоли (двухатомные спирты)
ЗС6Н5СН=СН2 + 2КМnО4 + 4Н2О ЗС6Н5СН(ОН)-СН2ОН + MnO2 + 2KOH
Алкины
промышленный способ получения ацетилена
2СН4 С2Н2 + ЗН2
карбидный способ получения ацетилена:
CaC2 + 2H2O = Ca(OH)2 + C2H2
реакция Кучерова — альдегид можно получить только из ацетилена:
С2Н2 + Н2О СН3СНО
Реакция алкинов с концевой тройной связью с аммиачным раствором оксида серебра:
2CH3-CH2-CCH + Ag2O 2CH3-CH2-CCAg +H2O
использование полученных продуктов в органическом синтезе:
CH3-CH2-CCAg + C2H5Br CH3-CH2-CC-C2H5 + AgBr
Бензол и его производные
Получение бензола из алкенов:
из ацетилена:
3C2H2 C6H6
Нитрование бензола и его производных в присутствие серной кислоты
C6H6 + HNO3 C6H5-NO2 + H2O
карбоксильная группа является ориентантом второго рода
реакция бензола и его производных с галогенами:
C6H6 + Cl2 C6H5Cl + HCl
С6Н5С2Н5 + Вг2 С6Н5-СНВг-СН3 + НВг
галогеналканами:
C6H6 + С2Н5С1 C6H5C2H5 + НС1
алкенами:
C6H6 + CH2=CH-CH3 C6H5-CH(CH3)2
Окисление бензола перманганатом калия в присутствии серной кислоты при нагревании:
5C6H5-CH3 + 6KMnO4 + 9H2SO4 = 5C6H5-COOH + 3K2SO4 + 6MnSO4 + 14H2O
Спирты
Промышленный способ получения метанола:
CO + 2H2 = CH3OH
при нагревании с серной кислотой в зависимости от условий могут образовываться простые эфиры:
2С2Н5OH C2Н5ОС2Н5 + Н2О
или алкены:
2С2Н5OH CH2=CH2 + H2O
спирты реагируют с щелочными металлами:
С2Н5OH + Na C2H5ONa + ½ H2
с галогенводородами:
СН3СН2ОН + НСl CH3CH2Cl + H2O
с оксидом меди (II):
СН3СН2ОН + СuO CH3CHO + Cu + H2O
более сильная кислота вытесняет более слабые из их солей:
C2H5ONa + HCl C2H5OH + NaCl
при нагревании смеси спиртов с серной кислотой образуются несимметричные простые эфиры:
Альдегиды
Образуют с аммиачным раствором оксида серебра серебряное зеркало:
CH3CHO + Ag2O CH3COONH4 + 2Ag
реагируют со свежеосажденным гидроксидом меди (II):
CH3CHO + 2Cu(OH)2 CH3COOH + 2CuOH + H2O
могут быть восстановлены до спиртов:
CH3CHO + H2 CH3CH2OH
окисляются перманганатом калия:
ЗСН3СНО + 2КМnО4 2СН3СООК + СН3СООН + 2МnО2 + Н2О
Амины
можно получить восстановлением нитросоединений в присутствии катализатора:
C6H5-NO2 + 3H2 = C6H5-NH2 + 2H2O
реагируют с кислотами:
C6H5-NH2 + HC1 =[C6H5-NH3]C1