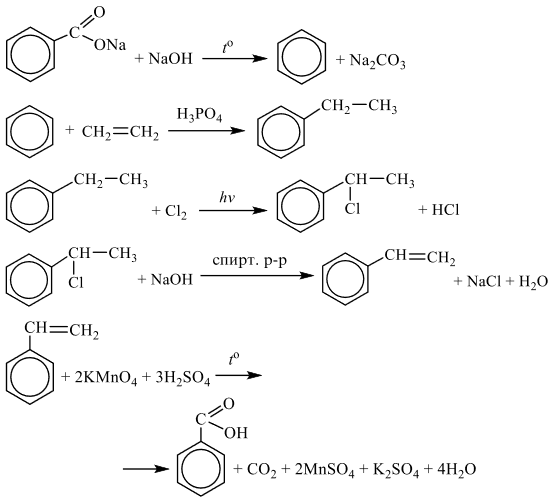
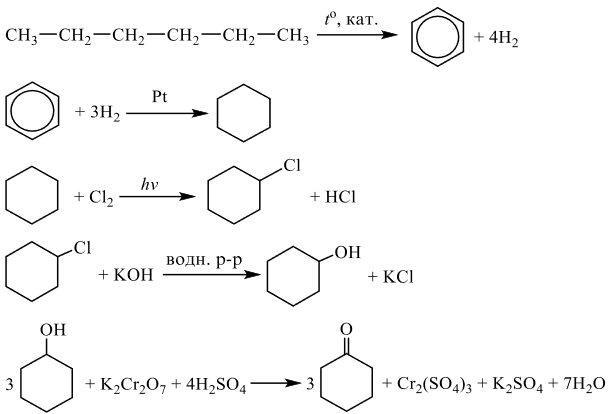
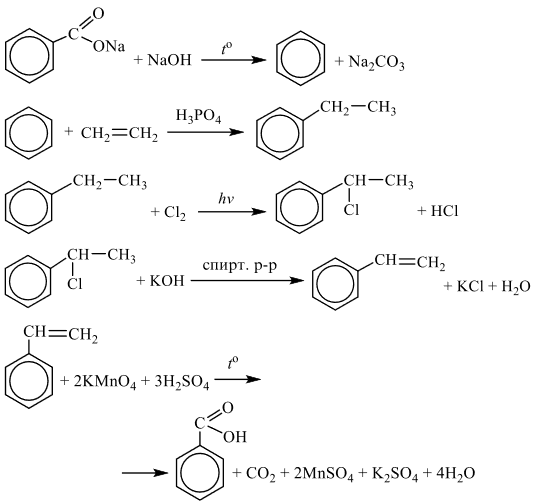
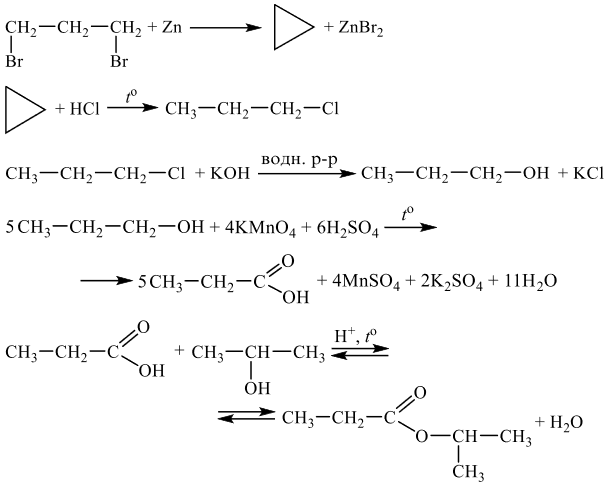
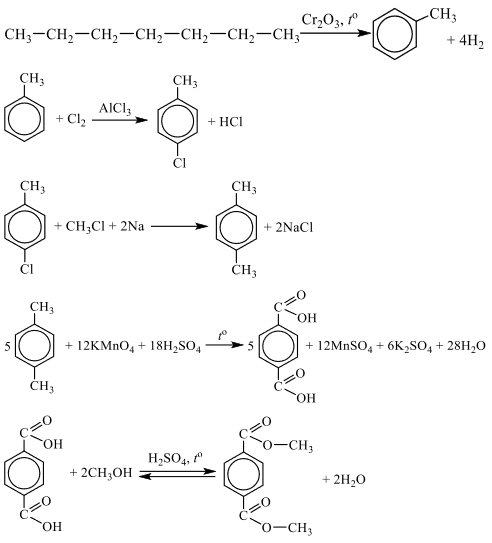
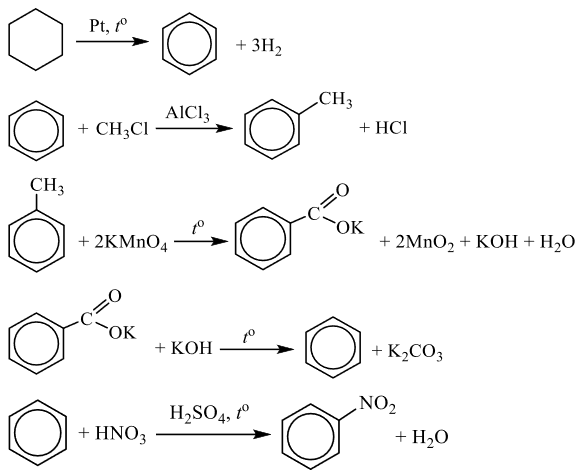
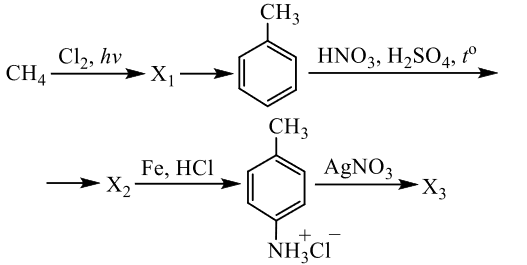
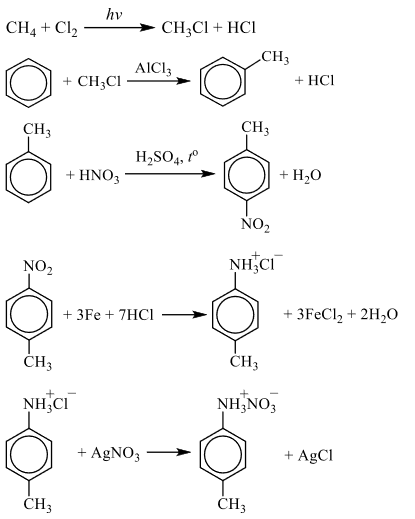
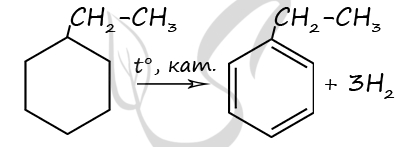
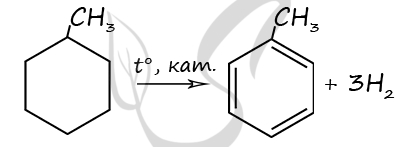
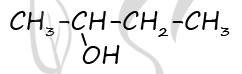
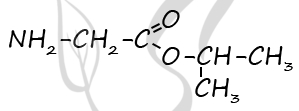
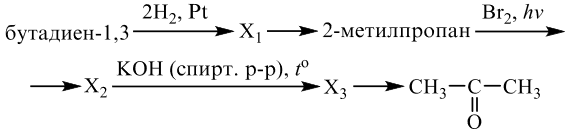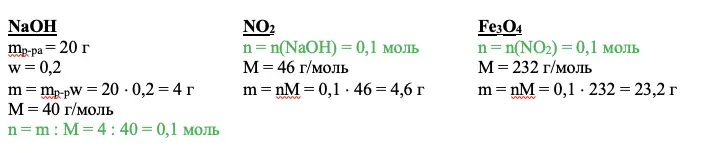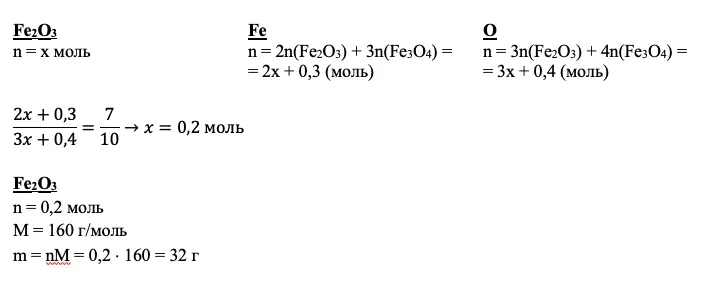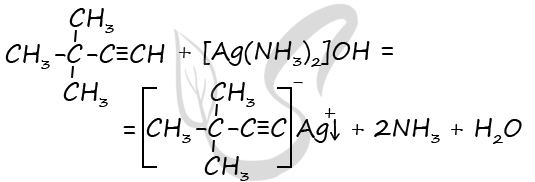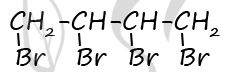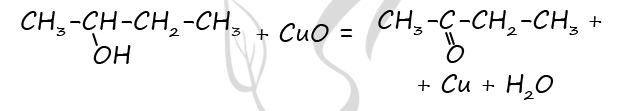Чтобы поделиться, нажимайте
Реальный ЕГЭ по химии 2020. Задание 33
Представляем вашему вниманию задание 33 из реального ЕГЭ 2020 (основная волна и резервные дни — 16 июля 2020 года, 24 июля 2020) с подробными текстовыми решениями и ответами.
Реальный ЕГЭ 2020. Задание 33. Вариант 1
Развернуть/свернуть решение
Реальный ЕГЭ 2020. Задание 33. Вариант 2
Развернуть/свернуть решение
Реальный ЕГЭ 2020. Задание 33. Вариант 3
Развернуть/свернуть решение
Реальный ЕГЭ 2020. Задание 33. Вариант 4
Развернуть/свернуть решение
Реальный ЕГЭ 2020. Задание 33. Вариант 5
Развернуть/свернуть решение
Реальный ЕГЭ 2020. Задание 33. Вариант 6
Развернуть/свернуть решение
Реальный ЕГЭ 2020. Задание 33. Вариант 7
Развернуть/свернуть решение
Реальный ЕГЭ 2020. Задание 33. Вариант 8
Развернуть/свернуть решение
Реальный ЕГЭ 2020. Задание 33. Вариант 9
Развернуть/свернуть решение
Реальный ЕГЭ 2020. Задание 33. Вариант 10
Развернуть/свернуть решение
Реальный ЕГЭ 2020. Задание 33. Вариант 11
Развернуть/свернуть решение
Реальный ЕГЭ 2020. Задание 33. Вариант 12
Развернуть/свернуть решение
Реальный ЕГЭ 2020. Задание 33. Вариант 13
Развернуть/свернуть решение
Реальный ЕГЭ 2020. Задание 33. Вариант 14
Развернуть/свернуть решение
Реальный ЕГЭ 2020. Задание 33. Вариант 15
Развернуть/свернуть решение
Реальный ЕГЭ 2020. Задание 33. Вариант 16
Развернуть/свернуть решение
Реальный ЕГЭ 2020. Задание 33. Вариант 17
Развернуть/свернуть решение
Реальный ЕГЭ 2020. Задание 33. Вариант 18
Развернуть/свернуть решение
Реальный ЕГЭ 2020. Задание 33. Вариант 19
Развернуть/свернуть решение
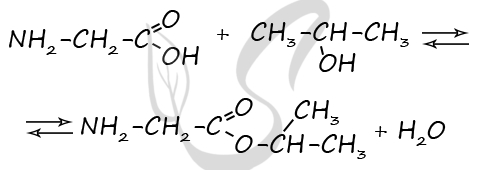
Реальный ЕГЭ 2020. Задание 33. Вариант 20 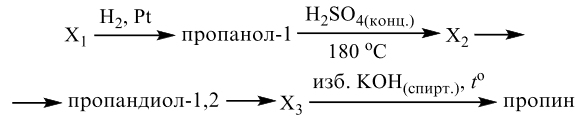
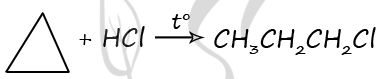
Реальный ЕГЭ 2020. Задание 33. Вариант 21 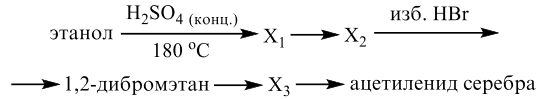
Реальный ЕГЭ 2020. Задание 33. Вариант 22 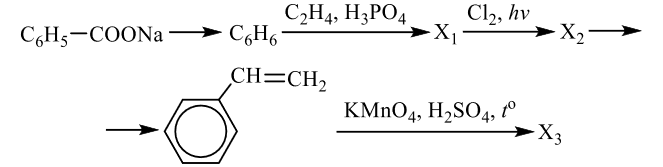
Реальный ЕГЭ 2020. Задание 33. Вариант 23 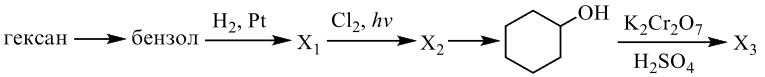
Реальный ЕГЭ 2020. Задание 33. Вариант 24 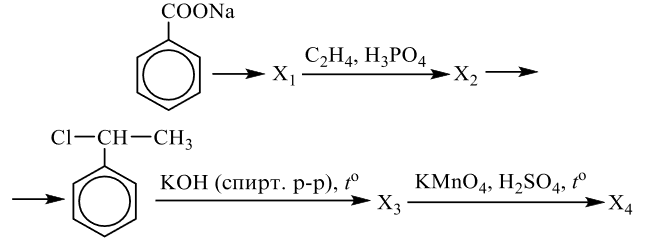
Реальный ЕГЭ 2020. Задание 33. Вариант 25 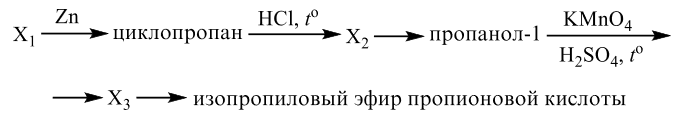
Резерв
Реальный ЕГЭ 2020 (резервные дни). Задание 33. Вариант 1
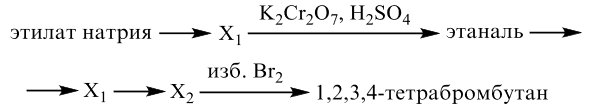
Реальный ЕГЭ 2020 (резервные дни). Задание 33. Вариант 2
Развернуть/свернуть решение
Реальный ЕГЭ 2020 (резервные дни). Задание 33. Вариант 3 
Реальный ЕГЭ 2020 (резервные дни). Задание 33. Вариант 4 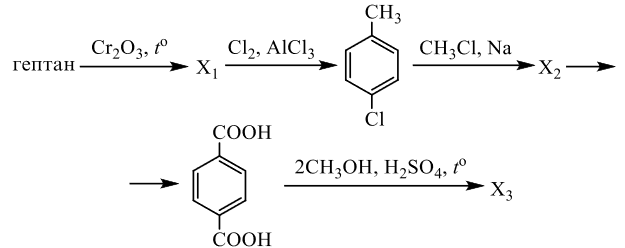
Реальный ЕГЭ 2020 (резервные дни). Задание 33. Вариант 5 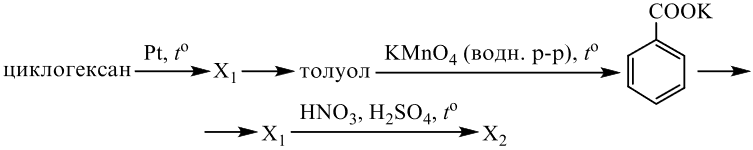
Реальный ЕГЭ 2020 (резервные дни). Задание 33. Вариант 6
Развернуть/свернуть решение
Реальный ЕГЭ 2020 (резервные дни). Задание 33. Вариант 7 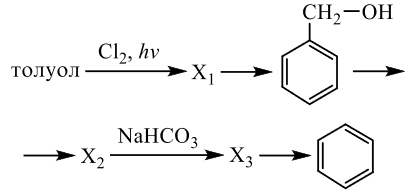
Реальный ЕГЭ 2020 (резервные дни). Задание 33. Вариант 8 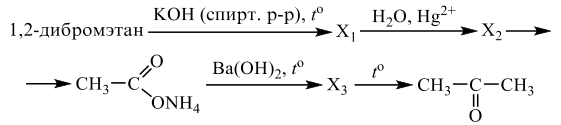
Реальный ЕГЭ 2020 (резервные дни). Задание 33. Вариант 9
Развернуть/свернуть решение
Реальный ЕГЭ 2020 (резервные дни). Задание 33. Вариант 10 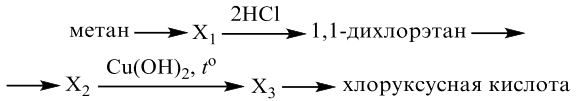
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку
Ни для кого не секрет, что задача 33 (она же бывшая задача 34) в ЕГЭ по химии — самое сложное задание, а судя по статистике (только 8,3% выпускников справляются с ним), она еще и практически невыполнимая. Поэтому значительное число выпускников даже не читают условие этой задачи. А зря. Если вы пришли на экзамен по химии, то уж точно сможете записать несколько уравнений, ведь так?
Задача 33 по химии: суть и критерии оценивания
Задание № 33 в ЕГЭ по химии — это расчетная задача высокого уровня сложности. Чтобы успешно решить ее, вам необходимо знать химические свойства веществ, уметь устанавливать логические связи между реакциями, применять расчетные формулы для нахождения количества вещества, массы и объема, массовой доли вещества в смеси.
Для получения максимально возможных 4 баллов за задачу 33 вам предстоит:
- записать все уравнения реакций, описанных в тексте (1 балл);
- рассчитать количества вещества всех известных и искомых веществ (1 балл);
- провести анализ и рассчитать искомые величины (1 балл);
- дать правильный ответ и безошибочно оформить решение (1 балл; снимается за отсутствие размерных величин — больше трех, также за математические ошибки)
Но слова в сторону, нам нужна успешная пошаговая стратегия: что делать, чтобы не получить за этот номер 0?
ЕГЭ по химии — в принципе достаточно сложный экзамен. Чтобы получить за него высокий балл, нужно хорошо постараться. Так, необходимо хорошо знать теорию и формулы, уметь выводить уравнения без ошибок, понимать, как правильно читать задания (в них могут быть ловушки!) и оформлять ответы по критериям. И все это — за ограниченный период времени.
Чтобы не стрессовать на экзамене и показать лучший результат, записывайтесь ко мне на курсы подготовки к ЕГЭ по химии. Мы изучим только то, что гарантированно пригодится вам на экзамене: ничего лишнего, только актуальные знания. А пробные экзамены, которые мы обязательно проводим, помогут понять, что ЕГЭ — совсем не такое страшное. Приходите к нам — за знаниями и спокойствием!
Пошаговый разбор реального задания 33
Уровень «Новичок»
Вы выбрали химию для поступления и готовилист к ЕГЭ минимум год. Вам абсолютно под силу записать уравнения реакций, описанных в тексте. Чаще всего здесь встречаются реакции обмена, замещения и разложения, ОВР, электролиз и совместный гидролиз. Правильно записанные реакции с расставленными коэффициентами дают 1 первичный балл за 33 задачу в ЕГЭ по химии.
ШАГ 1. Запишите все уравнения реакций, о которых идет речь в тексте
Если возможны вариации одной и той же реакции, рассмотрите их на черновике (например, получение средних/кислых солей, образование амфотерного гидроксида/ комплексной соли и т.п.). Какую реакцию оставить, вы поймете после получения первых результатов расчета.
Совет: повторите перед экзаменом тривиальные названия. Например, если вы не знаете, что такое «железная окалина», то ни записать реакцию, ни решить данную задачу не удастся 🙃
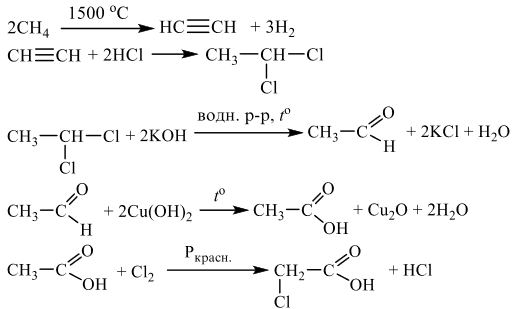
Смесь железной окалины и оксида железа III растворяют в азотной концентрированной кислоте. Запишем их по очереди. Железная окалина содержит железо в степени окисления +2, отсюда и протекание окислительно-восстановительной реакции: железо повышает степень окисления до +3, а азот изменяет свою степень окисления с +5 до +4. Вторая реакция представляет собой классическую реакцию обмена:
Fe3O4 + 10HNO3 = 3Fe(NO3)3 + NO2 + 5H2O
Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O
Образовавший газ (это NO2, полученный в первой реакции) взаимодействует с гидроксидом натрия:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
ИТОГО: +1 балл
С одним пунктом вы справились. Далее запишите «дано». Баллов за эту запись вам не добавят, но при этом вы сможете увидеть все известные величины и помнить, что необходимо найти.
Дано:
N(Fe) : N(O) = 7 : 10
mp-p(HNO3) = 500 г
mp-p(NaOH) = 20 г
w(NaOH) = 20%
Найти:
w(Fe(NO3)3) — ?
Уровень «Мастер»
Вы готовы сделать больше, чем записать уравнения реакции. Вы помните основные расчетные формулы и можете найти количество вещества по заданной массе и объему.
ШАГ 2. Используйте известные числовые значения, чтобы рассчитать количества вещества всех необходимых участников реакций
Переходим к действию. Нужно найти вещество, о котором мы все знаем. В приведенном примере это гидроксид натрия. Необходимо рассчитать количество вещества. Используем для этого основные расчетные формулы:
NaOH
mp-pa = 20 г
w = 0,2
m = mp-pw = 20 × 0,2 = 4 г
М = 40 г/моль
n = m : M = 4 : 40 = 0,1 моль
Задаем себе вопрос: что нам дает это значение? Каждый ответ должен вести к следующему действию. Так, мы можем рассчитать количество оксида азота IV – NO2, а благодаря ему получим количество вещества Fe3O4.
Совет: в задаче 33 по химии рассчитывайте сразу и количество вещества, и массу любого соединения, с которым работаете. Эти массы пригодятся при нахождении итогового раствора. А если не пригодятся, не переписывайте их в чистовик.
ИТОГО: +1 балл
Уровень «Гуру»
Вас не пугает уравнение с иксом в химии. Более того, вы можете его и составить, и решить.
ШАГ 3. Продумайте, как от найденных количеств вещества дойти по цепочке до искомого соединения
Что нужно найти дополнительно, чтобы получить ответ в задаче 33 по химии? Здесь может пригодиться работа с переменными, пропорции, соотношения и даже составление системы уравнений с двумя неизвестными.
Работаем!
Мы получили количества вещества нескольких соединений. Но так и не добрались до второй реакции и Fe2O3. Кроме того, мы не использовали соотношение атомов. Если вам ничего не дано для вещества по условию, а также вам не удалось подойти к нему через промежуточные расчеты, дело за уравнением. За х всегда принимайте количество неизвестного вещества.
Для нашего примера получим:
Совет: не пытайтесь принять за х все, что не получается рассчитать. Чаще всего задача 33 по химии решается без каких-либо переменных.
ИТОГО: +1 балл
Уровень «Профессионал»
Самое сложное уже позади. Теперь вам остается грамотно довести до конца. Обычно в завершении задачи требуется рассчитать массу полученного раствора и массовую долю вещества в нем. Чтобы не допустить ошибку на последнем этапе, помним, что в раствор входят все вещества, описанные в условии задачи, за исключением веществ, участвующих в реакциях сплавления, разложения и горения. Также обязательно нужно вычесть из этой массы потери. Потерями считаем осадки, газы, выпаренную воду, непрореагировавшие металлы и их оксиды.
ШАГ 4. Внимательно прочитайте вопрос задачи и рассчитайте искомую величину
Чаще всего необходимо вычислять массовую долю вещества в растворе. Предварительно вычислите массу полученного раствора с учетом всех потерь — осадков, газов и т.п.
В приведенном примере в раствор входит смесь железной окалины и оксида железа (III) и раствор азотной кислоты. Потеря — газообразное вещество NO2 (он же бурый газ).
mp-pa = m(Fe3O4) + m(Fe2O3) + mp-p(HNO3) – m(NO2) = 23,2 + 32 + 500 – 4,6 = 550,7 г
Зная количества вещества оксидов, вычислим количество вещества и массу искомой соли, а также ее массовую долю:
ИТОГО: +1 балл
Вот вы и решили 33 задачу в ЕГЭ по химии. Сложная ли она? Безусловно. Но можно ли с ней побороться? Да! Помните, что это задание, как и любое другое из второй части, оценивают согласно критериям. Не оставляйте его совсем без решения. Вы сможете остановиться на любом этапе и при этом принести в свою копилку больше, чем 0 баллов. А в пересчете на 100-балльную шкалу это будет уже весомо!
А если хотите научиться пошагово решать и другие задания из ЕГЭ по химии, записывайтесь ко мне на курсы подготовки к экзамену. Мы разберемся во всей теории, будем тренироваться в практических заданиях и научимся оформлять ответы в полном соответствии с критериями. Не теряйте возможность получить 80+ за ЕГЭ по химии — записывайтесь.
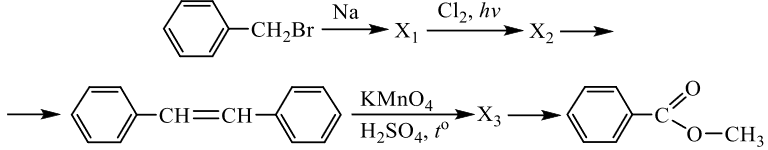
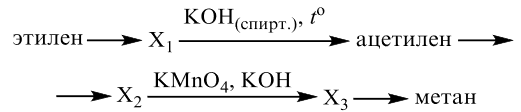
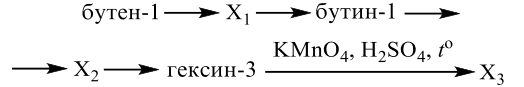
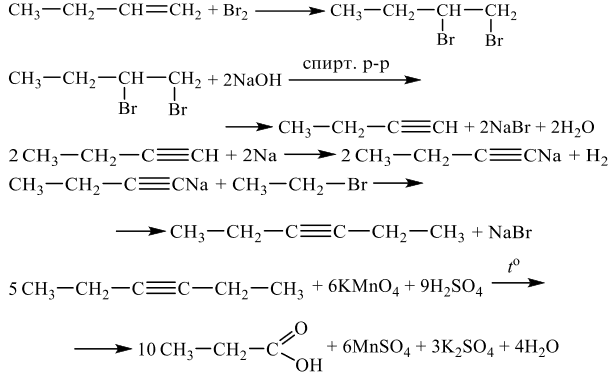
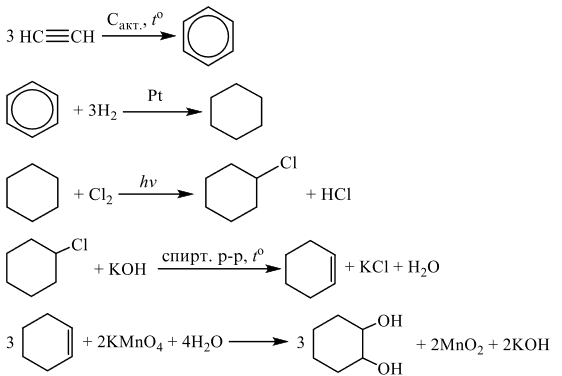
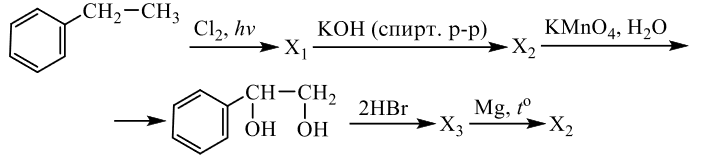
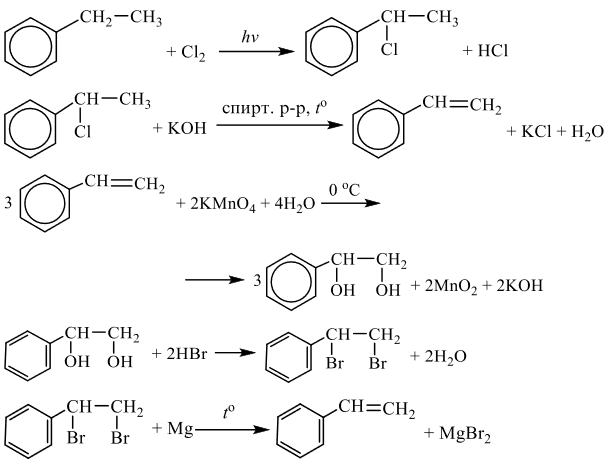
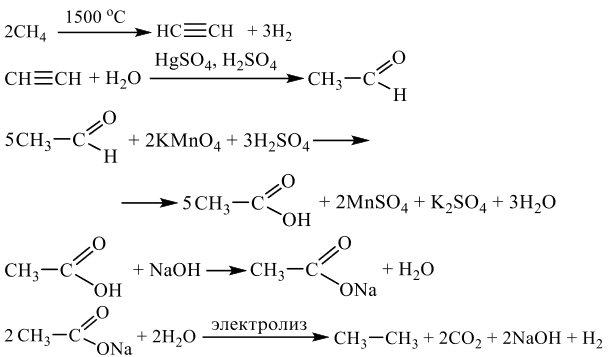
Задания 33 из реального ЕГЭ по химии-2020, все органические цепочки из реального экзамена ЕГЭ по химии, задания 33 из реального ЕГЭ 2020 (основная волна и резервные дни — 16 июля 2020 года, 24 июля 2020) с текстовыми решениями и ответами.
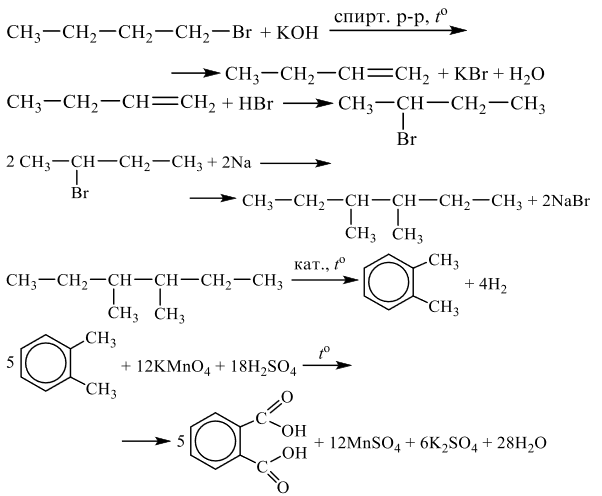
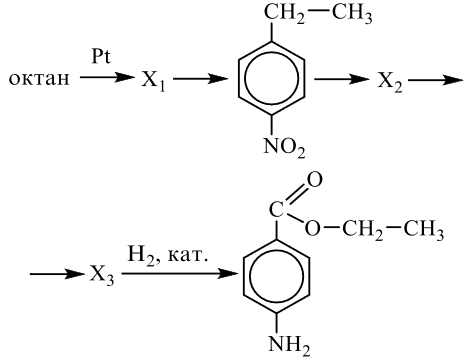
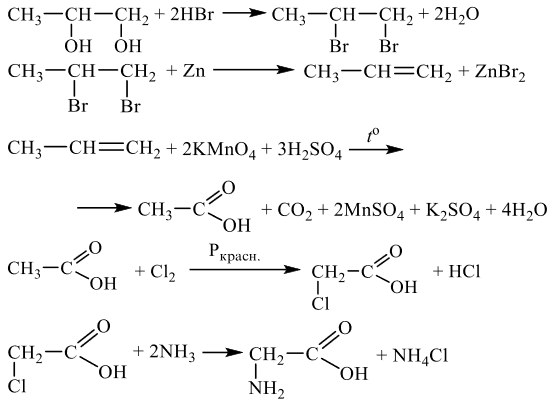
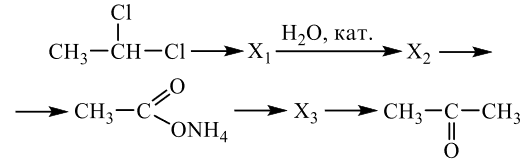
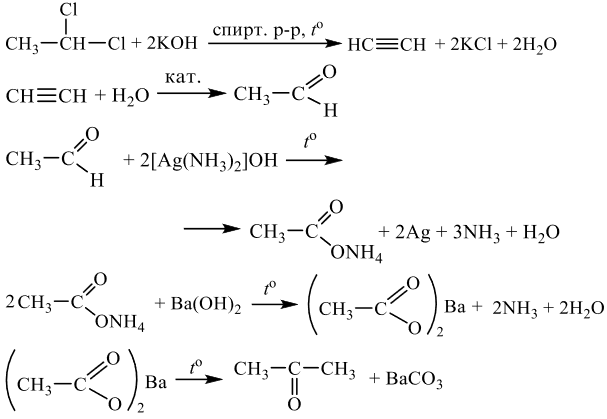
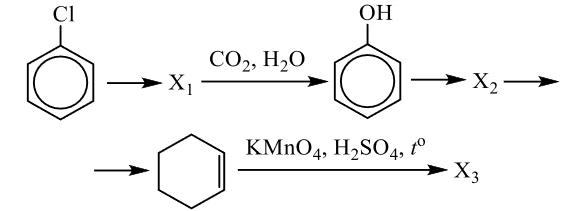
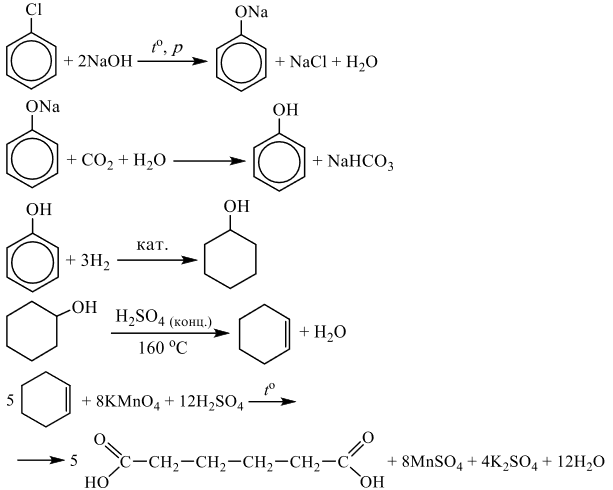
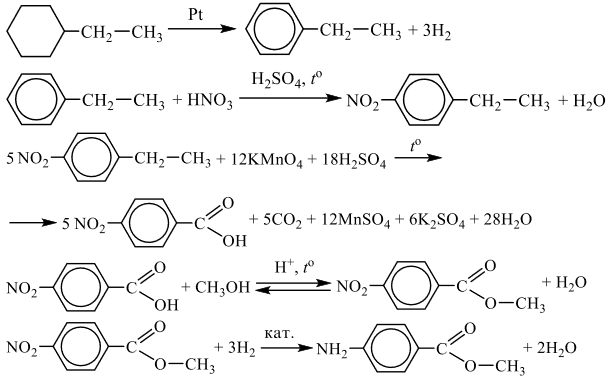
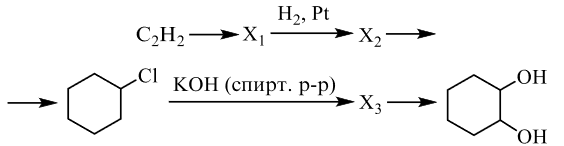
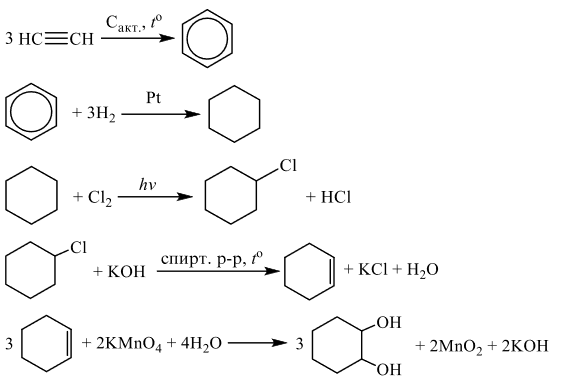
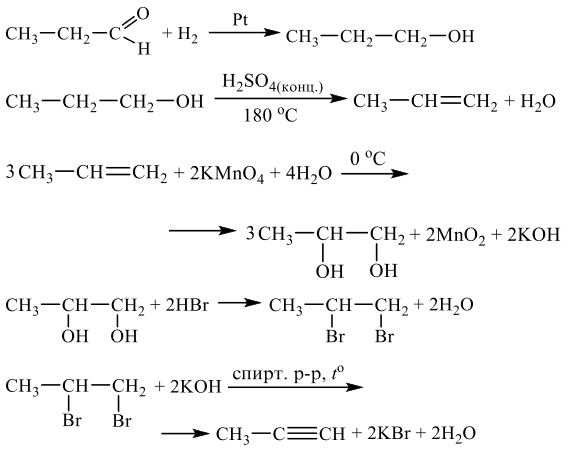
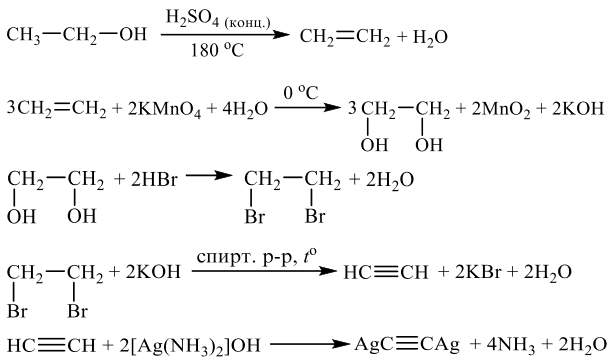
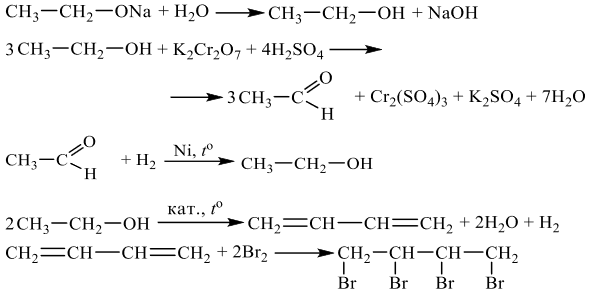
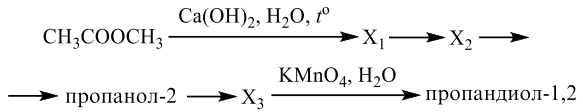
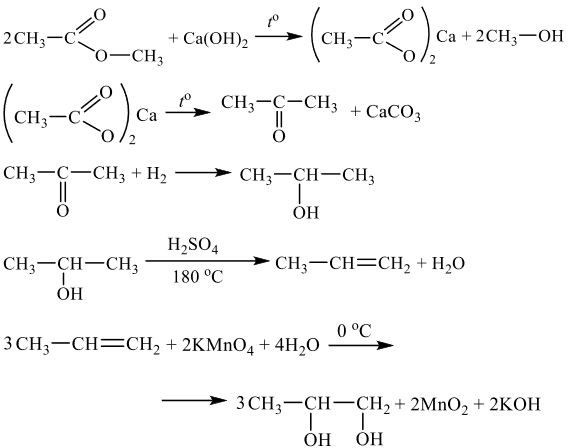
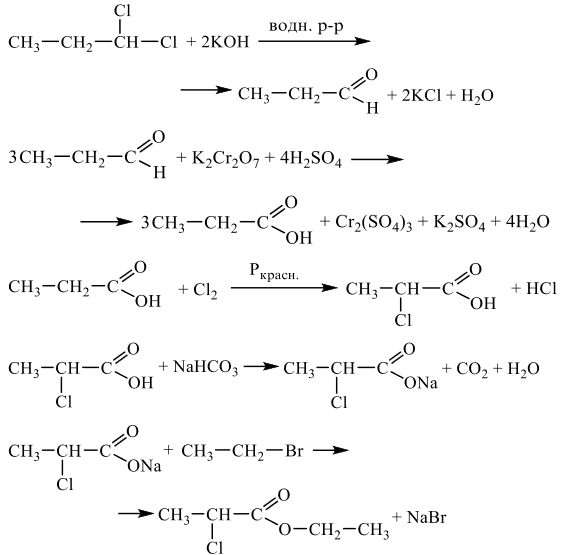
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Admin
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
-
Типы задач в задании 33.
-
Необходимые теоретические сведения.
-
Определение формул веществ по массовым долям атомов, входящих в его состав.
-
Определение формул веществ по продуктам сгорания.
-
Определение формул веществ по химическим свойствам.
-
Задачи для самостоятельного решения.
-
Часть 1. Определение формулы вещества по составу.
-
Часть 2. Определение формулы вещества по продуктам сгорания.
-
Часть 3. Определение формулы вещества по химическим свойствам.
-
Дополнение по определению структурной формулы:
-
Ответы и комментарии к задачам для самостоятельного решения.
Автор статьи — профессиональный репетитор О. В. Овчинникова.

- Некорректное оформление;
- Решение не математическим путем, а методом перебора;
- Неверно составленная общая формула вещества;
- Ошибки при написании требуемых уравнений реакций с участием найденного вещества.
к оглавлению ▴
Типы задач в задании 33.
- 1. Определение молекулярной формулы вещества по массовым долям химических элементов или по общей формуле вещества, а затем его структурной формулы по химическим свойствам;
- 2. Определение молекулярной формулы вещества по продуктам сгорания, а затем его структурной формулы по химическим свойствам.
Стоит отметить, что во всех подобных заданиях ЕГЭ требуется написать уравнение реакции, в котором принимает участие искомое вещество. Так что знание реакций тоже необходимо.
к оглавлению ▴
Необходимые теоретические сведения.
- Массовая доля элемента в веществе.
Массовая доля элемента — это его содержание в веществе в процентах по массе.
Например, в веществе составасодержится
атома углерода и
атома водорода. Если взять
молекулу такого вещества, то его молекулярная масса будет равна:
а.е.м. и там содержится
а.е.м. углерода.
Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
или
Если вещество имеет общую формулу
, то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества. Масса
атомов
равна
, масса
атомов
, масса
атомов кислорода
Тогда
Если записать эту формулу в общем виде, то получится следующее выражение:
Массовая доля атома Э в веществе = Атомная масса атома Э • число атомов Э в молекуле Аr(Э) • z —————— Mr(вещ.) Молекулярная масса вещества - Молекулярная и простейшая формула вещества.Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например,
— истинная формула бензола.
Простейшая (эмпирическая) формула — показывает соотношение атомов в веществе.
Например, для бензола соотношение, т.е. простейшая формула бензола —
.
Молекулярная формула может совпадать с простейшей или быть кратной ей.Примеры.
Вещество Молекулярная формула Соотношение атомов Простейшая формула Этанол Бутен Уксусная кислота Если в задаче даны только массовые доли элементов, то в процессе решения задачи можно вычислить только простейшую формулу вещества. Для получения истинной формулы в задаче обычно даются дополнительные данные — молярная масса, относительная или абсолютная плотность вещества или другие данные, с помощью которых можно определить молярную массу вещества.
- Относительная плотность газа
по газу
Относительная плотность
— это величина, которая показывает, во сколько раз газ
тяжелее газа
. Её рассчитывают как отношение молярных масс газов
и
:
Часто для расчетов используют относительные плотности газов по водороду и по воздуху.
Относительная плотность газа
по водороду:
Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за
г/моль (исходя из примерного усреднённого состава).
Поэтому: - Абсолютная плотность газа при нормальных условиях.Абсолютная плотность газа — это масса
л газа при нормальных условиях. Обычно для газов её измеряют в г/л.
Если взять
моль газа, то тогда:
,
а молярную массу газа можно найти, умножая плотность на молярный объём.
- Общие формулы веществ разных классов.
Часто для решения задач с химическими реакциями удобно пользоваться не обычной общей формулой, а формулой, в которой выделена отдельно кратная связь или функциональная группа.
Класс органических веществ Общая молекулярная формула Формула с выделенной кратной связью и функциональной группой Алканы — Алкены Алкины Диены — Гомологи бензола Предельные одноатомные спирты Многоатомные спирты Предельные альдегиды Кетоны Фенолы Предельные карбоновые кислоты Сложные эфиры Амины Аминокислоты (предельные одноосновные)
к оглавлению ▴
Определение формул веществ по массовым долям атомов, входящих в его состав.
Решение таких задач состоит из двух частей:
-
Пример 1.
Определить формулу вещества, если оно содержити
и имеет относительную плотность по воздуху, равную
.
Решение примера 1.
- Пусть масса вещества равна
г. Тогда масса
будет равна
г, а масса
г.
- Найдём количество вещества каждого атома:
моль,
моль.
- Определяем мольное соотношение атомов
и
:
(сократим оба числа на меньшее)
(домножим на
)
Таким образом, простейшая формула
. Однако вещества с такой формулой не существует. Для нахождения молекулярной формулы нам потребуется домножать простейшую формулу на небольшие числа: 2, 3 и т. п. Например при домножении эмпирической формулы на 2 мы получаем алкан, имеющий в своём составе 8 атомов углерода:
.
Чтобы проверить, правильна ли найденная нами формула, необходимо использовать дополнительные данные, которые всегда указаны в задаче. Это могут быть либо химические свойства вещества, либо информация, позволяющая вычислить его молярную массу. В данном случае дана относительная плотность соединения по воздуху. - По относительной плотности рассчитаем молярную массу:
г/моль.
Молярная масса, соответствующая простейшей формуле
г/моль, это в
раза меньше истинно молярной массы.
Значит, истинная формула
.
Есть гораздо более простой метод решения такой задачи, но, к сожалению, за него не поставят полный балл. Зато он подойдёт для проверки истинной формулы, т.е. с его помощью вы можете проверить своё решение.
Метод 2: Находим истинную молярную массу ( г/моль), а затем находим массы атомов углерода и водорода в этом веществе по их массовым долям.
т.е. число атомов
т.е число атомов
Формула вещества .
-
Пример 2.
Определить формулу алкина с плотностьюг/л при нормальных условиях.
Решение примера 2.
Общая формула алкина
Как, имея плотность газообразного алкина, найти его молярную массу? Плотность — это масса
литра газа при нормальных условиях.
Так как моль вещества занимает объём
л, то необходимо узнать, сколько весят
л такого газа:
плотность
молярный объём
г/л
л/моль =
г/моль.
Далее, составим уравнение, связывающее молярную массу и :
Значит, алкин имеет формулу
-
Пример 3.
Определить формулу предельного альдегида, если известно, чтомолекул этого альдегида весят
г.
Решение примера 3.
В этой задаче дано число молекул и соответствующая масса. Исходя из этих данных, нам необходимо вновь найти величину молярной массы вещества.
Для этого нужно вспомнить, какое число молекул содержится в моль вещества.
Это число Авогадро: (молекул).
Значит, можно найти количество вещества альдегида:
моль,
и молярную массу:
г/моль.
Далее, как в предыдущем примере, составляем уравнение и находим .
Общая формула предельного альдегида , то есть
.
-
Пример 4.
Определить формулу дихлоралкана, содержащегоуглерода.
Решение примера 4.
Общая формула дихлоралкана: , там
атома хлора и
атомов углерода.
Тогда массовая доля углерода равна:
число атомов
в молекуле
атомная масса
молекулярная масса дихлоралкана
вещество — дихлорпропан.
к оглавлению ▴
Определение формул веществ по продуктам сгорания.
В задачах на сгорание количества веществ элементов, входящих в исследуемое вещество, определяют по объёмам и массам продуктов сгорания — углекислого газа, воды, азота и других. Остальное решение — такое же, как и в первом типе задач.
-
Пример 5.
мл (н. у.) газообразного предельного нециклического углеводорода сожгли, и продукты реакции пропустили через избыток известковой воды, при этом образовалось
г осадка. Какой углеводород был взят?
Решение примера 5.
- Общая формула газообразного предельного нециклического углеводорода (алкана) —
Тогда схема реакции сгорания выглядит так:
Нетрудно заметить, что при сгорании
моль алкана выделится
моль углекислого газа.
Количество вещества алкана находим по его объёму (не забудьте перевести миллилитры в литры!):
моль.
- При пропускании углекислого газа через известковую воду
выпадает осадок карбоната кальция:
Масса осадка карбоната кальция —
г, молярная масса карбоната кальция
г/моль.
Значит, его количество вещества
моль.
Количество вещества углекислого газа тоже
моль.
- Количество углекислого газа в
раза больше чем алкана, значит формула алкана
.
-
Пример 6.
Относительная плотность паров органического соединения по азоту равна. При сжигании
г этого соединения образуется
л углекислого газа (н. у) и
г воды. Выведите молекулярную формулу органического соединения.
Решение примера 6.
Так как вещество при сгорании превращается в углекислый газ и воду, значит, оно состоит из атомов и, возможно,
. Поэтому его общую формулу можно записать как
.
- Схему реакции сгорания мы можем записать (без расстановки коэффициентов):
Весь углерод из исходного вещества переходит в углекислый газ, а весь водород — в воду.
- Находим количества веществ
и
, и определяем, сколько моль атомов
и
в них содержится:
моль.
На одну молекулу
приходится один атом
, значит, углерода столько же моль, сколько
.
моль
моль.
В одной молекуле воды содержатся два атома
, значит количество водорода в два раза больше, чем воды.
моль.
- Проверяем наличие в веществе кислорода. Для этого из массы всего исходного вещества надо вычесть массы
и
.
г,
г
Масса всего вещества
г.
, т.е.в данном веществе нет атомов кислорода.
Если бы кислород в данном веществе присутствовал, то по его массе можно было бы найти количество вещества и рассчитывать простейшую формулу, исходя из наличия трёх разных атомов.
- Дальнейшие действия вам уже знакомы: поиск простейшей и истинной формул.
Простейшая формула
.
- Истинную молярную массу ищем по относительной плотности газа по азоту (не забудьте, что азот состоит из двухатомных молекул
и его молярная масса
г/моль):
г/моль.
Истиная формула
, её молярная масса
.
Истинная формула
.
-
Пример 7.
Определите молекулярную формулу вещества, при сгоранииг которого образовалось
г
г воды и азот. Относительная плотность этого вещества по водороду —
. Определить молекулярную формулу вещества.
Решение примера 7.
- Вещество содержит атомы
и
. Так как масса азота в продуктах сгорания не дана, её надо будет рассчитывать, исходя из массы всего органического вещества.
Схема реакции горения: - Находим количества веществ
и
, и определяем, сколько моль атомов
и
в них содержится:
- Находим массу азота в исходном веществе.
Для этого из массы всего исходного вещества надо вычесть массы
и
.
г,
г
Масса всего вещества
г.
г ,
моль.
Простейшая формула —
Истинная молярная масса
г/моль.
Она совпадает с молярной массой, рассчитанной для простейшей формулы. То есть это и есть истинная формула вещества.
-
Пример 8.
Вещества содержити
. При сгорании
г его выделилось
г
г
, а сера была полностью переведена в сульфат бария, масса которого оказалась равна
г. Определить формулу вещества.
Решение примера 8.
Формулу заданного вещества можно представить как При его сжигании получается углекислый газ, вода и сернистый газ, который затем превращают в сульфат бария. Соответственно, вся сера из исходного вещества превращена в сульфат бария.
- Находим количества веществ углекислого газа, воды и сульфата бария и соответствующих химических элементов из исследуемого вещества:
моль.
моль.
моль.
моль.
моль.
моль.
- Рассчитываем предполагаемую массу кислорода в исходном веществе:
- Находим мольное соотношение элементов в веществе:
Формула вещества
Надо отметить, что таким образом мы получили только простейшую формулу.
Однако, полученная формула является истинной, поскольку при попытке удвоения этой формулы
получается, что на 4 атома углерода, помимо серы и кислорода, приходится 12 атомов Н, а это невозможно.
к оглавлению ▴
Определение формул веществ по химическим свойствам.
-
Пример 9.
Определить формулу алкадиена, если г его могут обесцветитьг
-го раствора брома.
Решение примера 9.
- Общая формула алкадиенов —
.
Запишем уравнение реакции присоединения брома к алкадиену, не забывая, что в молекуле диена две двойные связи и, соответственно, в реакцию с
моль диена вступят
моль брома:
- Так как в задаче даны масса и процентная концентрация раствора брома, прореагировавшего с диеном, можно рассчитать количества вещества прореагировавшего брома:
г
моль.
- Так как количество брома, вступившего в реакцию, в
раза больше, чем алкадиена, можно найти количество диена и (так как известна его масса) его молярную массу:
г/моль.
- Находим формулу алкадиена по его общей формул, выражая молярную массу через
:
Это пентадиен
.
-
Пример 10.
При взаимодействииг предельного одноатомного спирта с металлическим натрием выделился водород в количестве, достаточном для гидрирования
мл пропена (н. у.). Что это за спирт?
Решение примера 10.
- Формула предельного одноатомного спирта —
Здесь удобно записывать спирт в такой форме, в которой легко составить уравнение реакции — т.е. с выделенной отдельно группой
.
- Составим уравнения реакций (нельзя забывать о необходимости уравнивать реакции):
- Можно найти количество пропена, а по нему — количество водорода. Зная количество водорода, по реакции находим количество вещества спирта:
- Находим молярную массу спирта и
:
Спирт — бутанол
.
-
Пример 11.
Определить формулу сложного эфира, при гидролизег которого выделяется
г спирта и
г одноосновной карбоновой кислоты.
Решение примера 11.
- Общую формулу сложного эфира, состоящего из спирта и кислоты с разным числом атомов углерода можно представить в таком виде:
Соответственно, спирт будет иметь формулу
,
а кислота
.
Уравнение гидролиза сложного эфира:
- Согласно закону сохранения массы веществ, сумма масс исходных веществ и сумма масс продуктов реакции равны.
Поэтому из данных задачи можно найти массу воды:
= (масса кислоты) + (масса спирта) − (масса эфира) =
г
моль
Соответственно, количества веществ кислоты и спирта тоже равны моль.
Можно найти их молярные массы:
г/моль,
г/моль.
Получим два уравнения, из которых найдём
и
:
— уксусная кислота
— этанол.
Таким образом, искомый эфир — это этиловый эфир уксусной кислоты, этилацетат.
-
Пример 12.
Определить формулу аминокислоты, если при действии наг её избытком гидроксида натрия можно получить
г натриевой соли этой кислоты.
Решение примера 12.
- Общая формула аминокислоты (если считать, что она не содержит никаких других функциональных групп, кроме одной аминогруппы и одной карбоксильной):
.
Можно было бы записать её разными способами, но для удобства написания уравнения реакции лучше выделять в формуле аминокислоты функциональные группы отдельно.
- Можно составить уравнение реакции этой аминокислоты с гидроксидом натрия:
Количества вещества аминокислоты и её натриевой соли — равны. При этом мы не можем найти массу какого-либо из веществ в уравнении реакции. Поэтому в таких задачах надо выразить количества веществ аминокислоты и её соли через молярные массы и приравнять их:
Легко увидеть, что
.
Можно это сделать математически, если принять, что
.
.
Это аланин — аминопропановая кислота.
Однако на данном этапе решение задачи не заканчивается. В ней требуется установить и структурную формулу вещества. Вот пример подобного задания:
При сгорании 5,8 г органического вещества образуется 6,72 л углекислого газа и 5,4 г воды. Плотность паров этого вещества по воздуху равна 2.
Установлено, что это вещество не взаимодействует с аммиачным раствором оксида серебра, но каталитически восстанавливается водородом с образованием вторичного спирта и способно окисляться подкисленным раствором перманганата калия до карбоновой кислоты и углекислого газа. На основании этих данных:
1) установите простейшую формулу исходного вещества,
2) составьте его структурную формулу,
3) приведите уравнение реакции его взаимодействия с водородом.
(источник: Типовые тестовые задания по химии, под редакцией Ю. Н. Медведева. 2015 г.)
В первой части задачи в результате вычислений мы находим молекулярную формулу соединения: C3H6O. Затем начинаем путём логических размышлений находить структурную формулу. Общая формула CnH2nO характерна для альдегидов и кетонов, так же возможно предположить спирт: пропен-2-ол-1 (напомним: соединение с гидроксильной группы у атома углерода, образующего двойную связь является неустойчивым). Во-первых, данное вещество не подвергается окислению аммиачным раствором оксида серебра, значит, это не альдегид. Во-вторых, данное вещество каталитически восстанавливается водородом с образованием вторичного спирта, а значит, это не спирт. Единственный оставшийся вариант – кетон, а именно – ацетон. Подтверждает это и возможность окисления соединения кислым перманганатом калия до углекислого газа и карбоновой кислоты. Написание уравнения реакции уже не должно вызвать затруднений.
к оглавлению ▴
Задачи для самостоятельного решения.
Часть 1. Определение формулы вещества по составу.
1–1. Плотность углеводорода при нормальных условиях равна г/л. Массовая доля углерода в нем равна
. Выведите молекулярную формулу этого углеводорода.
1–2. Массовая доля углерода в диамине равна , массовая доля азота равна
. Выведите молекулярную формулу диамина.
1–3. Относительная плотность паров предельной двухосновной карбоновой кислоты по воздуху равна . Выведите молекулярную формулу карбоновой кислоты.
1–4. л алкадиена при н.у. имеет массу, равную
г. Выведите молекулярную формулу алкадиена.
1–5. (ЕГЭ–2011) Установите формулу предельной одноосновной карбоновой кислоты, кальциевая соль которой содержит кальция.
к оглавлению ▴
Часть 2. Определение формулы вещества по продуктам сгорания.
2–1. Относительная плотность паров органического соединения по сернистому газу равна . При сжигании
г этого вещества образуется
г углекислого газа (н.у.) и
г воды. Выведите молекулярную формулу органического соединения.
2–2. При сжигании органического вещества массой г в избытке кислорода получили
г азота,
л (н.у.)
и
г воды. Определите молекулярную формулу вещества, зная, что в указанной навеске вещества содержится
молекул.
2–3. Углекислый газ, полученный при сгорании г углеводорода, пропустили через избыток раствора гидроксида кальция и получили
г осадка. Выведите простейшую формулу углеводорода.
2–4. При сгорании органического вещества, содержащего и хлор, выделилось
л (н.у.) углекислого газа,
г воды,
г хлороводорода. Установите молекулярную формулу сгоревшего вещества.
2–5. (ЕГЭ–2011) При сгорании амина выделилось л (н.у.) углекислого газа,
г воды и
л азота. Определить молекулярную формулу этого амина.
к оглавлению ▴
Часть 3. Определение формулы вещества по химическим свойствам.
3–1. Определить формулу алкена, если известно, что он г его при присоединении воды образуют
г спирта.
3–2. Для окисления г предельного альдегида до кислоты потребовалось
г гидроксида меди (II). Определить формулу альдегида.
3–3. Одноосновная моноаминокислота массой г с избытком бромоводорода образует
г соли. Определить формулу аминокислоты.
3–4. При взаимодействии предельного двухатомного спирта массой г с избытком калия выделилось
л водорода. Определить формулу спирта.
3–5. (ЕГЭ–2011) При окислении предельного одноатомного спирта оксидом меди (II) получили г альдегида,
г меди и воду. Определить молекулярную формулу этого спирта.
к оглавлению ▴
Дополнение по определению структурной формулы:
Д-1. Дана молекулярная формула: C2H6O. Искомое вещество газообразно при н. у., не реагирует с металлическим натрием и может быть получено дегидратацией спирта. Установите его структурную формулу.
Д-2. Дана молекулярная формула: C3H8O2. Искомое вещество реагирует с натрием, а при дегидратации под действием серной кислоты превращается в соединение, содержащее шестичленный цикл. Установите его структурную формулу.
Д-3. Дана молекулярная формула: C2H7NO. Искомое вещество представляет собой бесцветную, вязкую жидкость с запахом аммиака. Оно реагирует и с натрием, и с азотистой кислотой, причём в обоих случаях выделяется газ. Установите его структурную формулу.
к оглавлению ▴
Ответы и комментарии к задачам для самостоятельного решения.
1–1.
1–2.
1–3.
1–4.
1–5. — формиат кальция, соль муравьиной кислоты
2–1.
2–2.
2–3. (массу водорода находим, вычитая из массы углеводорода массу углерода)
2–4. (не забудьте, что атомы водорода содержатся не только в воде, но и в
)
2–5.
3–1.
3–2.
3–3.
3–4.
3–5.
Д–1.
Д–2.
Д–3.
Спасибо за то, что пользуйтесь нашими публикациями.
Информация на странице «Задача 33 на ЕГЭ по химии. Определение формул органических веществ.» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из разделов нашего сайта.
Публикация обновлена:
08.03.2023
7936. При сгорании 4,6 г органического вещества образуется 8,8 г углекислого газа и 5,4 г воды. Известно, что указанное вещество газообразно при н. у., не реагирует с металлическим натрием и может быть получено дегидратацией спирта.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения исходного вещества в результате реакции дегидратации (используйте структурные формулы органических веществ).

1) Вычислим количество вещества продуктов
n(CO2) = 8,8 : 44 = 0,2 моль
n(C) = n(CO2) = 0,2 моль
m(C) = 0,2 ⋅ 12 = 2,4 г
n(H2O) = 5,4 : 18 = 0,3 моль
n(H) = 2n(H2O) = 0,3 ⋅ 2 = 0,6 моль
m(H) = 0,6 ⋅ 1 = 0,6 г
m(O) = m(в-ва) -m(C) — m(H) = 4,6 — 2,4 — 0,6 = 1,6 г
n(O) = 1,6 : 16 = 0,1 моль
Соотношение n(C) : n(H) : n(O)
x : y : z = 0,2 : 0,6 : 0,1 = 2 : 6 : 1
Простейшая формула C2H6O
2) Структурная формула
CH3-O-CH3
3) Уравнение реакции (для реакции межмолекулярной дегидратации температура должна быть менее 140 °С, например 130 °С)
2CH3-OH = (130 °С, H2SO4) CH3-O-CH3 + H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7936.
7901. При сгорании 21 г органического вещества получили 33,6 л углекислого газа (н. у.) и 27 г воды. Известно, что масса 1 л (н.у.) паров этого вещества составляет 1,875 г. В результате присоединения хлороводорода к этому веществу образуется только одно монохлорпроизводное, в котором атом хлора принадлежит первичному атому углерода.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции исходного вещества с хлороводородом (используйте структурные формулы органических веществ).

1) Вычислим количество вещества продуктов
n(CO2) = 33,6 : 22,4 = 1,5 моль; n(C) = 1,5 моль
m(C) = 1,5 ⋅ 12 = 18 г
n(H2O) = 27/18 = 1,5 моль; n(H) = 2n(H2O) = 1,5 ⋅ 2 = 3 моль; m(H) = 3 ⋅ 1 = 3 г
m(O) = m(в-ва) — m(C) — m(H) = 21 — 18 — 3 = 0 г (кислород отсутствует)
Искомое вещество — углеводород — CxHy
Соотношение атомов n(C) : n(H) = x : y = 1,5 : 3 = 1 : 2
Простейшая формула — CH2
M(в-ва)прост. = 14 г/моль
M(в-ва)по условию = 1,875 ⋅ 22,4 = 42 г/моль
Молекулярная формула C3H6 — циклопропан или пропен. Только одно монохлорпроизводное, в котором атом хлора принадлежит к первичному атому углерода, образуется в результате присоединения хлороводорода к циклопропану (в результате реакции с пропеном получается 2-хлорпропан, атом хлора здесь принадлежит вторичному атому углероду, поэтому пропен нам не подходит)
2) Структурная формула
3) Уравнение реакции
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7901.
7866. Дегидрирование органического вещества приводит к образованию ароматического углеводорода, 0,7 моль которого имеют массу 74,2 г. Известно, что количество вещества водорода, выделившегося при дегидрировании исходного вещества, в 3 раза превышает количество вещества исходного углеводорода. Исходный углеводород не обесцвечивает бромную воду и раствор перманганата калия. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества; 2) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение реакции дегидрирования исходного вещества (используйте структурные формулы органических веществ).

1) Молярная масса углеводорода
M(CnH2n-6) = 74,2 / 0,7 = 106
M(CnH2n-6) = 12n + 2n — 6 = 106
14n = 112
n = 8
Молекулярная формула исходного вещества — C8H10
2) Структурная формула
3) Уравнение реакции
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7866.
7831. Дегидрирование органического вещества приводит к образованию ароматического углеводорода, 0,3 моль которого имеют массу 27,6 г. Известно, что количество вещества водорода, выделившегося при дегидрировании исходного вещества, в 3 раза превышает количество вещества исходного углеводорода. Исходный углеводород не обесцвечивает бромную воду и раствор перманганата калия.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
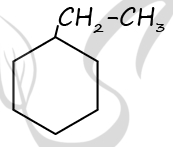
3) напишите уравнение реакции дегидрирования исходного вещества (используйте структурные формулы органических веществ).

1) Молярная масса углеводорода
M(CnH2n-6) = 27,6 : 0,3 = 92 г/моль
Установлена молекулярная формула ароматического углеводорода:
M(CnH2n-6) = 12n + 2n — 6 = 92
14n = 98
n = 7
Молекулярная формула — C7H8
2) Структурная формула метилциклогексана
3) Уравнение реакции
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7831.
7796. Некоторый углеводород содержит 87,81 % углерода по массе, Известно, что молекула этого углеводорода содержит один четвертичный атом углерода. Установлено, что этот углеводород может взаимодействовать с аммиачным раствором оксида серебра с образованием осадка.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции этого вещества с аммиачным раствором оксида серебра (используйте структурные формулы органических веществ).

1) Вычислим массовую долю водорода в веществе, и соотношение атомов углерода и водорода
ω(H) = 100 — 87,81 = 12,19
x : y = (87,81 / 12) : (12,19 / 1) = 0,6 : 1
Молекулярная формула — C6H10
2) Структурная формула вещества
3) Уравнение реакции
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7796.
7761. При сжигании образца органического вещества А получено 4,48 л (н. у.) углекислого газа, 0,9 г воды и 16,2 г бромоводорода. Данное вещество А может быть получено присоединением избытка брома к соответствующему углеводороду Б. Также известно, что при бромировании этого углеводорода Б в условиях недостатка брома возможно образование структурных изомеров.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте возможную структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения данного вещества А взаимодействием соответствующего углеводорода Б с избытком брома (используйте структурные формулы органических веществ).

1) Общая формула вещества — CxHyBrz
Вычислим количества вещества углекислого газа, воды и бромоводорода
n(CO2) = 4,48 : 22,4 = 0,2 моль; n(C) = n(CO2) = 0,2 моль
n(H2O) = 0,9 : 18 = 0,05 моль;
n(HBr) = 16,2 : 81 = 0,2 моль;
n(H) = 2n(H2O) + n(HBr) = 0,05 ⋅ 2 + 0,2 = 0,3 моль
n(Br) = n(HBr) = 0,2 моль
Соотношение: n(C) : n(H) : n(Br) = 0,2 : 0,3 : 0,2 = 2 : 3 : 2 = 4 : 6 : 4
x : y : z = 4 : 6 : 4
Молекулярная формула — C4H6Br4
2) Структурная формула вещества A:
3) Уравнение реакции
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7761.
7726. При сжигании образца некоторого органического соединения массой 29,6 г получено 70,4 г углекислого газа и 36,0 г воды. Известно, что относительная плотность паров этого вещества по воздуху равна 2,552. В ходе исследования химических свойств этого вещества установлено, что при его взаимодействии с оксидом меди(II) образуется кетон.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции этого вещества с оксидом меди(II) (используйте структурные формулы органических веществ).

1) Общая формула вещества — CxHyOz
Вычислим количество вещества продуктов
n(CO2) = 70,4 : 44 = 1,6 моль
n(C) = n(CO2) = 1,6 моль
n(H2O) = 36,0 : 18 = 2 моль
n(H) = 2n(H2O) = 2 ⋅ 2 = 4 моль
m(H) = 4 ⋅ 1 = 4 г
m(O) = 29,6 — 1,6 ⋅ 12 — 4 = 6,4 г
n(O) = 6,4 : 16 = 0,4 моль
Определена молекулярная масса вещества
M(CxHyOz)по услов. = 2,552 ⋅ 29 = 74 г/моль
x : y : z = 1,6 : 4 : 0,4 = 4 : 10 : 1
Вычисленная формула — C4H10O
M(CxHyOz)вычисл = 74 г/моль
Молекулярная формула исх. в-ва — C4H10O
2) Структурная формула вещества
3) Уравнение реакции
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7726.
7691. При взаимодействии соли первичного амина с ацетатом серебра образуется органическое вещество А и бромид серебра. Вещество А содержит 13,33% азота, 10,48% водорода и 30,48% кислорода по массе.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества А;
2) составьте возможную структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А взаимодействием соли первичного амина и ацетата серебра (используйте структурные формулы органических веществ).

1) Общая формула вещества — CxHyOzNm
Вычислим массовую долю углерода
ω(C) = 100 — 13,33 — 10,48 — 30,48 = 45,71%
x : y : z : m = 45,71/12 : 10,48/1 : 30,48/16 : 13,33/14
Соотношение атомов С, H, O и N
x : y : z : m = 3,81 : 10,48 : 1,91 : 0,95 = 4 : 11 : 2 : 1
Молекулярная формула — C4H11O2N
2) Структурная формула
CH3COO[NH3CH2CH3]
3) Уравнение реакции
CH3COOAg + Br[NH3CH2CH3] = CH3COO[NH3CH2CH3] + AgBr
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7691.
7656. Органическое вещество А содержит 11,97% азота, 9,40% водорода и 27,35% кислорода по массе и образуется при взаимодействии органического вещества Б с пропанолом-2 в молярном соотношении 1:1. Известно, что вещество Б имеет природное происхождение и способно взаимодействовать как с кислотами, так и со щелочами.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А из вещества Б и пропанола-2 (используйте структурные формулы органических веществ).

1) Общая формула — CxHyOzNm
Вычислим массовую долю углерода
ω(C) = 100 — 9,4 — 27,35 — 11,97 = 51,28%
x : y : z : m = (51,28 / 12) : (9,4 / 1) : (27,35 / 16) : (11,97 / 14)
Соотношение атомов: x : y : z : m = 5 : 11: 2 : 1
Молекулярная формула — C5H11O2N
2) Структурная функция
3) Уравнение реакции
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7656.
7621. При сгорании 10,5 г органического вещества получили 16,8 л углекислого газа (н.у.) и 13,5 г воды. Плотность паров этого вещества (н.у.) составляет 1,875 г/л. Известно, что в результате присоединения хлороводорода к этому веществу образуется только одно монохлорпроизводное.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции исходного вещества с хлороводородом (используйте структурные формулы органических веществ).

1) Найдем количество вещества продуктов сгорания
n(CO2) = 16,8 : 22,4 = 0,75 моль
n(C) = 0,75 моль
m(C) = 0,75 ⋅ 12 = 9 г
n(H2O) = 13,5 : 18 = 0,75 моль
n(H) = 0,75 ⋅ 2 = 1,5 моль
m(H) = 1,5 ⋅ 1 = 1,5 г
m(O) = m(в-ва) — (m(C) + m(H)) = 10,5 — (9 + 1,5) = 0 г (кислород отсутствует)
Соотношение атомов углерода и водорода:
x : y = 0,75 : 1,5 = 3 : 6
Молекулярная формула — C3H6
M(C3H6) = 42 г/моль
M(в-ва)по усл. = 1,875 ⋅ 22,4 = 42 г/моль
Молекулярная формула — C3H6
Циклопропан образует лишь одно производное в реакции с хлороводородом
2) Структурная формула вещества
3) Уравнение реакции
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7621.
Для вас приятно генерировать тесты, создавайте их почаще
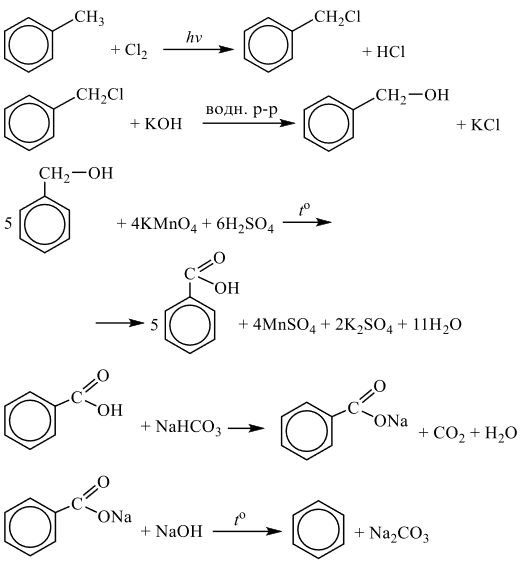
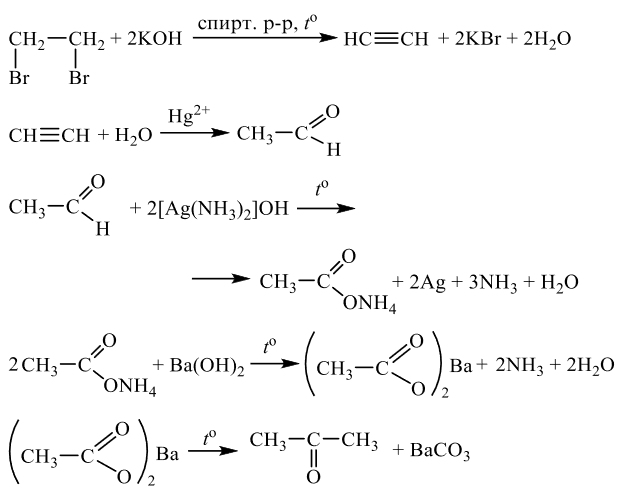
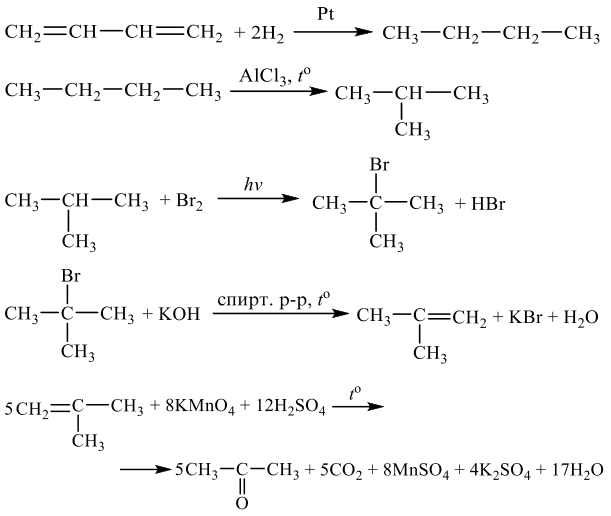
Задания 33 (2021). Реакции, подтверждающие взаимосвязь органических соединений.
Задание №1
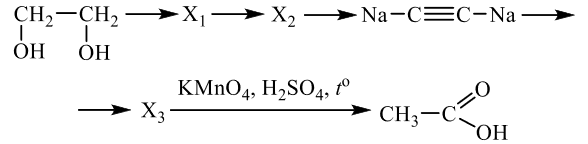
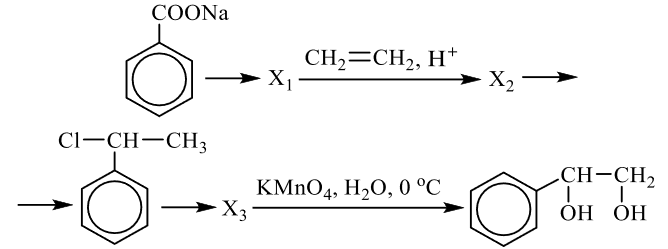
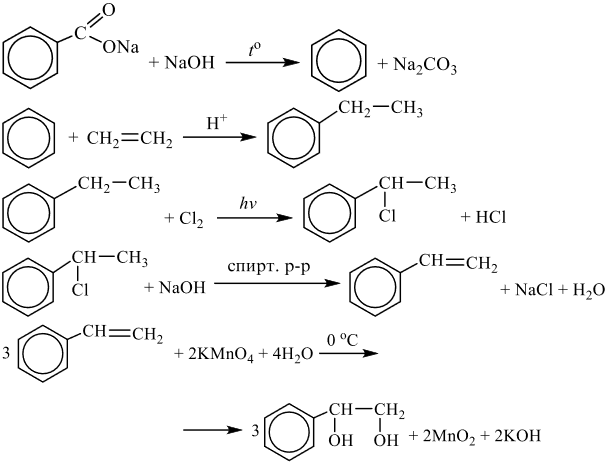
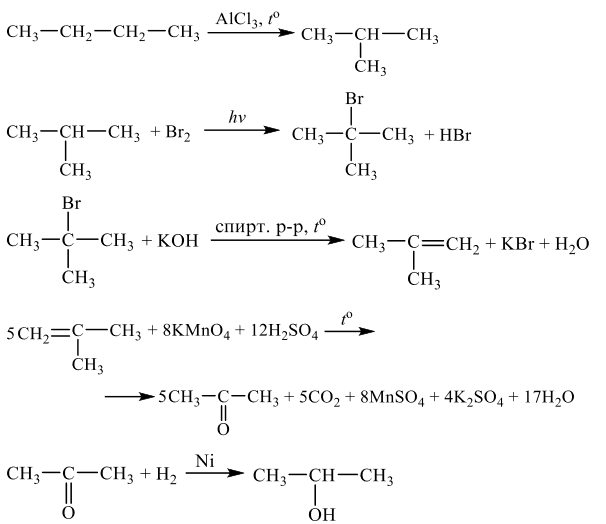
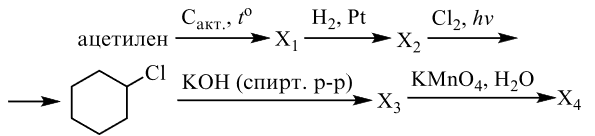
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
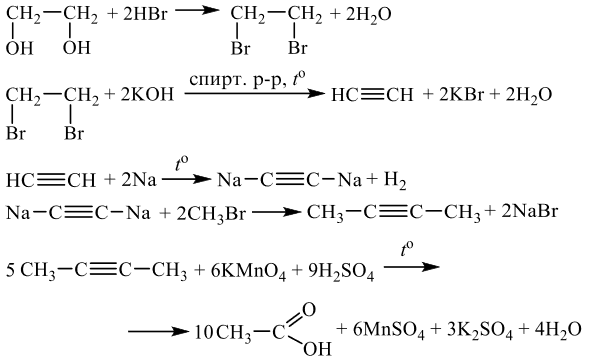
Решение
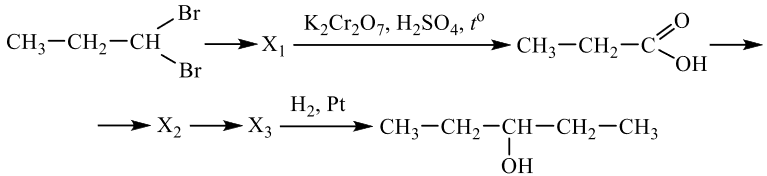
Задание №2
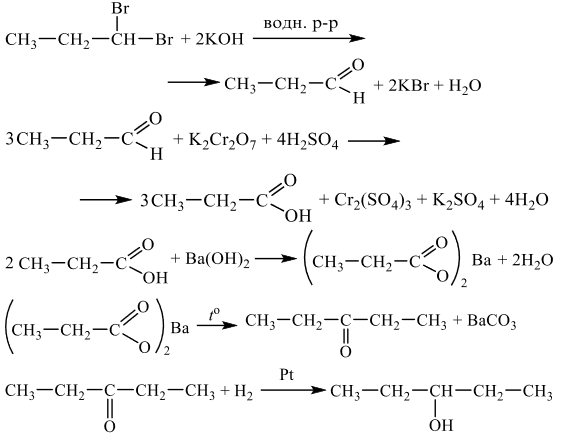
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Задание №3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Задание №4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Задание №5
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
[adsp-pro-3]
Задание №6
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Задание №7
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Задание №8
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Задание №9
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Задание №10
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
[adsp-pro-3]
Задание №11
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Задание №12
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Задание №13
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Задание №14
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Задание №15
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
[adsp-pro-3]
Задание №16
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Задание №17
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Задание №18
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Задание №19
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Задание №20
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
[adsp-pro-3]
Задание №21
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Задание №22
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Задание №23
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Задание №24
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Задание №25
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Задание №26
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Задание №27
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
Задание №28
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение
[adsp-pro-10]
22 июня 2022
В закладки
Обсудить
Жалоба
Подборка задач 33 и 34 с прошедшего ЕГЭ 2022 по химии.
→ 33 с ответами и уравнениями описанных реакций: 33.pdf
→ 34 c ответами: 34.pdf
Источник: vk.com/examtop