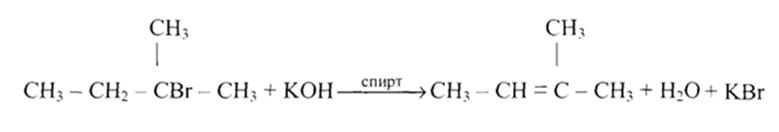
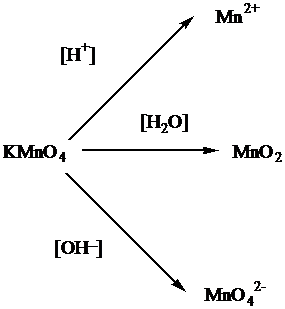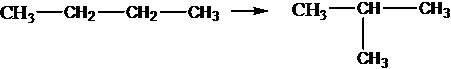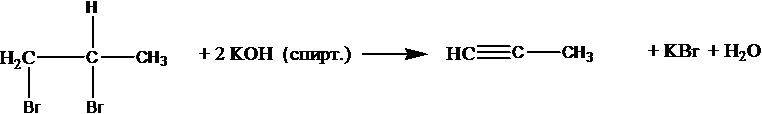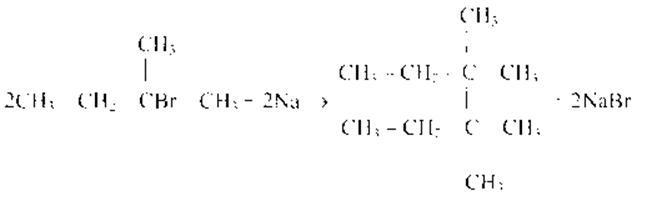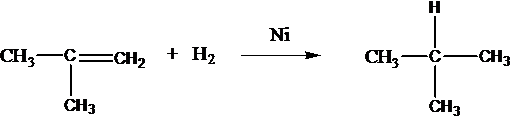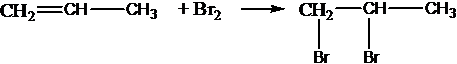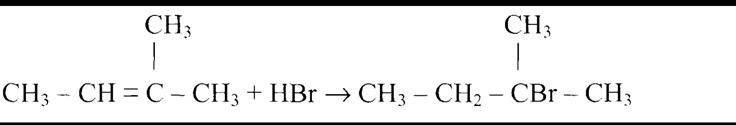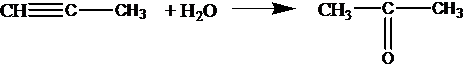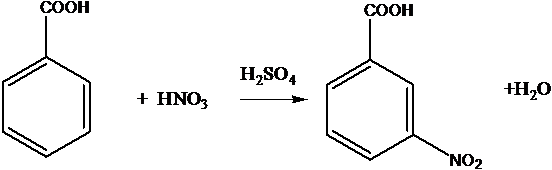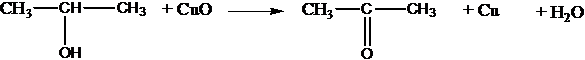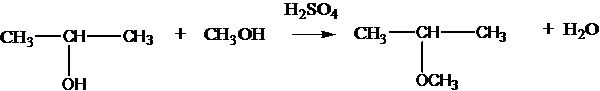Чтобы поделиться, нажимайте
Реальный ЕГЭ по химии
Вашему вниманию представлены задания реального ЕГЭ (их видео-объяснения, решения и ответы), которые представлялись в разных регионах и в разные годы. Также на этой странице вы найдёте задания и видео-объяснения из досрочных ЕГЭ, демо ЕГЭ всех лет, начиная с первого ЕГЭ 2002 года. А ещё тренировочные и пробные варианты ЕГЭ от разных авторов, и, конечно, всю литературу для подготовки к ЕГЭ.
В общем, на этой странице есть ВСЁ для вашей подготовки к ЕГЭ. Листайте до конца!
Варианты с видео-объяснением:
- Возможные варианты задания 33 в ЕГЭ 2022
- Возможные варианты задания 34 в ЕГЭ 2022
- Реальный ЕГЭ по химии 2021. Задание 34 (в ЕГЭ 2022 будет заданием 33)
- Открытый вариант ЕГЭ по химии 2021 от ФИПИ (досрочная волна)
- Реальный ЕГЭ по химии 2020. Задание 34 (в ЕГЭ 2022 будет заданием 33)
- Реальный ЕГЭ по химии 2020. Задание 35 (в ЕГЭ 2022 будет заданием 34)
- Новинка ЕГЭ 2020: задачи на «атомистику»
- Досрочный ЕГЭ 2020. Вариант 1
- Досрочный ЕГЭ 2020. Вариант 2
- Демо 2020. Часть 1 и Демо 2020. Часть 2
- Задачи ЕГЭ 2020
- Реальный ЕГЭ 2019 (основная волна, 31 мая 2019 года)
- Задания из резервных дней ЕГЭ 2019 (20 июня 2019 года и 1 июля 2019 года)
- Досрочный ЕГЭ 2019 (досрочная волна, 25 марта 2019 года)
- Досрочный ЕГЭ 2019 (текстовые условия ФИПИ, вариант 101)
- Демо 2019. Часть 1 и Демо 2019. Часть 2
- Реальный ЕГЭ 2018 (Задание 30, Задание 31, Задание 32, Задание 33, Задание 34, Задание 35)
- Досрочный ЕГЭ 2018 (Часть 1, Часть 2, Текстовые услововия досрочного ЕГЭ по химии)
- Реальный ЕГЭ 2017
- Досрочный ЕГЭ 2017 (Часть 1-1, Часть 1-2 и Часть 2)
Варианты без видео-объяснения:
- Задания по темам (по номерам заданий)
- Задачи 33 реального ЕГЭ по химии всех лет (бывшее задание 34)
- Задачи 34 реального ЕГЭ по химии всех лет (бывшее задание 35)
2022
- ЕГЭ 2022, Демонстрационный вариант
- ЕГЭ 2022, Кодификатор
- ЕГЭ 2022, Спецификация
- Рекомендации от ФИПИ (анализ ошибок ЕГЭ 2021)
Материалы из группы ЕГЭ на 100 баллов
- Тренировочный вариант №1
- Тренировочный вариант №2
- Тренировочный вариант №3
- Тренировочный вариант №4
- Тренировочный вариант №5
- Тренировочный вариант №6
- Тренировочный вариант №7
Материалы из группы в контакте ЕГЭ-2022 с Химическим Котом ★ Степенин и Дацук
- Вариант 1 ЕГЭ-2022 химия с ответами
- Вариант 2 ЕГЭ-2022 химия с ответами
- Вариант 3 ЕГЭ-2022 химия с ответами
- Вариант 4 ЕГЭ-2022 химия с ответами
- Вариант 5 ЕГЭ-2022 химия с ответами
- Вариант 6 ЕГЭ-2022 химия с ответами
- Вариант 7 ЕГЭ-2022 химия с ответами
- Вариант 8 ЕГЭ-2022 химия с ответами
Материалы из группы в контакте Широкопояс. Химия ЕГЭ. Вебинары.
- Тренировочный КИМ №1
- Тренировочный КИМ №2
- Тренировочный КИМ №3
- Тренировочный КИМ №4
- Тренировочный КИМ №5
- Тренировочный КИМ №6
- Тренировочный КИМ №7
- Тренировочный КИМ №8
- Тренировочный КИМ №9
- Тренировочный КИМ №10
- Тренировочный КИМ №31
- Тренировочный КИМ №32
- Тренировочный КИМ №33
- Тренировочный КИМ №34
2021
- Реальный вариант ЕГЭ по химии 2021. Центр
- Реальный вариант ЕГЭ по химии 2021. Сибирь
- Реальный вариант ЕГЭ по химии 2021. Урал
- Реальный ЕГЭ по химии 2021. Задание 34
- Открытый вариант ЕГЭ по химии 2021 от ФИПИ (досрочная волна)
- ЕГЭ 2021, Демонстрационный вариант
- ЕГЭ 2021, Кодификатор
- ЕГЭ 2021, Спецификация
Новые варианты пробных вариантов выходят в начале каждого месяца.
- Пробный ЕГЭ по химии 2021. Вариант 1
- Пробный ЕГЭ по химии 2021. Вариант 2
- Пробный ЕГЭ по химии 2021. Вариант 3
- Пробный ЕГЭ по химии 2021. Вариант 4
- Пробный ЕГЭ по химии 2021. Вариант 5
- Пробный ЕГЭ по химии 2021. Вариант 6
- Пробный ЕГЭ по химии 2021. Вариант 7
- Пробный ЕГЭ по химии 2021. Вариант 8
- Пробный ЕГЭ по химии 2021. Вариант 9
- Пробный ЕГЭ по химии 2021. Вариант 10
Материалы из группы ЕГЭ ПО ХИМИИ НА МАКСИМУМ
- Тренировочный вариант №1
- Тренировочный вариант №2
- Тренировочный вариант №3
- Тренировочный вариант №4
- Тренировочный вариант №5
- Тренировочный вариант №6
- Тренировочный вариант №7
- Тренировочный вариант №8
- Тренировочный вариант №9
- Тренировочный вариант №10
- Тренировочный вариант №11
- Тренировочный вариант №12
- Тренировочный вариант №13
- Тренировочный вариант №14
- Тренировочный вариант №15
- Тренировочный вариант №16
- Тренировочный вариант №17
- Тренировочный вариант №18
- Тренировочный вариант №19
Материалы из группы в контакте Химия: ЕГЭ, олимпиады и школьный курс
- Вариант 1 ЕГЭ-2021 химия с ответами
- Вариант 2 ЕГЭ-2021 химия с ответами
- Вариант 3 ЕГЭ-2021 химия с ответами
- Вариант 4 ЕГЭ-2021 химия с ответами
- Вариант 5 ЕГЭ-2021 химия с ответами
- Вариант 6 ЕГЭ-2021 химия с ответами
- Вариант 7 ЕГЭ-2021 химия с ответами
- Вариант 8 ЕГЭ-2021 химия с ответами
- Вариант 9 ЕГЭ-2021 химия с ответами
- Вариант 10 ЕГЭ-2021 химия с ответами
- Вариант 11 ЕГЭ-2021 химия с ответами
- Вариант 12 ЕГЭ-2021 химия с ответами
- Вариант 13 ЕГЭ-2021 химия с ответами
- Вариант 14 ЕГЭ-2021 химия с ответами
- Вариант 15 ЕГЭ-2021 химия с ответами
- Вариант 16 ЕГЭ-2021 химия с ответами
- Вариант 17 ЕГЭ-2021 химия с ответами
- Вариант 18 ЕГЭ-2021 химия с ответами
- Вариант 19 ЕГЭ-2021 химия с ответами
- Вариант 20 ЕГЭ-2021 химия с ответами
- Вариант 21 ЕГЭ-2021 химия с ответами
- Вариант 22 ЕГЭ-2021 химия с ответами
Материалы из группы в контакте
- Тренировочный КИМ №23
- Тренировочный КИМ №24
- Тренировочный КИМ №25
- Тренировочный КИМ №26
- Тренировочный КИМ №27
- Тренировочный КИМ №28
- Тренировочный КИМ №29
- Тренировочный КИМ №30
Материалы из группы в контакте ХИМИЯ | ЕГЭ 2021 | ВЕБИУМ
- Пробный вариант 1
2020
- ЕГЭ 2020, Демонстрационный вариант
- ЕГЭ 2020, Кодификатор
- ЕГЭ 2020, Спецификация
- Новинка ЕГЭ 2020: задачи на «атомистику»
Новые варианты пробных вариантов выходят в начале каждого месяца.
- Пробный ЕГЭ по химии 2020. Вариант 1
- Пробный ЕГЭ по химии 2020. Вариант 2
- Пробный ЕГЭ по химии 2020. Вариант 3
- Пробный ЕГЭ по химии 2020. Вариант 4
- Пробный ЕГЭ по химии 2020. Вариант 5
- Пробный ЕГЭ по химии 2020. Вариант 6
- Пробный ЕГЭ по химии 2020. Вариант 7
- Пробный ЕГЭ по химии 2020. Вариант 8
- Пробный ЕГЭ по химии 2020. Вариант 9
- Пробный ЕГЭ по химии 2020. Вариант 10
Материалы из группы ЕГЭ ПО ХИМИИ НА МАКСИМУМ
- Тренировочный вариант №1
- Тренировочный вариант №2
- Тренировочный вариант №3
- Тренировочный вариант №4
- Тренировочный вариант №5
- Тренировочный вариант №6
- Тренировочный вариант №7
- Тренировочный вариант №8
- Тренировочный вариант №9
- Тренировочный вариант №10
- Тренировочный вариант №11
- Тренировочный вариант №12
- Тренировочный вариант №13
- Тренировочный вариант №14
- Тренировочный вариант №15
- Тренировочный вариант №16
- Тренировочный вариант №17
- Тренировочный вариант №18
- Тренировочный вариант №19
- Тренировочный вариант №20
- Тренировочный вариант №21
- Тренировочный вариант №22
- Тренировочный вариант №23
- Тренировочный вариант №24
- Тренировочный вариант №25
- Тренировочный вариант №26
Материалы из группы в контакте Химия: ЕГЭ, олимпиады и школьный курс
- Вариант 1 ЕГЭ-2020 химия с ответами
- Вариант 2 ЕГЭ-2020 химия с ответами
- Вариант 3 ЕГЭ-2020 химия с ответами
- Вариант 4 ЕГЭ-2020 химия с ответами
- Вариант 5 ЕГЭ-2020 химия с ответами
- Вариант 6 ЕГЭ-2020 химия с ответами
- Вариант 7 ЕГЭ-2020 химия с ответами
- Вариант 8 ЕГЭ-2020 химия с ответами
- Вариант 9 ЕГЭ-2020 химия с ответами
- Вариант 10 ЕГЭ-2020 химия с ответами
- Вариант 11 ЕГЭ-2020 химия с ответами
- Вариант 12 ЕГЭ-2020 химия с ответами
- Вариант 13 ЕГЭ-2020 химия с ответами
- Вариант 14 ЕГЭ-2020 химия с ответами
- Вариант 15 ЕГЭ-2020 химия с ответами
- Вариант 16 ЕГЭ-2020 химия с ответами
- Вариант 17 ЕГЭ-2020 химия с ответами
- Вариант 18 ЕГЭ-2020 химия с ответами
- Вариант 19 ЕГЭ-2020 химия с ответами
- Вариант 20 ЕГЭ-2020 химия с ответами
Материалы из группы в контакте Химия ЕГЭ. Вебинары. ДВИ МГУ. Наука для тебя.
- Тренировочный КИМ №1
- Тренировочный КИМ №2
- Тренировочный КИМ №3
- Тренировочный КИМ №4
- Тренировочный КИМ №5
- Тренировочный КИМ №6
- Тренировочный КИМ №7
- Тренировочный КИМ №8
- Тренировочный КИМ №9
- Тренировочный КИМ №10
- Тренировочный КИМ №11
- Тренировочный КИМ №12
- Тренировочный КИМ №13
- Тренировочный КИМ №14
- Тренировочный КИМ №15
- Тренировочный КИМ №16
- Тренировочный КИМ №17
- Тренировочный КИМ №18
- Тренировочный КИМ №19
- Тренировочный КИМ №20
- Тренировочный КИМ №21
- Тренировочный КИМ №22
- Тренировочный КИМ №24
- Тренировочный КИМ №25
Материалы из группы в контакте ХИМИЯ | ЕГЭ 2020 | ВЕБИУМ
- Пробный вариант 1
- Пробный вариант 2
- Пробный вариант 3
- Пробный вариант 4
- Пробный вариант 5
- Пробный вариант 6
- Пробный вариант 7
- Пробный вариант 8
- Пробный вариант 9
- Пробный вариант 10
- Пробный вариант 11
- Пробный вариант 12
- Пробный вариант 13
- Пробный вариант 14
- Пробный вариант 15
- Пробный вариант 16
- Пробный вариант 17
- Пробный вариант 18
- Пробный вариант 19
Книги из интернета
- ЕГЭ 2020. Химия. Типовые тестовые задания. 14 вариантов. Медведев Ю.Н.
- Химия ЕГЭ. Курс самоподготовки. Технология решения заданий. Каверина, Медведев, Молчанова и др.
2019
Развернуть/свернуть
- ЕГЭ 2019, Демонстрационный вариант (видео-объяснения каждого задания)
- ЕГЭ 2019, Кодификатор
- ЕГЭ 2019, Спецификатор
- Досрочный ЕГЭ 2019
- Досрочный ЕГЭ 2019 (текстовые условия ФИПИ, вариант 101)
Новые варианты выходят в начале каждого месяца.
- Пробный ЕГЭ по химии 2019. Вариант 1
- Пробный ЕГЭ по химии 2019. Вариант 2
- Пробный ЕГЭ по химии 2019. Вариант 3
- Пробный ЕГЭ по химии 2019. Вариант 4
- Пробный ЕГЭ по химии 2019. Вариант 5
- Пробный ЕГЭ по химии 2019. Вариант 6
- Пробный ЕГЭ по химии 2019. Вариант 7
- Пробный ЕГЭ по химии 2019. Вариант 8
- Пробный ЕГЭ по химии 2019. Вариант 9
- Пробный ЕГЭ по химии 2019. Вариант 10
Материалы из интернета
- Тренировочный вариант №1
- Тренировочный вариант №2
- Тренировочный вариант №3
- Тренировочный вариант №4
- Тренировочный вариант №5
- Тренировочный вариант №6
- Тренировочный вариант №7
- Тренировочный вариант №8
- Тренировочный вариант №9
- Тренировочный вариант №10
- Тренировочный вариант №11
- Тренировочный вариант №12
- Тренировочный вариант №13
- Тренировочный вариант №14
- Тренировочный вариант №15
- Тренировочный вариант №16
- Тренировочный вариант №17
- Тренировочный вариант №18
- Тренировочный вариант №19
- Тренировочный вариант №20
- Тренировочный вариант №21
Материалы из группы в контакте Химия: ЕГЭ, олимпиады и школьный курс
- Вариант 1 ЕГЭ-2019 химия с ответами
- Вариант 2 ЕГЭ-2019 химия с ответами
- Вариант 3 ЕГЭ-2019 химия с ответами
- Вариант 4 ЕГЭ-2019 химия с ответами
- Вариант 5 ЕГЭ-2019 химия с ответами
- Вариант 6 ЕГЭ-2019 химия с ответами
- Вариант 7 ЕГЭ-2019 химия с ответами
- Вариант 8 ЕГЭ-2019 химия с ответами
- Вариант 9 ЕГЭ-2019 химия с ответами
- Вариант 10 ЕГЭ-2019 химия с ответами
- Вариант 11 ЕГЭ-2019 химия с ответами
- Вариант 12 ЕГЭ-2019 химия с ответами
- Вариант 13 ЕГЭ-2019 химия с ответами
- Вариант 14 ЕГЭ-2019 химия с ответами
- Вариант 15 ЕГЭ-2019 химия с ответами
- Вариант 16 ЕГЭ-2019 химия с ответами
- Вариант 17 ЕГЭ-2019 химия с ответами
- Вариант 18 ЕГЭ-2019 химия с ответами
- Вариант 19 ЕГЭ-2019 химия с ответами
- Вариант 20 ЕГЭ-2019 химия с ответами
- Вариант 21 ЕГЭ-2019 химия с ответами
- Вариант 22 ЕГЭ-2019 химия с ответами
- Вариант 23 ЕГЭ-2019 химия с ответами
- Вариант 24 ЕГЭ-2019 химия с ответами
- Вариант 25 ЕГЭ-2019 химия с ответами
- Вариант 26 ЕГЭ-2019 химия с ответами
Материалы из группы в контакте Химия ЕГЭ. Вебинары. ДВИ МГУ. Наука для тебя.
- Тренировочный КИМ №1
- Тренировочный КИМ №2
- Тренировочный КИМ №3
- Тренировочный КИМ №4
- Тренировочный КИМ №5
- Тренировочный КИМ №6
- Тренировочный КИМ №7
- Тренировочный КИМ №8
- Тренировочный КИМ №9
- Тренировочный КИМ №10
Книги из интернета
- ЕГЭ 2019. Химия. Типовые тестовые задания. 14 вариантов. Медведев Ю.Н.
- ЕГЭ 2019. Химия. 10 тренировочных вариантов экзаменационных работ. Савинкина Е.В., Живейнова О.Г. (2018)
- ЕГЭ 2019. Химия. 25 вариантов. Яшкин С.Н., Яшкина Е.А. (2019)
- ЕГЭ 2019. Химия. 50 тренировочных вариантов экзаменационных работ. Савинкина Е.В., Живейнова О.Г. (2018)
- ЕГЭ 2019. Химия. Эксперт. Краткий теоретический курс. 15 типовых вариантов ЕГЭ. Медведев Ю.Н. и др. (2019)
- ЕГЭ 2019. Химия. Готовимся к итоговой аттестации. Каверина А.А., Медведев Ю.Н. и др. (2019)
- ЕГЭ 2019. Химия. Решение задач. Антошин А.Э. (2018)
- ЕГЭ 2019. Химия. Диагностические работы. (2019)
- Химия. Алгоритмы выполнения типовых заданий. Крышилович Е.В., Мостовых В.А. (2018)
- ЕГЭ. Химия. Большой справочник для подготовки к ЕГЭ. (2018)
- ЕГЭ 2019. Химия. Методические рекомендации по результатам ЕГЭ 2018г.
2018
Развернуть/свернуть
- ЕГЭ 2018, Демонстрационный вариант (видео-объяснения каждого задания)
- ЕГЭ 2018, Кодификатор
- ЕГЭ 2018, Спецификатор
- Пробный ЕГЭ 2018 по химии №1
- Пробный ЕГЭ 2018 по химии №2
- Пробный ЕГЭ 2018 по химии №3
- Пробный ЕГЭ 2018 по химии №4
- Пробный ЕГЭ 2018 по химии №5
- Пробный ЕГЭ 2018 по химии №6
- Пробный ЕГЭ 2018 по химии №7
- Пробный ЕГЭ 2018 по химии №8
- Пробный ЕГЭ 2018 по химии №9
- Пробный ЕГЭ 2018 по химии №10
- Пробный ЕГЭ 2018 по химии №11
- Пробный ЕГЭ 2018 по химии №12
- Пробный ЕГЭ 2018 по химии №13
- Пробный ЕГЭ 2018 по химии №14
- Пробный ЕГЭ 2018 по химии №15
- Пробный ЕГЭ 2018 по химии №16
- Пробный ЕГЭ 2018 по химии №17
- Пробный ЕГЭ 2018 по химии №18
- Пробные ЕГЭ 2018 по химии №19
Материалы из группы в контакте Химия: ЕГЭ, олимпиады и школьный курс
- Вариант 26 ЕГЭ-2018 химия с ответами
- Вариант 25 ЕГЭ-2018 химия с ответами
- Вариант 24 ЕГЭ-2018 химия с ответами
- Вариант 23 ЕГЭ-2018 химия с ответами
- Вариант 22 ЕГЭ-2018 химия с ответами
- Вариант 21 ЕГЭ-2018 химия с ответами
- Вариант 20 ЕГЭ-2018 химия с ответами
- Вариант 19 ЕГЭ-2018 химия с ответами
- Вариант 18 ЕГЭ-2018 химия с ответами
- Вариант 17 ЕГЭ-2018 химия с ответами
- Вариант 16 ЕГЭ-2018 химия с ответами
- Вариант 15 ЕГЭ-2018 химия с ответами
- Вариант 14 ЕГЭ-2018 химия с ответами
- Вариант 13 ЕГЭ-2018 химия с ответами
- Вариант 12 ЕГЭ-2018 химия с ответами
- Вариант 11 ЕГЭ-2018 химия с ответами
- Вариант 10 ЕГЭ-2018 химия с ответами
- Вариант 9 ЕГЭ-2018 химия с ответами
- Вариант 8 ЕГЭ-2018 химия с ответами
- Вариант 7 ЕГЭ-2018 химия с ответами
- Вариант 6 ЕГЭ-2018 химия с ответами
- Вариант 5 ЕГЭ-2018 химия с ответами
- Вариант 4 ЕГЭ-2018 химия с ответами
- Вариант 3 ЕГЭ-2018 химия с ответами
- Вариант 2 ЕГЭ-2018 химия с ответами
- Вариант 1 ЕГЭ-2018 химия с ответами
- СтатГрад: Тренировочная работа 26.10.2017 с решениями: вариант ХИ10103
- СтатГрад: Тренировочная работа 26.10.2017 с решениями: вариант ХИ10104
- СтатГрад: Тренировочная работа ноябрь 2017: вариант ХИ10201 и ХИ10202
- ЕГЭ 2018, Химия, Типовые тестовые задания, Медведев Ю.Н.
- ЕГЭ 2018, Химия, Эксперт в ЕГЭ, Медведев Ю.Н., 2018
- ЕГЭ 2018, Химия, Типовые экзаменационные варианты, 30 вариантов, Каверина А.А., 2018
2017
Развернуть/свернуть
- ЕГЭ 2017, Демонстрационный вариант
- Досрочный ЕГЭ 2017 по химии
- Анализ ЕГЭ 2017
- Пробный ЕГЭ 2017 по химии №18 с ответами и решениями
- Пробный ЕГЭ 2017 по химии №17 с ответами и решениями
- Пробный ЕГЭ 2017 по химии №16 с ответами и решениями
- Пробный ЕГЭ 2017 по химии №15 с ответами и решениями
- Пробный ЕГЭ 2017 по химии №14 с ответами и решениями
- Пробный ЕГЭ 2017 по химии №13 с ответами и решениями
- Пробный ЕГЭ 2017 по химии №12 с ответами и решениями
- Пробный ЕГЭ 2017 по химии №11 с ответами и решениями
- Пробный ЕГЭ 2017 по химии №10 с ответами и решениями
- Пробный ЕГЭ 2017 по химии №9 с ответами и решениями
- Пробный ЕГЭ 2017 по химии №8 с ответами и решениями
- Пробный ЕГЭ 2017 по химии №7 с ответами и решениями
- Пробный ЕГЭ 2017 по химии №6 с ответами и решениями
- Пробный ЕГЭ 2017 по химии №5 с ответами и решениями
- Пробный ЕГЭ 2017 по химии №4 с ответами и решениями
- Пробный ЕГЭ 2017 по химии №3 с ответами и решениями
- Пробный ЕГЭ 2017 по химии №2 с ответами и решениями
- Пробный ЕГЭ 2017 по химии №1 с ответами и решениями
- ЕГЭ, Химия, Высший балл, Самостоятельная подготовка, Каверина А.А., Добротин Д.Ю., Медведев Ю.Н., 2017
- ЕГЭ 2017, Химия, Типовые тестовые задания, Медведев Ю.Н.
2016
Развернуть/свернуть
- ЕГЭ 2016, Демонстрационный вариант.
- ЕГЭ 2016, Досрочный экзамен, Реальный вариант №101
- ЕГЭ 2016, Химия, Тренировочный вариант №1-19.
- ЕГЭ 2016. Химия. Тренировочная работа 1. СтатГрад
- ЕГЭ 2016. Химия. Тренировочная работа 2. СтатГрад
- ЕГЭ 2016. Химия. Тренировочная работа 3. СтатГрад
- ЕГЭ 2016. Химия. Тренировочная работа 4. СтатГрад
- ЕГЭ 2016. Химия. Тренировочная работа 5. СтатГрад
- ЕГЭ 2016. Краснодарский демонстрационный вариант
- ЕГЭ по химии — 2016. Основная волна (Часть С).
- ЕГЭ по химии — 2016. Основная волна. Вариант 2 (Часть С).
- ЕГЭ по химии — 2016. Основная волна. Вариант 9 (Часть С).
- ЕГЭ по химии — 2016. Основная волна. Вариант 16 (Часть С).
- ЕГЭ по химии — 2016. Основная волна. Вариант 37 (Часть С).
- ЕГЭ по химии — 2016. Основная волна. Вариант 46 (Часть С).
- ЕГЭ по химии — 2016. Основная волна. Вариант 47 (Часть С).
- ЕГЭ по химии — 2016. Основная волна. Вариант 50 (Часть С).
- ЕГЭ по химии — 2016. Основная волна. Вариант 74 (Часть С).
- ЕГЭ по химии — 2016. Основная волна. Вариант 77 (Часть С).
- ЕГЭ по химии — 2016. Основная волна. Вариант 78 (Часть С).
- ЕГЭ по химии — 2016. Основная волна. Вариант 86 (Часть С).
- ЕГЭ 2016, Химия, Типовые тестовые задания, Медведев Ю.Н.
- ЕГЭ 2016, Химия, Эксперт в ЕГЭ, Медведев Ю.Н., Антошин А.Э., Лидин Р.А
- ЕГЭ, Химия, 50 тренировочных вариантов экзаменационных работ, Савинкина Е.В., Живейнова О.Г., 2016.
- ЕГЭ 2016, Тематический тренинг, Задания базового и повышенного уровней сложности, Доронькин В.Н., 2015.
- Химия, Новые задания ЕГЭ, Доронькин В.Н., 2016.
2015
Развернуть/свернуть
- ЕГЭ 2015, Демонстрационный вариант.
- ЕГЭ 2015, Досрочный экзамен.
- ЕГЭ-2015. Химия. Тематическая диагностическая работа 1. «Кислородсодержащие. Азотсодержащие.» 45-90 мин. Вар. 00101-00104. 09.10.2014г., критерии, спецификация
- ЕГЭ-2015. Химия. Тематическая диагностическая работа 2. «Строение веществ. Химические реакции.» 90 мин. Вар. 10303-10304. 14.11.2014г., критерии + Демо
- ЕГЭ-2015. Химия. Тренировочная работа 1. 180 мин. Вар. 10101-10102. 16.12.2014г., критерии
- ЕГЭ-2015. Химия. Тренировочная работа. Санкт-Петербург. Вар. 1-2. 06.02.2015г., с ответами
- ЕГЭ-2015. Химия. Репетиционная работа 1. 180 мин. Вар. 10401-10402. 11.02.2015г., критерии
- ЕГЭ-2015. Химия. Тренировочная работа 2. 180 мин. Вар. 10501-10504. 11.03.2015г., критерии (501-502)
- 11 класс. Химия. Краевая диагностическая работа. ( и 12кл. ВСОШ) Краснодар. Вар. 1-4. 12.03.2015г., с ответами
- ЕГЭ-2015. Химия. Тематическая диагностическая работа 3. «Металлы. Неметаллы.» 90 мин. Вар. 10603-10604. 03.04.2015г., критерии + Демо
- ЕГЭ-2015. Химия. Тренировочная работа 3. 180 мин. Вар. 10701-10702. 15.04.2015г., критерии
- ЕГЭ-2015. Химия. Репетиционная работа 2. 180 мин. Вар. 10801-10802. 12.05.2015г.
- СтатГрад: Тренировочная работа по химии 16.12.2014 Вариант ХИ10101.
- СтатГрад: Тренировочная работа по химии 16.12.2014 Вариант ХИ10102.
- СтатГрад: Репетиционная работа 11.02.2015 Вариант ХИ10401.
- СтатГрад: Репетиционная работа 11.02.2015 Вариант ХИ10402.
- СтатГрад: Тренировочная работа 11.03.2015 Вариант ХИ10501.
- СтатГрад: Тренировочная работа 11.03.2015 Вариант ХИ10502.
- Пробные варианты ЕГЭ 2015 по химии, апрель 2015
- Тренировочные варианты ЕГЭ 2015 по химии, апрель 2015
- Тренировочные варианты ЕГЭ 2015 по химии, март 2015
- Пробный ЕГЭ 2015 по химии 2 варианта, февраль 2015
- Пробный ЕГЭ 2015 по химии с ответами
- Тренировочные варианты ЕГЭ 2015 по химии (с ответами)
- ЕГЭ 2015, Химия, Сборник заданий, Оржековский П.А., Богданова Н.Н., Васюкова Е.Ю., Мещерякова Л.М., 2014.
- ЕГЭ 2015, Химия, Тематические тестовые задания, Медведев Ю.Н.
- ЕГЭ-2015, Химия, Самое полное издание типовых вариантов для подготовки к ЕГЭ, Савинкина Е.В., Живейнова О.Г.
2014
Развернуть/свернуть
- ЕГЭ 2014, Химия, Демонстрационный вариант.
- ЕГЭ 2014, Химия. Самое полное издание типовых вариантов заданий, Каверина А.А., Добротин Д.Ю., Снастина М.Г.
- ЕГЭ 2014, Химия, Досрочный этап, 3 варианта КИМ, с сайта ФЦТ.
- ЕГЭ 2014, Химия, Типовые тестовые задания, Медведев Ю.Н.
- ЕГЭ 2014, Химия, Тренировочная работа с ответами, Варианты 601-602, 21.03.2014.
- ЕГЭ 2014, Химия, Тренировочная работа с ответами, Варианты 501-502, 30.01.2014.
- ЕГЭ 2014, Химия, Тренировочная работа №1 с ответами, Варианты 101-104, 25.10.2013.
- ЕГЭ, Химия, 11 класс, Тренировочная работа, Варианты 10701-10702, 2014.
- Химия, Подготовка к ЕГЭ 2014, Диагностические работы, Богданова Н.Н., Смирнов С.С.
- Пробный ЕГЭ 2014 по химии с ответами и решениями, январь 2014
- Пробный ЕГЭ 2014 по химии с ответами и решениями, октябрь 2013
2013
Развернуть/свернуть
- ЕГЭ 2013, Химия, Демонстрационный вариант.
- ЕГЭ 2013, Химия, Основной этап, Дальний Восток.
- ЕГЭ 2013, Химия, Основной этап, Сибирь.
- ЕГЭ 2013, Химия, Основной этап, Урал.
- ЕГЭ 2013, Химия, Основной этап, Центр.
- ЕГЭ-2013. Химия. Экзамен. Основной этап. 20 вар. 11.06.2013г.
- ЕГЭ-2013. Химия. 14 вариантов КИМ (с сайта ФЦТ)
- ЕГЭ 2013, Химия, Диагностическая работа 1 (вариант №1-4)
- ЕГЭ 2013, Химия, Тренировочная работа 1 (вариант №1-4)
- ЕГЭ 2013, Химия, Тренировочная работа 2 (вариант №1-4)
- ЕГЭ 2013, Химия, Тренировочная работа 3 (вариант №1-4)
- ЕГЭ 2013, Химия, Диагностическая работа 2 (вариант №1-4) + краткая (2 варианта)
- ЕГЭ 2013, Химия, Тренировочная работа 4 (вариант №1-4)
- ЕГЭ 2013. Химия. Краевая диагностическая работа по химии за 2013 год
- ЕГЭ 2013, Химия, Самое полное издание типовых вариантов заданий, Каверина А.А., Добротин Д.Ю., Снастина М.Г.
- ЕГЭ 2013, Химия, Тематические тренировочные задания, Соколова И.А., 2012.
- ЕГЭ 2013, Химия, Типовые экзаменационные варианты, 30 вариантов, Каверина А.А., 2012.
2012
Развернуть/свернуть
- ЕГЭ 2012, Химия, Демонстрационный вариант.
- ЕГЭ 2012, Химия, Диагностическая работа
- ЕГЭ 2012, Химия, Диагностическая работа 1 (вариант №1-2)
- ЕГЭ 2012, Химия, Диагностическая работа 2 (вариант №3-4)
- ЕГЭ 2012, Химия, Тренировочная работа 1
- ЕГЭ 2012, Химия, Тренировочная работа 2
- ЕГЭ 2012, Химия, Тренировочная работа 3
- ЕГЭ 2012, Химия, Тренировочная работа 4
- ЕГЭ 2012, Химия, Краевая диагностическая работа
- ЕГЭ 2012, Химия, Типовые тестовые задания, Медведев Ю.Н., 2012.
- ЕГЭ 2012, Химия, Типовые экзаменационные варианты, 30 вариантов, Каверина А.А.
- ЕГЭ 2012. Химия. Самое полное издание типовых вариантов.
- Химия, Диагностические работы в формате ЕГЭ, Еремин В.В., Дроздов А.А., 2012.
2011
Развернуть/свернуть
- ЕГЭ 2011. Химия. Демонстрационный вариант 2011
- ЕГЭ 2011, Химия, Основной этап (8 вариантов)
- ЕГЭ 2011, Химия, Основной этап. Реальные фото с экзамена
- ЕГЭ 2011, Химия, Диагностическая работа 1 (вариант №1-2)
- ЕГЭ 2011, Химия, Диагностическая работа 2 (вариант №1-2)
- ЕГЭ 2011, Химия, Тренировочная работа 1 (вариант №1-2)
- ЕГЭ 2011, Химия, Тренировочная работа 2 (вариант №1-2)
- ЕГЭ 2011, Химия, Тренировочная работа 3 (вариант №1-2)
- ЕГЭ 2011, Химия, Тренировочная работа 4 (вариант №1-2)
- ЕГЭ 2011, Химия, Краевая тренировочная работа 1 (вариант №1-4)
- ЕГЭ 2011, Химия, Пробный вариант
- ЕГЭ 2011, Химия, Самое полное издание типовых вариантов заданий, Корощенко А.С., Каверина А.А., Добротин Д.Ю.
- ЕГЭ 2011. Химия. Типовые тестовые задания. Медведев Ю.Н. 2011
2010
Развернуть/свернуть
- ЕГЭ 2010. Химия. Демонстрационный вариант.
- ЕГЭ 2010, Химия, Реальный Вариант №1
- ЕГЭ 2010, Химия, Реальный Вариант №2
- ЕГЭ 2010, Химия, Реальный Вариант №3
- ЕГЭ 2010, Химия, Реальный Вариант №4
- ЕГЭ 2010, Химия, Реальный Вариант №5
- ЕГЭ 2010, Химия, Реальный Вариант №121
- ЕГЭ 2010, Химия, Реальный Вариант №128
- ЕГЭ 2010, Химия, Реальный Вариант №133
- ЕГЭ 2010, Химия, Досрочный Вариант №1
- ЕГЭ 2010, Химия, Досрочный Вариант №2
- ЕГЭ 2010, Химия, Досрочный Вариант №3
- ЕГЭ 2010, Химия, Диагностическая работа 1 (вариант № 1-2)
- ЕГЭ 2010, Химия, Диагностическая работа 2 (вариант № 1-2)
- ЕГЭ 2010, Химия, Краевая диагностическая работа 1 (вариант № 1-4)
- ЕГЭ 2010, Химия, Тренировочная работа 1
- ЕГЭ 2010, Химия, Тренировочная работа 2
- ЕГЭ 2010, Химия, Тренировочная работа 4
- ЕГЭ 2010, Химия, Тренировочная работа 5
- ЕГЭ 2010, Химия, Тренировочная работа 6
- ЕГЭ-2010 — Химия — самые новые реальные задания. Корощенко А.С., Снастина М.Г.
- Самое полное издание типовых вариантов реальных заданий ЕГЭ 2010 — Химия.
2009
Развернуть/свернуть
- ЕГЭ, Химия, Демонстрационный вариант, 2009
- ЕГЭ 2009, Химия, Реальный Вариант (37 вариантов)
- ЕГЭ 2009, Химия, Репетиционный экзамен
- ЕГЭ 2009, Химия, Тренировочная работа 1
- ЕГЭ 2009, Химия, Тренировочная работа 2
- ЕГЭ 2009, Химия, Тренировочная работа 3
- ЕГЭ 2009 — Химия — Сборник экзаменационных заданий. Каверина А.А., Медведев Ю.Н., Добротин Д.Ю.
- ЕГЭ-2009 — Химия — Самые новые реальные задания. Корощенко А.С., Снастина М.Г.
- Самое полное издание типовых вариантов реальных заданий — ЕГЭ 2009 — Химия. Корощенко А.С., Снастина М.Г.
2008
- ЕГЭ 2008, Химия, Демонстрационный вариант
- ЕГЭ 2008, Химия, Реальный Вариант (35 вариантов)ЕГЭ 2008. Химия. Самое полное издание реальных заданий. Корощенко А.С., Снастина М.Г.
2007
- ЕГЭ 2007, Химия, Демонстрационный вариант
2006
- ЕГЭ 2006, Химия, Демонстрационный вариант
- ЕГЭ 2006, Химия, Реальные варианты (29 вариантов)
2005
- ЕГЭ 2005, Химия, Демонстрационный вариант
- ЕГЭ 2005, Химия, Реальный вариант
2004
- ЕГЭ 2004, Химия, Демонстрационный вариант
2003
- ЕГЭ 2003, Химия. Реальный вариант
2002
- ЕГЭ 2002, Химия, Демонстрационный вариант
- ЕГЭ 2002, Химия. Реальный вариант
Часть материалов, которые представлены на этой странице, скачаны из интернтета. Все они находятся в свободном доступе и на каждом задании указаны ссылки на авторов. По сему мы не претендуем на авторство. Всё это сделано для удобства учащихся, которые готовятся к ЕГЭ.
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ по темам (номерам заданий) вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку
Продолжая рубрику про ЕГЭ по химии, конечно же, нельзя не упомянуть о самых сложных заданиях. Разбираемся в тонкостях и узнаем лайфхаки сегодня. Поехали!
Структура экзамена
И начинаем мы, как обычно, со структуры – основополагающего фактора, не разобравшись в котором справиться с КИМом на высокие баллы невозможно.
ЕГЭ по химии состоит из двух частей:
- Первая часть – тестовая, предусматривает краткий ответ в виде одного числа или последовательности чисел. Состоит из 28 заданий;
- Вторая часть требует подробного решения на бланках ответа №2 и состоит из 6 заданий;
То есть всего экзамен состоит из 34 заданий, за безошибочное решение которых можно получить 56 первичных баллов.
Кстати, на решение экзамена вам будет отведено 3 с половиной часа. Время более, чем реальное. Опыт прошлых лет показывает, что вы успеете не просто решить все задания и перенести их в бланки ответов, но сможете даже перепроверить написанное, что не может не радовать.
Самые сложные задания ЕГЭ по химии
После того, как мы вспомнили структуру экзамена, предлагаем перейти непосредственно к наиболее каверзным заданиям КИМа по химии.
Естественно, первая часть экзамена намного проще второй, однако и с тестовыми заданиями порой возникают проблемы. Поэтому давайте обо всем по порядку.
Задания 1-3
Самой обидной трудностью на пути к получению заветного балла бывает путанница из-за измененной формулировки задания. Очень часто ребята, нарешивая десятки пробников, привыкают к определенным установкам и потом просто не понимают, что от них требуется ровно то же самое, только другими словами.
Как решить проблему:
- быть внимательнее;
- готовиться по нескольким сборникам и пособиями, чтобы узнать различные формулировки;
Задание 7
Задание на растворы, в котором также пригодится внимательность. Если в состав добавляют вещество Y, то нужно сделать нехитрый вывод, что все нерастворимые вещества из списка потенциальных Y следует вычеркнуть.
Как не допустить ошибку:
- знать на зубок, в каких случаях выделяются газы;
- научиться работать с таблицей растворимости;
- научиться грамотно составлять схемы реакций;
Задания на свойства неорганических веществ (8, 30, 31 и 32)
В заданиях 30-31 важно помнить, что даже если вы верно составите уравнение реакции, то засчитано оно будет лишь при условии абсолютного соответствия условиям задания.
Что касается теории, то для номера 30 нужно вспомнить, что такое окислитель, а что восстановитель. Кстати подробная статья об овр уже есть на нашем сайте. (можно сделать ссылку на статью) А для номера 31 придется вспомнить формулы малодиссоциирующих веществ, которые нельзя записывать в виде ионов.
Как избежать ошибок:
- тщательно проверять, какие продукты получаются у вас из исходных веществ, ведь, к примеру, из кислоты никак не может выйти основание или основная соль (советуем еще раз вспомнить подробную теорию);
Главное о номере 8: приступая к заданию, обязательно рассмотрите предложенные формулы как с позиции кислотно-основных, так и окислительно-восстановительных свойств. Это поможет сразу отсеять “затесавшиеся” списки реагентов.
Самое важное при выполнении задания 32 – запомнить палитру, то есть цвета осадков и растворов. Кстати, для лучшего запоминания уже давно придуманы забавные стишки. Ну а если дружба с поэзией не складывается, то предлагаем запастись карандашами и раскрасить таблицу растворимости, отмечая все известные цветовые признаки соединений.
Задание 13
Задание на свойства углеводородов уже давно считается одним из самых провальных.
Самое “коварное” место: определение механизма реакции.
Как избежать трудностей:
- запомнить, что ионный механизм всегда связан с присутствием разноименных заряженных частиц;
- учитывать, что вещества определенных типов вступают в свойственные им реакции: кратная связь – реакции присоединения, одинарная связь – реакции замещения;
- не забывать о температурных условиях;
Задания 15 и 17
Номера на азотосодержащие и кислородосодержащие органические вещества и углеводы. Реакции идут по двум типам:
- по функциональной группе;
- по радикалу;
Как усовершенствовать умения в решении заданий 15 и 17:
- выписывать и заучивать как можно больше уравнений каждого класса;
- решать цепочки на взаимосвязь органических веществ;
Задания 34 и 35
Вот мы и добрались до расчетных задач – самого сложного “элемента” КИМа ЕГЭ по химии, на котором ежегодно проваливается большинство одиннадцатиклассников.
Задание 34 сложно тем, что для него нет единого алгоритма решения. Есть задачи на электролиз, смеси, атомистику, а бывает, что в условии переплетается несколько типов задач. Конечно, советуем прорешать каждый из возможных типов задач, чтобы при встрече в июне вам точно было, что сказать, ой, вернее расписать)
Ошибки в задании 35 чаще всего случаются из-за неправильного определения структурной формулы. Обычно это связано с недостаточным знанием химических свойств органических веществ.
Что нужно делать: стараться каждый день выполнять хотя бы одну цепочку превращений, писать уравнения реакций.
И напоследок немного общих советов для решения расчетных задач:
- максимально сконцентрируйтесь, даже когда решаете пробник: перечитывайте условие, зачеркивайте массы веществ, уходящие из раствора на черновиках, пересчитывайте результат;
- на всякий случай повторите даже самые простые формулы, известные вам как дважды два: “лучше перебдеть, чем недобдеть”;
- внимательно следите за массами: не забывайте их складывать;
- если в начале задачи трудно определить избыток или недостаток щелочи, можно написать два возможных уравнения – образования гидроксида и образования комплексной соли;
Сегодня мы разобрали самые хитрые места ЕГЭ по химии. Уверены, что теперь ошибок в них вы точно не сделайте. Желаем удачи в постижении очень непростой, но интересной науки! Ваш Умскул.
Дорогие друзья! На этой странице вы можете найти варианты реальных КИМ ЕГЭ по химии. На сайте размещены только ссылки на варианты КИМ ЕГЭ. Если вы хотите помочь и дополнить коллекцию вариантов, пожалуйста, присылайте свои материалы на почту: ste-vn@ya.ru. Все качественные материалы я опубликую с обратными ссылками.
Приобрести сборник вариантов ЕГЭ по химии вы можете здесь.
2021-2022 учебный год
| Демонстрационный вариант КИМ ЕГЭ по химии-2022 | ||
| Вариант Ответы | Кодификатор | Спецификация |
| Перспективный вариант демо-версии КИМ ЕГЭ по химии-2022 | ||
| Вариант | Спецификация |
2020-2021 учебный год
| Реальные варианты КИМ ЕГЭ по химии | ||
| Основная волна ЕГЭ по химии-2021 | ||
| Вариант 1 | Ответы и решения | 31 мая 2021 |
| Все задания второй части реального ЕГЭ по химии-2021 с решениями: 30-31, 32, 33, 34, 35 | ||
| Открытый вариант ЕГЭ по химии-2021 от ФИПИ | ||
| Вариант | Ответы и решения | |
| Демонстрационный вариант ЕГЭ по химии-2021 (проект) | ||
| Вариант Ответы | Кодификатор | Спецификация |
|
Тренировочные варианты ЕГЭ по химии-2021 |
||
| Вариант 1
Вариант 2 |
Вариант 1 — ответы и решения
Вариант 2 — ответы, критерии |
2019-2020 учебный год
| Реальные варианты КИМ ЕГЭ по химии | ||
| Основная волна ЕГЭ по химии-2020 | ||
| Вариант 1 |
Ответы и решения | 16 июля 2020 г. |
| Вариант 2 | 16 июля 2020 г. | |
| Все задания второй части реального ЕГЭ по химии-2020 с решениями: 30-31, 32, 33, 34, 35 |
||
| Демонстрационный ЕГЭ по химии-2020 | ||
| Вариант Ответы | Кодификатор | Спецификация |
|
Досрочный ЕГЭ по химии-2020 |
||
| Вариант 1
Вариант 2 |
Вариант 1 — ответы, критерии
Вариант 2 — ответы, критерии |
апрель 2020 г. |
2018-2019 учебный год
| Реальные варианты КИМ ЕГЭ по химии | ||
| Демонстрационный ЕГЭ по химии-2019 | ||
| Вариант Ответы | Кодификатор | Спецификация |
| Досрочный ЕГЭ по химии 25 марта 2019 года | ||
| Вариант 1 | Решения и ответы | |
| Вариант от ФИПИ | ||
| Основная волна 31 мая 2019 года | ||
2017-2018 учебный год
| Демонстрационный ЕГЭ по химии-2018 | ||
| Вариант Ответы | Кодификатор | Спецификация |
| Досрочный ЕГЭ по химии 26 марта 2018 года | ||
| Вариант резервного дня 06.04.2018 | ||
| Вариант от ФИПИ | ||
| Основная волна 4 июня 2018 года | ||
Сложные реальные задания ЕГЭ по химии
- 15.04.2018
Разбираем сложные задания, которые встречаются в ЕГЭ по химии. Данный сборник создан на основе реальных заданий ЕГЭ прошлых лет.
Каждое задание имеет подробное решение и ответ в конце документа. Изучайте, решайте и проверяйте себя. Для тех, кто хочет сдать ЕГЭ по химии на максимальный балл!
Смотреть в PDF:
Или прямо сейчас: cкачать в pdf файле.
Комментарии
-1
#1
Ардан
16.04.2018 20:56
Опечатка в задании 10.2: спрашивается о взаимодействии. Взаимодействует только фенол же, а стирол,как и остальные, не могут.
Еще вопрос: как определить с каким гидрокарбонатом взаимодействует фенол? Как понять: достаточно он кислый для взаимодействия или нет? (из примера взаимодействия с гидрокарбонатом цезия)
Цитировать
-1
#2
Женя
26.04.2018 15:06
Здесь вроде как опечатка:
[Cu(NH3)4](SO4) 2 + K2S = CuS↓ + NH3↑ + K2SO4
У аниона SO4 индекс 2, хотя не должно этого быть, ибо медь двухвалентна. Кстати, немного ниже пишется анион уже без индекса
Цитировать
Добавить комментарий
Комментарии без регистрации. Несодержательные сообщения удаляются.
Как показали результаты репетиционного экзамена по химии, наиболее трудными оказались задания, направленные на проверку знаний химических свойств веществ. К числу таких заданий можно отнести задание С3 – «Цепочка органических веществ», С2 – «Реакции между неорганическими веществами и их растворами».
При решении задания С3 «Цепочка органических веществ» учащийся должен написать пять уравнений химических реакций, среди которых одно является окислительно-восстановительным.
Рассмотрим составление одного из таких окислительно-восстановительных уравнений:
СН3СНО X1
Чтобы составить уравнение окислительно-восстановительной реакции с участием органических веществ, нужно научиться определять степень окисления в органическом веществе по его структурной формуле. Для этого нужно иметь знания о химической связи, знать, что такое электроотрицательность.
Структурная формула помогает оценить смещение электронов по каждой из связей. Так атом углерода метильной группы (–СН3) сместит электрон по каждой из связей к себе. Таким образом, степень окисления углерода метильной группы будет равна (-3). Атом углерода карбонильной группы (СО) отдаст 2 электрона атому кислорода, но частично компенсирует недостачу, приняв 1 электрон от атома водорода. Следовательно, его степень окисления будет равна +1:
В продукте реакции степень окисления углерода метильной группы не изменится. Карбонильная группа атомов превратится в карбоксильную с замещенным водородом на натрий, вследствие щелочной среды (-СООNa). Атом углерода карбоксильной группы сместит два электрона в сторону карбонильного кислорода и один электрон в сторону кислорода замещенной гидроксильной группы. Таким образом, степень окисления атома углерода карбоксильной группы будет равна (+3):
Следовательно, одна молекула этаналя отдает 2 электрона:
С+1-2е=С+3
Рассмотрим теперь процессы, происходящие с перманганатом натрия. Обращает внимание, что в схеме дан перманганат натрия, а не калия. Свойства перманганата натрия должны быть аналогичны свойствам перманганта калия, который в зависимости от кислотности среды способен давать различные продукты:
Так как в нашем случае перманганат натрия используется в щелочной среде, то продуктом реакции будет манганат ион – MnO42-.
Определим степень окисления иона марганца в перманганате калия NaMnO4 пользуясь правилом равенства числа положительных и отрицательных зарядов в нейтральной структурной единице вещества. Четыре кислорода каждый по (-2) дадут восемь отрицательных зарядов, так как степень окисления у калия +1, то у марганца будет +7:
Na+1Mn+7O4-2
Записав формулу манганата натрия Na2MnO4, определим степень окисления марганца:
Na2+1Mn+6O4-2
Таким образом, марганец принял один электрон:
Mn+7+1e=Mn+6
Полученные уравнения позволяют определить множители перед формулами в уравнении химической реакции, которые называют коэффициентами:
С+1-2е=С+3 ·1
Mn+7+1e=Mn+6 ·2
Уравнение реакции приобретет следующий вид:
2NaMnO4+CH3CHO+3NaOH=CH3COONa+2Na2MnO4+2H2O
Задание С2 требует от участника ЕГЭ знание свойств разнообразных свойств неорганических веществ, связанных с протеканием как окислительно-восстановительных реакций между веществами, находящимися как в одном, так и в различных агрегатных состояниях, так и обменных реакций протекающих в растворах. Такими свойствами могут быть некоторые индивидуальный свойства простых веществ и их соединений, например, реакция лития или магния с азотом:
2Li+3N2=2Li3N
2Mg+N2=Mg2N2
горение магния в углекислом газе:
Mg+CO2=MgO+CO
2Mg+CO2=2MgO+C
Особую трудность у учащихся вызывают сложные случаи взаимодействия растворов веществ солей подвергающихся гидролизу. Так для взаимодействия раствора сульфата магния с карбонатом натрия можно записать целых три уравнения возможных процессов:
MgSO4+Na2CO3=MgCO3+Na2SO4
2MgSO4+2Na2CO3+H2O=(MgOH)2CO3¯+2Na2SO4+CO2
2MgSO4+2Na2CO3+2H2O=2Mg(OH)2¯+2Na2SO4+2CO2
Традиционно трудны для написания уравнения с участием комплексных соединений. Так растворы амфотерных гидроксидов в избытке щелочи обладают всеми свойствами щелочей. Они способны вступать в реакции с кислотами и кислотными оксидами:
Na[Al(OH)4]+HCl=NaCl+Al(OH)3¯+H2O
Na[Al(OH)4]+2HCl=NaCl+Al(OH)2Cl+2H2O
Na[Al(OH)4]+3HCl=NaCl+Al(OH)Cl2+3H2O
Na[Al(OH)4]+4HCl=NaCl+AlCl3+4H2O
Na[Al(OH)4]+CO2=NaHCO3+Al(OH)3¯
2Na[Al(OH)4]+CO2=Na2CO3+2Al(OH)3¯+H2O
Растворы солей, имеющие кислую реакцию среды, вследствие гидролиза, способны растворять активные металлы, например, магний или цинк:
Mg+MgCl2+2H2O=2MgOHCl+H2
На экзамене желательно помнить об окислительных свойствах солей трехвалентного железа:
2FeCl3+Cu=CuCl2+2FeCl2
Могут пригодиться знания об аммиачных комплексах:
CuSO4+4NH3=[Cu(NH3)4]SO4
AgCl+2NH3=[Ag(NH3)2]Cl
Традиционно вызывают затруднения, связанные с проявлением основных свойств раствором аммиака. В результате чего могут протекать обменные реакции в водных растворах:
MgCl2+2NH3+2H2O=Mg(OH)2+2NH4Cl
В заключение приведем серию уравнений химических реакций, которые нужно знать участникам ЕГЭ по химии:
ОБЩАЯ ХИМИЯ
Кислоты. Основания. Соли. Оксиды.
Кислотные оксиды (кроме SiO2) реагируют с водой, как амфотерным оксидом с образованием кислот:
P2O5 + 3H2O = 2H3PO4
SO3 + H2O = H2SO4
Для получения азотной кислоты азот оксид азота (IV) должен быть доокислен, например кислородом воздуха:
4NO2 + O2 + 2H2О = 4HNO3
Лабораторный способ получения хлороводорода: к твердому хлориду натрия приливают концентрированную серную кислоту:
NaCl + H2SO4 = NaHSO4 + HCl
Для получения бромоводорода из бромида натрия, концентрированная серная кислота не подойдет, так как выделяющийся бромоводород будет загрязнен парами брома. Можно использовать концентрированную фосфорную кислоту:
NaBr+ H3PO4 = NaH2PO4 + HBr
Кислоты реагируют с металлами, стоящими в ряду напряжений до водорода:
Fe + 2 HCl = FeCl2 + H2
И их оксидами:
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Обратите внимание на валентность переходных элементов в солях.
Щелочные и щелочноземельные металлы взаимодействуют с водой:
K + H2O = KOH + ½ H2
В условиях избытка кислоты могут образовываться и кислые соли:
2Н3РО4 + 2Na = 2NaH2PO4 + Н2
Органические кислоты также проявляют кислотные свойства:
2СН3СООН + 2Na = 2CH3COONa + Н2
СНзСООН + NaOH = CH3COONa + Н2О
Комплексные гидроксиды реагируют с кислотами с образованием солей и воды:
Na[Al(OH)4] + HCl = AlCl3 + 4H2O + NaCl
LiOH + HNO3 = LiNO3 + H2O
Многоосновные кислоты в реакции с гидроксидами могут образовывать кислые соли:
Н3РО4 + КОН = КН2РО4 + Н2О
Продуктом реакции аммиака с фосфорной кислотой может также быть кислая соль:
NH3 + H3PO4 = NH4H2PO4
Обратим внимание на свойства оснований, их взаимодействие с кислотами:
2Н3РО4 + ЗСа(ОН)2 = Са3(РО4)2¯ + 6Н2О
с кислотными оксидами:
Ca(OH)2 + CO2 = CaCO3¯ + H2O
2Ca(OH)2 + CO2=(СaOH)2CO3+H2O
Реакция гидроксидов с кислотными оксидами может приводить и к кислым солям:
KOH + CO2 = KHCO3
Основные оксиды реагируют с амфотерными оксидами:
CaO + H2O = Ca(OH)2
Средние соли в воде реагируют с кислотными оксидами с образованием кислых солей:
CaCO3 + CO2 + H2O = Ca(HCO3)2
Более сильные кислоты вытесняют более слабые из их солей:
CH3COONH4 + HCl = CH3COOH + NH4Cl
K2CO3 + H2SO4 = K2SO4 + H2O + CO2
Кислоты в присутствии серной кислоты реагируют со спиртами с образованием сложных эфиров:
CH3COOH + C2H5OH = CH3COOC2H5 + H2O
Более сильное основание вытесняет более слабое из его солей:
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl
MgCl2 + KOH = MgOHCl + KCl
NH4С1 + NaOH = NaCl + NH3 + H2O
Чтобы получить из основной соли получить среднюю соль нужно подействовать кислотой:
MgOHCl + HCl = MgCl2 + H2O
Гидроксиды металлов (кроме щелочных металлов) разлагаются при нагревании в твердом виде до оксидов:
2Al(OH)3 = Al2O3 + 3H2O
2Fe(OH)3 = Fe2O3 + 3H2O
Гидрокарбонаты при нагревании разлагаются до карбонатов:
2KHCO3 = K2CO3 + H2O + CO2
Нитраты обычно разлагаются до оксидов (обратите внимание на повышение степени окисления переходного элемента находящегося в промежуточной степени окисления):
2Fe(NO3)2 = Fe2O3 + 4NO2 + 0,5O2
2Fe(NO3)3 ® Fe2O3 + 6NO2 + 1,5 O2
2Cu(NO3)2 = 2CuO + 4NO2 + О2
Нитраты щелочных металлов разлагаются до нитритов:
NaNO3 = NaNO2 + ½ O2
Карбонаты металлов (кроме щелочных) разлагаются до оксидов:
CaCO3 = CaO + CO2
При составлении уравнений реакций ионного обмена пользуйтесь таблицей растворимости:
K2SO4 + BaCl2 = BaSO4¯ + 2KCl
[C6H5-NH3]C1 + AgNО3 = [C6H5NH3]NO3 + AgCl¯
Электролиз
Электролиз расплавов солей:
2KCl = 2K + Cl2
Электролиз растворов солей металлов, стоящих в ряду напряжения после водорода:
2HgSO4 + 2H2O = 2Hg + О2 + 2H2SO4
1) на катоде: Hg2+ + 2e = Hg°
2) на аноде: 2Н2О – 4е = О2 + 4Н+
Электролиз раствора сульфата натрия
1) на катоде: 2H2O + 2e = H2 + 2OH–
2) на аноде: 2H2O – 4e = O2 + 4H+
3) Составлено общее уравнение электролиза:
2H2O = 2H2 + O2
до водорода:
СаI2 + 2Н2О = Н2 + I2 + Са(ОН)2
1) на катоде: 2Н2О + 2e = 2ОН + Н2
2) на аноде: 2I— — 2e = I2
Сравните свойства одноэлементных и кислородсодержащих анионов.
Химические реакции, возможные при электролизе сульфата хрома (III):
1)Сг3+ + e = Сг2+
2) Cr2+ + 2e = Сг°
3) Сг3+ + 3 e= Сг°
4) 2Н+ + 2e = Н2
Электролиз водных растворов солей карбоновых кислот:
2CH3COONa + 2H2O = CH3CH3 + 2CO2 + H2 + 2NaOH
Гидролиз
Пример взаимного гидролиза солей:
A12(SO4)3 + 3K2CO3 + 3H2O = 2A1(OH)3 + 3CO2 + 3K2SO4
Амфотерность
Амфотерные гидроксиды растворяются в водных растворах щелочей:
A1(OH)3 + 3KOH = K3[A1(OH)6]
A1(OH)3 + KOH = K[Al(OH)4]
реагируют с твердыми щелочами при сплавлении:
Al(OH)3 + KOH KAlO2 + 2H2O
Амфотерные металлы реагируют с водными растворами щелочей:
Al + NaOH + 3H2O = Na[Al(OH)4] + 3/2 H2
Продукт сплавления амфотерного гидроксида со щелочью легко разлагается водой:
KAlO2 + 2H2O = KOH + Al(OH)3¯
Комплексные гидроксиды реагируют с кислотами:
K[Al(OH)4] + HCl =KCl + Al(OH)3¯ + H2O
Бинарные соединения
Способ получения:
СаО + 3С = СаС2 + СО
Бинарные соединения реагируют с кислотами:
Al2S3 + 3H2SO4 := Al2(SO4)3 + 3H2S
Mg3N2 + 8HNO3 = Mg(NO3)2 + 2NH4NO3
и водой:
A14C3 + 12Н2О = 4А1(ОН)3 + ЗСН4
PCl3 + H2O = 3H3PO3 + 3HCl
НЕОРГАНИЧЕСКАЯ ХИМИЯ
Азот
Азотная кислота является сильным окислителем:
окисляют неметаллы:
ЗР + 5HNO3 + 2Н2О = Н3РО4 + 5NO
P + 5HNO3 = H3PO4 + 5NO2 + H2O
металлы:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 = 4Mg(NO3)2 + N2O + 5H2O
оксиды переходных металлов в промежуточных степенях окисления:
3Cu2O + 14HNO3 = 6Cu(NO3)2 + 2NO+ 7H2O (возможно выделение NО2)
оксиды азота также проявляют окислительные свойства:
5N2O + 2P = 5N, + P2O
но по отношению к кислороду являются восстановителями:
2NO + O2 = 2NO2
Азот реагирует с некоторыми простыми веществами:
N2+3H2= 2NH3
N2 + O2 = 2NO
3Mg + N2 = Mg3N2
Галогены
обычно проявляют окислительные свойства:
PH3 + 4Br2 + 4Н2О = Н3РО4 + 8НВг
2P + 5Cl2 = 2PCl5
2P + 3PCl5 = 5PCl3
PH3 + 4Br2 + 4H2O = H3PO4 + 8HBr
Cl2 + H2 = 2HCl
2HCl + F2 = 2HF + Cl2
2NH3 + 3Br2 = N2 + 6HBr
Галогены в растворах щелочей диспропорционируют при комнатной температуре:
Cl2 + 2KOH = KCl + H2O + KClO
и при нагревании:
Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
Окислительные свойства перманганата калия:
5Н3РО3 + 2КМnО4 + 3H2SO4 = K2SO4 + 2MnSO4 + 5Н3РО4 + ЗН2О
2NH3 + 2KMnO4 = N2 + 2MnO2 + 2KOH + 2H2O
Сера
реагирует с простыми веществами:
S + O2 = SO2
3S + 2А1 = A12S3
оксид серы (IV) может быть доокислен кислородом:
2SO2 + O2 = 2SO3
2SO2 + O2 + 2H2O = 2H2SO4
и выступать в роли окислителя:
SO2 + 2H2S = 3S + 2H2O
Концентрированная серная кислота проявляет окислительные свойства:
Cu + H2SO4 = CuSO4 + SO2 +2H2O
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
Фосфор
получение фосфора:
Са3(Р04)2 + 5С + 3SiO2 = 3CaSiO3 + 5СО + 2Р
Металлы
реагируют с галогенами:
2Fe + 3Cl2 = 2FeCl3
Алюминий без оксидной пленки растворяется в воде:
Al (без оксидной пленки) + Н2О = Al(OH)3 + 3/2 H2
методы получения металлов:
Fe2O3 + CO = 2FeO + CO2
FeO + CO = Fe + CO2
CuO + H2 = Cu + H2O
Гидроксид железа (II) может быть легко доокислен пероксидом водорода:
2Fe(OH)2 + H2O2 = 2Fe(OH)3
обжиг пирита:
2FeS2 + O2 = Fe2O3 + 4SO2
ОРГАНИЧЕСКАЯ ХИМИЯ
Горение органических веществ
2С10Н22 + 31O2 = 20CО2 + 22H2О
Алканы
Методы получения алканов из простых веществ:
С + 2H2 = CH4
сплавлением солей щелочных металлов с щелочами:
СН3СООК + КОН ® СН4 + К2СО3
Химические свойства алканов — промышленное окисление метана:
CH4 + O2 = CH2O + H2O
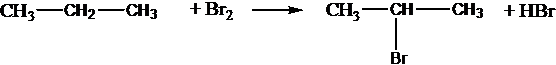
Взаимодействие алканов с галогенами:
С2Н6 + Сl2 С2Н5Сl + НСl
Изомеризация алканов:
Галогеналканы
Реакция со спиртовыми растворами щелочей:
С6Н5-СНВг-СН3 + КОН  С6Н5СН=СН2 + КВг + Н2О
С6Н5СН=СН2 + КВг + Н2О
с водными растворами щелочей:
С6Н5-СНВг-СН3 + КОН (водн.) ® С6Н5-СНОН-СН3 + KBr
C6H5Br + KOH ® C6H5OH + KBr
По правилу Зайцева водород отщепляется от наименее гидрированного атома
Из дигалогеналканов можно получить алкины:
Реакция Вюрца:
Алкены
Присоединяют водород:
присоединяют галогены:
присоединяют галогенводороды:
присоединят воду:
СН2=СН2 + Н2О ® СН3СН2ОН
С водным раствором перманганата калия без нагревания образуют гликоли (двухатомные спирты)
ЗС6Н5СН=СН2 + 2КМnО4 + 4Н2О ® ЗС6Н5СН(ОН)-СН2ОН + MnO2¯ + 2KOH
Алкины
промышленный способ получения ацетилена
2СН4 ® С2Н2 + ЗН2
карбидный способ получения ацетилена:
CaC2 + 2H2O = Ca(OH)2 + C2H2
реакция Кучерова — альдегид можно получить только из ацетилена:
С2Н2 + Н2О СН3СНО
Реакция алкинов с концевой тройной связью с аммиачным раствором оксида серебра:
2CH3-CH2-CºCH + Ag2O 2CH3-CH2-CºCAg +H2O
использование полученных продуктов в органическом синтезе:
CH3-CH2-CºCAg + C2H5Br ® CH3-CH2-CºC-C2H5 + AgBr
Бензол и его производные
Получение бензола из алкенов:
из ацетилена:
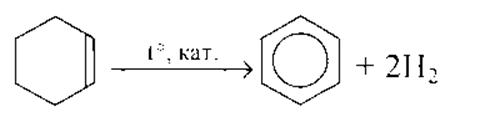
3C2H2 C6H6
Нитрование бензола и его производных в присутствие серной кислоты
C6H6 + HNO3 ® C6H5-NO2 + H2O
карбоксильная группа является ориентантом второго рода
реакция бензола и его производных с галогенами:
C6H6 + Cl2 C6H5Cl + HCl
С6Н5С2Н5 + Вг2 С6Н5-СНВг-СН3 + НВг
галогеналканами:
C6H6 + С2Н5С1 C6H5C2H5 + НС1
алкенами:
C6H6 + CH2=CH-CH3 ® C6H5-CH(CH3)2
Окисление бензола перманганатом калия в присутствии серной кислоты при нагревании:
5C6H5-CH3 + 6KMnO4 + 9H2SO4 = 5C6H5-COOH + 3K2SO4 + 6MnSO4 + 14H2O
Спирты
Промышленный способ получения метанола:
CO + 2H2 = CH3OH
при нагревании с серной кислотой в зависимости от условий могут образовываться простые эфиры:
2С2Н5OH C2Н5ОС2Н5 + Н2О
или алкены:
2С2Н5OH CH2=CH2 + H2O
спирты реагируют с щелочными металлами:
С2Н5OH + Na ® C2H5ONa + ½ H2
с галогенводородами:
СН3СН2ОН + НСl ® CH3CH2Cl + H2O
с оксидом меди (II):
СН3СН2ОН + СuO ® CH3CHO + Cu + H2O
более сильная кислота вытесняет более слабые из их солей:
C2H5ONa + HCl ® C2H5OH + NaCl
при нагревании смеси спиртов с серной кислотой образуются несимметричные простые эфиры:
Альдегиды
Образуют с аммиачным раствором оксида серебра серебряное зеркало:
CH3CHO + Ag2O CH3COONH4 + 2Ag
реагируют со свежеосажденным гидроксидом меди (II):
CH3CHO + 2Cu(OH)2 ® CH3COOH + 2CuOH + H2O
могут быть восстановлены до спиртов:
CH3CHO + H2 ® CH3CH2OH
окисляются перманганатом калия:
ЗСН3СНО + 2КМnО4® 2СН3СООК + СН3СООН + 2МnО2 + Н2О
Амины
можно получить восстановлением нитросоединений в присутствии катализатора:
C6H5-NO2 + 3H2 = C6H5-NH2 + 2H2O
реагируют с кислотами:
C6H5-NH2 + HC1 =[C6H5-NH3]C1
Углеводы
Глюкозу можно получить гидролизом крахмала или целлюлозы:
(С6Н10О5)n + n H2O = nC6H12O6
Для глюкозы характерно спиртовое брожение:
C6H12O6 ® 2C2H5OH + 2CO2
молочнокислое брожение:
C6H12O6 ® 2СН3СН(ОН)СООН
реакция серебряного зеркала:
C6H12O6+Ag2O 2Ag¯+C6H12O7
Аминокислоты
Аминокислоты реагируют как с кислотами:
H2N-CH-COOH+HCl ® Cl— H3N+-CH-COOH
так и c щелочами:
H2N-CH-COOH+NaOH ® H2N-CH-COONa+H2O
соли аминокислот также способны участвовать в реакциях обмена в водном растворе:
Cl— H3N+-CH-COOH+NaOH ® H2N-CH-COOH +NaCl + H2O
Cl— H3N+-CH-COOH+2NaOH ® H2N-CH-COONa +NaCl + 2H2O
H2N-CH-COONa+HCl ® H2N-CH-COOH +NaCl
H2N-CH-COONa+2HCl ® Cl— H3N+-CH-COOH +NaCl