Применение веществ в быту и промышленности. ЕГЭ по химии.
Ниже представлены вещества, применение которых на ЕГЭ по химии спрашивается наиболее часто
| Нитрат натрия Нитрат калия Нитрат аммония |
Азотсодержащие удобрения (селитры). |
| Фосфат кальция Гидрофосфат кальция Суперфосфат |
Фосфорные удобрения |
| Оксид кремния (IV) | Производство керамических изделий. |
| Пальмитат натрия/калия Стеарат натрия/калия |
Мыла Натриевые соли высших карбоновых кислот – твердые мыла, а калиевые соли высших карбоновых кислот – жидкие мыла. |
| Сера | Используется при производстве резины. Для этого серу нагревают (вулканизируют) с каучуком. |
| Гидрокарбонат натрия. | Твердое вещество, использующееся в качестве разрыхлителя теста, а также в качестве чистящего средства. |
| Карбонат аммония | Используется как разрыхлитель теста благодаря тому, что при нагревании образует газообразные продукты разложения в соответствии с уравнением: (NH4)2CO3 => 2NH3 + CO2 + H2O |
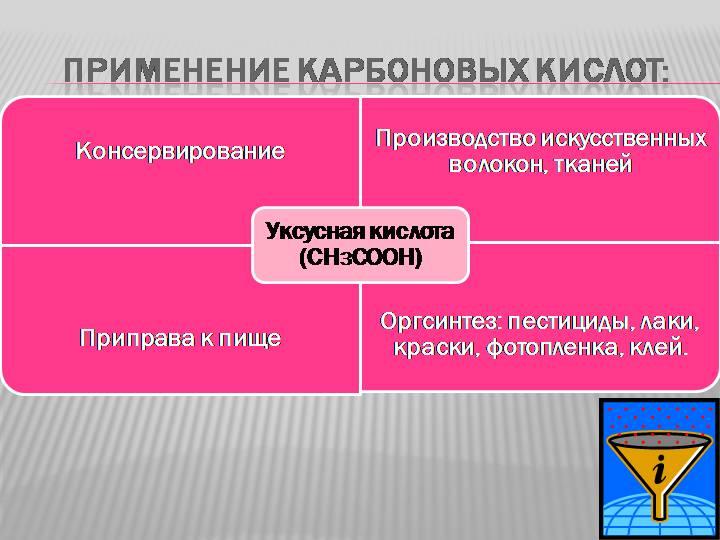
| Этановая (уксусная) кислота | Используется для консервирования овощей. Концентрированные растворы вызывают ожоги. |
| Активированный уголь | Твердое вещество черного цвета используется в качестве поглотителя (адсорбента) в фильтрах, а также как лекарственное средство при различных видах отравлений. |
| Этанол (этиловый спирт). C2H5OH |
Основной компонент алкогольных напитков, может быть использован в качестве топлива. Жидкость со специфическим запахом. |
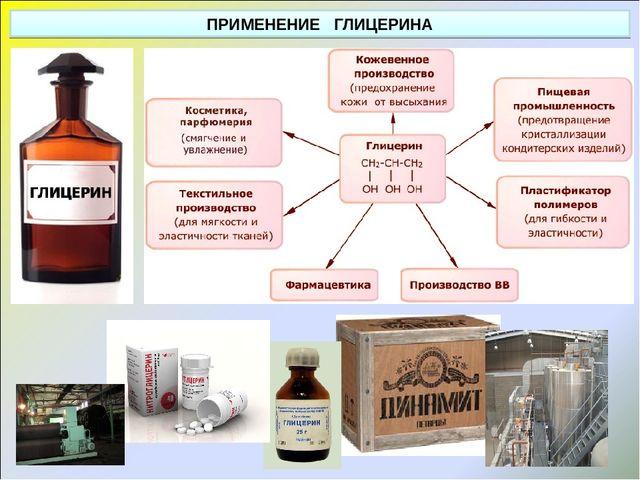
| Глицерин | Используется в парфюмерии и пищевой промышленности. |
| Ацетон | Распространенный растворитель. |
| Тетрахлорид углерода CCl4 | Растворитель. |
| Аммиак | Сырье для получения удобрений (нитратов калия, натрия, аммония). Сырье для получения азотной кислоты. |
| Аммиак раствор | Используется как компонент стеклоочистительных жидкостей, жидкость с резким запахом. В аптечке – нашатырный спирт, применяется для приведения в чувство человека, потерявшего сознание. |
| Озон O3 | Дезинфекция (очистка) воды. |
| Хлор Cl2 | Дезинфекция (очистка) воды. |
| Ацетилен C2H2 | Используется для сварки и резки металла благодаря тому, что при горении ацетилена развивается крайне высокая температура – около 3000 оС |
| Метан | Основной компонент природного газа. Горючее для газовых плит. |
| Лимонная кислота | Используется для удаления накипи с внутренней поверхности чайника. |
| Пероксид водорода | Используется в качестве антисептика (дезинфицирующего средства) при обработке небольших ран и порезов. |
| Хлоропрен (2-хлорбутадиен-1,3) Изопрен (2-метилбутадиен-1,3) Бутадиен (дивинил) |
Сырье для производства каучука. |
| Йод | Спиртовой раствор данного вещества используется для дезинфекции мелких порезов и царапин. |
| Анилин | Производство красителей |
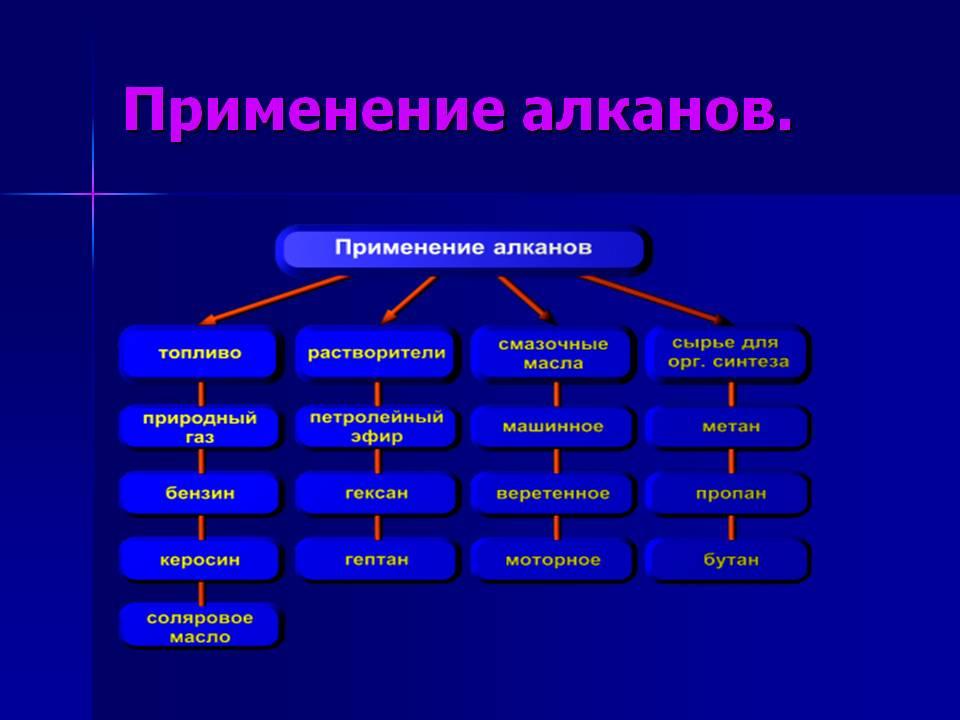
Применение алканов
Содержание
- 1 Применение алканов
- 1.1 Применение в промышленности
- 1.2 Применение в медицине и фармации
- 2 Значение алканов
Предельные углеводороды с общей формулой CnH2n+2, основным источником которых служат нефть, газ и каменный уголь, являются сырьевой базой для химической промышленности и основными природным источником энергии.
Применение алканов
Первоначально насыщенные углеводороды использовались как топливо — в результате горения высвобождается энергия:
CnH2n+2 + O2→CO2 + H2O +Q
Области применения алканов связаны с их физико-химическими свойствами:
- Газообразные алканы (метан, пропан и бутан). Горят бледно-голубым или бесцветным пламенем, при этом выделяется большое количество тепла. Применяются для бытовых нужд – как топливо в газовых плитах, зажигалках и газовых баллончиках для туристических горелок. В промышленных объемах — как топливо для газовых электростанций, вырабатывающих тепло и электроэнергию. Метан как часть природного газа — один из лучших природных субстратов, используемых в биотехнологии.
- Жидкие алканы. Являются основной частью горючего для двигателей внутреннего сгорания – от мотоциклетных до ракетных. Изомеры линейных алканов применяют как добавку для повышения качества топлива. Смесь предельных углеводородов с длиной цепочки не более 15 атомов углерода — вазелиновое масло применяют в косметологии и медицине. В промышленности применяют гудрон (остаточный продукт после переработки нефти) для производства строительных кровельных и дорожных битумов и кокса.
- Твердые алканы. Смесь жидких и твердых углеводородов с цепочкой до 25 атомов углерода – вазелин — густая масса, используется в медицине и косметических целях. Смесь алканов С20 -С35 называют парафином и используют для производства свечей, обработки упаковочных материалов и спичек. Парафиновые углеводороды служат основным сырьем для биосинтеза.
Это интересно:
Применение алкенов
Циклические углеводороды
Применение в промышленности
Парафины являются основой для производства целого ряда веществ:
- азотной кислоты HNO3;
- насыщенных одноатомных cпиртов СnH2n+1OH;
- сажа (аморфный углерод) — для типографской краски и резины;
- галогензамещенных растворителей и хладонов;
- алкенов;
- альдегидов, которые используются в производстве органических кислот и пластмасс;
- как нефтехимическое сырье для производства ПАВ.
Алканы применяются при производстве синтетических моющих средств.
Исходными веществами для этого служат парафины фракции С41-С44 .
Применение в медицине и фармации
Смесь жидких и твердых парафинов с С < 25 (вазелин очищенный) – белая пластичная масса без вкуса и запаха, применяется:
- для обработки трещин на коже;
- в качестве основы лекарственных мазей;
- при проведении различных процедур (для смягчения поверхности кожи, когда ставят банки; смазывают наконечники клизмы и газоотводной трубки).
Парафин – смесь алканов С19-С35, твердое вещество кристаллического строения. Используется в расплавленном виде для тепловых процедур -наслаивания, аппликаций компрессов и ванн.
Парафин
Хлорэтан С2H5Сl – применяется как местный анестетик и для замораживания (жидкость быстро испаряется с поверхности, что сопровождается сильным местным охлаждением).
Йодоформ CHI3 – применяется как заменитель йода, поскольку является менее токсичным.
Фторотан C2HBrClF3 – наркотическое средство, применяется для наркоза.
Сводная таблица применения алканов
| Область применения | представитель CnH2n+2 | использование |
|
Промышленность |
газообразные до С4 | Топливо для бытовых целей;
сажа для производства резины и типографских красок; основа для органического синтеза и производства ПАВ. |
| жидкие С5-С15 | Горючее для двигателей внутреннего сгорания;
изомеры применяют для улучшения качества бензина; из гудрона делают битумы и кокс. |
|
| твердые С20-С35 | Изготовление свечей; для обработки упаковочных материалов и спичек. | |
|
Медицина и косметология |
вазелин (очищенный) | Обработка трещин на коже;
основа для лекарственных мазей; для медицинских процедур (обработка наконечников клизм и газоотводных трубок). |
| парафин | Для тепловых процедур. | |
| хлорэтан С2H5Сl | Для местной анестезии. | |
| йодоформ CHI3 | Аналог йода. | |
| фторотан C2HBrClF3 | Наркоз. |
Значение алканов
Предельные углеводороды применяются в пищевой и химической промышленности, в энергетике, косметологии и медицине.
Алканы служат растворителями и сырьем для производства лаков, красок, мазей. Их используют в качестве топлива и компонентов для различных битумов.
Химическое производство пластика, ПАВов и синтетических тканей использует в качестве сырья алканы.
С развитием технологий сферы применения насыщенных углеводородов расширяется.
Оценка статьи:
Загрузка…
Всего: 45 1–20 | 21–40 | 41–45
Добавить в вариант
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) в качестве отбеливателя
2) в качестве удобрения
3) в качестве топлива
4) в качестве растворителя
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Демонстрационная версия ЕГЭ—2020 по химии
Установите соответствие между веществом и основной областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) фосфорная кислота
Б) этилен
В) кислород
Г) бензол
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) производство пластмасс
2) энергетика
3) производство удобрений
4) металлургия
5) авиакосмическая промышленность
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) гидроксид натрия
Б) азотная кислота
В) угарный газ
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) омыление жиров
2) синтез аммиака
3) органический синтез
4) производство удобрений
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между веществом и областью его применения.
ВЕЩЕСТВО
A) аммиак
Б) озон
В) кислород
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) энергетика
2) производство удобрений
3) производство стали
4) очистка воды
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между веществом и основной областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) хлор
Б) азотная кислота
В) уксусная кислота
Г) карбонат кальция
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) производство пластмасс
2) производство стекла
3) производство удобрений
4) переработка нефти
5) пищевая промышленность
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между веществом и основной областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) углекислый газ
Б) метан
В) аммиак
Г) бензол
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) энергетика
2) пищевая промышленность
3) производство пластмасс
4) производство удобрений
5) металлургия
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
A) метан
Б) изопрен
В) этилен
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) получение капрона
2) в качестве топлива
3) получение каучука
4) получение пластмасс
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Демонстрационная версия ЕГЭ—2022 по химии, Демонстрационная версия ЕГЭ—2018 по химии, Демонстрационная версия ЕГЭ−2019 по химии
Установите соответствие между веществом и областью его применения.
ВЕЩЕСТВО
А) сода
Б) углерод
В) бензол
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) производство пластмасс
2) производство стекла
3) производство бензина
4) производство чугуна
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между веществом и областью его применения.
ВЕЩЕСТВО
А) водород
Б) кислород
В) бутадиен
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) производство пластмасс
2) производство бензола
3) выплавка стали
4) производство аммиака
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между веществом и областью его применения.
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) производство хлора
2) очистка воды
3) производство удобрений
4) производство пластмасс
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между веществом и областью его применения.
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) производство этанола
2) производство удобрений
3) обеззараживание воды
4) производство соды
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между веществом и областью его применения.
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) производство удобрений
2) производство мыла
3) производство стекла
4) производство жиров
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между веществом и основной областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) производство стекла
2) в качестве удобрения
3) в качестве растворителя
4) производство кислорода
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ОБЛАСТЬ ПРИМЕНЕНИЯ
А) производство удобрений
Б) производство фосфора
В) выплавка чугуна
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: ЕГЭ по химии 2020. Основная волна. Вариант 2
Установите соответствие между веществом и его применением: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) серная кислота
Б) сернистый газ
В) этиленгликоль
ПРИМЕНЕНИЕ
1) отбеливание бумаги
2) производство удобрений
3) производство пластмасс
4) производство водорода
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между названием вещества и основной областью его применения.
ВЕЩЕСТВО
А) озон
Б) оксид железа(II, III)
В) бензол
ОСНОВНАЯ ОБЛАСТЬ ПРИМЕНЕНИЯ
1) чёрная металлургия
2) очистка воды
3) производство бензина
4) производство каучука и синтетических волокон
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) карбонат кальция
Б) азот
В) оксид хрома(III)
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) создание инертной атмосферы
2) производство краски
3) производство стекла
4) производство соды
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) уксусная кислота
Б) оксид кремния
В) гидроксид натрия
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) производство пластмасс
2) металлургия
3) производство бумаги
4) производство цемента
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
A) аммиак
Б) метан
В) изопрен
Г) этилен
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) получение капрона
2) в качестве топлива
3) получение каучука
4) производство удобрений
5) получение пластмасс
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Демонстрационная версия ЕГЭ—2017 по химии
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) аммиак
Б) тетрахлорид углерода
В) ацетон
Г) этилен
ОБЛАСТЬ ПРИМЕНЕНИЯ
1) получение высокомолекулярных соединений
2) производство удобрений
3) в качестве растворителя
4) получение капрона
5) в качестве топлива
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: ЕГЭ по химии 2017. Досрочная волна
Всего: 45 1–20 | 21–40 | 41–45
Применение
веществ
Органика
Алканы
Алканы
используются при изготовлении каучука,
синтетических тканей, пластмасс,
поверхностно-активных веществ.
Пропан,
бутан – исп-ся в качестве заправки
баллонов для тушения пожаров в сжиженном
виде
Пропан-бутановая
— смесь в зажигалках
Пропан
— баллоны для дачи
Алканы-газы
– в качестве пропеллентов для изготовления
аэрозолей
СН4
– горючее для газовых плит
С5-С19
– бензин, керосин, смеси для розжига,
топливо
С20
и далее – свечи
С₁₈Н₃₈
до С₃₅Н₇₂ (парафин) — Изготовление
вазелинового масла (смесь жидких
алканов), вазелина (смесь жидких и твёрдых
алканов), свечей, моющих средств, лаков,
эмалей, мыла. В качестве пропитки спичек.
Использование при производстве
органических кислот. В качестве пропитки
упаковочной бумаги. Производство
жевательных резинок
Хлорпроизводные
алканов — изготовление спиртов, альдегидов,
кислот, РАСТВОРИТЕЛИ
Алкены
Циклоалканы
Циклопропан
– анестетик
Циклопентан
— добавка к моторному топливу для
повышения качества.
Циклогексан
используется для синтеза полупродуктов
при производстве синтетических волокон
нейлона и капрона, для получения
циклогексанола, циклогексанона,
адипиновой кислоты, а также в качестве
растворителя.
Алкины
Ацетилен
– газовая сварка, получение технического
карбона; прим-ся в автономных светильниках
и при производстве ракетного топлива
Алкадиены
Синтез
каучуков => пол-е резины, эбонита (не
проводит эл. ток, исп-ся для изоляции),
пвх и т.д.
Бензол
Применяется
в синтезе современных отхаркивающих
средств, препаратов для лечения кожных
заболеваний и других лекарств. В малых
количествах практически не обладает
токсичностью. Применяется в качестве
исходного реагента для синтеза. Он
эффективно растворяет смолы, масла,
жиры, йод и серу.
Бензойная
кислота
Снижает
активность ферментов в структуре
микробов их
Проявляет
дезинфицирующие свойства.
Это
качество нашло активное применение
бензойной кислоты и с успехом используется
для изготовления лекарственных составов
от кашля, отхаркивающих и антисептических
средств
Получение
фунгицид, применяющихся в сельском
хозяйстве для защиты разнообразных
культурных растений.
Консервавнт
Толуол
Лакокрасочные
материалы
Лаки
Краски
РАСТВОРИТЕЛЬ
полимеров
Спирты
—
В
органическом синтезе.
— Биотопливо,
добавки в топливо, ингредиент тормозной
жидкости, гидравлических жидкостей.
—
Растворители.
— Сырье для производства
ПАВ, полимеров, пестицидов, антифризов,
взрывчатых и отравляющих веществ,
бытовой химии.
— Душистые вещества
для парфюмерии. Входят в состав
косметических и медицинских средств.
—
Основа алкогольных напитков, растворитель
для эссенций; сахарозаменитель (маннит
и т.п.); краситель (лютеин), ароматизатор
(ментол).
Этиленгликоль
Производство
теплоносителей и охлаждающих жидкостей,
задачами которых является теплопередача
и теплоотвод соответственно. Производство
пластиковых бутылок. Производство
синтетических волокон. Производство
гидравлических жидкостей. Изготовление
лекарственных средств.
Глицерин
Фенол
АНТИСЕПТИКИ,
лекарства, заменители сахара, красители,
клеи, фенолформальдегидная смола
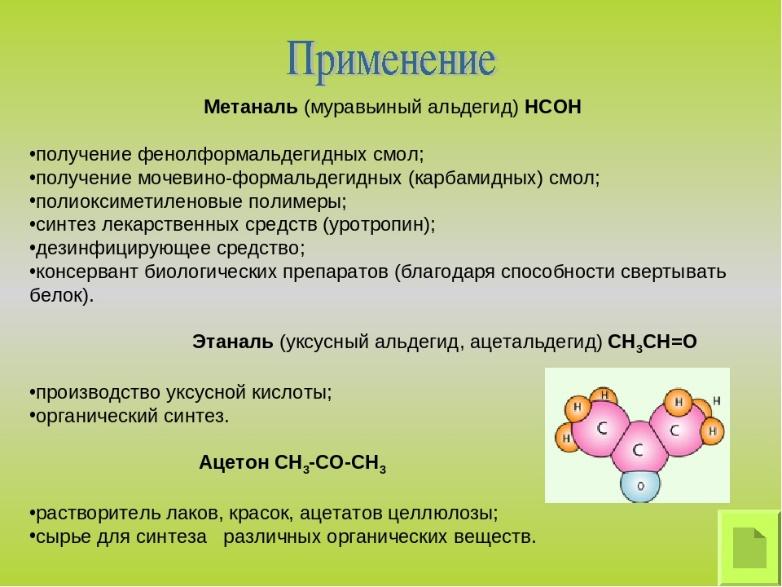
Альдегиды
и ацетон
Альдегиды
нашли широкое применение в качестве
сырья для синтеза различных продуктов.
Так, из формальдегида (крупнотоннажное
производство) получают различные смолы
(фенол-формальдегидные и т.д.), лекарственные
препараты (уротропин); ацетальдегид —
сырье для синтеза уксусной кислоты,
этанола, различных производных пиридина
и т.д. Многие альдегиды (масляный, коричный
и др.) используют в качестве ингредиентов
в парфюмерии
Карб
кислоты
Стеарат/пальмитат
натрия – мыло
Амины
Нитросоединения
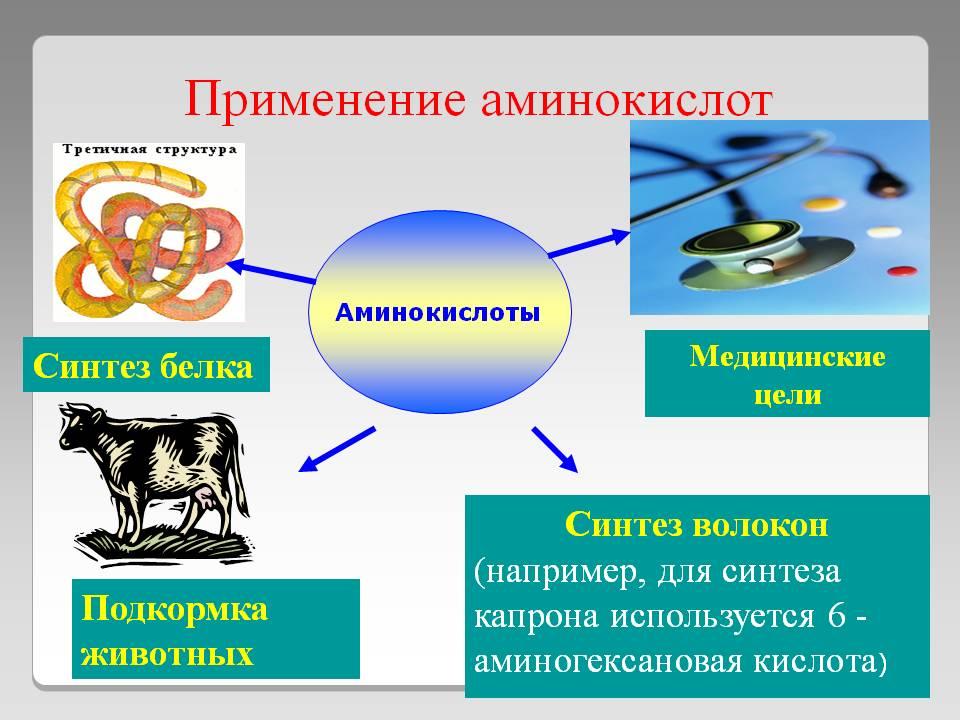
Аминокислоты
Жиры
Неорганика
Нитраты
– азотсодержащие удобрения
Фосфат,
гидрофосфат кальция; суперфосфат –
фосфорные удобрения
SiO2
– керамика, стекло
S
– резина
NaHCO3
– разрыхлитель теста, чистящее средство
(NH4)2CO3
– разрыхлитель теста
С
акт. – поглотитель в фильтрах и при
отравлениях
ССl4
– растворитель
NH3
– пол-е удобрений, пол-е азотной к-ты
NH3*H2O
– стеклоочистительные ж-ти и при потере
сознания
O3
– Дезинфекция воды; обнаруживание KI
с крахмалом
Cl2
– Дезинфекция воды; обнаруживание KI
с крахмалом
Лимонная
кислота – удвление накипи с внутр.
пов-ти чайника
H2O2
– антисептик для ран
I2
— антисептик для ран; обнар-е крахмала
Скачать материал

Скачать материал


- Сейчас обучается 47 человек из 23 регионов




- Сейчас обучается 111 человек из 49 регионов


Описание презентации по отдельным слайдам:
-
1 слайд
У меня достоинств много есть
“Людям я совсем как брат.
Много тысяч лет назад,
Освещая интерьер
Первобытных их пещер,
Я уже пылал в костре.
И украсить был я рад
Дам и рыцарей наряд,
Что блистали при дворе…
Если мягким быть решу,
То в тетради я пишу,
Такова друзья природа
Элемента
углерода -
-
3 слайд
ЦЕЛИ УРОКА:
установить строение атома углерода по его положению в ПС;
изучить аллотропные модификации углерода;
изучить химические свойства и применение углерода и его аллотропных модификаций -
4 слайд
Задачи урока:
познакомиться с различными формами существования углерода как простого вещества,
выяснить их физические свойства,
научиться раскрывать зависимость между составом, строением и свойствами аллотропных модификаций углерода, а также зависимость применения веществ от их свойств. -
5 слайд
«Химическая история»
Углерод является одним из первых химических элементов, который известен человеку. 3750 г. до н.э.
Углерод является одним из элементов, имя первооткрывателя которого неизвестно, неизвестно и то, какая из форм элементарного углерода – алмаз или графит – была открыта раньше. И то и другое случилось слишком давно, ещё до возникновения письма.В 1791 г. английский химик Теннант первым получил свободный углерод; он пропускал пары фосфора над прокаленным мелом, в результате чего образовывался фосфат кальция и углерод.
-
6 слайд
Углерод элемент миллионер
-
7 слайд
0,27%
45%
18%
В земной коре
в растительной клетке
В животной клетке.
В человеческом организме
10,5%
Элемент миллионер -
8 слайд
С +6 )2 )4
Строение атома
углерода -
9 слайд
Общая характеристика элемента
-
10 слайд
Аллотропные модификации углерода
-
11 слайд
a) лонсдейлит; б) алмаз; в) графит;
г) аморфный углерод; д) C60 (фуллерен);
е) графен; ж) однослойая нанотрубка -
12 слайд
Алмаз
Б…………й
П…………..й
Не проводит…..
П……… й
Самый т…………. й -
13 слайд
«Звезда Южной Африки»
«Эврика»
Бриллианты
(огранённые алмазы)
«Дрезденский
Зеленый
Бриллиант»
«Чёрный Орлов»
Алмаз
«Шах»
«Санси» -
14 слайд
Большая
императорская корона
Малая
императорская корона
Драгоценный камень- бриллиант -
15 слайд
Звезда ордена Св. Андрея Первозванного
Скипетр
императорский
Портретный алмаз -
16 слайд
Применение алмазов
-
17 слайд
Применение алмаза
Образив для режущих, точильных дисков
Сверла -
18 слайд
Применение алмаза
-
19 слайд
Используя алмаз можно получить лазерный луч большей мощности и в большем диапазоне длин волн света, нежели другие лазеры Рамана, существующие в настоящее время
Применение алмазов -
20 слайд
Мягкое вещество
…….цвета,
малая механическая прочность (неравноценные по прочности связи).
Э……..н и имеет…… блеск
……на ощупь
Графит -
21 слайд
Шахта по добыче графита
-
22 слайд
Применение графита
Стержни для карандашейСлово«карандаш»
происходит от тюркских слов «кара» (черный) и «таш» (камень).
Графитовые карандаши появились в XVIII веке.
Это было связано с открытием графитового месторождения в Камберленде (Англия).
В 1795 -
23 слайд
Применение графита
Смазка для трущихся поверхностей, работающих при очень высоких и очень низких температурах
Литол -
24 слайд
Применение графита
Пирографит – для изготовления искусственных клапанов сердцаКарбоникс- клапан для сердца
-
25 слайд
Применение графита
Электроды для электролизаЩетки из графита
-
26 слайд
Применение графита
Облицовка сопел ракетных двигателей -
27 слайд
Применение графита
Графитовые стержни-
замедлители нейтронов в ядерных реакторах -
28 слайд
Применение графита
Набивка из графита для уплотнения
Втулки из графита -
29 слайд
Произведения искусства из графита
-
30 слайд
Углеродная ткань из графита
Из них делают лечебные салфетки для осушения и очищения гнойных ран, с их помощью сшивают порванные сухожилия, -
31 слайд
Графитовые лопасти
для вакуумных насосов -
32 слайд
Сравнение свойств алмаза и графита
-
33 слайд
Сравнение свойств алмаза и графита
-
34 слайд
Аморфные модификации углерода
3.сажа
1.древесный уголь
2.активированный
уголь
4. кокс -
35 слайд
Активированный уголь
активированный
уголь обладает свойством адсорбции -
36 слайд
Древесный уголь
Получают разложением древесины
Углем рисовали еще в каменном веке. Росписи пещеры Альтамира в Испании, созданные 20 тыс. лет назад, выполнены охрой, мелом и углем
Росписи пещеры Альтамира -
37 слайд
Сажа
По строению сажа и древесный и активированный уголь – это тот же графит, но в состоянии тончайшего измельчения
Сажа
Древесный уголь -
38 слайд
Сажа
Применение сажи:
тушь для ресниц
крем для обуви
резина для колес.Самый чистый углерод – сажа:
CH4 → C + 2H2 (при 1000о С) -
39 слайд
Карбин получен искусственно
этот минерал на 99,99% состоит из углерода. Это мелкокристаллический
порошок чёрного цвета.
Построен из длинных цепочек атомов С, уложенных параллельно
друг другу, обладает полупроводниковыми свойствамиКарбин
Вприроде открыт позже в 1970 г. геофизиками Института Карнеги в метеоритном кратере Рис на территории ФРГ. -
40 слайд
электроника
космонавтика,
авиация
медицина
оптика
микроволновая и электрическая технология
Применение карбина -
41 слайд
Карбин обладает полупроводниковыми свойствами, под воздействием света его проводимость сильно увеличивается.
На этом свойстве основано первое практическое применение — в фотоэлементах.
КАРБИН -
42 слайд
Лонсдейлит
найден в метеоритах и получен искусственно;
его структура и свойства окончательно не установлены;
может содержать до
2000 атомов;
тверже алмаза.алмаз гексагональный
-
43 слайд
Графен
Новая аллотропная модификация – графен (полупрозрачное вещество, Это двухмерный кристалл, он очень прочный (слой в один атом во много раз прочнее, чем сталь) и обладает электропроводимостью, которую можно сопоставить со скоростью света. -
44 слайд
Графен
2011 год Нобелевская премия
Открыт в 2004 году
Андрей Гейм
Константин Новоселов -
45 слайд
Левитация графена
Электроны в графене, ведут себя так, будто они находятся в магнитном поле с индукцией 300 тесла, а это втрое больше, чем можно получить на экспериментальных установках -
46 слайд
Применение графена
Графеном покрыт тонкий светодиод этих лампочек
В Великобритании скоро можно будет купить энергосберегающие лампочки из графена -
47 слайд
Применение графена
Графен уже сейчас используется в протезах зубов, Благодаря высокому качеству материалов, импланты, сделанные из него, гораздо более долговечные и качественные
-
48 слайд
Нобелевский лауреат» графен позволил создать гибкие фотоэлементы
Применение графена -
49 слайд
Применение графена
Теннисные ракетки
Такой ракеткой играют лидеры мирового тенниса -
50 слайд
Фуллере́ны—молекулярные
соединения, представляющие
собой выпуклые замкнутые
многогранники, составленные
из четного числа трех координированных
атомов углерода
Фуллерен
По своей форме молекула С60 напоминает футбольный мяч, -
51 слайд
Своим названием эти
соединения обязаны
инженеру и дизайнеру
Ричарду Бакминстеру
Фуллеру, чьи сферические
конструкции построены
по этому принципу.Фуллерен
-
52 слайд
полупроводники;
антиоксиданты;
искусственные алмазы;
красители для копировальных машин;
запоминающая среда со сверхвысокой плотностью информации;
оптоэлектронные устройства
устройства.
Применение фуллеренов -
53 слайд
Сверхпроводимость фуллеренов используется
для создания препарата против ВИЧ-инфекции;
в косметологии;
как добавки для продуктов питания, увеличивающих сроки их хранения.
Применение фуллеренов -
54 слайд
Углеродные нанотрубки — протяжённые структуры, состоящие из свёрнутых гексагональных сеток с атомами углерода в узлах, открытые в 1991 году японским исследователем Иджимой.
Нанотрубки -
55 слайд
Нанотрубки
Первая нанотрубка была получена путём распыления графита в электрической дуге. Диаметр таких нитей не превышает нескольких нанометров, а длина от одного до нескольких микрон. -
56 слайд
Создание микроскопических весов.
Создания искусственных мускулов.
-
57 слайд
В 1999 году исследовательская группа во главе с Рэем Баухманом выступила с докладом о применении нанотрубок для создания искусственных мышц.
Применение нанотрубок -
58 слайд
Так как нанотрубки
теоретически, могут
Держать вес больше тонны
то их можно использовать
как трос для космического лифтаПрименение нанотрубок
-
59 слайд
Активированный уголь
Получают из древесного угля, пропуская через него пар.
Важнейшее свойство активированного угля-
Адсорбция-способность поглощать …..и ……вещества, удерживая их на своей поверхности
адсорбция -
60 слайд
Сырье для получения
активированного угля -
61 слайд
Применение
активированного угляСахарные фильтры
Катализатор в химических реакциях -
62 слайд
ЗЕЛИНСКИЙ
Николай Дмитриевич
(1861-1953) – изобретатель противогаза
Современный противогаз
Применение активированного угля
Противогаз Зелинского -
63 слайд
Применение активированного угля
Карболен (активированный уголь), применяется для абсорбции и выведения из организма различных токсинов -
64 слайд
Фильтры для очистки воды
-
65 слайд
Врубель М.А. «Портрет В.Я.Брюсова»
Кипренский О.А. «Портрет Алексея Томилова, участника Отечественной войны 1812 года»Федотов П.А.
«Молодой человек с бутербродом».
Этюд к картине «Завтрак аристократа»
Уголь, графит, тушь –
инструменты художника -
66 слайд
Кокс
Уголь (кокс) применяют как высококалорийное топливо в металлургии
Получают из каменного угля при температуре 1000 град. -
67 слайд
свойства – атомы С принимают четыре электрона, приобретают при этом степень окисления
свойства – атомы С отдают 2 или 4 электрона, приобретают при этом степени окисления
восстановитель?
окислитель?
Углерод
или
и -
68 слайд
Химические свойства
углерода
С+4
С0
С-4
С+2
Восстановитель
-4 ē
Окислитель
+4 ē
-2ē (О2, Н2О)
Cl2, F2, O2, HNO3
Me, H2 -
69 слайд
Окислительные свойства
1.С кислородом
а) С + O2 =
при избытке кислорода
б) 2С + О2 =
при недостатке кислорода
3. С водородом
С + 2H2 = только при высоких температурах и в присутствии катализаторов
. -
70 слайд
Восстановительные свойства
С оксидами металлов
2. С металлами
4Al + 3C =3. С + СО2 =
CuO + C = ? + CO↑
красный
порошок
чёрный
порошок -
-
72 слайд
Углерод
С
сталь
сельское хозяйство
топливо
медицина
типография
ювелирные изделия
адсорбент
резина
крем обуви
Применение -
73 слайд
Заполнить таблицу применения аллотропных
модификаций углерода -
74 слайд
Мой университет — www.moi-mummi.ru
Используемые источники
1. Габриелян О. С. Химия 9 класс. — М.: Дрофа, 2013.- 319 с.;
2. Рудзитис Г. Е. Химия 9 класс. – М.: Просвещение, 2010.-191 с.;
3. Чикалов В.И. Зажигая свет в алмазах.- Смоленск: Изд-во «Кристалл», 2003.;
4. alhimik.ru›Запоминалки;
5. https://www.kristallsmolensk.ru/;
6. http://rubuki.com/books/almazy-i-lyudi/ed32966;
7. Материал из википедии;
8. Фото из интернета.
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 155 157 материалов в базе
- Выберите категорию:
- Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Материал подходит для УМК
Другие материалы



- 18.06.2018
- 400
- 0

Рейтинг:
5 из 5
- 18.06.2018
- 2093
- 6




Вам будут интересны эти курсы:
-
Курс повышения квалификации «Химия окружающей среды»
-
Курс профессиональной переподготовки «Химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Основы туризма и гостеприимства»
-
Курс профессиональной переподготовки «Организация и предоставление туристских услуг»
-
Курс повышения квалификации «Нанотехнологии и наноматериалы в биологии. Нанобиотехнологическая продукция»
-
Курс повышения квалификации «Организация практики студентов в соответствии с требованиями ФГОС юридических направлений подготовки»
-
Курс повышения квалификации «Особенности подготовки к сдаче ОГЭ по химии в условиях реализации ФГОС ООО»
-
Курс профессиональной переподготовки «Биология и химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Финансы предприятия: актуальные аспекты в оценке стоимости бизнеса»
-
Курс повышения квалификации «Методы и инструменты современного моделирования»
-
Курс повышения квалификации «Современные образовательные технологии в преподавании химии с учетом ФГОС»
-
Курс профессиональной переподготовки «Уголовно-правовые дисциплины: теория и методика преподавания в образовательной организации»
-
Курс профессиональной переподготовки «Техническое сопровождение технологических процессов переработки нефти и газа»
-
Курс профессиональной переподготовки «Организация системы учета и мониторинга обращения с отходами производства и потребления»
№ п/п
Вещество
Применение
1
Сера
Для получения серной кислоты, вулканизации каучука (производство резины), изготовления горючих и светящихся составов, в сельском хозяйстве и в медицине.
2
Соляная кислота
Пищевая добавка Е507, которая применяется в процессе изготовления водочной продукции, а так же различных сиропов. В металлургии для очистки металла перед паянием или лужением. Входит в состав чистящих средств.
3
Серная кислота
Очистка нефтепродуктов от сернистых, непредельных органических соединений; Удаление окалины с проволоки, а также листов перед лужением и оцинкованием (разбавленная), для травления различных металлических поверхностей перед покрытием их хромом, медью, никелем. Средство при получении красителей и лекарственных веществ, для производства удобрений, этилового спирта, искусственного волокна, анилиновых красителей.
4
Сероводород и сульфиды
В производстве серной кислоты, в медицине, для проведения химического анализа катионов.
5
Сернистый газ (SO2) и сульфиты
В производстве серной кислоты, получение бумаги, для отбеливания шелковых и шерстяных тканей, для уничтожения микроорганизмов и грибковых заболеваний (окуривание виноградников, подвалов, добавление в вино). Используется SO2 в пищевой промышленности как консервирующее и антибактериальное вещество. Добавляют его в сиропы, вымачивают в нем свежие плоды. Консервированные овощные пюре и соки тоже содержат диоксид серы в качестве консервирующего агента.
6
Оксид серы (VI)
Для получения серной кислоты.
7
Соли серной кислоты
- Na2SO4 ∙ 10H2O (глауберова соль) – применяют в медицине в качестве слабительного средства, а безводный сульфат натрия – для производства соды и стекла.
- (NH4)2SO4 – азотное удобрение, K2SO4 – калийное удобрение.
- CaSO4 ∙ 2H2O (гипс) – в медицине и строительстве.
- MgSO4 (горькая соль) – в медицине в качестве слабительного средства.
- ВаSO4 (баритовая каша) – в медицине как рентгеноконтрастное вещество.
- Купоросы: CuSO4 ∙ 5H2O – используют для протравливания семян, для борьбы с болезнями растений; FeSO4 ∙ 7H2O – для приготовления чернил, минеральных красок; ZnSO4 ∙ 7H2O – для производства минеральных красок и в медицине (как антисептик).
8
Азот
Жидкий азот применяется для глубокого охлаждения, газообразный – для синтеза аммиака, для создания инертной атмосферы (лампы накаливания, сварка).
9
Азотная кислота
Производство азотных и комбинированных удобрений (натриевой, аммиачной, кальциевой и калиевой селитры, нитрофоса, нитрофоски). Взрывчатые вещества (тринитротолуола и др.), органических красителей. В металлургии — для растворения и травления металлов, а также для разделения золота и серебра.
10
Аммиак
Производство азотной кислоты, которая идет на производство удобрений (аммиачная селитра NH4NO3, мочевины (NH2)2CO, аммофос – смесь гидрофосфата (NH4)2HPO4 и дигидрофосфата аммония NH4H2PO4). В качестве дешевого хладагента в промышленных холодильных установках. Для получения синтетических волокон, например, найлона и капрона. При очистке и окрашивании хлопка, шерсти и шелка. Водный раствор аммиака (нашатырь) – в медицине.
11
Соли аммония
Производство взрывчатых веществ в смеси с порошками алюминия и угля при горных разработках, в качестве удобрений, при пайке металлов.
12
Оксиды азота
N2O – в медицине (наркоз), NO2 – производство азотной кислоты.
13
Водород
Экологически чистое топливо, для сварки и резки металлов, для получения металлов, аммиака, метанола, хлороводорода, гидрирования жидких жиров (в производстве маргарина).
14
Кислород
Реагент в органическом и неорганическом синтезе, для обеспечения дыхания в медицине.
15
Фосфор
Производство фосфорных удобрений (фосфоритной муки, простых и двойных суперфосфатов, комплексных азотно-фосфорных удобрений). Производство синтетических моющих средств, фосфатных стёкол, для обработки и крашения натуральных и синтетических волокон.
16
Оксид фосфора (V)
Получение ортофосфорной кислоты, в качестве осушителя (поглощает воду)
17
Ортофосфорная кислота
Производство фосфорных удобрений, в органическом синтезе.
18
Галогены
- Фтор — для получения смазочных веществ, выдерживающих высокую температуру, тефлона, фреонов и т.д.
- Хлор – в производстве соляной кислоты, хлорной извести, гипохлоритов и хлоратов, для отбеливания тканей и целлюлозы, идущей на изготовление бумаги, для стерилизации питьевой воды и обеззараживания сточных вод, полимеров.
- Бром — выработка различных лекарственных веществ, расителей, а также бромида серебра, использующегося в производстве фотоматериалов.
- Йод — в медицине в виде 10%-го раствора в этаноле в качестве антисептического и кровоостанавливающего средства. Йод входит в состав ряда фармацевтических препаратов.
19
Хлориды
- NaCl – для получения хлороводорода, натрия, хлора, едкого натра, водорода, в производстве соды, в пищевой промышленности медицине.
- KCl – в качестве калийного удобрения.
- ZnCl2 – для пропитки древесины от гниения и при пайке металлов, в медицине в качестве антисептика.
- BaCl2 — для борьбы с вредителями растений.
- CaCl2 — в качестве осушителя и в медицине.
- AlCl3 – катализатор в органическом синтезе.
- HgCl2 – для протравливания семян, дубления кожи в органическом синтезе.
20
Углерод
Алмазы применяются для обработки твёрдых материалов (бурение горных пород, металлообрабатывающий инструмент) в ювелирной промышленности (производство бриллиантов). Графит используется в производстве карандашей и электродов. Уголь и кокс используют в качестве топлива и для получения металлов, активированный уголь является адсорбентом.
21
Угарный газ
В качестве топлива, при получении метанола, металлов, фосгена (COCl2), в органическом синтезе.
22
Углекислый газ
В производстве напитков, соды, сахара, в огнетушителях, для хранения скоропортящихся продуктов («сухой лёд»), для получения угарного газа и участвует в процессе фотосинтеза.
23
Соли угольной кислоты
- Na2CO3 – кальцинированная сода и Na2CO3 ∙ 10Н2О – кристаллическая сода применяются в производстве бумаги, стекла, мыла, в быту.
- NaHCO3 – гидрокарбонат натрия (питьевая сода, двууглекислая сода) применяется в медицине, в пищевой и кондитерской промышленности.
- K2CO3 – поташ, применяется для производства мыла и специальных сортов стекла, в химической промышленности.
- CaCO3 – применяется для получения негашеной извести CaO, в строительстве, в архитектуре, для изготовления скульптур.
24
Кремний
Для получения легированных сталей, производства полупроводниковых приборов и изготовления кислотоустойчивой аппаратуры.
25
Оксид кремния (IV)
При производстве стекла, цемента, в строительстве, в производстве керамических изделий, химической посуды.
26
Натрий и калий
Получение пероксидов и амидов, сплав этих металлов используется в качестве теплоносителей в ядерных реакторах.
27
Бериллий
Получение сплавов
28
Медь
Для изготовления электропроводов и сплавов – бронзы, латуни, дюралюминия.
29
Серебро
Компонентов сплавов ювелирных изделий, монет, медалей, столовой и лабораторной посуды, для серебрения зеркал, как катализатор в органическом синтезе.
30
Цинк
Получение сплавов, для цинкования стали и чугуна в антикоррозионных целях.
31
Хром
Компонент стали (хромированная сталь), изготовление инструментов.
32
Железо
В качестве катализатора (губчатое железо), производство чугуна и сталей.
33
Алюминий
Используется для изготовления различных сплавов, применяемых в авиационной, машиностроительной, пищевой и электротехнической промышленности; для получения металлов методом алюмотермии (Cr, Mn, V, Ti и др.)
34
Ртуть
Производство люминесцентных и ртутных ламп, контрольно-измерительных приборов (термометров, манометров, барометров и т.д.), в медицине для изготовления мазей для лечения кожных заболеваний.
35
Гидроксид натрия
NaOH (едкий натр, каустическая сода, каустик) применяют для очистки нефтепродуктов, в производстве мыла, бумаги, в текстильной и химической промышленности.
36
Гидроксид кальция
В строительстве, производстве стекла, смягчитель воды.
37
Гидроксид магния
Очистка сахарных растворов, входит в состав зубной пасты.
38
Гидроксид алюминия
Для очистки воды, в медицине как обволакивающее и адсорбирующее вещество.
39
Алканы (метан, пропан)
В качестве топлива, как растворители и как сырьё для получения органических веществ.
40
Алкены (изопрен, этилен, пропилен)
Получение полимеров, фенола, ацетона, ацетальдегида, растворителей; для улучшения детонационных качеств топлива. Этилен – для ускорения созревания плодов растений.
41
Алкины
Ацетилен используется для резки и сварки металлов, в органическом синтезе: в производстве синтетических каучуков, поливинилхлорида, уксусной кислоты и растворителей.
42
Алкадиены
Производство полимеров (каучуков).
43
Бензол и его производные
Получение красителей, лекарственных веществ, взрывчатых веществ, ядохимикатов, пластмасс и синтетических волокон; используются в качестве растворителей; добавляются в бензины, повышая их октановое число.
44
Спирты
В качестве растворителей и в органическом синтезе. Этанол применяется для изготовления спиртных напитков, в медицине как дезинфицирующее средство, в качестве топлива. В промышленности – растворитель в производстве каучука, сложных эфиров, лаков, медикаментов. Метанол применяют для получения формальдегида, растворителей, в органическом синтезе.
45
Многоатомные спирты
Этиленгликоль применяется для приготовления охлаждающей жидкости (антифризов) для автомобилей, для получения растворителей и взрывчатых веществ. Глицерин – используется в медицине, парфюмерии, кожевенной промышленности, для получения взрывчатого вещества (тринитроглицерин), лакокрасочных материалов.
46
Фенолы
Применяют для получения фенолформальдегидной смолы, взрывчатых веществ, красителей, лекарственных препаратов, капрона, для дезинфекции (карболка).
47
Альдегиды и кетоны
Формальдегид – используется для получения фенолформальдегидной и карбамидной смол, в органическом синтезе; 40%-ный раствор (формалин) применяется в медицине, для консервирования биологических препаратов, в кожевенной промышленности и для протравливания семян.
Ацетальдегид – применяется для получения уксусной кислоты и для синтеза различных органических веществ.
Ацетон – в качестве растворителя лаков, красок.
48
Карбоновые кислоты
Муравьиная кислота – 1,25% -ный спиртовой раствор (муравьиный спирт) применяется в медицине, для производства сложных эфиров.
Уксусная кислота – в пищевой промышленности, для производства красителей, лекарств (аспирин), сложных эфиров, ацетатного волокна.
Стеариновая C17H35COOH и пальмитиновая C17H33COOH кислоты – входят в состав жиров. Натриевая и калиевая соли входят в состав мыла.
Щавелевая кислота – используется в кожевенной и текстильной промышленности.
Акриловая и метакриловая кислоты – для получения полимеров (органического стекла), волокон.
Бензойная кислота – в качестве консерванта в пищевой промышленности.
49
Сложные эфиры
Применяются в качестве растворителей лакокрасочных материалов, в парфюмерии, при производстве напитков.
50
Жиры
Жиры применяются в качестве продукта питания, для получения мыла, в косметической и фармацевтической промышленности. Гидрированные жиры применяются для изготовления маргарина.
51
Целлюлоза
Нитраты целлюлозы используются для производства бездымного пороха и лаков, ацетаты – в производстве ацетатного волокна, лаков, плёнок. Целлюлоза используется в производстве бумаги, волокон (ацетатного и вискозного), одежды, бинтов, ваты
52
Крахмал
Применяется для получения клея (декстриновый клей), накрахмаливания белья, в кондитерском производстве (получение патоки), в производстве спирта и вина.
53
Амины
Анилин и другие ароматические амины используются для получения красителей, лекарственных и взрывчатых веществ. Алифатические амины используются для получения лекарственных препаратов, пестицидов и пластмасс.
Углерод — это химический элемент, неметалл, расположенный в таблице Д. И. Менделеева в главной подгруппе IV группы, во 2-м периоде, имеет порядковый номер 6.
Агрегатное состояние углерода при нормальных условиях — твердое вещество с атомной кристаллической решеткой. Молекула углерода одноатомна. Химическая формула углерода — С.
Строение углерода
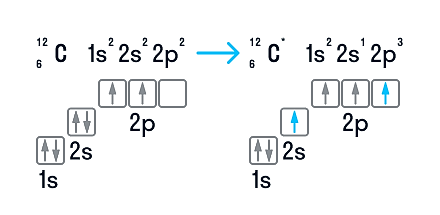
В нейтральном атоме углерода находится шесть электронов. Два из них расположены вблизи ядра и образуют первый слой (1s-состояние). Следующие четыре электрона образуют второй электронный слой. Два из четырех электронов находятся в 2s-состоянии, а два других — в 2р-состоянии. Нейтральный атом углерода в основном состоянии двухвалентен и имеет электронно-графическую конфигурацию 1s22s22р2.
Несмотря на наличие двух неспаренных электронов на внешнем уровне, в большинстве химических соединений углерод четырехвалентен. Возможность образовывать четыре связи углерод получает при переходе одного электрона из состояния 2s в 2р — происходит «распаривание», т. е. переход атома углерода из нейтрального состояния в возбужденное. Этому возбужденному состоянию атома углерода соответствует электронная конфигурация 1s22s12p3.
Возможные валентности: II, IV.
Возможные степени окисления: −4, 0, +2, +4.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Аллотропия углерода
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Выделяют два вида углерода в зависимости от образования модификаций:
-
Кристаллический углерод входит в состав твердых веществ (алмаз, графит, графен, фуллерен, карбин).
-
Аморфный углерод образует мягкие вещества (уголь, кокс, сажа).
Рассмотрим подробнее основные аллотропные модификации углерода, их физические свойства и применение.
Алмаз
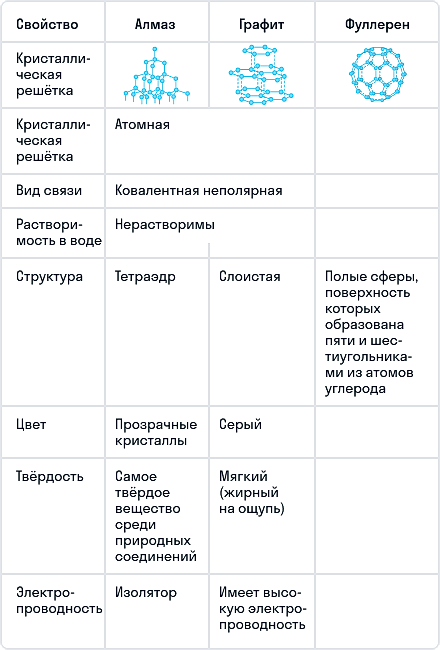
Алмаз — трехмерный полимер, бесцветное кристаллическое вещество, самый твердый природный минерал, имеет высокую теплопроводность. Его используют в промышленности для обработки различных твердых материалов, для бурения горных пород. Несмотря на то что алмаз твердый, в то же время он хрупкий. Получающийся при измельчении алмаза порошок применяют для шлифовки драгоценных камней. Хорошо отшлифованные прозрачные алмазы называют бриллиантами.
В кристаллической решетке атомы углерода связаны ковалентной связью. Расстояние между всеми атомами одинаковое, поэтому связи прочные по всем направлениям.
Одно из уникальных свойств алмазов — способность преломлять свет (люминесценция). При действии излучения алмазы начинают светиться разными цветами. Такая игра света, хороший показатель преломления и прозрачность делают этот драгоценный камень одним из самых дорогих. При этом необработанный алмаз не обладает такими качествами.
В промышленных масштабах алмазы получают при высоком давлении (тысячи МПа) и высоких температурах (1 500–3 000 °С). Процесс протекает в присутствии катализатора (например, Ni).
При нагревании алмаза до 1 000 °С и высоком давлении без доступа воздуха получают графит. При температуре 1 750 °С переход из алмаза в графит протекает существенно быстрее. При прокаливании в кислороде алмаз сгорает, образуя диоксид углерода.
Графит
Графит — темно-серое мягкое кристаллическое вещество со слабым металлическим блеском. Хорошо электро- и теплопроводен, стоек при нагревании в вакууме. Имеет слоистую структуру. На поверхности оставляет черные черты. На ощупь графит жирный и скользкий.
Графит термодинамически устойчив, поэтому в расчетах термодинамических величин он принимается в качестве стандартного состояния углерода.
На воздухе графит не загорается даже при сильном накаливании, но легко сгорает в чистом кислороде с образованием диоксида углерода.
При температуре 3 000 °С в электрических печах получают искусственный графит из лучших сортов каменного угля.
Графен
Графен представляет собой монослой графита. Впервые графен был получен ручным механическим отщеплением в лабораторных условиях, что не предполагает широкого производства.
В более крупных масштабах графен получают при помощи нагревания кремниевых пластин, верхний слой которых состоит из карбида кремния. Под действием высоких температур происходит отщепление атомов углерода, которые остаются на пластинке в виде графена, а кремний испаряется. Графен представляет собой тонкое и прочное вещество с высокой электропроводностью. В настоящее время он широко используется в микроэлектронике и автомобилестроении.
Карбин
Карбин — твердое черное вещество. Состоит из линейных полимерных цепей, которые соединены чередующимися одинарными и тройными связями в линейные цепочки: −С≡С−С≡С−С≡С−.
Впервые карбин был открыт в 60-х годах, но его существование не признавали до тех пор, пока его не обнаружили в природе — в метеоритном веществе.
Карбин — полупроводник, под действием света его проводимость сильно увеличивается. Переход в графит возможен при нагревании до 2 300 °С.
Карбин применяют в медицине для изготовления искусственных кровеносных сосудов.
Уголь
Уголь — мельчайшие кристаллики графита, полученные путем термического разложения углеродсодержащих соединений без доступа воздуха.
Угли имеют разные свойства в зависимости от веществ, из которых получены. Наиболее важные сорта угля — кокс, древесный уголь, сажа.
-
Кокс получается при нагревании каменного угля без доступа воздуха. Применяется в металлургии при выплавке металлов из руд.
-
Древесный уголь образуется при нагревании дерева без доступа воздуха. Благодаря пористому строению он обладает высокой адсорбционной способностью.
-
Сажа — очень мелкий графитовый кристаллический порошок. Образуется при сжигании углеводородов (природного газа, ацетилена, скипидара и др.) с ограниченным доступом воздуха.
Активные угли — пористые промышленные адсорбенты, получаемые из твердого топлива, дерева и продуктов его переработки. Применяются для поглощения паров летучих жидкостей из воздуха.
Сравнение основных аллотропных модификаций углерода
Нахождение углерода в природе
Согласно справочнику Дж. Эмсли «Элементы», углерод занимает 11-е место по распространенности в природе. Содержание углерода составляет 0,1% массы земной коры. Свободный углерод представлен в виде алмаза и графита.
Основная масса углерода существует в виде природных карбонатов кальция CaCO3 (мела, мрамора, известняка) и магния MgCO3, а также горючих ископаемых.
Доля углерода в составе горючих ископаемых
В атмосфере находится в виде диоксида углерода СО2 (~0,03%). В воде углерод содержится в составе растворимых гидрокарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2. Углерод входит в состав растений и животных (~20%).
Химические свойства углерода
Взаимодействие со фтором
Углерод обладает низкой реакционной способностью и из галогенов реагирует только со фтором:
С + 2F2 = CF4.
Взаимодействие с кислородом
При нагревании взаимодействует с кислородом, образуя оксиды СО и СО2:
2С + О2 = 2СО;
С + О2 = СО2.
Взаимодействие с другими неметаллами
Реагирует с серой:
С + 2S = CS2.
Не взаимодействует с азотом и фосфором.
Углерод взаимодействует с водородом и кремнием в присутствии никелевого катализатора:
C + Si = SiC;
C + 2H2 = CH4.
Взаимодействие с металлами
Способен взаимодействовать с металлами, образуя карбиды:
Ca + 2C = CaC2.
Взаимодействие с водой
При пропускании водяных паров через раскаленный уголь образуется оксид углерода (II) и водород:
C + H2O = CO + H2.
Восстановительные свойства
Углерод способен восстанавливать многие металлы из их оксидов (карботермия):
2ZnO + C = 2Zn + CO2.
Концентрированные серная и азотная кислоты при нагревании окисляют углерод до оксида углерода (IV):
C + 2H2SO4 = CO2 + 2SO2 + 2H2O;
C + 4HNO3 = CO2 + 4NO2 + 2H2O.
Вопросы для самопроверки
-
Что такое углерод? Дайте характеристику его положения в Периодической системе химических элементов Д. И. Менделеева.
-
Как распределяются электроны по энергетическим уровням в атоме углерода? Напишите электронную конфигурацию углерода.
-
Углерод является окислителем в реакции с:
-
Кислородом
-
Хлором
-
Водородом
-
Серой
-
-
Возможно ли взаимопревращение алмаза и графита? Объясните почему.
-
В виде каких соединений углерод находится в природе?
-
Для какого аллотропного видоизменения углерода характерна совместимость с тканями человеческого организма?
-
Опишите физические свойства графена и карбина.
-
Для чего используют карботермию?
-
Чем обусловлено наличие аллотропных видоизменений углерода?
-
В чем заключается различие между нейтральным состоянием атома углерода и возбужденным? Какие возможны степени окисления?
Красота химии — в том, что она изучает окружающий нас мир. Но это не всегда получается увидеть на школьных занятиях. Онлайн-уроки химии в Skysmart помогут не только подтянуть оценки и подготовиться к экзаменам, но и полюбить этот предмет, тесно связанный с окружающим нас миром.