Секвенирование на ЕГЭ
Материал по биологии
- Примеры заданий ЕГЭ на секвенирование
- Секвенирование по Сэнгеру
- Последовательность секвенирования
- Где применяется секвенирование?
Примеры заданий ЕГЭ на секвенирование
Секвенирование – это один из методов, встречающийся на ЕГЭ по биологии в заданиях линии 1 (таблица с пропуском названия метода), например:
Рассмотрите таблицу «Методы биологических исследований». Запишите в ответе пропущенный термин, обозначенный в таблице вопросительным знаком.
|
Методы |
Применение методов |
|
? |
Определение нуклеотидной последовательности ДНК или РНК |
|
Микроскопия |
Изучение особенностей фаз митоза |
Ответ: секвенирование / биохимический / молекулярногенетический / цитогенетический.
В этом году задания линии 1 могут содержать иллюстрации, мы оформили такое задание, использовав иллюстрации: https://vk.com/biochempublic?w=wall-202970776_1386
Секвенирование по Сэнгеру
Рассмотрим секвенирование по Сэнгеру (за разработку этого метода ученый получил Нобелевскую премию в 1977 году), а точнее его современную модификацию.
Чтобы знать структуру ДНК, достаточно узнать последовательность нуклеотидов в одной цепи, затем по принципу комплементарности можно легко установить и вторую цепь.
Что нужно знать, чтобы понимать принцип определения последовательности ДНК с помощью секвенирования?
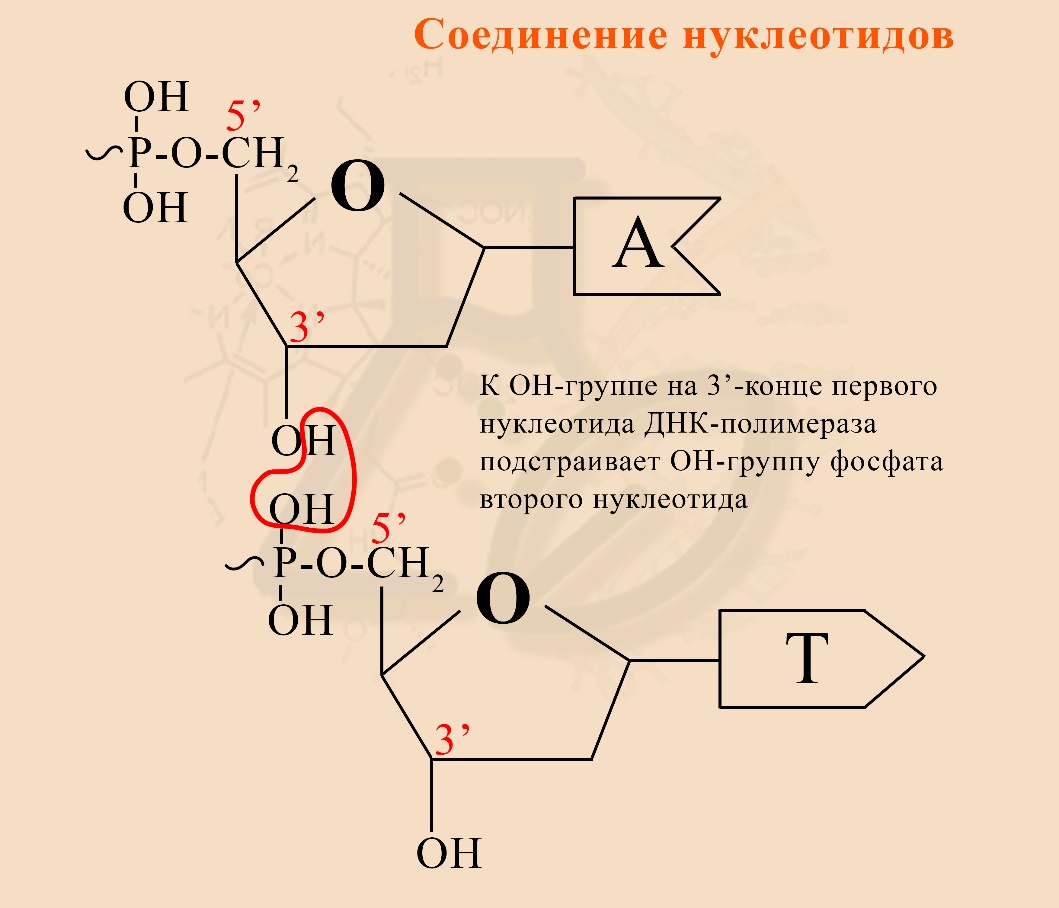
1) В состав ДНК входят нуклеотиды, они соединяются посредством взаимодействия ОН-группы дезоксирибозы одного нуклеотида и ОН-группы остатка фосфорной кислоты другого нуклеотида:
Секвенирование на ЕГЭ
Волнообразная связь от фосфата является макроэргической, так как цепи ДНК строятся не из обычных нуклеотидов, а из «активированных», содержащих не один, а три остатка фосфорной кислоты, о чем будет рассказано в другой статье.
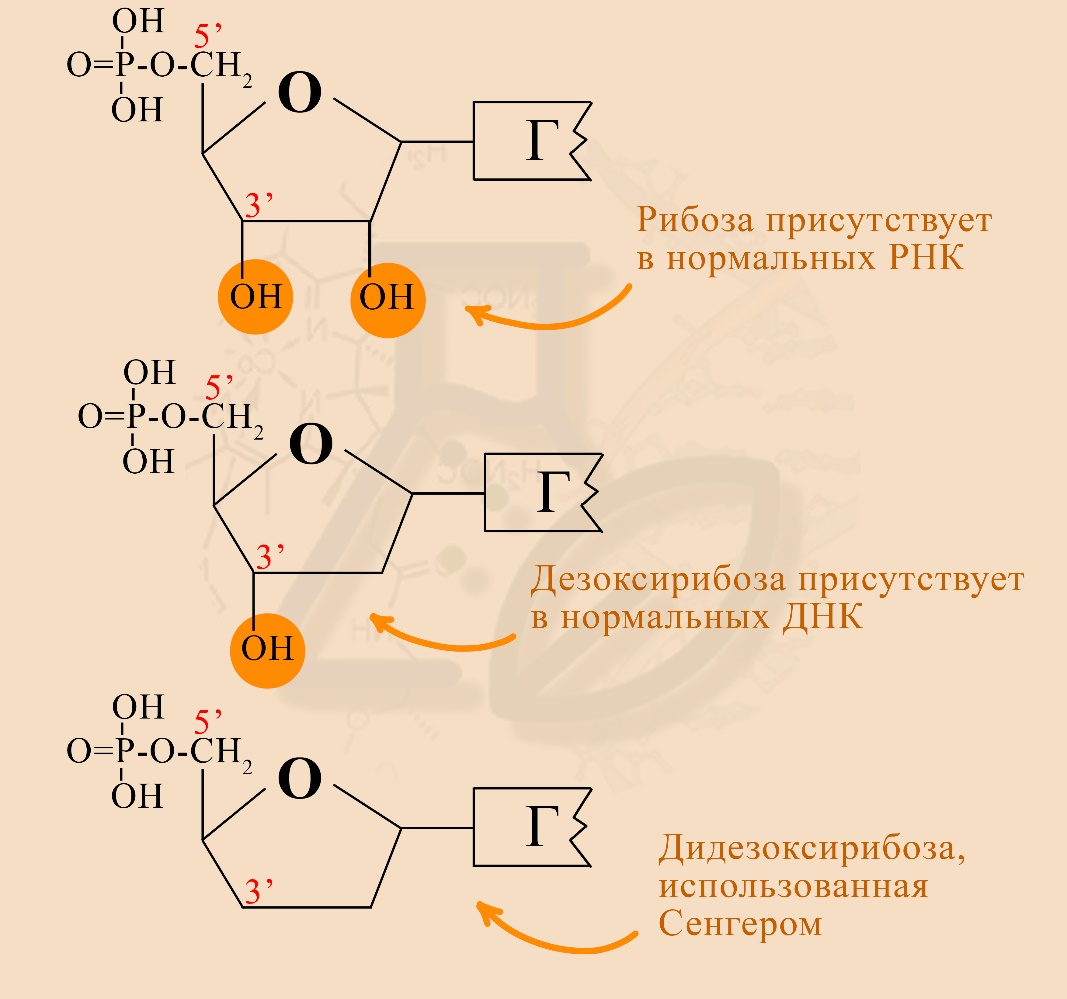
2) В своих экспериментах Сэнгер использовал нуклеотиды с дидезоксирибозой. Чтобы понять, чем она отличается от рибозы и дезоксирибозы, рассмотрите следующую иллюстрацию:
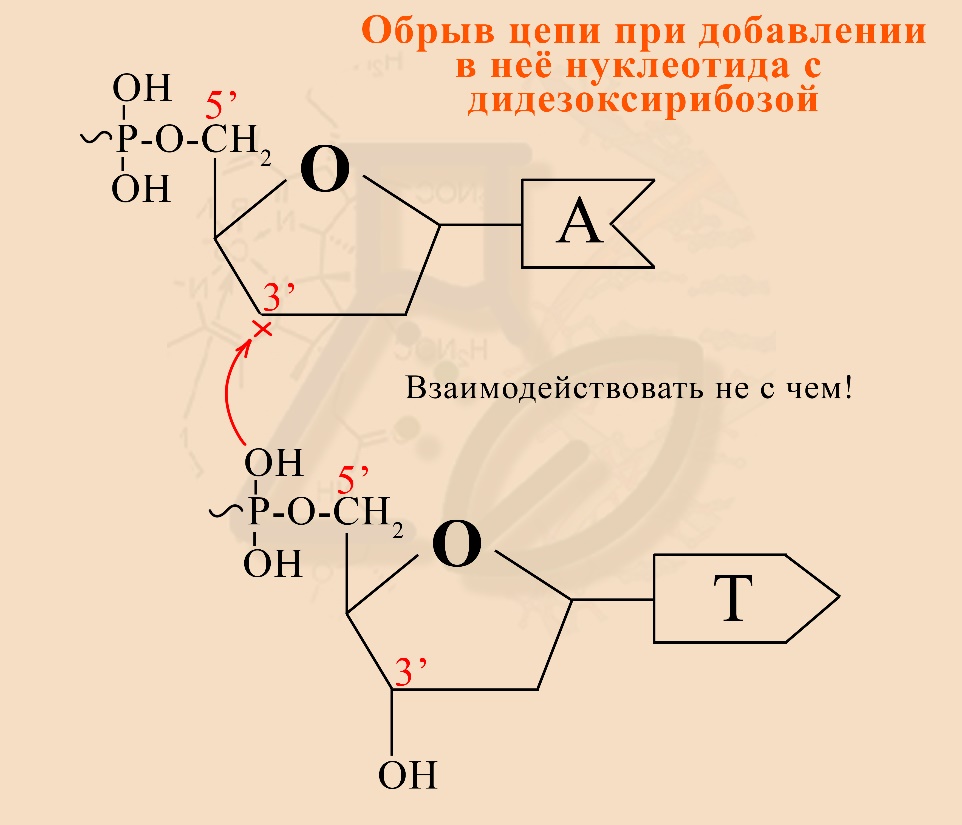
3) Использование дидезоксирибозы удобно тем, что на ней останавливается синтез нуклеотидной цепи, так как она не содержит ОН-группы на 3’-углероде сахара (рибоза, дезоксирибоза, дидезоксирибоза являются сахарами / моносахаридами / пентозами). Поэтому следующий нуклеотид не может присоединиться к цепи, оканчивающейся на дидезоксирибонуклеотид.
Образование динуклеотида
Последовательность секвенирования
Для определения последовательности ДНК секвенированием производят следующие действия (мы рассмотрим в упрощенном виде, достаточном для ЕГЭ по биологии).
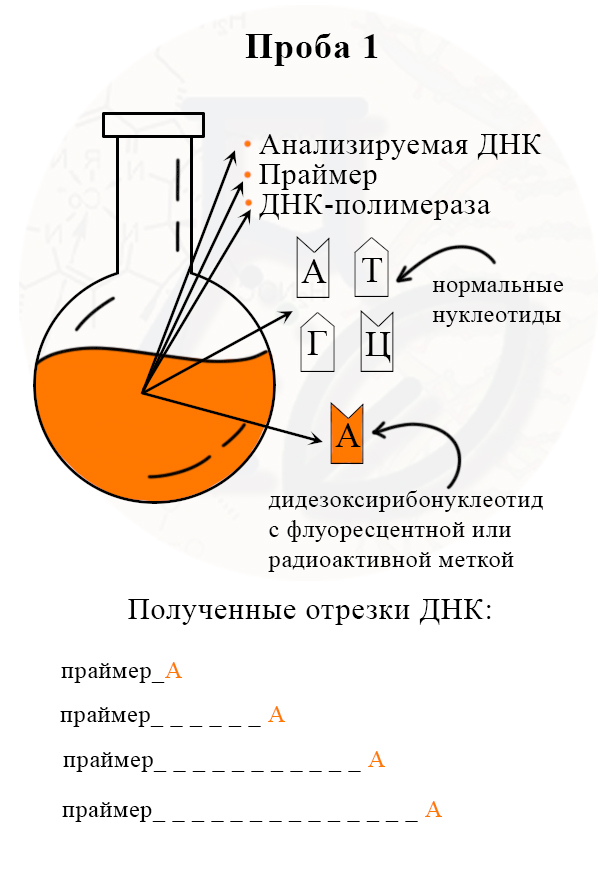
1) В колбу добавляют исследуемую ДНК (много копий), ДНК-полимеразу, праймер, все нормальные нуклеотиды и один вид дидезоксирибонуклеотидов, взятых в гораздо меньшем количестве, чем нормальных. Дидезоксирибонуклеотид помечают флуоресцентной меткой.
Почему добавляют много копий ДНК?
Дидезоксирибонуклеотид (далее сократим до «дд»), содержащий тимин, может комплиментарно присоединиться к первому нуклеотиды с аденином, или ко второму, или к пятому (представьте, сколько нуклеотидов с аденином может быть в одной ДНК, даже если мы используем последовательность около 1000 нуклеотидов – максимально длинный участок, который можно расшифровать методом Сэнгера). Исследователю нужно получить ВСЕ возможные варианты присоединения ддТ к растущей полинуклеотидной цепи.
Зачем нужна ДНК-полимераза?
Новая ДНК не может синтезироваться самостоятельно, каждый последующий нуклеотид присоединяется с помощью фермента ДНК-полимеразы.
Зачем нужен праймер?
ДНК-полимераза может присоединять следующие нуклеотиды только если уже имеется хотя бы несколько нуклеотидов новой цепи. Этими несколькими нуклеотидами и является праймер, он выполняет роль своего рода «затравки», к которой ДНК-полимераза присоединяет следующие нуклеотиды.
Почему дидезоксирибонуклеотидов гораздо меньше, чем нормальных нуклеотидов? Чтобы увеличить шанс образования цепей разной длинны. Если бы дидезоксирибонуклеотидов было много, то они бы достаточно быстро встраивались в цепь и обрывали дальнейший синтез полинуклеотида, а исследователь получил бы много одинаковых коротких фрагментов исследуемой ДНК и ни одного более длинного фрагмента.
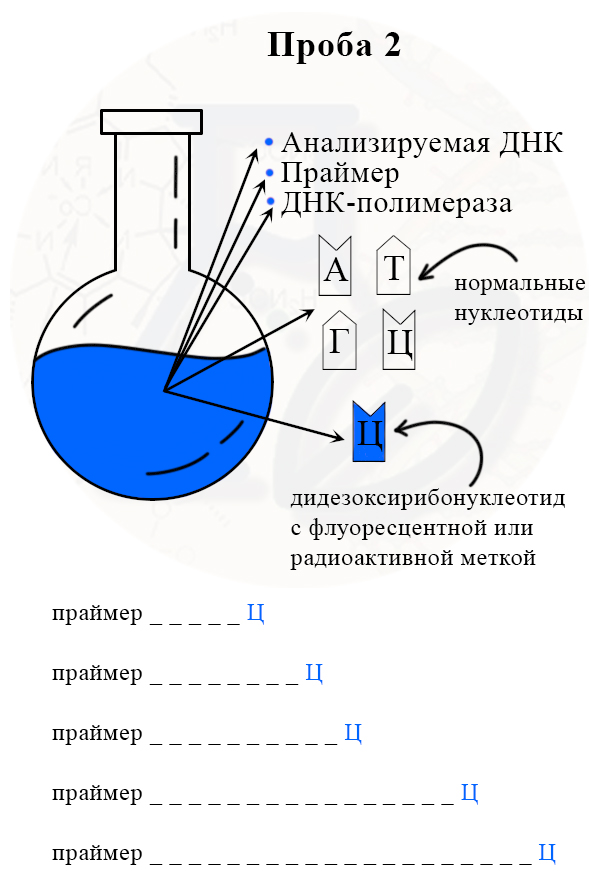
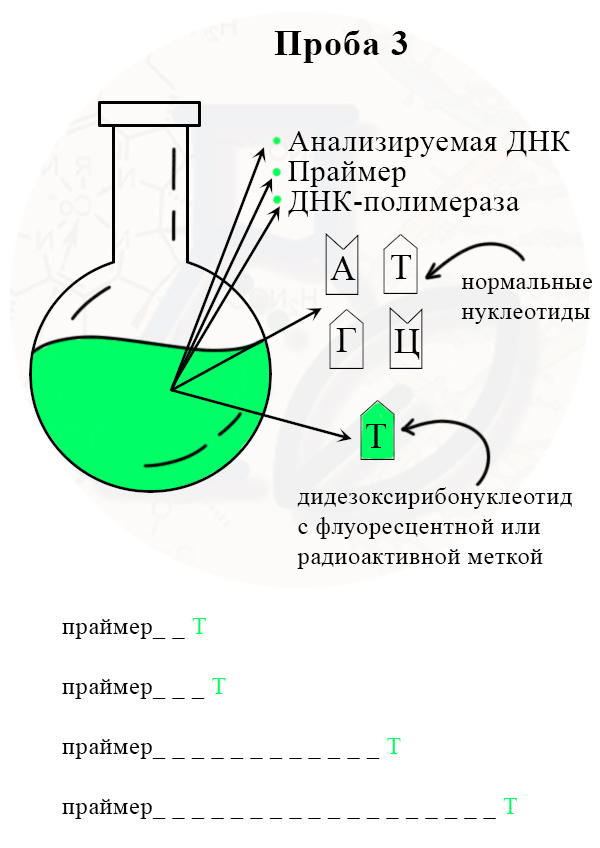
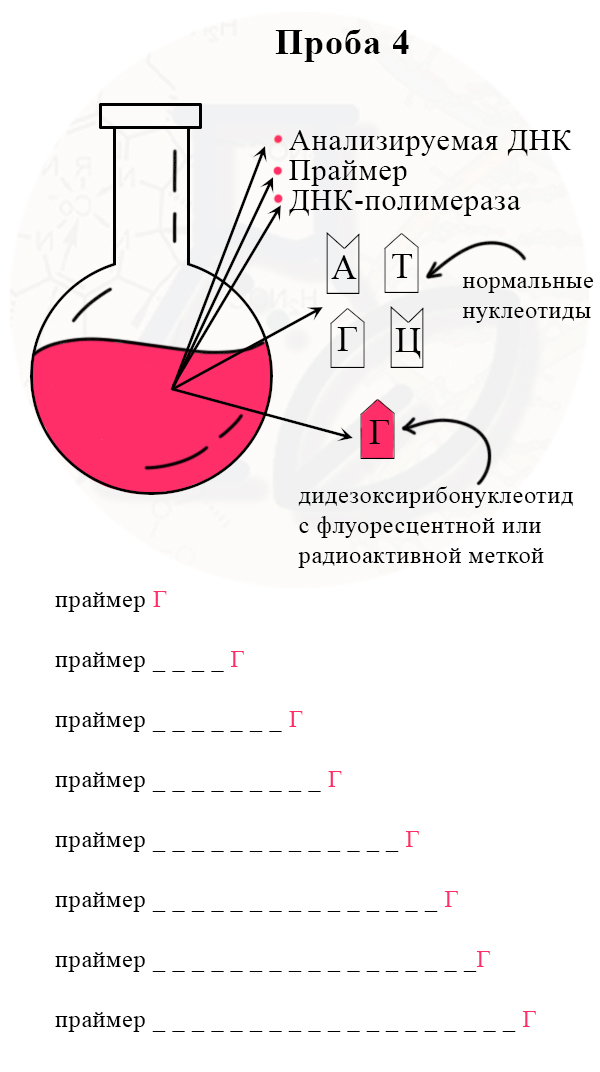
2) В итоге получаем четыре колбы, каждая из которых отличается только видом дидезоксирибонуклеотида.
3) В каждой колбе происходит синтез отрезков новой цепи ДНК на матрице исходной (исследуемой) цепи. При этом образуется множество вариантов этих отрезков, их разнообразие зависит от количества того или иного нуклеотида в исходной цепи ДНК.
Рассмотрим вариант, при котором исходная ДНК имела четыре нуклеотида с аденином. К этим неклеотидам могут комплиментарно присоединиться как нормальные нуклеотиды с тимином, так и ддТ, обрывающий цепь. Всего получится четыре варианта новых цепей:
Таким образом, в пробирках с разными видами дидезоксирибонуклеотидов, будут формироваться цепи разной длины.
Первая проба (пробирка или колба) с меченым дидезоксирибонуклеотидом А (аденином). Прочерками обозначены места неизвестных (не меченных) нуклеотидов.
Проба 2 с меченым дидезоксирибонуклеотидом Ц (цитозином)
Проба 3 с меченым дидезоксирибонуклеотидом Т (тимином)
Четвертая проба с меченым дидезоксирибонуклеотидом Г (гуанином)
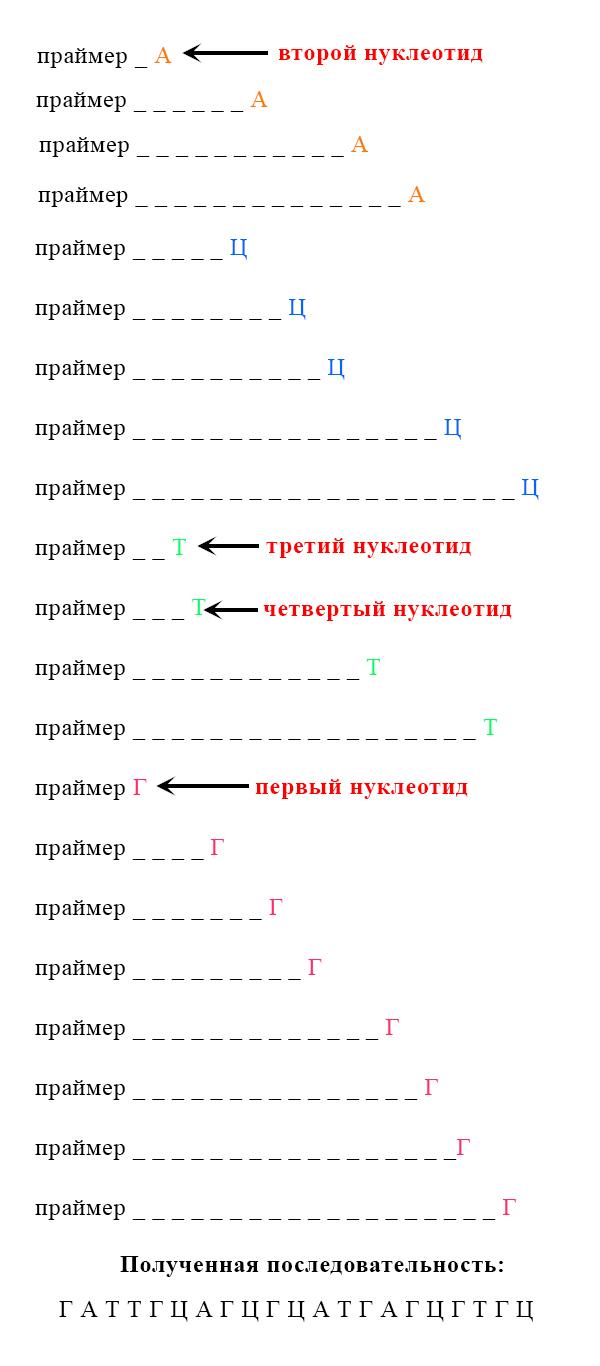
Если мы посмотрим на эти последовательности, то можем прийти к некоторым умозаключениям, позволяющим нам определить последовательность нуклеотидов в цепи (путем наложения):
4) Но на деле все немного сложнее. Далее полученные отрезки помещают в прибор, автоматически определяющий последовательность ДНК с помощью электрофореза. Через гель, используемый в электрофорезе (в него помещают исследуемые отрезки) проходит луч лазера, который заставляет флуоресцировать меченные молекулы. Так экспериментатор получает сведения о последовательности комплементарной цепи.
5) По последовательности отрезков комплементарной цепи исследователь может сделать вывод о последовательности исходной исследуемой цепи ДНК. Воспользовавшись таблицей генетического кода, можно понять, какой белок (или фрагмент какого белка) закодирован этим отрезком ДНК.
Где применяется секвенирование?
1) С помощью секвенирования расшифровывают геномы организмов.
2) Определение не только ДНК, но и РНК.
3) Определение генных заболеваний.
Секвенирование ДНК
Секвенирование (от англ. sequence — «последовательность») — это общее название методов, которые позволяют установить последовательность нуклеотидов в молекуле ДНК.
Существуют два основных метода секвенирования ДНК: химический и ферментативный.
Химический метод, или метод химической деградации по Максаму — Гилберту, был разработан в 1976 году Алланом Максамом и Уолтером Гилбертом. В основе метода лежит расщепление меченых участков ДНК под химическим воздействием. Мечение идет только по одному концу (3′ или 5′). Концентрация и длительность воздействия реагента подбираются так, что модифицируются нуклеотиды только одного типа (Ц; Ц+Т; Г; Г+А). Разделение по меченым участкам происходит с помощью электрофореза в агарозном геле.
Ферментативный метод (также метод обрыва цепи или дидезоксисеквенирование) был разработан Фредериком Сэнгером в 1977 году. Суть заключается в синтезе изучаемой цепи ДНК с остановкой синтеза на заданном основании путем присоединения дидезоксинуклеотида. Идет в несколько этапов:
Гибридизация участка ДНК с праймером — искусственно созданной последовательностью, комплементарной некоторому участку исходной ДНК;
Ферментативный синтез ДНК;
Денатурация, в результате которой образуются олигонуклеотидные последовательности разной длины, содержащие праймер;
Электрофорез в полиакриламидном геле.
Последние 20 лет доминирует автоматизированное секвенирование по методу Сэнгера. Развитие секвенирования в медицине начало эру персональной медицины, учитывающей индивидуальные различия пациентов и позволяющей улучшить качество медицинской помощи.
В настоящее время также существуют так называемые методы секвенирования ДНК нового поколения. Все подобные технологии основываются на секвенировании ДНК-чипов во время интерактивных циклических ферментативных реакций с дальнейшим сбором полученной информации в виде иллюстраций. С помощью полученных данных и восстанавливается последовательность ДНК. Преимущество этих методов заключается в том, что они могут одновременно читать несколько участков ДНК.
Задания
Версия для печати и копирования в MS Word
Рассмотрите таблицу «Методы биологических исследований». Запишите в ответе пропущенный термин, обозначенный в таблице вопросительным знаком.
Методы биологических исследований
| Частнонаучный метод | Применение метода |
|---|---|
| Близнецовый | определение степени влияния среды на
монозиготных близнецов |
| ? | определение последовательности нуклеотидов
в ДНК с использованием флуоресцентных меток |
Спрятать пояснение
Пояснение.
Методы биологических исследований
| Частнонаучный метод | Применение метода |
|---|---|
| Близнецовый | определение степени влияния среды на
монозиготных близнецов |
| Секвенирование | определение последовательности нуклеотидов
в ДНК с использованием флуоресцентных меток |
Секвенирование днк. Этапы секвенирования днк.
Секвенирование
— представляет собой определение
нуклеотидной последовательности
фрагмента ДНК путем получения серии
комплементарных молекул ДНК, различающихся
по длине на одно основание. Является
последним этапом молекулярного анализа
предварительно отобранного, клонированного
и протестированного более простыми
методами фрагмента ДНК.
Существует
два основных метода секвенирования;
метод Максама-Гилберта (основан на
химическом расщеплении ДНК по одному
основанию) и метод Сэнгера (дидезокси-метод).
Метод Сэнгера более надежен и прост в
исполнении, и на практике его используют
чаше.
Метод
Сэнгера или дидезоксисеквенирование
основан на синтезе изучаемой цепи ДНК
in vitro с остановкой синтеза на заданном
основании путем присоединения
дидезоксинуклеотида. Дидезоксинуклеотид
лишен гидроксильных групп при атомах
сахарного кольца не только в 2′-, но и в
3′-положении, что делает его неспособным
формировать фосфодиэфирную связь со
следующим нуклеотидом.
Для
проведения секвенирования
необходимы:
1)
секвенирующий праймер (искусственно
синтезированная олигонуклеотидная
последовательность, комплементарная
определенному участку исходной молекулы
ДНК),
2)
набором из четырех дезоксинуклеотидов
dATP, dCTP, dGTP и dTTP, один из которых изотопно
меченный
3)
один из четырех дидезоксинуклеотидов
(ddATP, ddCTP, ddGTP и ddTTP)
4)
ДНК-полимераза.
Сам
метод включает
следующие этапы:
1)
гибридизация изучаемого фрагмента ДНК
с праймером
2)
ферментативный синтез ДНК
3)
денатурация полученных продуктов
формамидом (в результате образуются
уникальные различающиеся по длине
олигонуклеотидные последовательности,
содержащие праймер)
4) электрофорез в
полиакриламидном геле на четырех
дорожках (по числу типов нуклеотидов)
и
5) анализ результатов
на радиоавтографе. На большинстве
радиоавтографов можно четко различить
250—350 полос, т.е. прочитать последовательность
в 250-350 п.н. Нуклеотидная последовательность
на радиоавтографе считывается снизу
вверх.
Таким
образом, по размеру синтезированных
фрагментов
может быть определена локализация
дидезоксинуклеотидов и порядок
соответствующих им нуклеотидов в
исходной молекуле ДНК.
Для
прочитывания
более длинных последовательностей
существует ряд методов, представляющих
собой разные модификации метода Сэнгера.
Эти методы основаны на предварительном
клонировании ДНК в векторах,
сконструированных на основе фага М13
E.coli для получения протяженных
одноцепочечных участков ДНК, которые
могут быть непосредственно секвенированы
без денатурации и праймирования.
Особенность фага М13 E.coli состоит в
возможности его существования в двух
формах: двухцепочечной репликативной,
функционирующей как плазмида, и
одноцепочечной фаговой, использующейся
в качестве матрицы для секвенирования.
Выделив после клонирования одноцепочечные
фаговые ДНК со вставкой (размер около
500 п.н.), праймер гибридизуют с
последовательностью вблизи вставки, и
проводят дидезоксисеквенирование.
Для
секвенирования
крупных фрагментов ДНК (около 2000 п,н.)
используют более сложные (комбинированные)
подходы. Один из них заключается в
предварительном клонировании данного
фрагмента в плазмидном векторе и
построении его подробной рестрикционной
карты, идентификации перекрывающихся
рестрикционных фрагментов длиной
100-500 п.н. Далее, субклонировав каждый из
этих фрагментов в ДНК M13 E.coli, их секвенируют
и определяют последовательность
исходного участка ДНК. Так как
субклонированные фрагменты могут быть
встроены в противоположных направлениях,
то праймер в одном случае будет
инициировать синтез первой цепи, а в
другом — комплементарной ей, а значит
возможно одновременное секвенирование
обеих цепей.
Для
секвенирования фрагментов ДНК
более 5000 п.н. используют методы
секвенирования двухцепочечных плазмидных
ДНК, не требующие субклонирования. Один
из них носит название «праймер-опосредованной
прогулки» («блуждающей затравки»). Суть
метода заключается в последовательном
дидезоксисеквенировании по 250-350 п.н.
Этапы метода представляют собой цепочку
циклов, включающих синтез праймера,
дидезоксисеквенирование и идентификацию
нуклеотидной последовательности:
1)
отжиг плазмидной ДНК, содержащей вставку,
с праймером, комплементарным
последовательности одной из цепей
векторной ДНК;
2)
дидезоксисеквенирование и идентификация
первых 250-350 п.н. вставки;
3)
синтез второго праймера, комплементарного
сегменту вставки, который отстоит от
места связывания первого праймера
примерно на 300 п.н., и секвенирование
следующих 250-350 п.н., и так далее, пока не
секвенируют весь фрагмент.
Обязательное
условие при секвенировании
очень длинных фрагментов иметь праймер
длиной не менее 24 нуклеотидов. Это
необходимо для того, чтобы избежать
спаривания праймера внутри вставки
более одного раза.
В
настоящее время широкое распространение
получила методология автоматического
ДНК-секвенирования
с использованием меченных различными
флуорохромами дидезоксинуклеотидов —
электрофорез в этом случае проводят на
одной дорожке и на электрофореграмме
каждому из нуклеотидов соответствует
свой цвет полосы, которую сканируют в
луче лазера, занося данные в компьютер,
который сопоставляет их и идентифицирует,
выводя на экран нуклеотидную
последовательность.. Этот метод широко
применялся в ходе реализации программы
«Геном человека». Использование
автоматических секвенаторов снизило
стоимость секвенирования одного звена
с 1 $ до 0,1 $.
Однако
существуют еще более быстрые методы
автоматического
секвенирования.
Один из них — секвенирование путем
гибридизации исследуемой последовательности
ДНК с набором олигонуклеотидов
(олигонуклеотидной матрицей), включающим
все возможные варианты перестановок
из 4 стандартных нуклеотидов (А, G, С, Т)
определенной длины. Наиболее удобными
считаются наборы матриц (чипы) из
октануклеотидов., при этом количество
возможных вариантов нуклеотидов
составляет 65536. Секвенируемый фрагмент
ДНК, меченный радиоактивным фосфором,
гибридизуется только с комплементарными
его участкам октануклеотидами.
В
результате определяется спектр
октануклеотидов,
составляющих исследуемый фрагмент ДНК.
Локализация октамеров в изучаемом
фрагменте ДНК устанавливается при
помощи специальной компьютерной
программы.
Метод
Максама-Гилберта
Используется
для секвенирования одно- и двухцепочечных
фрагментов ДНК.
Этапы метода:
-
специфическая
химическая фрагментация изучаемого
полинуклеотида -
фрагмент
ДНК метят радиоактивным изотопом 32Р
по 5′- или 3′-концу. У двухцепочечной ДНК
метятся обе цепи -
Подготовка
меченных фрагментов к секвенированию.
Для этого используются клонирующие
векторы, содержащие синтетические
полилинкеры. После гидролиза рестриктазами,
образующими липкие концы, с помощью
фрагмента Кленова избирательно метят
клонированные фрагменты по одному
концу. -
Меченные
фрагменты делят на порции и каждую
подвергают определенной химической
модификации. Еее проводят так, чтобы
на одну молекулу ДНК в среднем приходилось
по одной метке.
Пуриновые основания: диметилсульфат
– метилирование аденина по положению
N3, гуанина – N7. Обработка
0,1М HCl при температуре 0ºС приводит к
отщеплению метиладенина. Инкубация при
90ºС в щелочной среде (0,1М NaOH) вызывает
разрыв цепи ДНК в местах отщепления
оснований. При обработке пиперидином
происходит гидролиз цепи ДНК по остаткам
метилгуанина.
Пиримидиновые основания: гидразин.
Если реакцию вести в бессолевой среде,
то модифицируются тимин и цитозин, а в
присутствии 2М NaCl – только цитозин. При
обработке пиперидином происходит
гидролиз цепи ДНК пр точкам модификации
-
После
параллельного проведения четырех
различных обработок фрагмента ДНК
полученные субфрагменты разделяют
путем электрофореза в полиакриламидном
геле на соседних дорожках -
С помощью
радиоавтографии геля на рентгеновской
пленке считывается нуклеотидная
последовательность ДНК
Экспрессия в
клетках бактерий рекомбинантных ДНК
Одна
из важнейших задач генной инженерии –
создание штаммов бактерий или дрожжей,
линий клеток тканей животных или
растений, а также трансгенных растений
и животных, которые обеспечивали бы
эффективную экспрессию клонируемых в
них генов. Высокий уровень продукции
белков достигается в том случае, если
гены клонируются в многокопийных
векторах, т.к. при этом целевой ген будет
находиться в клетке в большом количестве.
Важно, чтобы кодирующая последовательность
ДНК находилась под контролем промотора,
который эффективно узнаётся РНК-полимеразой
клетки, а образующаяся мРНК была бы
относительно стабильной и эффективно
транслировалась. Кроме того, чужеродный
белок, синтезируемый в реципиентных
клетках, не должен подвергаться быстрой
деградации внутриклеточными протеазами.
При создании трансгенных животных и
растений часто добиваются тканеспецифичной
экспрессии вводимых целевых генов.
Любой полноценный ген состоит из двух
основных частей – регуляторной и
структурной. Регуляторная часть
распознается соответствующими ферментными
системами организма и обеспечивает
упорядоченную экспрессию его структурной
части. Она высокоспецифична в отношении
своих природных эффекторов (РНК-полимераз,
рибосом, факторов транскрипции и
трансляции, факторов сплайсинга и т.д.).
Чаще всего регуляторная часть не может
функционировать в другом генетическом
окружении.
Генетическая
информация передается по схеме ДНК →
(транскрипция) РНК → (трансляция) белок.
Это необходимые этапы для экспрессии
рекДНК.
Экспрессия
эукариотических генов в бактериальной
клетке является фундаментальным вопросом
биологии. Так как генетический код
универсален, то возможность такой
экспрессии определяется:
-
наличием
в изучаемом гене сигналов инициации и
терминации транскрипции и трансляции
2)
правильное узнавание их прокариотической
клеткой
Основные отличия
систем экспрессии про- и эукариот:
-
большинство
генов высших эукариот имеет прерывистую
экзон-интронную структуру, в результате
транскрипции таких генов образуется
матричная РНК–предшественник (пре-мРНК),
из которой при последующем сплайсинге
выщепляются некодирующие последовательности
– интроны, и образуется зрелая мРНК.
Такие гены не могут экспрессироваться
в клетках
бактерий, где отсутствует система
сплайсинга.
Эукариотические гены, имеющие непрерывную
кодирующую последовательность, иногда
способны правильно экспрессироваться
в клетках бактерий. -
У
прокариот существует одна РНК-полимераза,
синтезирующая все типы РНК. У эукариот
существуют три типа РНК-полимераз:
РНК-полимераза I
(синтезирует рибосомные РНК)
РНК-полимераза II
(матричные РНК)
РНК-полимераза
III (транспортные РНК)
-
Различия
по использованию кодонов, терминирующих
трансляцию: в эукариотических мРНК
используются все три терминирующих
кодона, а в прокариотических – только
один.
4)
Различия в последовательностях мРНК,
необходимых для инициации трансляции
5)
Различные последовательности,
ответственные за связывание транскриптов
с рибосомальными РНК
Автономная
экспрессия клонированного
гена возможна только в случае, если
инициация и терминация транскрипции
происходит полностью на клонируемом
фрагменте. В таком случае экспрессия
гена не зависит от типа вектора и
ориентации в нем встроенного фрагмента
ДНК.
При
инициации транскрипции на промоторе
вектора синтез полноценного белка,
детерминируемого клонированной
последовательностью, возможен только
при наличии в транскрипте участка
связывания бактериальной рибосомы.
Установление
экспрессии эукариотических генов в E.
coli
1)
функциональная комплементация (штамм
E. coli,
ауксотрофный по гистидину)
2)
селективные питательные среды: бактерии
не способны расти на питательной среде,
содержащей крахмал к качестве единственного
источника углерода. В плазмиду рВR322
встроили фрагменты хромосомной ДНК
дрозофилы и осуществили трансформацию
клеток E. coli гибридными ДНК. Среди
трансформантов выявлены клоны, растущие
на крахмале. Синтезируемая в E. coli
α-амилаза соответствует по своим
свойствам данному ферменту дрозофилы.
Клонирование
мозаичных генов высших эукариот в
клетках E. coli
-
С
помощью обратной транскриптазы на
молекулах мРНК синтезируется кДНК -
Достраиваются
вторые цепи на кДНК, в результате чего
образуются двухцепочечные ДНК-копии
мРНК -
Фрагменты
ДНК встраиваются в подходящий клонирующий
вектор коннекторным методом или с
помощью синтетических линкеров -
рекДНК
вводится в E. coli
К
генам, способным эффективно экспрессироваться
в эукариотических клетках, относят
гибридные
гены.
Это
гены, у
которых кодирующая последовательность
представлена эукариотической кДНК, а
сигналы инициации транскрипции и
трансляции имеют бактериальное
происхождение.
Пример:
1)
Экспрессирующий вектор + фрагмент гена
lacZ, содержащий промотор, участок
связывания рибосом и триплеты нескольких
первых аминокислот β-галактозидазы E.
coli, которые задают рамку трансляции
клонированной последовательности. При
совпадении рамок трансляции β-галактозидазы
и клонированной ДНК в бактериальных
клетках синтезируется эукариотический
белок, содержащий на N-конце дополнительно
несколько аминокислот β-галактозидазы.
Продукт экспрессии рекДНК представляет
собой химерный
белок.
2)
Плазмида pBR322, в которую по PstI участку
встроили кДНК проинсулина крысы в
составе гена β-лактамазы. При совпадении
рамок трансляции E. coli синтезирует
химерный белок, содержащий антигенные
детерминанты как инсулина, так и
β-лактамазы.
Целевой белок из
состава химерного можно извлечь с
помощью соответствующих протеаз.
Экспрессия
ген-эквивалентов эукариотических
полипептидов в клетках E. Coli
Ген-эквивалент
– это последовательность ДНК, кодирующая
зрелую форму полипептида.
Часть активных
полипептидов, таких как нейропептиды
или гормоны, обычно синтезируются в
виде предшественников, имеющих большую
молекулярную массу. В результате
специфического процессинга образуется
зрелый полипептид и низкомолекулярный
пептид. В бактериальной клетке для
большинства полипептидов правильный
процессинг из пре-белка невозможен. В
этих случаях в бактериальной клетке
необходимо клонировать последовательность
ДНК, кодирующую уже зрелую форму
полипептида.
Пример
Ген-эквивалент
соматостатина человека синтезируют
химическим методом и встраивают в
векторные плазмиды, содержащие фрагменты
lac-оперона E. coli. Если синтетический
фрагмент встраивали по сайту EcoRI
в конце гена β-галактозидазы, синтезировался
химерный белок, содержащий последовательности
как большей части β-галактозидазы, так
и соматостатина. Соматостатин высвобождают
из химерного белка, обрабатывая его
бромистым цианом.
Таким образом,
суть разработанного метода заключается
в следующем:
-
искусственный
ген встраивается внутрь структурного
гена, кодирующего определенный
бактериальный белок -
Инициация
синтеза РНК и белка происходят на
регуляторных участках бактериального
оперона, а терминация трансляции – на
нонсенс-кодонах синтетического гена -
Экспрессия
гибридного гена приводит к появлению
химерного белка, содержащего аминокислотную
последовательность бактериального
белка и пептида, кодируемого синтетическим
фрагментом ДНК -
Целевой
пептид выщепляется из состава химерного
белка специфическим химическим или
ферментативным гидролизом.
Этот
подход использовался для микробиологического
синтеза инсулина человека.
Инсулин
в клетках человека синтезируется в виде
препроинсулина.
Это препгормон, который синтезируется
на мембраносвязанных рибосомах и
содержит сигнальный пептид, обуславливающий
секрецию белка из клетки. В процессе
секреции сигнальный пептид отщепляется
от молекулы. Образующийся в результате
проинсулин
представляет собой сложную трехмерную
структуру с тремя дисульфидными
мостиками. Из середины проинсулина
выщепляется 35 аминокислот (С-цепь),
образуя А- и В-цепи, связанные дисульфидными
мостиками, обеспечивающими стабильность
четвертичной структуры зрелого белка.
Этапы микробиологического
синтеза инсулина:
-
химическим
путем синтезируются гены А и В-цепи
инсулина -
Синтезированные
фрагменты встраиваются в структурную
часть гена антранилсинтетазы в составе
векторной плазмиды в правильной рамке
трансляции -
Из
образовавшихся химерных полипептидов
бромистым цианом выщепляется
последовательность А и В-цепей -
А
и В-цепи смешиваются и химически
генерируются дисульфидные связи
Таким же способом
в 1981 г. был синтезирован лейкоцитарный
интерферон человека, а в 1983 г. – иммунный
интерферон.
Регуляция
транскрипции рекДНК в клетках E.
coli
У
бактерий транскрипция большинства
генов регулируется с помощью системы
белков-репрессоров и активаторов,
которые влияют на взаимодействие
РНК-полимеразы с транкрибируемыми
генами. В генной инженерии экспрессия
клонированных генов также должна
регулироваться, поскольку при избыточной
экспрессии продукты экспрессии могут
оказывать токсическое действие на
бактерии. Для этого конструируют системы,
в которых экспрессия клонируемых генов
подавлена (репрессирована) на ранних
фазах роста культур и дерепрессирована
в нужный момент времени.
Рассмотрим
две такие системы. В одном случае для
контроля экспрессии клонированных
генов используют систему регуляторных
элементов лактозного оперона, в другом
– систему промотор-репрессор-оператор
фага λ.
В
векторы вводятся регуляторные
последовательности фага λ и lac-оперона,
за которыми следуют полилинкеры с
несколькими уникальными сайтами
рестрикции. В тот же вектор вводится
ген-регулятор, кодирующий белок-репрессор.
В отсутствие индуцирующего воздействия
репрессор связывается с оператором,
препятствуя взаимодействию РНК-полимеразы
с промотором, под контролем которого
находится клонированный ген. Это приводит
к резкому снижению уровня транскрипции
этого гена и, соответственно низкому
содержанию белкового продукта. Для
индукции экспрессии в случае с lac—опероном
используют синтетический аналог
природного индуктора (алло-лактозы) –
изопропил-β-D-тиогалактопиранозид.
Индуктор связывается с молекулой
репрессора и нарушает его взаимодействие
с оператором. lac-промотор
становится доступным для РНК-полимеразы,
которая начинает транскрибировать
гены, расположенные за промотором.
В
системе репрессии –дерепрессии фага
λ используют ген репрессора, содержащий
температурочувствительную мутацию.
Мутантный белок –репрессор сохраняет
способность подавлять синтез РНК только
при температуре (28-30ºС). При повышении
температуры до 42ºС происходят инактивация
белка-репрессора и репрессия генов,
расположенных под контролем соответствующих
промоторов.
Для
обеспечения регулируемой тканеспецифической
экспрессии рекДНК в соматических клетках
животных и растений в составе векторов
используют энхансеры,
которые избирательно стимулируют
транскрипцию в соответствующих тканях,
клетки которых не экспрессируют
необходимые регуляторные белки.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Метод исследования
— это способ научного познания действительности.
Общие методы исследования
Что
такое метод исследования? Приведите примеры биологических методов
исследования и ситуации, в которых они применяются.
1) Метод исследования —
это способ научного познания действительности.
2) Различают
биологические методы исследования: описание, наблюдение, сравнение,
эксперимент, микроскопия, центрифугирование, гибридологический, близнецовый
метод, биохимический метод и др.
3) Методы
исследования применяются только в определенных случаях и для достижения
определенных целей. Например, гибридологический — для изучения
наследственности применяется в животноводстве и растениеводстве, но не
применяется для человека. Центрифугирование позволяет выделять органоиды
клетки для их изучения.
Метод
Для каких целей применяется
Примеры из ЕГЭ
Общие методы
исследования (как биологические, так и других наук): эксперимент, наблюдение, описание, сравнение,
моделирование.
Методы эмпирического
(практического) исследования (наблюдение,
эксперимент и др.) основаны
на опыте, практике. Суть эмпирических методов состоит в фиксации и описании
явлений, фактов, видимых связей между ними.
Наблюдение и
описание
Наблюдение — это целенаправленный процесс
восприятия предметов действительности, результаты которого фиксируются в
описании. Для получения значимых результатов необходимо многократное
наблюдение. Виды: непосредственное наблюдение, которое осуществляется без
применения технических средств; опосредованное наблюдение — с использованием
технических устройств.
·
Сезонные изменения в живой природе
·
Слежение за миграцией косяка трески
Эксперимент
Это научно поставленный опыт, наблюдение
исследуемого явления в контролируемых условиях, позволяющих выявить
характеристики данного объекта или явления.
·
изучение характера пульса после разных
физических нагрузок
·
лабораторное исследование влияния гиподинамии
на состояние здоровья
Моделирование
Метод, при котором создается некий образ
объекта, модель, с помощью которой ученые получают необходимые сведения об
объекте
Джеймс Уотсон и Френсис Крик создали из
отдельных элементов модель – двойную спираль ДНК, отвечающую данным рентгенологических
и биохимических исследований
·
Использовался при выяснении структуры ДНК.
Сравнительный
метод
Сравнительный
метод – позволяет выявить сходство между
организмами и их частями.
Полученные с помощью этого метода сведения
легли в основу систематики Карла Линнея, позволили Теодору Шванну и Маттиасу
Шлейдену сформулировать клеточную теорию, легли в основу закона зародышевого
сходства, открытого Карлом Бэром.
Исторический
метод
Выясняет закономерности появления и развития
организмов, становления их структуры и функций.
Теоретические методы (анализ и синтез,
обобщение (классификация), абстрагирование, конкретизация, моделирование и
др.) связаны с мысленным проникновением в сущность изучаемого явления или
процесса, построением моделей их идеальных состояний.
Методы изучения
клетки
МЕТОДЫ ЦИТОЛОГИИ:
1)
Микроскопия –
изучение морфологии клетки.
2)
Хроматография – физико-химический метод, используемый в цитологии
для разделения смеси веществ, основанном на разной скорости движения веществ
через адсорбент, например, разделение смеси пигментов растений.
3)
Метод меченых атомов – введение в вещество радиоактивного
изотопа химического элемента для изучения путей его превращения в клетке.
Метод используется для изучения жизнедеятельности клетки.
4)
Центрифугирование –
метод разделения клеточных структур и макромолекул с помощью центрифуги,
позволяющий дифференцировано осаждать клеточные структуры, отличающиеся друг
от друга своей массой.
5)
Биохимический метод – метод, используемый в цитологии для
обнаружения и оценки количества веществ в клетках и тканях организмов,
изучение структуры веществ.
6)
Электрофорез — физико-химический метод, используемый в
цитологии для разделения смеси веществ с помощью электрического тока,
например, разделение смеси белков плазмы крови.
7)
Метод культуры клеток и
тканей – изучение
жизнедеятельности клеток и тканей путем культивирования их на искусственных
средах.
1.Микроскопия или цитологичекий
Метод любых исследований клеток
и тканей с помощью микроскопа
Какие
преимущества имеет световой микроскоп перед электронным?
1) световой микроскоп
легче, компактнее (проще в обращении, значительно дешевле), и не требует
сложной подготовки препаратов;
2) в световой
микроскоп можно рассматривать живые клетки и видеть цветное изображение
(можно видеть движение цитоплазмы с органоидами, стадии деления клетки)
В световой микроскоп можно рассмотреть:
·
движение цитоплазмы в клетках
·
строение тканей животных
·
фазы митоза
·
движение органоидов
·
клетки кожицы лука
С помощью электронного
микроскопа:
·
рибосомы
·
микротрубочки
·
эндоплазматическую сеть
·
организацию аппарата Гольджи
2.Метод хроматографии
Метод основан на разной скорости движения
веществ смеси через адсорбент в зависимости от их молекулярной массы.
Учёный
выделил пигменты фотосинтеза из листа растения. Каким методом он мог бы
разделить их? На чём основан этот метод?
1. метод
хроматографии
2. метод основан на
разделении пигментов из-за различий в скорости движения пигментов в
растворителе (подвижной фазы по неподвижной фазе)
Известно,
что в растительных клетках присутствуют два вида хлорофилла: хлорофилл a и
хлорофилл b. Учёному, для изучения их структуры, необходимо
разделить эти два пигмента. Какой метод он должен использовать для их
разделения? На чём основан этот метод?
1.Целесообразно применить метод
хроматографии. 2.Метод основан на разной скорости движения веществ смеси
через адсорбент в зависимости от их молекулярной массы.
3.Метод меченых атомов
Метод меченых атомов применяется при изучении биохимических процессов,
происходящих в живых клетках. Чтобы проследить за превращениями какого-либо
вещества, в него вводят радиоактивную метку, т. е. заменяют в его молекуле
один из атомов соответствующим радиоактивным изотопом (3Н,32Р,14С). Как
известно, по химическим свойствам изотопы одного и того же элемента не
отличаются друг от друга, но зато радиоактивный изотоп сигнализирует о своем
местонахождении радиоактивным излучением. Это позволяет проследить за
определенным химическим веществом, установить последовательность этапов его
химических превращений, продолжительность их во времени, зависимость от
условий и т. д.
·
При изучении фотосинтеза ученые использовали метод меченных
атомов и установили, что свободный кислород образуется из воды, а не
углекислого газа. Как был поставлен эксперимент, позволивший обнаружить, что
кислород образуется из воды?
Элементы ответа:
1) Растение поливали
водой, в молекулах которой находится радиоактивный изотоп кислорода.
2) Выделившийся при
фотосинтезе кислород собрали и обнаружили в нем тяжелые изотопы кислорода.
·
Каким экспериментальным методом можно установить скорость прохождения
веществ через клеточную мембрану при исследовании функции щитовидной железы?
На чём основан этот метод?
1.методом меченых атомов; необходимо ввести пациенту порцию
радиоактивного йода;
2.по химическим свойствам изотопы одного и того же элемента не
отличаются друг от друга, но радиоактивное излучение позволяет отследить
этапы перемещения радиоактивного элемента (йода) и скорость его накопления в
клетках железы.
·
В эксперименте учёные длительное время выращивали бактерий на
среде, содержащей изотоп азота 15N, а затем перевели их на
среду с обычным изотопом 14N. Какой метод применяли эти
учёные? Молекулы каких классов органических веществ можно таким образом
различать?
1.метод меченных атомов;
2.белки, потому что аминокислоты содержат азот, и нуклеиновые
кислоты, потому что нуклеотиды (азотистые основания) содержат азот)
·
Для обнаружения местоположения определённого гена на хромосоме
можно использовать метод гибридизации. При этом на препарат хромосом
наносится раствор, содержащий фрагмент ДНК исследуемого гена, ковалентно
связанный с молекулой, испускающей свечение в ультрафиолете (флуоресценция).
Какой метод используется в данном случае? За счёт чего добавляемый фрагмент
гена связывается с ДНК хромосомы на препарате?
1.Метод меченых атомов (молекул).
2.За счёт взаимодействия между комплементарными
последовательностями (основаниями).
4.Центрифугирование

действием центробежной силы; применяется при разделении органоидов клетки,
фракций (составляющих) органических веществ и т.д.
·
избирательное выделение органоидов клетки для
последующего изучения
·
разделение органоидов клетки по плотности
1. Для изучения митохондриальных ДНК ученому необходимо выделить
из животных клеток митохондрии методом центрифугирования. На чем основан этот
метод? После обособления каких структур может быть получена митохондриальная
фракция?
Элементы ответа:
1)
Метод основан на разделении объектов, имеющих разную плотность (массу) под
воздействием центробежных сил.
2)
Митохондриальная фракция может быть получена после осаждения ядер.
3)
Плотность митохондрий меньше плотности ядер.
5.Биохимический метод
К биохимическим
методам исследования относят:
·
электрофорез
·
рентгено
спектрофотометрию
Биохимический метод исследования позволяет
определять активность ферментов, содержание продуктов метаболизма в различных
биологических жидкостях, а также выявлять нарушения в обмене веществ, которые
обусловлены наследственным фактором.
Объектами диагностики биохимического анализа
являются: кровь; моча; пот и другие биологические жидкости; ткани; клетки.
·
-определение уровня гемоглобина в крови
·
-определение количества сахара в крови
·
-диагностика сахарного диабета
·
-определение дефектов ферментов
·
-Применяется при анализах внутренней среды
организма.
·
-Применяется при выяснении уровня активности
вещества в определённых условиях.
С помощью биохимического метода отличают РНК —
содержащие вирусы от ДНК — содержащих. На чем основан этот метод? Какие
различия в химическом составе вирусов определяются при помощи этого метода?
Ответ поясните.
Элементы ответа:
1) Биохимический метод основан на анализе
химического состава веществ, качественных реакций.
2) РНК-вирусы содержат азотистое основание урацил
и углевод рибозу.
3) ДНК-вирусы содержат азотистое основание тимин
и дезоксирибозу
6.Электрофорез
Электрофорез — это
электрокинетическое явление перемещения частиц дисперсной фазы (коллоидных
или белковых растворов) в жидкой или газообразной среде под действием
внешнего электрического поля. Электрофорез применяют в лечебных целях в
физиотерапии.
Наиболее часто метод
используют для аналитических целей – для разделения смеси заряженных веществ
на фракции с последующим качественным и количественным их определением. Таким
способом удается разделить, например, белки сыворотки крови на 5 фракций:
альбумин и 4 фракции глобулинов. Эту задачу часто решают в клинической биохимии,
так как соотношение фракций закономерно изменяется при многих патологических
процессах.
Метод подразделяется
на фронтальный или свободный электрофорез (электрофорез в жидкой среде) и
зональный или электрофорез в поддерживающих средах.
7.Метод культуры клеток и тканей
Изучение жизнедеятельности клеток и тканей
путем культивирования их на искусственных средах
Искусственным
выращиванием биомассы женьшеня из отдельных его клеток на питательных средах
занимается
1) генная инженерия
2) клеточная инженерия
3) микробиология
4) животноводство
Женьшень – это
растение, и выращиванием организма из отдельных клеток (культуры
тканей)занимается клеточная инженерия.
Различные
отрасли народного хозяйства и медицины потребляют ежегодно более 200 тонн
женьшеня. Сбор этого растения в лесах даёт не более 150 килограмм в год.
Культурные плантации не могут удовлетворить потребности человека. Каким
способом удаётся получить необходимое количество сырья и сохранить это
растение в природе? Объясните, в чём заключается этот метод размножения.
1) Растение
размножают микроклональным методом.
2) Методом культуры
ткани, культивируемой на питательной среде, выращивают биомассу женьшеня в
необходимом количестве для получения экстракта этого растения
МЕТОДЫ ГЕНЕТИКИ:
1)
Цитогенетический –
изучение количества и структуры хромосом с помощью микроскопа, позволяет
выявить хромосомные (изменение структуры хромосом) и геномные (изменение
количества хромосом) мутации.
2)
Генеалогический –
изучение наследование признака на основе анализа родословных, позволяет
определять характер наследования признака, а также особенности наследования
признаков, обусловленных генными мутациями.
3)
Близнецовый – метод сравнительного изучения
наследования признаков у близнецов, позволяет установить роль среды и
наследственности в определении признака.
4)
Гибридологический –
генетический анализ потомства (гибридов), полученного от родителей,
отличающихся по одному или нескольким признакам.
5)
Популяционно-статистический – определение частоты встречаемости
различных генов в популяциях организмов.
6)
Биохимический
1.Цитогенетический метод
 |
С помощью данного метода можно изучать наследственный
материал клетки: совокупность хромосом в целом — число хромосом (кариотипирование)
или наличие и количество Х-хромосом. Цитогенетический метод. Это прежде всего изучение
хромосом под микроскопом. Он позволяет обнаружить геномные мутации (например,
трисомия 21, приводящая к синдрому Дауна), а также крупные перестройки отдельных
хромосом (инверсии, делеции). Для идентификации определенных хромосом
используют метод дифференциального окрашивания хромосом. Обычно при этом
получается определенный рисунок полос разной ширины, который уникален для
каждого конкретного участка хромосом
(например, обнаружить синдром Дауна —
трисомию по 21 хромосоме можно выявить с помощью цитогенетического
метода).
·
изучение числа хромосом на стадии метафазы
митоза
·
определение наличия геномных мутаций
·
определение числа хромосом в кариотипе
Для установления
причины наследственного заболевания исследовали клетки больного и обнаружили
изменение длины одной из хромосом. Какой метод исследования позволил
установить причину данного заболевания? С каким видом мутации оно связано?
1) причина болезни
установлена с помощью цитогенетического метода;
2) заболевание
вызвано хромосомной мутацией – утратой или присоединением фрагмента
хромосомы.
хромосомные
и геномные мутации!!!
2.Генеалогический
метод
Генеалогический метод генетики человека позволяет
определить закономерности наследования признаков
Применяется
при составлении родословных людей, выявление характера наследования некоторых
признаков
·
составление родословной
·
исследования наследственности и изменчивости
человека
·
выявления наследственных заболеваний в роду
·
устанавливается доминатный признак (характер
наследования признака)
·
выявляется сцепленность признака с полом
(характер наследования)
С
помощью какого метода было установлено наследование дальтонизма у человека?
С помощью построения
генеалогического древа.
Наследственное
заболевание сахарный диабет (вызывается рецессивной мутацией) характеризуется
повышением концентрации сахара в крови вследствие отсутствия инсулина.
Человек может передавать этот аллель своим потомкам. Какие методы изучения
наследственности человека позволили выявить причины этой болезни и характер
наследования признака?
1) Биохимический –
изучение состава крови и мочи больных и здоровых людей
2) Генеалогический –
определение характера наследования, анализируя проявление болезни в ряду
поколений.
3.Близнецовый метод
Близнецовый метод состоит в изучении различий
между однояйцевыми близнецами. Этот мeтoд предоставлен самой природой. Он
помогает выявить влияние условий среды на фенотип при одинаковых
генотипах.
Близнецовый метод изучает близнецов, выявляя
влияние генотипа и среды на организм.
Определение роли
факторов среды в формировании
фенотипа человека
4. Гибридологический метод
Скрещивание организмов с
определенными признаками и анализ проявления этих признаков у потомства
Что
представляет собой гибридологический метод изучения наследственности?
1) Подбор и
скрещивание родительских форм, отличающихся рядом признаков.
2) Анализ
наследования признаков потомством.
Сущность
гибридологического метода заключается в
1)
скрещивании особей, различающихся по нескольким признакам
2)
изучении характера наследования альтернативных признаков
3) использовании
генетических карт
4) применении
массового отбора
5)
количественном учёте фенотипических признаков потомков
6) подборе родителей
по норме реакции признаков
Пояснение.
Гибридологический
метод – метод генетики, связанный с получением потомства
(гибридов) от родительских особей, отличающихся по одному или нескольким
признакам (1) с целью анализа характера наследования признаков (2) гибридным
потомством.
Гибридологический метод предполагает: 1) принадлежность скрещиваемых особей к
одному виду; 2) отличие родительских особей по одному или нескольким
признакам; 3) количественный учет фенотипических признаков потомков (5).
Гибридологический
метод не предполагает использование генетических карт (3),
при подборе родительских пар норма реакции не
учитывается. Массовый отбор (4) – это метод селекции, при
котором проводят отбор целой группы особей с нужными признаками с целью
выведения сортов растений или пород животных.
Ответ: 125.
5.Популяционно-статистический метод
определение частоты
встречаемости различных генов в популяциях организмов.
Изучение распространения признака
в популяции
6.Биохимический
Этот метод помогает обнаружить
ряд заболеваний обмена веществ при помощи исследования биологических
жидкостей (крови, мочи, амниотической жидкости). Причиной этих болезней
является изменение активности определенных ферментов.
Ген-фермент-признак
7.Молекулярный
метод
Технологии прочтения
нуклеотидных последовательностей ДНК — секвенирования ДНК.
В настоящее время они позволяют за относительно короткое время прочитывать
целые геномы сложных организмов. Работа с полученными последовательностями
ДНК («генетическими текстами») легла в основу новой науки — биоинформатики.
.
Секвенирование — определение последовательности нуклеотидов в
нуклеиновых кислотах или аминокислотах в белках
Полимеразная цепная реакция основан на многократном избирательном
копировании определенного участка ДНК при помощи специальных ферментов.
Например, диагностика коронавируса
Найдите
три ошибки в приведённом тексте «Методы изучения генетики человека». Укажите
номера предложений, в которых сделаны ошибки, исправьте их.
(1)Для изучения
генетики человека используют специфические методы. (2)Генеалогический метод
основан на составлении родословной и изучении характера наследования
признака. (3)Этот метод эффективен при исследовании хромосомных мутаций.
(4)Близнецовый метод позволяет прогнозировать рождение однояйцевых близнецов.
(5)Цитогенетический метод основан на микроскопическом исследовании структуры
хромосом и их количества. (6)Данный метод используется в медицине для
установления геномных и хромосомных мутаций. (7)Характер наследования
гемофилии в королевских фамилиях Европы был установлен биохимическим методом
исследования.
Пояснение.
Ошибки допущены в
предложениях:
1. Предложение 3 —
эффективен при исследовании генных мутаций, (хромосомные мутации можно
исследовать цитогенетическим методом);
2. Предложение 4 —
близнецовый метод не прогнозирует рождение близнецов, а позволяет изучить
взаимодействие генотипа и факторов среды обитания (влияние факторов среды на
развитие фенотипа);
3. Предложение 7 —
характер наследования гемофилии был установлен генеалогическим методом
(биохимический метод изучает заболевания, в основе которых лежит нарушение
обмена веществ).
Методы селекции
Методы селекции:
·
скрещивание (гибридизация) нужно для выведения новых сортов,
пород или штаммов
·
инбридинг(родственное скрещивание) необходим чтобы получить
чистые линии ( гомозиготы)
·
аутбридинг (неродственное скрещивание) — скрещивание разных
сортов, пород. В итоге достигнут гетерозис — повышенная урожайность,
жизнестойкость
·
отдаленная гибридизация -скрещивание разных видов, потомки не
могут размножаться, устраняется полиплоидией
Методы селекции
микроорганизмов
1. Икусственный мутагенез
С помощью мутагенов повышают в сотни раз
мутационный процесс у микроорганизмов в целях получения нужных мутаций
Выберите
два верных ответа из пяти. Искусственный мутагенез используют для
1) получения организмов с
новыми свойствами
2) сохранения полезных
свойств организма
3) получения новых пород
млекопитающих животных
4) выведения чистых линий
5) получения новых
штаммов бактерий
Пояснение.
Искусственный
мутагенез — метод селекции бактерий (для
выведения новых штаммов) и селекции растений (для
выведения новых сортов). В результате искусственного мутагенеза
получают организмы с измененным генотипом и новыми свойствами.
(1) получения организмов
с новыми свойствами — используют искусственный мутагенез;
(2) сохранения полезных
свойств организма — не используют искусственный мутагенез, при мутагенезе
свойства изменяются;
(3) получения новых пород
млекопитающих животных — в селекции животных не используют искусственный
мутагенез;
(4) выведения чистых
линий — не используют искусственный мутагенез;
(5) получения новых
штаммов бактерий — используют искусственный мутагенез.
2. Искусственный отбор
Отбор рас микроорганизмов, наиболее активно
синтезирующих необходимые человеку вещества
3.Генная инженерия
Встраивания в геном микроорганизма новых генов,
гибридизация разных штаммов.
Методы
селекции растений
1.Гибридизация
-близкородственная (инцухт)
скрещивание сортов (чистых линий) с целью получения у гибридов
эффекта гетерозиса;
-неродственная (аутбридинг) — скрещивание особей разных видов или родов с целью получения
гибридов, сочетающих признаки двух разных растений
Капустно-редечный гибрид создан методом
отдалённой гибридизации. Отдаленной гибридизацией называется такие
скрещивания, когда подобранные пары принадлежат различным видам или родам, т.
е. являются отдаленными не в географическом, а в родственном отношении.
2.Искусственный отбор
массовый — отбор по фенотипу
группы особей;
индивидуальный — отбор единичных
особей
3.Мутагенез
изменение наследственности с помощью мутагенов с целью получения
полиплоидов и гибридов с новыми признаками
воздействие на семена пшеницы рентгеновскими
лучами в условиях эксперимента
4.Культура клеток и тканей
выращивание растений из отдельных клеток или тканей, в том числе
получение гаплоидов, выращенных из гамет гибридов — это современный метод —
относящийся к биотехнологии
КУЛЬТУРА ТКАНИ
Установите последовательность этапов размножения растений с помощью культуры
ткани. Запишите соответствующую последовательность цифр.
1) деление выделенных клеток и получение клеточной массы
2) отделение клеток образовательной ткани растения и помещение их в
питательную среду
3) пересадка молодого растения в грунт
4) дифференцировка тканей и органов
5) обработка клеточной массы фитогормонами для дифференцировки клеток
Ответ
21543
5.Хромосомная инженерия
внедрение хромосом растений одного сорта (вида) в геном растения
другого сорта (вида)
6.Генная инженерия
перенос генов растения одного вида (сорта) в генотип растения
другого вида (сорта), получение трансгенных растений — это современный метод
— относящийся к биотехнологии
7.Метод ментора
способ направленного развития («воспитания») молодых гибридных
растений при их прививке на другой сорт, разработанный И. В. Мичуриным.
8.Массовый отбор
в выведении новых сортов растений предусматривает опыление сразу
большого количества растений. Чаще всего этот метод применяется при выведении
новых сортов ржи, кукурузы, подсолнечника, пшеницы.
9.Получение полиплоидов
Человек давно использует полиплоидию (кратное увеличение числа
хромосом) для выведения высокопродуктивных сортов сельскохозяйственных растений.
Методы
селекции животных
1.Гибридизация
близкородственная (инбридинг)
— скрещивание близкородственных особей с целью получения гибридов с
гомозиготным состоянием генов;
неродственная (аутбридинг) —
скрещивание домашних животных с дикими предками (внутривидовая неродственная
гибридизация) и межвидовая неродственная гибридизация
2. Искусственный отбор
индивидуальный отбор по хозяйственно полезным
признакам и экстерьеру
3. Испытание родителей по потомству
для оценки племенных качеств производителей
4. Искусственное осеменение
для интенсивного использования ценных производителей
5. Полиэмбриония
получение нескольких близнецовых зародышей из одной зиготы
6.Клеточное клонирование (клеточная
инженерия)
ядро соматической клетки пересаживают в
лишённую ядра яйцеклетку с последующим выращиванием зародыша во взрослый
организм.
7. Генная инженерия
перенос генов одного вида (породы) в генотип другого вида
(породы), получение трансгенных животных
8.Оценка по экстерьеру
Экстерьером называют внешние формы животных.При оценке
экстерьера учитывают как общее сложение животного, его гармоничность и
соответствие с развитием отдельных частей, так и развитие отдельных частей.
Методы
изучения эволюции — это доказательства эволюции живой природы
Палеонтологический
метод, позволяющий выяснить родство между
древними организмами, останки которых находятся в разных геологических слоях
земной коры.
·
филогенетический ряд лошади
·
окаменелости и отпечатки организмов
Морфологические
методы (методы
сравнительной анатомии, гистологии и др.):
Сравнительно-анатомический метод
а) изучение гомологичных (сходных
по строению и происхождению) и аналогичных (сходных по функции) органов;
б) изучение рудиментов (органов и
структур, утративших свое назначение в процессе филогенеза) и атавизмов
(“возврат к предкам” — появление органов, характерных для далеких предков);
в) изучение
сравнительно-анатомических рядов — гомологии органов у специально подобранных
организмов. Например, изменение конечностей в ряду современных
непарнокопытных млекопитающих (тапира, носорога, лошади), показывающих путь
эволюции, приведший к возникновению однопалой ноги у лошади.
·
колючки кактуса и колючки барбариса
·
многососковость у человека
·
аппендикс у человека
Биогеографический
·
сравнение
фаун и флор, а также изучение особенностей развития современных континентов
Земли
·
изучение
эволюции островных фаун и флор
·
изучение
реликтовых (виды с комплексом признаков, характерных для давно вымерших групп
прошлых эпох) и эндемичных (нехарактерных для данной географической зоны)
видов растений и животных
·
флора и фауна континентов
·
эндемики озера Байкал
Эмбриологический
выявление
зародышевого сходства между организмами отдаленными в систематическом
отношении (закон зародышевого сходства К.Бэра)
·
сходство зародышевого развития хордовых на
ранних этапах развития
·
закладка жаберных дуг в онтогенезе человека
Биотехнология — методы и приёмы получения полезных для человека
продуктов и явлений с помощью живых организмов (бактерий, дрожжей и др.).
Клеточная инженерия
совокупность методов, используемых для
конструирования новых клеток:
·
культивирование и клонирование клеток на
специально подобранных средах гибридизацию клеток
·
пересадку клеточных ядер
КЛЕТОЧНАЯ
ИНЖЕНЕРИЯ
1. Выберите два верных ответа из пяти и запишите цифры, под которыми они
указаны. В клеточной инженерии используют следующие методы:
1) клонирование
2) культура клеток и тканей
3) микробиологический синтез
4) пересадка природных генов в ДНК бактерий или грибов
5) центрифугирование
Ответ
12
Генная
инженерия
·
введение плазмид в бактериальные клетки
·
получение рекомбинантной ДНК и РНК
Установите последовательность этапов
получения штамма бактерий, содержащих ген животного, с использованием метода
генной инженерии. Запишите в таблицу соответствующую последовательность цифр.
1) встраивание фрагмента ДНК в плазмиду
2) подбор животного, содержащего необходимый аллель
3) размножение прокариотической клетки с гибридной плазмидой
4) введение гибридной плазмиды в клетку бактерии
5) выделение нужного фрагмента ДНК из клетки животного
Ответ
25143
Примеры использования генной инженерии:
- Инсулин
получают из бактерии кишечной палочки с пересаженным человеческим геном
инсулина. - В
культурное растение пересаживают ген устойчивости к гербициду, при
обработке поля гербицидом все сорняки погибают, а культурное растение –
нет. - В
культурное растение пересаживают ген яда, убивающего некоторые виды
насекомых. Поле, засеянное этими растениями, не нужно обрабатывать
инсектицидами. - В рапс
пересажен ген устойчивости к засолению почвы из другого растения.
Установите
соответствие между приёмами и методами биотехнологии: для этого к каждому
элементу первого столбца подберите соответствующий элемент из второго
столбца.
|
А) работа с каллусной тканью Б) введение плазмид в бактериальные клетки В) гибридизация соматических клеток Г) трансплантация ядер клеток Д) получение рекомбинантной ДНК и РНК Ответ: 12112. |
МЕТОДЫ 1) клеточная инженерия 2) генная инженерия |