Марганец
Содержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам.

Для соединений марганца характерны степени окисления +2, +3, +4, +6 +7. В соединения +2 и +3 марганец проявляет основные свойства, +4 —
амфотерные, +6, +7 — кислотные.

Наиболее известными минералами, в которых содержится марганец, являются:
- MnO2 — пиролюзит
- MnO(OH) — бурая марганцевая руда, манганит
- 3Mn2O3*MnSiO3 — браунит

Получают марганец алюминотермией, восстановлением коксом, электролизом.
MnO2 + Al = (t) Al2O3 + Mn
MnO2 + C = (t) Mn + CO
MnSO4 + H2O = (электролиз) Mn + O2 + H2SO4
Химические свойства
- Реакции с неметаллами
- Реакция с водой
- Реакции с кислотами
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка.
Mn + O2 = MnO2
При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором.
Mn + N2 = (t) Mn3N2
Mn + C = (t) Mn3C
Mn + Si = (t) Mn2Si
Mn + P = (t) Mn3P2

При нагревании марганец вытесняет водород из воды.
Mn + H2O = (t) Mn(OH)2 + H2↑
Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот.
Mn + HCl = MnCl2 + H2↑
Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется.
Mn + H2SO4(конц.) = MnSO4 + SO2 + H2O
Mn + HNO3(конц.) = (t) Mn(NO3)2 + NO2 + H2O
Mn + HNO3(разб.) = (t) Mn(NO3)2 + NO + H2O

Соединения марганца (II)
Для соединений марганца (II) характерны основные свойства. Оксид марганца (II) может быть получен разложением карбоната марганца, либо
восстановлением оксида марганца (IV) до оксида марганца (II).
При растворении (и нагревании!) марганца в воде образуется гидроксид марганца (II).
Mn + H2O = (t) Mn(OH)2 + H2↑
MnSO4 + KOH = (t) Mn(OH)2 + K2SO4
Соединения марганца (II) на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца (IV).
Mn(OH)2 + O2 = MnO2 + H2O
Оксид и гидроксид марганца (II) проявляют основные свойства. При реакции с кислотами дает соответствующие
соли.
Mn(OH)2 + HCl = MnCl2 + H2O

Соли марганца (II) получаются при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если
выпадает осадок, выделяется газ или образуется слабый электролит.
Mn + HCl = MnCl2 + H2
MnSO4 + (NH4)2S = MnS↓ + (NH4)2SO4
При действии сильных окислителей ион Mn2+ способен переходить в ион Mn7+
MnSO4 + PbO2 + HNO3 = HMnO4 + PbSO4 + Pb(NO3)2 + H2O
Соединения марганца (IV) проявляют амфотерный характер. Оксид марганца (IV) можно получить разложением нитрата марганца (II).
Mn(NO3)2 = (t) MnO2 + NO2
Кислород в продуктах реакции не указываем, так как он участвует в окислении MnO до MnO2.

В реакциях с щелочами марганец переходит в СО +6, в кислой среде — принимает СО +2.
MnO2 + Na2CO3 + NaNO3 = Na2MnO4 + NaNO2 + CO2 (гидролиз карбоната натрия идет по аниону, среда — щелочная)
MnO2 + HCl = MnCl2 + Cl2 + H2O

Соединения марганца (VI) — MnO3, H2MnO4 — неустойчивы, в свободном виде не получены. Обладают кислотными свойствами.
Наиболее устойчивые соли — манганаты, окрашивающие раствор в зеленый цвет.
Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде.
KMnO4 = (t) K2MnO4 + MnO2 + O2↑ (способ получения кислорода)
Li2SO3 + KMnO4 + LiOH = Li2SO4 + K2MnO4 + H2O
MnO2 + NaOH + NaNO3 = Na2MnO4 + NaNO2 + H2O
MnSO4 + KClO3 + KOH = K2MnO4 + KCl + K2SO4 + H2O

В водной среде манганаты разлагаются на с.о. +7 и +4. Манганаты окисляют хлором.
K2MnO4 + H2O = KMnO4 + MnO2 + KOH
K2MnO4 + Cl2 = KMnO4 + KCl
Соединения марганца (VII) — неустойчивый Mn2O7, и относительно устойчивая в разбавленных растворах HMnO4 — проявляют
кислотные свойства. Соли марганцовой кислоты — перманганаты.
В различных средах — кислотной, нейтральной и щелочной — марганец принимает различные степени окисления. Внимательно изучите таблицу ниже.
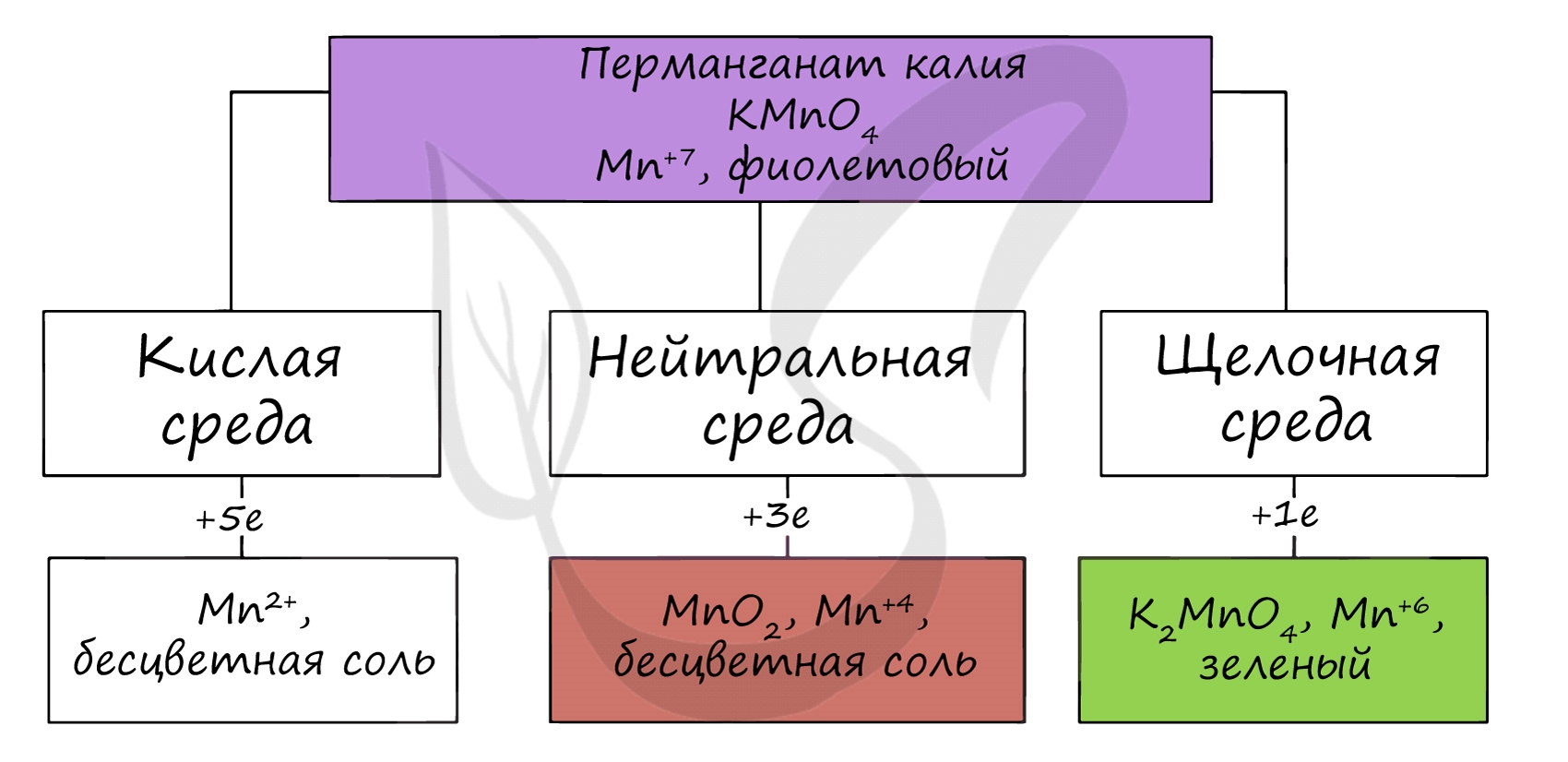
Оксид марганца (VII) получают в реакции перманганата с сильными кислотами.
KMnO4 + H2SO4 = Mn2O7 + K2SO4 + H2O
При растворении оксида марганца (VII) (кислотного оксида) в щелочи образуются соли марганцовой кислоты — перманганаты.
Mn2O7 + KOH = KMnO4 + H2O
Марганцовая кислота получается в реакциях сильных окислителей с солями марганца (II).
Mn(NO3)2 + PbO2 + HNO3 = HMnO4 + Pb(NO3)2 + H2O
В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение.
HMnO4 = MnO + O2 + H2O
При нагревании перманганата калия (в быту — марганцовка) разлагается с образованием бурого MnO2, выделением кислорода.
KMnO4 = (t) K2MnO4 + MnO2 + O2↑

При стоянии в растворе постепенно разлагается водой.
KMnO4 + H2O = MnO2 + KOH + O2↑
В кислой среде марганец принимает наиболее устойчивую (для кислой среды) — Mn2+, в щелочной — Mn6+.
KMnO4 + H2O2 + H2SO4 = MnSO4 + O2↑ + K2SO4 + H2O
KMnO4 + KOH = K2MnO4 + O2 + H2O
Цинк
Название цинка, вероятно, связано формой его кристаллитов: в переводе с немецкого Zinke — зубец. С древнейших времен известен сплав
меди с цинком — латунь.

Для цинка характерна постоянная степень окисления +2.

Наиболее известные минералы, в которых содержится цинк:
- ZnS — цинковая обманка, сфалерит
- ZnO — цинкит
- ZnCO3 — симсонит, цинковый шпат
- 2ZnO*SiO2*H2O — гемиморфит

Получение
Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка
различными восстановителями: чаще всего C, также возможно CO и H2.
ZnS + O2 = (t) ZnO + SO2
ZnO + C = (t) Zn + CO
ZnO + H2 = (t) Zn + H2O
ZnO + CO = (t) Zn + CO2

Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
ZnSO4 + H2O = (электролиз) Zn + H2SO4 + O2
Химические свойства
- Реакции с неметаллами (и аммиаком
- Реакции с кислотами
- Реакции с щелочами
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном.
Zn + O2 = ZnO
Zn + Br2 = (t) ZnBr2
Zn + P = (t) Zn3P2
Zn + S = (t) ZnS

Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком.
Zn + NH3 = (t) Zn3N2 + H2↑
Zn + HCl = ZnCl2 + H2↑
Zn + H2SO4(разб.) = ZnSO4 + H2↑
Zn + H2SO4(конц.) = ZnSO4 + H2S↑ + H2O
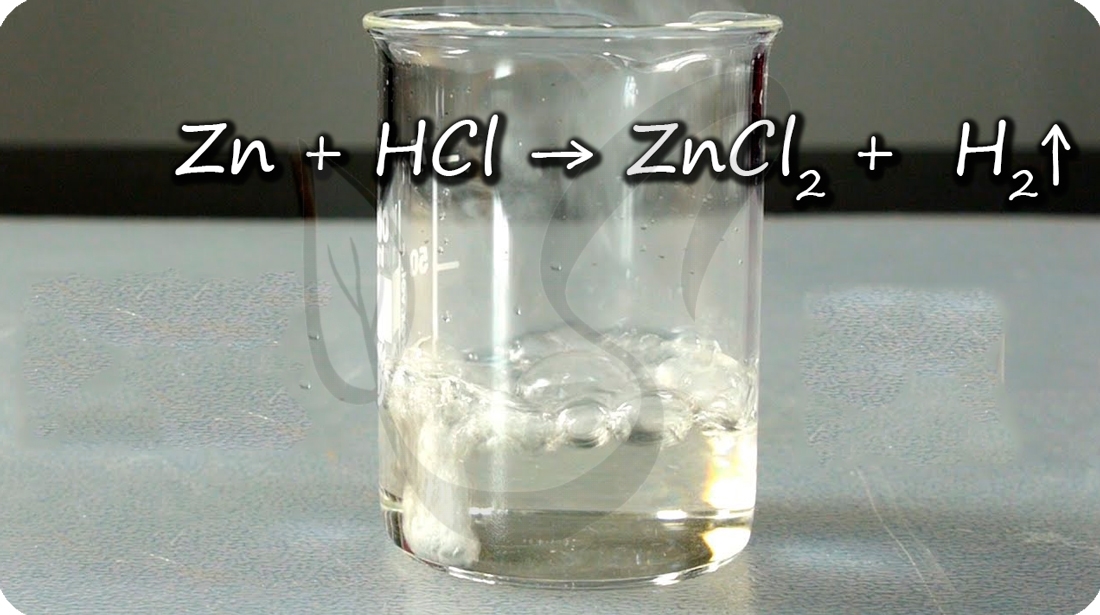
Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями.
При добавлении цинка в раствор щелочи выделяется водород.
Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия)
Соединения цинка (II)
Эти соединения обладают амфотерными свойствами. Оксид цинка (II) можно получить в ходе реакции горения цинка или
при разложении нитрата цинка.
Zn + O2 = (t) ZnO
Zn(NO3)2 = (t) ZnO + NO2↑ + O2↑
Оксид цинка (II) проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами.
ZnO + HCl = ZnCl2 + H2O
ZnO + H2SO4 = ZnSO4 + H2O
ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Комплексные соли образуются в растворе, при прокаливании они не образуются.
ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия)
Оксид цинка (II) может быть восстановлен до чистого цинка различными восстановителями.
ZnO + C = (t) Zn + CO
ZnO + H2 = (t) Zn + H2O
ZnO + CO = (t) Zn + CO2
Гидроксид цинка (II) получается в ходе реакций между растворимыми солями цинка и щелочами.

ZnSO4 + NaOH = Na2SO4 + Zn(OH)2↓
Гидроксид цинка (II) обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями.
Zn(OH)2 + HCl = ZnCl2 + H2O
Zn(OH)2 + HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + NaOH = Na2[Zn(OH)4]
При прокаливании комплексные соли распадаются, вода испаряется.
Na2[Zn(OH)4] = (t) Na2ZnO2 + H2O
Zn(OH)2 + NaOH = (t) Na2ZnO2 + H2O
Серебро
Драгоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом,
серебро обладает низкой реакционной способностью.

Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- С солями
- С органическими веществами
Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов.
При нагревании с серой получается сульфид серебра.
Ag + Cl2 = AgCl
Ag + S = (t) Ag2S
Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами.
Ag + HNO3(конц.) = AgNO3 + NO2↑ + H2O
Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода.
Ag + H2S + O2 = Ag2S + H2O

Ag + FeCl3 = AgCl + FeCl2
В дальнейшем, при изучении органической химии, вы не раз столкнетесь с соединением серебра — аммиачным раствором оксида серебра.
Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты.
CH3CHO + [Ag(NH3)2]OH = CH3COOH + Ag + NH3 + H2O
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Медь. Серебро
Разбор сложных заданий в тг-канале:
Медь ($Cu$) — элемент побочной подгруппы первой группы. Электронная формула: ($…3d^{10}4s^1$). Десятый d-электрон атома меди подвижный, т. к. переместился с $4s$-подуровня. Медь в соединениях проявляет степени окисления $+1(Cu_2O)$ и $+2(CuO)$.
Медь — мягкий, блестящий металл, имеющий красную окраску, ковкий и обладает хорошими литейными качествами, хороший тепло- и электропроводник. Температура плавления $1083°С$.
Как и другие металлы побочной подгруппы I группы Периодической системы, медь стоит в ряду активности правее водорода и не вытесняет его из кислот, но реагирует с кислотами-окислителями:
$Cu+2H_2SO_{4(конц.)}=CuSO_4+SO_2↑+2H_2O$;
$Cu+4HNO_{3(конц.)}=Cu(NO_3)_2+2NO_2↑+2H_2O$.
Под действием щелочей на растворы солей меди выпадает осадок слабого основания голубого цвета — гидроксида меди (II), который при нагревании разлагается на основный оксид $CuO$ черного цвета и воду:
$Cu^{2+}+2OH^{–}=Cu(OH)_2↓; Cu(OH)_2 {→}↖{t°} CuO+H_2O$
Химические свойства металлов
Характерные химические свойства простых веществ – металлов:
Химические свойства щелочных металлов
Химические свойства щелочноземельных металлов
Химические свойства магния
Химические свойства алюминия
Химические свойства меди
Химические свойства цинка
Химические свойства хрома
Химические свойства железа
Admin
Архив автора
Сайт автора
21.09.2021
Материалы по химии
Предыдущая запись
Следующая запись
1 комментарий
Добавить ваш
-
Ольга
10.03.2022 в 19:50
Замечательные подборки материала для подготовки к ЕГЭ Спасибо большое
Добавить комментарий
Ваш адрес email не будет опубликован. Обязательные поля помечены *
Комментарий *
Имя *
Email *
Сайт
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
-
Серебро
является предпоследним d-элементом
в своем периоде. Вследствие устойчивости
d10-
конфигурации энергетически более
выгоден переход одного из ns-электронов
в (n-1)
d-состояние.
Поэтому Ag
в s-состоянии
внешнего слоя имеет по одному, а в
предпоследнем слое по 18 электронов.
(S2p6d10) -
Уменьшение
энергии ионизации при переходе от Cu
к Ag
зависит от главного квантового числа
n. -
Для
подгруппы меди возможны С.О: +1,+2,+3.
Для
Ag
наиболее характерна С.О.: +1.
Особая
устойчивость в этой С.О. объясняется
прочностью конфигурации 4d10.
С.О.
+1 : Ag2O; AgNCS; [Ag(CN)2]
-
Особенность
электронной структуры обуславливает
относительно большую устойчивость
двухатомных молекул ( Ag2).
Прочность связана с образованием
дополнительных п-связей за счёт свободных
np-орбиалей
и (n-1)
d-электронных
пар.
-
Серебро
встречается в природе в самородном
состоянии.
Серебро
входит в состав сульфидных минералов
других металлов ( Pd,
Zn,
Cd
и др.). Может входить в состав арсенидных,
стибидных и сульфидарсенидных минераллов.
-
Серебро
представляет собой белый металл с
гранецентрированной кубической
решеткой.
Характеризуется
хорошей пластичностью, хорошей тепло-
и электропроводимостью.
Химические
св-ва:
-
Реагирует
с галогенами при нагревании:
2Ag+I2=2AgI
-
Взаимодействует
с серой:
2Ag+S=Ag2S
-
Взаимодействие
с сероводородом:
2Ag+H2S=Ag2S+H2
-
Не
взаимодействует с кислородом. При
наличии в воздухе сероводорода серебро
покрывается черным налётом Ag2S:
4Ag+2H2S+O2=2Ag2S+2H2O
-
С
водородом не реагирует
-
Ag
растворяется в HNO3
и конц. H2SO4
, в HCL
с присутствием свободного кислорода.
( т.к. в ряду напряжения располагается
после H
, кислоты могут окислять серебро только
за счёт аниона):
Ag
+ 2HNO3 = AgNO3 + NO2 + H2O
2Ag+2H2SO4=Ag2SO4+SO2+2H2O
2Ag+2HCL=2AgCl+H2
-
Растворяется
в хлорном железе ( применяют для
травления):
Ag+FeCl3=AgCl+FeCl2
-
В
отсутствии окислителей Ag
устойчиво к щелочам
-
Растворяется
в растворах оснОвных цианидов в
присутствии кислорода
4Ag+8NaCN+O2+2H2O=4Na[Ag(CN)2]+4NaOH
15)Положение в периодической системе
Хром — элемент
побочной подгруппы 6-ой группы 4-го
периода периодической системы
химических элементов Д. И. Менделеева с атомным
номером 24. Обозначается
символом Cr(лат. Chromium). Простое
вещество хром —
твёрдый металлголубовато-белого цвета.
Хром иногда относят к чёрным металлам.
Строение атома
+17
Cl )2 )8 )7 — схема строения атома
1s2s
2p
3s
3p
—
электронная формула
Атом
располагается в III периоде, и имеет три
энергетических уровня
Атом
располагается в VII в группе, в главной
подгруппе – на внешнем энергетическом
уровне 7 электронов
Получение.
При
сильном нагреве хромистого железняка
с углем происходит восстановление хрома
и железа:
FeO
* Cr2O3 +
4C = 2Cr + Fe + 4CO
В
результате этой реакции образуется
сплав хрома с железом, отличающийся
высокой прочностью. Для получения
чистого хрома, его восстанавливают из
оксида хрома(3) алюминием(способ
Бекетова):Cr2O3 +
2Al = Al2O3 +
2Cr
(В
данном процессе обычно используют два
оксида – Cr2O3 и
CrO3)
Физические
свойства
Хром
— белый блестящий металл с кубической
объемно-центрированной решеткой, а
= 0,28845 нм, отличающийся твердостью и
хрупкостью, с плотностью 7,2 г/см3,
один из самых твердых чистых металлов
(уступает только бериллию, вольфраму
и урану), с температурой плавления
1903 град. И с температурой кипения около
2570 град. С. На воздухе поверхность хрома
покрывается оксидной пленкой, которая
предохраняет его от дальнейшего
окисления. Добавка углерода к хрому еще
больше увеличивает его твердость.
Химические
свойства
Хром
при обычных условиях – инертный металл,
при нагревании становится довольно
активным.
Взаимодействие
с неметаллами
При
нагревании выше 600°С хром сгорает в
кислороде: 4Cr + 3O2 =
2Cr2O3.
С
фтором реагирует при 350°С, с хлором –
при 300°С, с бромом – при температуре
красного каления, образуя галогениды
хрома (III): 2Cr + 3Cl2 =
2CrCl3.
С
азотом реагирует при температуре выше
1000°С с образованием нитридов:
2Cr + N2 =
2CrN или 4Cr + N2 =
2Cr2N.
Сера
при температуре выше 300°С образует
сульфиды от CrS до Cr5S8,
например: 2Cr + 3S = Cr2S3.
Реагирует
с бором, углеродом и кремнием с образованием
боридов, карбидов и силицидов:
Cr
+ 2B = CrB2 (возможно
образование Cr2B,
CrB, Cr3B4,
CrB4),
2Cr
+ 3C = Cr2C3 (возможно
образование Cr23C6,
Cr7B3),
Cr
+ 2Si = CrSi2 (возможно
образование Cr3Si,
Cr5Si3,
CrSi).
С
водородом непосредственно не
взаимодействует.
-
Взаимодействие
с водой
В
тонкоизмельченном раскаленном состоянии
хром реагирует с водой, образуя оксид
хрома (III) и водород:
2Cr
+ 3H2O
= Cr2O3 +
3H2
-
Взаимодействие
с кислотами
В
электрохимическом ряду напряжений
металлов хром находится до водорода,
он вытесняет водород из растворов
неокисляющих кислот: Cr
+ 2HCl
= CrCl2 +
H2;
Cr
+ H2SO4 =
CrSO4 +
H2.
В
присутствии кислорода воздуха образуются
соли хрома (III): 4Cr
+ 12HCl
+ 3O2 =
4CrCl3 +
6H2O.
Концентрированная
азотная и серная кислоты пассивируют
хром. Хром может растворяться в них лишь
при сильном нагревании, образуются соли
хрома (III) и продукты восстановления
кислоты:
2Cr
+ 6H2SO4 =
Cr2(SO4)3 +
3SO2 +
6H2O;
Cr + 6HNO3 =
Cr(NO3)3 +
3NO2 +
3H2O.
-
Взаимодействие
с щелочными реагентами
В
водных растворах щелочей хром не
растворяется, медленно реагирует с
расплавами щелочей с образованием
хромитов и выделением водорода: 2Cr
+ 6KOH
= 2KCrO2 +
2K2O
+ 3H2.
Реагирует
с щелочными расплавами окислителей,
например хлоратом калия, при этом хром
переходит в хромат калия: Cr
+ KClO3 +
2KOH
= K2CrO4 +
KCl
+ H2O.
-
Восстановление
металлов из оксидов и солей
Хром
– активный металл, способен вытеснять
металлы из растворов их солей: 2Cr +
3CuCl2 =
2CrCl3 +
3Cu.
в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 236 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
При нагревании образца нитрата серебра(I) часть вещества разложилась, при этом образовался твёрдый остаток массой 88,0 г. К этому остатку добавили 200 г 20%-ной соляной кислоты, в результате чего образовался раствор массой 205,3 г с массовой долей хлороводорода 15,93%. Определите объём смеси газов, выделившейся при разложении нитрата серебра(I).
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Источник: ЕГЭ — 2018, основная волна. Задания 34 (С5).
При разложении нитрата серебра выделилась смесь газов объемом 6,72 л (в пересчете на н. у.). Масса остатка составила 25 г. После этого остаток поместили в 50 мл воды и добавили 18,25 г 20%-ного раствора соляной кислоты. Определите массовую долю соляной кислоты в полученном растворе. В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Источник: Задания 33 (С4). Сергей Широкопояс: Химия — подготовка к ЕГЭ 2016
При нагревании образца нитрата серебра часть вещества разложилась и выделилась смесь газов объёмом 6,72 л (в пересчёте на н. у.). Масса остатка составила 25,0 г. После этого остаток поместили в 50 мл воды и добавили 18,25 г 20%-ной соляной кислоты. Определите массовую долю хлороводорода в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Источник: ЕГЭ — 2018, основная волна. Задания 34 (С5).
При сливании раствора нитрата серебра с избытком раствора хлорида натрия образовался осадок массой 28,6 г. Масса нитрата серебра в исходном растворе равна ___________ г. (Запишите число с точностью до целых.)
1) 43
2) 12
3) 23
4) 34
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 3
Хлорат калия разложили в присутствии катализатора — оксида марганца (IV), в результате чего выделился кислород объемом 6,72 л (в пересчете на н. у.). Масса сухого остатка составила 16 г. Этот остаток прореагировал с 170 г 30%-ного раствора нитрата серебра. Определите массовую долю нитрата серебра в образовавшемся растворе. В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Источник: Задания 33 (С4). Сергей Широкопояс: Химия — подготовка к ЕГЭ 2016
Масса осадка, образовавшегося при смешивании раствора, содержащего 34 г нитрата серебра, и избытка раствора хлорида натрия, равна ____________ г. (Запишите число с точностью до десятых.)
1) 13,5
2) 28,7
3) 13,3
4) 14,6
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 3
Задания Д26 № 686
Для подтверждения качественного состава хлорида алюминия необходимы растворы
1) фосфата калия и бромида серебра
2) нитрата серебра и гидроксида калия
3) нитрата натрия и гидроксида бария
4) хлорида кальция и фенолфталеина
Раствор нитрата меди(II) массой 2 кг 730 г с массовой долей нитрата меди(II) 18,8 %, содержащий в качестве примеси нитрат серебра(I), разлит на 2 колбы в отношении 1 : 2. В первую колбу, содержащую меньшую часть раствора, опустили медную проволоку. После завершения реакции проволоку извлекли из раствора. При этом массовая доля нитрата меди(II) в первой колбе составляла 20 % (возможной реакцией меди с нитратом меди(II) пренебречь). В раствор во второй колбе внесли порошок цинка, в результате получили бесцветный раствор. Определите массовую долю соли в конечном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Источник: Задания 34 ЕГЭ–2021 по химии
Медную пластинку массой 30,0 г опустили в раствор нитрата серебра. После длительного выдерживания в растворе пластинку вынули, высушили и взвесили. Масса пластинки оказалась равна 37,6 г, а масса раствора, из которого вынули пластинку, составила 242,4 г. Рассчитайте массовую долю нитрата серебра в исходном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите необходимые вычисления с указанием единиц измерения искомых физических величин.
При взаимодействии соли первичного амина с нитратом серебра образуется органическое вещество А и бромид серебра. Вещество А содержит 25,93% азота, 7,41% водорода и 44,44% кислорода по массе. На основании данных условия задания:
1) проведите необходимые вычисления и установите молекулярную формулу органического вещества А;
2) составьте возможную структурную формулу вещества А, которая однозначно отражает порядок связи атомов;
3) напишите уравнение реакции получения вещества А взаимодействием соли первичного амина и нитрата серебра (используйте структурную формулу органического вещества).
Источник: ЕГЭ по химии 2022. Досрочная волна
Смесь хлорида и бромида калия общей массой 5,36 г растворили в воде и к полученному раствору добавили 200 г 6,8%-го раствора нитрата серебра. После отделения осадка в фильтрат поместили цинковую пластинку, при этом 0,65 г цинка растворилось. Определите состав исходной смеси солей (в % по массе). Примите Ar(Zn) = 65, Ar(Cl) = 35,5.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите необходимые вычисления с указанием единиц измерения искомых физических величин.
При разложении 68 г нитрата серебра образовалось 8 л оксида азота(IV). Вычислите выход реакции (%). Объемы газов измерены при нормальных условиях. (Запишите число с точностью до десятых.)
К 60 г раствора дигидрофосфата натрия, в котором 55% от общей массы раствора составляет масса протонов в ядрах всех атомов, добавили 40 г 15%-ного раствора гидроксида натрия. Затем к образовавшемуся раствору добавили 51 г нитрата серебра. Определите массовую долю нитрата серебра в конечном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения и обозначения искомых физический величин).
Источник: ЕГЭ по химии 26.05.2022. Основная волна. Урал
При проведении электролиза 340 г 20%-го раствора нитрата серебра(I) процесс прекратили, когда на аноде выделилось 1,12 л газа (н. у.). Из полученного раствора отобрали порцию массой 79,2 г. Вычислите массу 10%-го раствора хлорида натрия, необходимого для полного осаждения ионов серебра из отобранной порции раствора.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Источник: ЕГЭ — 2018, основная волна. Задания 34 (С5).
В двух пробирках находился водный раствор нитрата серебра. В одну пробирку добавили водный раствор вещества X и наблюдали образование жёлтого осадка, а в другую — избыток водного раствора вещества Y, в результате чего сначала образовался тёмный осадок, который затем растворился. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1)
2)
3)
4)
5)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Источник: СтатГрад: Тренировочная работа 09.11.2022. Вариант ХИ2210202.
Соль первичного амина прореагировала с нитратом серебра, в результате чего выделился осадок и образовалось органическое вещество А, содержащее по массе 29,79% азота, 51,06% кислорода и 12,77% углерода.
На основании данных условия задачи:
1) произведите вычисления, необходимые для нахождения формулы вещества А;
2) установите его молекулярную формулу;
3) составьте структурную формулу этого вещества А, которая отражает порядок связей атомов в молекуле;
4) напишите уравнение реакции получения вещества А из соли первичного амина и .
Источник: Задания 34 (С5). Сергей Широкопояс: Химия — подготовка к ЕГЭ 2016
Для выполнения задания используйте следующий перечень веществ: оксид фосфора (III), хлорноватая кислота, иодид натрия, нитрат серебра (I), диоксид углерода. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
1
Для выполнения задания используйте следующий перечень веществ: оксид фосфора(III), хлорноватая кислота, иодид натрия, нитрат серебра(I), диоксид углерода. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Смесь, состоящую из нитрата цинка, нитрата меди(II) и нитрата серебра(I), растворили в воде. При этом получился раствор, в котором массовая доля нитрата цинка 18,9 %, а массовая доля нитрата меди(II) 9,4 %. В первую колбу налили 500 г этого раствора и внесли медную проволоку. После окончания реакции массовая доля нитрата меди(II) в колбе составила 25,5 %. Во вторую колбу налили 200 г этого раствора и добавили избыток порошка цинка. Вычислите массовую долю соли в конечном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Источник: Задания 34 ЕГЭ–2021 по химии
Смесь нитратов серебра и меди, общей массой 27,3 г, прокалили до постоянной массы. После окончания реакции полученное вещество частично растворилось в избытке соляной кислоты, а масса нерастворившегося остатка составила 5,4 г. Рассчитайте массовые доли (в%) нитратов в исходной смеси.
Смешали растворы нитрата серебра и хлорида натрия, в результате чего выпал белый творожистый осадок. Этот осадок отделили, а полученный раствор выпарили. Образовавшееся вещество прокалили и продукт, образованный при прокаливании, добавили к раствору перманганата калия. Выпавший в осадок порошок темно-коричневого цвета прореагировал с соляной кислотой, при этом наблюдали выделение желто-зеленого газа.
Напишите уравнения четырёх описанных реакций.
Источник: Задания 31 (С2). Сергей Широкопояс: Химия — подготовка к ЕГЭ 2016
Всего: 236 1–20 | 21–40 | 41–60 | 61–80 …
Серебро – довольно тяжёлый (ρ = 10,5 г/см
3
), блестящий (коэффициент отражения света близок к 100%), серебристо-белый металл, ковкий и пластичный (1 г серебра можно вытянуть тончайшую проволочку длиной почти 2 км!), лучший среди металлов проводник тепла (поэтому серебряная ложка в стакане горячего чая быстро нагревается) и электричества. Температура плавления 962°С.
Применение
Серебро известно с древнейших времён. Это связано с тем, что в своё время серебро, равно как и золото, встречалось в самородном виде – его не приходилось выплавлять из руд.
В старину из него изготовляли монеты, вазы, ювелирные изделия, тончайшими серебряными нитями украшали одеяния. Сейчас применение серебра не ограничивается ювелирным делом – оно идёт на производство зеркал с высокой отражающей способностью (недорогие зеркала покрывают алюминием), электрических контактов, аккумуляторов, используется в стоматологии, применяется в фильтрах противогазов, как дезинфицирующее вещество для обеззараживания воды. Некоторое время назад для лечения простуды использовали растворы коллоидного серебра – протаргол и колларгол.
Йодид серебра (AgI) применяется для управления климатом («разгон облаков»). Кристаллическая решетка йодида серебра очень схожа по строению с решеткой льда, поэтому введение небольшого количества иодида вызывает образование очагов конденсации в облаках, тем самым вызывая выпадение осадков.
Серебро зарегистрировано в качестве пищевой добавки Е-174.
Из серебра делают электроды для мощных цинк-серебряных аккумуляторов. Так, в аккумуляторах затонувшей американской подводной лодки «Трешер» было три тонны серебра. Высокую теплопроводность и химическую инертность серебра используют в электротехнике: из серебра и его сплавов делают электрические контакты, серебром покрывают провода в ответственных приборах. Из серебряно-палладиевого сплава (75% Ag) делают зубные протезы.
Огромные количества серебра раньше шли на изготовление монет. Сейчас из серебра делают в основном юбилейные и памятные монеты. Много серебра расходуется для изготовления ювелирных изделий и столовых приборов. На таких изделиях, как правило, ставят пробу, указывающую массу чистого серебра в граммах в 1000 г сплава (современная проба), либо число золотников в одном фунте сплава (дореволюционная проба). В 1 фунте содержится 96 золотников, поэтому, например, старой пробе 84 соответствует современная [(84/96)·1000] = 875. Советские рубли и полтинники имели пробу 900. Современные серебряные изделия могут иметь пробу 960, 925, 916, 875, 800 и 750.
Соединения серебра часто неустойчивы к нагреванию и действию света. Открытие светочувствительности солей серебра привело к появлению фотографии и быстрому увеличению спроса на серебро. Еще в середине 20 во всем мире ежегодно добывалось около 10 000 тонн серебра, а расходовалось значительно больше (дефицит покрывался за счет старых запасов). Вытеснение черно-белых фотографий и кинофильмов цветными позволило значительно снизить потребление серебра.
«Серебро не окисляется на воздухе, – писал Д.И.Менделеев в своем учебнике «Основы химии», – а потому причисляется к разряду так называемых благородных металлов». Но хотя серебро с кислородом непосредственно не реагирует, оно может растворять значительные количества этого газа. Даже твердое серебро при температуре 450° С способно поглотить пятикратный объем кислорода. Значительно больше кислорода (до 20 объемов на 1 объем серебра) растворяется в жидком металле.
Это свойство серебра приводит к красивому (и опасному) явлению – разбрызгиванию серебра, которое известно с древних времен. Если расплавленное серебро поглотило значительные количества кислорода, то затвердевание металла сопровождается высвобождением большого количества газа. Давлением выделяющегося кислорода корка на поверхности застывающего серебра разрывается, часто с большой силой. В результате происходит внезапное взрывное разбрызгивание металла.
При 170° С серебро на воздухе покрывается тонкой пленкой оксида Ag
2
О, а под действием озона образуются высшие оксиды (например Ag
2
O
3
). Но особенно «боится» серебро йода (йодной настойки) и сероводорода. Со временем серебряные изделия часто тускнеют и даже могут почернеть. Причина – действие сероводорода. Его источником могут быть не только тухлые яйца, но и резина, некоторые полимеры и даже продукты. В присутствии влаги серебро легко реагирует с сероводородом с образованием на поверхности тончайшей пленки сульфида Ag
2
S, из-за неровностей поверхности и игры света такая пленка иногда кажется радужной. Постепенно пленка утолщается, темнеет, становится коричневой, а потом черной.
Одной из важных сфер использования серебра являлась медицина. Древние египтяне, например, прикладывали серебряную пластину к ранам, добиваясь их быстрого заживления. Персидский царь Кир в военных походах перевозил воду только в серебряных сосудах. Знаменитый средневековый врач Парацельс лечил некоторые болезни AgNO
3
– нитратом серебра (ляписом). Этим средством в медицине пользуются и поныне.
Сравнительно недавно исследования клеток организма на содержание серебра привели к заключению, что оно повышено в клетках мозга.
Хорошо известно бактерицидное действие малых концентраций серебра на питьевую воду. При содержании 0,05 мг/л воду можно пить без вреда для здоровья. Вкус ее при этом не изменяется. (Для питья космонавтов допускается концентрация Ag
+
до 0,1 – 0,2 мг/л.).
Для дезинфекции воды в бассейнах было предложено насыщать ее бромидом серебра. Насыщенный раствор AgBr содержит 0,08 мг/л, что безвредно для здоровья человека, но губительно для микроорганизмов и водорослей.
Однако, как это часто бывает, то, что полезно в малых дозах, губительно в больших. Не составляет исключения и Ag.
Серебро при избыточном поступлении в организм вызывает снижение иммунитета, изменения в тканях головного и спинного мозга, приводит к заболеваниям печени, почек, щитовидной железы. Описаны случаи тяжёлого нарушения психики у людей при отравлении препаратами серебра. К счастью, в нашем теле через 1-2 недели остаётся всего 0,02 – 0,1 % введённого серебра, остальное выводится из организма.
При многолетней работе с серебром и его солями, когда они поступают в организм
длительно
, но
малыми дозами
, может развиться необычное заболевание – аргирия. Поступающее в организм серебро способно медленно отлагаться в виде металла в соединительной ткани и стенках капилляров разных органов, в том числе в почках, костном мозге, селезенке. Накапливаясь в коже и слизистых оболочках, серебро придает им серо-зеленую или голубоватую окраску, особенно сильную на открытых участках тела, подвергающихся действию света. Изредка окраска может быть настолько интенсивной, что кожа напоминает кожу негров.
Развивается аргирия очень медленно, первые ее признаки появляются через 2–4 года непрерывной работы с серебром, а сильное потемнение кожи наблюдается лишь спустя десятки лет. Раньше всего темнеют губы, виски и конъюнктива глаз, затем веки. Сильно могут быть окрашены слизистые оболочки рта и десны, а также лунки ногтей. Иногда аргирия проявляется в виде мелких сине-черных пятен. Раз появившись, аргирия не исчезает, и вернуть коже ее прежний цвет не удается. Если не считать чисто косметических неудобств, больной аргирией может не испытывать никаких болезненных ощущений или расстройств самочувствия (если не поражены роговица и хрусталик глаза); в этом отношении аргирию можно назвать болезнью лишь условно. Есть у этой болезни и своя «ложка меда» – при аргирии не бывает инфекционных заболеваний: человек настолько «пропитан» серебром, что оно убивает все болезнетворные бактерии, попадающие в организм.
Серебро в природе
Этот красивый металл известен людям с древнейших времен. Изделиям из серебра, найденным в Передней Азии, более 6 тысяч лет. Из сплава золота и серебра (электрума) были изготовлены первые в мире монеты. И в течение нескольких тысячелетий серебро было одним из основных монетных металлов.
Особенно богаты серебром были расположенные в Центральной Европе Рудные горы, Гарц, горы Богемии и Саксонии. Из серебра, добывавшегося близ города Иоахимсталя (ныне Яхимов в Чехии), были отчеканены миллионы монет. Они вначале так и назывались – «иоахимсталеры»; затем название укоротилось до «талера» (в России по первой части слова – «ефимка»). Эти монеты были в ходу по всей Европе, став самой распространенной серебряной монетой в истории. От талера произошло и название доллара.
После открытия Америки множество самородков серебра было найдено на территории современных Перу, Чили, Мексики, Боливии. Так, в Чили обнаружен самородок в виде пластины массой 1420 кг. Многие элементы имеют «географические» названия, Аргентина же – единственная страна, названная по уже известному элементу. Последние из самых крупных самородков серебра найдены уже в XX веке в Канаде (провинция Онтарио). Один из них, названный «серебряный тротуар», имел длину 30 м и уходил вглубь земли на 18 м. Когда из него было выплавлено чистое серебро, его оказалось 20 тонн!
Самородное серебро находят редко; основная часть серебра в природе сосредоточена в минералах, основной – аргентит Ag
2
S. Еще больше серебра рассеяно среди различных горных пород.
При описании любого элемента принято указывать его первооткрывателя и обстоятельства открытия. Такими данными об элементе № 47 человечество не располагает. Серебром люди стали пользоваться еще тогда, когда не было ученых.
Латинское название серебра Аргентумпроисходит от греческого «аргос»– белый, блестящий. Русское слово «серебро», как считают учёные, происходит от слова «серп» (серп луны). Блеск серебра напоминал лунное сияние и алхимикам, использовавшим в качестве символа элемента знак луны.
Серебро и стекло
. Эти два вещества встречаются не только в производстве зеркал. Серебро нужно для изготовления сигнальных стекол и светофильтров. Небольшая добавка (0,15 – 0,20 %) нитрата серебра (или азотнокислого серебра) придает стеклу интенсивную золотисто-желтую окраску. А оранжевое стекло получают, вводя в стекломассу золото и серебро одновременно.
Серебро лучше многих других металлов противостоит действию щелочей. Именно поэтому стенки трубопроводов, автоклавов, реакторов и других аппаратов химической промышленности покрывают серебром как защитным металлом.
И по звонкости серебро заметно выделяется среди других металлов. Недаром во многих сказках фигурируют серебряные колокольчики. Колокольных дел мастера издавна добавляли серебро в бронзу «для малинового звона». В наше время струны некоторых музыкальных инструментов делают из сплава, в котором 90% серебра.
Если серебро почернело …
При длительном хранении серебряные изделия тускнеют – покрываются тончайшим слоем сульфида серебра Ag
2
S. Чтобы вернуть изделию прежний блеск, необходимо снять сульфидную плёнку. Это можно сделать несколькими способами.
1) Смешать воду, нашатырный спирт и зубной порошок в виде кашицы. Это средство нанести на мягкую ткань и чистить изделия до удаления потемнения.
2) Прокипятить серебряное изделие (около 20 минут) в воде с добавлением пищевой соды и кусочков алюминиевой фольги или проволоки (или в алюминиевой посуде).
3) Обычный зубной порошок или зубная паста до сих пор не уступают ни одному из новейших средств. Потерев изделие бывшей щеткой для зубов, вы вернете ему первоначальный блеск.
Не важно, какое средство вы выберете для чистки изделий, обязательно промойте их тщательно после процедуры и вытрите насухо суконной тряпочкой.
Найди свое:
сиалис купить в украине
или виагру решать только вам. Мы же в свою очередь рады предложить выгодные цены на препараты.
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.




