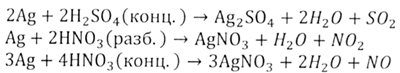Марганец
Содержится в количестве 0,03% по массе в земной коре. Наряду с железом и его сплавами относится к черным металлам.

Для соединений марганца характерны степени окисления +2, +3, +4, +6 +7. В соединения +2 и +3 марганец проявляет основные свойства, +4 —
амфотерные, +6, +7 — кислотные.

Наиболее известными минералами, в которых содержится марганец, являются:
- MnO2 — пиролюзит
- MnO(OH) — бурая марганцевая руда, манганит
- 3Mn2O3*MnSiO3 — браунит

Получают марганец алюминотермией, восстановлением коксом, электролизом.
MnO2 + Al = (t) Al2O3 + Mn
MnO2 + C = (t) Mn + CO
MnSO4 + H2O = (электролиз) Mn + O2 + H2SO4
Химические свойства
- Реакции с неметаллами
- Реакция с водой
- Реакции с кислотами
На воздухе марганец вступает во взаимодействие с кислородом, пассивируется: на поверхности металла образуется оксидная пленка.
Mn + O2 = MnO2
При нагревании марганец реагирует с азотом, углеродом, кремнием, бором и фосфором.
Mn + N2 = (t) Mn3N2
Mn + C = (t) Mn3C
Mn + Si = (t) Mn2Si
Mn + P = (t) Mn3P2

При нагревании марганец вытесняет водород из воды.
Mn + H2O = (t) Mn(OH)2 + H2↑
Марганец стоит в ряду напряжений до водорода и способен вытеснить его из кислот.
Mn + HCl = MnCl2 + H2↑
Под воздействием кислот, которые обладают окислительными свойствами, марганец окисляется.
Mn + H2SO4(конц.) = MnSO4 + SO2 + H2O
Mn + HNO3(конц.) = (t) Mn(NO3)2 + NO2 + H2O
Mn + HNO3(разб.) = (t) Mn(NO3)2 + NO + H2O

Соединения марганца (II)
Для соединений марганца (II) характерны основные свойства. Оксид марганца (II) может быть получен разложением карбоната марганца, либо
восстановлением оксида марганца (IV) до оксида марганца (II).
При растворении (и нагревании!) марганца в воде образуется гидроксид марганца (II).
Mn + H2O = (t) Mn(OH)2 + H2↑
MnSO4 + KOH = (t) Mn(OH)2 + K2SO4
Соединения марганца (II) на воздухе неустойчивы, Mn(OH)2 быстро буреет, превращаясь в оксид-гидроксид марганца (IV).
Mn(OH)2 + O2 = MnO2 + H2O
Оксид и гидроксид марганца (II) проявляют основные свойства. При реакции с кислотами дает соответствующие
соли.
Mn(OH)2 + HCl = MnCl2 + H2O

Соли марганца (II) получаются при его растворении в разбавленных кислотах. Эти соли способны вступать в реакции с другими солями, кислотами, если
выпадает осадок, выделяется газ или образуется слабый электролит.
Mn + HCl = MnCl2 + H2
MnSO4 + (NH4)2S = MnS↓ + (NH4)2SO4
При действии сильных окислителей ион Mn2+ способен переходить в ион Mn7+
MnSO4 + PbO2 + HNO3 = HMnO4 + PbSO4 + Pb(NO3)2 + H2O
Соединения марганца (IV) проявляют амфотерный характер. Оксид марганца (IV) можно получить разложением нитрата марганца (II).
Mn(NO3)2 = (t) MnO2 + NO2
Кислород в продуктах реакции не указываем, так как он участвует в окислении MnO до MnO2.

В реакциях с щелочами марганец переходит в СО +6, в кислой среде — принимает СО +2.
MnO2 + Na2CO3 + NaNO3 = Na2MnO4 + NaNO2 + CO2 (гидролиз карбоната натрия идет по аниону, среда — щелочная)
MnO2 + HCl = MnCl2 + Cl2 + H2O

Соединения марганца (VI) — MnO3, H2MnO4 — неустойчивы, в свободном виде не получены. Обладают кислотными свойствами.
Наиболее устойчивые соли — манганаты, окрашивающие раствор в зеленый цвет.
Манганаты получают в ходе разложения перманганатов, а также реакциями в щелочной среде.
KMnO4 = (t) K2MnO4 + MnO2 + O2↑ (способ получения кислорода)
Li2SO3 + KMnO4 + LiOH = Li2SO4 + K2MnO4 + H2O
MnO2 + NaOH + NaNO3 = Na2MnO4 + NaNO2 + H2O
MnSO4 + KClO3 + KOH = K2MnO4 + KCl + K2SO4 + H2O

В водной среде манганаты разлагаются на с.о. +7 и +4. Манганаты окисляют хлором.
K2MnO4 + H2O = KMnO4 + MnO2 + KOH
K2MnO4 + Cl2 = KMnO4 + KCl
Соединения марганца (VII) — неустойчивый Mn2O7, и относительно устойчивая в разбавленных растворах HMnO4 — проявляют
кислотные свойства. Соли марганцовой кислоты — перманганаты.
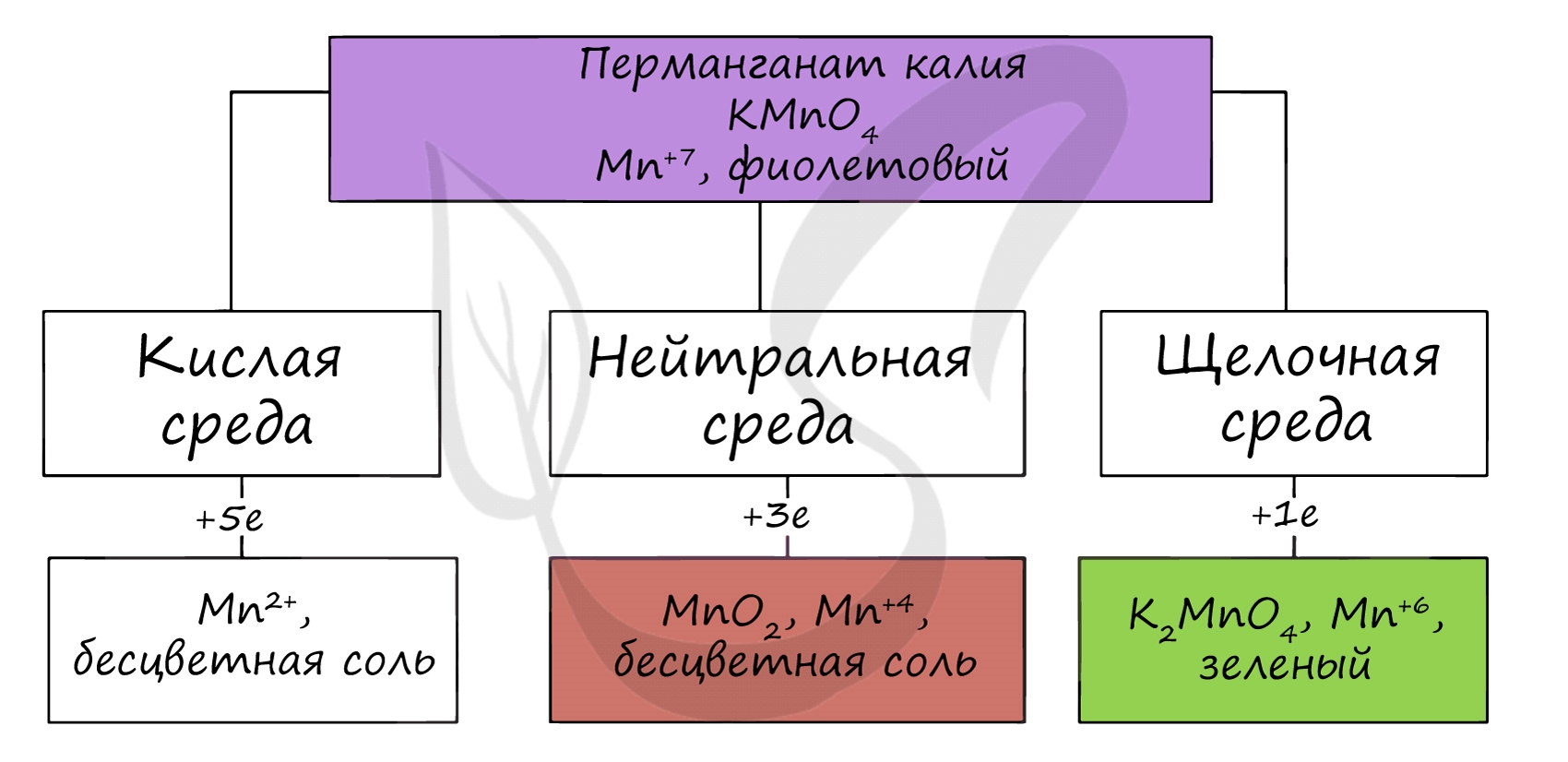
В различных средах — кислотной, нейтральной и щелочной — марганец принимает различные степени окисления. Внимательно изучите таблицу ниже.
Оксид марганца (VII) получают в реакции перманганата с сильными кислотами.
KMnO4 + H2SO4 = Mn2O7 + K2SO4 + H2O
При растворении оксида марганца (VII) (кислотного оксида) в щелочи образуются соли марганцовой кислоты — перманганаты.
Mn2O7 + KOH = KMnO4 + H2O
Марганцовая кислота получается в реакциях сильных окислителей с солями марганца (II).
Mn(NO3)2 + PbO2 + HNO3 = HMnO4 + Pb(NO3)2 + H2O
В растворах с концентрацией марганцовой кислоты более 20% происходит ее разложение.
HMnO4 = MnO + O2 + H2O
При нагревании перманганата калия (в быту — марганцовка) разлагается с образованием бурого MnO2, выделением кислорода.
KMnO4 = (t) K2MnO4 + MnO2 + O2↑

При стоянии в растворе постепенно разлагается водой.
KMnO4 + H2O = MnO2 + KOH + O2↑
В кислой среде марганец принимает наиболее устойчивую (для кислой среды) — Mn2+, в щелочной — Mn6+.
KMnO4 + H2O2 + H2SO4 = MnSO4 + O2↑ + K2SO4 + H2O
KMnO4 + KOH = K2MnO4 + O2 + H2O
Цинк
Название цинка, вероятно, связано формой его кристаллитов: в переводе с немецкого Zinke — зубец. С древнейших времен известен сплав
меди с цинком — латунь.

Для цинка характерна постоянная степень окисления +2.

Наиболее известные минералы, в которых содержится цинк:
- ZnS — цинковая обманка, сфалерит
- ZnO — цинкит
- ZnCO3 — симсонит, цинковый шпат
- 2ZnO*SiO2*H2O — гемиморфит

Получение
Пирометаллургический метод получения цинка заключается в обжиге цинковой обманки, и последующем восстановлении оксида цинка
различными восстановителями: чаще всего C, также возможно CO и H2.
ZnS + O2 = (t) ZnO + SO2
ZnO + C = (t) Zn + CO
ZnO + H2 = (t) Zn + H2O
ZnO + CO = (t) Zn + CO2

Гидрометаллургический метод получения основывается на электролизе сульфата цинка.
ZnSO4 + H2O = (электролиз) Zn + H2SO4 + O2
Химические свойства
- Реакции с неметаллами (и аммиаком
- Реакции с кислотами
- Реакции с щелочами
На воздухе цинк покрывается оксидной пленкой. При нагревании цинк реагирует с галогенами, фосфором, серой, селеном.
Zn + O2 = ZnO
Zn + Br2 = (t) ZnBr2
Zn + P = (t) Zn3P2
Zn + S = (t) ZnS

Для цинка не характерны реакции с водородом, бором, кремнием, азотом, углеродом. Нитрид цинка можно получить в ходе реакции цинка с аммиаком.
Zn + NH3 = (t) Zn3N2 + H2↑
Zn + HCl = ZnCl2 + H2↑
Zn + H2SO4(разб.) = ZnSO4 + H2↑
Zn + H2SO4(конц.) = ZnSO4 + H2S↑ + H2O
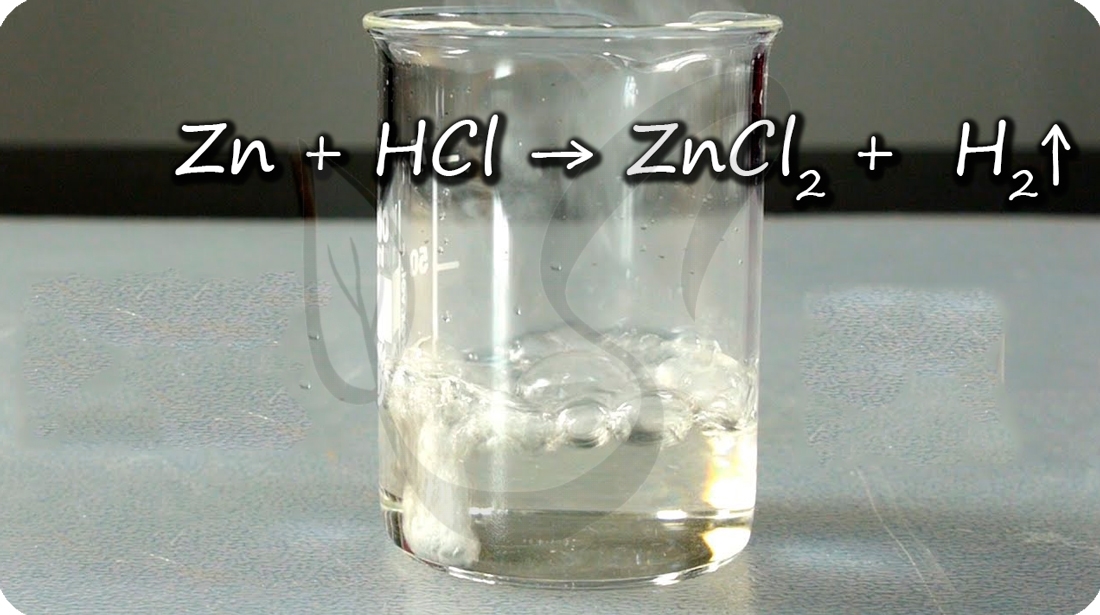
Цинк способен проявлять амфотерные (двойственные) свойства: реагирует как с кислотами, так и с основаниями.
При добавлении цинка в раствор щелочи выделяется водород.
Zn + H2O + NaOH = Na2[Zn(OH)4] + H2↑ (тетрагидроксоцинкат натрия)
Соединения цинка (II)
Эти соединения обладают амфотерными свойствами. Оксид цинка (II) можно получить в ходе реакции горения цинка или
при разложении нитрата цинка.
Zn + O2 = (t) ZnO
Zn(NO3)2 = (t) ZnO + NO2↑ + O2↑
Оксид цинка (II) проявляет амфотерные свойства, реагирует как с кислотами, так и с щелочами.
ZnO + HCl = ZnCl2 + H2O
ZnO + H2SO4 = ZnSO4 + H2O
ZnO + H2O + 2NaOH = Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Комплексные соли образуются в растворе, при прокаливании они не образуются.
ZnO + 2NaOH = (t) H2O + Na2ZnO2 (цинкат натрия)
Оксид цинка (II) может быть восстановлен до чистого цинка различными восстановителями.
ZnO + C = (t) Zn + CO
ZnO + H2 = (t) Zn + H2O
ZnO + CO = (t) Zn + CO2
Гидроксид цинка (II) получается в ходе реакций между растворимыми солями цинка и щелочами.

ZnSO4 + NaOH = Na2SO4 + Zn(OH)2↓
Гидроксид цинка (II) обладает амфотерными свойствами, реагирует как с кислотами, так и с основаниями.
Zn(OH)2 + HCl = ZnCl2 + H2O
Zn(OH)2 + HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + NaOH = Na2[Zn(OH)4]
При прокаливании комплексные соли распадаются, вода испаряется.
Na2[Zn(OH)4] = (t) Na2ZnO2 + H2O
Zn(OH)2 + NaOH = (t) Na2ZnO2 + H2O
Серебро
Драгоценный металл, известный человеку с древнейших времен. Встречаемся в самородном виде. Будучи благородным металлом,
серебро обладает низкой реакционной способностью.

Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- С солями
- С органическими веществами
Серебро не окисляется кислородом даже при высокой температуре. Галогены легко окисляют серебро до соответствующих галогенидов.
При нагревании с серой получается сульфид серебра.
Ag + Cl2 = AgCl
Ag + S = (t) Ag2S
Серебро не растворяется в соляной и разбавленной серной кислотах, однако способно реагировать с концентрированными кислотами.
Ag + HNO3(конц.) = AgNO3 + NO2↑ + H2O
Потемнение серебряных изделий обусловлено реакцией серебра с сероводородом в присутствии кислорода.
Ag + H2S + O2 = Ag2S + H2O

Ag + FeCl3 = AgCl + FeCl2
В дальнейшем, при изучении органической химии, вы не раз столкнетесь с соединением серебра — аммиачным раствором оксида серебра.
Будет полезно, если вы уже сейчас познакомитесь с его формулой на примере реакции окисления уксусного альдегида до уксусной кислоты.
CH3CHO + [Ag(NH3)2]OH = CH3COOH + Ag + NH3 + H2O
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Серебро (Ag от лат. Argentum) — элемент 11 группы (по устаревшей классификации — побочной подгруппы первой группы), пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 47.
Простое вещество серебро — ковкий, пластичный благородный металл серебристо-белого цвета. Кристаллическая решётка — гранецентрированная кубическая. Температура плавления — 962 °C, плотность — 10,5 г/см³.
| Название, символ, номер | Серебро / Argentum (Ag), 47 |
|---|---|
| Атомная масса (молярная масса) |
107,8682(2)[2] а. е. м. (г/моль) |
| Электронная конфигурация | [Kr] 4d10 5s1 |
| Радиус атома | 144 пм |
| Ковалентный радиус | 134 пм |
| Радиус иона | (+2e) 89 (+1e) 126 пм |
| Электроотрицательность | 1,93 (шкала Полинга) |
| Электродный потенциал | +0,799 |
| Степени окисления | 2, 1 |
| Энергия ионизации |
1‑я: 730,5 кДж/моль (эВ) 3‑я: 3361 кДж/моль (эВ) |
| Плотность (при н. у.) | 10,5 г/см³ |
| Температура плавления | 1235,1 К; 962 °C |
| Температура кипения | 2485 К; 2162°C |
| Уд. теплота плавления | 11,95 кДж/моль |
| Уд. теплота испарения | 254,1 кДж/моль |
| Молярная теплоёмкость | 25,36[3] Дж/(K·моль) |
| Молярный объём | 10,3 см³/моль |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 4,086 Å |
| Температура Дебая | 225 K |
| Теплопроводность | (300 K) 429 Вт/(м·К) |
| Номер CAS | 7440-22-4 |
Содержание
- 1 История
- 1.1 Происхождение названия
- 2 Нахождение в природе
- 2.1 Месторождения
- 3 Физические свойства
- 4 Химические свойства
- 5 Применение
- 5.1 В медицине
- 6 Физиологическое действие
- 7 Добыча
- 8 В мифологии
Кристалл серебра
История
Серебро известно человечеству с древнейших времён. Это связано с тем, что в своё время серебро, равно как и золото, часто встречалось в самородном виде — его не приходилось выплавлять из руд. Это предопределило довольно значительную роль серебра в культурных традициях различных народов. Одним из древнейших центров добычи и обработки серебра была доисторическая Сардиния, где оно было известно с раннего энеолита.
В Ассирии и Вавилоне серебро считалось священным металлом и являлось символом Луны. В Средние века серебро и его соединения были очень популярны среди алхимиков. С середины XIII века серебро становится традиционным материалом для изготовления посуды. Кроме того, серебро и по сей день используется для чеканки юбилейных монет (выход из оборота последних серебряных монет в 1960—1970-е годы примерно совпал с кризисом Бреттон-Вудской валютной системы).
Происхождение названия
Славянские названия металла — рус. серебро, польск. srebro, болг. сребро, ст.‑слав. сьребро — восходят к праславянскому *sьrebro, которое имеет соответствия в балтийских (лит. sidabras, др.-прусск. sirablan) и германских (готск. silubr, нем. Silber, англ. silver) языках. Дальнейшая этимология за пределами германо-балто-славянского круга языков неясна, предполагают либо происхождение от той же основы, что и анатолийское subau-ro «блестящий», либо раннее заимствование из языков Ближнего Востока: ср. аккад. sarpu «очищенное серебро», от аккад. sarapu «очищать, выплавлять», или из доиндоевропейских языков древней Европы: ср. баск. zilar.
Греческое название серебра ἄργυρος, árgyros произошло от индоевропейского корня *H₂erǵó-, *H₂erǵí-, означающего «белый, блистающий». Из того же корня происходит и его латинское название — argentum.
Нахождение в природе
Среднее содержание серебра в земной коре (по Виноградову) — 70 мг/т. Максимальные его концентрации устанавливаются в глинистых сланцах, где достигают 1 г/т. Серебро характеризуется относительно низким энергетическим показателем ионов, что обуславливает незначительное проявление изоморфизма этого элемента и сравнительно трудное его вхождение в решётку других минералов. Наблюдается лишь постоянный изоморфизм ионов серебра и свинца. Ионы серебра входят в решётку самородного золота, количество которого иногда достигает в электруме почти 50 % по массе. В небольшом количестве ион серебра входит в решётку сульфидов и сульфосолей меди, а также в состав теллуридов, развитых в некоторых полиметаллических и особенно, в золото-сульфидных и золото-кварцевых месторождениях.
Определённая часть благородных и цветных металлов встречается в природе в самородной форме. Известны и документально подтверждены факты нахождения не просто больших, а огромных самородков серебра. Так, например, в 1477 году на руднике «Святой Георгий» (месторождение Шнееберг в Рудных горах в 40—45 км от города Фрайберг) был обнаружен самородок серебра весом 20 т. Глыбу серебра размером 1×1×2,2 м выволокли из горной выработки, устроили на ней праздничный обед, а затем раскололи и взвесили. В Дании, в музее Копенгагена, находится самородок весом 254 кг, обнаруженный в 1666 году на норвежском руднике Конгсберг. Крупные самородки обнаруживали и на других континентах. В настоящее время в здании парламента Канады хранится одна из добытых на месторождении Кобальт в Канаде самородных пластин серебра, имеющая вес 612 кг. Другая пластина, найденная на том же месторождении и получившая за свои размеры название «серебряный тротуар», имела длину около 30 м и содержала 20 т серебра. Однако, при всей внушительности когда-либо обнаруженных находок, следует отметить, что серебро химически более активно, чем золото, и по этой причине реже встречается в природе в самородном виде. По этой же причине растворимость серебра выше и его концентрация в морской воде на порядок больше, чем у золота (около 0,04 мкг/л и 0,004 мкг/л соответственно).
Известно более 50 природных минералов серебра, из которых важное промышленное значение имеют лишь 15—20, в том числе:
- самородное серебро;
- электрум (золото-серебро);
- кюстелит (серебро-золото);
- аргентит (серебро-сера);
- прустит (серебро-мышьяк-сера);
- бромаргерит (серебро-бром);
- кераргирит (серебро-хлор);
- пираргирит (серебро-сурьма-сера);
- стефанит (серебро-сурьма-сера);
- полибазит (серебро-медь-сурьма-сера);
- фрейбергит (медь-сера-серебро);
- аргентоярозит (серебро-железо-сера);
- дискразит (серебро-сурьма);
- агвиларит (серебро-селен-сера)
Как и другим благородным металлам, серебру свойственны два типа проявлений:
- собственно серебряные месторождения, где оно составляет более 50 % стоимости всех полезных компонентов;
- комплексные серебросодержащие месторождения (в которых серебро входит в состав руд цветных, легирующих и благородных металлов в качестве попутного компонента).
Собственно серебряные месторождения играют достаточно существенную роль в мировой добыче серебра, однако следует отметить, что основные разведанные запасы серебра (75 %) приходятся на долю комплексных месторождений.
Содержание серебра в рудах цветных металлов 10-100 г/т, в золото-серебряных рудах 200—1000 г/т, а в рудах серебряных месторождений 900—2000 г/т, иногда десятки килограммов на тонну.
Серебро встречается и в каустоболитах: торфах, нефти, угле, битуминозных сланцах.
Месторождения
Производство серебра по странам (2011 год)
Значительные месторождения серебра расположены на территориях следующих стран:
- Армении,
- Германии,
- Испании,
- Перу,
- Чили,
- Мексики,
- Китая,
- Канады,
- США,
- Австралии,
- Польши,
- России,
- Казахстана,
- Румынии,
- Швеции,
- Чехии,
- Словакии,
- Австрии,
- Венгрии,
- Норвегии.
Также месторождения серебра есть на Кипре и на Сардинии.
Физические свойства

Чистое серебро — довольно тяжёлый (легче свинца, но тяжелее меди, плотность — 10,5 г/см³), необычайно пластичный серебристо-белый металл (коэффициент отражения света близок к 100 %). Тонкая серебряная фольга в проходящем свете имеет фиолетовый цвет. С течением времени металл тускнеет, реагируя с содержащимися в воздухе следами сероводорода и образуя налёт сульфида, чья тонкая плёнка придаёт тогда металлу характерную розоватую окраску. Обладает самой высокой теплопроводностью среди металлов. При комнатной температуре имеет самую высокую электропроводность среди всех известных металлов (удельное электрическое сопротивление 1,59⋅10−8 Ом·м при температуре 20 °C). Относительно тугоплавкий металл, температура плавления 962 °C.
Химические свойства
Серебро, будучи благородным металлом, отличается относительно низкой реакционной способностью, оно не растворяется в соляной и разбавленной серной кислотах. Однако в окислительной среде (в азотной, горячей концентрированной серной кислоте, а также в соляной кислоте в присутствии свободного кислорода) серебро растворяется:
- Ag + 2HNO3(conc) = AgNO3 + NO2↑ + H2O
Растворяется оно и в хлорном железе, что применяется для травления:
- Ag + FeCl3 = AgCl + FeCl2
Серебро также легко растворяется в ртути, образуя амальгаму (жидкий сплав ртути и серебра).
Серебро не окисляется кислородом даже при высоких температурах, однако в виде тонких плёнок может быть окислено кислородной плазмой или озоном при облучении ультрафиолетом. Во влажном воздухе в присутствии даже малейших следов двухвалентной серы (сероводород, тиосульфаты, резина) образуется налёт малорастворимого сульфида серебра, обуславливающего потемнение серебряных изделий:
- 4Ag + 2H2S + O2 = 2Ag2S + 2H2O
В отсутствии кислорода:
- 2Ag + H2S = Ag2S + H2↑
Свободные галогены легко окисляют серебро до галогенидов:
- 2Ag + I2 = 2AgI
Однако на свету эта реакция обращается, и галогениды серебра (кроме фторида) постепенно разлагаются. На этом явлении основан принцип чёрно-белой фотографии.
При нагревании с серой серебро даёт сульфид:
- 2Ag + S = Ag2S
Наиболее устойчивой степенью окисления серебра в соединениях является +1. В присутствии аммиака соединения серебра (I) дают легко растворимый в воде комплекс [Ag(NH3)2]+. Серебро образует комплексы также с цианидами, тиосульфатами. Комплексообразование используют для растворения малорастворимых соединений серебра, для извлечения серебра из руд. Более высокие степени окисления (+2, +3) серебро проявляет только в соединении с кислородом (AgO, Ag2O3) и фтором (AgF2, AgF3), такие соединения гораздо менее устойчивы, чем соединения серебра (I).
Соли серебра (I), за редким исключением (нитрат, перхлорат, фторид), нерастворимы в воде, что часто используется для определения ионов галогенов (хлора, брома, йода) в водном растворе.
Применение
- Так как обладает наибольшей электропроводностью, теплопроводностью и стойкостью к окислению кислородом при обычных условиях, применяется для контактов электротехнических изделий (например, контакты реле, ламели), а также многослойных керамических конденсаторов.
- В составе припоев: медносеребряные припои ПСр-72, ПСр-45 и другие, используется для пайки разнообразных ответственных соединений, в том числе разнородных металлов, припои с высоким содержанием серебра используются в ювелирных изделиях, а со средним — в разнообразной технике, от сильноточных выключателей до жидкостных ракетных двигателей, иногда также как добавка к свинцу в количестве 3 % (ПСр-3), им заменяют оловянный припой.
- В составе сплавов: для изготовления катодов гальванических элементов.
- Применяется как драгоценный металл в ювелирном деле (обычно в сплаве с медью, иногда с никелем и другими металлами).
- Используется при чеканке монет (оборотных — до начала 1970-х годов, сейчас — только юбилейных), а также наград — орденов и медалей.
- Галогениды серебра и нитрат серебра используются в фотографии, так как обладают высокой светочувствительностью.
- Иодистое серебро применяется для смены погоды («разгон облаков»).
- Из-за высочайшей электропроводности и стойкости к окислению применяется:
- в электротехнике и электронике как покрытие ответственных контактов и проводников в высокочастотных цепях;
- в СВЧ-технике как покрытие внутренней поверхности волноводов.
- Используется как покрытие для зеркал с высокой отражающей способностью (в обычных зеркалах используется алюминий).
- Часто используется как катализатор в реакциях окисления, например, при производстве формальдегида из метанола, а также эпоксида из этилена.
- Используется как дезинфицирующее вещество, в основном для обеззараживания воды. Ограниченно применяется в виде солей (нитрат серебра) и коллоидных растворов (протаргол и колларгол) как вяжущее средство. В прошлом применение препаратов серебра было значительно шире.
Области применения серебра постоянно расширяются, и его применение — это не только сплавы, но и химические соединения. Определённое количество серебра постоянно расходуется для производства серебряно-цинковых и серебряно-кадмиевых аккумуляторных батарей, обладающих очень высокой энергоплотностью и массовой энергоёмкостью и способных при малом внутреннем сопротивлении выдавать в нагрузку очень большие токи.
Серебро используется в качестве добавки (0,1—0,4 %) к свинцу для отливки токоотводов положительных пластин специальных свинцовых аккумуляторов, имеющих очень большой срок службы (до 10—12 лет) и малое внутреннее сопротивление.
Хлорид серебра используется в хлор-серебряно-цинковых батареях, а также для покрытий некоторых радарных поверхностей. Кроме того, хлорид серебра, прозрачный в инфракрасной области спектра, используется в инфракрасной оптике.
Монокристаллы фторида серебра используются для генерации лазерного излучения с длиной волны 0,193 мкм (ультрафиолетовое излучение).
Серебро используется в качестве катализатора в фильтрах противогазов.
Ацетиленид серебра (карбид) изредка применяется как мощное инициирующее взрывчатое вещество (детонаторы).
Фосфат серебра используется для варки специального стекла, используемого для дозиметрии излучений. Примерный состав такого стекла: фосфат алюминия — 42 %, фосфат бария — 25 %, фосфат калия — 25 %, фосфат серебра — 8 %.
Перманганат серебра, кристаллический тёмно-фиолетовый порошок, растворимый в воде; используется в противогазах. В некоторых специальных случаях серебро также используется в сухих гальванических элементах следующих систем: хлор-серебряный элемент, бром-серебряный элемент, йод-серебряный элемент.
Серебро зарегистрировано в качестве пищевой добавки E174.
В медицине
Основная статья: Коллоидное серебро
До середины ХХ века нитрат серебра использовался в качестве наружного антисептика под названием ляпис. На свету он разлагается на свободное серебро, диоксид азота и молекулярный кислород. Однако в настоящее время во всех сферах применяется множество значительно более эффективных антисептиков.
Начиная с 1990 года, в нетрадиционной медицине наблюдается возрождение использования коллоидного серебра в качестве средства для лечения многочисленных болезней. В лабораторных исследованиях получены разные результаты: в одних исследований показано, что антимикробное воздействие серебра весьма незначительно, в то время как другие показали, что раствор 5—30 ppm является эффективным против стафилококка и кишечной палочки. Данное противоречие связано с размерами коллоидных наночастиц серебра — чем меньше их размер, тем более выражен антимикробный эффект. Следует отметить, что подобные свойства наночастиц характерны для большинства переходных металлов и связаны с разрушением клеточной мембраны бактерий при сорбции наночастицы. Это, однако, проявляется только в очень чистых растворах.
Серебро — это тяжёлый металл, содержание которого в питьевой воде регламентировано СанПиН 2.1.4.1074-01 «Вода питьевая» — серебру присвоен класс опасности 2, «высокоопасное вещество». Госсанэпидемнадзор официально утвердил гигиенические нормативы содержания вредных веществ в питьевой воде, в этих нормативах содержание серебра в питьевой воде ограничено концентрацией 0,05 мг/л.
В США и Австралии препараты на основе коллоидного серебра не признаны лекарствами и предлагаются в продовольственных магазинах. Также в изобилии их можно встретить в Интернет-магазинах по всему миру в качестве БАД (биологически активных добавок), более простое название — пищевые добавки. Законом США и Австралии было запрещено маркетологам приписывать медицинскую эффективность коллоидному серебру. Но некоторые сайты, в том числе на их территории, по-прежнему указывают на благотворное воздействие препарата при профилактике простуды и гриппа, а также на лечебное воздействие при более серьёзных заболеваниях, таких, как диабет, рак, синдром хронической усталости, ВИЧ/СПИД, туберкулёз, и другие заболевания. Нет никаких медицинских исследований, свидетельствующих о том, что коллоидное серебро эффективно для какого-либо из этих заявленных симптомов.
До эпохи доказательной медицины растворы солей серебра широко применяли в качестве антисептических и вяжущих средств. На этом свойстве серебра основано действие таких лекарственных препаратов, как протаргол, колларгол и др., представляющих собой коллоидные формы серебра. В настоящее время препараты серебра применяются всё реже в связи с низкой эффективностью.
Физиологическое действие
Следы серебра (порядка 0,02 мг/кг) содержатся в организмах всех млекопитающих, но его биологическая роль недостаточно изучена. Головной мозг человека характеризуется повышенным содержанием серебра (0,03 мг на 1000 г свежей ткани, или 0,002 % по массе в золе). Интересно, что в изолированных ядрах нервных клеток — нейронов — серебра гораздо больше (0,08 % по массе в золе).
С пищевым рационом человек получает в среднем около 0,1 мг Ag в сутки. Относительно много его содержит яичный желток (0,2 мг в 100 г). Выводится серебро из организма главным образом с калом.
Ионы серебра обладают бактериостатическими свойствами. Однако для достижения бактериостатического эффекта концентрацию ионов серебра в воде необходимо повысить настолько, что она становится непригодной для питья. Бактериостатические свойства серебра известны с древности. В VI веке до н. э. персидский царь Кир II Великий в своих военных походах использовал серебряные сосуды для хранения воды. Покрытие поверхностных ран серебряными пластинами практиковалось ещё в древнем Египте. Очистку больших количеств воды, основанную на бактерицидном действии серебра, особенно удобно производить электрохимическим путём.
В начале 1970-х годов нижний предел бактериостатического действия серебра оценивался содержанием его в воде порядка 1 мкг/л. По данным 2009 года — нижний предел действия находится на уровне 50—300 мкг/л, что уже опасно для человека.
Как и все тяжёлые металлы, серебро при избыточном поступлении в организм токсично.
По санитарным нормам США содержание серебра в питьевой воде не должно превышать 0,05 мг/л. Согласно действующим российским санитарным нормам серебро относится к высокоопасным веществам (класс опасности 2 по санитарно-токсикологическому признаку вредности), и предельно допустимая концентрация серебра в питьевой воде составляет те же 0,05 мг/л.
При длительном поступлении в организм избыточных доз серебра развивается аргирия, внешне выражающаяся серой окраской слизистых оболочек и кожи, причём преимущественно на освещённых участках тела, что обусловлено отложением частичек восстановленного серебра. Какие-либо расстройства самочувствия заболевших аргирией наблюдаются далеко не всегда. Вместе с тем, немедицинскими источниками отмечалось, что они не подвержены инфекционным заболеваниям.
Ионы серебра оказывают генотоксичный эффект, разрушая целостность молекул ДНК в клетках, в том числе вызывая перестройки в хромосомах и фрагментацию последних. Кроме того, исследователи выявили повреждения генов в сперматозоидах.
Добыча
Серебро было известно с глубокой древности (4-е тысячелетие до н. э.) в Египте, Персии, Китае.
Значительным источником извлечённого серебра (не в виде самородков) считается территория Анатолии (современная Турция). Добываемое серебро поступало в основном на Ближний Восток, в Крит и Грецию.
Более или менее значительные данные о добыче серебра относятся к периоду после III тысячелетия до н. э., например, известно, что халдеи в 2500 году до н. э. извлекали металл из свинцово-серебряных руд.
После 1200-х годов до н. э. центр производства металла сместился в Грецию, в Лаврион, недалеко от Афин. Шахты были весьма богаты: их добыча с 600 до 300 года до н. э. составляла около 1 млн тройских унций (30 т) в год. В течение почти тысячи лет они оставались самым крупным источником серебра в мире.
С IV по середину I века до н. э. лидером по производству серебра были Испания и Карфаген.
Во II—XIII веках действовало множество рудников по всей Европе, которые постепенно истощались.
По мере расширения торговых связей, требующих денежного обращения, в XII—XIII веках выросла добыча серебра в Гарце, Тироле (главный центр добычи — Швац), Рудных горах, позднее в Силезии, Трансильвании, Карпатах и Швеции. С середины XIII до середины XV веков ежегодная добыча серебра в Европе составляла 25—30 т; во 2-й половине XV века она достигала 45—50 т в год. На германских серебряных рудниках в это время работало около 100 тысяч человек. Крупнейшим из старых месторождений самородного серебра является открытое в 1623 году месторождение Конгсберг в Норвегии.
Освоение Америки привело к открытию богатейших месторождений серебра в Кордильерах. Главным источником становится Мексика, где в 1521—1945 годах было добыто около 205 тыс. т металла — около трети всей добычи за этот период. В крупнейшем месторождении Южной Америки — Потоси — за период с 1556 по 1783 год добыто серебра на 820 513 893 песо и 6 «прочных реалов» (последний в 1732 году равнялся 85 мараведи).
В России первое серебро было выплавлено в июле 1687 года российским рудознатцем Лаврентием Нейгартом из руд Аргунского месторождения (Нерчинский горный округ). В 1701 году в Забайкалье был построен первый сереброплавильный завод, который на постоянной основе стал выплавлять серебро 3 года спустя. Некоторое количество серебра добывалось на Алтае. Лишь в середине XX века освоены многочисленные месторождения на Дальнем Востоке.
В 2008 году всего добыто 20 900 т серебра. Лидером добычи является Перу (3600 т), далее следуют Мексика (3000 т), Китай (2600 т), Чили (2000 т), Австралия (1800 т), Польша (1300 т), США (1120 т), Канада (800 т).
На 2008 год лидером добычи серебра в России является компания «Полиметалл», добывшая в 2008 году 535 т. В 2009 и 2010 годах «Полиметалл» добыл по 538 т серебра, в 2011 году — 619 т.
Мировая добыча серебра (1990-2017) (1990-2007 — данные U.S. Geological Survey, 2008-2017 — данные The Silver Institute)
Мировые запасы серебра оцениваются в 505 тыс. т (на 1986 год), подтверждённые — 360 тыс. т.
В мифологии многих народов серебру приписываются магические свойства, способность отгонять всяческую нечисть — оборотней, вампиров, злых духов и так далее.
Медь. Серебро
Разбор сложных заданий в тг-канале:
Медь ($Cu$) — элемент побочной подгруппы первой группы. Электронная формула: ($…3d^{10}4s^1$). Десятый d-электрон атома меди подвижный, т. к. переместился с $4s$-подуровня. Медь в соединениях проявляет степени окисления $+1(Cu_2O)$ и $+2(CuO)$.
Медь — мягкий, блестящий металл, имеющий красную окраску, ковкий и обладает хорошими литейными качествами, хороший тепло- и электропроводник. Температура плавления $1083°С$.
Как и другие металлы побочной подгруппы I группы Периодической системы, медь стоит в ряду активности правее водорода и не вытесняет его из кислот, но реагирует с кислотами-окислителями:
$Cu+2H_2SO_{4(конц.)}=CuSO_4+SO_2↑+2H_2O$;
$Cu+4HNO_{3(конц.)}=Cu(NO_3)_2+2NO_2↑+2H_2O$.
Под действием щелочей на растворы солей меди выпадает осадок слабого основания голубого цвета — гидроксида меди (II), который при нагревании разлагается на основный оксид $CuO$ черного цвета и воду:
$Cu^{2+}+2OH^{–}=Cu(OH)_2↓; Cu(OH)_2 {→}↖{t°} CuO+H_2O$
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Цель урока:
- Изучить распространение, историю происхождения
серебра. - На основании положения атома серебра в ПСХЭ Д.И.
Менделеева дать характеристику как типичному d–
элементу; обобщить знания по изучению его
физико-химических свойств как простого вещества
и его соединений. - Изучить способы получения, применение и
магические свойства серебра.
Задачи урока:
- Научить учащихся анализировать теоретический
материал при изучении химии элементов. - Отрабатывать навыки использования
дополнительной химической литературы, материала
интернет – ресурсов для повышения интереса к
предмету и качества подготовки к ЕГЭ. - Стимулировать проявление волевых, умственных
качеств, чувства коллективного труда.
План урока
- Серебро – химический элемент.
- История происхождения серебра.
- Нахождение в природе.
- Физические свойства серебра.
- Химические свойства серебра:
- Взаимодействие с простыми веществами.
- Взаимодействие со сложными веществами.
- Химические свойства соединений серебра со
степенью окисления +1. - Получение серебра.
- Применение серебра.
- Закрепление.
- Домашнее задание.
Ход урока
При подготовке к уроку учащиеся класса
получают задание по анализу отдельных вопросов и
делятся на экспертные группы: “историки”,
“геологи”, “физики”, “химики – теоретики”,
“химики – экспериментаторы”, “технологи”,
“врачи”.
1. Серебро – химический элемент.
Учитель: На основании положения атома
серебра в периодической системе дайте
характеристику как типичному d-элементу.
Ученик: Серебро – химический элемент с
порядковым номером 47, номер периода 5, большой,
нечетный 7 ряд, номер группы 1, побочная подгруппа,
d-элемент, металл, электронная конфигурация [Кr]4d10
5s1.
Учащиеся на доске изображают
электронно-графическую формулу атома серебра,
отмечают характерные степени окисления: 0, +1;
отмечая признаки проскокa электронов, о
возможности проявления степеней окисления +2, +3.
2. История происхождения серебра (сообщение
учащегося их группы “историков”).
Серебро известно человечеству с древнейших
времен. Это связано с тем, что в свое время
серебро, равно как золото, часто встречалось в
самородном виде – его не приходилось выплавлять
из руд. Это предопределило довольно сильное
присутствие серебра в культурных традициях
различных народов. В Ассирии и Вавилоне серебро
считалось священным металлом и являлось
символом Луны. В средние века серебро и его
соединения были очень популярны среди алхимиков.
На русском “серебро”, на немецком “зильбер”, на
английском “сильвер” – эти слова восходят к
древнеиндийскому слову “сарпа”, которым
обозначили Луну и Серп – древнейшее орудие
земледельца. Латынское слово “аргентум”
означает “белое”. С середины 18 века серебро
становится традиционным материалом для
изготовления посуды. Кроме того, серебро и по сей
день используется для чеканки монет.
3. Нахождение в природе (сообщение
учащегося из группы “геологов”).
Знаете ли Вы?
- Определенная часть благородных и цветных
металлов встречаются в природе в самородной
форме. Известны и документально подтверждены
факты нахождения не просто больших, а огромных
самородков серебра. Так, например, в 1447г. на
руднике “Святой Георгий” был обнаружен
самородок серебра весом 20 т. Глыбу серебра
размером 1х1х2,2 м выволокли из горной выработки,
устроили на ней праздничный обед, а затем
раскололи и взвесили. В Дании, в музее
Копенгагена, находится самородок весом 254 кг,
обнаруженный в 1666 г. на норвежском руднике
Конгсберг. - В настоящее время в здании парламента Канады
хранится одна из добытых на месторождении
Кобальт самородных пластин серебра, получившая
за свои размеры название “серебряный тротуар”,
она имела длину около 30 м и содержала 20 т серебра. - Известны более 50 природных минералов серебра; в
них серебро связано с серой, селеном, теллуром
или галогенами, из которых важное промышленное
значение имеют лишь 15-20, в том числе: самородное
серебро; электрум (золото-серебро); кюстелит
(серебро-золото); аргентит Ag2S (серебро-сера).
Вывод:
Серебро встречается в природе в самородном
состоянии и в виде соединений. Серебро– редкий
элемент; в земной коре его почти в тысячу раз
меньше, чем меди и его содержание составляет 7х10-6
весовых процента (золота в 20 раз меньше), по
распространенности серебро на 67-месте среди
элементов. Серебром богаты страны Центральной
Европы ( Чехии, Германии, Австрии, Испании,
Франции, Англии), Южной Америки (Перу, Чили,
Мексики, Боливии), Канады.
4. Физические свойства серебра.
Учитель: Какова кристаллическая решетка
серебра? Исходя из этого, назовите известные Вам
физические свойства серебра, отмечая самые
привлекательные из них.
Сообщение учащегося из группы “физиков”: Серебро
– довольно тяжелый ( его плотность 10,5 г/см3)
металл белого цвета, сравнительно мягкий, ковкий,
пластичный (1 г его можно вытянуть в проволоку
длиной до 2 км), тугоплавкий (температура
плавления 1235,1?С). Имеет высокую отражательную
способность (во время ВОВ при штурме Берлина
войсками Первого и Белорусского фронта 143
прожектора огромной светосилы ослепили
гитлеровцев в их оборонительной полосе, и это
способствовало быстрому исходу операции) и самые
высокие показатели электропроводности и
теплопроводности среди всех металлов. Серебро
легко сплавляется со многими металлами;
небольшие добавки меди делают его более твердым,
годным для изготовления различных изделий.
Не стоит забывать и о “фамильном серебре”:
ковкость, пластичность, бактерицидность делали
посуду предметом роскоши. Это был символ
достатка и респектабельности. В этом никто не мог
переплюнуть графа Орлова, фаворита Екатерины
Великой. Его респектабельность состояла из 3275
серебряных предметов, на изготовление которых
более 2 тонн серебра.
5. Химические свойства серебра.
a. Взаимодействие с простыми веществами
Учитель: Какова химическая активность
серебра по положению в электрохимическом ряду
напряжения металлов?
Учитель: С какими простыми веществами
реагирует серебро?
В работу включаются учащиеся из группы
“химиков – теоретиков”.
На доске составляются левые части уравнений
химических реакций; учащиеся в духе соревнования
дописывают правую часть уравнений.
4Ag + O2—> 2Ag2O (при обычных условиях с
кислородом реакция не идет)
Учитель: Что происходит с серебром во время
грозы?
8Ag + 2O3—> 4Ag2O+ O2
Учитель: Почему серебряные изделия чернеют
на воздухе и на кожном покрове?
Ответ:
2Ag + S—> Ag2S (черный осадок)
4Ag + O2 +H2S—> 2Ag2S+2H2O
Серебро также темнеет при продолжительном
контакте с белком и кожей нездорового человека,
отсюда и поверье о том, что серебро обладает
даром предвидеть тяжелое заболевание своего
хозяина. Чёрное вещество на серебре – это окись
серебра и сульфид серебра в разных пропорциях.
Учитель: Почему при работе с галогенами
нужно снимать серебряные изделия?
2Ag + Cl2—> 2AgCl (серебро хорошо реагирует с
галогенами)
b. Взаимодействие со сложными веществами
1) с кислотами
Учитель: Возможно ли протекание следующих
уравнений химических реакций:
Ag + HCl—>
Ag +H2SO4 (разб.) —>
Ответ: Серебро – благородный металл
(находится в ряду напряжений металлов после
водорода, с разбавленными растворами кислот,
кроме HNO3, реакция не идет)
Учитель: Составьте уравнения следующих
реакций (на доске представляется схема левой
части уравнений):
2) с солями
Учитель: Возможно ли протекание следующих
уравнений химических реакций:
Ag +CuSO4 —> (реакция не протекает, так как
атом серебра в электрохимическом ряду
напряжений металлов находится после атома меди).
2Ag +Hg(NO3)2 —> 2AgNO3 + Hg (реакция
идет)
Вывод: Серебро – малоактивный металл
(электродный потенциал равен 0),
восстановительные свойства выражены слабо.
c. Химические свойства соединений серебра со
степенью окисления +1
1) Взаимодействие с неорганическими веществами
Учитель: Как из нитрата серебра можно
получить оксид серебра (I)
2AgNO3 +2NaOH —> Ag2O + H2O + 2NaNO3
2AgOH —> Ag2O + H2O
Ag2 O – оксид серебра – твердое вещество
темно–коричнего цвета. Проявляет амфотерные
свойства
AgNO3 нитрат серебра (ляпис) – кристаллы
белого цвета. Самая известная соль элемента №47.
Обладает прижигающим и вяжущим действием. На
коже оставляет след.
Учитель: Какие ионы можно определять с
помощью раствора нитрата серебра AgNO3 ? (Приложение 1).
AgNO3 + NaГ —> Ag Г + NaNO3; Г=Cl, Г=Br, Г=J, .
3Ag++PO43– —> Ag3PO4v;
3Ag++CrO42– —> Ag2CrO4
Учащиеся составляют уравнения химических
реакций качественного анализа в молекулярном
ионном видах с указанием цвета осадков.
Группа химиков-экспериментаторов осуществляет
качественный анализ, результаты исследований
представляет вниманию класса.
Учитель: Какие изменения происходят с
соединениями серебра со степенью окисления +1 при
термическом разложении?
Разложение AgBr используется в фотоделе:
Учитель: В чем проявляются основные
свойства ?
Учитель: Какие свойства имеют соединения Ag+1с
точки зрения ОВР?
Окислительные свойства :
Учитель: Соединения Ag+1 –
комплексообразователи.
Соединения Ag+1легко восстанавливаются до
Ag0:
Но хлорид серебра не растворяется даже в
концентрированной азотной кислоте.
2) Взаимодействие аммиачного раствора оксида
серебра (I) с органическими веществами.
Учитель: Как можно качественно обнаружить
концевую тройную связь у алкинов?
Ответ: Концевую тройную связь у алкинов
можно обнаружить с помощью аммиачного раствора
оксида серебра (I). При этом с ацетиленом
образуется взрывчатое вещество ацетитиленида
серебра (I) темно-серого цвета, применяемое в
военном деле для взрывных работ.
Данная реакция не характерна для алкинов с
положением тройной связи в других позициях:
реакция не идет с бутином-2.
Учитель: Какие функциональные группы у
кислородсодержащих органических соединений
можно качественно обнаружить с помощью
аммиачного раствора оксида серебра (I)?
Ответ: C помощью аммиачного раствора оксида
серебра (I) определяется альдегидная группа у
альдегидов, моносахаридов (глюкозы), дисахаридов:
восстанавливающихся сахаров– лактозы и
мальтозы. При этом идет реакция “серебряного
зеркала” с выпадением блестящего зеркального
налета (использовалась для производства зеркал),
где является
окислителем.
Учитель: В двух пробирках находятся
растворы муравьиной и уксусной кислот. Как
экспериментально можно обнаружить данные
кислоты?
Ответ: Оба раствора кислот является
бесцветными жидкостями со специфическим
запахом, изменяют цвет лакмуса в красный,
метилоранжа – розовый. Под действием соды –
вскипают. Но у муравьиной кислоты в результате
внутренней перегруппировки атомов имеется
альдегидная группа. Поэтому единственной
карбоновой кислоте характерна реакция
“серебряного зеркала”.
Выводы:
- Серебро-благородный малоактивный металл, с
трудом вступает в реакции взаимодействия с
простыми веществами. С разбавленными растворами
кислот в реакцию не вступает (кроме HNO3). При
взаимодействии с концентрированными растворами
H2SO4 и HNO3 водород не выделяется. - Ионы серебра со степенью окисления +1 –
окислители и комплексообразователи. - Ионы серебра с степенью окисления +1 –
качественный реактив на ионы галогенидов,
фосфатов, хроматов. - Аммиачный раствор оксида серебра (I)
используется для качественного определения
концевой тройной связи у алкинов и альдегидной
группы у кислородсодержащих органических
соединений.
6. Получение серебра (выступает группа
“технологов”).
Поскольку месторождения серебра редки и
выработаны, его получают из руд таких металлов,
как медь и свинец, в которых всегда содержится
примесь серебра:
1) Пирометаллургический способ получения
серебра.
Серебро выделяют из неочищенного свинца.
Сначала к свинцу добавляют жидкий цинк, который
не смешивается со свинцом, но дает прочные
интерметаллиды с серебром: Ag2Zn3, Ag2Zn5.
В жидком свинце эти интерметаллиды не
растворяются, а всплывают на поверхность
(образуется серебристая поверхность). Ее снимают,
удаляют Zn перегонкой, а свинец удаляют в виде
оксида:
Ag+Pb+Zn—>Pb+Ag Zn
Ag+Pb+O2—>Ag+PbO2
Далее серебро очищается электролитически.
2) Серебро получают в виде побочного продукта
при переработке медных руд. При очистке
электролизом “черновой меди” в электролит
(раствор CuSO4) переходят примеси металлов,
стоящих в ряду напряжений до меди, а в осадок
(шлам) выпадает Ag, Au, платиновые металлы и т.д.–
металлы, стоящие в ряду напряжений до меди.
7. Применение серебра.
Учитель: На основании изученных
физико-химических свойств серебра и его
соединений выделите наиболее важные отрасли
применения серебра.
Ответ:
- Так как обладает наибольшей
электропроводностью, теплопроводностью и
стойкостью к окислению кислородом при обычных
условиях, применяется для контактов
электротехнических изделий, например, контакты
реле, ламели. - Применяется как драгоценный металл в ювелирном
деле. - Используется при чеканке монеты (в особенности
в прошлом). - Галогениды серебра и нитрат серебра
используются в фотографии, так как обладают
высокой светочувствительностью. - Используется как покрытие для зеркал с высокой
отражающей способностью (в обычных зеркалах
используется алюминий). - Часто используется как катализатор в реакциях
окисления, например при производстве
формальдегида из метанола. - Используется как дезинфицирующее вещество, в
основном для обеззараживания воды. Некоторое
время назад для лечения простуды использовали
раствор протаргол и колларгол, которые
представляли собой коллоидное серебро.
Серебро используется в качестве катализатора в
фильтрах противогазов.
Ацетиленид серебра (карбид) изредка
применяется как мощное инициирующее взрывчатое
вещество (детонаторы).
Серебро зарегистрировано в качестве пищевой
добавки Е174.
Еще более эффективно действует слабый раствор
комплексного соединения серебра с аммиаком,
применяющийся в медицине под названием аммарген
(производное от слов “аммиак” и “аргентум”).
Нитраты серебра в виде раствора аммаргена широко
применяются для промывания ран или слизистой
оболочки при различных воспалительных
состояниях, а также используются в изготовлении
различных антибактериальных средств.
Физиологическое действие (выступает группа
“врачей”).
Обычно серебро поступает с водой и пищей в
ничтожно малых количествах– всего 7
микрограммов в сутки. И при этом такое явление,
как дефицит серебра, пока нигде не
описано.Серебро не относится к жизненно важным
биоэлементам. Серебро – это тяжелый металл. Пить
воду с ионами серебра не стоит. Серебро –
клеточный яд. Постоянное употребление серебра
даже в малых дозах может вызвать хроническое
заболевание, связанное с повышенным содержанием
серебра в организме – аргирию (аргентоз,
аргироз). ПДК для серебра – 50 мкг/л. При
длительном употреблении может возникать
поражение почек, неврологические расстройства,
нарушение пищеварения, головные боли и
хроническая усталость. При попадании в организм
больших доз растворимых солей серебра наступает
острое отравление, сопровождающееся некрозом
слизистой желудочно-кишечного тракта. Первая
помощь при отравлении – промывание желудка
раствором хлорида натрия, при этом образуется
нерастворимый хлорид серебра, который и
выводится из организма. Ион Ag+, попадая на
тело, вызывает ожог.
8. Закрепление.
- Выполните тестовые задания (задания
проецируются на экран) (Приложение
2). - Вставьте пропущенные слова в следующие
предложения (Приложение 3).
9. Домашнее задание.
- Назовите пословицы, поговорки, связанные со
словом “серебро” (Приложение 4). - Какие свойства серебра отражены в следующих
строках поэтов (Приложение 5). - Осуществите цепочки превращений (Приложение
6). - §52, учебник 11 класса. Автор Н.Е. Кузнецов и т.д.
стр.131, 132, №5 (а, б).
-
Серебро
является предпоследним d-элементом
в своем периоде. Вследствие устойчивости
d10-
конфигурации энергетически более
выгоден переход одного из ns-электронов
в (n-1)
d-состояние.
Поэтому Ag
в s-состоянии
внешнего слоя имеет по одному, а в
предпоследнем слое по 18 электронов.
(S2p6d10) -
Уменьшение
энергии ионизации при переходе от Cu
к Ag
зависит от главного квантового числа
n. -
Для
подгруппы меди возможны С.О: +1,+2,+3.
Для
Ag
наиболее характерна С.О.: +1.
Особая
устойчивость в этой С.О. объясняется
прочностью конфигурации 4d10.
С.О.
+1 : Ag2O; AgNCS; [Ag(CN)2]
-
Особенность
электронной структуры обуславливает
относительно большую устойчивость
двухатомных молекул ( Ag2).
Прочность связана с образованием
дополнительных п-связей за счёт свободных
np-орбиалей
и (n-1)
d-электронных
пар.
-
Серебро
встречается в природе в самородном
состоянии.
Серебро
входит в состав сульфидных минералов
других металлов ( Pd,
Zn,
Cd
и др.). Может входить в состав арсенидных,
стибидных и сульфидарсенидных минераллов.
-
Серебро
представляет собой белый металл с
гранецентрированной кубической
решеткой.
Характеризуется
хорошей пластичностью, хорошей тепло-
и электропроводимостью.
Химические
св-ва:
-
Реагирует
с галогенами при нагревании:
2Ag+I2=2AgI
-
Взаимодействует
с серой:
2Ag+S=Ag2S
-
Взаимодействие
с сероводородом:
2Ag+H2S=Ag2S+H2
-
Не
взаимодействует с кислородом. При
наличии в воздухе сероводорода серебро
покрывается черным налётом Ag2S:
4Ag+2H2S+O2=2Ag2S+2H2O
-
С
водородом не реагирует
-
Ag
растворяется в HNO3
и конц. H2SO4
, в HCL
с присутствием свободного кислорода.
( т.к. в ряду напряжения располагается
после H
, кислоты могут окислять серебро только
за счёт аниона):
Ag
+ 2HNO3 = AgNO3 + NO2 + H2O
2Ag+2H2SO4=Ag2SO4+SO2+2H2O
2Ag+2HCL=2AgCl+H2
-
Растворяется
в хлорном железе ( применяют для
травления):
Ag+FeCl3=AgCl+FeCl2
-
В
отсутствии окислителей Ag
устойчиво к щелочам
-
Растворяется
в растворах оснОвных цианидов в
присутствии кислорода
4Ag+8NaCN+O2+2H2O=4Na[Ag(CN)2]+4NaOH
15)Положение в периодической системе
Хром — элемент
побочной подгруппы 6-ой группы 4-го
периода периодической системы
химических элементов Д. И. Менделеева с атомным
номером 24. Обозначается
символом Cr(лат. Chromium). Простое
вещество хром —
твёрдый металлголубовато-белого цвета.
Хром иногда относят к чёрным металлам.
Строение атома
+17
Cl )2 )8 )7 — схема строения атома
1s2s
2p
3s
3p
—
электронная формула
Атом
располагается в III периоде, и имеет три
энергетических уровня
Атом
располагается в VII в группе, в главной
подгруппе – на внешнем энергетическом
уровне 7 электронов
Получение.
При
сильном нагреве хромистого железняка
с углем происходит восстановление хрома
и железа:
FeO
* Cr2O3 +
4C = 2Cr + Fe + 4CO
В
результате этой реакции образуется
сплав хрома с железом, отличающийся
высокой прочностью. Для получения
чистого хрома, его восстанавливают из
оксида хрома(3) алюминием(способ
Бекетова):Cr2O3 +
2Al = Al2O3 +
2Cr
(В
данном процессе обычно используют два
оксида – Cr2O3 и
CrO3)
Физические
свойства
Хром
— белый блестящий металл с кубической
объемно-центрированной решеткой, а
= 0,28845 нм, отличающийся твердостью и
хрупкостью, с плотностью 7,2 г/см3,
один из самых твердых чистых металлов
(уступает только бериллию, вольфраму
и урану), с температурой плавления
1903 град. И с температурой кипения около
2570 град. С. На воздухе поверхность хрома
покрывается оксидной пленкой, которая
предохраняет его от дальнейшего
окисления. Добавка углерода к хрому еще
больше увеличивает его твердость.
Химические
свойства
Хром
при обычных условиях – инертный металл,
при нагревании становится довольно
активным.
Взаимодействие
с неметаллами
При
нагревании выше 600°С хром сгорает в
кислороде: 4Cr + 3O2 =
2Cr2O3.
С
фтором реагирует при 350°С, с хлором –
при 300°С, с бромом – при температуре
красного каления, образуя галогениды
хрома (III): 2Cr + 3Cl2 =
2CrCl3.
С
азотом реагирует при температуре выше
1000°С с образованием нитридов:
2Cr + N2 =
2CrN или 4Cr + N2 =
2Cr2N.
Сера
при температуре выше 300°С образует
сульфиды от CrS до Cr5S8,
например: 2Cr + 3S = Cr2S3.
Реагирует
с бором, углеродом и кремнием с образованием
боридов, карбидов и силицидов:
Cr
+ 2B = CrB2 (возможно
образование Cr2B,
CrB, Cr3B4,
CrB4),
2Cr
+ 3C = Cr2C3 (возможно
образование Cr23C6,
Cr7B3),
Cr
+ 2Si = CrSi2 (возможно
образование Cr3Si,
Cr5Si3,
CrSi).
С
водородом непосредственно не
взаимодействует.
-
Взаимодействие
с водой
В
тонкоизмельченном раскаленном состоянии
хром реагирует с водой, образуя оксид
хрома (III) и водород:
2Cr
+ 3H2O
= Cr2O3 +
3H2
-
Взаимодействие
с кислотами
В
электрохимическом ряду напряжений
металлов хром находится до водорода,
он вытесняет водород из растворов
неокисляющих кислот: Cr
+ 2HCl
= CrCl2 +
H2;
Cr
+ H2SO4 =
CrSO4 +
H2.
В
присутствии кислорода воздуха образуются
соли хрома (III): 4Cr
+ 12HCl
+ 3O2 =
4CrCl3 +
6H2O.
Концентрированная
азотная и серная кислоты пассивируют
хром. Хром может растворяться в них лишь
при сильном нагревании, образуются соли
хрома (III) и продукты восстановления
кислоты:
2Cr
+ 6H2SO4 =
Cr2(SO4)3 +
3SO2 +
6H2O;
Cr + 6HNO3 =
Cr(NO3)3 +
3NO2 +
3H2O.
-
Взаимодействие
с щелочными реагентами
В
водных растворах щелочей хром не
растворяется, медленно реагирует с
расплавами щелочей с образованием
хромитов и выделением водорода: 2Cr
+ 6KOH
= 2KCrO2 +
2K2O
+ 3H2.
Реагирует
с щелочными расплавами окислителей,
например хлоратом калия, при этом хром
переходит в хромат калия: Cr
+ KClO3 +
2KOH
= K2CrO4 +
KCl
+ H2O.
-
Восстановление
металлов из оксидов и солей
Хром
– активный металл, способен вытеснять
металлы из растворов их солей: 2Cr +
3CuCl2 =
2CrCl3 +
3Cu.