Сероводород
Строение молекулы и физические свойства
Сероводород H2S – это бинарное соединение водорода с серой, относится к летучим водородным соединениям. Следовательно, сероводород бесцветный ядовитый газ, с запахом тухлых яиц. Образуется при гниении. В твердом состоянии имеет молекулярную кристаллическую решетку.
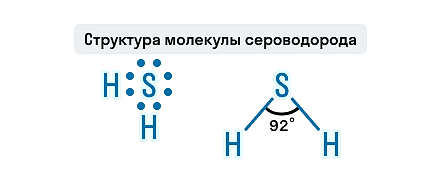
Геометрическая форма молекулы сероводорода похожа на структуру воды — уголковая молекула. Но валентный угол H-S-H меньше, чем угол H-O-H в воде и составляет 92,1о.
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например, при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
S + H2 → H2S
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: хлорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
2CrCl3 + 3Na2S + 6H2O → 2Cr(OH)3 + 3H2S↑ + 6NaCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например, сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
2H2S + O2 → 2S + 2H2O
В избытке кислорода:
2H2S + 3O2 → 2SO2 + 2H2O
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Например, азотная кислота окисляет сероводород до молекулярной серы:
H2S + 2HNO3(конц.) → S + 2NO2 + 2H2O
При кипячении сера окисляется до серной кислоты:
H2S + 8HNO3(конц.) → H2SO4 + 8NO2 + 4H2O
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например, оксид серы (IV) окисляет сероводород:
2H2S + SO2 → 3S + 2H2O
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
3H2S + K2Cr2O7 + 4H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 7H2O
2H2S + 4Ag + O2 → 2Ag2S + 2H2O
Серная кислота окисляет сероводород либо до молекулярной серы:
H2S + H2SO4(конц.) → S + SO2 + 2H2O
Либо до оксида серы (IV):
H2S + 3H2SO4(конц.) → 4SO2 + 4H2O
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов: меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например, сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
H2S + Pb(NO3)2 → PbS + 2HNO3
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 232 1–20 | 21–40 | 41–60 | 61–80 | 81–100 …
Добавить в вариант
Для выполнения задания используйте следующий перечень веществ: серная кислота, сероводород, карбонат натрия, вода, марганцовая кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
1
Для выполнения задания используйте следующий перечень веществ: серная кислота, сероводород, карбонат натрия, вода, марганцовая кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Сколько граммов сульфида алюминия требуется для получения 2,24 л (н. у.) сероводорода с помощью реакции гидролиза? Ответ округлите до ближайшего целого числа.
Для выполнения задания используйте следующий перечень веществ: сероводород, оксид железа(II), нитрат серебра, карбонат бария, хлорид железа (III). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
1
Для выполнения задания используйте следующий перечень веществ: сероводород, оксид железа(II), нитрат серебра, карбонат бария, хлорид железа (III). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Из предложенного списка выберите два вещества, которые реагируют с бромом в обычных условиях.
1) азот
2) раствор гидроксида калия
3) сероводород
4) соляная кислота
5) углекислый газ
Запишите в поле ответа номера выбранных веществ.
Для выполнения задания используйте следующий перечень веществ: сероводород, азотная кислота концентрированная, сульфат алюминия, оксид фосфора(V), нитрат меди(II). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
1
Для выполнения задания используйте следующий перечень веществ: сероводород, азотная кислота концентрированная, сульфат алюминия, оксид фосфора(V), нитрат меди(II). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Источник: ЕГЭ — 2018, основная волна. Задания 31 (С2).
Источник: ЕГЭ — 2018, основная волна. Задания 30 (С1).
Для выполнения задания используйте следующий перечень веществ: гидроксид магния, сероводород, нитрат серебра, дихромат натрия, серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
1
Для выполнения задания используйте следующий перечень веществ: гидроксид магния, сероводород, нитрат серебра, дихромат натрия, серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Источник: ЕГЭ — 2018, основная волна. Задания 31 (С2).
Источник: ЕГЭ — 2018, основная волна. Задания 30 (С1).
Из предложенного перечня выберите все вещества, на скорость взаимодействия которых с концентрированным раствором азотной кислоты при комнатной температуре оказывает влияние изменение давления
1) оксид магния
2) оксид серы(IV)
3) медь
4) сероводород
5) фосфин
Запишите номера выбранных ответов в порядке возрастания.
Источник: ЕГЭ по химии 2021. Досрочная волна. Вариант 1
Установите соответствие между названием соли и отношением этой соли к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ ВЕЩЕСТВА
А) сероводород
Б) метиламин
В) глюкоза
Г) хлорид аммония
СРЕДА РАСТВОРА
1) кислотная
2) щелочная
3) нейтральная
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между реагирующими веществами и признаком реакции, протекающей между ними: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) сероводород и сернистая кислота
Б) сернистый газ и подкисленный раствор перманганата калия
В) иод и раствор тиосульфата натрия
Г) фосфат калия и соляная кислота
ПРИЗНАК РЕАКЦИИ
1) образование окрашенного раствора
2) видимые признаки реакции отсутствуют
3) обесцвечивание раствора
4) помутнение раствора
5) выделение газа
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между способом воздействия на равновесную систему:
и направлением смещения равновесия при этом воздействии: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СПОСОБ ВОЗДЕЙСТВИЯ
А) увеличение давления
Б) добавление сероводорода
В) добавление твердого
Г) нагревание
НАПРАВЛЕНИЕ СМЕЩЕНИЯ РАВНОВЕСИЯ
1) смещается в направлении прямой реакции
2) смещается в направлении обратной реакции
3) практически не смещается
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между названием вещества и признаком реакции, который наблюдается при взаимодействии вещества с раствором сульфата меди: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) концентрированная соляная кислота
Б) раствор карбоната натрия
В) сероводород
Г) разбавленная азотная кислота
ПРИЗНАК РЕАКЦИИ
1) видимые признаки отсутствуют
2) образование осадка и изменение цвета раствора
3) образование осадка и выделение газа
4) только изменение цвета раствора
5) только выделение газа
Запишите в таблицу выбранные цифры под соответствующими буквами.
Источник: СтатГрад: Тренировочная работа 06.02.2023. Вариант ХИ2210302.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с выделением газа. Выпадение осадка в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с выпадением осадка. Выделение газа в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с выделением газа. Выпадение осадка в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, не приводящая к выделению газа. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с выпадением осадка. Выделение газа в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением окраски раствора и выпадением осадка. Выделение газа в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Даны водные растворы: гексагидроксоалюмината калия , хлорида алюминия, сероводорода и гидроксида рубидия.
Напишите уравнения четырёх возможных реакций между всеми предложенными веществами, не повторяя пары реагентов.
Даны водные растворы: сульфида натрия, сероводорода, хлорида алюминия и хлора.
Напишите уравнения четырёх возможных реакций между всеми предложенными веществами, не повторяя пары реагентов.
Какой объём (н. у.) сероводорода выделился при взаимодействии 0,3 моль сульфида железа (II) с избытком соляной кислоты? (Запишите число с точностью до сотых.)
1) 6,72
2) 4,12
3) 3,31
4) 5,36
Оксид хрома(VI) прореагировал с гидроксидом калия. Полученное вещество обработали серной кислотой, из образовавшегося раствора выделили соль оранжевого цвета. Эту соль обработали бромоводородной кислотой. Полученное простое вещество вступило в реакцию с сероводородом. Напишите уравнения четырёх описанных реакций.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 2
Всего: 232 1–20 | 21–40 | 41–60 | 61–80 | 81–100 …
Сероводород. Сульфиды.
Сероводород H2S — бесцветный с неприятным запахом
тухлых яиц, ядовит, малорастворим в воде, образуется при гниении белковых
веществ. Молекулярная кристаллическая решетка.
Получение
— в промышленности
1. выделение из
природных газов
2. синтез из простых
веществ (практического значения не имеет)
Водород + сера ___________________________________________________________________
— в лаборатории
1. действием кислот на сульфиды металлов, расположенных в ряду напряжений левее железа
соляная кислота + сульфид железа
(II) __________________________________________________
2. гидролиз сульфидов
алюминия/хрома
Сульфид алюминия + вода
_____________________________________________________________
Сульфид алюминия + соляная кислота
__________________________________________________
Химические
свойства
I. Кислотные свойства — слабая кислота, диссоциирует ступенчато, образует 2 ряда солей
(средние и кислые), изменяет окраску индикаторов, проявляет общие свойства
кислот.
— с Ме до Н2
Сероводород +
цинк _________________________________________________________________
— С основными и амфотерными оксидами
Сероводородная кислота + оксид калия
___________________________________________________
Сероводородная
кислота + оксид цинка ___________________________________________________
— С основаниями, амфотерными
гидроксидами; со щелочами образует средние и кислые соли
Сероводородная
кислота + гидроксид натрия(изб)
______________________________________________________________________________________
Сероводородная
кислота (изб) + гидроксид натрия
_______________________________________________________________________________________
Сероводородная
кислота + гидроксид цинка
_______________________________________________________________________________________
Сероводородная кислота + гидроксид
меди (II) — черный осадок
_______________________________________________________________________________________
H2S
+ Al(OH)3 / Cr(OH)3
-С аммиаком
Сероводородная кислота (нед) + аммиак
__________________________________________________
Сероводородная кислота (изб) + аммиак
__________________________________________________
— с солями — ТОЛЬКО с растворами солей
Сu2+, Pb2+, Ag+, Hg2+ ® “суровые сульфиды» —
качественная реакция на сульфиды
Сероводородная
кислота + сульфат меди (II) → … (черный
осадок)
______________________________________________________________________________________
Сероводородная кислота + ацетат
свинца → (черный ↓)
_____________________________________________________________________________________
Сероводород
+ хлорид железа (II) —- РЕАКЦИЯ НЕ ПРОТЕКАЕТ
— разрушение гидроксокомплексов
Тетрагидроксоалюминиат натрия +
сероводород = сульфид цинка +…
_______________________________________________________________________________________
Тетрагидроксоалюминиат натрия +
сероводород(изб) = гидроксид алюминия + …
______________________________________________________________________________________
II. ОВР – сильный восстановитель
1.
Разложение при t сероводород = _______________________________________________
2.
С кислородом – в избытке кислорода ® SO2, в
недостатке — S
Сероводород + кислород(нед) = … + …
(неполние окисление)
_______________________________________________________________________________________
Сероводород + кислород(изб) = … + …
(горение)
_______________________________________________________________________________________
3.
С сернистым газом ® S + вода
Сероводород + сернистый газ ______________________________________________________
Большинство
окислителей — Вr2,
I2, KMnO4, K2Cr2O7,
K2CrO4
и др. → S0
Сl2 (в
водном растворе), НNO3 ® S+6
4. С галогенами
Сероводород + хлор → … + …
(замещение) _______________________________________________
(Бром, йод)
Сероводород + хлор + вода ______________________________________________________________
5. С
кислотами-окислителями
Сероводород + азотная кислота (конц) ___________________________________________________
Сероводород + азотная кислота (разб) ____________________________________________________
Сероводород + серная кислота(конц)
_____________________________________________________
Сероводород + серная кислота(конц) _____________________________________________________
6. С KMnO4, K2Cr2O7
Сероводород + перманганат калия +
серная кислота
______________________________________________________________________________________
Сероводород + перманганат калия
______________________________________________________________________________________
Сероводород + дихромат калия + серная
кислота
______________________________________________________________________________________
7. C
cолями железа (III), S-2 ® S, Fe 3+® Fe2+, осадок FeS не образуется, т.к.
он растворяется в кислотах.
Хлорид железа (III) + сероводород
________________________________________________________
Сульфат железа (III) + сероводород
_____________________________________________________
8. Почернение серебряных и медных
изделий
Сероводород + серебро + кислород
________________________________________________________
Сульфиды
|
Растворимые |
Нерастворимые в воде, но растворимые в растворах |
Нерастворимые ни в воде, ни в минеральных кислотах (растворяются только в |
Разлагаемые водой, в растворе не существуют |
|
Сульфиды |
Белые и |
Черные сульфиды (CuS, HgS, PbS, «СУРОВЫЕ» |
Сульфиды |
|
Реагируют ZnS |
Не |
Разлагаются Cr2S3 + 2Cr(OH)3+ |
Многие
сульфиды окрашены:
HgS
– черный PbS
— черный MnS
– розовый
CuS
– черный Ag2S
— черный ZnS
– белый
Химические свойства
1. Гидролиз
— Растворимые сульфиды гидролизуются по
аниону, среда водных растворов сульфидов щелочная:
Сульфид
калия + вода __________________________________________________________________
—
Необратимый гидролиз
Сульфид
алюминия + вода ______________________________________________________________
Сульфид
алюминия + соляная кислота ___________________________________________________
Сульфид
алюминия + гидроксид натрия (р-р) _______
______________________________________
—
взаимное усиление гидролиза натрия — сульфиды щелочных Ме с солями Ме (+3) в
растворе
Сульфид
калия + хлорид алюминия (раствор)
_____________________________________________________________________________________
Сульфид
натрия + сульфат хрома (III)
(раствор)
_____________________________________________________________________________________
сульфид
лития и сульфат алюминия
_____________________________________________________________________________________
2. Сульфиды
металлов, расположенных в ряду напряжений левее железа (включительно),
растворяются в сильных минеральных кислотах.
сульфид
кальция + соляная кислота _____________________________________________________
сульфид
железа (II) + бромоводородная кислота __________________________________________
3.
Растворимые сульфиды с растворами солей, если образуется осадок
Сульфид натрия + нитрат свинца (II) ____________________________________________________
Сульфид калия + хлорид меди (II) _______________________________________________________
4. Нерастворимые
сульфиды растворяются в только конц. азотной или конц. серной кислоте
(сера окисляется до сульфата)
Сульфид
меди (II) + серная кислота (конц) _________________________________________________
Сульфид
меди (II) + азотная кислота (конц) _______________________________________________
Сульфид
меди (II) + азотная кислота (разб) _______________________________________________
5. С
пероксидом водорода, хлором и др. окислителями — чаще всего до S0
(редко S+6)
Сульфид
свинца (II) + пероксид водорода _________________________________________________
Сульфид
натрия + дихромат калия + серная кислота
______________________________________________________________________________________
Сульфид
калия + сульфат железа (III)
+ серная кислота
_____________________________________________________________________________________________________________________________________________________________________________________________________________
6.
При взaимодействии с солями Fe+3 – ОВР
(НЕ ГИДРОЛИЗ)
Сульфид
калия + хлорид железа (III)
______________________________________________________________________________________
бромид
железа (III) + избыток водного раствора сульфида натрия
______________________________________________________________________________________
7.
Обжиг сульфидов – образуется 2 оксида
Сульфид
цинка + кислород ____________________________________________________________
Сульфид
алюминия + кислород _________________________________________________________
Пирит
+ кислород ___________________________________________________________________
8.
Качественная реакция
—
на растворимые сульфиды – взаимодействие с растворимыми солями свинца ®
черный осадок PbS
—
взаимодействие с растворами кислот ®
образуется Н2S — газ
с неприятным запахом
Чтобы поделиться, нажимайте
Физические свойства
Газ, бесцветный, с запахом тухлых яиц, ядовит, растворим в воде (в одном объёме H2O растворяется 3 объёма H2S при н.у.); t°пл. = -86°C; t°кип. = -60°С.
Получение
1) H2 + S → H2S↑ (при t)
2) FeS + 2HCl → FeCl2 + H2S↑
Химические свойства
1) Раствор H2S в воде – слабая двухосновная кислота.
Диссоциация происходит в две ступени:
H2S → H+ + HS— (первая ступень, образуется гидросульфид — ион)
HS— → 2H+ + S2- (вторая ступень)
Сероводородная кислота образует два ряда солей — средние (сульфиды) и кислые (гидросульфиды):
Na2S – сульфид натрия;
CaS – сульфид кальция;
NaHS – гидросульфид натрия;
Ca(HS)2 – гидросульфид кальция.
2) Взаимодействует с основаниями:
H2S + 2NaOH(избыток) → Na2S + 2H2O
H2S (избыток) + NaOH → NaНS + H2O
3) H2S проявляет очень сильные восстановительные свойства:
H2S-2 + Br2 → S0 + 2HBr
H2S-2 + 2FeCl3 → 2FeCl2 + S0 + 2HCl
H2S-2 + 4Cl2 + 4H2O → H2S+6O4 + 8HCl
3H2S-2 + 8HNO3(конц) → 3H2S+6O4 + 8NO + 4H2O
H2S-2 + H2S+6O4(конц) → S0 + S+4O2 + 2H2O
(при нагревании реакция идет по — иному:
H2S-2 + 3H2S+6O4(конц) → 4S+4O2 + 4H2O
4) Сероводород окисляется:
при недостатке O2
2H2S-2 + O2 → 2S0 + 2H2O
при избытке O2
2H2S-2 + 3O2 → 2S+4O2 + 2H2O
5) Серебро при контакте с сероводородом чернеет:
4Ag + 2H2S + O2 → 2Ag2S↓ + 2H2O
Потемневшим предметам можно вернуть блеск. Для этого в эмалированной посуде их кипятят с раствором соды и алюминиевой фольгой. Алюминий восстанавливает серебро до металла, а раствор соды удерживает ионы серы.
6) Качественная реакция на сероводород и растворимые сульфиды — образование темно-коричневого (почти черного) осадка PbS:
H2S + Pb(NO3)2 → PbS↓ + 2HNO3
Na2S + Pb(NO3)2 → PbS↓ + 2NaNO3
Pb2+ + S2- → PbS↓
Загрязнение атмосферы вызывает почернение поверхности картин, написанных масляными красками, в состав которых входят свинцовые белила. Одной из основных причин потемнения художественных картин старых мастеров было использование свинцовых белил, которые за несколько веков, взаимодействуя со следами сероводорода в воздухе (образуются в небольших количествах при гниении белков; в атмосфере промышленных регионов и др.) превращаются в PbS. Свинцовые белила – это пигмент, представляющий собой карбонат свинца (II). Он реагирует с сероводородом, содержащимся в загрязнённой атмосфере, образуя сульфид свинца (II), соединение чёрного цвета:
PbCO3 + H2S = PbS↓ + CO2 + H2O
При обработке сульфида свинца (II) пероксидом водорода происходит реакция:
PbS + 4H2O2 = PbSO4 + 4H2O,
при этом образуется сульфат свинца (II), соединение белого цвета.
Таким образом реставрируют почерневшие масляные картины.
7) Реставрация:
PbS + 4H2O2 → PbSO4(белый) + 4H2O
Сульфиды
Получение сульфидов
1) Многие сульфиды получают нагреванием металла с серой:
Hg + S → HgS
2) Растворимые сульфиды получают действием сероводорода на щелочи:
H2S + 2KOH → K2S + 2H2O
3) Нерастворимые сульфиды получают обменными реакциями:
CdCl2 + Na2S → 2NaCl + CdS↓
Pb(NO3)2 + Na2S → 2NaNO3 + PbS↓
ZnSO4 + Na2S → Na2SO4 + ZnS↓
MnSO4 + Na2S → Na2SO4 + MnS↓
2SbCl3 + 3Na2S → 6NaCl + Sb2S3↓
SnCl2 + Na2S → 2NaCl + SnS↓
Химические свойства сульфидов
1) Растворимые сульфиды сильно гидролизованы, вследствие чего их водные растворы имеют щелочную реакцию:
K2S + H2O → KHS + KOH
S2- + H2O → HS— + OH—
2) Сульфиды металлов, стоящих в ряду напряжений левее железа (включительно), растворимы в сильных кислотах:
ZnS + H2SO4 → ZnSO4 + H2S
3) Нерастворимые сульфиды можно перевести в растворимое состояние действием концентрированной HNO3:
FeS2 + 8HNO3 → Fe(NO3)3 + 2H2SO4 + 5NO + 2H2O
Сероводород — это молекулярное соединение с ковалентной полярной связью. По-другому это вещество называется сернистым водородом или сульфидом водорода. Химическая формула сероводорода — H2S.
Строение и физические свойства сероводорода
Сероводород — это бесцветный газ с характерным запахом тухлых яиц, сладкий на вкус, тяжелее воздуха. Малорастворим в воде, хорошо растворим в спирте. На воздухе легко воспламеняется. Очень ядовит.
Вдыхание паров сероводорода даже в малых количествах может привести к тяжелому отравлению. Признак сильного отравления парами сероводорода — потеря обоняния, перестает ощущаться характерный неприятный запах газа.
Противоядия при отравлении сероводородом — вещества-окислители. При слабом отравлении необходимо выйти на свежий воздух, то есть повысить концентрацию вдыхаемого кислорода. В случае более сильного отравления полезно очень осторожно вдохнуть пары хлора.
Состав H2S представлен двумя элементами-неметаллами, атомы которых связаны ковалентной полярной связью. Молекула этого газа имеет угловое строение, этим она схожа с молекулой воды, но по сравнению с водой в молекуле сероводорода слабые водородные связи. Связи S—H образуют валентный угол, равный 92,1о, как показано на структурной формуле сероводорода.
Знание физических свойств сульфида водорода может спасти кому-то жизнь, и это не единственное применение химической теории на практике. На курсах подготовки к ОГЭ по химии в онлайн-школе Skysmart ученики не только разбирают задания экзамена, но и учатся применять полученные знания в реальной жизни.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Способы получения сероводорода
Сероводород встречается в природе в вулканических газах и водах минеральных источников. Также он образуется в результате разложения белков погибших животных и растений, при гниении пищевых отбросов.
-
При высокой температуре сера взаимодействует с водородом, в результате образуется газ — сероводород:
H2 + S → H2S.
-
Практический способ получения сероводорода — действие разбавленных кислот на сульфиды:
FeS (тв) + 2HCl (разб) → H2S + FeCl2.
-
Полный гидролиз, в результате которого выделяется газ и выпадает осадок:
Al2S3 + 6H2O → 3H2S + 2Al(OH)3.
-
Сероводород можно получить путем нагревания смеси парафина и серы:
С20H42 + 21S → 21H2S + 20C.
-
Действие концентрированной серной кислоты на щелочные и щелочноземельные металлы:
8Na + 5H2SO4 (конц) → 4Na2SO4 + H2S + 4H2O.
Химические свойства сероводорода
Горение
На воздухе сероводород горит голубым пламенем. Процесс может протекать в двух направлениях:
-
Полное горение. Продукты реакции — диоксид серы и вода:
2H2S + 3O2 → 2SO2 + 2H2O.
-
Если внести в пламя сероводорода холодный предмет, например фарфоровую чашку, температура пламени значительно снизится и сероводород окислится до свободной серы, оседающей на чашке в виде желтого налета:
2H2S + O2 → 2S + 2H2O.
Растворимость в воде
Сероводород растворим в воде. Его раствор называют сероводородной водой или сероводородной кислотой. Формула сероводородной кислоты — H2S. Если кислота долго находится на воздухе и особенно на свету, она мутнеет, т. к. сера окисляется.
Сероводородная кислота — это слабая кислота, она диссоциирует ступенчато, в основном диссоциация протекает по первой ступени:
-
H2S ⇄ H+ + HS−.
-
HS− ⇄ H+ + S2−.
Свойства кислот
Так как раствор сероводорода является кислотой, то для него характерны свойства кислот:
-
изменение цвета индикатора — лакмус становится розовым в растворе сероводорода;
-
взаимодействие с активными металлами:
H2S + Mg → MgS + H2;
-
раствор сероводорода реагирует с основными оксидами:
H2S + BaO → BaS + H2O;
-
взаимодействие со щелочами:
H2S + NaOH → NaHS + H2O;
H2S + 2NaOH → Na2S + 2H2O;
-
сероводородная кислота может вступать в реакции обмена с солями, если одним из продуктов реакции будет нерастворимый сульфид:
H2S + CuCl2 → CuS↓ + 2HCl.
Взаимодействие с аммиаком
Раствор сероводородной кислоты взаимодействует с аммиаком:
H2S + 2NH3 → (NH4)2S.
Окисление металлов
Сероводород может окислять малоактивные металлы в присутствии кислорода:
4Ag + 2H2S + O2 → 2Ag2S + 2H2O.
Реакции с галогенами
Сероводород вступает в реакции с галогенами:
H2S + Cl2 → S + 2HCl.
Качественные реакции
Качественная реакция на сероводород — бумага, смоченная раствором нитрата свинца (II), чернеет в присутствии сероводорода:
H2S + Pb(NO3)2 → PbS↓ + 2HNO3.
Восстановительные свойства
В молекуле сероводорода сера имеет низшую степень окисления, следовательно, сероводород проявляет свойства сильного восстановителя. При взаимодействии с сильнейшими окислителями он окисляется до серы, оксида серы (IV) или серной кислоты. Полнота окисления зависит от условий протекания химической реакции: температуры, pH раствора и концентрации окислителя:
-
в реакции с бромной водой наблюдается обесцвечивание раствора:
H2S + 4Br2 + 4H2O → H2SO4 + 8HBr;
-
окисление сероводорода подкисленным раствором перманганата калия:
5H2S + 2KMnO4 + 3H2SO4 → 5S + K2SO4 + 2MnSO4 + 8H2O;
-
сероводород в кислой среде реагирует с дихроматом калия:
3H2S + K2Cr2O7 + 4H2SO4 → K2SO4 + Cr2(SO4)3 + 3S + 7H2O;
-
взаимодействие с кислотами-окислителями (HNO3, H2SO4):
3H2S + 8HNO3 (разб) → 3H2SO4 + 8NO + 4H2O;
H2S + 8HNO3 (конц) → H2SO4 + 8NO2 + 4H2O;
H2S + H2SO4 (конц) → S + SO2 + 2H2O.
Вопросы для самопроверки
-
Охарактеризуйте физические свойства сульфида водорода.
-
Перечислите свойства сероводородной кислоты. От чего зависит образование сульфидов и гидросульфидов?
-
Схеме превращений S−2 → S+4 соответствует уравнение:
-
2H2S + O2 → S + 2H2O
-
H2SO3 + H2O2 → H2SO4 + H2O
-
PbS + 4H2O2 → PbSO4 + 4H2O
-
2H2S + 3O2 → 2SO2 + 2H2O
-
-
Составьте уравнения четырех реакций, которые могут протекать между NaOH, H2S, CuCl2.
-
Верны ли следующие суждения?
А. Сероводород при взаимодействии со щелочами образует два вида солей: средние и кислые.
Б. Сероводород — восстановитель.
-
Верно только А
-
Верно только Б
-
Оба верны
-
Оба неверны
-