Иммунитет
-
Словарь основных терминов
-
Органы иммунной системы
-
Клеточный и гуморальный механизмы иммунитета
-
Типы иммунитета:
-
Воспалительный процесс.
Статья профессионального репетитора по биологии Т. М. Кулаковой
Иммунитет — способность организма распознавать вторжение чужеродного материала и мобилизовать клетки и образуемые ими вещества на более быстрое и эффективное удаление этого материала.
Фрэнк Бёрнет, лауреат Нобелевской премии по физиологии и медицине.
Словарь основных терминов
• Иммунитет – способность организма защищать себя от бактерий, вирусов, чужеродных тел, избавляться от них и благодаря этому сохранять постоянство внутренней среды организма.
• Фагоцитоз – процесс «заглатывания» лейкоцитами микроорганизмов, а также остатков мёртвых клеток и других частиц, например, пыли в лёгких.
• Фагоциты – некоторые лейкоциты, осуществляющие процесс фагоцитоза. Фагоциты способны к амёбоидному движению, благодаря образованию ложноножек.
• Антитела – белки, вырабатывающиеся В-лимфоцитами в ответ на присутствие чужеродного вещества – антигена. Антитела строго специфичны. Человеческий организм способен образовать примерно 100 миллионов различных антител, распознающих практически любые чужеродные вещества.
• Антиген – чужеродная молекула, вызывающая образование антител. Антигенами могут быть микробы, вирусы, любые клетки, состав которых отличается от состава собственных клеток организма.
• Антитоксин – специальное защитное вещество. Антитоксины нейтрализуют циркулирующие в крови яды микробов.
• Вакцина – препарат, содержащий убитых или ослабленных возбудителей заболевания, т.е. препарат, содержащий небольшое количество антигенов.
• Лечебная сыворотка – препарат, содержащий готовые антитела. Сыворотка готовится из крови животных, которые раньше специально заражались возбудителем заболевания. Иногда сыворотка готовится из крови человека, переболевшего заболеванием, например гриппом.
• Макрофаги – крупные клетки способные к фагоцитозу, находящиеся в тканях. Выполняют санитарную и защитную функции.
к оглавлению ▴
Органы иммунной системы
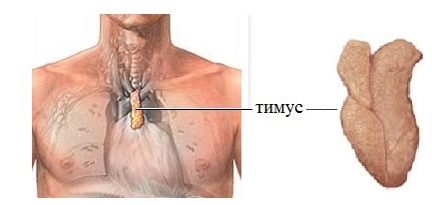
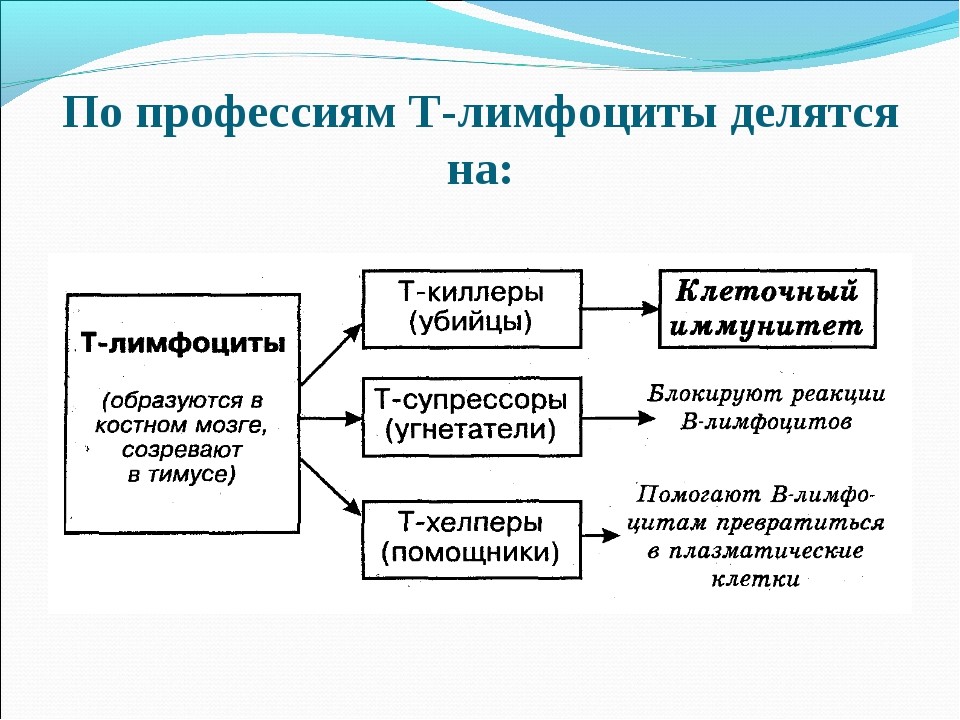
1. Тимус (вилочковая железа) расположена позади грудины. Функционирует только у детей. Играет важную роль в развитии иммунной системы. В тимусе образуются и созревают Т–лимфоциты.
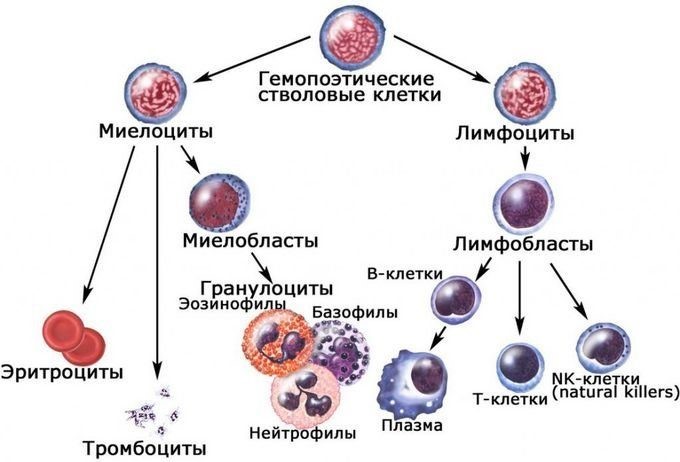
2. Костный мозг содержится в трубчатых костях. В нем образуются клетки крови — эритроциты, лейкоциты, тромбоциты, макрофаги. Рождающиеся здесь лимфоциты мигрируют в тимус. Дозревая там, они образуют Т-лимфоциты.
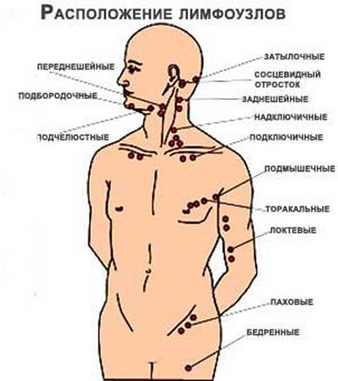
3. Лимфоузлы – узлы, расположенные по ходу лимфатических сосудов. Они содержат лимфоциты. Фильтруют лимфу, очищая её от вирусов, бактерий, раковых клеток.
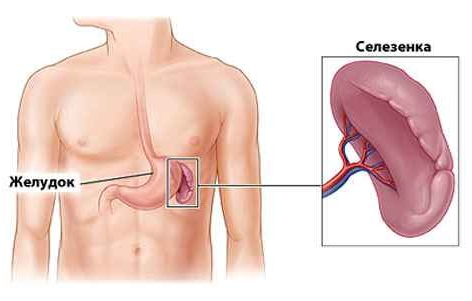
4. Селезёнка – орган, в котором формируются лимфоциты. Является биологическим фильтром — удаляет состарившиеся, повреждённые клетки крови, растворяет и поглощает бактерии и другие чужеродные вещества. Выполняет роль депо крови.
Неспецифическая сопротивляемость обеспечивается:
1. Непроницаемостью здоровой кожи и слизистых оболочек для микроорганизмов;
2. Наличием защитных органов: печени, лимфоузлов, селезёнки;
3. Наличием бактерицидных веществ в жидкостях: в слюне, слезах, крови, лимфе, тканевой жидкости.
4. Выделения потовых и сальных желёз, а также соляная кислота выполняют защиту от микроорганизмов.
Наш организм имеет несколько форм защиты от чужеродных тел и соединений.
Неспецифический иммунитет – самая древняя форма иммунитета, осуществляется лейкоцитами путём фагоцитоза. Специфический иммунитет – это способность организма распознавать вещества, отличные от его клеток и тканей, и уничтожать только эти антигены.

В организме имеются два типа лимфоцитов – Т-клетки и В-клетки.
Т-лимфоциты возникают в костном мозге, проходят этап созревания в тимусе и затем расселяются в лимфатических узлах, селезёнке или в крови, где на их долю приходится 40 – 70 % всех лимфоцитов. Т-лимфоциты способны распознавать антигены.
В-лимфоциты образуются в костном мозге, дозревают в лимфоидной ткани червеобразного отростка, миндалинах. В-лимфоциты, получив информацию об антигене от Т-лимфоцита, начинают стремительно размножаться и синтезируют антитела.
к оглавлению ▴
Клеточный и гуморальный механизмы иммунитета
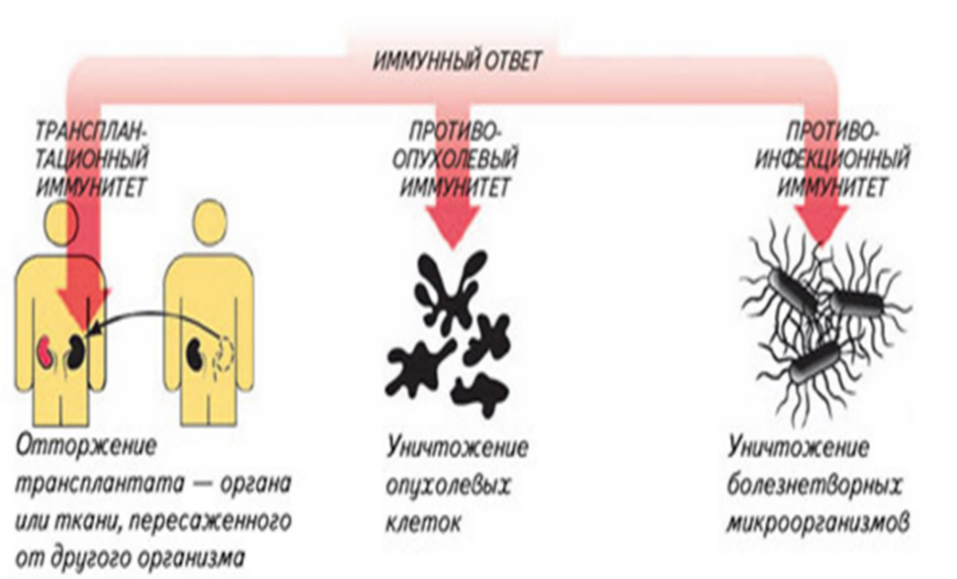
Клеточный иммунитет: Т-лимфоциты распознают микроорганизмы, вирусы, трансплантированные органы и ткани, злокачественные клетки. В реакции участвует вся иммунная клетка, свободные антитела при этом не выделяются.
Гуморальный иммунитет: В-лимфоциты выделяют антитела в плазму крови, тканевую жидкость и лимфу. Одни антитела склеивают микроорганизмы, другие осаждают склеенные частицы, а третьи разрушают, растворяют их.
к оглавлению ▴
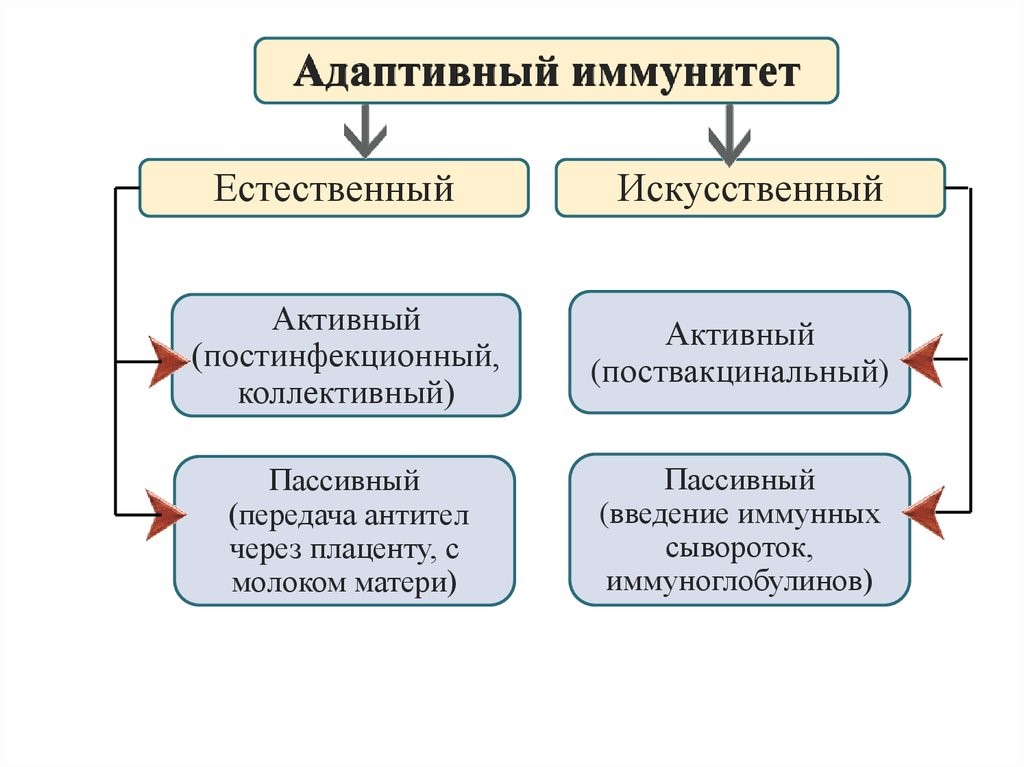
Типы иммунитета:
| Естественный | Искусственный | |
| Пассивный | Материнские антитела проникают через плаценту в кровь плода и обеспечивают защиту младенца. В первые дни жизни младенец через молоко получает антитела , которые всасываются в кишечнике без расщепления. | Введение антител обеспечивает немедленную защиту от инфекции.однако такая защита действует недолго, поскольку количество антител постепенно снижается. |
| Активный | Организм сам производит антитела в результате инфекции. Корь, ветрянная оспа, коклюш, свинка обычно оставляют стойкий иммунитет. | Введение вакцин вызывают появление антител в плазме привитого человека. В настоящее время разработаны приёмы создания антител при помощи современных методов биотехнологии. |
к оглавлению ▴
Воспалительный процесс.
При ранении участка тела возникает местная реакция, проявляющаяся в отёке и болезненности. Такое состояние называют воспалением. Воспаление сопровождается следующими признаками:
1. Происходит местное расширение капилляров, в результате чего усиливается приток крови к данному участку. Происходит покраснение и повышение температуры.
2. Вследствие усиления проницаемости капилляров, плазма и лейкоциты выходят в окружающие ткани. Возникает отёк.
3. Лейкоциты направляются к бактериям, происходит фагоцитоз. Если фагоцит поглощает больше микробов, чем он может переварить, то он гибнет. Смесь погибших и живых фагоцитов и бактерий называется гноем.
4. Возникающие признаки приводят к раздражению рецепторов, вызывающее ощущение боли.
Подготовка к ЕГЭ по биологии и поступлению в медицинский вуз.
Благодарим за то, что пользуйтесь нашими публикациями.
Информация на странице «Иммунитет» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
08.03.2023
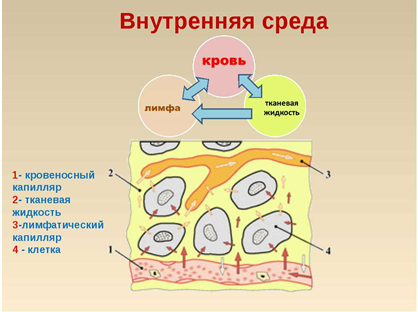
Внутренняя среда организма складывается из 3 тесно взаимосвязанных компонентов: кровь, лимфа и межклеточная жидкость (тканевая,
интерстициальная).
В капиллярах стенка состоит из одного слоя клеток, что делает возможным газообмен и обмен питательными веществами с окружающими капилляр тканями. Через стенку
сосуда газы, питательные вещества и вода из крови устремляются к клеткам. В клетках происходит тканевое дыхание, в межклеточную
жидкость выделяется углекислый газ, который затем поступает в кровь, соединяется с гемоглобином и, достигая альвеол в легких,
удаляется из организма.
У лимфатических сосудов есть особенность, которую вы всегда обнаружите на рисунке: они начинаются слепо, в отличие от кровеносных
сосудов. Лимфу в них образует вода, поступающая из межклеточной жидкости. Лимфа участвует в перераспределении жидкости в организме.
Состав и функции крови
Кровь — важнейшая составляющая внутренней среды организма. Напомню, что эта ткань относится к жидким соединительным
тканям и состоит из плазмы (на 55%) и форменных элементов (оставшиеся 45%). У взрослого человека объем крови составляет 4-6 литра.
Давайте систематизируем и углубим наши знания о крови. Кровь состоит из:
- Плазмы на 55%
- Трофическую (питательную) — белки плазмы являются источником аминокислот
- Буферную — поддерживают кислотно-щелочное состояние (pH крови = 7,35-7,4)
- Транспортную — белки глобулины транспортируют питательные вещества — жиры, а также гормоны, витамины
- Защитную — в крови циркулируют антитела, белки крови (в частности фибриноген) обеспечивают гемостаз
(свертывание крови) - Форменных элементов
- Эритроциты — от греч. ἐρυθρός — красный и κύτος — вместилище, клетка
- C кислородом — оксигемоглобин
- C углекислым газом — карбгемоглобин
- C угарным газом — карбоксигемоглобин
- Лейкоциты — от др.-греч. λευκός — белый и κύτος — вместилище, тело
- Осуществлении фагоцитоза
- Обезвреживании ядов, токсинов
- Участие в клеточном и гуморальном иммунитете
- Тромбоциты — от греч. θρόμβος — сгусток и κύτος — клетка
В состав плазмы входят различные белки: альбумины, глобулины, фибриноген, ионы Ca2+, K+,
Mg2+, Na+, Cl—, HPO42-, HCO3—.
Плазма выполняет ряд важных функций:
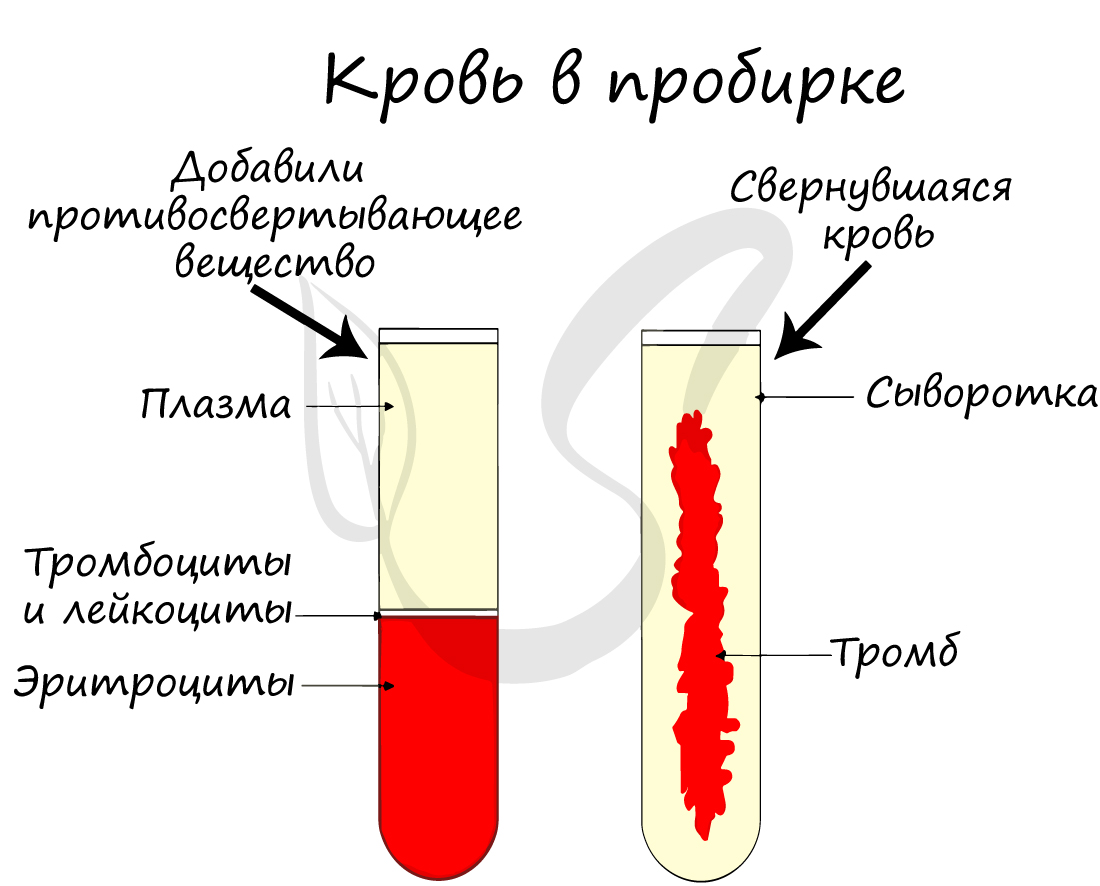
Отметьте, что плазма крови без фибриногена называется сывороткой (она не свертывается, в отличие от плазмы).
Концентрация соли NaCl (хлорида натрия) в крови примерно постоянна и составляет 0,9%.
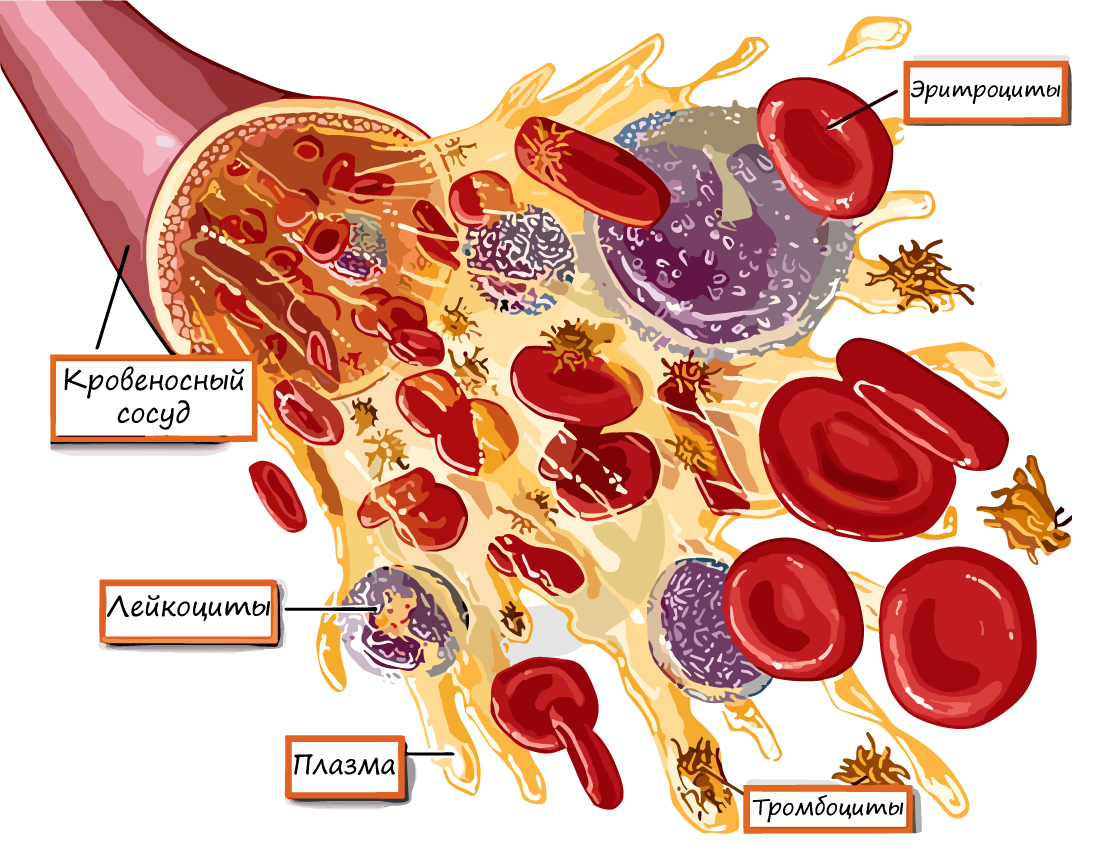
К ним относятся:
Эритроциты — красные кровяные тельца, основная их
функция — дыхательная — перенос газов: кислорода от альвеол легких к тканям и углекислого газа от тканей к альвеолам.
В 1 мм3 крови находится около 4-5 млн.
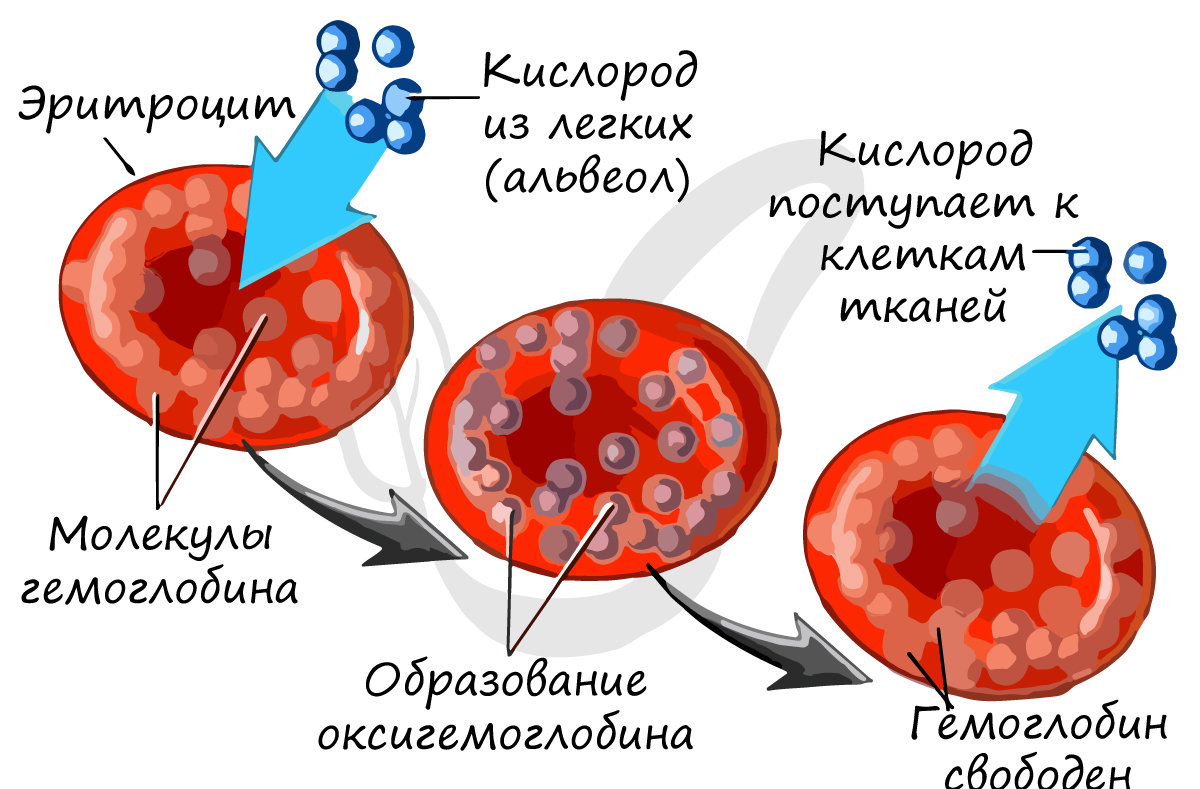
Основной белок эритроцита — гемоглобин, состоящий из железосодержащего гема (Fe) и белка глобина.
Эритроциты имеют характерную двояковогнутую форму, лишены ядра (в отличие от эритроцитов других животных, например,
эритроциты лягушки содержат ядро). Их маленький диаметр и способность складываться помогает им проникать через самые
мельчайшие сосуды нашего тела — капилляры, диаметр которых меньше, чем диаметр эритроцита!
Эритроциты дифференцируются в красном костном мозге (в губчатом веществе костей), срок их жизни составляет 120 дней. К окончанию жизненного цикла их форма становится шарообразной. Такие старые шарообразные эритроциты
задерживаются в печени и селезенке, которая называется кладбищем эритроцитов. Здесь они разрушаются, а их остатки
фагоцитируются.
Из статьи о легких вы уже знаете, что гемоглобин образует соединения:
Сродство гемоглобина к угарному газу в 300 раз выше, чем к кислороду, поэтому карбоксигемоглобин
очень устойчив.
Вообразите: при содержании во вдыхаемом воздухе 0,1% угарного газа 80% от общего количества гемоглобина
связываются с угарным газом, а не с кислородом! Угарный газ образуется при пожарах в замкнутом пространстве,
отравиться им и потерять сознание можно очень быстро. Если немедленно не вынести человека на свежий воздух,
то летальный исход становится неизбежным.

Запомните, что у людей, живущих в горной местности, количество эритроцитов в крови несколько выше, чем у
обитателей равнины. Это связано с тем, что концентрация кислорода в горах ниже средней, вследствие чего
компенсаторно увеличивается содержание эритроцитов в крови, чтобы переносить больше кислорода.

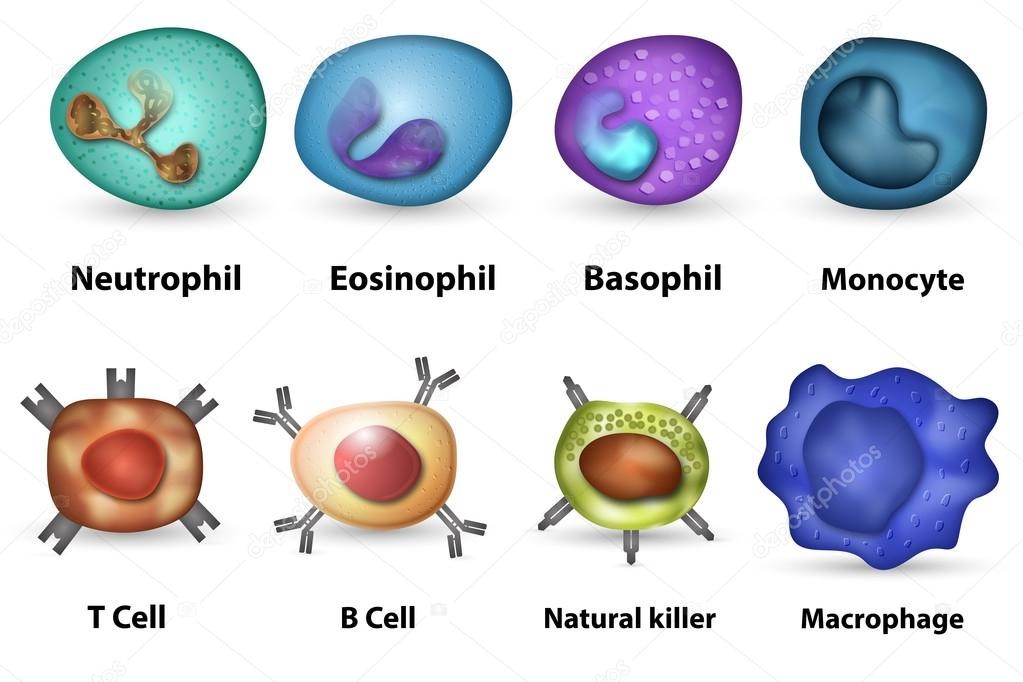
Лейкоциты — белые кровяные тельца, имеющие ядро и не содержащие гемоглобин. Дифференцируются в красном костном мозге,
лимфатических узлах. С кровью переносятся к тканям организма, где проходит основная часть их жизненного цикла: они выполняют защитную функцию, которая заключается в:
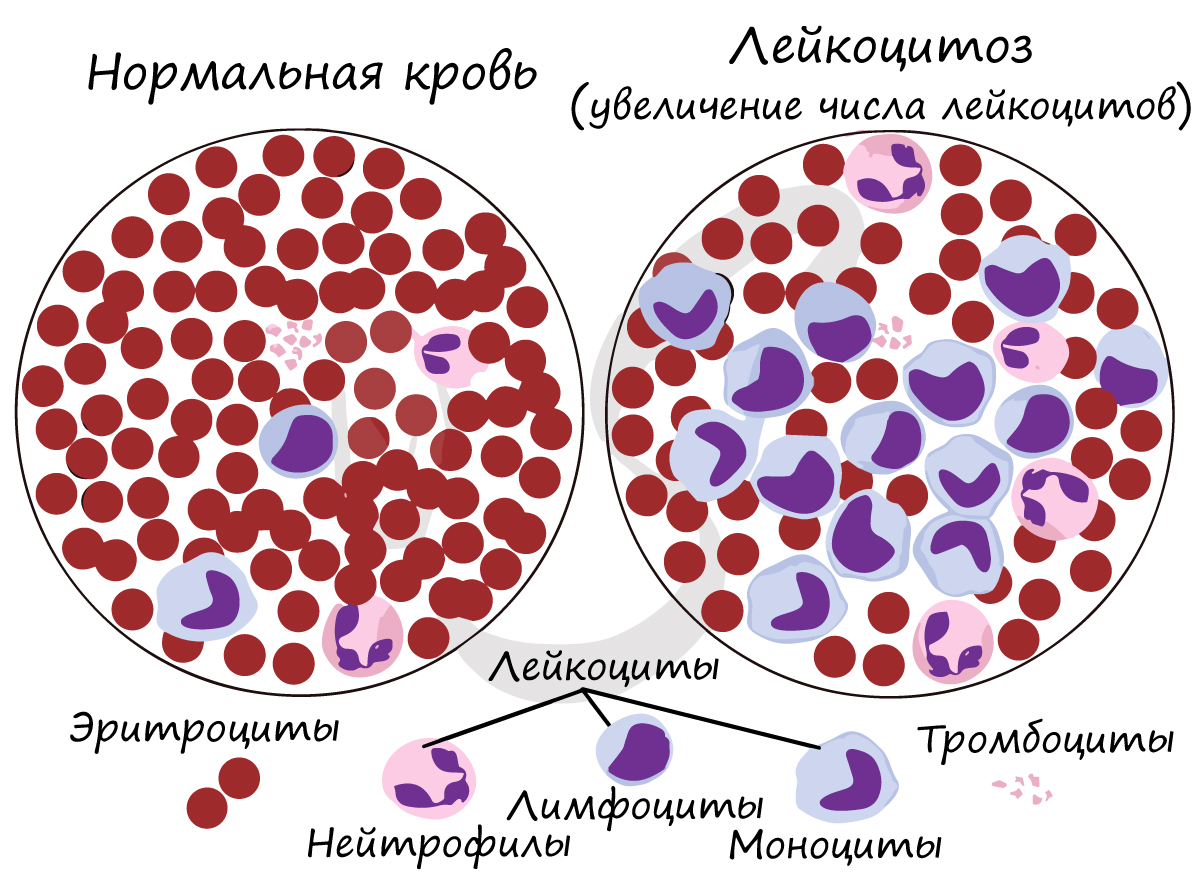
Число лейкоцитов в 1 мм3 крови 4-9 тысяч. Лейкоциты разнообразны по форме и строению, среди них встречаются
нейтрофилы, лимфоциты, моноциты. Их деятельность направлена на защиту организма: они обеспечивают иммунитет.
Если количество лейкоцитов
увеличено в анализе крови, то врач может заподозрить инфекционный процесс: при его наличии количество лейкоцитов возрастает, чтобы
уничтожить бактерии и вирусы, попавшие в организм.
Около 25-40% от всех лейкоцитов составляют лимфоциты, в популяции которых можно обнаружить T- и B-лимфоциты. Они
выполняют важнейшие функции, благодаря которым формируется иммунитет.
T-лимфоциты созревают в специальном органе — тимусе (вилочковой железе). Они обеспечивают клеточный иммунитет, выявляют
и уничтожают мутантные (раковые) клетки, миллионы которых ежедневно образуются даже у здорового человека. Уничтожают в организме подобные клетки T-лимфоциты путем фагоцитоза.
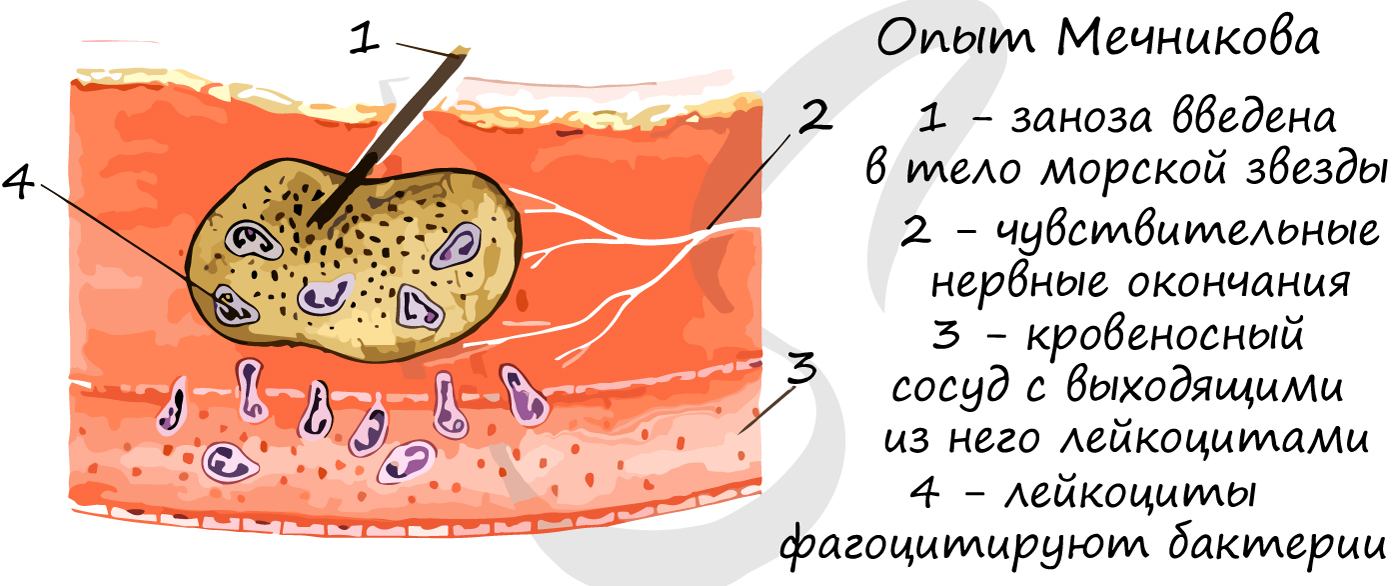
Фагоцитоз — процесс, при котором клетки захватывают и переваривают твердые частицы (другие клетки). Создатель фагоцитарной
теории иммунитета И.И. Мечников провел опыт, который наглядно демонстрирует, что лейкоциты способны выходить из кровеносного
русла в ткани (при воспалении), фагоцитировать попавшие в рану чужеродные белки, бактерии.
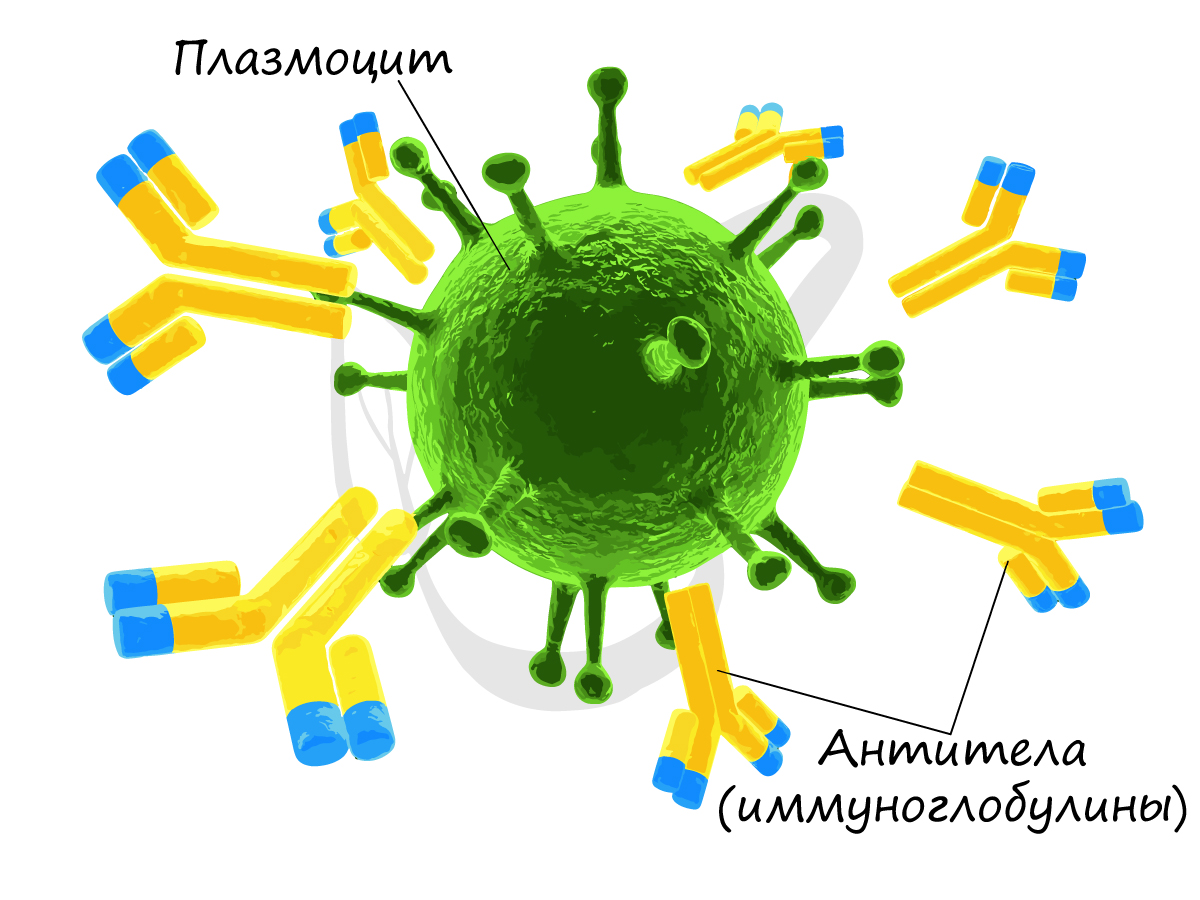
Гуморальный (греч. humor — жидкость) иммунитет обеспечивается B-лимфоцитами. После контакта с антигеном (чужеродное вещество в организме) B-лимфоцит
превращается в плазмоцит — клетку, которая вырабатывает антитела. Антитела (иммуноглобулины) — белковые молекулы, препятствующие размножению микроорганизмов и нейтрализующие выделяемые ими токсины.
Часть плазмоцитов может оставаться в организме после устранения антигена многие годы, эта часть обеспечивает иммунную память, благодаря которой
в случае повторного попадания того же антигена — человек не заболеет, либо легко и быстро перенесет болезнь.
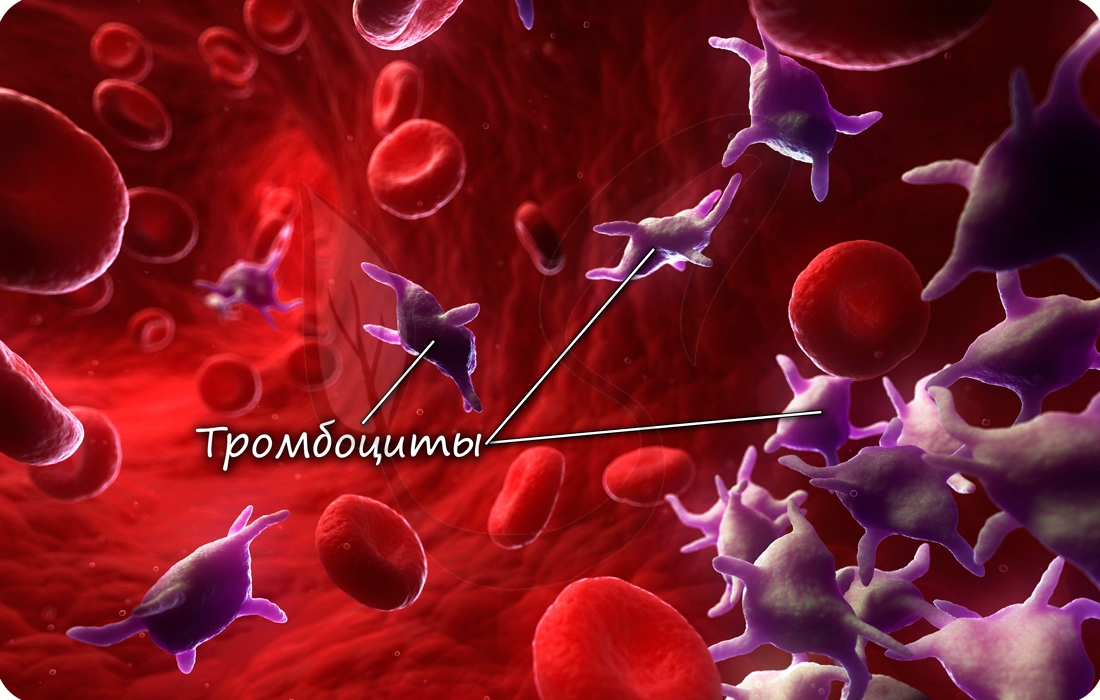
Устаревшее название тромбоцитов — кровяные пластинки. Тромбоциты — клеточные элементы крови, представляющие собой круглые безъядерные
образования. В 1 мм3 насчитывается 250-400 тысяч клеток.
Дифференцируются (образуются) тромбоциты в красном костном мозге. На их поверхности имеются рецепторы,
которые активируются при повреждении кровеносного русла. Они играют важную роль в процессе
гемостаза — свертывания крови, предотвращают кровопотерю.
Процесс гемостаза требует нашего особого внимания. Гемостаз (от греч. haima — кровь + stasis — стояние) —
процесс свертывания крови, являющийся важнейшим защитным механизмом от кровопотери. Активируется при
повреждении кровеносных сосудов.
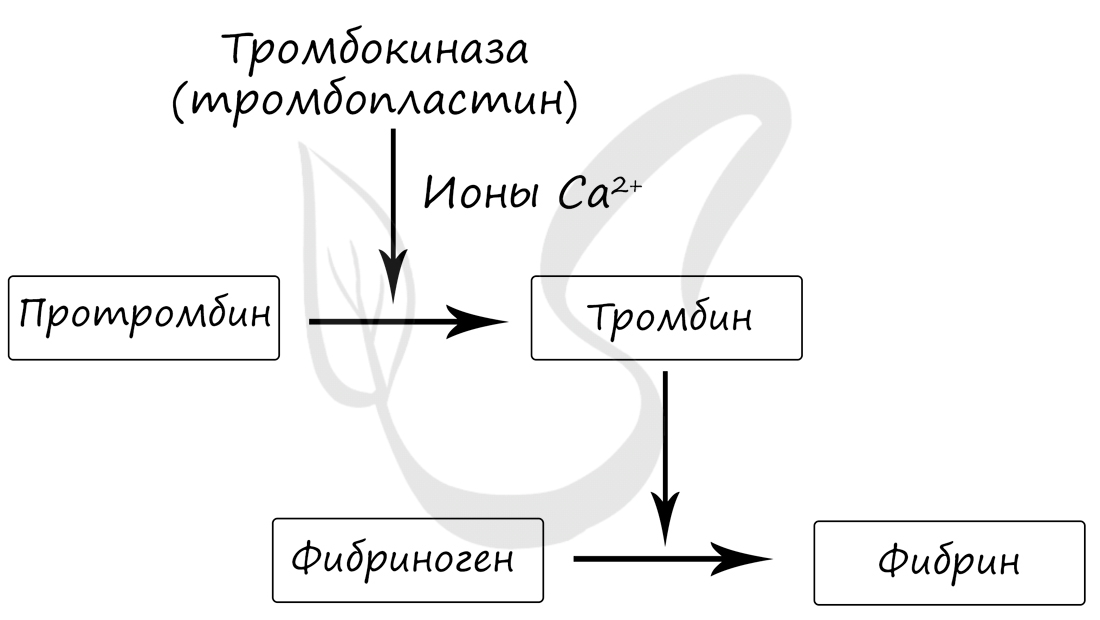
Гемостаз зависит от множества факторов, среди которых важное место отводится ионам Ca2+. Гемостаз происходит
следующим образом: при повреждении сосуда из тромбоцитов высвобождаются тромбопластины, которые способствуют переходу протромбина в тромбин. В свою очередь, тромбин способствует переходу растворимого белка крови, фибриногена, в нерастворимый фибрин.
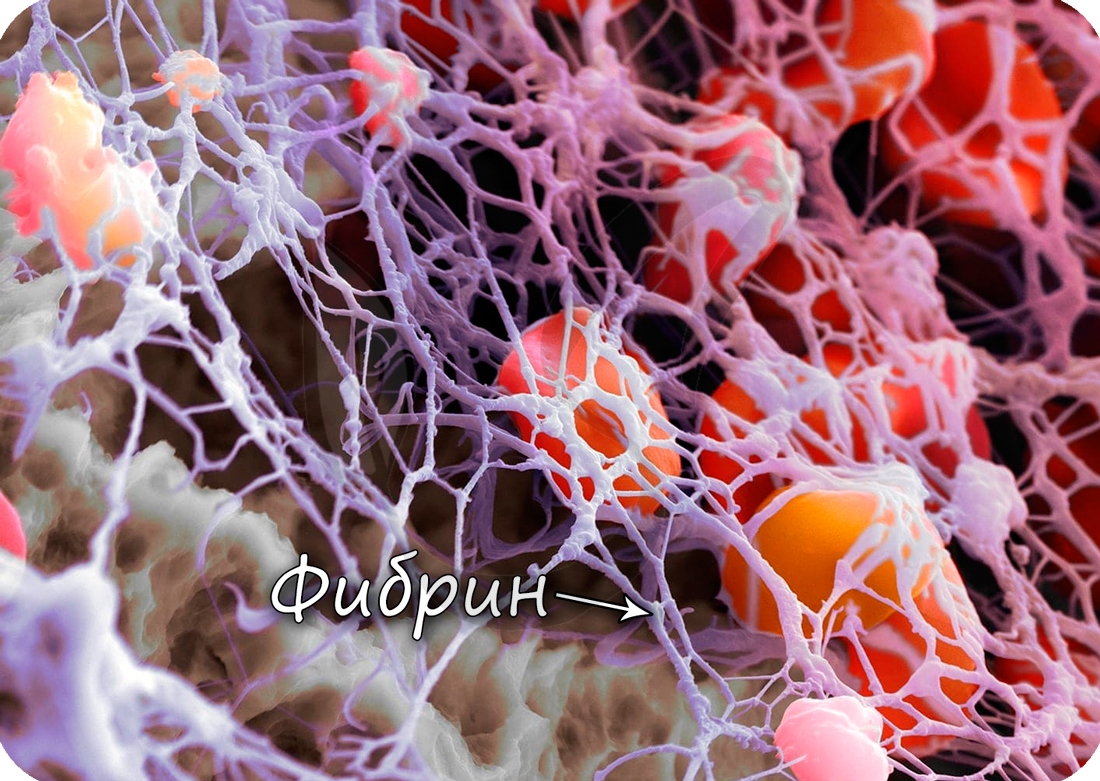
Истинный тромб образуется при переходе растворимого белка крови, фибриногена, в нерастворимый фибрин, нити которого
создают «сетку», где застревают эритроциты. В результате останавливается кровотечение из сосуда.
Группы крови и трансфузия (переливание)
Не могу утаить, что существует более 30 различных систем групп крови. Наиболее широко используемая (в том числе и в
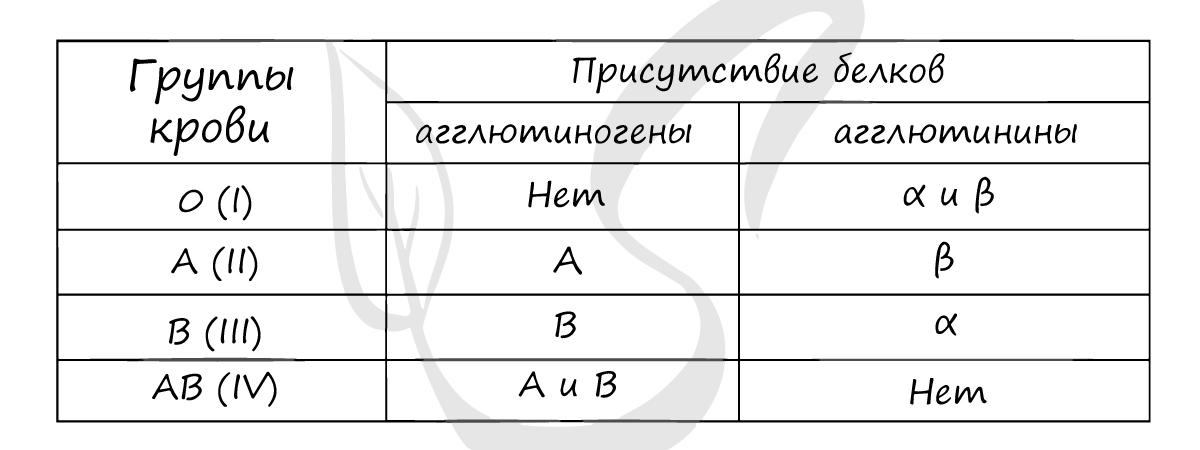
медицине при переливании крови) — система AB0. Она основана на том факте, что на мембране эритроцитов располагаются различные
антигены, определенные генетически. На основании сходства этих антигенов людей делят на 4 группы.
Наибольшее значение в системе AB0 имеют агглютиногены A и B, расположенные на поверхности эритроцитов, и агглютинины α и β.
Если встречаются два одинаковых компонента, к примеру: агглютиноген A и агглютинины α, то начинается реакция агглютинации —
эритроциты начинают склеиваться.
Агглютинацию ни в коем случае нельзя допустить, она может сильно ухудшить состояние пациента
вплоть до летального исхода. При переливании крови строго соблюдается следующее правило: переливается только кровь,
относящаяся к одной и той же группе. Это наилучший вариант, однако, и здесь бывают неудачные переливания, заканчивающиеся
гибелью пациента, ведь ранее я уточнил, что система AB0 является лишь одной из 30 систем групп крови, а учесть их все
не представляется возможным.
Ниже вы найдете схему, где группы крови (по системе AB0) проверяют на совместимость. Реципиентом называют того, кому переливают кровь,
а донором — от кого переливают. Если вы видите сгустки эритроцитов, то это значит, что произошла агглютинация, и переливание крови от донора к реципиенту ни к чему хорошему не приведет.
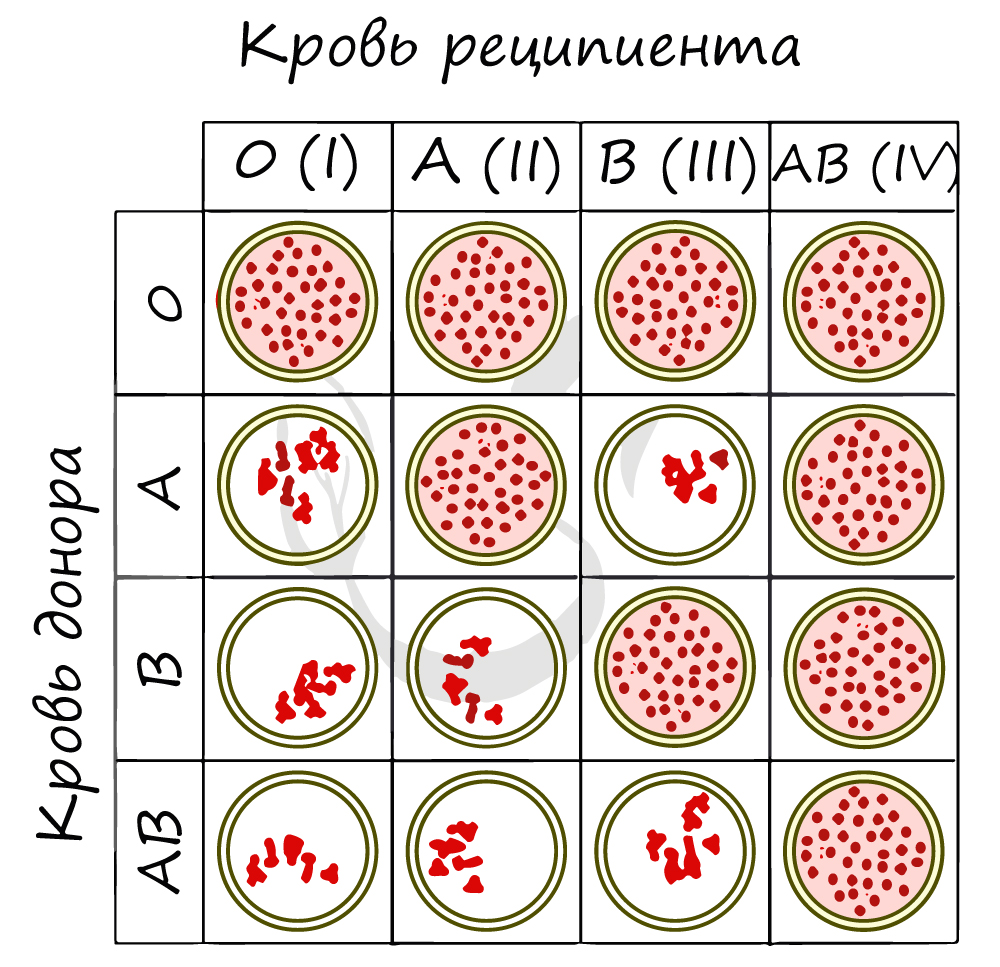
В рамках заданий ЕГЭ (по опыту решений) переливанию подвергаются именно эритроциты, то есть агглютиногены. Для более полного понимания рассмотрим два случая.
1) При переливании крови от донора 0 к реципиенту A (II) агглютинации не происходит (кровь донора не содержит агглютиногенов).
2) При переливании крови от донора A к реципиенту 0 (I) агглютинация происходит (кровь донора содержит агглютиноген A).
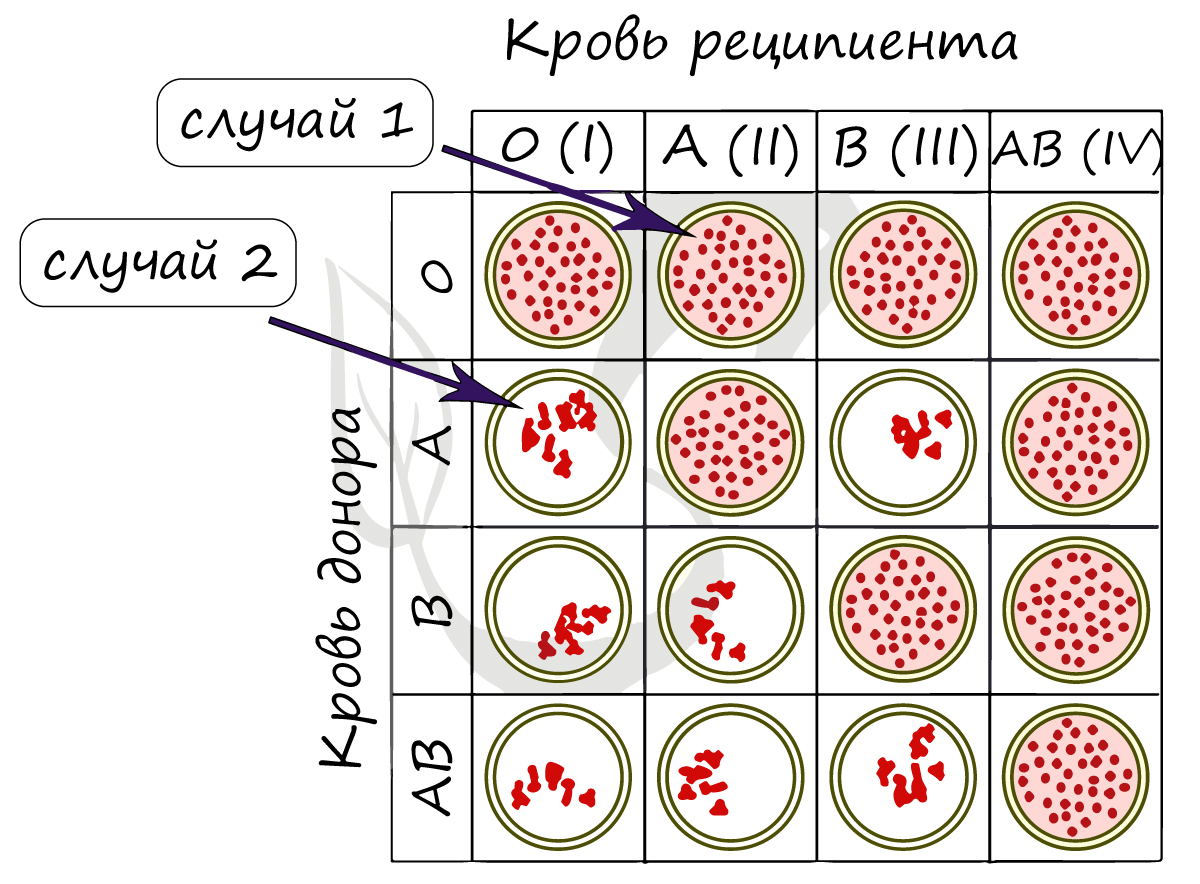
Из-за того, что вместе оказываются агглютинин α и агглютиноген A между эритроцитами начинается агглютинация — они
склеиваются.
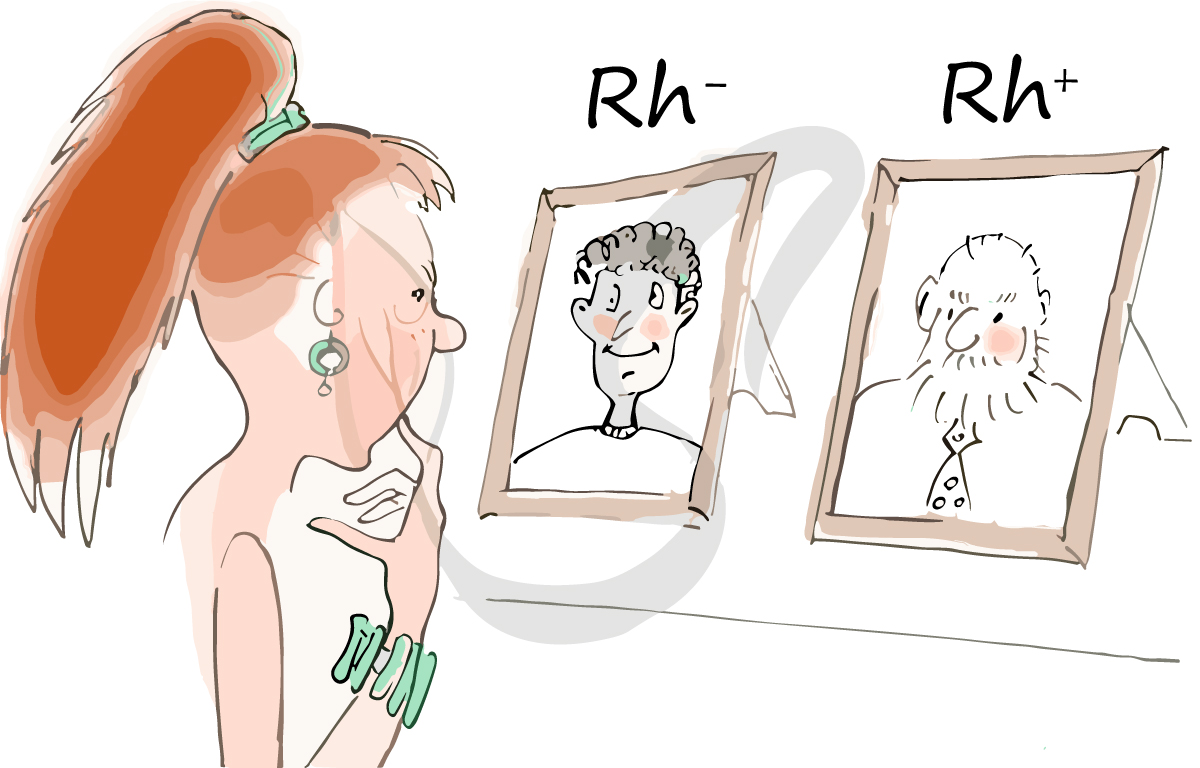
Резус-фактор (Rh-фактор) и резус-конфликт
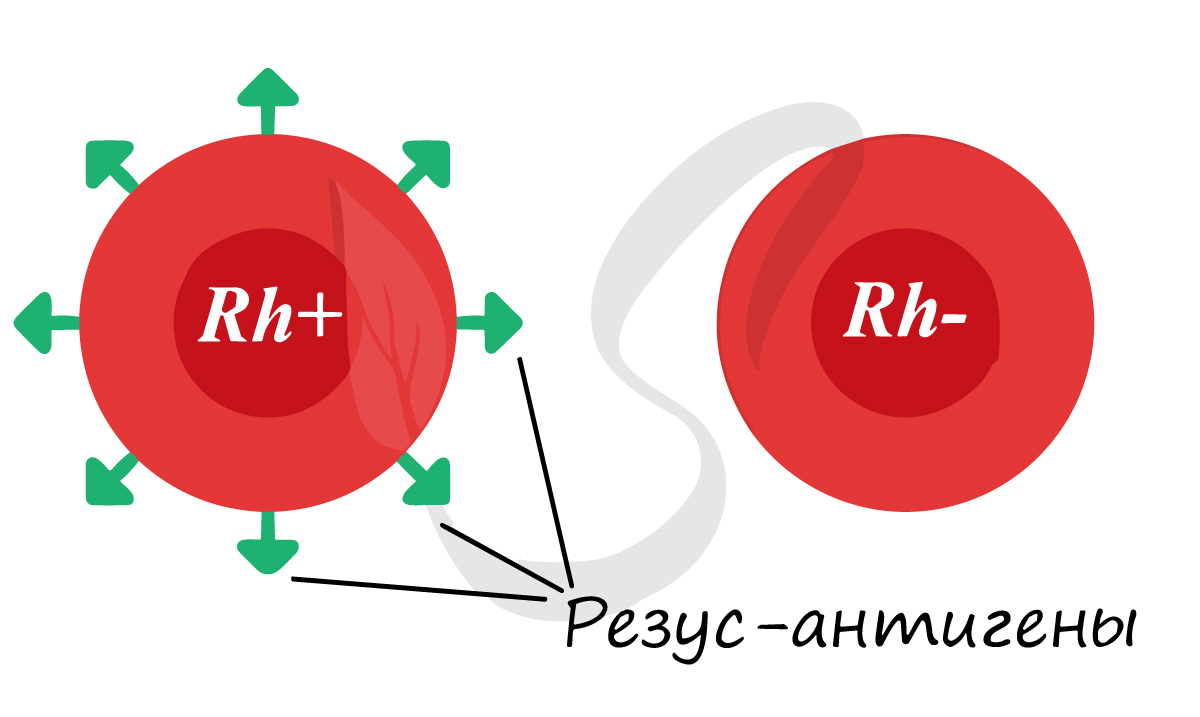
Помимо агглютиногенов системы AB0 на поверхности эритроцитов могут присутствовать резус-антигены. «Могут» — потому что
у большинства людей они есть (85%), а у некоторых резус-антигены отсутствуют (15%). Если данные белки имеются, то
говорят, что у человека положительный резус-фактор, если белки отсутствуют — отрицательный резус-фактор.
Особую важность приобретает резус-фактор у матери и плода. Если женщина резус-отрицательна, а плод
резус-положителен, то при повторной беременности существует риск резус-конфликта: антитела матери начнут атаковать
эритроциты плода, которые разрушатся и плод погибент от гипоксии (нехватки кислорода).
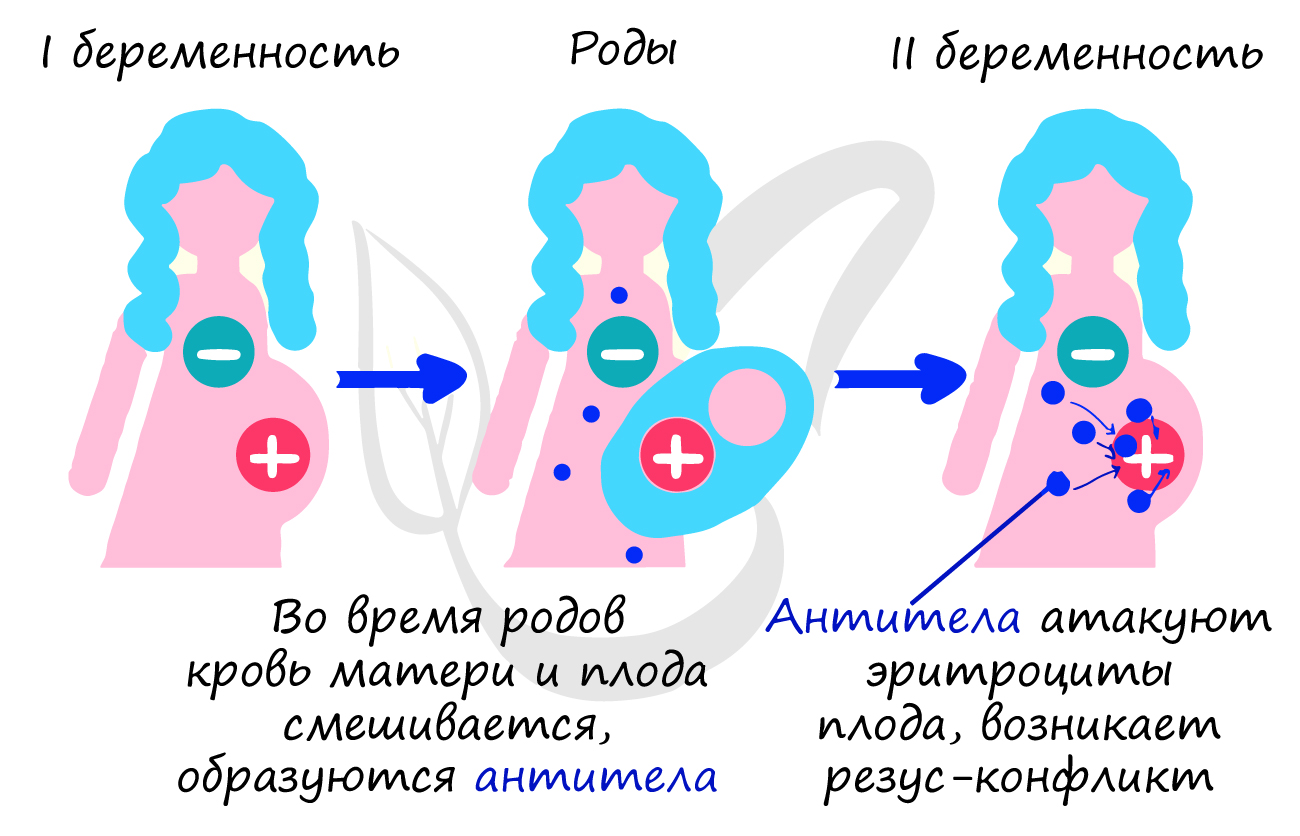
Заметьте — при первой беременности нет угрозы резус-конфликта. Если женщина резус-положительна, то никакого резус-конфликта
не может быть априори, независимо от того резус-положительный или резус-отрицательный плод.
Опасность резус-конфликта вовсе не значит, что вы должны выбирать свою половинку руководствуясь наличием или отсутствием
резус-антигенов)) Они не должны вам препятствовать!) Доложу вам, что на сегодняшней день арсенал лекарственных препаратов
помогает устранить резус-конфликт и успешно рожать женщине во 2, 3, и т.д. раз. Главное, чтобы беременность протекала под наблюдением врача с самого раннего срока.
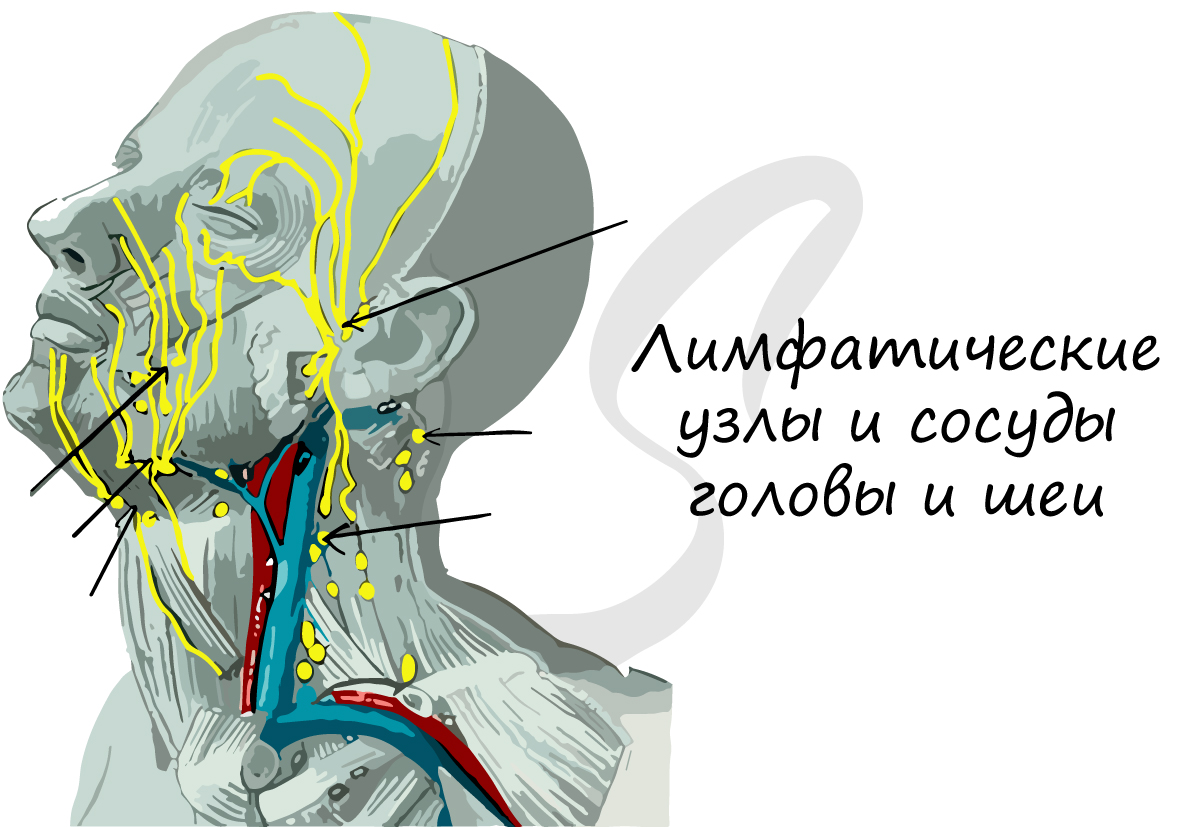
Лимфа, лимфатическая система
Лимфа, как и кровь, образует внутреннюю среду организма. В самом начале статьи была схема, на которой видно, как кровь,
тканевая жидкость и лимфа соотносятся друг с другом. В норме избыток жидкости выводится из тканей по лимфатическим сосудам.
Состав лимфы близок к плазме крови: в лимфе можно обнаружить антитела, фибриноген и ферменты. Лимфатические сосуды
впадают в лимфатические узлы, которые М.Р. Сапин, выдающийся анатом, называл «сторожевые посты». Здесь появляются
лимфоциты — важнейшее звено иммунитета, и происходит фагоцитоз бактерий.
Подытоживая полученные знания, давайте соберем вместе функции лимфатической системы:
- Защитная — в лимфатических узлах образуются лимфоциты, происходит фагоцитоз бактерий
- Транспортная — в лимфатические сосуды кишечника всасываются жиры
- Возврат белка в кровь из тканевой жидкости
- Перераспределение жидкости в организме
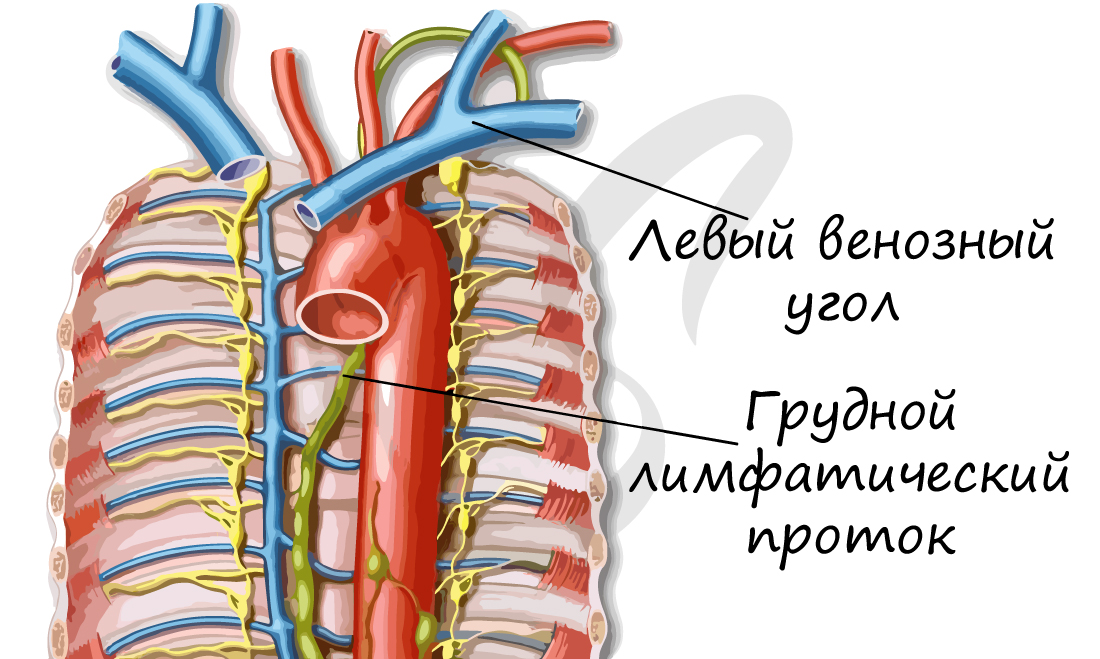
Куда же течет вся лимфа с жирами, лимфоцитами и белками? В конечном итоге лимфатическая система соединяется с кровеносной,
впадая в нее в области левого и правого венозных углов. Таким образом, лимфатическая и кровеносная системы теснейшим образом
связаны друг с другом.
Виды иммунитета
Мы уже отчасти касались темы иммунитета в нашей статье и отмечали особый вклад И.И. Мечникова в создании фагоцитарной теории
иммунитета.
Иммунитет — способ защиты организма и поддержания гомеостаза внутренней среды, предупреждающий размножение
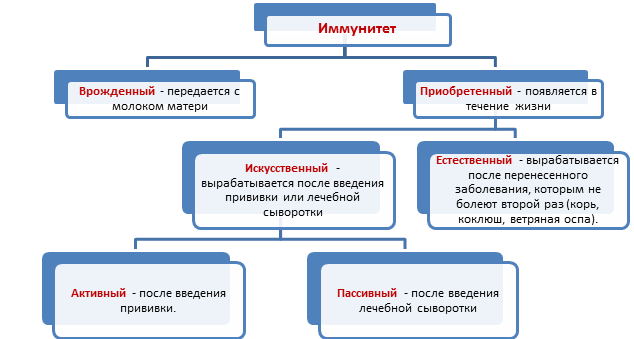
в организме инфекционных агентов. Выделяют естественный и искусственный иммунитет.
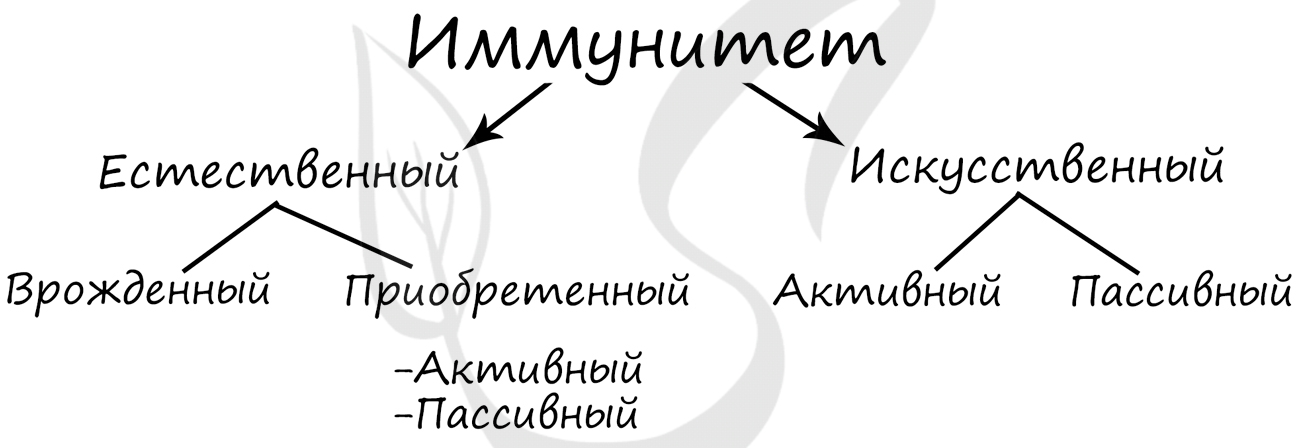
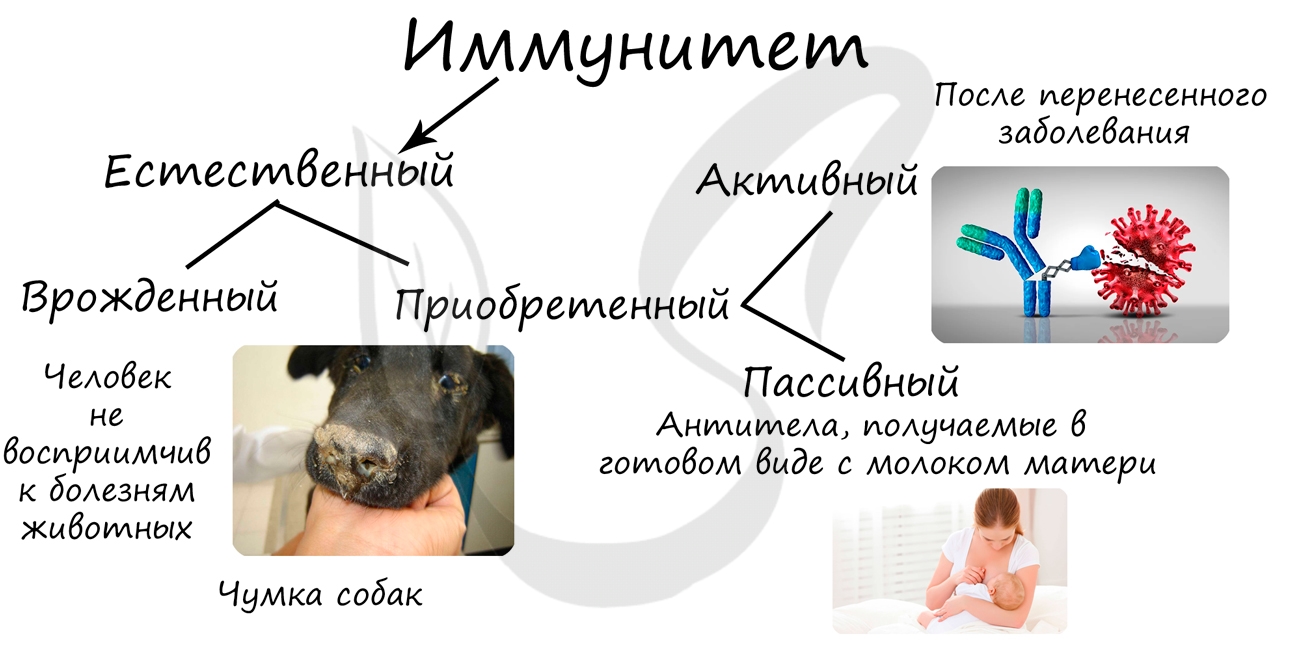
Естественный иммунитет включает в себя врожденный (видовой) и приобретенный (индивидуальный).
Врожденный иммунитет заключается в невосприимчивости человека к болезням животных: человек не может заболеть многими
болезнями собак, и, наоборот, собаки невосприимчивы ко многим заболеваниям человека.
Приобретенный (индивидуальный) иммунитет бывает активный и пассивный.
- Активный
- Пассивный
Вырабатывается человеком в ответ на внедрение инфекционного агента через 10-12 дней (образование антител)
Состоит в переходе материнских антител в кровь плода, также антитела поступают вместе
с грудным молоком. Пассивным этот вид иммунитета называется потому, что сам организм антитела не вырабатывает, а использует уже готовые.
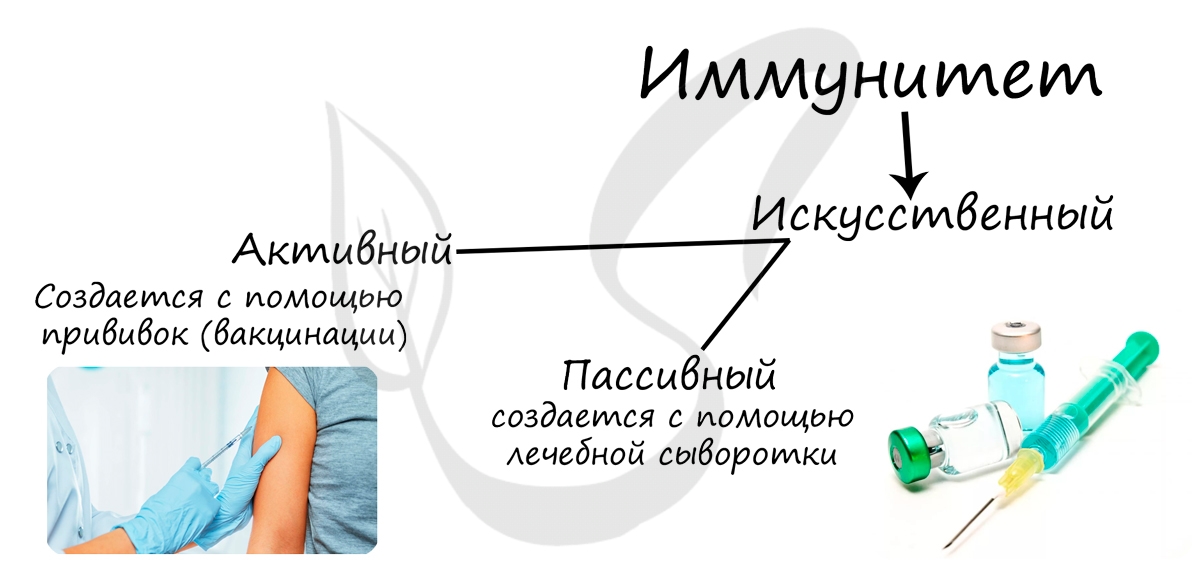
Искусственный иммунитет делится на активный и пассивный.
Активный искусственный создается с помощью прививок — вакцинации. При вакцинации в организм здорового человека вводят разрушенные или ослабленные инфекционные агенты (вакцину), с которыми лейкоциты легко справляются, в результате чего вырабатываются антитела. Это напоминает тренировку перед матчем: когда настоящий вирус/бактерия попадут
в организм, лейкоцитам будет все о них известно, и они быстро выработают антитела, за счет чего заболевание пройдет либо в легкой,
либо в бессимптомной форме.
Пассивный искусственный иммунитет подразумевает применение лечебной сыворотки, которая содержит готовые антитела к возбудителю
заболевания. Часто сыворотки применяются в экстренных случаях, когда заболевание протекает тяжело и медлить нельзя. Существует
противоботулиническая сыворотка (применятся при тяжелейшем заболевании — ботулизме), антирабическая сыворотка (против вируса
бешенства).
Лечебные сыворотки получают из крови животных, зараженных определенным вирусом или бактерией. Получение сыворотки заключается
в выделении из крови готовых антител к данному возбудителю. Применяются сыворотки не только в лечебных, но и в профилактических
целях.
Позвольте добавить краткую и важную историческую сводку. Первая прививка была сделана Эдвардом Дженнером в 1796 году. Он заметил, что
доярки, переболевшие коровьей оспой, невосприимчивы к натуральной. Получив согласие родителей ребенка, Дженнер заразил ребенка (!) коровьей оспой, тот перенес ее и через две недели был невосприимчив к натуральной оспе. Так Эдвард Дженнер начал эпоху вакцинации.

Луи Пастер также внес огромнейший вклад, создав и сделав первую прививку от бешенства в 1885 году. Мать привезла к нему в Париж сына,
которого покусала бешеная собака. Было очевидно, что без вмешательства мальчик умрет. Пастер взял на себя огромную ответственность (к слову,
не имея врачебной лицензии) и 14 дней вводил мальчику изобретенную вакцину. Мальчик вылечился, симптомы бешенства не развились. Примечательно,
что всю взрослую жизнь спасенный юноша посвятил Пастеру, работая сторожем в Пастеровском музее.

Заболевания
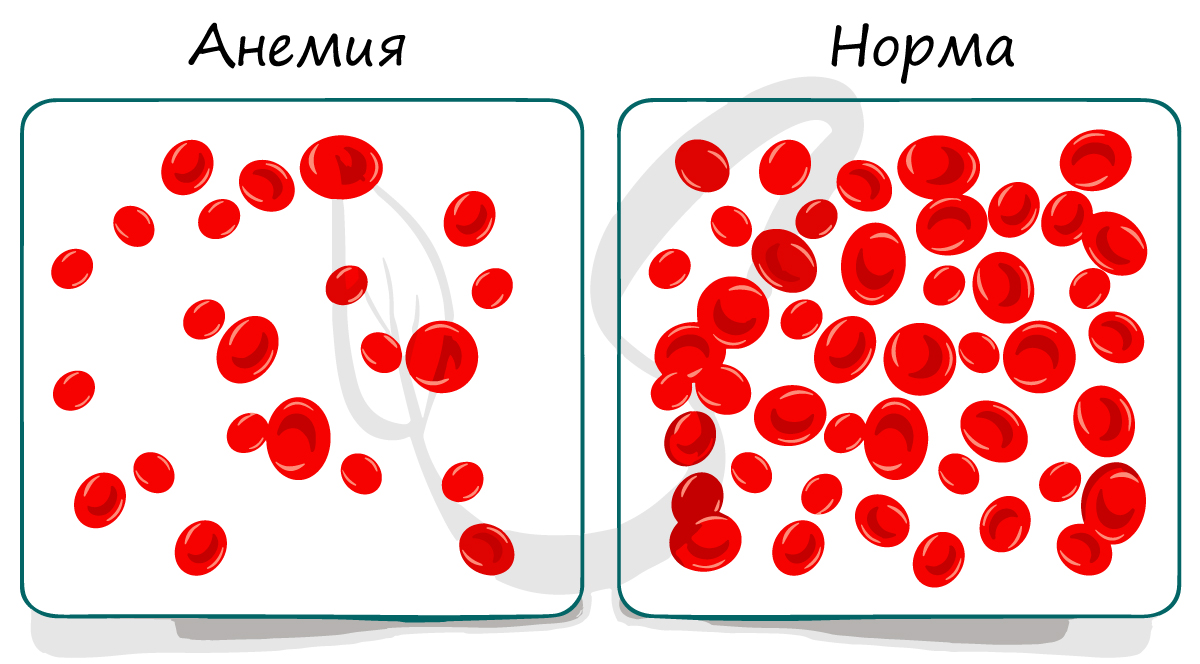
Анемия (от др.-греч. ἀν- — приставка со значением отрицания и αἷμα «кровь»), или малокровие — снижение концентрации гемоглобина в крови,
очень часто с одновременным уменьшением количества эритроцитов. Вам уже известна основная функция эритроцитов, и вы легко сможете догадаться,
что при анемии кислорода к тканям поступает меньше должного уровня — отсюда и развиваются симптомы анемии.
Пациенты могут жаловаться на непривычную одышку (учащение дыхания) при незначительных физических нагрузках, общую слабость, быструю утомляемость,
головную боль, сердцебиение, шум в ушах. При анализе крови анемию выявить легко, гораздо сложнее выявить причину, из-за которой анемия возникла.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
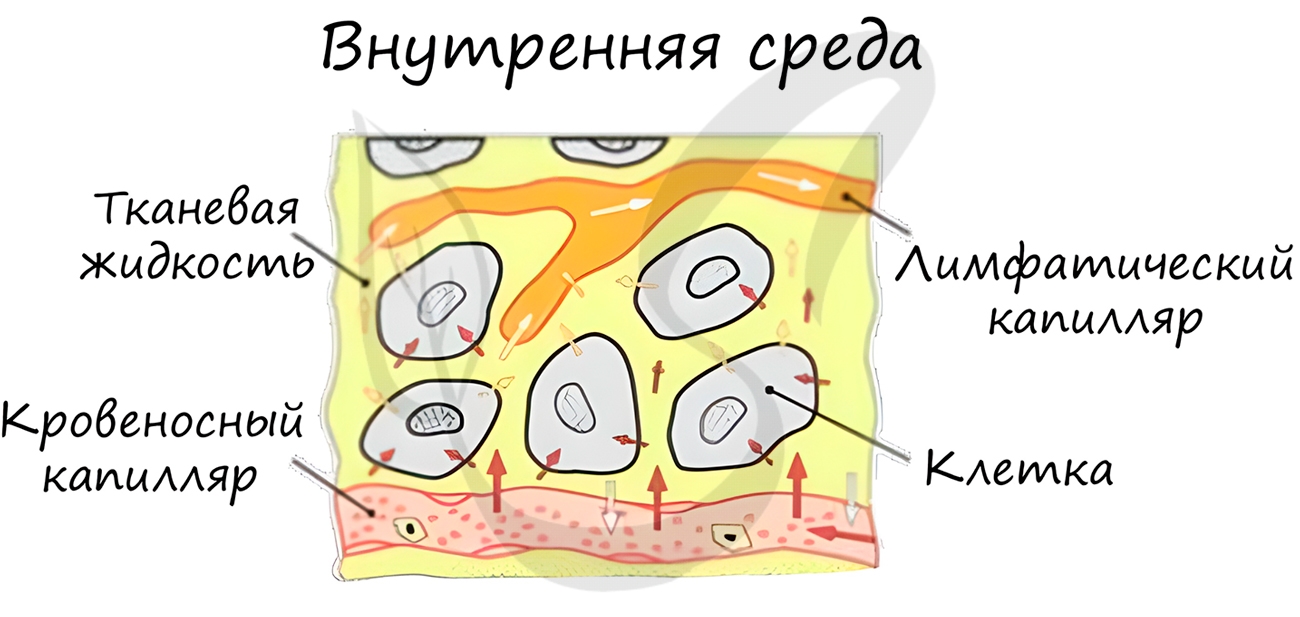
Внутренняя среда организма (кровь, лимфа, тканевая жидкость)
У высших животных и человека внутренняя среда организма образована кровью, тканевой жидкостью и лимфой. Она характеризуется относительным постоянством состава, физических и химических свойств, т.е. гомеостазом. Поддержание гомеостаза — результат нервно-гуморальной регуляции.
Рисунок 1. Внутренняя среда организма
Кровь
Кровь — жидкая подвижная соединительная ткань внутренней среды организма, которая состоит из жидкой среды — плазмы и взвешенных в ней клеток — форменных элементов: клеток лейкоцитов, постклеточных структур (эритроцитов) и тромбоцитов (кровяные пластинки). У позвоночных кровь имеет красный цвет (от бледно- до тёмно-красного). Сами эритроциты жёлто-зелёные и лишь в совокупности образуют красный цвет, в связи с наличием в них гемоглобина. У некоторых моллюсков и членистоногих кровь имеет голубой цвет за счёт наличия гемоцианина. У человека кровь образуется из кроветворных стволовых клеток, количество которых составляет около 30000, в основном в костном мозге.
Функции крови:
Кровь выполняет следующие функции.
-
Транспортная функция — заключается в транспорте кровью различных веществ (энергии и информации, в них заключенных) и тепла в пределах организма.
-
Дыхательная функция — кровь переносит дыхательные газы — кислород (О2) и углекислый газ (СО2) — как в физически растворенном, так и в химически связанном виде. Кислород доставляется от легких к потребляющим его клеткам органов и тканей, а углекислый газ — наоборот, от клеток к легким.
-
Питательная функция — кровь переносит также питательные вещества от органов, где они всасываются или депонируются к месту их потребления.
-
Выделительная (экскреторная) функция — при биологическом окислении питательных веществ, в клетках образуются, кроме СО2, другие конечные продукты обмена (мочевина, мочевая кислота), которые транспортируются кровью к выделительным органам: почкам, легким, потовым железам, кишечнику. Кровью осуществляются также транспорт гормонов, других сигнальных молекул и биологически активных веществ.
-
Терморегулирующая функция — благодаря своей высокой теплоемкости кровь обеспечивает перенос тепла и его перераспределение в организме. Кровью переносится около 70% тепла, образующегося во внутренних органах в кожу и легкие, что обеспечивает рассеяние ими тепла в окружающую среду.
-
Гомеостатическая функция — кровь участвует в водно-солевом обмене в организме и обеспечивает поддержание постоянства его внутренней среды — гомеостаза.
-
Защитная функция заключается, прежде всего, в обеспечении иммунных реакций, а также создании кровяных и тканевых барьеров против чужеродных веществ, микроорганизмов, дефектных клеток собственного организма. Вторым проявлением защитной функции крови является ее участие в поддержании своего жидкого агрегатного состояния (текучести), а также остановке кровотечения при повреждении стенок сосудов и восстановлении их проходимости после репарации дефектов.
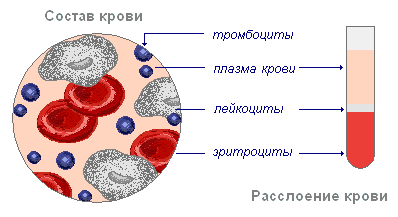
Состав крови
Весь объём крови живого организма условно делится на периферический (находящийся и циркулирующий в русле сосудов) и кровь, находящуюся в кроветворных органах и периферических тканях. Кровь состоит из двух основных компонентов: плазмы и взвешенных в ней форменных элементов. Отстоявшаяся кровь состоит из трёх слоёв: верхний слой образован желтоватой плазмой крови, средний, сравнительно тонкий серый слой составляют лейкоциты, нижний красный слой образуют эритроциты.
Рисунок 2. Состав крови
Плазма
Плазма крови — жидкая часть крови, которая содержит воду и взвешенные в ней вещества — белки и другие соединения. Основными белками плазмы являются альбумины, глобулины и фибриноген. Около 90 % плазмы составляет вода. Неорганические вещества составляют около 2-3 %; это катионы (Na+, K+, Mg2+, Ca2+) и анионы (HCO3—, Cl—, PO43-, SO42-). Органические вещества (около 9 %) в составе крови подразделяются на азотсодержащие (белки, аминокислоты, мочевина, креатинин, аммиак, продукты обмена пуриновых и пиримидиновых нуклеотидов) и безазотистые (глюкоза, жирные кислоты, пируват, лактат, фосфолипиды, холестерин). Также в плазме крови содержатся газы (кислород, углекислый газ) и биологически активные вещества (гормоны, витамины, ферменты, медиаторы).
Форменные элементы
У взрослого человека форменные элементы крови составляют около 40—50 %, а плазма — 50—60 %. Форменные элементы крови представлены эритроцитами, тромбоцитами и лейкоцитами:
-
Эритроциты (красные кровяные тельца) — самые многочисленные из форменных элементов. Зрелые эритроциты не содержат ядра и имеют форму двояковогнутых дисков. Циркулируют 120 дней и разрушаются в печени и селезёнке. В эритроцитах содержится железосодержащий белок — гемоглобин. Он обеспечивает главную функцию эритроцитов — транспорт газов, в первую очередь — кислорода. Именно гемоглобин придаёт крови красную окраску. В лёгких гемоглобин связывает кислород, превращаясь в оксигемоглобин, который имеет светло-красный цвет. В тканях оксигемоглобин высвобождает кислород, снова образуя гемоглобин, и кровь темнеет. Кроме кислорода, гемоглобин в форме карбогемоглобина переносит из тканей в лёгкие углекислый газ.
-
Тромбоциты (кровяные пластинки) представляют собой ограниченные клеточной мембраной фрагменты цитоплазмы гигантских клеток костного мозга (мегакариоцитов). Совместно с белками плазмы крови (например, фибриногеном) они обеспечивают свёртывание крови, вытекающей из повреждённого сосуда, приводя к остановке кровотечения и тем самым защищая организм от кровопотери.
-
Лейкоциты (белые клетки крови) являются частью иммунной системы организма. Они способны к выходу за пределы кровяного русла в ткани. Главная функция лейкоцитов — защита от чужеродных тел и соединений. Они участвуют в иммунных реакциях, выделяя при этом Т-клетки, распознающие вирусы и всевозможные вредные вещества; В-клетки, вырабатывающие антитела, макрофаги, которые уничтожают эти вещества. В норме лейкоцитов в крови намного меньше, чем других форменных элементов.
Кровь относится к быстро обновляющимся тканям.
Физиологическая регенерация форменных элементов крови осуществляется за счёт разрушения старых клеток и образования новых органами кроветворения. Главным из них у человека и других млекопитающих является костный мозг. У человека красный, или кроветворный, костный мозг расположен в основном в тазовых костях и в длинных трубчатых костях. Основным фильтром крови является селезёнка (красная пульпа), осуществляющая, в том числе и иммунологический её контроль (белая пульпа).
Тканевая жидкость
Тканевая жидкость – это часть внутренней среды организма, которая заполняет все пространство между клетками. К таким видам специалисты относят жидкость плевральной полости, сердечной сумки, спинномозговую жидкость и др.
Образование тканевой жидкости происходит из плазмы крови, проникающей в интерстициальное пространство через стенки капилляров, при этом одна ее часть возвращается назад, а другая часть остается между клетками тканей. Частично тканевая жидкость скапливается в лимфатических капиллярах, оттуда направляется в лимфатические сосуды, образуя лимфу, и проходя через лимфоузлы, снова попадает в кровоток.
В норме из-за своего постоянного перемещения тканевая жидкость не накапливается вокруг клеток. Если же по какой-то причине жидкость перестает возвращаться в кровь, возникают отеки.
Состав тканевой жидкости
Тканевая жидкость очень мало содержит белковых компонентов (1,5 г на 100 мл), и по своему химическому составу сильно напоминает плазму, хотя отличается количеством электролитов, ферментов и метаболитов.
Состав тканевой жидкости определяется спецификой определенных органов, соответствует их особенностям, но главным образом она состоит из воды, растворенных питательных веществ (сахаров, солей, аминокислот, ферментов и прочих), кислорода, углекислого газа и продуктов жизнедеятельности клеток.
Функции тканевой жидкости
Тканевая жидкость является своеобразным посредником между кровеносными сосудами и клетками организма. Обмен веществ, который постоянно совершают клетки, поглощая кислород и питательные вещества и отдавая углекислый газ и другие продукты жизнедеятельности, может быть реализован при условии растворенного состояния клеточной мембраны.
Эту ответственную роль выполняет тканевая жидкость, которая окружает клетки и омывает их. При этом клетки из тканевой жидкости получают все необходимое питание и кислород, а ей возвращают отработанные вещества. Из тканевой жидкости все продукты клеточного обмена дальше проникают в кровеносное русло.
Лимфа, ее состав и свойства. Образования и движение лимфы.
Лимфой называется жидкость, содержащаяся у позвоночных животных и человека в лимфатических капиллярах и сосудах. Лимфатическая система начинается лимфатическими капиллярами, которые дренируют все тканевые межклеточные пространства. Движение лимфы осуществляется в одну сторону- по направлению к большим венам. На этом пути мелкие капилляры сливаются в крупные лимфатические сосуды, которые постепенно, увеличиваясь в размерах, образуют правый лимфатический и грудной протоки. В кровяное русло через грудной проток оттекает не вся лимфа, так как некоторые лимфатические стволы (правый лимфатический проток, яремный, подключичный и бронхомедиастинальный) самостоятельно впадают в вены.
По ходу лимфатических сосудов расположены лимфатические узлы, после прохождения которых лимфа снова собирается в лимфатические сосуды несколько больших размеров.
Функции лимфы
Основные функции лимфатической системы весьма разнообразны и в основном состоят в:
— возвращении белка в кровь из тканевых пространств;
— в участии в перераспределении жидкости в теле;
— в защитных реакциях как путем удаления и уничтожения различных бактерий, так и участием в иммунных реакциях;
— в участии в транспорте питательных веществ, особенно жиров.
Иммунитет
Иммунитет – сопротивляемость, невосприимчивость организма к генетически чужеродным белкам, организмам, ядовитым веществам.
Схема 1. Виды иммунитета
При введении вакцины в организм человека попадает ослабленный (или погибший) возбудитель или даже его компоненты. При этом развивается типичный иммунный ответ, формируются антитела. Заболевание при этом либо не развивается вовсе, либо проходит в неяркой форме, так как возбудитель не достаточно силен, чтобы вызвать типичные признаки болезни. Однако информация о контакте с возбудителем сохраняется, и при последующих контактах сразу же выделяются антитела, и человек не заболевает. Вакцинация предохраняет человека от многих инфекционных заболеваний. Первую вакцину получил Э. Дженер в конце 18 века.
При введении сыворотки в организм попадают готовые антитела, которые помогают организму бороться с заболеванием. Ее вводят человеку, который уже болеет, с целью лечения, а не профилактики.
Помимо антител в защите организма от инфекций большую роль играют белые клетки крови – лейкоциты. Эти клетки способны мигрировать по организму в поисках болезнетворных агентов, находить их и элиминировать из организма. Впервые способность лейкоцитов к фагоцитозу отметил И.И. Мечников, это позволило ему создать клеточную теорию иммунитета.
Органы иммунной системы
Выделяют центральные и периферические органы иммунной системы. К центральным органам относят красный костный мозг и тимус, а к периферическим — селезёнку, лимфатические узлы, а также местноассоциированную лимфоидную ткань.
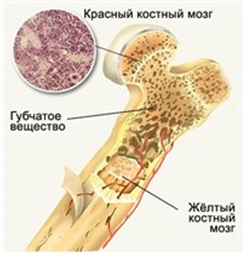
Красный костный мозг — центральный орган кроветворения и иммуногенеза. Содержит самоподдерживающуюся популяцию стволовых клеток. Красный костный мозг находится в ячейках губчатого вещества плоских костей и в эпифизах трубчатых костей. Здесь происходит дифференцировка В-лимфоцитов из предшественников. Содержит также Т-лимфоциты.
Рисунок 3. Костный мозг
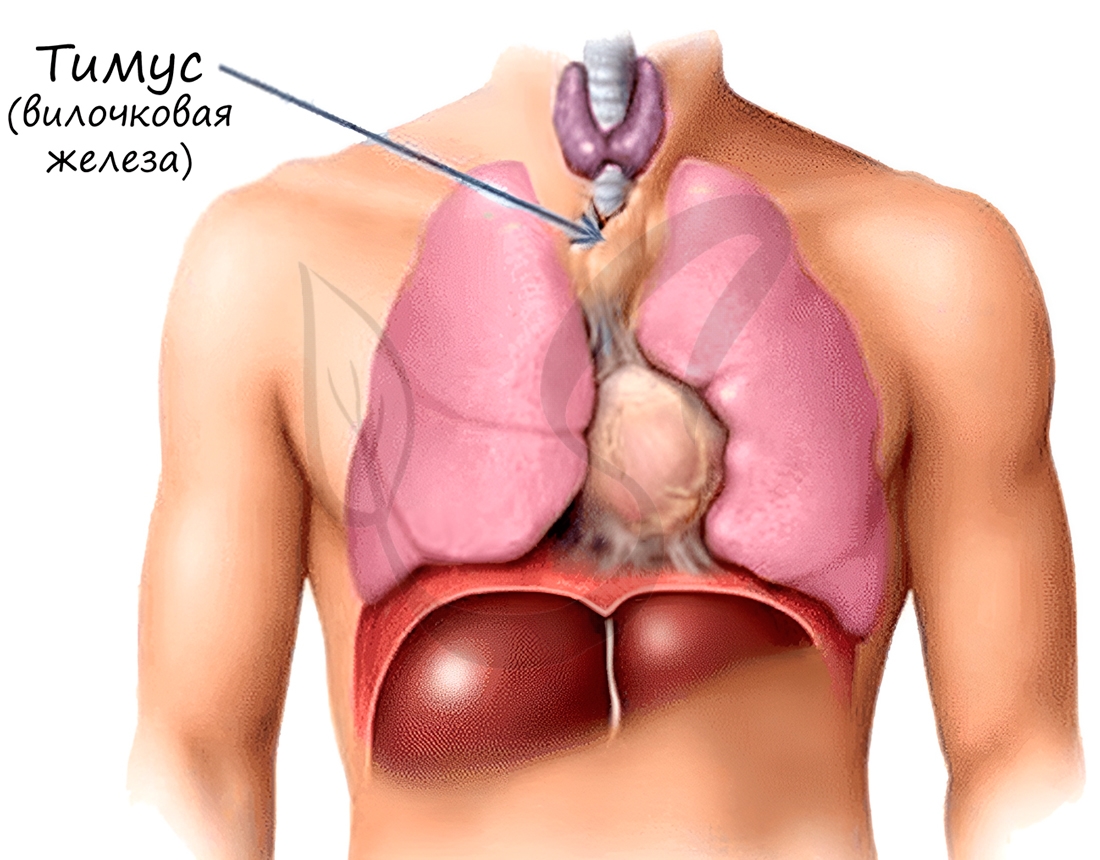
Тимус — центральный орган иммунной системы. В нём происходит дифференцировка Т-лимфоцитов из предшественников, поступающих из красного костного мозга.
Рисунок 4. Расположение тимуса
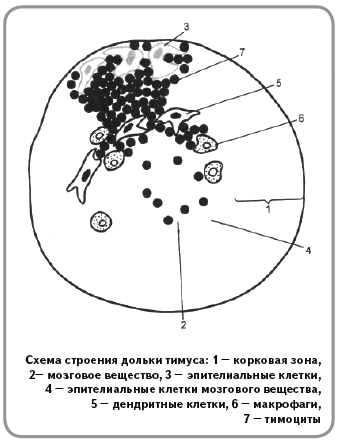
Лимфатические узлы — периферические органы иммунной системы. Они располагаются по ходу лимфатических сосудов. В каждом узле выделяют корковое и мозговое вещество. В корковом веществе есть В-зависимые зоны и Т-зависимые зоны. В мозговом есть только Т-зависимые зоны.
Рисунок 5. Расположение лимфатических узлов
Селезёнка — паренхиматозный зональный орган. Является самым крупным органом иммунной системы, кроме того, выполняет депонирующую функцию по отношению к крови.
Рисунок 6. Расположение селезёнки
Функции селезёнки:
-
Лимфопоэз — главный источник образования циркулирующих лимфоцитов; действует как фильтр для бактерий, простейших и инородных частиц, а также продуцирует антитела (иммунная и кроветворная функции).
-
Разрушение старых и повреждённых эритроцитов и тромбоцитов, остатки которых затем направляются в печень. Таким образом, селезенка через разрушение эритроцитов участвует в образовании желчи (фильтрационная функция, участие в обмене веществ, в том числе в обмене железа).
-
Депонирование крови, накопление тромбоцитов (1/3 всех тромбоцитов в организме).
-
На ранних стадиях развития плода селезёнка служит одним из органов кроветворения.
Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Фагоциты человека способны
1) захватывать чужеродные тела
2) вырабатывать гемоглобин
3) участвовать в свёртывании крови
4) вырабатывать антитела
2
Первый барьер на пути микробов в организме человека создают
1) волосяной покров и железы
2) кожа и слизистые оболочки
4) эритроциты и тромбоциты
3
Что происходит в организме человека после предохранительной прививки?
1) вырабатываются ферменты
2) кровь свертывается, образуется тромб
4) нарушается постоянство внутренней среды
4
Какой вирус нарушает работу иммунной системы человека:
5
Невосприимчивость организма к воздействию возбудителя заболевания обеспечивается:
Раздел: Человек
Пройти тестирование по этим заданиям
к.м.н. Гольдинберг Б. М., Васюк Я.В.
Городской центр трансфузиологии учреждения здравоохранения «6-я городская клиническая больница», г. Минск,
учреждение здравоохранения «7-я городская детская поликлиника», г. Минск
ИММУНННАЯ СИСТЕМА ЧЕЛОВЕКА

Введение
Группа органов, имеющих общее происхождение, единый план строения и выполняющая общую функцию называется системой органов. Пять из всех десяти систем органов являются регулирующими (управляющими): нервная, кровеносная, эндокринная, лимфатическая и иммунная. Уточним, что лимфатические органы и лимфатических узлы, которых насчитывается около 600, функционально является частью иммунной системы, а к собственно лимфатической системе относится обширная сеть сосудов, которая проходит почти через все наши ткани, обеспечивая движение жидкости, называемой лимфой.
Слово «иммунитет» происходит от латинского «immunis» (на английском – immunity), что означает «чистый от чего-либо», невосприимчивый к чему-либо. Иммунная система появилась вместе с многоклеточными организмами и развивалась, как помощница их выживанию. Она объединяет органы и ткани, которые гарантируют защиту организма от генетически чужеродных клеток и веществ, поступающих из окружающей среды.
Иммунная система представлена тремя уровнями: органным, клеточным и молекулярным.
Органы иммунной системы человека
Иммунная система включает центральные и периферические органы.
Центральные органы иммунной системы представляют собой красный костный мозг и тимус.
Костный мозг является хранилищем стволовых клеток, из которых образуются клетки крови (рис.1). В зависимости от ситуации, стволовые клетки трансформируются в иммунные В-лимфоциты. При необходимости, определенная часть B-лимфоцитов превращается в плазматические клетки, которые способны вырабатывать антитела.
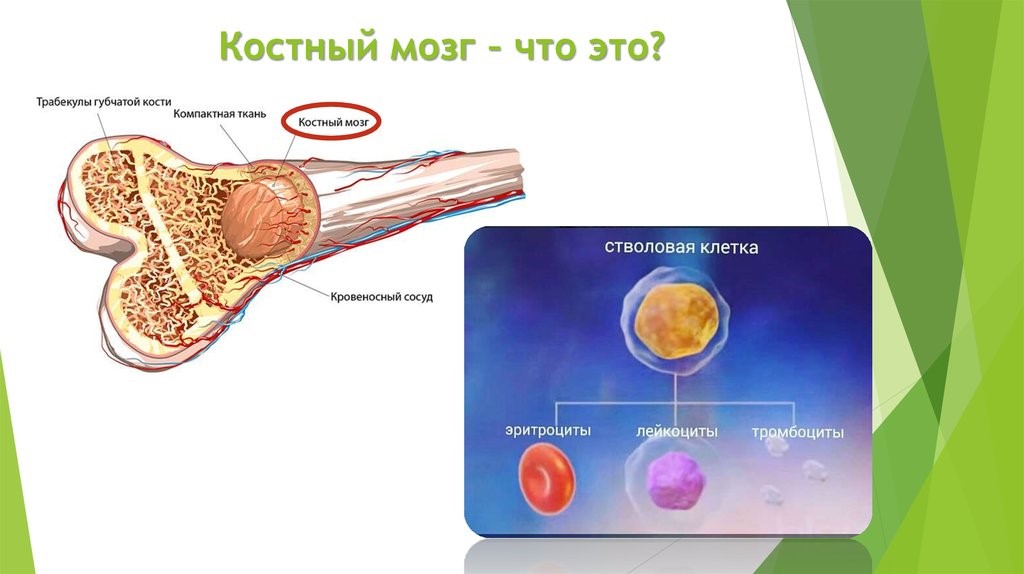
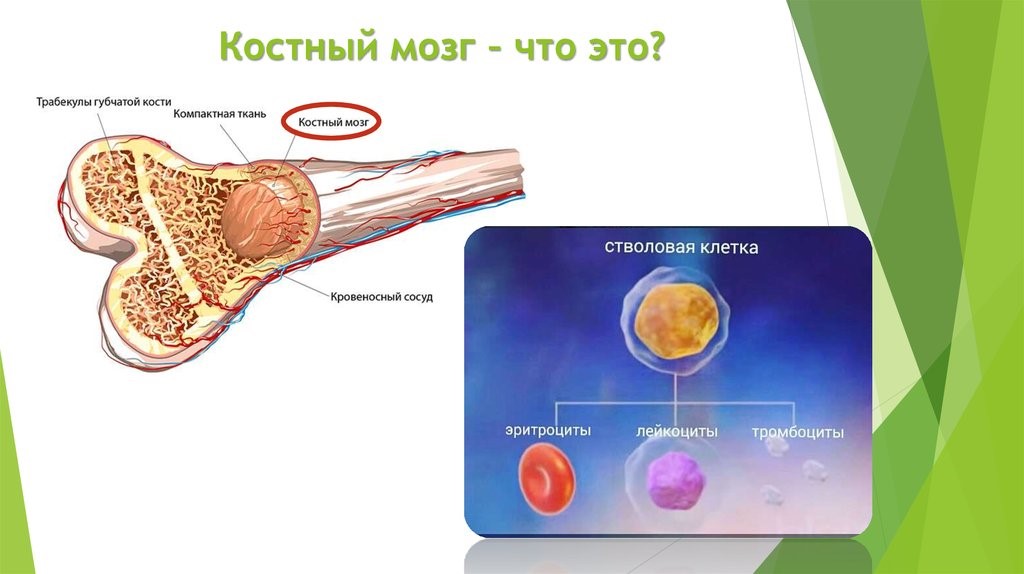
Рис.1. Костный мозг содержит стволовые клетки
Тимус (или вилочковая железа) – один из главных органов иммунной системы, расположенный у человека за грудиной ниже ключиц, который отвечает за образование Т-клеток иммунной системы в лимфоидных тканях организма (рис.2).
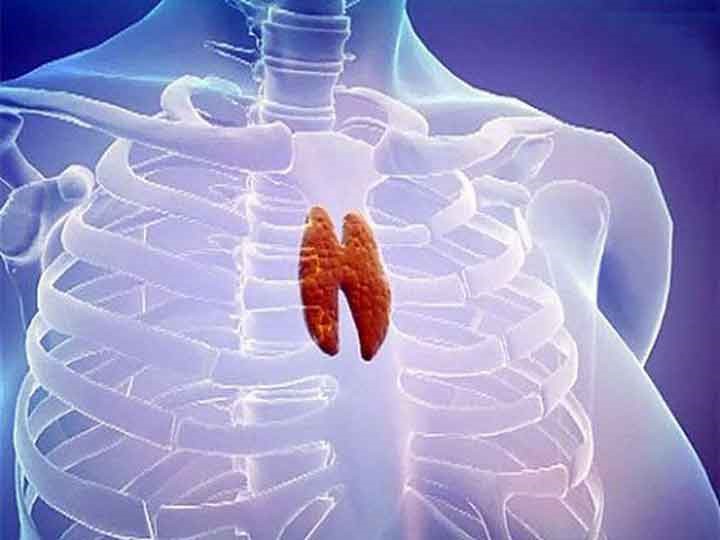
Рис.2. Тимус
К периферическим органам относятся селезенка, миндалины и лимфоузлы, в которых находятся зоны созревания иммунных клеток.
Миндалины, получившие свое название из-за внешней схожести с миндалем, представляют собой скопление лимфоидной ткани в верхней части носоглотки. У человека шесть миндалин: две небные, две грудные и по одной носоглоточной и язычной.
Самыми крупными из них являются небные миндалины, или гланды, которых легко осмотреть самостоятельно в зеркале, если достаточно широко раскрыть рот (рис.3).
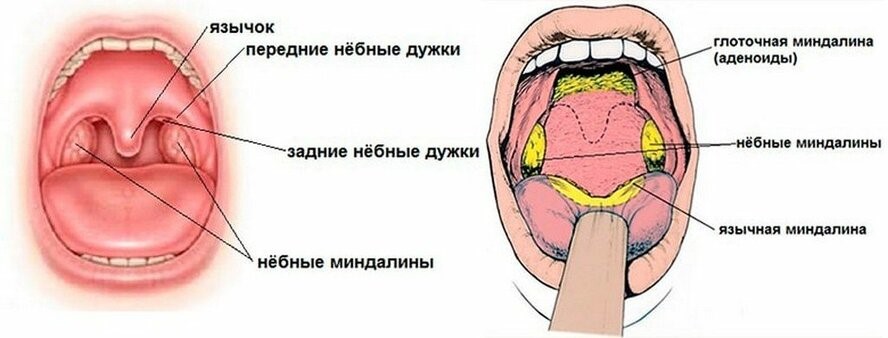
Рис. 3. Небные миндалины
Селезенка является самым крупным лимфоидным органом (рис. 4). Кроме того, она может накапливать некоторое количество крови. В экстренных ситуациях селезенка способна послать свои запасы в общий кровоток. Это позволяет улучшить качество и скорость иммунных реакций организма. Селезенка очищает кровь от бактерий и перерабатывает всевозможные вредные вещества. В ней полностью разрушаются эндотоксины, а также остатки умерших клеток при ожогах, травмах или других повреждениях тканей. У людей, оставшихся по какой-либо причине без селезенки, ухудшается иммунитет.
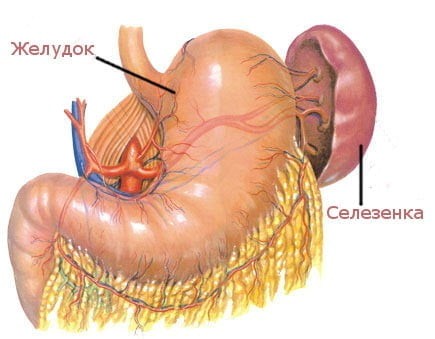
Рис. 4. Селезенка
Лимфатические узлы представляют собой небольшие образования округлой формы (рис. 5), расположенные в грудной полости (бронхолегочные, бронхотрахеальные) и брюшной полости (пейеровы бляшки, аппендикс и другие), окологрудные на поверхности грудной клетки, на шее и на конечностях. Лимфоузел – это один из барьеров на пути инфекций и раковых клеток, играющий роль своеобразной таможни (рис. 5). В нем образуются лимфоциты – специальные клетки, которые принимают активное участие в уничтожении вредных веществ.
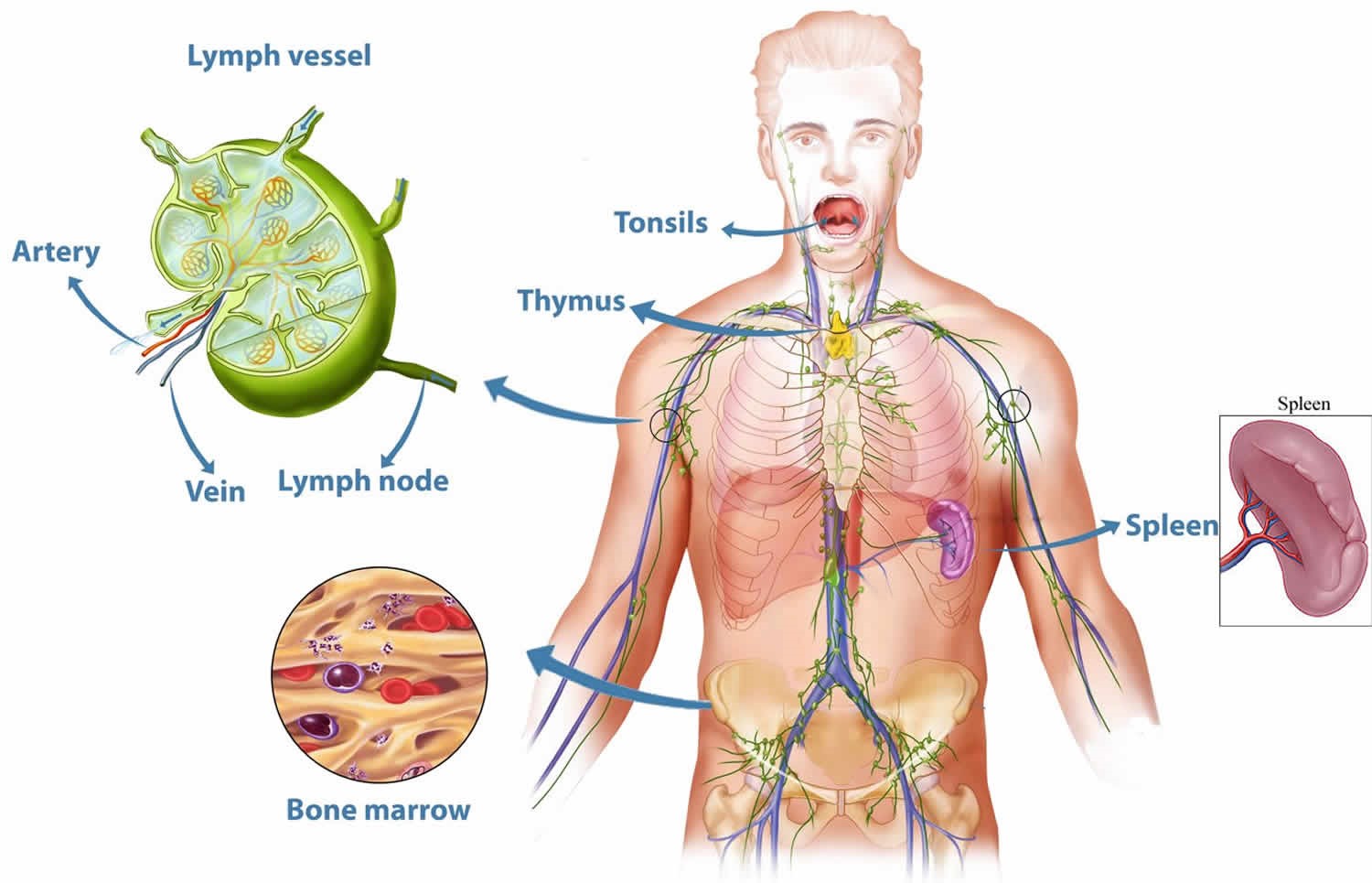
Рис. 5. Лимфоузел
Центральные органы иммунной системы отвечают за образование и созревание клеток, а периферические органы обеспечивают защиту, то есть иммунный ответ. Периферические и центральные органы иммунной системы выполняют свои работу только вместе и если выходит из строя какой-либо один из этих органов, то организм лишится защитного барьера.
Компоненты иммунной системы
Современная иммунология различает два взаимодействующих компонента иммунной системы – врожденный и приобретенный виды иммунитета, обеспечивающие развитие иммунного ответа на генетически чужеродные субстанции (сущности).
Врожденный (видовой) иммунитет – наследственно закрепленная система защиты организма человека от патогенных и непатогенных микроорганизмов, а также продуктов тканевого распада. Клетки врожденного иммунитета распознают патоген по специфичным для него молекулярным маркёрам – так называемым «образам патогенности». Эти маркёры не позволяют точно определить принадлежность патогена к тому или иному виду, а лишь сигнализируют о том, что иммунитет столкнулся с возмутителями спокойствия: чужаком или своим, но ставшим для организма предателем (рис.6).
Рис.6. Врожденный иммунитет: главное – спокойствие!

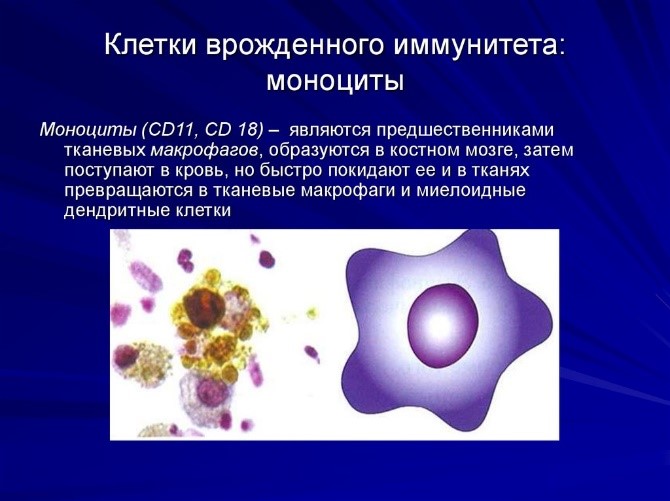
Врожденный иммунитет на клеточном уровне представляют:
- моноциты – предшественники макрофагов (клетки, пожирающие чужеродные частицы). Образуются в костном мозге, затем поступают в кровь, но быстро ее покидают, превращаясь в тканевые макрофаги и дендритные клетки (рис. 7);
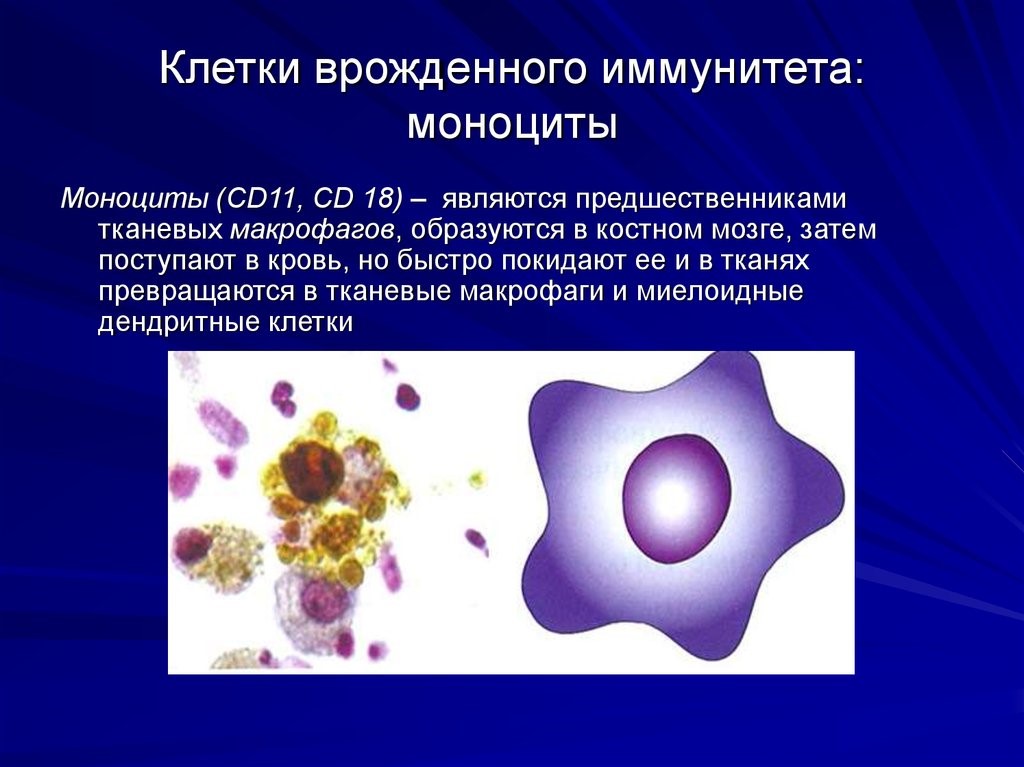
Рис.7. Моноцит
- макрофаги и дендритные клетки расположены в коже, слизистых. Обладают подвижностью, переносятся с током крови и лимфы. Они поглощают (фагоцитируют) патоген, и уже внутри себя при помощи содержимого вакуолей растворяют его. Дендритные клетки ветвятся подобно дереву. Благодаря ветвям-антеннам они работают связистами между врожденным и приобретенным видами иммунитета(рис.8);
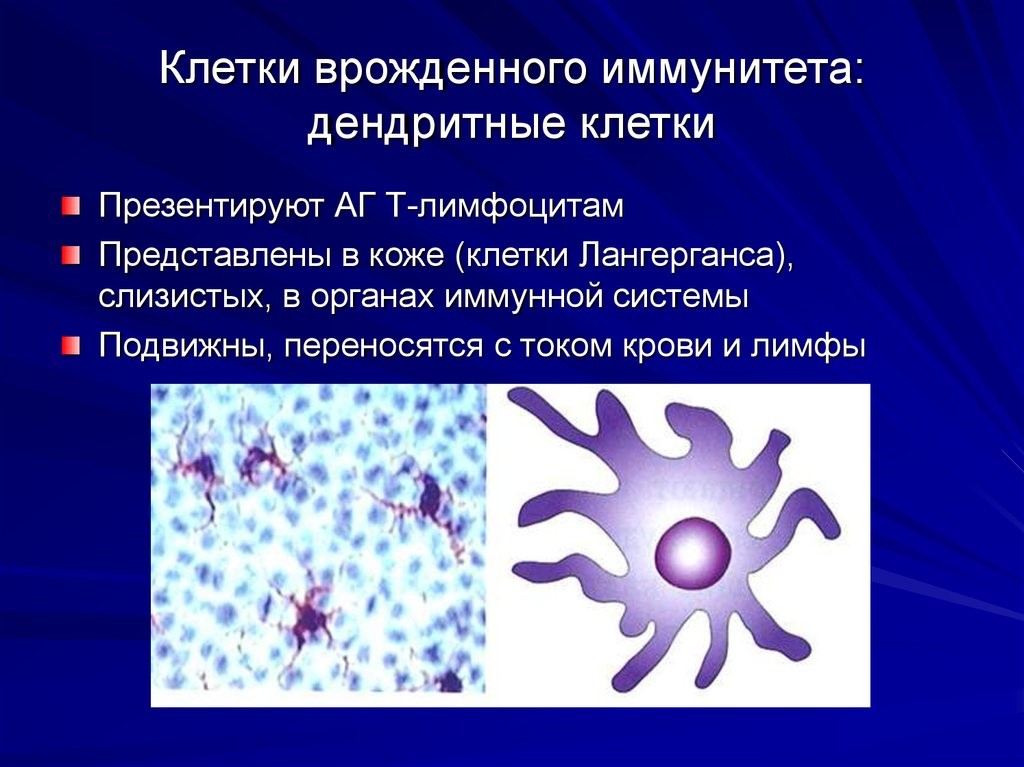
Рис.8. Дендритная клетка и
и макрофаг
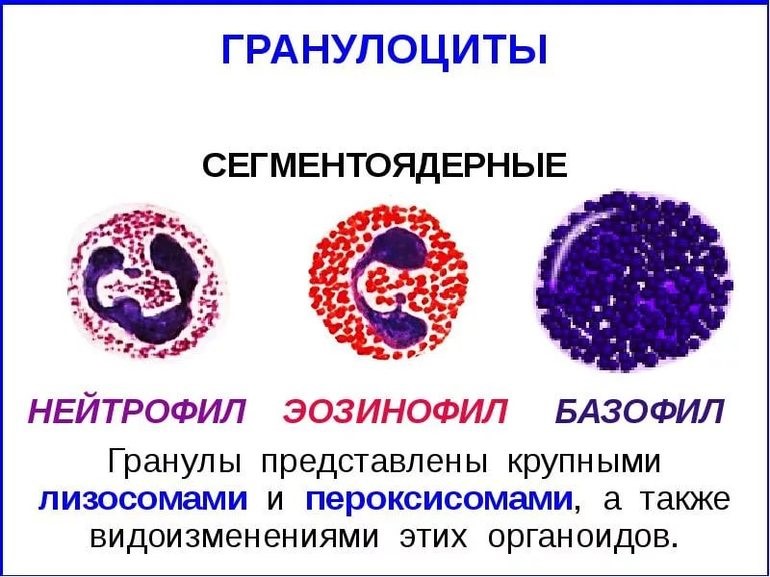
- клетки крови, содержащие в цитоплазме гранулы (гранулоциты): нейтрофилы, эозинофилы и базофилы (рис.9);
Рис.9. Гранулоциты
Нейтрофилы – самые многочисленные иммунные клетки в крови человека. Они циркулируют в крови всего 8-10 часов и бόльшую часть своей жизни путешествуют по тканям организма. При встрече с патогеном они его захватывают и переваривают, после чего обычно сами погибают. Из разрушенных нейтрофилов высвобождаются гранулы, содержащие антибиотические вещества.
Гранулы эозинофилов и базофилов осуществляют химическую защиту организма от крупных патогенов, например, паразитических червей, грибов, внеклеточных бактерий. Однако при чрезмерной активности могут участвовать и в развитии аллергической реакции;
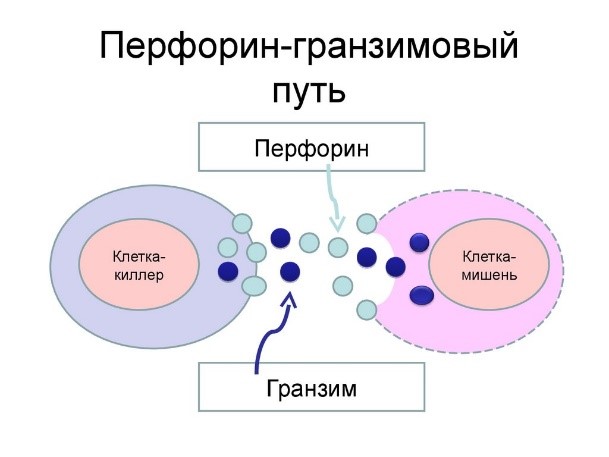
- натуральные (естественные) киллеры или NK-клетки (англ. Natural killer cells, NK cells) – тип цитотоксических лимфоцитов, участвующий в функционировании врождённого иммунитета. Они на высокой скорости уничтожают клетки, инфицированные бактериями и вирусами, а также опухолевые клетки.
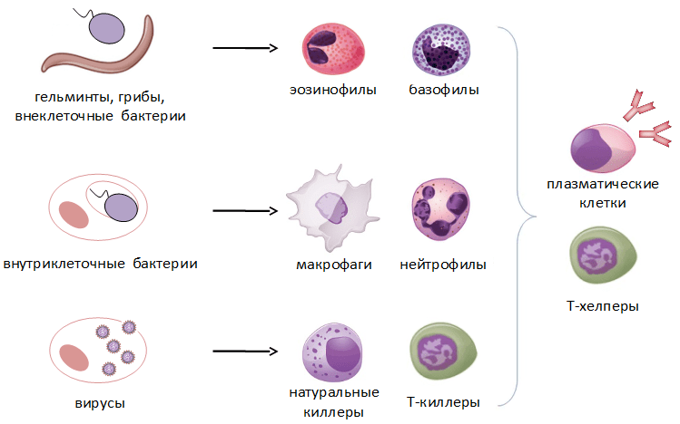
Рис.10. Натуральный киллер
Действуют натуральные киллеры с помощью агрессивных веществ перфорина и гранзима, которые наподобие буравчиков «кусают» и разрушают пораженную клетку, ставшую для них мишенью (рис.11)
Рис.11. Проникновение перфорина и гранзима в раковую клетку и ее уничтожение
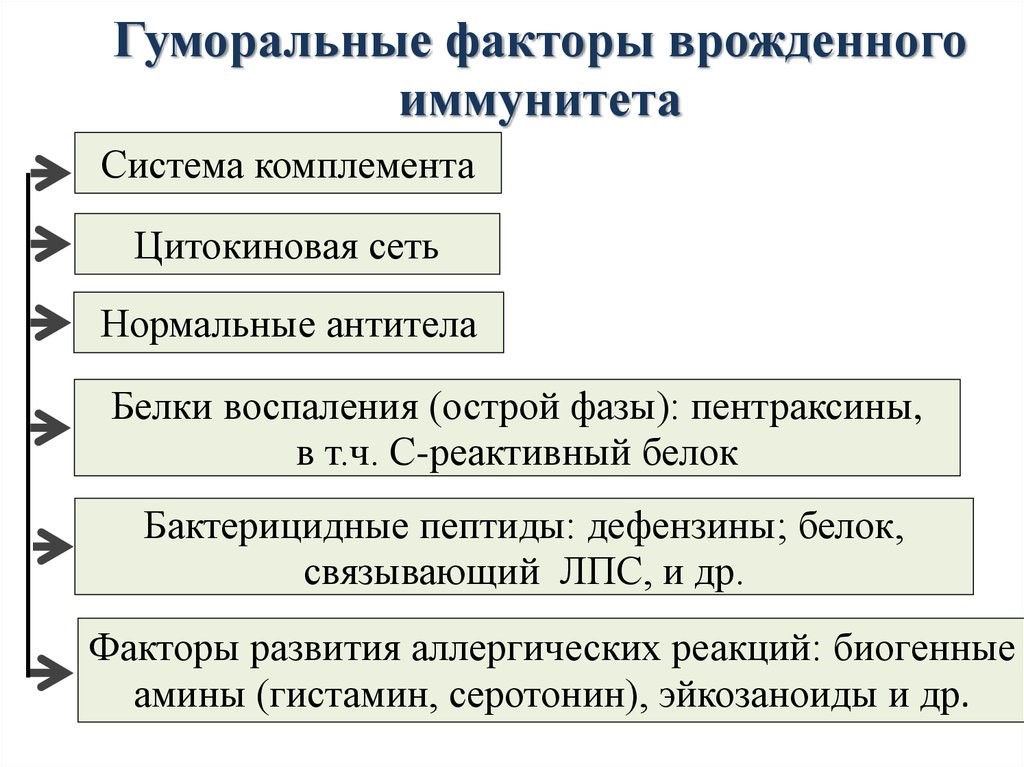
Молекулярными(гуморальные) факторами врожденного иммунитета являются (рис.12):
- белки, связывающие ионы металлов (железа, цинка), необходимых для жизнедеятельности и размножения патогенов – лактоферрин, кальпротектин, мембранный белок и другие;
- ферменты, генерирующие окислители – кислород и оксид азота:
- ферменты, способные расщеплять клеточную мембрану патогенов – лизоцим, хитиназа, фосфолипаза А2;
- белки и пептиды, нарушающие целостность клеточной оболочки микроорганизма – комплемент, эозинофильный протеин, дефензины и другие.
Рис.12.Гуморальные факторы врожденного иммунитета
Система комплемента – это многокомпонентная самособирающаяся система более 20 сывороточных белков, которые в норме находятся в неактивном состоянии.
После активации проявляются биологические эффекты комплемента: образование мембраноатакающего комплекса для лизиса патогенов, выброса медиаторов воспаления для привлечения фагоцитов и усиления их поглотительной способности.
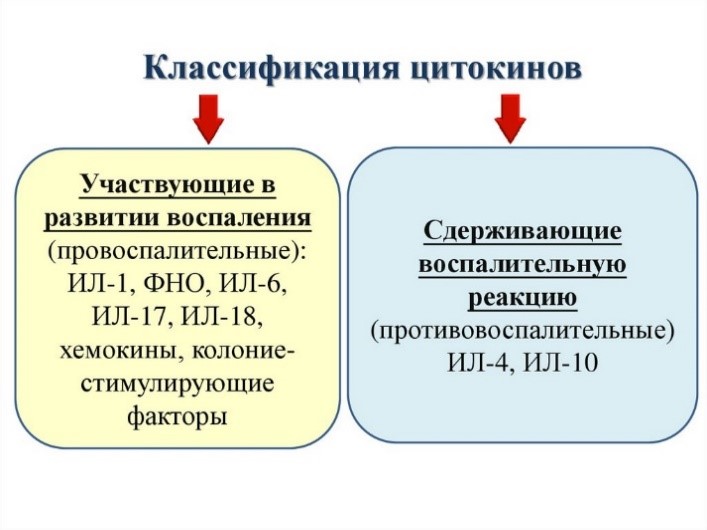
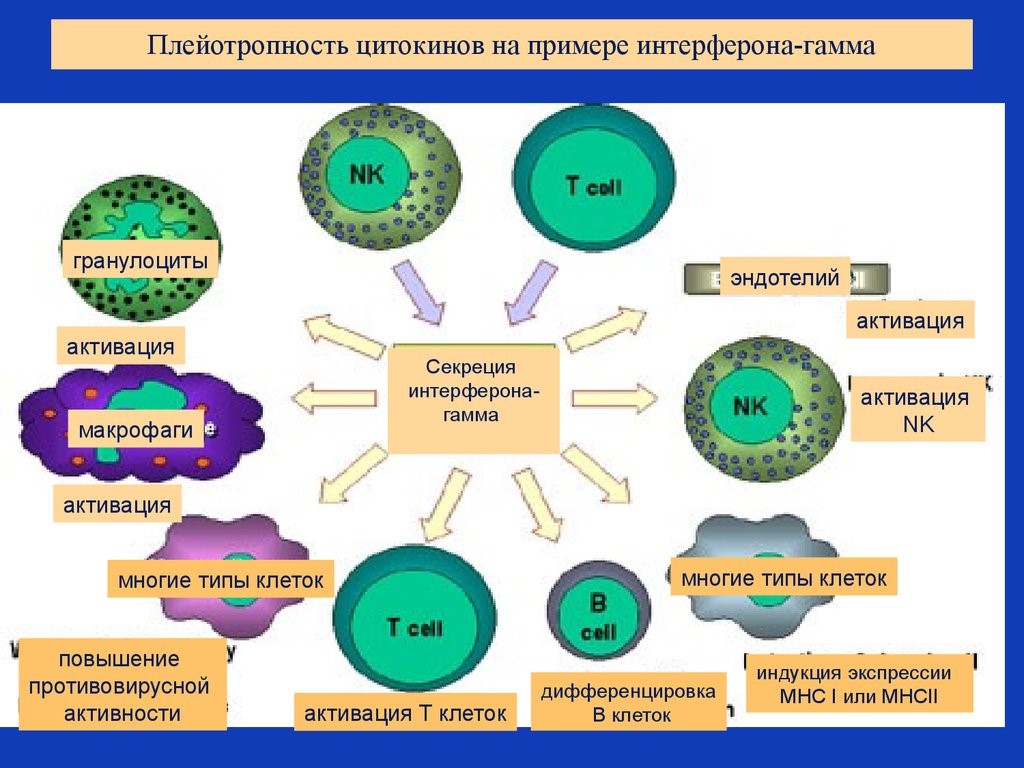
Цитокины – это система низкомолекулярных белков организма, синтезируемых преимущественно активными клетками иммунной и кроветворной систем, регулирующих межклеточные взаимодействия «универсальный» язык для всех клеток), представленные на рис.13 и 14.
Рис. 13. Цитокины: ИЛ – интерлейкины, которых в настоящее время насчитывается 34 разновидности;
Рис. 14. Разнонаправленность действия цитокинов на примере гамма-интерферона
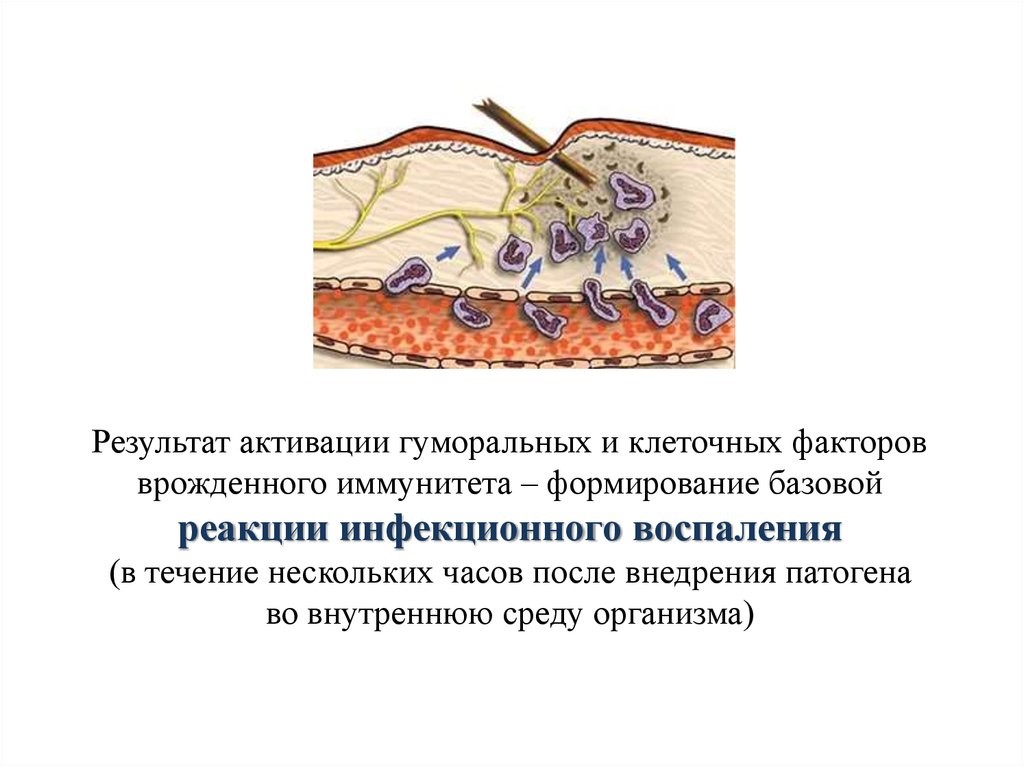
В результате активации гуморальных и клеточных факторов врожденного иммунитета в течение нескольких часов после внедрения патогена во внутреннюю среду организма формируется базовая реакция инфекционного воспаления (рис. 15)
Рис. 15. Инфекционное воспаление ткани на месте внедрения инородного тела с целью его удаления
Приобретенный иммунитет (или адаптивный – от франц. adapter «приспосабливать») формируется индивидуально в течение жизни под влиянием антигенной стимуляции и, в свою очередь, подразделяется на естественный и искусственный (рис.16).
Рис.16. Адаптивный
иммунитет
Естественный иммунитет формируется при встрече с патогеном, в результате чего в организме вырабатываются защитные иммунные факторы (активный естественный иммунитет), либо они попадают в готовом виде из материнского оргазма в период внутриутробного развития или при грудном вскармливании (пассивный естественный иммунитет).
Искусственный иммунитет создается путем введения вакцин или анатоксинов, которые стимулируют выработку антител против конкретных патогенов или их ядов. При этом с профилактической целью воспроизводится процесс реакции иммунной системы пациента на патоген, но в бессимптомной или легкой клинической форме с сохранением их защитной иммунной силы в течение нескольких месяцев, лет или даже пожизненно (искусственный активный иммунитет). Когда необходимо быстро и на короткое время защитить пациента от реального риска встречи с патогеном во время эпидемии или нейтрализовать уже проникший в его организм патоген применяются иммуноглобулины (антитела) как в очищенном виде, так и в дозированных объемах плазмы или сыворотки, полученных из крови донора (человека или животного). Применение готовых антител формирует пассивный искусственный иммунитет, сохраняющийся 2-3 недели.
Адаптивный иммунитет основывается на трех главных процессах:
- распознавание антигенов (как правило чужеродных для организма) с помощью рецепторов;
- удаление (элиминация) распознанных чужеродных агентов (рис. 17);
- формирование иммунологической памяти о контакте с антигеном, позволяющей быстрее и эффективнее удалять этот антиген при повторном его распознавании.
Рис.17.Варианты реагирования иммунной системы на пересадку органов или тканей, возникновение злокачественных новообразований и инфекций
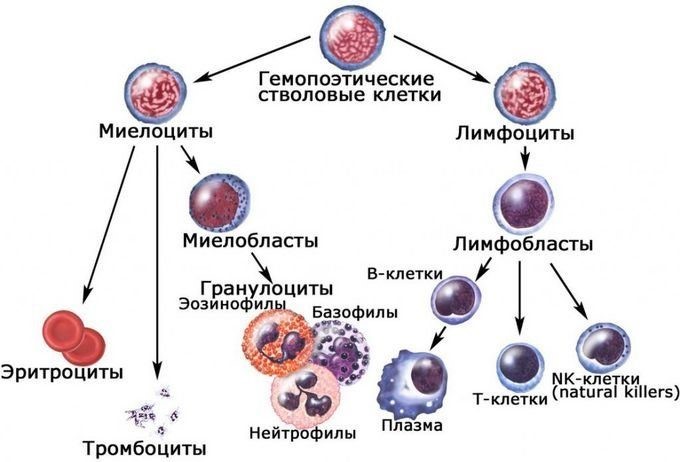
Иммунокомпетентными клетками адаптивного иммунитета являются лимфоциты, которые живут в организме человека от нескольких месяцев до несколько лет. По функциям клетки подразделяются на Т-лимфоциты – 80% и В-лимфоциты – 20%.
То, что Т-лимфоцит распознает только чужеродные антигены, а не молекулы собственного организма, является следствием процесса, называемого селекцией, которая происходит в тимусе, где завершают свое развитие Т-клетки. Суть селекции такова: клетки, окружающие юный, или наивный, лимфоцит, показывают (презентируют) ему пептиды собственных белков. Тот лимфоцит, который слишком хорошо или слишком плохо узнает эти белковые фрагменты, уничтожается. Выжившие же клетки (а это менее 1% всех предшественников Т-лимфоцитов, пришедших в тимус) обладают промежуточным сродством к антигену, следовательно, они, как правило, не считают собственные клетки мишенями для атаки, но имеют возможность среагировать на подходящий чужеродный пептид.
Для активации Т-лимфоцита нужно, чтобы он получил специальные сигналы от рецепторов лейкоцитарной антигенной системы и коктейля из множества провоспалительных цитокинов.

С помощью специальных реагентов определяются маркеры поверхностных белков лейкоцитов определенного типа, которые называются кластерами дифференциации (Сluster of differentiation) – CD. В настоящее время известно 350 CD-антигенов и их подтипов (табл. 1).
Таблица 1. Главные идентификациионные СD-маркёры клеток
|
Обозначение кластера |
Клетки |
|
CD 10, CD34 |
Лимфоидная стволовая клетка |
|
CD3 |
Т-лимфоцит |
|
CD4 |
Т-хелпер |
|
CD8 |
Т-киллер |
|
CD19, CD72, CD79 и др. |
В-лимфоцит |
|
CD16/ CD56 |
NK-клетки |
|
CD14, CD64 |
Моноцит/макрофаг |
Т-лимфоциты распознают клетки, несущие чужеродные антигены, и уничтожают их после непосредственного контакта (атаки), а также выполняют функцию регуляции иммунного ответа.
Т-лимфоциты имеют подтипы (рис. 18):
Рис. 18. Подтипы Т-лимфоцитов и их функции
- Т-киллеры (их еще называют CD8+ Т-лимфоциты), которые подобно NK-клетке (натуральному киллеру), выделяет белки перфорин и гранзим, что приводит к лизису клетки-мишени;
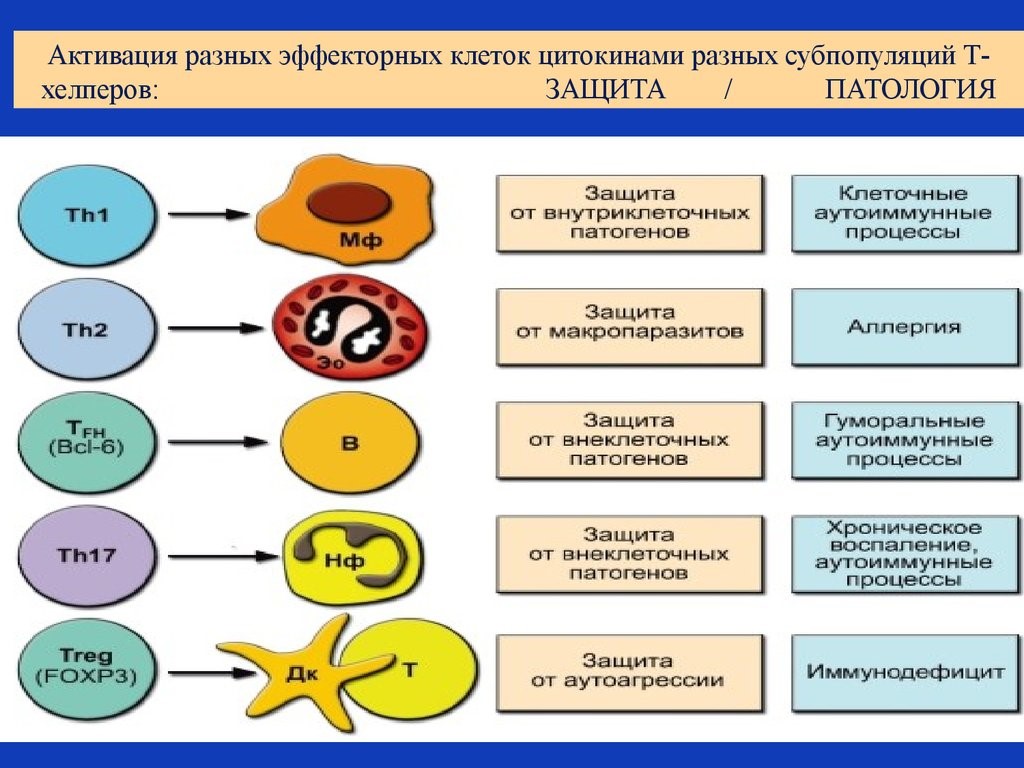
- Т-хелперы (от английского helper – помощник). Они еще обозначаются как Th-клетки, CD4+ T-лимфоциты. Активированные Т-хелперы продуцируют хемокины и цитокины, участвующие в иммунном процессе (рис.19);
Рис. 19. Активация цитокинами разных субпопуляций Т-хелперов
- Т-супрессоры (Ts) подавляют (супрессируют) реакции В-лимфоцитов и блокируют Т-хелперы. Притом эти клетки вовсе не устраивают саботаж иммунным процессам и не вредят здоровью. Они просто регулируют силу иммунного ответа, что позволяет иммунной системе сдержанно и с умеренной силой отвечать на раздражители (тушить пожар, а не костер);
- Т-регуляторные клетки (Tr1) влияют на образование зернистых лейкоцитов (гранулоцитов), которых мы уже представляли в качестве макрофагов.
Соотношение количества клеток CD4/CD8 называют иммунорегуляторным индексом (ИРИ). Если у пациента ИРИ повышен (более 2,2), то это говорит о чрезмерной активности T-хелперов и ослаблении регулирующей функции T-киллеров. При таком показателе иммунные клетки могут разрушать собственные ткани организма. Повышенный ИРИ чаще всего отмечается у пациентов с аутоиммунными болезнями (системной красной волчанкой, склеродермией, ревматоидным артритом и др.). Причиной чрезмерной активности T-хелперов может также стать опухоль вилочковой железы. При этой патологии продуцируется избыточное количество лимфоцитов. Высокие показатели ИРИ отмечаются при остром лимфобластном лейкозе. Это тяжелое онкологическое заболевание сопровождается неконтролируемым увеличением количества незрелых лимфоцитов.
Если иммунорегуляторный индекс понижен (менее1,6), то это говорит о серьезном ухудшении работы иммунитета. Низкие показатели ИРИ свидетельствуют о том, что в организме ослаблена функция защитных клеток, а регуляция со стороны T-киллеров чрезмерна. Обычно это отмечается при следующих патологиях, сопровождающихся иммунодефицитом: инфекционных болезнях (в том числе ВИЧ-инфекции); врожденном иммунодефиците; любых затяжных и хронических болезнях; опухолях костного мозга.
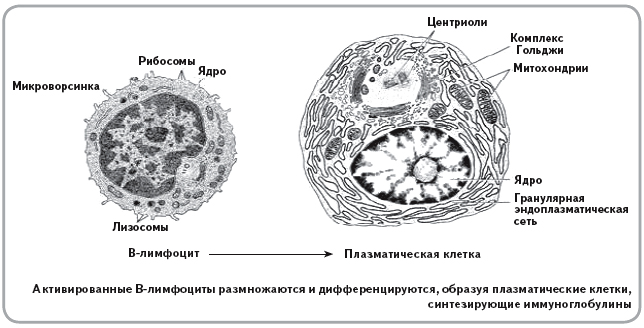
В-лимфоциты ответственны за гуморальное звено иммунитета – продукцию антител. После антигенного стимула В-лимфоцит превращается в лимфобласт – клетку, способную к делению. Часть лимфобластов дифференцируется в В-лимфоциты памяти, другая часть превращается в плазматические клетки, которые осуществляют продукцию антител.
В-лимфоциты несут на своей поверхности В-клеточный рецептор. При контакте с антигеном эти клетки активируются и превращаются в особый клеточный подтип – плазматические клетки, живущие до трех недель и обладающие уникальной способностью секретировать в этот срок тысячи антител.
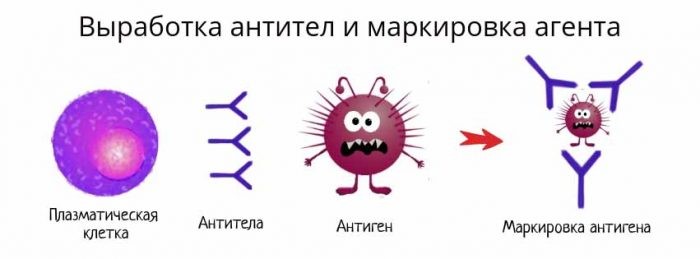
Антитело имеет сродство к распознаваемому им антигену, как бы «прилипает» к нему. Это дает возможность антителам обволакивать (опсонизировать) клетки и вирусные частицы, покрытые молекулами антигена, привлекая макрофаги и другие иммунные клетки для уничтожения патогена. Антитела также умеют активировать специальный каскад иммунологических реакций, называемый системой комплемента, который приводит к перфорации клеточной мембраны патогена и его гибели.
Рис. 20. Выработка антител и маркировка патогена
Различают несколько классов антител (иммуноглобулинов). Первыми после антигенного раздражения, вызывающих агглютинацию бактерий и нейтрализацию вирусов, появляются иммуноглобулины М (IgM). В длительном иммунитете участвуют иммуноглобулины G(IgG).
В табл.2 представлена интерпретация лабораторных исследований на наличие патогена на молекулярном уровне и с помощью тестов на иммуноглобулины М и G.
Таблица 2. Интерпретация лабораторных исследований на наличие патогена на молекулярном уровне
|
Результат молекулярного исследования |
Тест на антитела |
Интерпретация |
|
|
IgM |
IgG |
||
|
Положительный |
Отрицательный |
Отрицательный |
Острая инфекция |
|
Положительный |
Положительный |
Отрицательный |
Острая инфекция |
|
Положительный |
Положительный |
Положительный |
Инфицированный пациент |
|
Положительный |
Отрицательный |
Положительный |
Инфицированный или повторно инфицированный пациент |
|
Отрицательный |
Положительный |
Отрицательный |
Ранние стадии инфекции. Требуется дополнительное исследование |
|
Отрицательный |
Положительный |
Положительный |
Инфекция. Требуется дополнительное исследование |
|
Отрицательный |
Отрицательный |
Положительный |
Постинфекционный период |
|
Отрицательный |
Отрицательный |
Отрицательный |
Неинфицированный пациент |
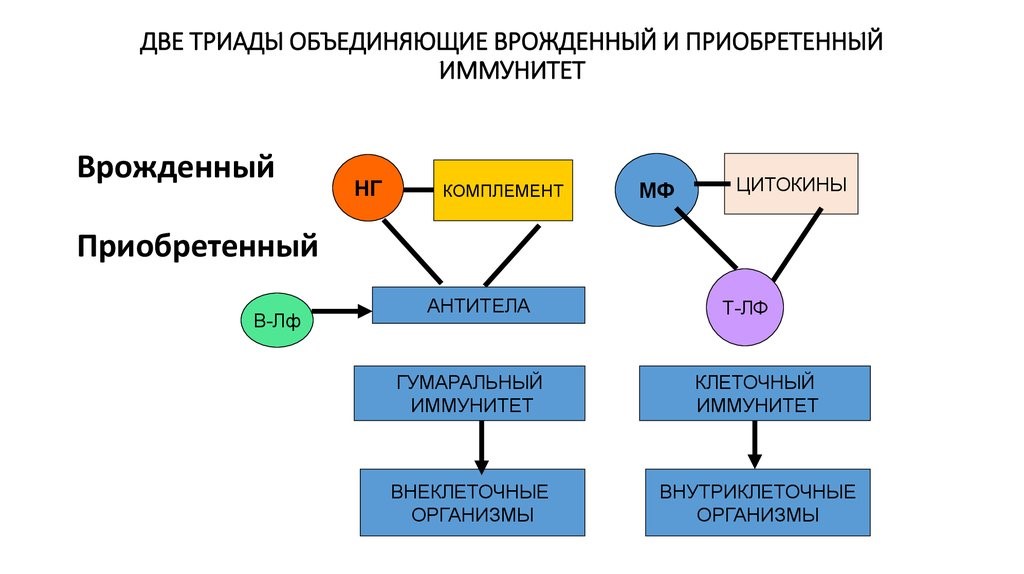
Врожденный и приобретенный виды иммунитета имеют точки соприкосновения, которые представляют две триады (рис.21)
Рис. 21. Две триады, объединяющие врожденный и приобретенный виды иммунитета
Развитие адаптивного иммунного ответа требует достаточно много времени (от нескольких дней до двух недель), и для того чтобы организм мог защищаться от уже знакомой инфекции быстрее, из Т- и В-клеток, участвовавших в прошлых битвах, формируются так называемые клетки памяти. Они, подобно ветеранам, в небольшом количестве присутствуют в организме, и, если появляется знакомый им патоген, вновь активируются, быстро делятся и целой армией выходят на защиту границ (рис.22).
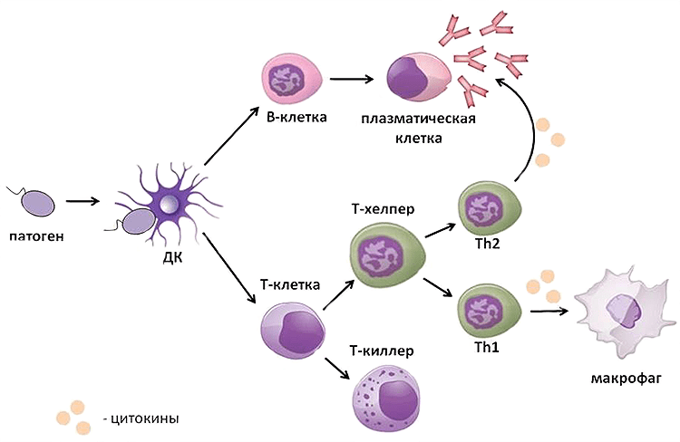
Рис.22. Т-клетки памяти быстро формирует вторичный иммунный ответ
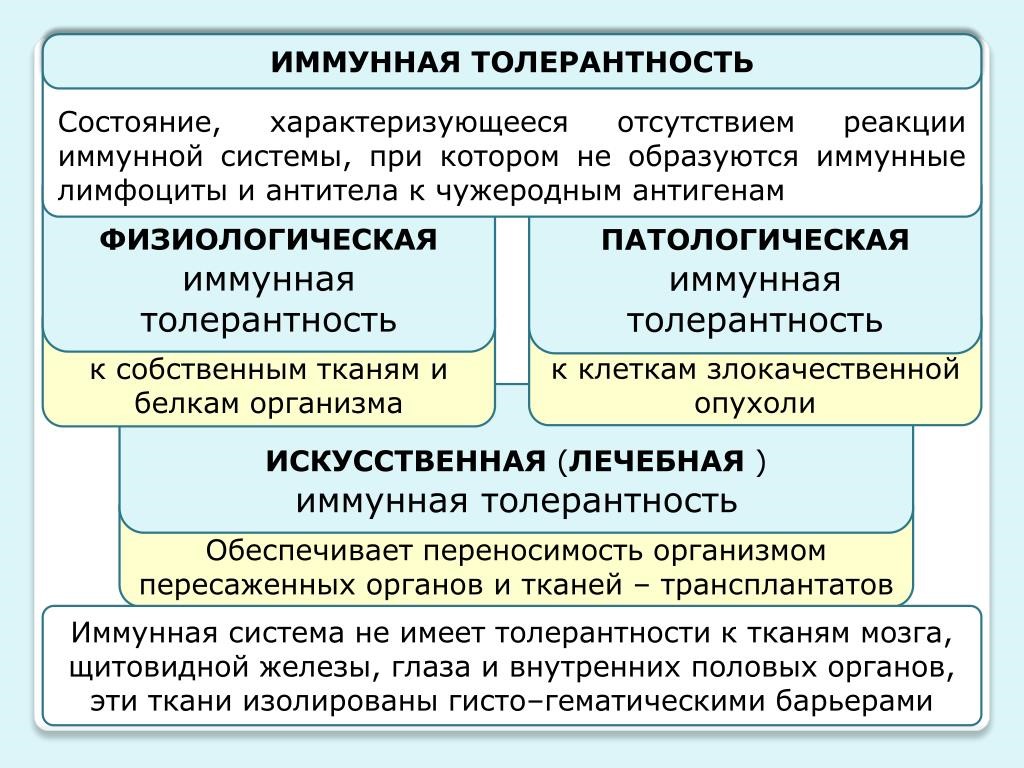
Иммунологическая толерантность
Под иммунологической толерантностью (терпимостью, ареактивностью) понимают отсутствие иммунного ответа на специфический антиген. Перечень антигенов, к которым может развиваться толерантность, практически неотличим от набора антигенов, против которых развивается специфический иммунный ответ (рис.23).
Рис. 23. Иммунная толерантность
Механизмы толерантности необходимы, поскольку иммунная система продуцирует огромное число разнообразных антиген специфичных рецепторов, и некоторые из них оказываются специфичными к собственным антигенам организма; толерантность предотвращает нежелательные реакции против собственных органов и тканей, также для нормального протекания беременности.
Нарушения иммунной системы у человека
Нарушения в работе иммунной системы можно подразделить на три категории: иммунодефициты, аутоиммунные заболевания и реакции гиперчувствительности.
Иммунодефициты
Иммунодефицит – снижение количественных показателей и/или функциональной активности основных компонентов иммунной системы, приводящее к нарушению защиты организма от патогенных микроорганизмов и проявляющееся повышенной инфекционной заболеваемостью.
Первичные иммунодефициты (ПИД) – наследственные заболевания, обусловленные дефектами генов, контролирующих иммунный ответ. В основном ПИД заявляют о себе уже в раннем детском возрасте, но иногда лишь к 30-40 годам жизни.
- симптомов, которые могут быть признаками первичных иммунодефицитов:
- 4 и более случаев отита в течение года;
- 2 и более синусита в течение года;
- низкая эффективность антибиотиков в течение двух и более месяцев приема;
- 2 и более случаев пневмонии в течение года;
- невозможность ребенка набирать вес и нормально расти;
- частые и глубокие абсцессы кожи и внутренних органов
- постоянный кандидоз полости рта и кожи;
- необходимость внутривенного введения антибиотиков для разрешения инфекции;
- две и более системных инфекции, включая сепсис;
- наследственная предрасположенность.
По механизмам развития выделяют 4 основные группы ПИД (табл.3):
- 1-я группа – преимущественно гуморальные, или В-клеточные ПИД;
- 2-я группа – комбинированные ПИД (при всех Т-клеточных иммунодефицитах есть нарушение функции В-клеток);
- 3-я группа – ПИД, обусловленные дефектами фагоцитоза;
- 4-я группа – ПИД, обусловленные дефектами в системе комплемента.
Таблица 3. Некоторые первичные иммунодефициты
|
Патология |
Симптомы |
Диагностика |
Лечение |
|
Дефекты антителообразования |
|||
|
Агаммаглобулинемия |
Частые бактериальные инфекции |
Дефицит или полное отсутствие В-лимфоцитов |
Антибиотики, пожизненное введение IgG |
|
Общая вариабельная иммунная недостаточность |
Частые респираторные инфекции, отиты |
Дефекты Т- и В- лимфоцитов |
Антибиотики, пожизненное введение IgG |
|
Комбинированные ПИД |
|||
|
Атаксия-телеангиоэкстазия (синдром Луи-Бар) |
Аномалия двигательной функции, слабость мышц, нарушение речи |
Дефицит Т- и В- лимфоцитов |
Симптоматическое |
|
ПИД, обусловленные дефектами фагоцитоза |
|||
|
Хроническая гранулёматозная болезнь |
Частые пневмонии, гнойные инфекции |
Генетический дефект |
Пожизненная антибактериальная и противогрибковая терапия, интерферон гамма |
|
ПИД, обусловленные дефектами в системе комплемента |
|||
|
Наследственный ангионевротический отек |
Отеки губ и век при отсутствии зуда. Отеки гортани, носа, языка опасны для жизни |
Низкая концентрация ингибитора эстеразы С1 |
Введение концентрата ингибитора эстеразы С1 |
Как следует из табл.3, основным и часто единственным методом лечения большинства пациентов с первичными В-клеточными иммунодефицитами являются иммуноглобулины. Это лекарственные средства, получаемые из плазмы крови человека. Они призваны заменить защитные антитела, отсутствующие в иммунной системе, с целью предотвращения или остановки развития тяжелых инфекционных заболеваний. Сегодня в арсенале врача имеются иммуноглобулины, различающиеся по концентрации активного вещества (5 и 10%), а также по способу введения (внутривенный и подкожный).
ПИД может проявиться в любом возрасте. В зависимости от этого у пациента возникают своеобразные проблемы, требующие определенных видов поддержки на протяжении всей жизни (табл. 4).
Таблица 4. Необходимость в видах поддержки пациента с ПИД в различных возрастных группах
|
Возраст, лет |
Виды поддержки |
|||
|
семьи |
врача |
психолога |
общества |
|
|
0-14 |
+++ |
+ |
+ |
+++ |
|
14-18 |
+++ |
+ |
+++ |
+++ |
|
18-65 |
+ |
++ |
+ |
+++ |
|
Старше 65 |
+ |
++ |
++ |
+++ |
В возрасте от 0 до 14 лет требуется уход со стороны родителей, направленный на профилактику инфекций и на период лечения. Могут потребоваться: обучение на дому; оказание психологической помощи; социальная поддержка в приобретении лекарственных средств.
В подростковом возрасте (14-18 лет) дополнительно могут возникнуть потребности в продолжении непрерывного обучения, профессиональной ориентации, налаживании взаимоотношений со сверстниками, организации досуга.
В возрасте от 18 до 65 лет у пациентов чаще возникают инфекционные осложнения, а с ними и расходы на приобретение лекарственных средств, не подлежащих восполнению, а также проблемы с трудоустройством.
В пожилом возрасте (старше 65 лет) возникают потребности в материальной, социальной и психологической поддержке пациента с ПИД.
Аутоиммунная патология
Повреждение собственных органов и тканей организма иммунной системой называется аутоиммунным процессом. Заболеваниями такого типа страдает около 5% человечества. В организме пациента развиваются боевые действия, напоминающие гражданскую войну: в атаку идут «свои против своих». В этой борьбе победителей нет – одни страдания.
Селекция Т-лимфоцитов в тимусе, а также удаление аутореактивных клеток на периферии (центральная и периферическая иммунологическая толерантность), о которых мы говорили ранее, не могут полностью избавить организм от аутореактивных Т-лимфоцитов. Что же касается В-лимфоцитов, вопрос о том, насколько строго осуществляется их селекция, до сих пор остается открытым. Поэтому в организме каждого человека обязательно присутствует множество аутореактивных лимфоцитов, которые в случае развития аутоиммунной реакции могут повреждать собственные органы и ткани.
В качестве аналога можно привести созданную турками в ХIV веке янычарскую пехоту, в которую набирали юношей-христиан 8-16 лет, воевших против своих сородичей.
Т-клеточная аутоиммуннная агрессия хорошо изучена при ревматоидном артрите, сахарном диабете первого типа, рассеянном склерозе и многих других болезнях.
Такие же клетки-янычары, не помнящие своего родства, прослеживаются среди В-лимфоцитов:
- аутоантитела могут вызывать гибель клеток, активируя на их поверхности систему комплемента или же привлекая макрофаги;
- мишенями для антител могут стать рецепторы на поверхности клетки.
Например, вследствие срыва иммунологической толерантности происходит активация В-лимфоцитов, продуцирующих антитела. Это приводит к выраженному повышению выработки тиреоидных гормонов (Т4 и Т3), а также к увеличению щитовидной железы в размерах (гипертрофии). Патология носит название болезнь Грейвса.
Еще одним примером может быть миастения гравис, которая характеризуется слабостью скелетной мускулатуры вследствие образования аутоантител против структур, отвечающих за холинергическую передачу и сокращение мышечного волокна;
- аутоантитела вместе с растворимыми антигенами могут образовывать иммунные комплексы, которые оседают в различных органах и тканях (например, в почечных клубочках, суставах, на эндотелии сосудов), нарушая их работу и вызывая воспалительные процессы.
Как правило, аутоиммунное заболевание возникает внезапно, и невозможно точно определить, что стало его причиной. Считается, что триггером для запуска может послужить практически любая стрессовая ситуация, будь то перенесенная инфекция, травма или переохлаждение. Значительный вклад в вероятность возникновения аутоиммунного заболевания вносит как образ жизни человека, так и генетическая предрасположенность – наличие определенного варианта какого-либо гена.
Гиперчувствительность
Под гиперчувствительностью понимают чрезмерный иммунный ответ на какой-либо антиген. Реакции гиперчувствительности подразделяют на несколько типов в зависимости от их длительности и механизмов, лежащих в их основе:
- гиперчувствительность I типа включает немедленные анафилактические реакции, часто связанные с аллергией. Реакции этого типа могут как вызывать небольшой дискомфорт, так и приводить к смерти. Основу гиперчувствительности I типа составляют иммуноглобулины E (IgE), которые вызывают дегрануляцию базофилов и тучных клеток;
- гиперчувствительность II типа характеризуется присутствием антител, распознающих его собственные белки и помечающие экспрессирующие их клетки к разрушению. Гиперчувствительность II типа также называют зависимой от антител или цитотоксической гиперчувствительностью, её основу составляют иммуноглобулины G (IgG) и M (IgM);
- гиперчувствительность III типа обусловлена иммунными комплексами, состоящими из антигенов, белков комплемента, IgG и IgM;
- гиперчувствительность IV типа, также известная как отложенная гиперчувствительность, развивается в течение 2-3 дней. Реакции гиперчувствительности IV типа наблюдаются при многих аутоиммунных и инфекционных заболеваниях, а их основу составляют T-клетки, моноциты и макрофаги.
Эффективные методы воздействия на иммунитет:
- регулярная вакцинация по скорости и качеству реакции превышает естественный процесс формирования иммунитета на конкретную инфекцию;
- сбалансированное питание, обеспечивающее поддержание нормального обмена веществ;
- регулярные физические нагрузки, обеспечивающие физиологическое функционирование всех систем организма, поддержание оптимальных показателей массы тела;
- отказ от вредных привычек, приводящих к зависимостям (алкогольной, никотиновой, наркотической, токсической, компьютерной);
- режим дня, особенно влияние циркадных ритмов (смена дня и ночи): во время бодрствования пика достигает численность T-киллеров и NK-клеток, а также концентрация противовоспалительных веществ, таких как кортизол и катехоламины; во время сна достигает своего пика формирование Т-клеток памяти.
Спекулятивные методы вокруг иммунитета:
- прием иммуностимуляторов клинически не оправдан. Если постоянно стимулировать выработку лейкоцитов лекарственными средствами, иммунная система начнет утрачивать свои непосредственные функции. Вот тогда и наступает момент начала серьезных проблем с иммунитетом. Совершенно не влияют на иммунную систему природные адаптогены: лимонник китайский, женьшень, элеутерококк, радиола розовая. Они воздействуют, как усилители синтеза РНК и белков (основу человеческих клеток), активизируют ферменты обмена и работу эндокринной и вегетативной систем;
- прием витаминов явно переоценен. Положительное влияние на иммунную систему оказывает витамин D, который стимулирует образование Т-киллеров. Все остальные группы витаминов прямого участия в функционировании иммунной системы не принимают;
- банные процедуры и сауна на иммунную систему не влияют;
- народные средства, такие как мед и чеснок обладают легким бактерицидным, но не иммуногенным действием.
Заключение
Иммунная система представлена тремя уровнями: органным, клеточным и молекулярным со сложнейшими взаимодействиями между ними.
Современная иммунология различает два взаимодействующих компонента иммунной системы – врожденный и приобретенный (адаптивный) виды иммунитета, обеспечивающие развитие иммунного ответа на генетически чужеродные субстанции, которые представляют собой микроорганизмы, злокачественные опухолевые клетки, пересаженные органы и ткани.
Адаптивный иммунитет основывается на трех главных процессах: распознавание антигенов, их удаление (элиминация) и формирование иммунологической памяти.
Поломки в структуре иммунной системы приводят к развитию иммунодефицитов, аутоиммунным заболеваниям или реакции гиперчувствительности.
Иммунодефицит на генетическом уровне (первичный) или приобретенный (вторичный) может проявиться в любом возрасте и привести к повышенной инфекционной заболеваемости. В последние годы появились средства заместительной терапии, которые продлевают жизнь этим пациентам. Для повышения качества их жизни требуется не только обеспечение дорогостоящим лечением, но и организация поддержки со стороны семьи, психологов и социальных институтов.
Аутоиммунные заболевания и гиперчувствительность – это неспособность организма противостоять разбушевавшейся иммунной системе, которая перепутала свое и чужое.
К сожалению, ни одно из заболеваний иммунной системы медицина еще не научилась излечивать, а только применять заместительную терапию.
Эффективными профилактическими методами воздействия на иммунную систему являются вакцинация и здоровый образ жизни. Купить иммунитет в аптеке пока никому не удалось.
Г. А. Воронина ;
М. З. Федорова
Наиболее сложные вопросы преподавания раздела «Человек и его здоровье»
Продолжение. См. № 17/2009
Учебный план курса
|
№ газеты |
Учебный материал |
|
17 |
Лекция 1. Регуляторные системы организма |
|
18 |
Лекция 2. Иммунитет |
|
19 |
Лекция 3. Нарушения в работе иммунной системы |
|
20 |
Лекция 4. Общий план строения нервной системы |
|
21 |
Лекция 5. Строение и функции отделов центральной нервной системы |
|
22 |
Лекция 6. Гуморальная регуляция функций в организме |
|
23 |
Лекция 7. Стресс в жизнедеятельности организма человека |
|
24 |
Лекция 8. Основы рационального питания |
|
Итоговая работа |
Лекция 2. Иммунитет
Основные понятия
ЦИТОКИНЫ – вещества белковой природы, секретируемые лейкоцитами и другими клетками организма. Являются медиаторами (посредниками) иммунного ответа, осуществляющими через специфические рецепторы взаимодействие между клетками, вовлекаемыми в защитный ответ. Регулируют иммунные и воспалительные реакции организма. Известно около 100 цитокинов. Для иммунной защиты особенно важны интерлейкины, интерфероны, колониестимулирующие факторы, различные факторы роста.
ИНТЕРЛЕЙКИНЫ – цитокины, действующие как факторы роста и дифференцировки лимфоцитов и других клеток.
Факторы роста стимулируют рост и дифференцировку, а иногда и трансформацию (переход в злокачественную форму) различных клеток. Известно несколько десятков факторов роста (эпидермальный, гепатоцитов, нервов и др.).
ХЕМОКИНЫ – небольшие секреторные белки, в первую очередь регулирующие перемещения лейкоцитов. К хемокинам относятся: фракталкин, лимфотактин, фактор хемотаксиса моноцитов, эутактин и др.
КОЛОНИЕСТИМУЛИРУЮЩИЕ ФАКТОРЫ – белковые молекулы, необходимые для выживания, деления, роста и дифференцировки гемопоэтических клеток. Эти факторы вырабатывают макрофаги, T-лимфоциты, эндотелий, фибробласты.
ИНТЕРФЕРОНЫ – группа белков, подавляющая размножение вирусов. Система интерферона – важнейший фактор неспецифической сопротивляемости организма человека. Важнейшие их функции – антивирусная, противоопухолевая, иммуномодулирующая и радиопротекторная. Интерфероны видоспецифичны. Каждый биологический вид, способный к их образованию, продуцирует свои уникальные интерфероны, похожие по структуре и свойствам, но не способные проявлять антивирусный эффект в условиях организма другого вида.
ЛИЗОЦИМ – универсальный гидролитический фермент, разрушающий клеточную стенку бактерий. У животных и человека содержится в крови, слезах, слюне и других жидких средах. Богаты лизоцимом такие растения, как хрен, редька и некоторые другие. Благодаря лизоциму оказывается полезным поплакать по несущественному поводу во время эпидемий респираторных заболеваний или зализать небольшую ранку.
КОМПЛЕМЕНТ – группа сывороточных белков; в активной форме комплемент повреждает мембрану бактерий, нейтрализует токсины и вирусы.
АНТИГЕНЫ – чужеродные для организма вещества, способные вызвать иммунный ответ. Антигенными свойствами обладают высокомолекулярные соединения: белки, нуклеопротеиды, полисахариды, липополисахариды и др. Чужеродными для организма могут быть различные клетки (бактерии, грибки, простейшие, клетки пересаженных органов и тканей и др.); высокомолекулярные вещества, попавшие в организм не через пищеварительную систему; аутоантигены (антигены собственных мутировавших клеток).
ГАПТЕНЫ – низкомолекулярные вещества, не содержащие антигенных структур. К ним относятся многие моно-, олиго- и полисахариды, липиды, гликолипиды, искусственные полимеры, неорганические вещества (соединения йода, брома, висмута) и др. Сами по себе гаптены не иммуногенны, т.е. не вызывают ответных реакций иммунной системы. Однако они могут присоединяться к молекуле белка, после чего приобретают способность вызывать иммунный ответ.
ИММУНОГЛОБУЛИНЫ (антитела) – вещества из группы гликопротеидов. Специфически взаимодействуют c антигенами, к которым иммунная система синтезировала данное антитело. При образовании комплекса «антиген–антитело» антиген нейтрализуется. Существуют миллионы разновидностей антител, и каждая молекула иммуноглобулина имеет уникальный участок связывания антигена. Антитела синтезируются плазматическими клетками в ходе гуморального иммунного ответа.
Общая характеристика функций иммунной системы
Основная функция иммунной системы – контроль за генетическим постоянством внутренней среды организма. Иммунитет – это способ защиты организма от живых тел и веществ, несущих признаки генетически чужеродной информации. Термин «иммунитет» происходит от лат. immunitas –
избавление, освобождение от чего-либо (в Древнем Риме это слово означало освобождение гражданина от какой-либо обязанности, повинности или службы).
Иммунная система состоит из центральных (костный мозг, тимус) и периферических (селезенка, лимфатические узлы, миндалины, пейеровы бляшки кишечника, лимфоидные образования кожи и слизистых оболочек и др.) органов и тканей. Основной структурной и функциональной единицей иммунной системы являются Т- и В-лимфоциты (иммунокомпетентные клетки (ИКК), иммуноциты). Иммуноциты способны распознавать чужеродные вещества (антигены), обеспечивать иммунный ответ, создавать клоны себе подобных клеток, формировать клетки памяти. Лимфоциты проходят несколько стадий клеточных преобразований, необходимых для выполнения этих функций.
Другими клетками иммунной системы являются моноциты, нейтрофилы, эозинофилы, базофилы, тучные клетки, дендритные клетки, естественные, или натуральные, киллеры (ЕК-, NK-клетки). Эти клетки не являются иммунокомпетентными, но выполняют ряд важных функций.
Одна из важных защитных функций – способность к фагоцитозу. Ею обладают нейтрофилы и моноциты. Из нейтрофилов образуются малые фагоциты (микрофаги), из моноцитов – большие фагоциты (макрофаги). Активность фагоцитирующих клеток увеличивается системой комплемента, интерферонами, иммуноглобулинами.
Естественные киллеры (наряду с Т-лимфоцитами) обладают цитотоксичностью, т.е. способностью уничтожать генетически чужеродные клетки. Клетки иммунной системы находятся в большинстве органов и тканей организма. Исключение составляют так называемые забарьерные органы, в которые в норме ИКК не проникают: головной мозг, яички, хрусталик.
Центральные и периферические органы иммунной системы
Костный мозг. Первое описание костного мозга дал Р.Вирхов. Во второй половине XIX в. было установлено, что костный мозг является органом кроветворения. У новорожденного очагами кроветворения являются только костные полости. К 18 годам гемопоэтическая ткань обнаруживается в позвонках, ребрах, тазовых костях, скулах, эпифизах трубчатых костей. У взрослого человека очаги кроветворения разной степени выраженности обнаруживаются в 206 костях скелета. Общая масса красного костного мозга составляет у среднестатистического человека 1400 г, что близко к массе печени.
Красный костный мозг заселяется стволовыми кроветворными клетками на ранних стадиях внутриутробного развития. В структуру красного костного мозга, кроме предшественников клеток крови, входят кровеносные сосуды, нервные окончания, костная капсула и вспомогательные клетки.
Предположительно, в эмбриональном периоде у человека закладывается определенное число ранних кроветворных предшественников, которые в течение жизни дифференцируются в зависимости от потребностей организма. Образующиеся в костном мозге клетки по мере созревания поступают в кровяное русло. В обычных условиях костномозговое кроветворение покрывает потребности организма и производит довольно большой запас клеток.
В эти годы идет постоянное образование тимоцитов. Из их общего числа (2×108) 20–25% ежедневно образуются заново путем деления; 95–98% вновь образовавшихся тимоцитов погибает. Оставшиеся 2–5% – это те клетки, которые способны распознавать антигены и активироваться для выполнения защитных функций. Эти клетки поступают в кровоток и лимфоидные органы.
До 6 лет продолжается медленный незначительный прирост тимуса, после чего его масса начинает уменьшаться, и со второго десятилетия жизни тимус подвергается инволюции.
В тимусе происходит созревание Т-лимфоцитов, и они становятся способными распознавать «свои» и «чужие» клетки. Зрелые Т-лимфоциты циркулируют по организму. Их иммунная функция реализуется в основном в лимфатических узлах. Т-лимфоциты индуцируют также созревание В-лимфоцитов и превращение последних в плазматические клетки.
Селезенка. Селезенка находится в левом верхнем квадранте живота (левом подреберье). У взрослого человека она весит около 150 г. Селезенка покрыта капсулой, которая, прорастая внутрь органа, формирует сеть перегородок. Внутренняя часть селезенки называется селезеночной пульпой. Через селезенку проходят кровеносные и лимфатические сосуды. В селезенке скапливается большое количество Т- и В-лимфоцитов, которые обеспечивают иммунологическую «проверку» крови, собирающейся со всего тела. В селезенке задерживаются эритроциты, где поврежденные, либо восстанавливаются, либо удаляются из кровотока. Селезенка также служит резервуаром для тромбоцитов, поступающих из костного мозга. По мере необходимости происходит замена циркулирующих в крови тромбоцитов.
Лимфатические узлы. Лимфатические узлы располагаются по ходу лимфатических сосудов и представляют собой маленькие овальные или почковидные образования длиной 0,1–2,5 см. Каждый лимфатический узел состоит из фолликулов. Основу фолликулов образуют В-лимфоциты, вокруг которых группируются Т-лимфоциты. Такое объединение Т- и В-лимфоцитов обеспечивает секрецию иммуноглобулинов и оптимальную защиту организма. В лимфатических узлах имеются также макрофаги, которые вместе с иммунокомпетентными клетками предотвращают развитие инфекционных заболеваний.
Иммунокомпетентные клетки. Клетки иммунной системы относятся к одной из групп клеток крови – лейкоцитам. Лейкоциты, как и другие клетки крови, возникают в гемопоэтической ткани. У плода на ранних стадиях развития гемопоэтическая ткань находится в печени и селезенке, на поздних – в печени, селезенке и костном мозге. У взрослого человека кроветворным органом является только красный костный мозг, расположенный в плоских костях.
В строме красного костного мозга располагаются стволовые клетки. Они обладают двумя важными свойствами: полипотентностью (т.е. могут дифференцироваться в разные клетки крови – эритроциты, лейкоциты, тромбоциты) и способностью к самовоспроизведению (т.е. могут образовывать идентичные самим себе клетки). Стволовые клетки превращаются в клетки-предшественницы лимфоидного (клетки-предшественницы лимфоцитов) и миелоидного (клетки-предшественницы эритроцитов, тромбоцитов и всех видов лейкоцитов, кроме лимфоцитов) ряда.
Молодые клетки костного мозга морфологически похожи друг на друга. Они, как правило, имеют крупные размеры и большое количество рибосом. По мере созревания часть клеточных органоидов редуцируется, появляются специфические признаки зрелых клеток крови. Зрелые клетки выходят в кровь и ткани.
Дифференцировка клеток регулируется гемопоэтическими факторами. Образование эритроцитов стимулирует гормон эритропоэтин, образующийся преимущественно в почках. Образование тромбоцитов контролируется тромбопоэтином (секретируется клетками печени). Дифференцировку лейкоцитов в разные формы регулируют местные гуморальные факторы, образующиеся в костном мозге: интерлейкины, факторы, стимулирующие колонии, и др.
Для некоторых гемопоэтических факторов известны кодирующие их гены, что позволяет получать их методами генной технологии и использовать для лечения некоторых гематологических заболеваний.
После рождения развитие первичных полипотентных стволовых клеток и миелопоэз (образование клеток миелоидного ряда) происходят в костном мозге, лимфопоэз – в тимусе, селезенке и лимфатических узлах, лимфоидной ткани, ассоциированной с пищеварительной системой, включая миндалины, аденоиды, пейеровы бляшки кишечника.
Количество лейкоцитов в 1 л крови взрослого человека колеблется от 4×109 до 9×109, и подвержено суточным и сезонным колебаниям, зависит от баланса гормонов, витаминов и других факторов. Увеличение количества лейкоцитов называется лейкоцитозом, уменьшение – лейкопенией.
Согласно гистологической классификации лейкоциты делятся на две группы: зернистые (гранулоциты) и незернистые (агранулоциты). К гранулоцитам относятся нейтрофилы, эозинофилы и базофилы; к агранулоцитам лимфоциты и моноциты.
Процентное соотношение разных форм лейкоцитов называют лейкограммой, или лейкоцитарной формулой. У взрослого человека нормальной является следующая лейкограмма: нейтрофилы – 46–76%; эозинофилы – 1–5%; базофилы – 0–1%; лимфоциты – 18–40%; моноциты – 2–10%. У детей до 5 лет физиологической нормой является доля лимфоцитов в крови до 80%, 5–14 лет – до 50%. Из общей популяции лимфоцитов крови на Т-лимфоциты приходится около 80%, на В-лимфоциты около 15%, на естественные киллеры примерно 5%.
У млекопитающих сформировалось два типа иммунитета – клеточный и гуморальный. Клеточный иммунитет опосредуется Т-лимфоцитами, гуморальный – В-лимфоцитами.
Родоначальники Т-лимфоцитов образуются в костном мозге. Оттуда они мигрируют в тимус, где приобретают способность реагировать на антигены. В тимусе происходит постоянная селекция лимфоцитов: уничтожаются агрессивно настроенные против «своих» белков и сохраняются реагирующие на «чужие» белки.
Созревание В-лимфоцитов происходит в костном мозге. Затем В-лимфоциты мигрируют во вторичные лимфоидные органы: печень, селезенку, лимфатические узлы. В этих органах может продолжаться и завершаться дифференцировка В-лимфоцитов.
Каждая В-клетка генетически запрограммирована на синтез поверхностного рецептора к одному антигену. После распознавания антигена В-лимфоциты начинают делиться и дифференцироваться, создавая клоны плазматических клеток. Плазматические клетки синтезируют иммуноглобулины (антитела) одного определенного вида, представляющие собой крупные растворимые молекулы гликопротеидов. Иммуноглобулины циркулируют в крови, тканевой жидкости и связываются с антигенами на поверхности микроорганизмов. Меченые антителами микроорганизмы легче уничтожаются фагоцитами. Кроме того, антитела активируют комплемент, разрушающий мембрану бактериальных клеток.
В популяциях Т- и В-лимфоцитов есть клетки иммунологической памяти. Они образуются из Т- и В-лимфоцитов, отреагировавших на антиген, но не дифференцировавшихся в клетки-эффекторы или клетки, продуцирующие иммуноглобулины. Клетки памяти хранят информацию о структуре антигена, однажды попавшего в организм. Такие клетки живут много лет и находятся в состоянии постоянной готовности к быстрому и эффективному ответу при повторном внедрении в организм данного антигена. С этим связана возможность вакцинации против инфекций: в ответ на введение вакцины, содержащей антигены, в организме вакцинированного формируется иммунологическая память и способность отреагировать на последующую встречу с таким же антигеном ускоренным и усиленным иммунным ответом.
Морфологически различить Т- и В-лимфоциты под световым микроскопом невозможно. Под электронным микроскопом зрелые Т-лимфоциты имеют, как правило, гладкую поверхность, а В-лимфоциты – ворсинчатую, т.к. несут на поверхностной мембране вырабатываемые ими иммуноглобулины.
Естественные киллеры (ЕК) – отдельная популяция лимфоцитов, существующая наряду с Т- и В-клетками. Основная их функция – сохранение гомеостаза в организме позвоночных на генетическом уровне. ЕК регулируют дифференцировку клеток организма, уничтожают (лизируют) клетки с генетическими дефектами и пораженные внутриклеточными паразитами (вирусами и т.п.). ЕК препятствуют попаданию разнообразной микрофлоры из ротовой полости, кишечника, носовой полости, носоглотки, легких в кровь и другие ткани организма. Они первыми включаются в реакции на чужеродные агенты без предварительной иммунизации, т.е. обеспечивают врожденный иммунитет.
Для осуществления своих функций ЕК располагают рецепторами, обеспечивающими возможность межклеточных контактов, реакций на цитокины, гормоны, нейромедиаторы. Они сами способны вырабатывать огромное количество биологически активных веществ. Получив сигнал об угрозе нарушения генетически обусловленного постоянства внутренней среды, ЕК «включают» не только собственные защитные средства, но также те, которыми располагают иммунная, эндокринная и нервная системы. Вступая в контакт с нейронами или клетками эндокринной системы, ЕК сами «обучаются» нейроэндокринной регуляции.
На внутриутробных стадиях развития организма и после рождения способы образования ЕК различаются. В эмбриональном периоде предшественником ЕК является гемопоэтическая стволовая клетка печени, которая мигрирует в тимус и там дифференцируется либо в ЕК, либо в дендритные клетки или Т-лимфоциты. После рождения ЕК образуются из полипотентной стволовой клетки костного мозга. Через несколько этапов дифференцировки происходит формирование зрелого ЕК – большого гранулярного лимфоцита.
Для выполнения своих функций созревшие в центральных органах иммунитета ЕК, должны пройти дозревание в периферических органах иммунной системы. После этого ЕК способны синтезировать интерферон и проявлять цитотоксическую активность.
Зрелые ЕК распространены по всему организму. Депо этих клеток в селезенке и печени поддерживают оптимальное количество ЕК в крови и лимфе. Из кровеносных и лимфатических сосудов ЕК попадают в различные органы, где контролируют генотип клеток. Если от клеток, ведущих надзор за генетической чистотой организма, поступает сигнал о неблагополучии, происходит массовый выход ЕК из депо. Цитолиз генетически измененных клеток является сигналом для ИКК (Т- и В-лимфоцитов).
Выделяют два основных иммунных процесса: врожденный (не изменяющийся) и приобретенный (адаптивный, приспособительный).
Врожденный иммунитет появился на ранних этапах эволюции: до способности распознавать свои белки и формировать клетки иммунной памяти. Врожденный иммунитет реализуется через клеточные и гуморальные механизмы. Его обеспечивают ЕК, макрофаги, нейтрофилы, дендритные клетки, способные к фагоцитозу и цитолизу. Гуморальными факторами врожденного иммунитета являются естественные антитела, комплемент, лизоцим и другие ферменты. Факторы врожденного иммунитета контролируются генами зародышевой линии, передаются по наследству и не изменяются в течение жизни.
Приобретенный иммунитет является следствием перегруппировки сегментов небольшого набора генов зародышевой линии, передаваемых по наследству и ответственных за синтез иммуноглобулинов (антител) В-лимфоцитами и рецепторов на Т-лимфоцитах. В результате перегруппировки может создаваться огромное число распознающих элементов, перекрывающих все существующие в природе антигены.
В процессе развития лимфоцитов в центральных органах иммунной системы образуются клетки, имеющие рецепторы к любому антигену. Каждая такая клетка может стать родоначальницей клона, готового бороться с чужеродным образованием. Потомство получает от родителей только набор зародышевых генов, а процесс перегруппировки происходит на ранних этапах онтогенеза у каждого организма индивидуально. Поэтому каждый организм, в зависимости от того как прошел процесс перегруппировки, может иметь свою разновидность иммунитета.
Особенности функционирования иммунной системы в разные периоды жизни
Зародыши всех млекопитающих, в том числе человека, с самых ранних стадий развития содержат чужеродные для материнского организма гены (антигены), полученные от отца. Теоретически иммунная система матери должна реагировать на клетки зародыша проявлением иммунитета.
В случае развития специфического иммунитета Т-лимфоциты материнского организма активируются и стимулируют образование цитотоксических лимфоцитов. Вместе с естественными киллерами они начинают уничтожать клетки зародыша, и беременность прерывается. Однако такое явление встречается редко. Сохранение беременности при нормальном ее течении обеспечивают ряд механизмов. К их числу относятся следующие.
1. Изменение гормонального фона беременной женщины. С момента оплодотворения яйцеклетки и ее имплантации (закрепления) в матке начинается синтез одного из стероидных гормонов – прогестерона – желтым телом яичника (временной железой внутренней секреции, образовавшейся на месте выхода яйцеклетки). Прогестерон, как и другие стероидные гормоны, угнетает функции иммунной системы. Под влияние прогестерона лимфоциты беременной женщины вместо цитокинов начинают синтезировать вещества, угнетающие образование Т-лимфоцитов и проявление клеточного иммунитета. Кроме того, в геноме эмбриона имеются гены, ответственные за синтез специального белка, снижающего активность Т-лимфоцитов и естественных киллеров материнского организма.
2. Особенности плаценты, в частности синтез ею цитокинов, обеспечивающих преобладание гуморального иммунитета над клеточным и подавление активности естественных киллеров материнского организма, т.к. именно эти клетки наиболее активны в отторжении плода.
Снижение иммунной активности материнского организма по отношению к плоду не только не уменьшает, но даже повышает защиту беременной женщины от патогенных бактерий. В ее крови увеличивается количество активированных моноцитов и повышается уровень иммуноглобулинов. Вместе с тем организм беременной женщины оказывается плохо защищенным от вирусов и грибков.
Развитие иммунной системы продолжается на протяжении всего детства. В детском возрасте есть периоды риска для иммунной системы и становления ее функций, которые называют критическими периодами.
Первый критический период – период новорожденности (первые 2 недели жизни ребенка). В этот период защиту детского организма обеспечивают иммуноглобулины матери, полученные с молозивом и грудным молоком. Чувствительность новорожденного к инфекциям очень высока.
Второй критический период – 4–6 месяцы жизни. В это время происходит утрата пассивного иммунитета, получаемого с грудным молоком, и становление собственных активных иммунных реакций. В этот период возрастает чувствительность ребенка ко многим воздушно-капельным и кишечным инфекциям.
Третий критический период – второй год жизни. Становление иммунной защиты еще не произошло, а контакты ребенка с окружающим миром возрастают, поэтому остается высокой чувствительность организма к респираторным и кишечным инфекциям.
Четвертый критический период – 6–7 лет. В этот период уменьшается абсолютное и относительное количество лимфоцитов в крови, приближаясь к показателям взрослого человека. Чувствительность к инфекциям детей этого возраста все еще высока.
Пятый критический период – подростковый возраст. Увеличение уровня половых гормонов в крови, связанное с половым созреванием, сочетается с уменьшением массы лимфоидных органов. Угнетается клеточный иммунитет, и как следствие повышается чувствительность к вирусным инфекциям.
Стимулом для развития иммунной системы после рождения являются в основном микроорганизмы окружающей среды, поступающие в организм через кожу, слизистые оболочки дыхательных путей, желудочно-кишечный тракт. Быстрое развитие иммунной системы сопровождается увеличением массы лимфатических узлов, которые заселяются Т- и В-лимфоцитами.
Иммунный статус взрослого человека определяется индивидуальными особенностями развития и созревания иммунной системы в детстве. Резервные возможности иммунной системы полностью реализуются при грудном вскармливании детей. Иммуноглобулины женского молока повышают защиту всех слизистых оболочек ребенка (желудочно-кишечного тракта, дыхательной и мочеполовой систем), препятствуя прикреплению бактерий и вирусов к эпителию. Иммуноглобулины и цитокины грудного молока стимулируют иммунную систему ребенка.
Один из компонентов грудного молока – лактоферрин стимулирует иммунологические функции ребенка, взаимодействуя с ДНК его иммунокомпетентных клеток. Грудное вскармливание препятствует развитию аллергических и аутоиммунных заболеваний.
В подростковом возрасте снижение иммунитета может быть связано с неправильным питанием, гипоксией, психоэмоциональным стрессом, курением и т.п. Одним из возможных факторов ослабления гуморального иммунитета могут стать интенсивные физические нагрузки, приводящие к острому и хроническому утомлению. При этом происходит ослабление иммунной системы, проявляющееся прежде всего в снижении количества В-лимфоцитов и концентрации циркулирующих в крови иммуноглобулинов, вплоть до исчезновения иммуноглобулинов отдельных классов. У профессиональных спортсменов в пике формы на ответственных соревнованиях зарегистрировано явление, получившее название феномена исчезающих антител. В этот период резко повышается чувствительность к инфекциям, и в случае заражения высока вероятность неблагоприятного исхода заболевания, вплоть до гибели больного.
У людей зрелого возраста сохраняется высокая функциональная активность костного мозга, селезенки, лимфатических узлов, а тимус подвергается значительной инволюции.
В пожилом и старческом возрасте происходит почти полная утрата тимуса. От него остается небольшая часть изменившихся клеток – около 10% от исходного их количества. Утрата тимуса компенсируется успевшими накопиться в организме долгоживущими Т-лимфоцитами памяти. Важным источником дифференцировки Т-лимфоцитов становится лимфоидная ткань. Количество циркулирующих В-лимфоцитов и концентрация иммуноглобулинов в старости не изменяются. В связи с инволюцией тимуса, уменьшением числа Т-лимфоцитов и их активности снижается клеточный иммунитет. Поэтому в возрастном диапазоне от 15 до 90 лет частота развития раковых заболеваний возрастает в 240 раз. У долгожителей выявлена сохранность механизмов клеточного иммунитета: количество Т-лимфоцитов, их разнообразие, доля клеток памяти, активность цитокинов у лиц старше 90 лет мало отличаются от таковых у более молодых людей.
Методическое сопровождение курса
Формы дифференцированного обучения анатомии, их применение
В современной общеобразовательной школе широкое распространение получило дифференцированное обучение, учитывающее индивидуально-типические особенности школьников (интересы, склонности, психологический тип восприятия информации и др.). В ходе изучения наиболее сложных анатомо-физиологических вопросов курса возможна следующая дифференциация:
– внешняя: для разных классов объем и содержание учебного материала и организация учебной деятельности школьников могут различаться;
– внутренняя: в одном классе предлагаются разные уровни сложности для облегчения усвоения знаний, методы и методические приемы, адаптирующие содержание образования для разных групп школьников.
Рассмотрим конкретные примеры.
Внешняя дифференциация. Материал данной лекции расширяет представления о составе крови, строении лимфатической системы, видах иммунитета, профилактике вирусных инфекций, в том числе СПИДа. В гимназических, лицейских классах и классах повышенного уровня обучения педагог имеет возможность углубить знания учеников по этой теме. Для объяснения нового материала используется монологический рассказ педагога или эвристический метод – частично поисковая беседа.
Монологический рассказ учителя может быть посвящен развитию иммунной системы человека или особенностям ее функционирования.
Эвристический метод предполагает определение логической последовательности изложения материала, сформулированной в форме вопросов, обращенных к школьникам. При затруднении с ответом педагог предлагает наводящие вопросы и задания или сам дает необходимые пояснения. Так, для организации поисковой беседы по теме «Лимфатическая система» основной познавательной задачей является выяснение особенностей ее строения и функционирования. Перечень вопросов и заданий возможен следующий:
1. Перечислите форменные элементы крови и укажите их значение.
2. Каким должен быть состав лимфы? Аргументируйте свой ответ.
3. Каковы основные функции кровообращения?
4. В чем различие функций кровообращения и лимфообращения?
5. Какова связь лимфатической и кровеносной систем?
6. Назовите органы, образующие систему кровообращения.
7. Выясните строение лимфатической системы.
В ходе беседы используются пояснения из текста предлагаемой лекции.
Школьники в классах повышенного уровня зачастую сами проявляют инициативу в подготовке сообщений. В этом случае затруднение вызывает поиск и отбор необходимой информации. Педагог организует подготовку докладов или стендовых сообщений по предлагаемым в лекции материалам.
Внешняя дифференциация в коррекционных классах направлена на адаптацию сложных вопросов курса и отбор личностно ориентированных знаний. Повышение мотивации к процессу обучения позволяет облегчить усвоение учебного материала. Перед объяснением тем, вызывающих наибольшие затруднения, следует поставить проблемный вопрос, имеющий практическую направленность, например: «Объясните с точки зрения физиологии, почему кошки и собаки зализывают раны», «Какие факторы отрицательно влияют на иммунитет подростка?», «Почему пожилые люди (ваши бабушки и дедушки) чаще болеют и как им поддержать свое здоровье?»
Другой способ адаптации знаний заключается в изложении сущности физиологических механизмов при небольшой терминологической насыщенности: число наиболее сложных для восприятия узкоспециализированных терминов следует сократить или подробно пояснить их, найти аналогии с известными понятиями. Например, для расшифровки или замены термина «Т-лимфоциты» используем понятие «лимфоциты, обеспечивающие клеточный иммунитет», а вместо термина «В-лимфоциты» используем понятие «лимфоциты, обеспечивающие гуморальный иммунитет».
Значительная сложность приводимого в лекциях анатомо-морфологического материала связана с его теоретичностью, умозрительностью. Облегчение восприятия сложного материала обеспечивается наглядностью, которая представлена как традиционными иллюстрациями (рисунки, схемы, фотографии), так и современными средствами обучения (компьютерные технологии, CD-диски и др.).
Таким образом, урок на сходную тему в разных классах может иметь разное наполнение, предлагать отличающиеся методы обучения и даже организацию учебной деятельности в целом. Например, для организации урока «Виды иммунитета» можно использовать традиционную структуру, урок с эвристической беседой, урок с элементами ролевой игры и др.
Внутренняя дифференциация предполагает адаптацию содержания учебного материала для учащихся одного класса. Она осуществляется по разным основаниям, в зависимости от выделяемых групп. Так, педагоги определяют разные уровни владения знаниями и навыками (базовый, повышенный и высокий). Школьные психологи предлагают распределение учеников на группы в зависимости от основного канала восприятия информации (визуалы – орган зрения, аудиалы – орган слуха, кинестетики).
При объяснении новой темы следует учитывать разные психологические особенности, т.е. словесные методы обучения необходимо подкреплять демонстрациями, практическими работами, а также предлагать разные способы деятельности с учебным материалом. Так, при закреплении материала можно предложить разные типы заданий при работе с текстом: поиск ответов на поставленные вопросы, заполнение таблицы, составление схемы, решение проблемной задачи, например: «Составь схему видов иммунитета», «Ответь на вопрос: «Чем обусловлен клеточный и гуморальный иммунитет?», «Реши проблемную задачу: «Какие способы повышения иммунитета новорожденного ребенка применяют?»
Перспективный методический прием при проверке полученных знаний и навыков – использование карточек, в которых учтен уровень освоения материала. Предлагаемые задания отличаются не только по уровню сложности, но и по форме. Для карточек базового уровня предлагаются готовые тексты, схемы или иллюстрации, опираясь на которые школьник проявляет знания и умения. Повышенный уровень предусматривает репродуктивные и продуктивные задания, а высокий – решение творческих задач. Например, карточка базового уровня «Прочти текст об иммунитете. Укажи отличительные характеристики разных видов иммунитета». Повышенный уровень: «1. Дай определение понятию иммунитет. 2. Перечисли известные тебе виды иммунитета.
3. Объясни, как формируется активный иммунитет». Высокий уровень: «1. Почему лимфоцит называют структурной и функциональной единицей иммунной системы? 2. Опиши сущность механизма клеточного иммунитета. Приведи пример».
Итак, дифференциация процесса обучения анатомии предусматривает внешнюю и внутреннюю формы, предполагающие разный объем содержания учебного материала, применение вариативных методов и приемов обучения, а также разных форм организации учебного процесса.
ЛИТЕРАТУРА
1. Галактионов В.Г. Иммунология. – М.: Нива России, 2000. – 488 с.
2. Хаитов Р.М., Игнатьева Г.А., Сидорович И.Г. Иммунология. – М.: Медицина, 2000. – 432 с.
3. Петров Р.В. Иммунология. – М.: Медицина, 1987. – 416 с.
4. Вершигора А.Е. Основы иммунологии. – Киев: Вища школа, 1980. – 504 с.
Вопросы и задания
1. Составьте глоссарий, т.е. словарик терминов лекции. Давая свои пояснения к понятиям, укажите особенности строения и функционирования в организме тех образований, характеристику которых вы даете. Постарайтесь не дублировать материал, а сделать собственное краткое описание.
2. Заполните таблицу 1 «Строение иммунной системы человека».
3. Сравните механизм гуморального и клеточного иммунитета по плану:
– какие клетки принимают участие;
– какие клетки или образования являются мишенью;
– в чем заключается физиологический смысл иммунитета.
4. Охарактеризуйте этапы функционирования иммунной системы человека, заполнив таблицу 2.
5. В чем сущность процесса дифференциации?
6. Назовите основные формы дифференциации. Какие из них вы применяете?
7. Составьте карточки на основе принципа дифференциации для разных уровней: базового, повышенного и высокого.
Таблица 1. Строение иммунной системы человека
|
Орган иммунной системы, или анатомическое образование |
Особенности его строения |
Продуцируемые клетки |
Функционирование в организме человека |
Таблица 2. Этапы функционирования иммунной системы
|
Возрастной период |
Особенности функционирования иммунной системы |
Изменение иммунного статуса (восприимчивость к заболеваниям) |
Продолжение следует
В статье мы расскажем:
- Виды иммунитета
- Передается ли иммунитет по наследству
- Иммунитет и питание
- Влияние физической активности и здорового сна на иммунитет
Иммунитет – это слово произошло от латинского immunitas, что означает неприкосновенность. Этот термин использовался еще в прошлые века и означал освобождение крестьян от податей. В наше время «иммунитет» имеют дипломаты, что означает их неприкосновенность.
Биологический смысл иммунитета — защита. Иммунная система критически важна для выживания организма. Постоянно мы сталкиваемся с различными чужеродными микроорганизмами, которые не прочь «захватить» нас и воспользоваться нашими ресурсами. Но целая армия иммунных клеток противостоит этому ежесекундно.
Основная роль иммунитета — распознать чужеродную генетическую информацию и устранить ее носителей, тем самым сохранив постоянство внутренней среды. Организация иммунной системы сложная и многоуровневая, и состоит из взаимосвязанных элементов. Иммунным клеткам необходимо различать свои структуры и чужие антигены.

Антиген — это генетически чужеродные макромолекулы для организма, это могут быть белки, полисахариды, нуклеиновые кислоты и их комплексы. Помимо этого, иммунная система должна контролировать внутренние процессы, не допуская распространения клеток с мутациями, например перерожденных клеток злокачественных опухолей. Также должны остаться в сохранности представители дружественной микрофлоры кишечника. И конечно, свои клетки не должны быть атакованы собственной иммунной системой.
Эволюционно иммунная система млекопитающих самая сложная. Потому что бактерии, попадая в теплый организм, очень легко размножаются. И от них нужна защита.
Как клетки узнают, что попал «чужой»?
Есть несколько групп патогенных агентов, на которые реагирует иммунная система:
-
Патоген-ассоциируемые молекулярные паттерны (Pathogen-associated molecular patterns — PAMP). Это характерные для вирусов, простейших, грибов и паразитов молекулярные группы. Они не встречаются в организме-хозяине и рассматриваются как маркеры опасности проникновения в организм чужеродного агента, обладающего биологической агрессией. Это врожденный иммунитет.
-
Антигены. Это высокомолекулярные молекулы, которые способны стимулировать специализированные лимфоидные клетки, активируя иммунный ответ. Распознавание антигенов — индивидуальный процесс и относится к адаптивному иммунитету.
-
Стрессорные молекулы. Это особые молекулы, которые синтезируются при клеточном стрессе и говорят об опасности эндогенного происхождения. Они распознаются рецепторами некоторых лимфоцитов.
Чужеродность — очень важное свойство патогенов, на которых направлены реакции иммунитета. Поэтому очень важны барьеры, цель которых отгородить внутреннюю среду от внешней. Эту роль выполняют кожа и слизистые оболочки.
Виды иммунитета
Иммунитет можно разделить на естественный иммунитет и искусственный. Естественный иммунитет в свою очередь делят на врожденный и приобретенный иммунитет.
Врожденный вид иммунитета, он же наследственный, конституциональный или генетический. Это неизменная, наследственная врожденная защита. Он не зависит от предыдущего контакта с возбудителями заболеваний и чужеродными веществами. Врожденный иммунитет зависит от неспецифических механизмов, молекулярной защиты и активности фагоцитирующих клеток.
Врожденный вид иммунитета может быть неспецифическим, когда он указывает на степень устойчивости к инфекции в целом или специфическим, когда речь идет об устойчивости к конкретному патогену.
Врожденный вид иммунитета может рассматриваться на уровне вида, расы и индивидуума. В видовом иммунитете все особи вида рождаются с устойчивостью к инфекционному агенту, который вызывает заболевание у другого вида. Например, люди обладают иммунитетом к большинству инфекционных агентов, вызывающих заболевания у домашних животных (например чума крупного рогатого скота или оспа лошадей). Аналогичным образом животные демонстрируют врожденный иммунитет ко многим человеческим болезням. Механизмы видового иммунитета четко не изучены, но возможно, это связано с физиологическими и биохимическими различиями между тканями различных видов хозяев, которые определяют, может ли инфекционный агент размножаться или нет.
В пределах одного вида разные расы демонстрируют различия в восприимчивости к инфекциям. Это известно как расовый иммунитет. Примером расового иммунитета является устойчивость к сибирской язве у алжирских овец, в то время как овцы в целом не имеют иммунитета к сибирской язве. Интересный пример генетической устойчивости к малярии Plasmodium falciparum наблюдается в некоторых частях Африки, где распространена серповидно-клеточная анемия. Наследственная аномалия эритроцитов дает иммунитет к заражению малярийным плазмодием.
Также интересно, что люди обладают разной чувствительностью к кори. Когда-то эта болезнь опустошила острова Тихого океана. Естественный отбор, возникший в результате воздействия вируса кори на многие поколения, привел к тому, что происходит более частое наследованию генов, которые обеспечивают определенную устойчивость к этому вирусу.
Естественный иммунитет также зависит от возраста. Повышенная восприимчивость плода к инфекциям связана с незрелостью иммунной системы. Плод в матке обычно защищен материнскими антителами, но некоторые патогены (токсоплазма, вирус краснухи, цитомегаловирус, герпес-вирусы, вирус гепатита В, вирус иммунодефицита человека и т.д.) пересекают плацентарный барьер и вызывают соответствующие заболевания. Эпителий влагалища девочек препубертатного возраста более восприимчив к гонококковой инфекции. А полиомиелит и ветряная оспа, обычно протекают тяжелее у взрослых. Пожилые люди подвержены инфекциям из-за ослабления иммунной системы.
Механизмы врожденного иммунитета
Первой линией защиты являются физические барьеры — это кожа и слизистые.
Неповрежденная кожа практически непроницаема для бактерий. Низкий уровень pH и жирные кислоты делают ее некомфортной средой для большинства бактерий, исключая дружественные микроорганизмы, которые защищают наш покров. А постоянно отслаивающийся верхний слой кожи также снижает бактериальную нагрузку.
Слизистые оболочки — менее прочный барьер. Бактерии, которые попадают на слизистые, либо проглатываются и обезвреживаются в желудке, или «выгоняются» наружу при кашле или с током жидкости.
Усиливают защиту клеток кожи и слизистых антибактериальные вещества:
-
Лизоцим. Гидролитический фермент, содержится в слизистых выделениях и слезах. Способен расщеплять стенку бактериальных клеток.
-
Перекись водорода в слюне — вызывает разрушение бактерий.
-
Нормальная кислотность желудочного сока.

Есть и другие средства неспецифического вида иммунитета:
- Интерферон. Эта молекула вырабатывается клетками при вирусной инфекции. Сам интерферон не влияет на вирус, но дает сигнал соседним клеткам о заражении, и они не дают вирусу распространяться. Также он привлекает внимание клеток иммунной системы.
- Иммуноглобулины. На слизистых присутствуют все виды иммуноглобулинов, но больше всего иммуноглобулина А. Он препятствует прикреплению бактериальных клеток, что является первым шагом к распространению инфекции.
- Система комплемента. Это группа сывороточных белков, которые циркулируют в крови в неактивном состоянии. Разнообразные специфические и неспецифические иммунологические механизмы могут преобразовывать неактивную форму этих белков в активную, что приводит к разрушению бактерий, клеток и вирусов; стимулированию неспецифического вида иммунитета; запуску воспаления; выделению различных регуляторных молекул и выведения связанных патогенов из организма.
- Цитокины и хемокины: Цитокины секретируются лейкоцитами и другими клетками и участвуют во врожденном, адаптивном иммунитете и воспалении. Цитокины действуют неспецифично по отношению к патогенам, вызывая широкий спектр биологической активности. Хемокины — это подгруппы цитокинов, обладающих низкой молекулярной массой, участвующие в хемотаксисе (миграции, вызванной химическими веществами).
- Симбиотическая флора: она предотвращает распространение инфекции в организме. Изменение дружественной флоры может привести к вторжению посторонних микробов, вызывая серьезные заболевания, такие как стафилококковый и клостридиальный энтероколит после приема антибиотиков.
Наша флора, если она представлена “хорошими” бактериями, не дает патогенам “захватить” организм. Хорошую флору нужно выращивать и правильно кормить. Необходимо разнообразно питаться: чем разнообразней будет ваш рацион, тем разнообразней будет флора! Хорошие бактерии любят сложные углеводы (цельнозерновые крупы), клетчатку из овощей, фруктов, ягод, орехов, семян. А патогенам по вкусу простые сахара. Поэтому если в вашем рационе много простых углеводов — это повод задуматься о своем питании. Патогенные бактерии и грибы используют в качестве еды молекулы глюкозы (сахара). Мы кормим не только себя, надо помнить об этом.
Также необходимо минимизировать прием антибиотиков, использовать их строго по назначению врача.
Дружественные бактерии защищают хозяина с помощью различных механизмов:
-
Конкуренция за доступную пищу и тканевые рецепторы.
-
Выработка токсичных веществ, которые действуют на патогены: жирные кислоты и бактериоцины.
-
Стимуляция выработки антител.
Если первая линия защиты не сработала, в ход идут другие механизмы.
Иммунные клетки, видя патоген, пытаются поглотить и переварить его. Это явление называется фагоцитоз. Фагоцитоз препятствует распространению инфекции в кровеносное русло. Есть 3 типа клеток, которые занимаются этой «уборкой». Это нейтрофилы, макрофаги и, в гораздо меньшей степени, эозинофилы.
Если и это не сработало, и патоген вызвал повреждение ткани, то происходит воспалительная реакция. Она включает в себя:
- приток крови к пораженному месту;
- увеличивается количество межклеточной жидкости (отек), при этом разбавляются ферменты и токсины;
- выделяются хемотаксические факторы, которые привлекают иммунные клеткиё;
- происходит формирование фибринового барьера, который ограничивает воспаление;
- происходит активация комплемента и адаптивного иммунитета.
Активация врожденного иммунитета обеспечивает быстрый ответ на вторжение. Если по каким-то причинам он не сработал, включается действие адаптивного иммунитета.
Специфический иммунитет
Специфический, или адаптивный иммунитет, способен распознавать и избирательно уничтожать чужеродные микроорганизмы или молекулы (антигены опухолей, трансплантированные антигены и т. д.). Это происходит благодаря гуморальному или клеточному иммунитету.
Активизация адаптивного иммунитета происходит не сразу, он не способен быстро среагировать при первом «знакомстве» с патогеном. Но после того, как иммунная система «опознала» чужеродный микроорганизм, при последующей встрече с ним она очень быстро развернет защиту. Это происходит благодаря клеткам-памяти, которые запоминают патогены и способы борьбы с ними.
Адаптивный вид иммунитета работает сообща с врожденным. Фагоцитирующие клетки, которые являются главным оружием неспецифического иммунитета, принимают активное участие в развертывании адаптивного иммунитета. И наоборот: гуморальные факторы, которые вырабатываются иммунокомпетентными клетками, усиливают действия фагоцитов, то есть влияют на неспецифический иммунитет.
Специфический иммунитет может быть естественным и искусственным.
Естественный специфический иммунитет человека, это вид приобретенного иммунитета, когда организм встречается с патогеном в повседневной жизни. Иногда этот приобретенный иммунитет сохраняется на всю жизнь, например при кори или ветряной оспе. В других случаях он недолговечен — сезонные ОРВИ, кишечные инфекции.
Искусственный специфический иммунитет возникает при вакцинации.
Пассивный иммунитет
Это вид приобретенного иммунитета, когда в организм человека вводят готовые гуморальные факторы защиты, или даже иммунные клетки.
Естественно приобретенный пассивный иммунитет возникает при передаче защитных антител от матери к плоду, а затем к младенцу. Материнские антитела передаются с грудным молоком, особенно много их в молозиве. Иммунитет у младенцев часто сохраняется до тех пор, пока ребенок находится на грудном вскармливании. Во время беременности некоторые материнские антитела также передаются через плаценту к плоду. Если у матери есть иммунитет к дифтерии, краснухе или полиомиелиту, то новорожденный будет временно невосприимчив к этим заболеваниям.
Искусственно приобретенный пассивный иммунитет возникает при введении антител в организм.
Адаптивный иммунитет человека построен на кооперации различных клеток. Для этого необходима концентрация клеток определенных типов в определенном месте. Это невозможно без формирования органной структуры. Различают центральные органы иммунной системы и периферические.
К центральным органам иммунной системы относят костный мозг и тимус. Именно здесь происходит созревание и дифференцировка клеток. Костный мозг является органом кроветворения. Еще он является местом, где сосредоточены клетки, продуцирующие антитела — плазматические клетки. Вообще лимфоциты разделяют на 3 типа:
- Т-клетки отвечают за клеточный иммунитет (Т-киллеры), также есть субпопуляция иммунорегуляторных клеток (Т-супрессоры) и клеток-помощников (Т-хелперы).
- В-клетки ответственны за гуморальный иммунитет (синтез антител).
- NK-клетки — «натуральные киллеры», клетки врожденного иммунитета. Осуществляют уничтожение чужеродных клеток.
В тимусе, или вилочковой железе, происходит развитие и созревание Т-клеток. В-клетки созревают в печени плода и в костном мозге плода и взрослого человека.
Периферические лимфоидные ткани состоят из хорошо организованных инкапсулированных органов — селезенки и лимфатических узлов и различных скоплений лимфатических клеток, которые расположенных по всему телу. Особенно их много на слизистых оболочках. После созревания в первичных лимфоидных органах (тимус и костный мозг) лимфоциты мигрируют по крово- и лимфотоку, накапливаясь в соответствующих местах в лимфатических узлах и селезенке. После антигенного стимула они участвуют в иммунном ответе. Лимфоциты из селезенки реагируют на антигены, циркулирующие в крови. А лимфатические узлы защищают организм от антигенов, поступающих с поверхности кожи или внутренних органов. Система слизистых оболочек защищает от антигенов, поступающих в организм непосредственно через слизистые эпителиальные поверхности, выстилающие кишечный тракт, дыхательные пути и мочеполовой тракт. Основным эффекторным механизмом является секреторный иммуноглобулин А (sIgA), секретируемый непосредственно на слизистую оболочку.
Все лимфоциты обладают уникальным рецептором, позволяющим распознавать различные антигены. В нашем организме циркулируют десятки тысяч разных лимфоцитов. Для активации адаптивного иммунитета человека необходимы сигналы со стороны врожденного иммунитета — антиген-презентирующих клеток. Это макрофаги и дендритные клетки. Они «представляют» участок чужеродного микроорганизма, и если его способен распознать лимфоцит, то происходит цепная реакция. В зависимости от типа патогена активируется клеточный или гуморальный иммунитет.
Клеточный иммунитет направлен на физическое уничтожение клетки. Работают клетки-киллеры, которые буквально «дырявят» оболочку патогена, вызывая его гибель. При гуморальном иммунитете вырабатываются антитела, специфичные к данному патогену. Антитела обладают различными свойствами. Они могут как сами блокировать патоген (нейтрализация, распад патогена, ферментативное разрушение), так и опосредованно влиять на уничтожение путем активации неспецифического вида иммунитета или усиления клеточного иммунитета человека.
После встречи с патогеном и активации специфического иммунитета человека происходит взрывной рост необходимого клона лимфоцитов. После того, как патоген удален, остаются клетки памяти, которые вновь делятся, если патоген попал в организм повторно.
Передается ли иммунитет по наследству?
Конечно, всю генетическую информацию мы получаем в наследство. И иммунитет — не исключение. Мы может наследовать предрасположенность к каким-либо заболеваниям, но заболеем мы или нет, зависит еще от факторов внешней среды. Поэтому так важно создавать себе максимально здоровую среду. Есть заболевания иммунной системы, которые связаны с генетическими аномалиями. Эти заболевания называются «Первичные иммунодефициты». К ним относят синдром Вискотта-Олдрича, синдром Гитлина, синдром «голых лимфоцитов» и другие. Поражение иммунной системы на уровне генетики всегда очень тяжело переносятся.
Нашу дружественную флору мы тоже наследуем. И тут имеет значение, каким образом ребенок появился на свет. Если через естественные родовые пути, то микробиота его кишечника будет заселена лактобактериями мамы. Если же через Кесарево сечение, то тогда его микробиом в первые недели будет напоминать микробиом кожи. В данном случае необходима поддержка пробиотическими препаратами.

Иммунитет и питание
Кожа и слизистые оболочки являются первым барьером и важной частью иммунной защиты. Поэтому все, что влияет на кожу, влияет и на иммунную систему:
- целостность кожных покровов и слизистых;
- скорость заживления ран;
- проницаемость слизистых барьеров;
- толщина слизистого слоя в кишечнике.
Может это все не столь очевидно, но питание играет очень важную роль в иммунной защите. Гуморальные факторы специфического иммунитета человека, иммуноглобулины, являются гликопротеинами. Это комплекс белка и углевода. Это значит, что уровень защиты от патогенов зависит от адекватного поступления белка с пищей, а также от наличия ферментов и кофакторов белкового обмена.
Вся иммунная система имеет нейроэндокринную регуляцию. Это значит, что она регулируется одновременно нервной системой и железами внутренней секреции. А на работу этой системы влияет пищевой статус.
Например, гормон лептин, который вырабатывается жировыми клетками, регулирует аппетит, активность Т-клеток и стимулирует клетки врожденного иммунитета.
Точечные советы по питанию, которые
повысят уровень твоей энергии на 10 из 10
От ТОПовых нутрициологов МИИН
Получить советы

Костный мозг — орган, который потребляет очень много энергии и нутриентов, потому что он ежедневно производит миллиарды клеток крови, и клеток иммунной системы в том числе. Этот процесс зависит от наличия всех необходимых компонентов, которые должны поступать с пищей.
Рассмотрим роль отдельных пищевых компонентов, которые влияют на иммунитет человека.
Белок и аминокислоты
Белок является основным строительным материалом. Многие гормоны являются белками, иммуноглобулины тоже имеют белковую природу. Исследования показали, что при недостаточном поступлении белка снижается количество Т-хелперов. Состав белка тоже важен. Незаменимые аминокислоты должны поступать в достаточном количестве. При нехватке любой из незаменимых аминокислот, снижается функция гуморального иммунитета. При воспалительных заболеваниях будут особенно востребованы серосодержащие (метионин и цистеин) аминокислоты, которые участвуют в синтезе глутатиона — одного из важнейших антиоксидантов. Аргинин является условно-незаменимой аминокислотой, но его применение у пациентов после операций, позволило сократить время пребывания в стационаре. Аргинин является донором азота для синтеза оксида азота. Оксид азота токсичен для некоторых патогенов, его вырабатывают макрофаги. Следовательно аргинин влияет на неспецифический вид иммунитета. Усиление иммунитета человека приписывается также глутамину и таурину.
Жирные кислоты
Правильное соотношение насыщенных и ненасыщенных кислот в организме обеспечивает адекватную иммунную функцию. Так, например, полиненасыщенная кислота омега-3 входит в состав мембран всех иммунных клеток. Клинические исследования влияния омега-3 на иммунитет показали, что включение в рацион дошкольников рыбьего жира, содержащего преимущественно омега-3, способствует снижению частоты заболеваемости ОРВИ, а также повышению концентрации иммуноглобулинов IgA, IgM, IgG в крови.
Витамин С
Этот витамин часто пьют во время сезонных ОРВИ, стараясь поднять иммунитет. Однако исследования показали, что витамин С не способен предотвратить заражение вирусом, но его прием может снизить время болезни, благодаря антиоксидантной активности. Усиливает выработку иммуноглобулинов и активность макрофагов.

Витамин А
При дефиците этого витамина нарушается целостность кожных покровов и слизистых оболочек, что нарушает первую линию защиты. Часто рецидивирующий халязион — образование в толще века — коррелирует с низким уровнем витамина А в сыворотке. Также этот витамин усиливает рост Т-клеток. Является антиоксидантом.
Витамин Е
Витамин Е — это собирательное название нескольких форм токоферолов и токотриенолов. Является антиоксидантом, и компонентом клеточных мембран. В мембранах иммунных клеток его относительно большее количество, так как эти клетки подвержены риску поражения свободными радикалами. Рандомизированное исследование приема витамина Е в течение 4 месяцев здоровыми пожилыми людьми продемонстрировало улучшение клинически значимых показателей функции Т-клеток
Витамин Д
Отвечает за формирование костной ткани, а также регулирует множество реакций в иммунной системе. Многие иммунные клетки содержат ферменты, активирующие витамин D. Эти реакции обеспечивают локальную активацию иммунитета человека. Многочисленные эпидемиологические отчеты связывают дефицит витамина D с повышенным риском хронических инфекций, в частности, микобактерий туберкулеза и аутоиммунных расстройств. Недавние исследования показали, что активный витамин D оказывает множественное воздействие на иммунную систему, включая увеличение фагоцитоза и активацию Т-клеток. Прием добавок ассоциировался со снижением риска аутоиммунных заболеваний.
Цинк
Дефицит цинка считается одним из самых распространенных дефицитов питания во всем мире. Это связано как с низким его содержанием в продуктах питания, так и с присутствием в фитиновой кислоты в пище (содержится в пшеничных отрубях, цельнозерновых крупах и многих сырых овощах). Фитиновая кислота связывает цинк и мешает его усвоению. Цинк является важным кофактором в более чем 90 реакциях обмена веществ. Дефицит цинка приводит к остановке созревания Т-клеток. Исследования показали, что недостаточные запасы цинка являются фактором риска развития пневмонии у пожилых людей. Восполнение запасов цинка способен восстановить нормальный иммунитет всего за 2 недели.
Влияние физической активности и здорового сна на иммунитет
Регулярная физическая активность способствует контролю веса, улучшает здоровье сосудов и в целом поддерживает иммунную систему. Интенсивные тренировки наоборот, оказывают краткосрочный угнетающий эффект на иммунитет человека.
При соблюдении циркадных ритмов и отходу ко сну в промежутке 22.00-23.00, происходит выработка важного гормона — мелатонина, способного защищать нас от вирусных инфекций. Параллельно снижается уровень гормона стресса — кортизола, в избытке оказывающего разрушающее действие на слизистые оболочки и иммунную систему организма.
Заключение
Иммунная система устроена очень сложно. В защите участвуют все виды иммунитета: естественный и приобретенный иммунитет, активный, пассивный. Наш организм как тонко настроенный инструмент. Точно знает, какую ноту сыграть в любой ситуации — кого пропустить, а против кого развязать сражение. Миллиарды клеток всегда готовы к защите наших границ и ежесекундно выполняют свою главную функцию — поддержание постоянства внутренней среды для нашей с вами жизни.