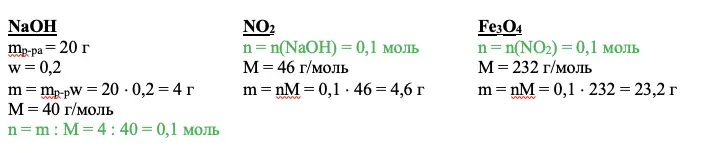ХИМИЯ: Алгоритмы решения типовых задач
Алгоритмы решения типовых задач по химии: последовательность выполнения действий, запись условий задачи обозначениями, оформление решения задачи, запись уравнений реакции, вычисления и ответ. Представлены алгоритмы решения 9-ти типовых задач.
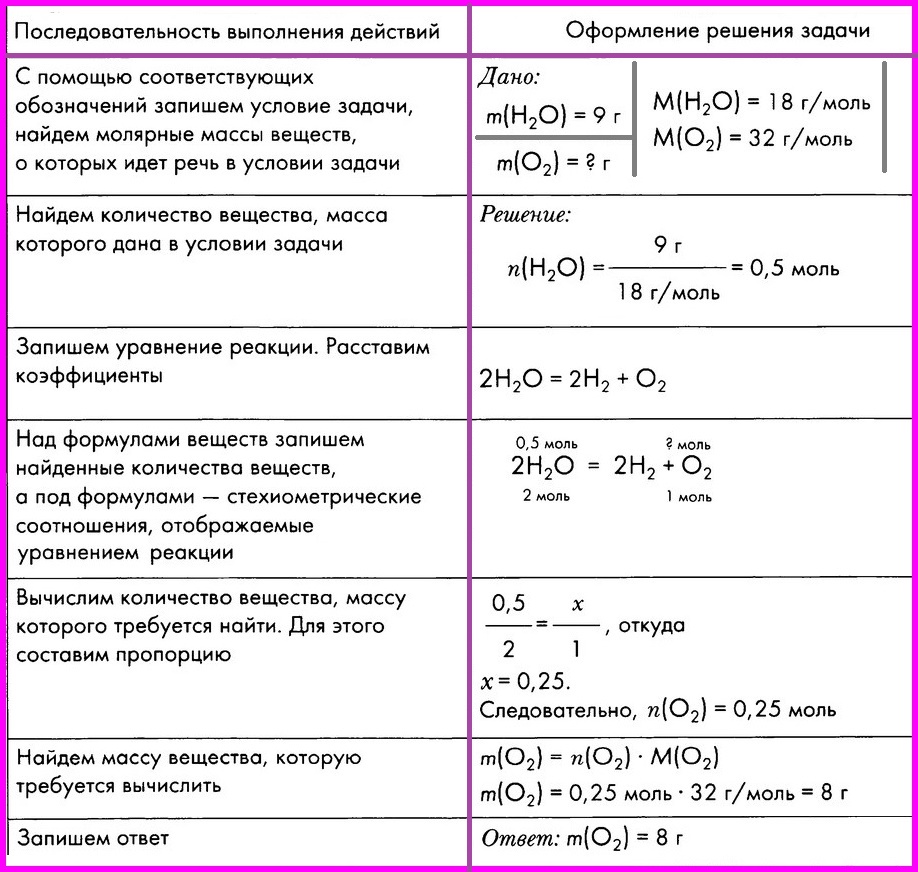
Алгоритм № 1.
Вычисление массы вещества по известной массе другого вещества, участвующего в реакции.
ЗАДАЧА: Вычислите массу кислорода, выделившегося в результате разложения порции воды массой 9 грамм.
Алгоритм № 2.
Вычисление объема вещества по известной массе другого вещества, участвующего в реакции.
ЗАДАЧА: Вычислите объем кислорода (н.у.), выделившегося в результате разложения
порции воды массой 9 г.
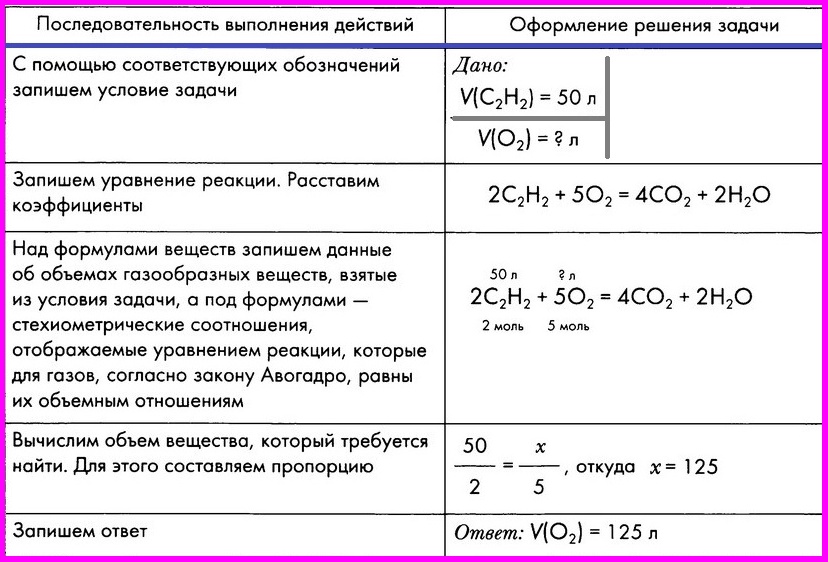
Алгоритм № 3.
Расчет по химическому уравнению объемных отношений газов
ЗАДАЧА: Вычислите объем кислорода, необходимого для сжигания порции ацетилена объемом 50 л.
Алгоритм № 4.
Вычисление относительной плотности газа по другому газу
ЗАДАЧА: Вычислите плотность кислорода а) по водороду; 6) по воздуху.
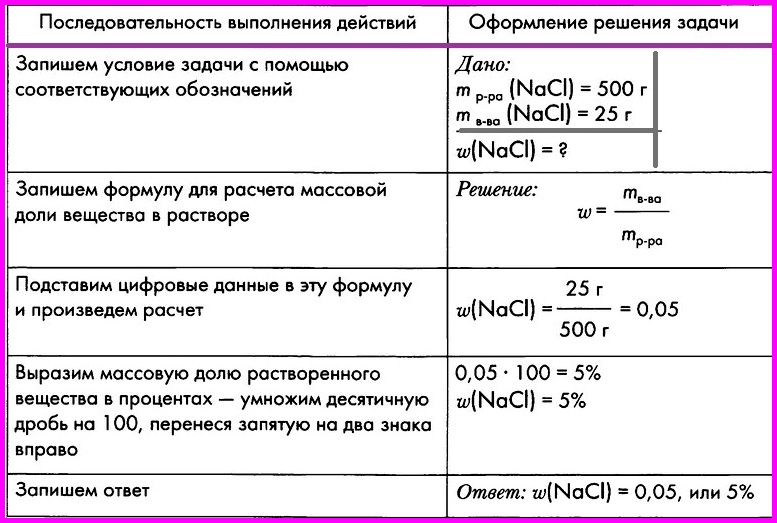
Алгоритм № 5.
Вычисление массовой доли вещества в растворе
ЗАДАЧА: При выпаривании раствора массой 500 г образовалось 25 г кристаллической соли — хлорида натрия. Вычислите массовую долю соли в исходном растворе.
Алгоритм № 6.
Вычисление массы вещества в растворе по массе раствора и массовой доле растворенного вещества.
ЗАДАЧА: Вычислите массу гидроксида натрия, необходимого для приготовления 400 г 20%-ного раствора гидроксида натрия.
Алгоритм № 7.
Расчеты по термохимическим уравнениям. Вычисление количества теплоты по известной массе вещества.
ЗАДАЧА: По термохимическому уравнению 2Сu + O2 = 2СuO + 310 кДж вычислите количество теплоты, выделившейся в результате окисления порции меди массой 16 г.
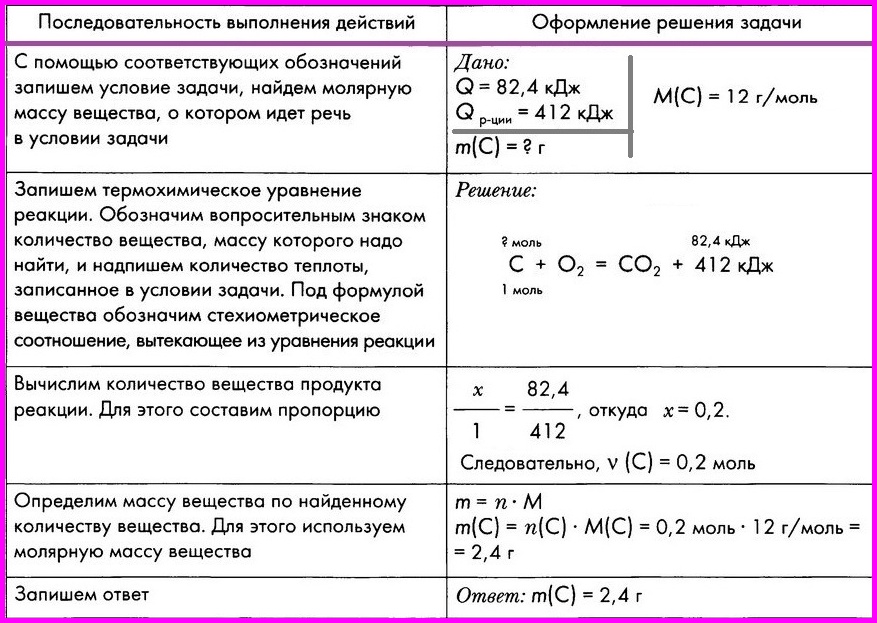
Алгоритм № 8.
Расчеты по термохимическим уравнениям. Вычисление массы вещества по известному количеству теплоты.
ЗАДАЧА: По термохимическому уравнению С + O2 = СO2 + 412 кДж вычислите массу сгоревшего угля, если количество теплоты, выделившееся в результате реакции, составляет 82,4 кДж.
Алгоритм № 9.
Расчеты по химическим уравнениям, если одно из реагирующих веществ дано в избытке.
ЗАДАЧА: Смешали два раствора, один из которых содержал 33,3 г хлорида кальция, а другой — 16,4 г фосфата натрия. Вычислите массу образовавшегося фосфата кальция.
Вы смотрели Справочник по химии «Алгоритмы решения типовых задач». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Задачи: базовый блок
1. Теория: Атомно-молекулярное учение
Задачи: Атомно-молекулярное учение
2. Способы выражения концентрации в растворах: массовая доля, растворимость, молярная концентрация.
3. Расчеты по уравнению реакции
4. Задачи на избыток-недостаток
5. Задачи на примеси
6. Задачи на выход
Задачи повышенной сложности
1. Задачи на электролиз
2. Задачи на кристаллогидраты
3. Задачи на пластинки
4. Задачи на порции
5. Задачи на неполное разложение
6. Задачи на альтернативные реакции (кислые/средние соли, амфотерность)
7. Задачи на атомистику
8. Задачи на смеси и сплавы
9. Задачи на растворимость
Муниципальное автономное общеобразовательное учреждение
гимназия №4 г. Канска
Методическое пособие для обучающихся 11 классов
профильного направления «Химия»
Алгоритмы решения 34 задания ЕГЭ по химии
Подготовил:
ученик 11Б класса
МАОУ гимназии №4
Ходасевич Егор
Канск, 2022 г.
Оглавление
|
Спецификация:………………………………… |
3 |
|
Оценивание 34 задания………………………. |
4 |
|
Типы задач…………………………………….. |
5 |
|
Что нужно знать для выполнения?……………. |
7 |
|
Химические свойства………………………… |
8 |
|
• Оксиды …………………………………… |
8 |
|
• Основания………………………………… |
9 |
|
• Соли……………………………………….. |
10 |
|
• Кислоты…………………………………… |
11 |
|
Алгоритм решения……………………………. |
12 |
|
Примеры решения задач по алгоритму……… |
13 |
|
Задача на электролиз………………………….. |
13 |
|
Задача на кристаллогидрат…………………… |
18 |
|
Задача на пластинку …………………………… |
21 |
|
Задача на выход реакции……………………… |
24 |
|
Задача на растворимость……………………… |
26 |
34 задание ЕГЭ по химии является расчётной задачей высокого уровня сложности. При решении данного типа задач задействуются все алгоритмы, механизмы и знания по неорганической химии за школьный курс.
Спецификация:
- Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе».
- Расчёты массы (объёма, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси).
- Расчёты массы (объёма, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определённой массовой долей растворённого вещества.
- Расчёты массовой доли (массы) химического соединения в смеси
Так как задание повышенного уровня сложности, решает его маленький процент сдающих экзамен.
Правильный ответ должен включать в себя:
- Правильно записанные уравнения всех реакций
- Правильно выполненные вычисления
- Логическую взаимосвязь физических величин, на основании которой проводятся расчёты
- Правильно определённая искомая величина
Оценивание 34 задания
|
Ответ правильный и полный, содержит следующие элементы: • правильно записаны уравнения реакций, соответствующих условию задания; • правильно произведены вычисления, в которых используются необходимые физические величины, заданные в условии задания; • продемонстрирована логически обоснованная взаимосвязь физических величин, на основании которой проводятся расчёты; • в соответствии с условием задания определена искомая физическая величина |
4 |
|
Правильно записаны три элемента ответа |
3 |
|
Правильно записаны два элемента ответа |
2 |
|
Правильно записаны один элемента ответа |
1 |
|
Все элементы ответа записаны неверно |
0 |
|
Максимальный балл |
4 |
Типы задач
Существует несколько типов 34 задания
- На атомы
Смесь малахита ((CuOH)2CO3) и карбоната цинка, в которой
соотношение числа атомов углерода к числу атомов кислорода равно 5 : 19, растворили в 580,1 г разбавленного раствора серной кислоты. При этом все исходные вещества прореагировали полностью, и выделилось 11,2 л газа (н.у.). К полученному раствору добавили 52 г цинка. После того как массовая доля сульфата меди(II) уменьшилась до 2,5%, всю смесь цинка и меди отделили. Вычислите массовую долю сульфата цинка в конечном растворе.
- На растворимость
Растворимость карбоната аммония составляет 96 г на 100 г воды. Приготовили насыщенный раствор с 250 мл воды, разделили его на две колбы. В первую колбу добавили избыток твёрдого гидроксида натрия и нагрели, а во вторую — 250 г соляной кислоты (тоже в избытке). При этом из второй колбы выделилось в три раза меньше газа (при одинаковых условиях), чем из первой. Определите массовую долю соли во второй пробирке.
- На электролиз
Для проведения электролиза взяли раствор нитрата серебра. После того
как объём газа, выделившийся на аноде, оказался в 1,2 раза меньше
объёма газа, выделившегося на катоде, процесс остановили. (Объёмы
газов измерены при одинаковых условиях). Масса образовавшегося в
процессе электролиза раствора оказалась на 51,8% меньше массы
исходного раствора. К полученному раствору добавили равный ему по
массе 20%-ный раствор гидроксида натрия. Определите среду конечного
раствора и массовую долю соли в нём.
- На неполное разложение
При нагревании образца нитрата алюминия часть вещества разложилась.
При этом образовался твёрдый остаток массой 37,98 г. В этом остатке
число атомов алюминия в 5 раз меньше числа атомов кислорода.
Остаток полностью растворили в необходимом для реакции
минимальном объёме 24%-ного раствора гидроксида натрия. При этом
образовался тетрагидроксоалюминат натрия. Определите массовую
долю нитрата натрия в полученном растворе.
- На пластинку
Магниевую пластинку поместили в 483 г 20%-ного раствора сульфата цинка. После того как масса раствора уменьшилась на 20,5 г, пластинку вынули. К оставшемуся раствору добавили 224 г 40%-ного раствора гидроксида калия. Определите массовую долю гидроксида калия в образовавшемся растворе. (Процессами гидролиза пренебречь.)
- Определение типа соли
Раствор гидрокарбоната кальция содержит 88,8% кислорода по массе.
Этот раствор массой 540 г по каплям добавили к 120 г 0,4%-ного
раствора гидроксида натрия. Выпавший осадок отделили, а оставшийся
раствор нагрели до прекращения выделения газа. Вычислите массу
конечного раствора и массу соли в нём.
- Выход реакции
При обжиге 65,79 г известняка, содержащего 5% примесей, был получен углекислый газ с выходом 80%, который пропустили через 328 мл 20%-ого раствора гидроксида натрия (p=1,22 г/мл). Определите состав и массовые доли веществ в полученном растворе.
- На смесь
Смесь, состоящую из порошков алюминия и угля, прокалили без доступа воздуха. После завершения реакции масса твёрдого остатка составила 12,24 г. К этому остатку добавили 300 г раствора гидроксида калия, взятого в избытке. При этом выделилось 10,752 л (н.у.) смеси газов. Вычислите массовую долю тетрагидроксоалюмината калия в конечном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
- На кристаллогидрат
Оксид меди (II) массой 16 г обработали 40 мл 5,0%-ного раствора серной кислоты (р = 1,03 г/см3). Полученный раствор отфильтровали, фильтрат упарили. Определите массу полученного кристаллогидрата.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Что нужно знать для выполнения?
- Формулы
- Химические свойства веществ, чтобы записать уравнения реакций
- Примерный алгоритм решения
Начнём с формул. На самом деле формулы для решения задач запомнить не так трудно, потому что их небольшое количество. Большую часть формул можно вывести из других.
Пример: m = n ∙ M
n = m/М
Для решения расчетных задач по химии понадобятся следующие физические величины и формулы для их вычисления.
|
Формула |
|
|
Количество вещества n (моль) |
n=m/Mr n=V/22.4 (л/моль) |
|
Масса вещества m (г) |
m=n•Mr |
|
Объем вещества V (л) |
V=n • 22.4 (л/моль) V=m/ρ |
|
Массовая доля W (%) |
А)элемента W=Ar*n/Mr*100% Б)веществаW=m(ч.в.)/m(р-ра)*100% |
|
Плотность ρ (г/мл) |
ρ=m(р-ра)/V(р-ра) |
|
Выход продукта реакции (%) |
η=m(пр.)/m(теор.) |
|
Относительная плотность газа А по газу В |
Dв(A)=M(A)/M(B) |
Химические свойства
Для составления уравнений реакций в решении задачи, следует знать все химические свойства всех веществ. Ведь это обязательное условие для решения задачи.
-
Оксиды
это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Оксиды делятся на две группы солеобразующие (ВеО, ZnO, CaO) и несолеобразующие (NO, N2O, CO).
В свою очередь солеобразующие делятся ещё на три группы: основные (степень окисления метала +1,+2), амфотерные (степень окисления метала +3,+4,+5), кислотные (степень окисления метала +6,+7; степень окисления не метала +3 и больше)
Основные
1.Взаимодействие оксидов щелочных и щелочноземельных металлов с водой
CaO + H2O → Ca(OH)2
2.Взаимодействие с кислотами
MgO+ 2HNO3 → Mg(NO3)2+ 2H2O
3.Взаимодействие с кислотными оксидами
BaO + SO3 → BaSO4
4. Взаимодействие с амфотерными оксидами
Na2O + Al2O33 → NaAlO2
Кислотные
1.Взаимодействие с водой (образование кислоты)
SO3 + H2O → H2SO4
2. Взаимодействие с основными оксидами
SO3 + CuO → CuSO4
3. Взаимодействие с амфотерными оксидами
SO3 + Al2O3 → Al2 (SO4) 3
4. Взаимодействие с основаниями
N2O5 + 2NaOH → 2NaNO3 + H2O
Амфотерные
1. С кислотами (образование соли этой кислоты и воды)
Al2O3 + 6HCl → 2AlCl3 + 3H2O
2. Взаимодействие с кислотными оксидами
Al2O3 + N2O5 → 2Al(NO3) 3
3.Взаимодействие с основными оксидами
Al2O3 + Na2O → 2NaAlO2
4. Взаимодействие с щелочами (раствор)
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH) 4]
5. Взаимодействие с щелочами (расплав)
ZnO + 2KOH → K2ZnO2 + H2O
-
Основания
это сложные вещества, которые состоят из катиона металла и гидроксильной группы (OH).
1.Взаимодействие с кислотными оксидами
N2O5 + 2NaOH → 2NaNO3 + H2O
2. Взаимодействие с кислотами
Ba(OH) 2 + 2HNO3 → Ba(NO3) 2 + 2H2O
3. Взаимодействие с солями
KOH + MgSO4 → Mg(OH) 2↓ + K2SO4
4. Термическое разложение (только нерастворимые основания)
Cu(OH) 2 → CuO +H2O
5. Взаимодействие амфотерных гидроксидов со щелочами
Al(OH) 3(тв.) + KOH(тв.) → KAlO2 + 2H2O
Al(OH) 3(р-р) + KOH(р-р) → K[Al(OH) 4]
-
Соли
это сложные вещества, в состав которых входят катионы металла и анионы кислотного остатка. Иногда в состав солей входят водород или гидроксид-ион.
Соли делятся на 4 группы: средние (метал + кислотный остаток), кислые (метал + Н + кислотный остаток), основные (метал + ОН + кислотный остаток), комплексные(K[Al(OH)4])
Средние
1.Диссоциация
NaCl → Na+ + Cl—
2. Термическое разложение
CaCO3 → CaO + CO2
3. Взаимодействие солей с металлами
Fe + CuSO4 → FeSO4 + Cu
4. Гидролиз
Na2 CO3 + H2 O → NaOH + NaHCO3
5.Взаимодействие с кислотами
K2 CO3 + 2HCl → 2KCl + CO2 +H2 O
6. Взаимодействие с основаниями
Fe(NO3)3 + 3NaOH → Fe(OH)3 + 3NaNO3
7.Взаимодействие с солями
AgCl + 2Na2 S2 O3 → Nа3 [Ag(S2 O3)2] + NaCl
Кислые
1.Диссоциация.
NaHCO3 → Na + +HCO3 — HCO3− → H + + CO3 2-
2. Термическое разложение
Ca(HCO3)2 → CaCO3 + CO2 + H2 O
3. Взаимодействие солей со щелочью.
Ba(HCO3)2 + Ba(OH)2 → 2BaCO3 + 2H2 O
Основные
1.Термическое разложение
[Cu(OH)]2 CO3 → 2CuO + CO2 + H2 O
2.Взаимодействие с кислотами
Sn(OH)Cl + HCl → SnCl2 + H2 O
3. Диссоциация
Mg(OH)Cl → Mg(OH)+ + Cl— Mg(OH)+ → Mg2+ + OH—
Комплексные
1.Взаимодействие с кислотами
Na[Al(OH)4] + 4HCl(изб.) → NaCl + AlCl3 + 4H2 O
Na[Al(OH)4] + HCl(нед.) → NaCl + Al(OH)3 + H2 O
2.Диссоциация
K[Al(OH)4] → K++ [Al(OH)4] —
3. Взаимодействие с сероводородом
K[Al(OH)4]+ H2 S → KHS+Al(OH)3 ↓ +H2 O
4. Взаимодействие с кислотными оксидами
K[Al(OH)4]+CO2 → KHCO3+Al(OH)3 ↓
5.Термическое разложение
K[Al(OH)4] → KAlO2 +2H2 O
-
Кислоты
это сложные вещества, состоящие из атомов водорода (которые могут замещаться на атомы металлов) и кислотных остатков.
1. Диссоциация
HNO3 → H + + NO -3
2. Разложение
H2CO3 → H2O + CO2 ↑
3. Взаимодействие с металлами (до Н)
Mg + 2HCl → MgCl2 + H2 ↑
4. Взаимодействие с основаниями
H3 PO4+3NaOH →Na 3 PO4+3H2O
5. Взаимодействие с солями
BaCl2 + H2SO4 → BaSO4↓ + 2HCl↑
6. Взаимодействие с основными оксидами
K2O + 2HNO3 → 2KNO3 + H2O
7. Взаимодействие с амфотерными оксидами
2HNO 3 +ZnO → Zn(NO3) 2+H2O
Алгоритм решения
На самом деле все задачи уникальны и сложны по-своему. Очень трудно составить один алгоритм для решения всех задач. Можно только выявить некоторые базовые модули, определяющие общую стратегию и основные этапы решения задачи. А уже из них выстраивать ход решения, наполняя пустой алгоритм содержанием.
Поэтому я разработал алгоритм, которым можно пользоваться при решении этих задач
А) Определяем тип задачи
Б) Структурируем все данные (пишем дано)
В) Проводим анализ условия (составляем уравнения химических реакций, о которых упоминается в условии задачи)
Г) Устанавливаем логические связи (формулируем главный вопрос задачи, т.е. находим вещество, количество которого необходимо рассчитать, и логическую цепочку, связывающую количество этого вещества с веществами, количество которых мы знаем или можем вычислить).
Д)Решаем задачу
Примеры решения задач по алгоритму
Задача на электролиз
Электролиз 640 г 15%-го раствора сульфата меди(II) прекратили, когда масса раствора уменьшилась на 32,0 г. К образовавшемуся раствору добавили 400 г 20%-го раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
А) Определяем тип задачи
Данная задача относится к типу задач на электролиз. Нужно вспомнить что мы знаем про электролиз.
Электролиз (греч. elektron — янтарь + lysis — разложение) — химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
- NaCl + H2O → H2 + Cl2 + NaOH
- CuSO4 + H2O → Cu + O2 + H2SO4
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
- В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
AlCl3 → Al + Cl2
LiBr → Li + Br2
Если в условии задачи электролиз прекратили, то в дальнейшем взаимодействует не только продукт реакции, но и то вещество, которое подверглось электролизу.
Пример: При проведении электролиза 500 г 16%-го раствора сульфата меди(II) процесс прекратили, когда на аноде выделилось 1,12 л газа (н. у.). К образовавшемуся раствору прибавили 53,0 г 10%-го раствора карбоната натрия. Определите массовую долю сульфата меди(II) в полученном растворе.
В данном случае будет составлено 3 уравнения реакций:
- Электролиз сульфата меди (II).
- Реакция остатка сульфата меди (II) с карбонатом натрия
- Реакция серной кислоты с карбонатом натрия
Б) Структурируем все данные (пишем дано)
m (р-ра)(CuSO4)=640г
w (CuSO4)=15%
m (р-ра)(NaOH)=400г
w (NaOH)=20%
В) Проводим анализ условия (составляем уравнения химических реакций, о которых упоминается в условии задачи)
1) 2 CuSO4 + 2 H2O → O2 + 2 H2SO4 + 2 Cu
(электролиз 640 г 15%-го раствора сульфата меди(II) прекратили)
2) H2SO4 + 2 NaOH → 2 H2O+ Na2SO4
(К образовавшемуся раствору добавили 400 г 20%-го раствора гидроксида натрия)
3) CuSO4 + 2 NaOH → Na2SO4 + Cu(OH)2
(так как электролиз прекратили, в нём осталась какая-то доля сульфата меди(II), которая тоже будет реагировать с гидроксидом натрия)
Вывод: у нас получилось 3 уравнения реакций по которым мы будем вести вычисления
Г) Устанавливаем логические связи
Требуется найти массовую долю гидроксида натрия в полученном растворе.
1.Чтобы найти массовую долю гидроксида натрия в полученном растворе нужно знать массу раствора и массу самого гидроксида в этом растворе
W=m(ч.в.)/m(р-ра)*100%
2. Сульфат меди количественно связан с гидроксидом натрия- гидроксида натрия в 2 раза больше (3 реакция)
3. Гидроксид натрия связан с серной кислотой- гидроксида натрия в 2 раза больше (2 реакция)
4. Сульфат меди связан с серной кислотой – равны (1 реакция)
5.Сульфат меди связан с гидроксидом меди- равны (3 реакция)
Д)Решаем задачу
1.m(ч-в)(CuSO4)= 640г*15%/100% = 96г
2.n(CuSO4)= m/Mr = 96г/160 = 0,6 моль
3.m(ч-в)(NaOH)= 400г*20%/100% = 80г
4.n(NaOH)= m/Mr = 80г/40 = 2 моль
Пусть количество вещества образовавшегося кислорода n(O2) = х моль. Тогда количество вещества образовавшейся меди n(Сu) = 2xмоль. m(O2) = 32x(г), а m(Сu) = 64∙2x = 128x(г). По условию задачи: m(O2) + m(Сu) = 32.
32x + 128x = 32
х = 0,2(моль)
5.n(O2)=0,2 моль, а n(Cu)=0,4 моль, тогда n( изр)(CuSO4)=0,4 моль
6. n(ост)(CuSO4)(3ур.)=0,2 моль, а n(NaOH) в 2 раза больше (по 3 уравнению).
n(NaOH)=0,4 моль (в 3 реакции)
7.m(NaOH)=0,4 моль*40г/моль=16г
8.n( изр)(CuSO4)(1ур)=n(H2SO4)=0,4 моль
9.m(1ур)(H2SO4)=0,4 моль*98г/моль=39,2г
10.n(2ур.)(NaOH) в 2 раза больше n(H2SO4) (по 2 реакции)
n (2ур.) (NaOH)=0,8 моль
11.n(изр)(NaOH)=0,8+0,4=1,2 моль
12.n(ост)(NaOH)=2 моль-1,2 моль=0,8моль
13.m(ост)(NaOH)=0,8*40=32г
14.n(Cu(OH2)=n(CuSO4)=0,2 моль (по 3 реакции)
15.m(Cu(OH2)=0,2 моль *98г/моль=19,6 г
16.m(кон.раств.)=m(CuSO4)+ m(NaOH)-32г- m(Cu(OH2)=640+400-32- 19,6=988,4г
17.w(NaOH)= m(NaOH)/ m(кон.раств.)=32г*100%/988,4г=3,24%
Ответ: w(NaOH)= 3,24%
Задача на кристаллогидрат
Смесь цинка и цинкового купороса (ZnSO4 · 7H2O) полностью растворилась в 160 г раствора гидроксида натрия, при этом выделилось 2,24 л газа (н.у.) и образовался раствор массой 172,04 г. Вычислите массовые доли солей в полученном растворе
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
А) Определяем тип задачи
Кристаллогидраты — это сложные вещества, которые содержат в кристаллической решетке молекулы воды.
Многие соединения (чаще всего соли) выкристаллизовываются из водных растворов в виде кристаллогидратов.
При расчёте молярной массы нельзя забывать про воду.
Пример: ZnSO4 · 7H2O
Его молярная масса будет не 161г/моль, а 287г/моль (161 — ZnSO4 ,126 — 7H2O)
Часто встречающиеся кристаллогидраты в ЕГЭ
|
Кристаллогидрат |
Тривиальное название/ название по систематической номенклатуре |
|
Na2CO3 · 10H2O |
Кристаллическая сода, декагидрат карбоната натрия |
|
CaSO4 · 2H2O |
Гипс, дигидрат сульфата кальция |
|
CuSO4 · 5H2O |
Медный купорос, пентагидрат сульфата меди(II) |
|
Na2SO4 · 10H2O |
Кристаллическая сода, декагидрат карбоната натрия |
|
FeSO4 · 7H2O |
Железный купорос, гептагидрат сульфата железа(II) |
|
ZnSO4 · 7H2O |
Цинковый купорос, гептагидрат сульфата цинка(II) |
Б) Пишем «дано» исходя из условия задачи
m(NaOH)=160г
V(H2)=2,24л
m(кон.раств.)=172,04г
В) Проводим анализ условия (составляем уравнения химических реакций, о которых упоминается в условии задачи)
1) ZnSO4 + 4NaOH → Na2 [Zn(OH)4] + Na2SO4
(Смесь цинка и цинкового купороса (ZnSO4 ·7H2O) полностью растворилась в 160 г раствора гидроксида натрия)
2) Zn + 2NaOH + 2H2O → Na2 [Zn(OH)4] + H2
(Смесь цинка и цинкового купороса (ZnSO4 · 7H2O) полностью растворилась в 160 г раствора гидроксида натрия)
Г) Устанавливаем логические связи
Требуется найти массовые доли солей в полученном растворе
1.Чтобы найти массовые доли солей в полученном растворе нужно знать массу раствора и массу самих солей в этом растворе
W=m(ч.в.)/m(р-ра)*100%
2. Цинк связан с водородом –равны (2 реакция)
3. Сульфат натрия связан с сульфатом цинка- равны(1 реакция)
Д)Решаем задачу
1.n(H2)=2,24л/22,4л/моль=0,1 моль
2.m(H2)=0,1 моль*2 г/моль=0,2 г
3. n(Zn)= n(H2)=0,1 моль
4. m(Zn)= 0,1 моль* 65г/моль=6,5г
5. m(кон.раств.)= m(исх)+m(Zn)+m(ZnSO4 · 7H2O)-m(H2)
m(ZnSO4 · 7H2O)=m(кон.раств.)-m(исх)— m(Zn)-m(H2)=172,04г-160г-6,5г+0,2г=5,74г
6.n (ZnSO4 · 7H2O)=n(ZnSO4)=5,74г/287г/моль=0,02 моль
7.n(Na2SO4)=n(ZnSO4)= 0,02 моль
8.n(Na2 [Zn(OH)4])=n(Zn)+ n(ZnSO4)=0,1 моль+0,02 моль=0,12 моль
9. m(Na2SO4)=0,02 моль*142г/моль=2,84г
10. m(Na2 [Zn(OH)4])=0,12 моль*179г/моль=21,48г
11.w(Na2SO4)=2,84г/172,04г*100%=1,65%
12. w(Na2 [Zn(OH)4])=21,48г/172,04г*100%=12,49%
Ответ: w(Na2SO4)= 1,65%; w(Na2 [Zn(OH)4])=12,49%
Задача на пластинку
Навеску оксида меди(II) массой 12,0 г растворили в 200 г 9,8 %-й серной кислоты. В полученный раствор опустили железную пластинку, выдержали до прекращения реакции и удалили из раствора. Найдите массовую долю соли в полученном растворе. Примите Ar(Cu)=64. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите необходимые вычисления (указывайте единицы измерения искомых физических величин).
А) Определяем тип задачи
Данная задача относится к типу задач на пластинку. Решая задачи, важно понимать, что реакции металлов с солями являются окислительно-восстановительными и протекают на поверхности металла, погруженного в раствор соли а выделившийся в результате реакции металл осаждается на данной поверхности.
Б) Пишем «дано» исходя из условия задачи
m(CuO)=12,0г
m(H2SO4)=200г
w(H2SO4)=9,8%
Ar(Cu)=64
В) Проводим анализ условия (составляем уравнения химических реакций, о которых упоминается в условии задачи)
1) CuO+ H2SO4→ CuSO4+ H2O
(Навеску оксида меди(II) массой 12,0 г растворили в 200 г 9,8 %-й серной кислоты)
2) CuSO4+Fe→FeSO4+Cu
(В полученный раствор опустили железную пластинку, выдержали до прекращения реакции и удалили из раствора)
3) H2SO4+ Fe→ FeSO4+ H2
( В полученный раствор опустили железную пластинку, выдержали до прекращения реакции и удалили из раствора)
Г) Устанавливаем логические связи
Требуется найти массовую долю соли в полученном растворе
1.Чтобы найти массовую долю соли в полученном растворе нужно знать массу раствора и массу самой соли в этом растворе
W=m(ч.в.)/m(р-ра)*100%
2.Сульфид меди связан с оксидом меди — равны (1 реакция)
3.Сульфид железа связан с сульфидом меди – равны (2 реакция)
4.Серная кислота связана с оксидом меди – равны
5.Сульфид железа связан с серной кислотой – равны (3 реакция)
Д)Решаем задачу
1)n(CuO)=12/80=0,15 моль
2) m(H2SO4)=200*9,8%/100%=19,6г
3) n(H2SO4)=200*0,098/98=0,2 моль
4) n(CuSO4)= n(CuO)=0,15 моль (1 реакция)
5) n(FeSO4)= n(CuSO4)= )=0,15 моль (2 реакция)
6) n(H2SO4)= n(CuO)=0,15 моль
7) n(H2SO4)=0,2 моль-0,15 моль=0,05 моль (3 реакция)

9)m(FeSO4)=(0,15+0,05)*152=30,4г
10)m(H2O в FeSO4)= m(H2O в H2SO4)+ m(H2O) = (200 -19,6)+0,15*18= 183,1г
11)mраств(FeSO4)=m(FeSO4)+m(H2O)=30,4+183,1= 213,5
12) w(FeSO4)=30,4*100/213,5=14,2%
Ответ: w(FeSO4)= 14,2%
Задача на выход реакции
При взаимодействии в сернокислой среде 17,4 г диоксида марганца с 58 г бромида калия при 77%-ном выходе выделился бром. Какой объём (н. у.) пропена может провзаимодействовать с полученным количеством брома?
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
А) Определяем тип задачи
Данная задача относится к типу задач на выход реакции. Выход продукта реакции (выход реакции) — это коэффициент, определяющий полноту протекания химической реакции. Он численно равен отношению количества (массы, объема) реально полученного продукта к его количеству (массе, объему), которое может быть получено по стехиометрическим расчетам (по уравнению реакции).
Б) Пишем «дано» исходя из условия задачи
m (MnO2)=17,4г
m (KBr)=58г
η=77%=0,77
В) Проводим анализ условия (составляем уравнения химических реакций, о которых упоминается в условии задачи)
1)MnO2+2KBr+2 H2SO4 →MnSO4+Br2+K2SO4+2 H2O
(При взаимодействии в сернокислой среде 17,4 г диоксида марганца с 58 г бромида калия при 77%-ном выходе выделился бром)
2)C3H6+Br2→C3H6Br2
(Какой объём (н. у.) пропена может провзаимодействовать с полученным количеством брома)
Г) Устанавливаем логические связи
1)Требуется найти объём пропена. Что бы найти объём нужно знать его количество
V=n • 22.4 (л/моль)
2)Бром связан с диоксидом марганца – равны (1 реакция)
3)Пропен связан с бромом – равны (2 реакция)
Д)Решаем задачу
1) n(MnO2)=17,4/81=0,2 моль
2) n(KBr)=58/119=0,49
KBr – избыток
3) n(Br2)= n(MnO2)=0,2 моль (1 реакция)
4) n(Br2)=0,2 моль*0,77=0,154 моль (с учётом выхода реакции)
5) n(C3H6)= n(Br2)=0,154 моль (2 реакция)
6)V(C3H6)=0,154 моль *22,4 л/моль=3,450 л
Ответ: V(C3H6)= 3,450 л
Задача на расстворимость
Растворимость карбоната аммония составляет 96 г на 100 г воды. Приготовили насыщенный раствор с 250 мл воды, разделили его на две колбы. В первую колбу добавили избыток твёрдого гидроксида натрия и нагрели, а во вторую — 250 г соляной кислоты (тоже в избытке). При этом из второй колбы выделилось в три раза меньше газа (при одинаковых условиях), чем из первой. Определите массовую долю соли во второй пробирке. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
А) Определяем тип задачи
Данная задача относится к типу задач на растворимость.
Б) Пишем «дано» исходя из условия задачи
m(H2O)=250г
m(HCl)=250г
В) Проводим анализ условия (составляем уравнения химических реакций, о которых упоминается в условии задачи)
1) (NH4)2CO3+2NaOH→Na2CO3+NH3+2H2O
(В первую колбу добавили избыток твёрдого гидроксида натрия и нагрели)
2) (NH4)2CO3+2HCl→2NH4Cl+H2O+CO2
(а во вторую — 250 г соляной кислоты (тоже в избытке))
Г) Устанавливаем логические связи
Требуется найти массовую долю соли во 2 пробирке
1.Чтобы найти массовую долю соли во 2 пробирке нужно знать массу раствора и массу самой соли в этом растворе
W=m(ч.в.)/m(р-ра)*100%
2)Углекислый газ связан с карбонатом амония – равны (2 реакция)
3)Хлорид амония связан с карбонатом амония – в 2 раза меньше (2 реакция)
Д)Решаем задачу
1) m((NH4)2CO3)= 96г – m(H2O)=100г
m((NH4)2CO3)=x г — m(H2O)=250г
m((NH4)2CO3)=96г*250г/100г=240г
2)n((NH4)2CO3)=240г/96г/моль=2,5 моль
3) Пусть n((NH4)2CO3) во 2 колбе = х моль, тогда n((NH4)2CO3) в 1 колбе =1,5х моль
х+1,5х=2,5
х=1 моль n((NH4)2CO3)=1 моль (2 реакция)
4)m((NH4)2CO3)=1 моль*96г/моль= 96г (2 реакция)
5) m раств((NH4)2CO3)=196г
6) n(CO2)= n((NH4)2CO3)=1 моль (2 реакция)
7) m(CO2)=1 моль *44г/ моль =44г

9) m(NH4Cl)= 2 моль * 53,5 г/моль= 107 г
10)w(NH4Cl)= m(NH4Cl)/ (m раств((NH4)2CO3)+ m(HCl) — m(CO2))*100%=107г/(196+250-44)*100%=107г/402г*100%=26,6%
Ответ: w(NH4Cl)= 26,6%
Ни для кого не секрет, что задача 33 (она же бывшая задача 34) в ЕГЭ по химии — самое сложное задание, а судя по статистике (только 8,3% выпускников справляются с ним), она еще и практически невыполнимая. Поэтому значительное число выпускников даже не читают условие этой задачи. А зря. Если вы пришли на экзамен по химии, то уж точно сможете записать несколько уравнений, ведь так?
Задача 33 по химии: суть и критерии оценивания
Задание № 33 в ЕГЭ по химии — это расчетная задача высокого уровня сложности. Чтобы успешно решить ее, вам необходимо знать химические свойства веществ, уметь устанавливать логические связи между реакциями, применять расчетные формулы для нахождения количества вещества, массы и объема, массовой доли вещества в смеси.
Для получения максимально возможных 4 баллов за задачу 33 вам предстоит:
- записать все уравнения реакций, описанных в тексте (1 балл);
- рассчитать количества вещества всех известных и искомых веществ (1 балл);
- провести анализ и рассчитать искомые величины (1 балл);
- дать правильный ответ и безошибочно оформить решение (1 балл; снимается за отсутствие размерных величин — больше трех, также за математические ошибки)
Но слова в сторону, нам нужна успешная пошаговая стратегия: что делать, чтобы не получить за этот номер 0?
ЕГЭ по химии — в принципе достаточно сложный экзамен. Чтобы получить за него высокий балл, нужно хорошо постараться. Так, необходимо хорошо знать теорию и формулы, уметь выводить уравнения без ошибок, понимать, как правильно читать задания (в них могут быть ловушки!) и оформлять ответы по критериям. И все это — за ограниченный период времени.
Чтобы не стрессовать на экзамене и показать лучший результат, записывайтесь ко мне на курсы подготовки к ЕГЭ по химии. Мы изучим только то, что гарантированно пригодится вам на экзамене: ничего лишнего, только актуальные знания. А пробные экзамены, которые мы обязательно проводим, помогут понять, что ЕГЭ — совсем не такое страшное. Приходите к нам — за знаниями и спокойствием!
Пошаговый разбор реального задания 33
Уровень «Новичок»
Вы выбрали химию для поступления и готовилист к ЕГЭ минимум год. Вам абсолютно под силу записать уравнения реакций, описанных в тексте. Чаще всего здесь встречаются реакции обмена, замещения и разложения, ОВР, электролиз и совместный гидролиз. Правильно записанные реакции с расставленными коэффициентами дают 1 первичный балл за 33 задачу в ЕГЭ по химии.
ШАГ 1. Запишите все уравнения реакций, о которых идет речь в тексте
Если возможны вариации одной и той же реакции, рассмотрите их на черновике (например, получение средних/кислых солей, образование амфотерного гидроксида/ комплексной соли и т.п.). Какую реакцию оставить, вы поймете после получения первых результатов расчета.
Совет: повторите перед экзаменом тривиальные названия. Например, если вы не знаете, что такое «железная окалина», то ни записать реакцию, ни решить данную задачу не удастся 🙃
Смесь железной окалины и оксида железа III растворяют в азотной концентрированной кислоте. Запишем их по очереди. Железная окалина содержит железо в степени окисления +2, отсюда и протекание окислительно-восстановительной реакции: железо повышает степень окисления до +3, а азот изменяет свою степень окисления с +5 до +4. Вторая реакция представляет собой классическую реакцию обмена:
Fe3O4 + 10HNO3 = 3Fe(NO3)3 + NO2 + 5H2O
Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O
Образовавший газ (это NO2, полученный в первой реакции) взаимодействует с гидроксидом натрия:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
ИТОГО: +1 балл
С одним пунктом вы справились. Далее запишите «дано». Баллов за эту запись вам не добавят, но при этом вы сможете увидеть все известные величины и помнить, что необходимо найти.
Дано:
N(Fe) : N(O) = 7 : 10
mp-p(HNO3) = 500 г
mp-p(NaOH) = 20 г
w(NaOH) = 20%
Найти:
w(Fe(NO3)3) — ?
Уровень «Мастер»
Вы готовы сделать больше, чем записать уравнения реакции. Вы помните основные расчетные формулы и можете найти количество вещества по заданной массе и объему.
ШАГ 2. Используйте известные числовые значения, чтобы рассчитать количества вещества всех необходимых участников реакций
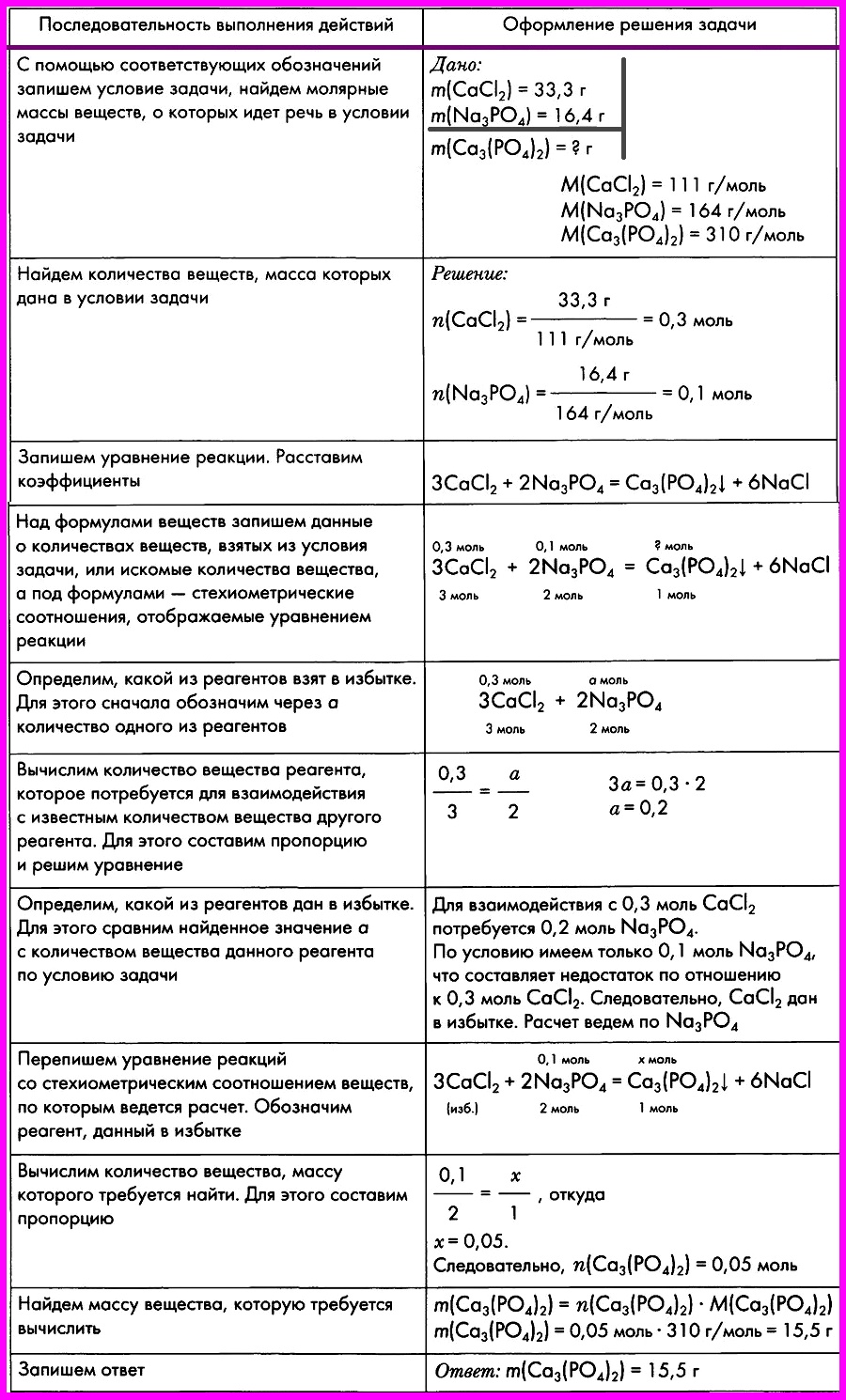
Переходим к действию. Нужно найти вещество, о котором мы все знаем. В приведенном примере это гидроксид натрия. Необходимо рассчитать количество вещества. Используем для этого основные расчетные формулы:
NaOH
mp-pa = 20 г
w = 0,2
m = mp-pw = 20 × 0,2 = 4 г
М = 40 г/моль
n = m : M = 4 : 40 = 0,1 моль
Задаем себе вопрос: что нам дает это значение? Каждый ответ должен вести к следующему действию. Так, мы можем рассчитать количество оксида азота IV – NO2, а благодаря ему получим количество вещества Fe3O4.
Совет: в задаче 33 по химии рассчитывайте сразу и количество вещества, и массу любого соединения, с которым работаете. Эти массы пригодятся при нахождении итогового раствора. А если не пригодятся, не переписывайте их в чистовик.
ИТОГО: +1 балл
Уровень «Гуру»
Вас не пугает уравнение с иксом в химии. Более того, вы можете его и составить, и решить.
ШАГ 3. Продумайте, как от найденных количеств вещества дойти по цепочке до искомого соединения
Что нужно найти дополнительно, чтобы получить ответ в задаче 33 по химии? Здесь может пригодиться работа с переменными, пропорции, соотношения и даже составление системы уравнений с двумя неизвестными.
Работаем!
Мы получили количества вещества нескольких соединений. Но так и не добрались до второй реакции и Fe2O3. Кроме того, мы не использовали соотношение атомов. Если вам ничего не дано для вещества по условию, а также вам не удалось подойти к нему через промежуточные расчеты, дело за уравнением. За х всегда принимайте количество неизвестного вещества.
Для нашего примера получим:
Совет: не пытайтесь принять за х все, что не получается рассчитать. Чаще всего задача 33 по химии решается без каких-либо переменных.
ИТОГО: +1 балл
Уровень «Профессионал»
Самое сложное уже позади. Теперь вам остается грамотно довести до конца. Обычно в завершении задачи требуется рассчитать массу полученного раствора и массовую долю вещества в нем. Чтобы не допустить ошибку на последнем этапе, помним, что в раствор входят все вещества, описанные в условии задачи, за исключением веществ, участвующих в реакциях сплавления, разложения и горения. Также обязательно нужно вычесть из этой массы потери. Потерями считаем осадки, газы, выпаренную воду, непрореагировавшие металлы и их оксиды.
ШАГ 4. Внимательно прочитайте вопрос задачи и рассчитайте искомую величину
Чаще всего необходимо вычислять массовую долю вещества в растворе. Предварительно вычислите массу полученного раствора с учетом всех потерь — осадков, газов и т.п.
В приведенном примере в раствор входит смесь железной окалины и оксида железа (III) и раствор азотной кислоты. Потеря — газообразное вещество NO2 (он же бурый газ).
mp-pa = m(Fe3O4) + m(Fe2O3) + mp-p(HNO3) – m(NO2) = 23,2 + 32 + 500 – 4,6 = 550,7 г
Зная количества вещества оксидов, вычислим количество вещества и массу искомой соли, а также ее массовую долю:
ИТОГО: +1 балл
Вот вы и решили 33 задачу в ЕГЭ по химии. Сложная ли она? Безусловно. Но можно ли с ней побороться? Да! Помните, что это задание, как и любое другое из второй части, оценивают согласно критериям. Не оставляйте его совсем без решения. Вы сможете остановиться на любом этапе и при этом принести в свою копилку больше, чем 0 баллов. А в пересчете на 100-балльную шкалу это будет уже весомо!
А если хотите научиться пошагово решать и другие задания из ЕГЭ по химии, записывайтесь ко мне на курсы подготовки к экзамену. Мы разберемся во всей теории, будем тренироваться в практических заданиях и научимся оформлять ответы в полном соответствии с критериями. Не теряйте возможность получить 80+ за ЕГЭ по химии — записывайтесь.
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса — Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса — Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль — единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) — число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль — международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов — вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается «ню»).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса — M
Молярная масса — масса одного моля вещества, выражается в «г/моль» (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы — массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl — 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково — 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика — лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем — объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как — VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. — константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор — Cl2.


Моль (количество вещества) — самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи — выполнена 

Относительная плотность и газы — D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): «Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества»

Относительная плотность и водный раствор — ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении — так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам «как к числам», то не запутаетесь.
В ходе ваших действий «грамм» и «грамм» должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 
К примеру, даны масса раствора HCl — 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля — ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах — его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Задачи №35 на ЕГЭ по химии
Алгоритм решения подобных заданий
1. Общая формула гомологического ряда
Наиболее часто используемые формулы сведены в таблицу:
|
Гомологический ряд |
Общая формула |
|
Алканы |
CnH2n+2 |
|
Алкены |
CnH2n |
|
Алкины |
CnH2n-2 |
|
Диены |
CnH2n-2 |
|
Арены |
CnH2n-6 |
|
Предельные одноатомные спирты |
CnH2n+1ОН |
|
Предельные альдегиды |
CnH2n+1СОН |
|
Предельные монокарбоновые кислоты |
CnH2n+1СОOН |
2. Уравнение реакции
1) ВСЕ органические вещества горят в кислороде с образованием углекислого газа, воды, азота (если в соединении присутствует N) и HCl (если есть хлор):
CnHmOqNxCly + O2 = CO2 + H2O + N2 + HCl (без коэффициентов!)
2) Алкены, алкины, диены склонны к реакциям присоединения (р-ции с галогенами, водородом, галогенводородами, водой):
CnH2n + Cl2 = CnH2nCl2
CnH2n + H2 = CnH2n+2
CnH2n + HBr = CnH2n+1Br
CnH2n + H2O = CnH2n+1OH
Алкины и диены, в отличие от алкенов, присоединяют до 2 моль водорода, хлора или галогенводорода на 1 моль углеводорода:
CnH2n-2 + 2Cl2 = CnH2n-2Cl4
CnH2n-2 + 2H2 = CnH2n+2
При присоединении воды к алкинам образуются карбонильные соединения, а не спирты!
3) Для спиртов характерны реакции дегидратации (внутримолекулярной и межмолекулярной), окисления (до карбонильных соединений и, возможно, далее до карбоновых кислот). Спирты (в т.ч., многоатомные) реагируют с щелочными металлами с выделением водорода:
CnH2n+1OH = CnH2n + H2O
2CnH2n+1OH = CnH2n+1OCnH2n+1 + H2O
2CnH2n+1OH + 2Na = 2CnH2n+1ONa + H2
4) Химические свойства альдегидов весьма разнообразны, однако здесь мы вспомним лишь об окислительно — восстановительных реакциях:
CnH2n+1COH + H2 = CnH2n+1CH2OH (восстановление карбонильных соединений в прис. Ni),
CnH2n+1COH + [O] = CnH2n+1COOH
важный момент: окисление формальдегида (НСОН) не останавливается на стадии муравьиной кислоты, НСООН окисляется далее до СО2 и Н2О.
5) Карбоновые кислоты проявляют все свойства «обычных» неорганических кислот: взаимодействуют с основаниями и основными оксидами, реагируют с активными металлами и солями слабых кислот (напр., с карбонатами и гидрокарбонатами). Весьма важной является реакция этерификации — образование сложных эфиров при взаимодействии со спиртами.
CnH2n+1COOH + KOH = CnH2n+1COOK + H2O
2CnH2n+1COOH + CaO = (CnH2n+1COO)2Ca + H2O
2CnH2n+1COOH + Mg = (CnH2n+1COO)2Mg + H2
CnH2n+1COOH + NaHCO3 = CnH2n+1COONa + H2O + CO2
CnH2n+1COOH + C2H5OH = CnH2n+1COOC2H5 + H2O
3. Нахождение количества вещества по его массе (объему)
формула, связывающая массу вещества (m), его количество (n) и молярную массу (M):
m = n*M или n = m/M.
Например, 710 г хлора (Cl2) соответствует 710/71 = 10 моль этого вещества, поскольку молярная масса хлора = 71 г/моль.
Для газообразных веществ удобнее работать с объемами, а не с массами. Напомню, что количество вещества и его объем связаны следующей формулой: V = Vm*n, где Vm — молярный объем газа (22,4 л/моль при нормальных условиях).
4. Расчеты по уравнениям реакций
Это, наверное, главный тип расчетов в химии. Если вы не чувствуете уверенности при решении подобных задач, необходимо тренироваться.
Основная идея заключается в следующем: количества реагирующих веществ и образующихся продуктов относятся так же, как соответствующие коэффициенты в уравнении реакции (вот почему так важно правильно их расставить!)
Рассмотрим, например, следующую реакцию: А + 3B = 2C + 5D. Уравнение показывает, что 1 моль А и 3 моль B при взаимодействии образуют 2 моль C и 5 моль D. Количество В в три раза превосходит количество вещества А, количество D — в 2,5 раза больше количества С и т. д. Если в реакцию вступит не 1 моль А, а, скажем, 10, то и количества всех остальных участников реакции увеличатся ровно в 10 раз: 30 моль В, 20 моль С, 50 моль D. Если нам известно, что образовалось 15 моль D (в три раза больше, чем указано в уравнении), то и количества всех остальных соединений будут в 3 раза больше.
5. Вычисление молярной массы исследуемого вещества
Масса Х обычно дается в условии задачи, количество Х мы нашли в п. 4. Осталось еще раз использовать формулу М = m/n.
6. Определение молекулярной формулы Х.
Финальный этап. Зная молярную массу Х и общую формулу соответствующего гомологического ряда, можно найти молекулярную формулу неизвестного вещества.
Пусть, например, относительная молекулярная масса предельного одноатомного спирта равна 46. Общая формула гомологического ряда: CnH2n+1ОН. Относительная молекулярная масса складывается из массы n атомов углерода, 2n+2 атомов водорода и одного атома кислорода. Получаем уравнение: 12n + 2n + 2 + 16 = 46. Решая уравнение, получаем, что n = 2. Молекулярная формула спирта: C2H5ОН.
Не забудьте записать ответ!
Пример 1. 10,5 г некоторого алкена способны присоединить 40 г брома. Определите неизвестный алкен.
Решение. Пусть молекула неизвестного алкена содержит n атомов углерода. Общая формула гомологического ряда CnH2n. Алкены реагируют с бромом в соответствии с уравнением:
CnH2n + Br2 = CnH2nBr2.
Рассчитаем количество брома, вступившего в реакцию: M(Br2) = 160 г/моль. n(Br2) = m/M = 40/160 = 0,25 моль.
Уравнение показывает, что 1 моль алкена присоединяет 1 моль брома, следовательно, n(CnH2n) = n(Br2) = 0,25 моль.
Зная массу вступившего в реакцию алкена и его количество, найдем его молярную массу: М(CnH2n) = m(масса)/n(количество) = 10,5/0,25 = 42 (г/моль).
Теперь уже совсем легко идентифицировать алкен: относительная молекулярная масса (42) складывается из массы n атомов углерода и 2n атомов водорода. Получаем простейшее алгебраическое уравнение:
12n + 2n = 42.
Решением этого уравнения является n = 3. Формула алкена: C3H6.
Ответ: C3H6.
Пример 2. На полное гидрирование 5,4 г некоторого алкина расходуется 4,48 л водорода (н. у.) Определите молекулярную формулу данного алкина.
Решение. Будем действовать в соответствии с общим планом. Пусть молекула неизвестного алкина содержит n атомов углерода. Общая формула гомологического ряда CnH2n-2. Гидрирование алкинов протекает в соответствии с уравнением:
CnH2n-2 + 2Н2 = CnH2n+2.
Количество вступившего в реакцию водорода можно найти по формуле n = V/Vm. В данном случае n = 4,48/22,4 = 0,2 моль.
Уравнение показывает, что 1 моль алкина присоединяет 2 моль водорода (напомним, что в условии задачи идет речь о полном гидрировании), следовательно, n(CnH2n-2) = 0,1 моль.
По массе и количеству алкина находим его молярную массу: М(CnH2n-2) = m(масса)/n(количество) = 5,4/0,1 = 54 (г/моль).
Относительная молекулярная масса алкина складывается из n атомных масс углерода и 2n-2 атомных масс водорода. Получаем уравнение:
12n + 2n — 2 = 54.
Решаем линейное уравнение, получаем: n = 4. Формула алкина: C4H6.
Ответ: C4H6.
Пример 3. При сгорании 112 л (н. у.) неизвестного циклоалкана в избытке кислорода образуется 336 л СО2. Установите структурную формулу циклоалкана.
Решение. Общая формула гомологического ряда циклоалканов: СnH2n. При полном сгорании циклоалканов, как и при горении любых углеводородов, образуются углекислый газ и вода:
CnH2n + 1,5n O2 = n CO2 + n H2O.
Обратите внимание: коэффициенты в уравнении реакции в данном случае зависят от n!
В ходе реакции образовалось 336/22,4 = 15 моль углекислого газа. В реакцию вступило 112/22,4 = 5 моль углеводорода.
Дальнейшие рассуждения очевидны: если на 5 моль циклоалкана образуется 15 моль CO2, то на 5 молекул углеводорода образуется 15 молекул углекислого газа, т. е., одна молекула циклоалкана дает 3 молекулы CO2. Поскольку каждая молекула оксида углерода (IV) содержит по одному атому углерода, можно сделать вывод: в одной молекуле циклоалкана содержится 3 атома углерода.
Вывод: n = 3, формула циклоалкана — С3Н6.
формуле С3Н6 соответствует всего один изомер — циклопропан.
Ответ: циклопропан.
Пример 4. 116 г некоторого предельного альдегида нагревали длительное время с аммиачным раствором оксида серебра. В ходе реакции образовалось 432 г металлического серебра. Установите молекулярную формулу альдегида.
Решение. Общая формула гомологического ряда предельных альдегидов: CnH2n+1COH. Альдегиды легко окисляются до карбоновых кислот, в частности, под действием аммиачного раствора оксида серебра:
CnH2n+1COH + Ag2O = CnH2n+1COOH + 2Ag.
Примечание. В действительности, реакция описывается более сложным уравнением. При добавлении Ag2O к водному раствору аммиака образуется комплексное соединение [Ag(NH3)2]OH — гидроксид диамминсеребра. Именно это соединение и выступает в роли окислителя. В ходе реакции образуется аммонийная соль карбоновой кислоты:
CnH2n+1COH + 2[Ag(NH3)2]OH = CnH2n+1COONH4 + 2Ag + 3NH3 + H2O.
Еще один важный момент! Окисление формальдегида (HCOH) не описывается приведенным уравнением. При взаимодействии НСОН с аммиачным раствором оксида серебра выделяется 4 моль Ag на 1 моль альдегида:
НCOH + 2Ag2O = CO2 + H2O + 4Ag.
Будьте осторожны, решая задачи, связанные с окислением карбонильных соединений!
Вернемся к нашему примеру. По массе выделившегося серебра можно найти количество данного металла: n(Ag) = m/M = 432/108 = 4 (моль). В соответствии с уравнением, на 1 моль альдегида образуется 2 моль серебра, следовательно, n(альдегида) = 0,5n(Ag) = 0,5*4 = 2 моль.
Молярная масса альдегида = 116/2 = 58 г/моль. Дальнейшие действия попробуйте проделать самостоятельно: необходимо составить уравнение решить его и сделать выводы.
Ответ: C2H5COH.
Пример 5. При взаимодействии 3,1 г некоторого первичного амина с достаточным количеством HBr образуется 11,2 г соли. Установите формулу амина.
Решение. Первичные амины (СnH2n+1NH2) при взаимодействии с кислотами образуют соли алкиламмония:
СnH2n+1NH2 + HBr = [СnH2n+1NH3]+Br—.
К сожалению, по массе амина и образовавшейся соли мы не сможем найти их количества (поскольку неизвестны молярные массы). Пойдем по другому пути. Вспомним закон сохранения массы: m(амина) + m(HBr) = m(соли), следовательно, m(HBr) = m(соли) — m(амина) = 11,2 — 3,1 = 8,1.
Обратите внимание на этот прием, весьма часто используемый при решении C 5. Если даже масса реагента не дана в явной форме в условии задачи, можно попытаться найти ее по массам других соединений.
Итак, мы вернулись в русло стандартного алгоритма. По массе бромоводорода находим количество, n(HBr) = n(амина), M(амина) = 31 г/моль.
Ответ: CH3NH2.
Пример 6. Некоторое количество алкена Х при взаимодействии с избытком хлора образует 11,3 г дихлорида, а при реакции с избытком брома — 20,2 г дибромида. Определите молекулярную формулу Х.
Решение. Алкены присоединяют хлор и бром с образованием дигалогенпроизводных:
СnH2n + Cl2 = СnH2nCl2,
СnH2n + Br2 = СnH2nBr2.
Бессмысленно в данной задаче пытаться найти количество дихлорида или дибромида (неизвестны их молярные массы) или количества хлора или брома (неизвестны их массы).
Используем один нестандартный прием. Молярная масса СnH2nCl2 равна 12n + 2n + 71 = 14n + 71. М(СnH2nBr2) = 14n + 160.
Массы дигалогенидов также известны. Можно найти количества полученных веществ: n(СnH2nCl2) = m/M = 11,3/(14n + 71). n(СnH2nBr2) = 20,2/(14n + 160).
По условию, количество дихлорида равно количеству дибромида. Этот факт дает нам возможность составить уравнение: 11,3/(14n + 71) = 20,2/(14n + 160).
Данное уравнение имеет единственное решение: n = 3.
Ответ: C3H6
Ниже приведен подробный разбор демоверсии ЕГЭ-2023 по химии, проектная версия. Задания разобраны от 1 до 34 подряд, приведена логика рассуждения по каждому из них. Если есть желание разобраться более детально, то переходите по ссылкам в тексте или записывайтесь к нам на курс.
Для выполнения первого задания всегда рекомендую расписать электронно-графические формулы элементов (с ячейками). В большинстве случаев достаточно изобразить внешний и предвнешний уровень. Напомню также, что для элементов дальше IV периода не нужно изображать формулу целиком, а можно воспользоваться аналогией строения валентных подуровней с соседом из подгруппы. По приведенным элементам:
- Цезий находится в первой группе, главной подгруппе, аналог натрия по строению внешнего уровня. Имеет 1 электрон на 6s-подуровне, он же является неспаренным.
- Углерод находится в четвертой группе, главной подгруппе. На внешнем уровне имеет 4 электрона, из них неспаренных два, которые находятся на 2р-подуровне.
- Кислород находится в шестой группе, главной подгруппе. На внешнем уровне имеет 6 электронов, из них неспаренных два, которые находятся на 2р-подуровне.
- Хром находится в шестой группе, побочной подгруппе. Необходимо вспомнить о проскоке электрона, за счет которого на внешнем уровне, 4s-подуровне, имеет 1 электрон, а не предвнешнем, 3d-подуровне, – пять. Итого 6 неспаренных.
- Азот находится в пятой группе, главной подгруппе. На внешнем уровне имеет 5 электронов, из них неспаренных три, которые находятся на 2р-подуровне.
Выбираем углерод и кислород, у обоих по два неспаренных электрона.
Ответ: 23
Необходимо вспомнить, что к р-элементам можно отнести элементы главных подгрупп шести последних групп в периоде. Представители первых двух относятся к s-элементам, а элементы побочных подгрупп относим к d-элементам. Исходя из приведенных соображений, выбираем пункты 2), 3), 5).
Атомный радиус уменьшается направо по периоду, поэтому располагаем выбранные ранее элементы в порядке 2), 5), 3).
Ответ: 253
Для выполнения такого рода заданий рекомендую выписать на лист бумаги высшую и низшую степени окисления для каждого из элементов.
- Цезий имеет высшую степень окисления +1, низшую – 0. Разность 1.
- Углерод имеет высшую степень окисления +4, низшую – -4. Разность 8.
- Кислород имеет высшую степень окисления +2, низшую – -2. Разность 4.
- Хром имеет высшую степень окисления +6, низшую – 0. Разность 6.
- Азот имеет высшую степень окисления +5, низшую – -3. Разность 8.
Таким образом, выбираем углерод и азот.
Ответ: 25
В задании, по сути, есть два фильтра: по типу строения и по характеру связи. Начнем с типа строения. Поскольку необходимо выбрать вещества молекулярного строения, то сразу можно исключить соли и иные соединения, имеющие ионные связи. Убираем из рассмотрения пункты 1) и 4). Среди оставшихся нужно найти вещества с ковалентной полярной связью. Вспомним, что такая связь может возникать между атомами разных неметаллов (или сильно различающихся фрагментов в органических молекулах). По такому принципу можно исключить пункт 5). Остаются вещества 2) и 3).
Ответ: 23
К двухосновным кислотам относятся те из них, которые содержат в молекуле 2 атома водорода, способных замещаться на катионы металлов. Подобным требованиям отвечает сернистая кислота, пункт 4).
К средним можно отнести соли, не содержащие способных к замещению атомов водорода, фрагментов ОН, комплексных ионов и подобного. Из приведенного списка можно взять аммиачную селитру, тривиальное название нитрата аммония.
К амфотерным гидроксидам можно отнести гидроксиды металлов в степенях окисления +3 и +4, также гидроксиды бериллия, цинка, свинца, олова. Подойдет пункт 2).
Ответ: 482
Попробуем найти в приведенном списке сильные кислоты. Пункт 1) подходит, поскольку в пункте 3) находится слабая кислота. Таким образом X уже установлен.
Среди оставшихся пунктов нужно найти вещество, которое при добавлении вызовет растворение гидроксида алюминия. Поскольку гидроксид является амфотерным, то сможет прореагировать с кислотой, кроме наиболее слабых, или щелочью. Среди приведенных соединений можно взять 4), поскольку гидроксид калия является щелочью.
Ответ: 14
Для выполнения подобных заданий советую следующий порядок действий:
- Берем вещество из левого столбика
- Классифицируем его, вспоминаем характерные типы реакций для такого класса соединений
- Оцениваем его с точки зрения кислотно-основных и окислительно-восстановительных свойств
- Подбираем вещества и правого столбика, противоположные по свойствам и способные реагировать с веществом из правого столбика
Пункт А):
Сера относится к простым веществам-неметаллам, средняя по активности. Способна вступать в реакцию со щелочами, сильными окислителями и активными восстановителями. С водой и кислотами, кроме кислот-окислителей, реакции нет.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 3) водород выступит против серы в качестве восстановителя, хлор и кислород – окислители. Подходит.
В пункте 4) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 5) нет реакции уже с первым веществом, дальше не продолжаем.
Пункт Б):
Оксид серы (VI) относится к кислотным оксидам, реагирует с водой, большинством веществ основной и амфотерной природы. Восстановительных свойств не проявляет, может быть окислителем.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) оксид бария – основный, КОН – щелочь, с водой реакция тоже есть. Подходит.
В пункте 3) хлор и кислород – окислители, не подходит.
В пункте 4) нет реакции с уксусной кислотой, не подходит.
В пункте 5) нет реакции уже со вторым веществом, дальше не продолжаем.
Пункт В):
Гидроксид цинка относится к амфотерным гидроксидам, может реагировать со щелочами, кислотами. Выраженных окислительных или восстановительных свойств не проявляет. В воде нерастворим, с солями не обменивается.
В пункте 1) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 2) нет реакции с водой, не подходит.
В пункте 3) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 4) реагирует с кислотами и щелочью. Подходит.
В пункте 5) нет реакции с хлоридом бария, не подходит.
Пункт Г):
Бромид цинка относится к солям, может вступать в реакции обмена со щелочами и солями. Может проявлять восстановительные свойства за счет бромид-иона.
В пункте 1) обмен имеет смысл с первым и вторым веществам, с третьим будет ОВР. Подходит.
В пункте 2) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 3) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 4) нет реакции уже с первым веществом, дальше не продолжаем.
В пункте 5) нет реакции уже с первым веществом, дальше не продолжаем.
Ответ: 3241
Для ответа на вопрос имеет смысл оценить свойства веществ в каждой паре, а при необходимости записать уравнение реакции между ними. Сделаем и то, и другое.
В пункте А) магний является сильным восстановителем, а концентрированная серная кислота – окислителем. Магний способен восстановить серу до низшей степени окисления:
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
В пункте Б) встречаются основный оксид и кислота, произойдет обмен:
MgO + H2SO4 = MgSO4 + H2O
В пункте В) сера выступает в качестве восстановителя, а концентрированная серная кислота – окислитель. Произойдет ОВР:
S + 2H2SO4 = 3SO2 + 2H2O
В пункте Г) сероводород выступает в качестве восстановителя, а кислород – окислитель. Произойдет ОВР:
2H2S + 3O2 = 2SO2 + 2H2O
Ответ: 5144
Обратим внимание, что железо в одну стадию переходит в степень окисления +3. Для этого нам нужен сильный окислитель- хлор.
2Fe + 3Cl2 = 2FeCl3
Во второй реакции железо понижает степень окисления до +2, поэтому необходимо найти восстановитель. Им тут может быть только йодид калия.
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
Ответ: 43
Для установления соответствия имеет смысл найти в структурах из левого столбика характерные функциональные группы и фрагменты.
В структуре А) видим фрагмент -NH-, который можно отнести ко вторичному амину. Циклическая структура молекулы в данном случае ничего не значит.
В структуре Б) есть аминогруппа и карбоксильная группа. Соответственно, вещество можно отнести к аминокислотам.
В структуре В) есть структурный фрагмент -С(О)NH- и просматриваются два остатка от аминокислот, что указывает на дипептид.
Ответ: 231
К решению подобных заданий может быть несколько подходов. Можно для начала определить молекулярную формулу бутена-1, а затем сравнить ее с молекулярными формулами предложенных вариантов. Изомеры по определению должны иметь одинаковые молекулярные формулы.
Бутен-1 – С4Н8
- С4Н10
- С4Н8
- С4Н6
- С4Н6
- С4Н8
Ответ: 25
Поскольку подкисленный раствор перманганата проявляет сильные окислительные свойства, следует поискать вещества, которые могут окисляться с образованием карбоновой кислоты. Прокомментируем все предложенные пункты:
- Окисляется с разрывом кратной связи, кислота будет
- Не окисляется
- Окисляется по боковой цепи, кислота будет
- Не окисляется
- Окисляется до кислоты
Ответ: 135
Метиламин относится к первичным алифатическим аминам, проявляет выраженные основные свойства, вступает в реакции алкилирования, реагирует с азотистой кислотой. Прокомментируем все предложенные пункты:
- Алкан, низкая активность, реакции нет
- Хлоралкан, реакция алкилирования, реагирует
- Водород, гидрировать нечего, не реагирует
- Основание, не реагирует
- Кислота, образование соли, реагирует
Ответ: 25
Для решения имеет смысл записать классы соединений из левого столбика, далее оценить происходящие изменения:
А) 1,2-дигалогеналкан – алкен
Б) моногалогеналкан – алкен
В) моногалогеналкан – алкан
Г) 1,2-дигалогеналкан – алкин
По изменениям назвать тип происходящей реакции и подобрать к ней подходящий реагент:
А) дегалогенирование, магний
Б) дегидрогалогенирование, спиртовой раствор щелочи
В) реакция Вюрца, натрий
Г) дегидрогалогенирование, спиртовой раствор щелочи
Ответ: 1252
Для надежности перед выбором ответа имеет смысл преобразовать названия веществ в формулы и прописать предложенные реакции. Попробуем это сделать:
А) 2CH3COOH + Na2S = 2CH3COONa + H2S
Б) HCOOH + NaOH = HCOONa + H2O
В) HCOH + 4Cu(OH)2 = 2Cu2O + CO2 + 5H2O
Г) 2CH3CH2OH + 2Na = 2CH3CH2ONa + H2
Ответ: 5462
При рассмотрении цепочек превращений бывает полезно посмотреть через одну стадию и оценить, как можно осуществить такое превращение. Также очень полезно сравнить число атомов углерода в исходной молекуле и продукте, может навести на мысль.
В первых двух реакциях цепочки число атомов углерода удваивается, что наводит на мысль о реакции Вюрца. Если рассуждение верное, то веществом Х должен быть галогеналкан. Действительно, его можно получить в одну стадию из спирта, а затем превратить в алкан.
Следующее превращение можно понять, если посмотреть на условия реакции. Нагревание линейного алкана в присутствии хлорида алюминия приводит к его изомеризации в разветвленный алкан.
Ответ: 54
Для решения можно переписать вещества в парах в виде формул, оценить их окислительно-восстановительные свойства и возможность реакции между ними:
- K2S – восстановитель, KMnO4 – окислитель, имеет смысл
- H2SO4 – окислитель, NaCl – очень слабый восстановитель, не ОВР
- NH4Cl – очень слабый восстановитель, NaNO2 – окислитель, специфический случай обмена, сопровождаемого ОВР
- SiO2 – выраженных окислительно-восстановительных свойств не проявляет, Na2CO3 — выраженных окислительно-восстановительных свойств не проявляет, не ОВР
- HI – восстановитель, Na2Cr2O7 – сильный окислитель, имеет смысл
Для надежности можно записать уравнения реакций между ними:
- 2KMnO4 + 3K2S + 4H2O = 2MnO2 + 3S + 8KOH
- NaCl + H2SO4 = NaHSO4 + HCl
- NaNO2 + NH4Cl = NaCl + N2 + 2H2O
- Na2CO3 + SiO2 = Na2SiO3 + CO2
- Na2Cr2O7 + 14HI = 2NaI + 2CrI3 + 3I2 + 7H2O
Ответ: 135
Изменение давления не будет влиять на скорость реакций, в которых нет газообразных реагентов. Среди приведенных пунктов это будут 2), 3), 5).
Ответ: 235
Для решения подобных заданий нужно расставить степени окисления на атомах азота до и после реакции.
Если степень не меняется, то азот не проявляет окислительно-восстановительных свойств. Так будет в пункте А) (переход -3 в -3).
Если степень увеличится, то азот проявляет восстановительные свойства. Так будет в пунктах Б) (переход -3 в 0) и В) (переход -3 в +2).
Ответ: 422
В первом случае для решения необходимо вспомнить зависимость продуктов электролиза от состава соли:
А) соль образована катионом активного металла и кислородсодержащим анионом, на электродах выделятся водород и кислород.
Б) соль образована катионом активного металла и галогенид-ионом, на электродах выделятся водород и галоген.
В) соль образована катионом малоактивного металла и галогенид-ионом, на электродах выделятся металл и галоген.
Ответ: 342
Во втором случае нужно помнить, что алюминий получают при электролизе раствора оксида в расплаве криолита. Калий и подобные наиболее активные металлы только из расплавов галогенидов. Кислород в данном случае можно получить при электролизе водного раствора фторида калия.
Ответ: 124
Для начала имеет смысл определить класс каждого из соединений:
- Средняя соль
- Средняя соль
- Средняя соль
- Сильная кислота
Исходя из этого уже можно сказать, что наиболее низкое значение рН (самая кислая среда) будет в пункте 4).
Как разобраться с солями? Нужно оценить их способность к гидролизу и потенциальное влияние на среду раствора:
- Соль сильной кислоты и сильного основания, не гидролизуется, среда нейтральная
- Соль слабого основания и сильной кислоты, гидролиз по катиону, среда кислая
- Соль сильного основания и слабой кислоты, гидролиз по аниону, среда щелочная
Ответ: 4213
В задании на равновесие следует учитывать разные факторы. Пройдем по каждому из пунктов:
А) кислота при диссоциации может дать дополнительное количество ионов Н+, которые участвуют в равновесии. При увеличении их концентрации равновесие сместится в сторону обратной реакции.
Б) давление в данном случае не окажет влияния, поскольку нет участников-газов
В) повышение температуры сместит равновесие в сторону эндотермической реакции. В данном случае – прямой.
Г) твердая щелочь может раствориться и прореагировать с Н+, уменьшая концентрацию таких ионов в системе. Равновесие сместится в сторону прямой реакции.
Ответ: 2311
Задания подобного типа удобнее всего решать с помощью таблицы. Данный подход к решению задания ЕГЭ-2023 на равновесие в реакторе можно посмотреть по ссылке ниже:
Способ, на мой взгляд, наиболее оптимальный и доступный каждому.
Ответ: 25
В первом случае нужно подобрать такое вещество из правого столбика, которое реагирует с одним или двумя веществами из пары в левом столбике. При этом очень важно, чтобы реакция сопровождалась видимыми признаками:
Пара А):
- Есть реакция с азотной кислотой, сопровождается выделением газа и растворением твердого вещества. Нитрат натрия не реагирует. Подходит.
- Есть реакция с азотной кислотой, но внешних признаков нет. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
Пара Б):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с гидроксидом калия, но внешних признаков нет. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с гидроксидом натрия, сопровождается образованием осадка. Хлорид калия не реагирует. Подходит.
Пара В):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Есть реакция с хлоридом бария, сопровождается образованием осадка. Хлорид натрия не реагирует. Подходит.
Пара Г):
- Нет реакции ни с одним веществом из пары. Не подходит.
- Специфический случай, поскольку один из изначально образовавшихся нерастворимых гидроксидов (Al(OH)3) может раствориться снова при избытке щелочи. Подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
- Нет реакции ни с одним веществом из пары. Не подходит.
В заданиях второго типа имеет смысл записать происходящие реакции и попытаться себе их представить. Как может выглядеть и что увидим:
- 2CH3CH2COOH + 2Li = 2CH3CH2COOLi + H2
- 2CH3CH(OH)CH3 + 2K = 2CH3CH(OK)CH3 + H2
- Zn(OH)2 + 2CH3COOH = Zn(CH3COO)2 + 2H2O
- C2H2 + 2Br2 = CHBr2-CHBr2
В первом и втором случаях наблюдаем выделение газообразного водорода. В третьем наблюдаем растворение осадка гидроксида цинка. В четвертом исчезнет окраска брома, наблюдается обесцвечивание.
Ответ: 4415
Задание 25 охватывает несколько совершенно разнородных тем, каждая из которых требует отдельного блока знаний. Приведу здесь ссылки на полезные материалы по заданию, поскольку многое здесь нужно просто выучить.
По первому блоку следует знать, что сопряженные алкадиены используются для производства каучуков, а алкены – пластмасс. Метан в составе природного газа используют в качестве топлива.
По второму блоку можно относительно легко соотнести мономер и полимер, если представить себе структуру молекулы мономера. В молекуле этена всего два атома углерода, поэтому элементарное звено формулы полимера тоже содержит два атома углерода. По той же логике здесь можно действовать и для пропена с дивинилом.
Третий блок нужно просто выучить. По переработке углеводородов можно заглянуть сюда. Хорошее описание технологических процессов можно посмотреть здесь.
Ответ: 234; 214; 312
Для решения подобных заданий на растворы рекомендую использовать метод таблиц, подробно описанный здесь.
В итоге решение задачи сводится к уравнению вида
(15+х)/(150+х) = 0,12
15+х = 18+0,12х
0,88х = 3
х = 3,4
Ответ: 3,4 г
Задания такого типа сводятся к решению пропорции. Для начала переведем известный объем аммиака в количество:
n(NH3) = V(NH3)/Vm = 0,56/22,4 = 0,025 (моль)
2 моль – 92 кДж
0,025 моль – х кДж
х = 1,15 кДж
Ответ: 1,15 кДж
Для решения первой задачи запишем уравнение протекающей реакции:
CaCO3 + 2HNO3 = Ca(NO3)2 + CO2 + H2O
Далее вычислим количество нитрата кальция:
n(Ca(NO3)2) = m(Ca(NO3)2)/M(Ca(NO3)2) = 196800/164 = 1200 (моль)
Вычислим массу чистого карбоната кальция, который содержался в известняке:
m(CaCO3) = n(Ca(NO3)2)·M(Ca(NO3)2) = 1200·100 = 120000 (г) = 120 (кг)
Вычислим массу примесей в известняке:
m(примеси) = m(известняка) – m(CaCO3) = 150 — 120 = 30 (кг)
Определим массовую долю примеси в известняке:
ω(примеси) = m(примеси)/m(известняка)·100% = 30/150·100% = 20%
Ответ: 20%
Для решения второй задачи запишем уравнение протекающей реакции:
3С2Н2 = С6Н6
Вычислим количества ацетилена и практически полученного бензола:
n(С2Н2) = V(С2Н2)/Vm = 26,88/22,4 = 1,2 (моль)
n(С6Н6 практ.) = m(С6Н6)/M(С6Н6) = 23,4/78 = 0,3 (моль)
Вычислим теоретически возможное количество бензола и сравним его с практическим:
n(С6Н6 теор.) = n(С2Н2)/3 = 1,2/3 = 0,4 (моль)
η(С6Н6) = n(С6Н6 практ.)/n(С6Н6 теор.)·100% = 0,3/0,4·100% = 75%
Ответ: 75%
При выполнении заданий 29 и 30 имеет смысл записать все представленные вещества в виде молекулярных формул:
KMnO4, NaHCO3, Na2SO3, BaSO4, KOH, H2O2
Далее следует внимательно прочитать описание реакции. Поскольку должно происходить изменение цвета раствора, нужно найти окрашенный реагент. Из предложенных это может быть только KMnO4. Это вещество проявляет сильные окислительные свойства, поэтому нужно подобрать восстановитель. Осадка в ходе реакции образоваться не должно, поэтому брать нейтральную среду нельзя. В противном случае выпадет осадок MnO2. Среда может быть кислой или щелочной. Кислоты в предложенном наборе нет, поэтому выберем гидроксид калия для создания среды. Восстановителей в предложенном наборе два: сульфит натрия и пероксид водорода. Пероксид брать нельзя, поскольку по описанию реакции газа образоваться не должно. Таким образом приходим к выводу, что нужно взять сульфит, перманганат и щелочь. Приведем соответствующую реакцию и электронный баланс:
2KMnO4 + Na2SO3 + 2KOH = 2K2MnO4 + Na2SO4 + H2O
2∙ | Mn+7 + 1ē → Mn+6
1∙ | S+4 – 2ē → S+6
марганец в степени окисления +7 (или перманганат калия) является окислителем.
сера в степени окисления +4 (или сульфит натрия) – восстановителем.
Есть хороший инструмент для отработки данного задания, рекомендую.
При выполнении заданий 29 и 30 имеет смысл записать все представленные вещества в виде молекулярных формул:
KMnO4, NaHCO3, Na2SO3, BaSO4, KOH, H2O2
Далее следует внимательно прочитать описание реакции. К кислым солям здесь относится только NaHCO3. В обмен с ней вступит только гидроксид калия, поскольку кислое и щелочь точно смогут прореагировать. Приведем молекулярное, полное и сокращенное ионные уравнения:
2NaHCO3 + 2KOH = Na2CO3 + K2CO3 + 2H2O
2Na+ + 2HCO3− + 2K+ + 2OH− = 2Na+ + CO32− + 2K+ + CO32− + 2H2O
HCO3− + OH− = CO32− + H2O
Решение 31 номера сводится к знанию неорганической химии, свойств и реакций отдельных веществ. Приведем уравнения протекающих процессов:
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
SO2 + 2H2S = 3S + 2H2O
3S + 6KOH = K2SO3 + 2K2S + 3H2O
При рассмотрении цепочек превращений бывает полезно посмотреть через одну стадию и оценить, как можно осуществить такое превращение. Также очень полезно сравнить число атомов углерода в исходной молекуле и продукте, может навести на мысль.
Начнем с циклогексана. Получить его путем гидрирования можно, например, из бензола. Его, в свою очередь, можно получить из гексана по реакции дегидроциклизации. Х1 – бензол. Далее в цепочке много неизвестных веществ, заглянем в самый конец. Циклогексанон относится к кетонам, получить его можно из вторичного спирта. Условия последней реакции на это указывают, поскольку там дан сильный окислитель в кислой среде. Тогда Х3 – циклогексанол. Получить такой спирт в две стадии нужно из циклоалкана. Тогда можно предположить последовательно галогенирование и замещение полученного галогенпроизводного под действием водного раствора щелочи. Тогда Х2 – хлорциклогексан, можно бромциклогексан. Последовательность реакций получается следующей:
Решение задачи начинается с анализа и расчета молекулярной формулы. Поскольку продуктами сгорания являются только углекислый газ и вода, можно приписать веществу формулу CxHyOz. Вычислим количества углекислого газа и воды:
n(H2O) = m(H2O)/M(H2O) = 1,8/18 = 0,1 (моль)
n(СО2) = V(CO2)/Vm = 4,48/22,4 = 0,2 (моль)
Тогда можно определить количества и массы элементов, входивших в состав исходного вещества:
n(С) = n(СО2) = 0,2 моль
m(С) = n(С)·M(С) = 0,2·12 = 2,4 г
n(H) = 2n(H2O) = 0,2 моль
m(H) = n(H)·M(H) = 0,2·1 = 0,2 г
m(О) = m(CxHyOz) − m(С) − m(H) = 3,4 − 2,4 − 0,2 = 0,8 (г)
n(O) = m(O)/M(O) = 0,8/16 = 0,05 (моль)
Вычислим молекулярную формулу неизвестного вещества:
x : y : z = n(С) : n(H) : n(O) = 0,2 : 0,2 : 0,05 = 4 : 4 : 1
Поскольку по условию один из фрагментов молекулы должен содержать 7 атомов углерода, разумным будет удвоить простейшее соотношение и получить формулу C8H8O2.
С8Н8О2 – молекулярная формула
Вещество по условию реагирует со щелочью, процесс гидролиза с образованием соли и спирта. В остатке кислоты 7 атомов углерода и малое количество атомов водорода, что вполне соответствует бензоату. Тогда на спирт приходится всего один атом углерода, что соответствует метанолу. Тогда можно предложить структуру метилбензоата:
Запишем уравнение его реакции с гидроксидом лития:
К заданию 34 следует приступать только после ПОЛНОГО выполнения и проверки всех остальных заданий КИМа. Убедитесь также, что все прочие задания перенесены в бланк ответов, а не остались на черновике. Времени на это задание нужно больше всего, поэтому велик риск потерять остальное и не успеть что-то перенести в бланк.
Для решения следует внимательно прочитать условие и написать реакции, которые сразу же очевидны, без дополнительных расчетов. Здесь их можно записать две:
Ca + 2HCl = CaCl2 + H2
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
Поскольку напрямую ничего не известно про массу и количество кальция и карбоната кальция, можно сказать, что кальция было х моль, а его карбоната у моль. Тогда в ходе реакций выделилось х моль водорода и у моль углекислого газа. Выразим массы указанных веществ:
m(Ca) = n·M = 40х г
m(CaCO3) = n·M = 100у г
m(Н2) = n·M = 2х г
m(CO2) = n·M = 44у г
Выразим массу раствора после добавления исходной твердой смеси к соляной кислоте:
m(р-ра) = m(Ca) + m(CaCO3) + m(р-ра HCl) − m(Н2) − m(CO2)
m(р-ра) = 40х + 100у + 300 − 2х − 44у = 330 (г)
38х + 56у = 30
Первое уравнение системы готово. Второе составим по массовой доле кальция в исходной смеси:
m(смеси) = m(Ca) + m(CaCO3) = 40х + 100у (г)
m(Ca) = 40х + 40у (г)
ω(Са) = m(Ca)/m(смеси)·100% = (40х+40у)/(40х+100у)·100% = 50%
(40х+40у)/(40х+100у) = 0,5
Составим и решим систему уравнений:
38х + 56у = 30
(40х + 40у)/(40х + 100у) = 0,5
38х + 56у = 30
(2х + 2у)/(2х + 5у) = 0,5
38х + 56у = 30
2х + 2у = х + 2,5у
38х + 56у = 30
х = 0,5у
75у = 30
у = 0,4
х = 0,2
n(Ca) = 0,2 моль
n(CaСО3) = 0,4 моль
Далее вычислим количество и массу углекислого газа:
n(СО2) = n(CaСО3) = 0,4 моль
m(СО2) = n(СО2)·M(СО2) = 0,4·44 = 17,6 г
Вычислим массу и количество гидроксида натрия:
m(NaOH) = m(р-ра NaOH)·ω(NaOH)/100% = 400·4%/100% = 16 (г)
n(NaOH) = m(NaOH)/M(NaOH) = 16/40 = 0,4 (моль)
Далее нужно сравнить количества щелочи и углекислого газа, чтобы понять, какая будет реакция между ними:
n(СО2)/n(NaOH) = 0,4/0,4 = 1:1
Соотношение 1:1, поэтому образуется кислая соль:
NaOH + CO2 = NaHCO3
Вычислим массу образовавшейся соли и массу раствора:
n(NaHCO3) = n(СО2) = 0,4 моль
m(NaHCO3) = n·M = 0,4·84 = 33,6 г
m(р-ра конечн.) = m(р-ра NaOH) + m(CO2) = 400 + 17,6 = 417,6 (г)
Вычислим массовую долю гидрокарбоната натрия в полученном растворе:
ω(NaHCO3) = m(NaHCO3)/m(р-ра конечн.)·100% = 33,6/417,6·100% = 8,05%
Ответ: 8,05%