Щелочные металлы
1. Положение в периодической системе химических элементов
2. Электронное строение и закономерности изменения свойств
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой и фосфором
7.1.3. Взаимодействие с водородом
7.1.4. Взаимодействие с азотом
7.1.5. Взаимодействие с углеродом
7.1.6. Горение
7.2. Взаимодействие со сложными веществами
7.2.1. Взаимодействие с водой
7.2.2. Взаимодействие с минеральными кислотами
7.2.3. Взаимодействие с серной кислотой
7.2.4. Взаимодействие с азотной кислотой
7.2.5. Взаимодействие со слабыми кислотами
7.2.6. Взаимодействие с солями
Оксиды щелочных металлов
1. Способы получения
2. Химические свойства
2.1. Взаимодействие с кислотными и амфотерными оксидами
2.2. Взаимодействие с кислотами
2.3. Взаимодействие с водой
2.4. Взаимодействие с кислотами
Пероксиды щелочных металлов
1. Химические свойства
1.1. Взаимодействие с водой
1.2. Взаимодействие с кислотными и амфотерными оксидами
1.3. Взаимодействие с кислотами
1.4. Разложение
1.5. Взаимодействие с восстановителями
1.6. Взаимодействие с окислителями
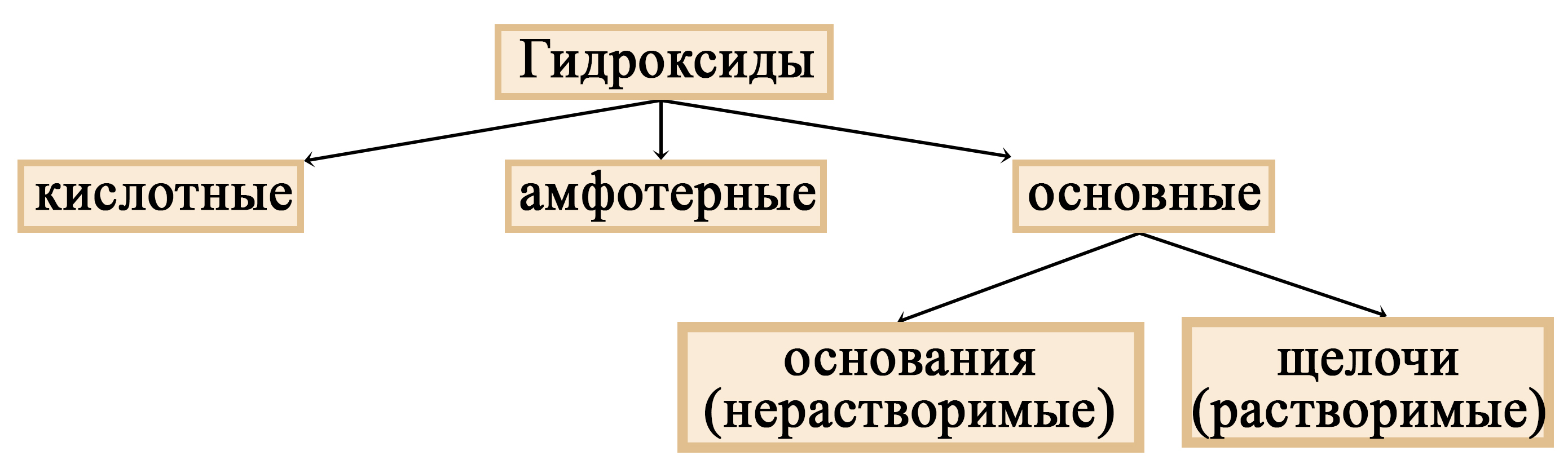
Гидроксиды щелочных металлов (щелочи)
1. Способы получения
2. Химические свойства
2.1. Взаимодействие щелочей с кислотами
2.2. Взаимодействие щелочей с кислотными оксидами
2.3. Взаимодействие щелочей с амфотерными оксидами и гидроксидами
2.4. Взаимодействие щелочей с кислыми солями
2.5. Взаимодействие щелочей с неметаллами
2.6. Взаимодействие щелочей с металлами
2.7. Взаимодействие щелочей с солями
2.8. Разложение щелочей
2.9. Диссоциация щелочей
2.10. Электролиз щелочей
Соли щелочных металлов
Щелочные металлы
Положение в периодической системе химических элементов
Щелочные металлы расположены в главной подгруппе первой группы периодической системы химических элементов Д.И. Менделеева (или просто в 1 группе в длиннопериодной форме ПСХЭ). Это литий Li, натрий Na, калий K, цезий Cs, рубидий Rb и франций Fr.
Электронное строение щелочных металлов и основные свойства
Электронная конфигурация внешнего энергетического уровня щелочных металлов: ns1, на внешнем энергетическом уровне находится 1 s-электрон. Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Рассмотрим некоторые закономерности изменения свойств щелочных металлов.
В ряду Li-Na-K-Rb-Cs-Fr, в соответствии с Периодическим законом, увеличивается атомный радиус, усиливаются металлические свойства, ослабевают неметаллические свойства, уменьшается электроотрица-тельность.
Физические свойства
Все щелочные металлы — вещества мягкие, серебристого цвета. Свежесрезанная поверхность их обладает характерным блеском.
Кристаллическая решетка щелочных металлов в твёрдом состоянии — металлическая. Следовательно, щелочные металлы обладают высокой тепло- и электропроводимостью. Кипят и плавятся при низких температурах. Они имеют также небольшую плотность.
Нахождение в природе
Как правило, щелочные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др. Основные минералы, в которых присутствуют щелочные металлы:
Поваренная соль, каменная соль, галит — NaCl — хлорид натрия
Сильвин KCl — хлорид калия
Сильвинит NaCl · KCl
Глауберова соль Na2SO4⋅10Н2О – декагидрат сульфата натрия
Едкое кали KOH — гидроксид калия
Поташ K2CO3 – карбонат калия
Поллуцит — алюмосиликат сложного состава с высоким содержанием цезия:
Способы получения
Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl (расплав) → 2Na + Cl2
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
Калий получают также электролизом расплавов солей или расплава гидроксида калия. Также распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов. В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний:
KCl + Na = K↑ + NaCl
KOH + Na = K↑ + NaOH
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl → 2Cs + CaCl2
В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме.
Качественные реакции
Качественная реакция на щелочные металлы — окрашивание пламени солями щелочных металлов.
Цвет пламени:
Li — карминно-красный
Na — жѐлтый
K — фиолетовый
Rb — буро-красный
Cs — фиолетово-красный
Химические свойства
1. Щелочные металлы — сильные восстановители. Поэтому они реагируют почти со всеми неметаллами.
1.1. Щелочные металлы легко реагируют с галогенами с образованием галогенидов:
2K + I2 = 2KI
1.2. Щелочные металлы реагируют с серой с образованием сульфидов:
2Na + S = Na2S
1.3. Щелочные металлы активно реагируют с фосфором и водородом (очень активно). При этом образуются бинарные соединения — фосфиды и гидриды:
3K + P = K3P
2Na + H2 = 2NaH
1.4. С азотом литий реагирует при комнатной температуре с образованием нитрида:
6Li + N2 = 2Li3N
Остальные щелочные металлы реагируют с азотом при нагревании.
1.5. Щелочные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
2Na + 2C = Na2C2
1.6. При взаимодействии с кислородом каждый щелочной металл проявляет свою индивидуальность: при горении на воздухе литий образует оксид, натрий – преимущественно пероксид, калий и остальные металлы – надпероксид.
4Li + O2 = 2Li2O
2Na + O2 = Na2O2
K + O2 = KO2
Цезий самовозгорается на воздухе, поэтому его хранят в запаянных ампулах. Видеоопыт самовозгорания цезия на воздухе можно посмотреть здесь.
2. Щелочные металлы активно взаимодействуют со сложными веществами:
2.1. Щелочные металлы бурно (со взрывом) реагируют с водой. Взаимодействие щелочных металлов с водой приводит к образованию щелочи и водорода. Литий реагирует бурно, но без взрыва.
Например, калий реагирует с водой очень бурно:
2K0 + H2+O = 2K+OH + H20
Видеоопыт: взаимодействие щелочных металлов с водой можно посмотреть здесь.
2.2. Щелочные металлы взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом. При этом образуются соль и водород.
Например, натрий бурно реагирует с соляной кислотой:
2Na + 2HCl = 2NaCl + H2↑
2.3. При взаимодействии щелочных металлов с концентрированной серной кислотой выделяется сероводород.
Например, при взаимодействии натрия с концентрированной серной кислотой образуется сульфат натрия, сероводород и вода:
8Na + 5H2SO4(конц.) → 4Na2SO4 + H2S + 4H2O
2.4. Щелочные металлы реагируют с азотной кислотой. При взаимодействии с концентрированной азотной кислотой образуется оксид азота (I):
8Na + 10HNO3 (конц) → N2O + 8NaNO3 + 5H2O
С разбавленной азотной кислотой образуется молекулярный азот:
10Na + 12HNO3 (разб)→ N2 +10NaNO3 + 6H2O
При взаимодействии щелочных металлов с очень разбавленной азотной кислотой образуется нитрат аммония:
8Na + 10HNO3 = 8NaNO3 + NH4NO3 + 3H2O
2.5. Щелочные металлы могут реагировать даже с веществами, которые проявляют очень слабые кислотные свойства. Например, с аммиаком, ацетиленом (и прочими терминальными алкинами), спиртами, фенолом и органическими кислотами.
Например, при взаимодействии лития с аммиаком образуются амиды и водород:
2Li + 2NH3 = 2LiNH2 + H2 ↑
Ацетилен с натрием образует ацетиленид натрия и также водород:
Н ─ C ≡ С ─ Н + 2Na → Na ─ C≡C ─ Na + H2
Фенол с натрием реагирует с образованием фенолята натрия и водорода:
2C6H5OH + 2Na → 2C6H5ONa + H2↑
Метанол с натрием образуют метилат натрия и водород:
2СН3ОН + 2Na → 2 CH3ONa + H2↑
Уксусная кислота с литием образует ацетат лития и водород:
2СH3COOH + 2Li → 2CH3COOLi + H2↑
Щелочные металлы реагируют с галогеналканами (реакция Вюрца).
Например, хлорметан с натрием образует этан и хлорид натрия:
2CH3Cl + 2Na → C2H6 + 2NaCl
2.6. В расплаве щелочные металлы могут взаимодействовать с некоторыми солями. Обратите внимание! В растворе щелочные металлы будут взаимодействовать с водой, а не с солями других металлов.
Например, натрий взаимодействует в расплаве с хлоридом алюминия :
3Na + AlCl3 → 3NaCl + Al
Оксиды щелочных металлов
Способы получения
Оксиды щелочных металлов (кроме лития) можно получить только косвенными методами: взаимодействием натрия с окислителями в расплаве:
1. Оксид натрия можно получить взаимодействием натрия с нитратом натрия в расплаве:
10Na + 2NaNO3 → 6Na2O + N2 ↑
2. Взаимодействием натрия с пероксидом натрия:
2Na + Na2O2 → 2Na2O
3. Взаимодействием натрия с расплавом щелочи:
2Na + 2NaOН → 2Na2O + Н2↑
4. Оксид лития можно получить разложением гидроксида лития:
2LiOН → Li2O + Н2O
Химические свойства
Оксиды щелочных металлов — типичные основные оксиды. Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой.
1. Оксиды щелочных металлов взаимодействуют с кислотными и амфотерными оксидами:
Например, оксид натрия взаимодействует с оксидом фосфора (V):
3Na2O + P2O5 → 2Na3PO4
Оксид натрия взаимодействует с амфотерным оксидом алюминия:
Na2O + Al2O3 → 2NaAlO2
2. Оксиды щелочных металлов взаимодействуют с кислотами с образованием средних и кислых солей (с многоосновными кислотами).
Например, оксид калия взаимодействует с соляной кислотой с образованием хлорида калия и воды:
K2O + 2HCl → 2KCl + H2O
3. Оксиды щелочных металлов активно взаимодействуют с водой с образованием щелочей.
Например, оксид лития взаимодействует с водой с образованием гидроксида лития:
Li2O + H2O → 2LiOH
4. Оксиды щелочных металлов окисляются кислородом (кроме оксида лития): оксид натрия — до пероксида, оксиды калия, рубидия и цезия – до надпероксида.
2Na2O + O2 = 2Na2O2
Пероксиды щелочных металлов
Химические свойства
Свойства пероксидов очень похожи на свойства оксидов. Однако пероксиды щелочных металлов, в отличие от оксидов, содержат атомы кислорода со степенью окисления -1. Поэтому они могут могут проявлять как окислительные, так и восстановительные свойства.
1. Пероксиды щелочных металлов взаимодействуют с водой. При этом на холоде протекает обменная реакция, образуются щелочь и пероксид водорода:
Na2O2 + 2H2O (хол.) = 2NaOH + H2O2
При нагревании пероксиды диспропорционируют в воде, образуются щелочь и кислород:
2Na2O2 + 2H2O (гор.) = 4NaOH + O2↑
2. Пероксиды диспропорционируют при взаимодействии с кислотными оксидами.
Например, пероксид натрия реагирует с углекислым газом с образованием карбоната натрия и кислорода:
2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
3. При взаимодействии с минеральными кислотами на холоде пероксиды вступают в обменную реакцию. При этом образуются соль и перекись водорода:
Na2O2 + 2HCl = 2NaCl + H2O2
При нагревании пероксиды, опять-таки, диспропорционируют:
2Na2O2 + 2H2SO4 (разб.гор.) = 2Na2SO4 + 2H2O + O2↑
4. Пероксиды щелочных металлов разлагаются при нагревании, с образованием оксида и кислорода:
2Na2O2 = 2Na2O + O2↑
5. При взаимодействии с восстановителями пероксиды проявляют окислительные свойства.
Например, пероксид натрия с угарным газом реагирует с образованием карбоната натрия:
Na2O2 + CO = Na2CO3
Пероксид натрия с сернистым газом также вступает в ОВР с образованием сульфата натрия:
Na2O2 + SO2 = Na2SO4
2Na2O2 + S = Na2SO3 + Na2O
Na2O2 + 2H2SO4 + 2NaI = I2 + 2Na2SO4 + 2H2O
Na2O2 + 2H2SO4 + 2FeSO4 = Fe2(SO4)3 + Na2SO4 + 2H2O
3Na2O2 + 2Na3[Cr(OH)6] = 2Na2CrO4 + 8NaOH + 2H2O
6. При взаимодействии с сильными окислителями пероксиды проявляют свойства восстановителей и окисляются, как правило, до молекулярного кислорода.
Например, при взаимодействии с подкисленным раствором перманганата калия пероксид натрия образует соль и молекулярный кислород:
5Na2O2 + 8H2SO4 + 2KMnO4 = 5O2 + 2MnSO4 + 8H2O + 5Na2SO4 + K2SO4
Гидроксиды щелочных металлов (щелочи)
Способы получения
1. Щелочи получают электролизом растворов хлоридов щелочных метал-лов:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии щелочных металлов, их оксидов, пероксидов, гидридов и некоторых других бинарных соединений с водой также образуются щелочи.
Например, натрий, оксид натрия, гидрид натрия и пероксид натрия при растворении в воде образуют щелочи:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
Na2O2 + H2O → 2NaOH + H2O2
3. Некоторые соли щелочных металлов (карбонаты, сульфаты и др.) при взаимодействии с гидроксидами кальция и бария также образуют щелочи.
Например, карбонат калия с гидроксидом кальция образует карбонат кальция и гидроксид калия:
K2CO3 + Ca(OH)2 → CaCO3↓ + 2KOH
Химические свойства
1. Гидроксиды щелочных металлов реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например, гидроксид калия с фосфорной кислотой реагирует с образованием фосфатов, гидрофосфатов или дигидрофосфатов:
3KOH + H3PO4 → K3PO4 + H2O
2KOH + H3PO4 → K2HPO4 + 2H2O
KOH + H3PO4 → KH2PO4 + H2O
2. Гидроксиды щелочных металлов реагируют с кислотными оксидами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например, гидроксид натрия с углекислым газом реагирует с образованием карбонатов или гидрокарбонатов:
2NaOH(избыток) + CO2 → Na2CO3 + H2O
NaOH + CO2 (избыток) → NaHCO3
Необычно ведет себя оксид азота (IV) при взаимодействии с щелочами. Дело в том, что этому оксиду соответствуют две кислоты — азотная (HNO3) и азотистая (HNO2). «Своей» одной кислоты у него нет. Поэтому при взаимодействии оксида азота (IV) с щелочами образуются две соли- нитрит и нитрат:
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
А вот в присутствии окислителя, например, молекулярного кислорода, образуется только одна соль — нитрат, т.к. азот +4 только повышает степень окисления:
2KOH + 2NO2 + O2 = 2KNO3 + H2O
3. Гидроксиды щелочных металлов реагируют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются средние соли, а в растворе комплексные соли.
Например, гидроксид натрия с оксидом алюминия реагирует в расплаве с образованием алюминатов:
2NaOH + Al2O3 → 2NaAlO2 + H2O
в растворе образуется комплексная соль — тетрагидроксоалюминат:
2NaOH + Al2O3 + 3H2O → 2Na[Al(OH)4]
Еще пример: гидроксид натрия с гидроксидом алюминия в растворе образует также комплексную соль:
NaOH + Al(OH)3 → Na[Al(OH)4]
4. Щелочи также взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли.
Например: гидроксид калия реагирует с гидрокарбонатом калия с образованием карбоната калия:
KOH + KHCO3 → K2CO3 + H2O
5. Щелочи взаимодействуют с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется щелочами до силиката и водорода:
2NaOH + Si + H2O → Na2SiO3 + H2
Фтор окисляет щелочи. При этом выделяется молекулярный кислород:
4NaOH + 2F2 → 4NaF + O2 (OF2)+ 2H2O
Другие галогены, сера и фосфор — диспропорционируют в щелочах:
3KOH + P4 + 3H2O = 3KH2PO2 + PH3↑
2KOH(холодный) + Cl2 = KClO + KCl + H2O
6KOH(горячий) + 3Cl2 = KClO3 + 5KCl + 3H2O
Сера взаимодействует с щелочами только при нагревании:
6NaOH + 3S = 2Na2S + Na2SO3 + 3H2O
6. Щелочи взаимодействуют с амфотерными металлами, кроме железа и хрома. При этом в расплаве образуются соль и водород:
2KOH + Zn → K2ZnO2 + H2
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
7. Гидроксиды щелочных металлов вступают в обменные реакции с растворимыми солями.
С щелочами взаимодействуют соли тяжелых металлов.
Например, хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с щелочами взаимодействуют соли аммония.
Например, при взаимодействии хлорида аммония и гидроксида натрия образуются хлорид натрия, аммиак и вода:
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксиды всех щелочных металлов плавятся без разложения, гидроксид лития разлагается при нагревании до температуры 600°С:
2LiOH → Li2O + H2O
9. Все гидроксиды щелочных металлов проявляют свойства сильных оснований. В воде практически нацело диссоциируют, образуя щелочную среду и меняя окраску индикаторов.
NaOH ↔ Na+ + OH—
10. Гидроксиды щелочных металлов в расплаве подвергаются электролизу. При этом на катоде восстанавливаются сами металлы, а на аноде выделяется молекулярный кислород:
4NaOH → 4Na + O2 + 2H2O
Соли щелочных металлов
Нитраты и нитриты щелочных металлов
Нитраты щелочных металлов при нагревании разлагаются на нитриты и кислород. Исключение — нитрат лития. Он разлагается на оксид лития, оксид азота (IV) и кислород.
Например, нитрат натрия разлагается при нагревании на нитрит натрия и молекулярный кислород:
2NaNO3 → 2NaNO2 + O2
Нитраты щелочных металлов в реакциях могут выступать в качестве окислителей.
Нитриты щелочных металлов могут быть окислителями или восстановителями.
В щелочной среде нитраты и нитриты — очень мощные окислители.
Например, нитрат натрия с цинком в щелочной среде восстанавливается до аммиака:
NaNO3 + 4Zn + 7NaOH + 6H2O = 4Na2[Zn(OH)4] + NH3↑
Сильные окислители окисляют нитриты до нитратов.
Например, перманганат калия в кислой среде окисляет нитрит натрия до нитрата натрия:
5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за
их сильной реакционной способности.

Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств,
реакционной способности. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns1:
- Li — 2s1
- Na — 3s1
- K — 4s1
- Rb — 5s1
- Cs — 6s1
- Fr — 7s1
Природные соединения
В природе щелочные металлы встречаются в виде следующих соединений:
- NaCl — галит (каменная соль)
- KCl — сильвин
- NaCl*KCl — сильвинит

Получение
Получить такие активные металлы электролизом водного раствора — невозможно. Для их получения применяют электролиз расплавов при
высоких температурах (естественно — безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
- Реакция с кислородом
- Реакции с неметаллами
- Реакция с водой
- Окрашивание пламени
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид,
натрий — пероксид, калий, рубидий и цезий — супероксиды.
Li + O2 → Li2O (оксид лития)
Na + O2 → Na2O2 (пероксид натрия)
K + O2 → KO2 (супероксид калия)
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления
+1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Li + H2 → LiH (в гидридах водород -1)
Na + F2 → NaF (в фторидах фтор -1)
Na + S → Na2S (в сульфидах сера -2)
K + N2 → K3N (в нитридах азот -3)
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда — взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH — натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: «… в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет».
Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий — в желтый, калий — в фиолетовый, рубидий — синевато-красный,
цезий — синий.

Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение
Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
Li + O2 → Li2O (оксид лития)
В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из
пероксида, так и из супероксида, при желании можно получить оксид:
Na2O2 + Na → Na2O
KO2 + K → K2O
Химические свойства
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание — реакция идет, только если основание растворимо)
K2O + CO2 → K2CO3 (осн. оксид + кисл. оксид = соль)
Na2O + SO2 → Na2SO3 (обратите внимание — мы сохраняем СО серы +4)
Li2O + HCl → LiCl + H2O
Гидроксиды щелочных металлов
Относятся к щелочам — растворимым основаниям. Наиболее известные представители: NaOH — едкий натр, KOH — едкое кали.
Получение
Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции
щелочных металлов и их оксидов с водой:
KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде — хлор)
Li2CO3 + Ca(OH)2 → CaCO3↓ + LiOH
K + H2O → KOH + H2↑
Rb2O + H2O → RbOH

Химические свойства
Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется
газ или образуется слабый электролит (вода).
LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке — получается кислая соль)
2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке — получается средняя соль)
KOH + SO2 → KHSO3 (соотношение 1:1 — получается кислая соль)
2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 — получается средняя соль)
NaOH + MgBr2 → NaBr + Mg(OH)2↓
С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием окиселов —
смешанных оксидов (при высоких температурах — прокаливании).
NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется окисел — смесь двух оксидов: Al2O3
и Na2O, вода испаряется)
Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
В реакциях щелочей с йодом образуется исключительно иодат, так как гипоиодит неустойчив даже при комнатной температуре, не говоря о нагревании. С серой реакция протекает схожим образом:
NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)

NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам — и азотной,
и азотистой.
LiOH + NO2 → LiNO2 + LiNO3 + H2O
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Щелочи: определение, химические свойства, методы получения
Материал по химии
Оглавление
- Как связаны щелочи с основаниями?
- Чем отличаются щёлочи от остальных оснований?
- Как определить, является ли основание растворимым, то есть щелочью, если его нет в таблице растворимости?
- Физические свойства щелочей
- Химические свойства щелочей
- Получение щелочей
Как связаны щелочи с основаниями?
Щелочи – это небольшая группа неорганических веществ, относящихся к основным гидроксидам или основаниям. Для начала разберемся, какие вещества можно называть основаниями. Основания – это вещества, содержащие гидроксо-группу (‒OH), которая в неорганической химии (в случае с основаниями) пишется в конце молекулы, например: NaOH, Fe(OH)2, Ba(OH)2, но это определение не точное, ведь Fe(OH)3 и Zn(OH)2 имеют сходную формулу, однако, основаниями не являются. Точнее будет сказать, что основания – это гидроксиды, в которых металл находится в степени окисления «+1» или «+2» (кроме цинка и бериллия, образующих в степени окисления «+2» амфотерные оксиды и гидроксиды).
Таблица 1. – Основания и амфотерные гидроксиды
|
Это основания: |
Это НЕ основания: |
|
NaOH KOH Mg(OH)2 Ca(OH)2 Fe(OH)2 |
Al(OH)3 Fe(OH)3 Cr(OH)3 Zn(OH)2 Be(OH)2 |
|
Потому что содержат металл в степени окисления «+1» или «+2» |
Так как в этой группе есть гидроксиды, имеющие металл в степени окисления «+3», и два исключения — Zn(OH)2 и Be(OH)2. Все приведенные выше вещества являются амфотерными гидроксидами, а не основаниями |
Подробнее об отличиях понятий «гидроксиды» и «основания» можно прочитать в статье «Классификация гидроксидов и оснований»
Кроме отличий в степени окисления, основания и амфотерные гидроксиды отличаются так же по реакционной способности. Так, амфотерные гидроксиды могут реагировать как с кислотами, так и с основаниями, а основания могут реагировать с кислотами, но не могут реагировать с другими основаниями. Подробнее о химических свойствах амфотерных гидроксидов можно прочитать в статье «Амфотерные гидроксиды. Получение, химические свойства, образование средних и комплексных солей»
Чем отличаются щёлочи от остальных оснований?
Основания можно разделить на две группы: растворимые и нерастворимые. Растворимые иначе называют щелочами. То есть щелочи – это растворимые основания (растворимые основные гидроксиды).
Таблица 2. – Основания и щёлочи
|
Щелочи (растворимые основания) |
Остальные основания (нерастворимые основания) |
|
NaOH KOH Ba(OH)2 |
Mg(OH)2 Fe(OH)2 Ni(OH)2 |
Место щелочей в классификации гидроксидов
Щелочи – растворимые основания
Как определить, является ли основание растворимым, то есть щелочью, если его нет в таблице растворимости?
В состав щелочей входят металлы IА-группы Периодической Системы Д. И. Менделеева, а также кальций, стронций и барий.
Полный список щелочей:
NaOH – гидроксид натрия, едкий натр, гидроокись натрия, каустическая сода
KOH – гидроксид натрия, едкое кали, гидроокись калия
LiOH – гидроксид лития, гидроокись лития
CsOH – гидроксид цезия, гидроокись цезия
FrOH – гидроксид франция, гидроокись франция
RbOH – гидроксид рубидия, гидроокись рубидия
Ba(OH)2 – гидроксид бария, едкий барий, баритовая вода
Ca(OH)2 – гидроксид кальция, гашеная известь, известковое молоко, известковая вода.
Sr(OH)2 – гидроксид стронция
Остальные основания считаем нерастворимыми (кроме аммиака, образующего гидрат аммония, являющегося хоть и растворимым, но нестойким соединением). Гидроксид аммония, образующийся при пропускании аммиака через воду, можно представить в виде формулы NH4OH (лучше NH3·H2O – гидрат аммония) является растворимым (раствор называют нашатырным спиртом), однако щелочью это вещество не является.
Гидроксид лития и гидроксид кальция растворяются не так хорошо, как другие основания, но все равно считаются щелочами.
Задание в формате ЕГЭ с ответом:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Ga(OH)3
- RbOH
- Cr(OH)2
- щелочь
- нерастворимое основание
- амфотерный гидроксид
Комментарий к заданию: Галлий, в представленном гидроксиде, имеет степень окисления +3, поэтому он относится к группе амфотерных гидроксидов. Гидроксид рубидия – щелочь, так как рубидий – элемент IА-группы. Гидроксид хрома – нерастворимое основание, так как хром в степени окисления +2 не является амфотерным, и не относится к щелочным или щелочноземельным металлам, поэтому не может образовать щелочь.
Пример задания из КИМ ЕГЭ:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Sr(OH)2
- Zn(OH)2
- Fe(OH)2
- щелочь
- нерастворимое основание
- амфотерный гидроксид
Комментарий к заданию: Стронций является щелочноземельным металлом (металлы IIА-группы, кроме магния и бериллия, образуют растворимые гидроксиды), поэтому образует щелочь. Гидроксид цинка вместе с гидроксидом бериллия входят в группу исключений и, несмотря на вторую валентность, образуют амфотерные гидроксиды. Гидроксид железа нерастворим и не входит в группу амфотерных веществ, он является нерастворимым основанием.
Щёлочи, являясь сильными основаниями, диссоциируют в воде очень быстро, тогда как нерастворимые основания диссоциируют медленно, ступенчато:
|
Диссоциация щелочей |
Диссоциация слабых оснований |
|
Ca(OH)2 = Ca2+ + 2OH‒ |
Fe(OH)2 = FeOH+ + OH‒ (I ступень) FeOH+ = Fe2+ + OH‒(II ступень) |
|
Диссоциация настолько быстрая, что ступенчатостью процесса можно пренебречь |
Диссоциация очень медленная, быстрее идет по первой ступени, по второй ступени практически не идёт |
Физические свойства щелочей
Гидроксиды щелочных металлов (металлов IА-группы) – твердые бесцветные кристаллические вещества. Как уже было описано выше, большинство из них очень хорошо растворимы в воде. Гидроксиды щелочноземельных металлов хуже растворяются в воде.
Химические свойства щелочей
Основные свойства гидроксидов в Периодической системе возрастают справа налево и сверху вниз. Поэтому все щелочи, образованные металлами IА-группы сильнее щелочей, образованных металлами IIА-группы.
Щелочи окрашивают фенолфталеин в малиновый цвет.
Твёрдые щелочи и их концентрированные растворы разъедают живые ткани, поэтому работать с ними нужно в перчатках, а при растирании твёрдой щелочи в ступке необходимо надевать очки.
- Щелочи реагируют с кислотными оксидами, образуя либо соль и воду, либо кислую соль:
Щелочь + кислотный оксид = соль + вода
Щелочь + кислотный оксид = кислая соль
Рассмотрим эти реакции на примере образования карбонатов и гидрокарбонатов.
Для щелочей, содержащих одновалентный катион (катион в степени окисления «+1») справедлива общая схема реакции:
2MeOH + CO2 = Me2CO3 + H2O
Или
MeOH + CO2 = MeHCO3
Например:
2NaOH + CO2 = Na2CO3 + H2O
NaOH + CO2 = NaHCO3
2KOH + CO2 = K2CO3 + H2O
KOH + CO2 = KHCO3
Для щелочей, содержащих двухвалентный металл (катион в степени окисления «+2») справедлива общая схема реакции:
Me(OH)2 + CO2 = MeCO3 + H2O
Или
Me(OH)2 + 2CO2 = Me(HCO3)2
Например:
Ca(OH)2 + CO2 = CaCO3 + H2O
Ca(OH)2 + 2CO2 = Ca(HCO3)2
Ba(OH)2 + CO2 = BaCO3 + H2O
Ba(OH)2 + 2CO2 = Ba(HCO3)2
Образование кислых и средних солей
Щелочи с кислотными оксидами
Щелочи при плавлении разрушают стекло и фарфор, основным компонентом которых является кислотный оксид SiO2:
2NaOH(тв) + SiO2(тв) = Na2SiO3(тв) + H2O(г)
Некоторые оксиды диспропорционируют в щелочах (участвуют в реакции самоокисления-самовосстановления). К таким оксидам относят оксид азота IV, который в щелочах превращается одновременно и в нитрит-ион (NO2‒), и нитрат-ион (NO3‒):
2KOH + 2NO2 = KNO2 + KNO3 + H2O
2Ca(OH)2 + 4NO2 = Ca(NO2)2 + Ca(NO3)2 + 2H2O
Для того, чтобы получить только нитрат-ион необходимо присутствие кислорода:
4KOH + 4NO2 + O2 = 4KNO3 + 2H2O
2Ca(OH)2 + 4NO2 + O2 = 2Ca(NO3)2 + 2H2O
О других свойствах кислотных оксидов можно прочитать в статье «Свойства кислотных оксидов»
- Щелочи реагируют с кислотами. Притом, если кислота одноосновная, то образуется только средняя соль, если кислота многоосновная, то может образоваться как средняя, так и кислая соль.
Узнать, как определить тип кислоты можно в статье «Классификация кислот»
А) щелочь + одноосновная кислота = соль + вода
NaOH + HClO3 = NaClO3 + H2O
LiOH + HNO3 = LiNO3 + H2O
KOH + HI = KI + H2O
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
Ba(OH)2 + 2HClO4 = Ba(ClO4)2 + 2H2O
Sr(OH)2 + HPO3 = Sr(PO3)2 + H2O
Б) щелочь + двухосновная кислота = соль + вода
Щелочь + двухосновная кислота = кислая соль + вода
2NaOH + H2SO4 = Na2SO4 + 2H2O
NaOH + H2SO4 = NaHSO4 + H2O
Ba(OH)2 + H2S = BaS + 2H2O
Ba(OH)2 + 2H2S = Ba(HS)2 + 2H2O
Для получения кислой соли необходим недостаток щелочи (избыток кислоты).
Задание по образцу ФИПИ:
Установите соответствие между реагирующими веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Sr(OH)2 + SO2 =
- Sr(OH)2 +2SO2 =
- Sr(OH)2 + H2SO4 =
- Sr(OH)2 + 2H2SO4 =
- SrSO4 + 2H2O
- SrSO3 + H2O
- SrSO4 + H2O
- Sr(HSO4)2 + 2H2O
- Sr(HSO3)2 + H2O
- Sr(HSO3)2
- В отличие от нерастворимых оснований, щелочи реагируют с растворимыми солями. Условия типичны для обменных реакций (в продуктах должен появиться газ или осадок):
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓
LiOH + NH4Cl = LiCl + NH3↑ + H2O
2KOH + Fe(NO3)2 = 2KNO3 + Fe(OH)2↓
Ca(OH)2 + 2NaF = CaF2↓ + 2NaOH
Ba(OH)2 + K2SO4 = BaSO4↓ + 2KOH
Sr(OH)2 + Na2SiO3 = SrSiO3↓ + 2NaOH
Попробуйте решить задание ЕГЭ:
Из предложенного перечня веществ выберете три вещества, с которыми гидроксид натрия (р-р) не реагирует:
- LiCl
- NH4Br
- CrSO4
- PbSO4
- KNO3
- CuSO4
Комментарий к заданию: помните, что исходная соль должна быть растворимой, а одно из полученных веществ – газ или осадок.
- Щелочи реагируют с кислыми солями с образованием средних солей:
NaHSO3 + NaOH = Na2SO3 + H2O
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O
- Твёрдые щелочи реагируют с амфотерными оксидами и гидроксидами при сплавлении, при этом образуется средняя соль, в катион которой входит щелочной или щелочноземельный металл, а в анион – амфотерный металл:
2NaOH + Al2O3 = 2NaAlO2 + H2O
2NaOH + ZnO = Na2ZnO2 + H2O
Ca(OH)2 + Al2O3 = Ca(AlO2)2 + H2O
Ca(OH)2 + ZnO = CaZnO2 + H2O
Из предложенного перечня веществ выберете три вещества, с которыми реагирует гидроксид калия:
- P2O5
- Cr2O3
- NiO
- FeO
- CaO
- ZnO
Комментарий к заданию: Не забывайте, что щелочи реагируют не только с амфотерными, но и с кислотными оксидами.
О том, как амфотерные оксиды реагируют с щелочами и другими веществами, а также о том, как можно прочитать в статье «Амфотерные оксиды»
NaOH + Al(OH)3 = NaAlO2 + 2H2O
NaOH + Zn(OH)2 = Na2ZnO2 + H2O
Ca(OH)2 + 2Al(OH)3 = Ca(AlO2)2 + 4H2O
Ca(OH)2 + Zn(OH)2 = CaZnO2 + 2H2O
Подробнее о свойствах амфотерных гидроксидов можно прочитать в этой статье
- Концентрированные растворы щелочей растворяют амфотерные оксиды и гидроксиды с образованием комплексных солей:
2KOH + Fe2O3 + 3H2O = 2K[Fe(OH)4]
2KOH + BeO + H2O = K2[Be(OH)4]
Ba(OH)2 + Fe2O3 + 3H2O = Ba[Fe(OH)4]2
Ba(OH)2 + BeO + H2O = Ba[Be(OH)4]
KOH + Fe(OH)3 = K[Fe(OH)4]
2KOH + Be(OH)2 = K2[Be(OH)4]
Ba(OH)2 + 2Fe(OH)3 = Ba[Fe(OH)4]2
Ba(OH)2 + Be(OH)2 = Ba[Be(OH)4]
- Концентрированные щелочи вступают в реакции с некоторыми металлами (Al, Be, Zn) с образованием комплексной соли и выделением водорода:
2NaOH + 2Al + 6H2O = 2Na[Al(OH)4] + 3H2↑
2NaOH + Be + 2H2O = Na2[Be(OH)4] + H2↑
2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H2↑
Ba(OH)2 + 2Al + 6H2O = Ba[Al(OH)4]2 + 3H2↑
Ba(OH)2 + Zn + 2H2O = Ba[Zn(OH)4] + H2↑
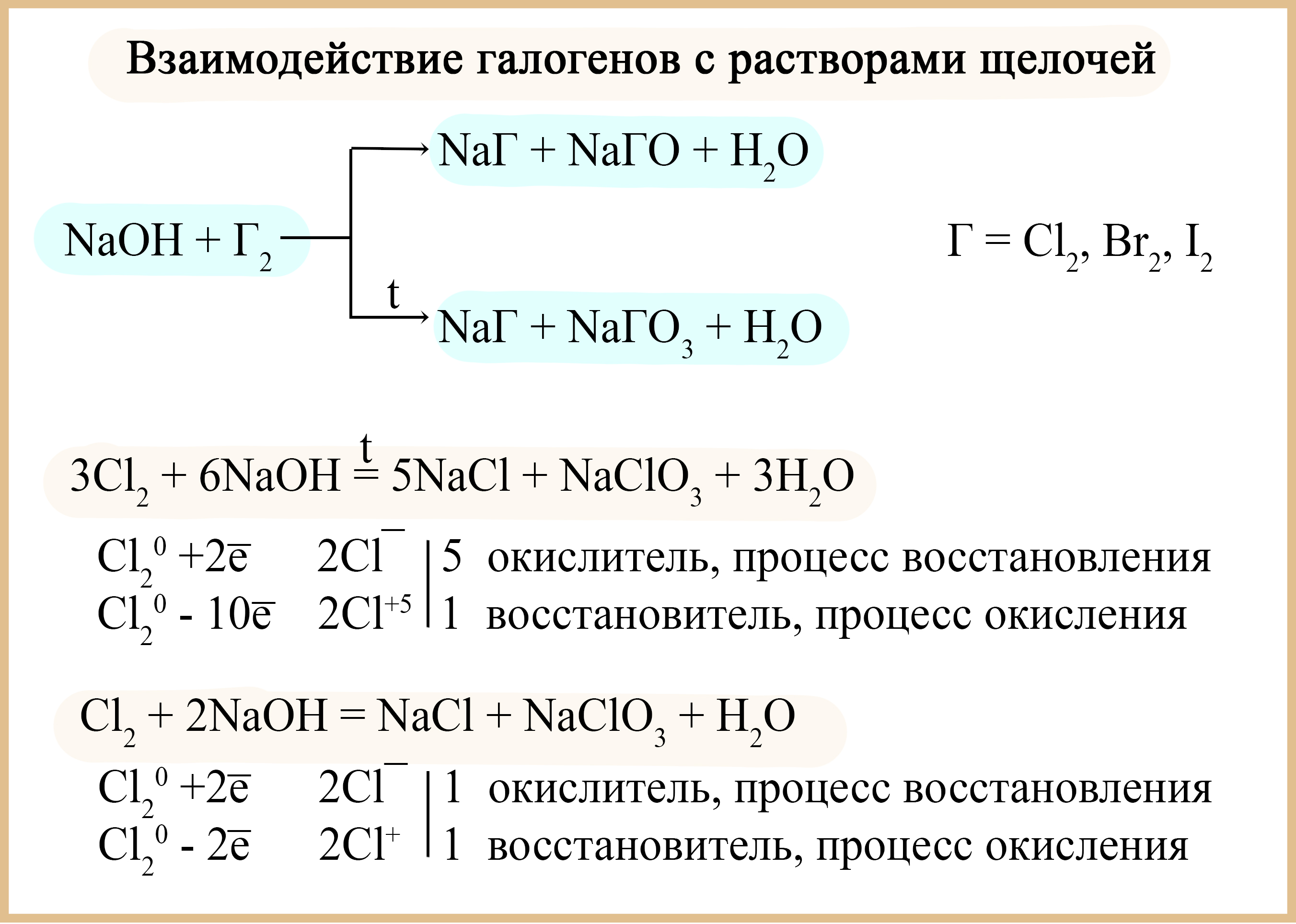
- Хлор, бром, йод диспропорционируют в щелочах, продукты реакции зависят от температуры, при которой происходит реакция:
Cl2 + 2NaOH(холодный) = NaCl + NaClO +H2O
3Cl2 + 6NaOH(горячий) = 5NaCl + NaClO3 + 3H2O
Реакция хлора с гидроксидом натрия
Диспропорционирование галогенов в щелочах
- Фосфор, сера также самоокисляются-самовосстанавливаются в щелочах:
P4 + 3NaOH + 3H2O = 3NaH2PO2 + PH3
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
- Кремний реагирует с щелочами в качестве восстановителя:
Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
Получение щелочей
- Щелочи можно получить из гидридов, нитридов, фосфидов, карбидов:
LiH + H2O = LiOH + H2↑
CaH2 + 2H2O = Ca(OH)2 + 2H2↑
Na3N + 3H2O = 3NaOH + NH3↑
Ca3N2 + 6H2O = 3Ca(OH)2 + 2NH3↑
K3P + 3H2O = 3KOH + PH3↑
Ba3P2 + 6H2O = 3Ba(OH)2 + 2PH3↑
Na4C + 4H2O = 4NaOH + CH4↑
CaC2 + 2H2O = Ca(OH)2 + C2H2↑
- При растворении оксида щелочного или щелочноземельного металла в воде образуется раствор щелочи:
Na2O + H2O = 2NaOH
BaO + H2O = Ba(OH)2
Реакции идут с выделением большого количества теплоты, то есть являются экзотермическими.
- Щелочи можно получить растворением пероксидов в воде (характерно для получения гидроксида натрия, гидроксида калия и гидроксида бария):
Na2O2 + 2H2O = H2O2 + 2NaOH
BaO2 + 2H2O = H2O2 + Ba(OH)2
- Раствор щелочи получают при растворении щелочного или щелочноземельного металла в воде:
2K + 2H2O = 2KOH + H2↑
Sr + 2H2O = Sr(OH)2 + H2↑
- Растворы щелочей можно получить обменными реакциями:
Li2SO4 + Ba(OH)2 = 2LiOH + BaSO4↓
K2SO4 + Sr(OH)2 = 2KOH + SrSO4↓
- Раствор щелочи можно получить электролизом раствора соли, содержащей катион щелочного или щелочноземельного металла и бескислородный анион, например раствор гидроксида калия получают электролизом раствора хлорида калия:
KCl + H2O = KOH + H20↑ + Cl20↑
Катод: 2H2O + 2ē = H20↑ + 2OH‒
Анод: 2Cl‒ ‒2ē = Cl20
Электролизом расплава соли, содержащей щелочной металл, щелочь получить нельзя. Этим способом получают сам щелочной металл.
2.2.1. Характерные химические свойства щелочных металлов.
Щелочными металлами (ЩМ) называют все элементы IA группы таблицы Менделеева, т.е. литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr.
У атомов ЩМ на внешнем электронном уровне находится только один электрон на s-подуровне, легко отрывающийся при протекании химических реакций. При этом из нейтрального атома ЩМ образуется положительно заряженная частица – катион с зарядом +1:
М0 – 1 e → М+1
Семейство ЩМ является наиболее активным среди прочих групп металлов в связи с чем в природе обнаружить их в свободной форме, т.е. в виде простых веществ невозможно.
Простые вещества щелочные металлы являются крайне сильными восстановителями.
Взаимодействие щелочных металлов с неметаллами
с кислородом
Щелочные металлы реагируют с кислородом уже при комнатной температуре, в связи с чем их требуется хранить под слоем какого-либо углеводородного растворителя, такого как, например, керосина.
Взаимодействие ЩМ с кислородом приводит к разным продуктам. С образованием оксида, с киcлородом реагирует только литий:
4Li + O2 = 2Li2O
Натрий в аналогичной ситуации образует с кислородом пероксид натрия Na2O2:
2Na + O2 = Na2O2,
а калий, рубидий и цезий – преимущественно надпероксиды (супероксиды), общей формулы MeO2:
K + O2 = KO2
Rb + O2 = RbO2
с галогенами
Щелочные металлы активно реагируют с галогенами, образуя галогениды щелочных металлов, имеющих ионное строение:
2Li + Br2 = 2LiBr бромид лития
2Na + I2 = 2NaI иодид натрия
2K + Cl2 = 2KCl хлорид калия
с азотом
Литий реагирует с азотом уже при обычной температуре, с остальными же ЩМ азот реагирует при нагревании. Во всех случаях образуются нитриды щелочных металлов:
6Li + N2 = 2Li3N нитрид лития
6K + N2 = 2K3N нитрид калия
с фосфором
Щелочные металлы реагируют с фосфором при нагревании, образуя фосфиды:
3Na + P = Na3Р фосфид натрия
3K + P = K3Р фосфид калия
с водородом
Нагревание щелочных металлов в атмосфере водорода приводит к образованию гидридов щелочных металлов, содержащих водород в редкой степени окисления – минус 1:
Н2 + 2K = 2KН-1 гидрид калия
Н2 + 2Rb = 2RbН гидрид рубидия
с серой
Взаимодействие ЩМ с серой протекает при нагревании с образованием сульфидов:
S + 2K = K2S сульфид калия
S + 2Na = Na2S сульфид натрия
Взаимодействие щелочных металлов со сложными веществами
с водой
Все ЩМ активно реагируют с водой с образованием газообразного водорода и щелочи, из-за чего данные металлы и получили соответствующее название:
2HOH + 2Na = 2NaOH + H2↑
2K + 2HOH = 2KOH + H2↑
Литий реагирует с водой довольно спокойно, натрий и калий самовоспламеняются в процессе реакции, а рубидий, цезий и франций реагируют с водой с мощным взрывом.
с галогенпроизводными углеводородов (реакция Вюрца):
2Na + 2C2H5Cl → 2NaCl + C4H10
2Na + 2C6H5Br → 2NaBr + C6H5–C6H5
со спиртами и фенолами
ЩМ реагируют со спиртами и фенолами, замещая водород в гидроксильной группе органического вещества:
2CH3OH + 2К = 2CH3OК + H2↑
метилат калия
2C6H5OH + 2Na = 2C6H5ONa + H2
фенолят натрия
2. ЩЕЛОЧЬ + КИСЛОТА = СОЛЬ + ВОДА (реакция нейтрализации) (исключение H₂SiO₃).
Избыток кислоты → кислая соль, избыток щелочи → средняя)
КОН + H₂SO₄ → KНSO₄ + 2H₂O
2КОН + H₂SO₄ → K₂SO₄ + 2H₂O
3) С КИСЛОТНЫМИ ОКСИДАМИ = КИСЛЫЕ ИЛИ СРЕДНИЕ СОЛИ
избыток щелочи → средняя, избыток оксида → кислая)
SiO2(тв.)+ 2NaOH = Na2SiO3 + +H2O
2NaOH (избыток) + CO2 = Na2CO3 + H2O(средняя соль)
NaOH+ CO2(избыток) = NaНCO3 (кислая соль)
4)С РАСТВОРАМИ СРЕДНИХ СОЛЕЙ = СОЛЬ + ОСНОВАНИЕ
Исходные вещества должны быть растворимы, в продуктах — газ или осадок.
2NaOH + FeSO4 = Fe(OH)2↓+ Na2SO4
2KOH + (NH4)2SO4 = K2SO4 + 2NH3↑+ 2H2O
5)СОЛЬ АМФОТЕРНОГО МЕТАЛЛА С ЩЕЛОЧЬЮ + ГИДРОКСИД или ГИДРОКСОКОМПЛЕКС
AlCl3 + 3KOH(недостаток) = Al(OH)3↓ + 3KCl
AlCl3 + 4KOH(избыток) = 3KCl + K[Al(OH)4]
6) С КИСЛЫМИ СОЛЯМИ + СРЕДНЯЯ СОЛЬ
NaOH + NaHCO3 = H2O + Na2CO3;
7) С АМФОТЕРНЫМИ ОКСИДАМИ И ГИДРОКСИДАМИ (сплавление) = СРЕДНЯЯ СОЛЬ + ВОДА
2NaOH + Cr2O3 =2NaCrO2 (хромат натрия) + H2O
2NaOH +Zn(OH)2= Na2ZnO2 (цинкат натрия) + 2H2O
В РАСТВОРАХ = ГИДРОКСОКОМПЛЕКС.
2KOH + ZnO +H2O= K2[Zn(OH)4] (тетрагидроксоцинкат калия)
2NaOH +Zn(OH)2= Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)

2KOH + Zn(сплавление) = K2ZnO2 + H2↑
В РАСТВОРАХ = ГИДРОКСОКОМПЛЕКС + H2↑
2NaOH + Zn +2H2O = Na2[Zn(OH)4] + H2↑
9) С НЕМЕТАЛЛАМИ = СОЛЬ + H2↑,
с серой и галогенами – 2 соли (кислородсодержащая + бескислородная + H2O
(Не реагируют N2, C, O2, инертные газы)
Si + 2KOH + H2O = K2SiO3 + 2H2↑
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O
Исключение:
2F2 + 4NaOH = O2 или (OF2) + 4NaF + 2H2O
10) ЩЕЛОЧИ ПРИ НАГРЕВАНИИ НЕ РАЗЛАГАЮТСЯ ( исключение LiOH)
11) В РАСПЛАВАХ ПОДВЕРГАЮТСЯ ГИДРОЛИЗУ
NaOH(расплав) → Na⁰ + O2⁰ + H2O
Катод Анод
ХЛОРНОВАТИСТАЯ КИСЛОТА HCl⁺¹O.
Существует только в виде разбавленных водных растворов. HClO — слабая кислота и сильный окислитель. Соли – гипохлориты
Разлагается: на свету до хлороводорода и кислорода:
HClO (свет) = HCl+ O2↑
Без света – до хлороводорода и хлорноватой кислоты
3HClO = 2HCl + НСlO3
2) Реагирует со щелочами – образуются соли и вода:
HClO + KOH =KClO + H2O
HClO + Са(OH)2 = СаOСl2 + H2O
хлорная известь
3) Окислитель:
2HI + HClO = I2↑ + HCl + H2O
ХЛОРИСТАЯ КИСЛОТА HCl⁺³O2
Существует только в водных растворах. Соли – хлориты
Получение:
2ClO2+H2O2=2HClO2 + O2↑
Неустойчива, при хранении разлагается
4HClO2 = HCl + HClO3 + 2ClO2↑ + H2O
ХЛОРНОВАТАЯ КИСЛОТА HCl⁺⁵O3.
Устойчива только в водных растворах. Соли – хлораты
Концентрированная кислота разлагается
8HClO3 = 4HClO4 + 2Cl2 + 3O2 + 2H2O
Получение:
Ba(ClO3)2+H2SO4=2HClO3 + BaSO4
Cильный окислитель.
1) 6P+5HClO3 =3P2O5↑ + 5HCl
ХЛОРНАЯ КИСЛОТА HCl⁺⁷O4
очень сильная кислота и очень сильный окислитель.
1) При нагревании хлорная кислота и ее соли разлагаются:
4HClO4 = 4ClO2↑ + 3O2↑ + 2H2O
KClO4 = KCl + 2O2↑
2) Сильный окислитель:
HClO4 + C → CO2↑ + Cl2↑ + H2O
ХЛОРОВОДОРОД HCl¯¹
Бесцветный газ, хорошо растворим в воде. Раствор в воде – сильная хлороводородная кислота.
HCl – сильный восстановитель:
Взаимодействие с нитратом серебра (нитрат серебра является реактивом на соляную кислоту и ее соли);
выпадет осадок белого цвета, который не растворяется в воде, ни в кислотах:
HCl + AgNO₃ → AgCl↓ + HNO3
2) Взаимодействие с окислителями (MnO2, KMnO, KCLO3 и др.):
6HCl + KClO3 → KCl +3H2O + 3Cl2↑
ФТОРОВОДОРОД HF¯¹
Бесцветный газ, хорошо растворим в воде.
Раствор в воде – фтороводородная (плавиковая) кислота – средней силы.
Химические свойства оснований и амфотерных гидроксидов
Основания — это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп ($–OH$).
Общая формула ${Me}↖{+y}(OH)_y$,где $y$ — число гидроксогрупп, равное степени окисления металла ${Me}↖{+y}$.
Классификация оснований.
| Признаки классификации | Группы оснований | Примеры |
| Растворимость в воде | растворимые (щелочи) | $NaOH, KOH, Ca(OH)_2, Ba(OH)_2$ |
| нерастворимые | $Cu(OH)_2, Fe(OH)_2, Fe(OH)_3$ | |
| Степень электролитической диссоциации | сильные ($α→1$) | щелочи |
| слабые ($α→0$) | нерастворимые основания, водный р-р аммиака $NH_3·H_2O$ | |
| Кислотность (число гидроксогрупп) | однокислотные | $NaOH, KOH$ |
| двухкислотные | $Fe(OH)_2, Cu(OH)_2$ |
Свойства щелочей — гидроксидов щелочных и щелочноземельных металлов
1. Водные растворы щелочей мылкие на ощупь, изменяют окраску индикаторов: лакмуса — в синий цвет, фенолфталеина — в малиновый.
2. Водные растворы диссоциируют:
$Ba(OH)_2=Ba_^{2+}+2OH^–$.
3. Взаимодействуют с кислотами, вступая в реакцию обмена:
$NaOH+HCl=NaCl+H_2O$ — реакция нейтрализации.
Многокислотные основания могут давать средние и основные соли:
$Ca(OH)_2+HCl=CaOHCl+H_2O$.
4. Взаимодействуют с кислотными оксидами, образуя средние и кислые соли в зависимости от основности кислоты, соответствующей этому оксиду:
$Ca(OH)_2+CO_2=CaCO_3↓+H_2O$,
$NaOH+CO_{2(изб.)}=NaHCO_3$.
5. Взаимодействуют с амфотерными оксидами и гидроксидами:
а) сплавление:
$2NaOH+ZnO=Na_2ZnO_2+H_2O$,
$2NaOH+Zn(OH)_2=Na_2ZnO_2+2H_2O;$
б) в растворах:
$2KOH+H_2O=ZnO+K_2[Zn(OH)_4]$,
$2KOH+Zn(OH)_2=K_2[Zn(OH)_4]$.
6. Взаимодействуют с растворимыми в воде солями, если образуется осадок или газ:
$2NaOH+CuSO_4=Cu(OH)_2↓+Na_2SO_4$,
$NaOH+NH_4Cl=NH_3↑+H_2O+NaCl$.
Нерастворимые основания ($Cr(OH)_3, Mn(OH)_2$ и др.) взаимодействуют с кислотами и разлагаются при нагревании:
$Mn(OH)_2+2HCl=MnCl_2+2H_2O$,
$Mn(OH)_2{→}↖{t}MnO+H_2O$.
Амфотерные оксиды и гидроксиды.
| $H_2ЭO_2$ Кислотная форма |
—-$ЭO$—- $BeO, ZnO, GeO, SnO, PbO, …$ |
$Э(OH)_2$ Основная форма |
| $H_3ЭO_3$ Кислотная ортоформа $НЭO_2$ Кислотная метаформа |
—-$Э_2O_3$—- $Al_2O_3, Ga_2O_3, In_2O_3, Tl_2O_3,$ $Cr_2O_3, Fe_2O_3, Sb_2O_3, …$ |
$Э(OH)_3,$ чаще $Э_2O_3·nH_2O,ЭO(OH)$ Основная форма |
| $H_4ЭO_4$ Кислотная ортоформа $Н_2ЭO_3$ Кислотная метаформа |
—-$ЭO_2$—- $GeO_2,SnO_2, PbO_2, VO_2, TiO_2, …$ |
$Э(OH)_4,$ чаще $ЭO·nH_2O,ЭO(OH)_2$ Основная форма |
Химические свойства амфотерных соединений
1. Взаимодействуя с сильными кислотами, они обнаруживают основные свойства:
$Zn(OH)_2+2HCl=ZnCl_2+2H_2O$.
2. Взаимодействуя со щелочами — сильными основаниями, они обнаруживают кислотные свойства:
$Zn(OH)_2+2NaOH=Na_2[Zn(OH)_4]$ — комплексная соль;
$Al(OH)_3+NaOH=Na[Al(OH)_4]$ — комплексная соль.
Комплексными называют соединения, в которых хотя бы одна ковалентная связь образовалась по донорно-акцепторному механизму.
Химические свойства кислот
Кислотами называются сложные вещества, молекулы которых состоят из атомов водорода, способных замещаться на атомы металла, и кислотных остатков.
Классификация кислот.
В обычных условиях кислоты могут быть твердыми (фосфорная $H_3PO_4$; кремниевая $H_2SiO_3$) и жидкими (в чистом виде жидкостью является серная кислота $H_2SO_4$).
Такие газы, как хлороводород $HCl$, бромоводород $HBr$, сероводород $H_2S$, в водных растворах образуют соответствующие кислоты.
Разделение кислот на группы по различным признакам представлено в таблице.
Классификация кислот.
| Признаки классификации | Группы кислот | Примеры |
| Наличие кислорода в кислотном остатке | а) кислородные б) бескислородные |
$H_3PO_4, HNO_3$ $H_2S, HCl, HBr$ |
| Основность | а) одноосновные б) двухосновные в) трехосновные |
$HCl, HNO_3$ $H_2S, H_2SO_4$ $H_3PO_4$ |
| Растворимость в воде | а) растворимые б) нерастворимые |
$H_2SO_4, H_2S, HNO_3$ $H_2SiO_3$ |
| Летучесть | а) летучие б) нелетучие |
$H_2S, HCl, HNO_3$ $H_2SO_4, H_2SiO_3, H_3PO_4$ |
| Степень электролитической диссоциации | а) сильные б) слабые |
$H_2SO_4, HCl, HNO_3$ $H_2S, H_2SO_3, H_2CO_3$ |
| Стабильность | а) стабильные б) нестабильные |
$H_2SO_4, H_3PO_4, HCl$ $H_2SO_3, H_2CO_3, H_2SiO_3$ |
Часто путают понятия летучесть и устойчивость (стабильность). Летучими называют кислоты, молекулы которых легко переходят в газообразное состояние, т.е. испаряются. Например, соляная кислота является летучей, но устойчивой, стабильной кислотой. О летучести нестабильных кислот судить нельзя. Например, нелетучая нерастворимая кремниевая кислота разлагается на воду и $SiO_2$.
Водные растворы соляной, азотной, серной, фосфорной и ряда других кислот не имеют окраски. Водный раствор хромовой кислоты $H_2CrO_4$ имеет желтую окраску, марганцевой кислоты $HMnO_4$ — малиновую.
Свойства кислот
Кислый вкус, воздействие на индикаторы, электрическая проводимость, взаимодействие с металлами, основными и амфотерными оксидами, основаниями и солями, образование сложных эфиров со спиртами — эти свойства являются общими для неорганических и органических кислот.
1. В воде кислоты диссоциируют на катионы водорода и анионы кислотных остатков, например:
$HCl=H^{+}+Cl^–$,
$HNO_3=H^{+}+NO_3^{-}$,
$H_2SO_4=H^{+}+HSO_4^{-}⇄2H^{+}+SO_4^{2-}$.
Растворы кислот изменяют цвет индикаторов: лакмуса — в красный, метилового оранжевого — в розовый, цвет фенолфталеина не изменяют.
2. Растворы кислот реагируют с металлами, стоящими в электрохимическом ряду напряжений левее водорода, при соблюдении ряда условий, важнейшим из которых является образование в результате реакции растворимой соли:
$2HCl+Zn=ZnCl_2+H_2↑$,
$2H^{+}+Zn=Zn^{2+}+H_2↑$.
3. Неорганические и органические кислоты взаимодействуют с основными и амфотерными оксидами при условии, что образуется растворимая соль:
$2HCl+ZnO=ZnCl_2+H_2O$,
$2H^{+}+ZnO=Zn^{2+}+H_2O$.
4. И те, и другие кислоты вступают в реакцию с основаниями. Многоосновные кислоты могут образовывать как средние, так и кислые соли (это реакции нейтрализации):
а) $H^{+}+OH^{–}=H_2O$.
Например, $HCl+NaOH=H_2O+NaCl;$
б) $H_2SO_4+NaOH={NaHSO_4}↙{text»кислая соль»}+H_2O$.
5. Реакция между кислотами и солями идет только в том случае, если образуется осадок или газ:
$2H^{+}+CaCO_3=Ca^{2+}+H_2O+CO_2↑,$
$SO_4^{2-}+Ba^{2+}=BaSO_4↓$.
Взаимодействие $H_3PO_4$ с известняком прекратится из-за образования на поверхности последнего нерастворимого осадка $Ca_3(PO_4)_2$.
Особенности свойств азотной $HNO_3$ и концентрированной серной $H_2SO_4$(конц.) кислот обусловлены тем, что при их взаимодействии с простыми веществами (металлами и неметаллами) окислителями будут выступать не катионы $H^+$, а нитрат- и сульфат-ионы. Логично ожидать, что в результате таких реакций образуется не водород $H_2$, а другие вещества: обязательно соль и вода, а также один из продуктов восстановления нитрат- или сульфат-ионов в зависимости от концентрации кислот, положения металла в ряду напряжений и условий реакции (температуры).
Следует отметить, что третий продукт реакции металлов с этими кислотами образуется в «букете » — смеси с другими продуктами. Эти особенности химического поведения $HNO_3$ и $H_2SO_4$(конц.) наглядно иллюстрируют тезис теории химического строения о взаимном влиянии атомов в молекулах веществ.
Продукты взаимодействия простых веществ с азотной и серной кислотами.
| ${text»Простые вещества»}/{text»Кислоты»}$ | $Mg$ | $Al$ | $Zn$ | $Fe$ |
| $HNO_3$ разбавленная |
$Mg(NO_3)_2$ $NH_4NO_3$ $N_2$ |
$Al(NO_3)_3$ $NH_4NO_3$ $N_2$ |
$Zn(NO_3)_2$ $NH_4NO_3$ $N_2$ |
$Fe(NO_3)_3$ $NH_4NO_3$ $N_2$ |
| $HNO_3$ концентрированная |
$Mg(NO_3)_2$ $N_2O$ |
пассивирует | $Zn(NO_3)_2$ $N_2O$ |
пассивирует |
| $H_2SO_4$ разбавленная |
$MgSO_4$ $H_2$ |
$Al_2(SO_4)_3$ $H_2$ |
$ZnSO_4$ $H_2$ |
$FeSO_4$ $H_2$ |
| $H_2SO_4$ концентрированная горячая |
$MgSO_4$ $H_2S$ |
$Al_2(SO_4)_3$ $H_2S$ |
$ZnSO_4$ $H_2S$ $S$ |
$Fe_2(SO_4)_3$ $SO_2$ $S$ |
| ${text»Простые вещества»}/{text»Кислоты»}$ | $Cr$ | $Cu$ | $P$ | $S$ |
| $Fe(NO_3)_3$ $NH_4NO_3$ $N_2$ |
$Cr(NO_3)_3$ $NO$ |
$Cu(NO_3)_2$ $NO$ |
$H_3PO_4$ $NO$ |
$H_2SO_4$ $NO$ |
| пассивирует | пассивирует | $Cu(NO_3)_2$ $N_2O$ |
$H_3PO_4$ $N_2O$ |
$H_2SO_4$ $N_2O$ |
| $FeSO_4$ $H_2$ |
$CrSO_4$ $H_2$ |
— | — | — |
| $Fe_2(SO_4)_3$ $SO_2$ $S$ |
$Fe_2(SO_4)_3$ $SO_2$ |
$CuSO_4$ $SO_2$ |
$H_3PO_4$ $SO_2$ |
$SO_2$ $H_2O$ |
Химические свойства солей: средних, кислых, основных, комплексных
Соли — это класс химических соединений, состоящих из ионов металла и ионов кислотного остатка.
Номенклатура солей
Названия солей кислородсодержащих кислот состоят из двух слов: названия иона, образованного кислотным остатком, в именительном падеже и названия иона металла — в родительном. Названия ионов кислотных остатков составляются, в свою очередь, из корней названий элементов с суффиксами -ат для высшей степени окисления и -ит для низшей степени окисления атомов элемен — та-неметалла, образующего сложный ион остатка кислородсодержащей кислоты. Например, соли азотной кислоты $HNO_3$ называются нитратами: $KNO_3$ — нитрат калия, а соли азотистой кислоты $HNO_2$ — нитритами: $Ca(NO_2)_2$ — нитрит кальция. Если же металл проявляет различные степени окисления, то они указываются в скобках римской цифрой, например: $Fe^{2+}SO_4$ — сульфат железа (II) и $Fe_2^{3+}(SO_4)_3$ — сульфат железа (III).
Номенклатура солей.
| Название кислоты | Формула | Название солей | Формула (пример) |
| Азотистая | $HNO_2$ | Нитриты | $KNO_2$ |
| Азотная | $HNO_3$ | Нитраты | $Al(NO_3)_3$ |
| Хлороводородная (соляная) | $ HCl$ | Хлориды | $FeCl_3$ |
| Сернистая | $ H_2SO_3$ | Сульфиты | $K_2SO_3$ |
| Серная | $H_2SO_4$ | Сульфаты | $Na_2SO_4$ |
| Сероводородная | $H_2S$ | Сульфиды | $FeS$ |
| Фосфорная | $H_3PO_4$ | Фосфаты | $Ca_3(PO_4)_2$ |
| Угольная | $H_2CO_3$ | Карбонаты | $CaCO_3$ |
| Кремниевая | $H_2SiO_3$ | Силикаты | $Na_2SiO_3$ |
Растворимость солей
По растворимости в воде соли делятся на растворимые ($Р$), нерастворимые ($Н$) и малорастворимые ($М$). Для определения растворимости солей пользуются таблицей растворимости кислот, оснований и солей в воде. Если таблицы под рукой нет, то можно воспользоваться правилами. Их легко запомнить.
- Растворимы все соли азотной кислоты — нитраты.
- Растворимы все соли соляной кислоты — хлориды, кроме $AgCl (Н), PbCl_2 (М)$.
- Растворимы все соли серной кислоты — сульфаты, кроме $BaSO_4 (Н), PbSO_4 (Н)$.
- Растворимы соли натрия и калия.
- Не растворяются все фосфаты, карбонаты, силикаты и сульфиды, кроме солей для $Na^{+}$ и $K^{+}$.
Классификация солей
Из всех химических соединений соли являются наиболее многочисленным классом веществ. Это твердые вещества, они отличаются друг от друга по цвету и растворимости в воде.
В начале XIX в. шведский химик И. Берцелиус сформулировал определение солей как продуктов реакций кислот с основаниями или соединений, полученных заменой атомов водорода в кислоте металлом. По этому признаку различают соли средние, кислые и основные.
Средние, или нормальные, соли — это продукты полного замещения атомов водорода в кислоте на металл.
Именно с этими солями вы уже знакомы и знаете их номенклатуру. Например:
$Na_2CO_3$ — карбонат натрия,
$CuSO_4$ — сульфат меди (II) и т. д.
Диссоциируют такие соли на катионы металла и анионы кислотного остатка:
$Na_2CO_3=2Na^{+}+CO_2^{2-}$.
Кислые соли — это продукты неполного замещения атомов водорода в кислоте на металл.
К кислым солям относят, например, питьевую соду $NaHCO_3$, которая состоит из катиона металла $Na^{+}$ и кислотного однозарядного остатка $HCO_3^{−}$. Для кислой кальциевой соли формула записывается так: $Ca(HCO_3)_2$.
Названия этих солей складываются из названий средних солей с прибавлением приставки гидро-, например:
$Mg(HSO_4)_2$ — гидросульфат магния.
Диссоциируют кислые соли следующим образом:
$NaHCO_3=Na^{+}+HCO_3^{-}$,
$Mg(HSO_4)_2=Mg^{2+}+2HSO_4^{-}$.
Основные соли — это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.
Например, к таким солям относится знаменитый малахит $(CuOH)_2CO_3$, о котором вы читали в сказках П. Бажова. Он состоит из двух основных катионов $CuOH^{+}$ и двухзарядного аниона кислотного остатка $CO_3^{2−}$.
Катион $CuOH^{+}$ имеет заряд $+1$, поэтому в молекуле два таких катиона и один двухзарядный анион $CO_3^{2−}$ объединены в электронейтральную соль.
Названия этих солей такие же, как и у нормальных солей, но с прибавлением приставки гидроксо-, $(CuOH)_2CO_3$ — гидро ксокарбонат меди (II) или $AlOHCl_2$ — гидроксо хлорид алюминия. Большинство основных солей нерастворимы или малорастворимы.
Последние диссоциируют так:
$AlOHCl_2=AlOH^{2+}+2Cl^{–}$.
Свойства солей
Типичные реакции солей.
1. Соль + кислота ${→}↙{text»(реакция обмена)»}$ другая соль + другая кислота.
2. Соль + щелочь ${→}↙{text»(реакция обмена)»}$ другая соль + другое основание.
3. ${Соль_1 + соль_2 → соль_3 + соль_4}↙{text»(реакция обмена: в реакцию вступают две соли, в результате ее получаются две другие соли)»}$.
4. Соль + металл ${→}↙{text»(реакция замещения)»}$ другая соль + другой металл.
Первые две реакции обмена были подробно рассмотрены ранее.
Третья реакция также является реакцией обмена. Она протекает между растворами солей и сопровождается образованием осадка, например:
а) $Ca(NO_3)_2+Na_2CO_3=CaCO_3↓+2NaNO_3$
или $Ca^{2+}+CO_2^{2-}=CaCO_3↓$;
б) $K_2SO_4+BaCl_2=2KCl+BaSO_4↓$
или $SO_4^{2-}+Ba^{2+}=BaSO_4↓$.
Четвертая реакция солей связана с положением металла в электрохимическом ряду напряжений металлов.
Второе правило ряда напряжений: каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений. Это правило соблюдается при выполнении следующих условий:
а) обе соли (и реагирующая, и образующаяся в результате реакции) должны быть растворимыми;
б) металлы не должны взаимодействовать с водой, по этому металлы главных подгрупп I и II групп (для последней начиная с $Са$) не вытесняют другие металлы из растворов солей.
Комплексные соединения
При взаимодействии со щелочами амфотерных оксидов и гидроксидов в растворе образуются комплексные соли, состав которых может быть отражен формулой
${Na[Al(OH)_4^{–}]}↙{text»тетрагидроксоалюминат натрия»}$.
Комплексными называют соединения, в которых хотя бы одна ковалентная связь образовывалась по донорно-акцепторному механизму.
В переводе с латинского complexus означает «сочетание». Действительно, очень многие комплексные соединения получают из двух или трех веществ, например:
$NH_3 + HCl = {[NH_4]Cl}↙{text»соль аммония»}$,
$C_6H_5NH_2 + HCl = {[C_6H_5NH_3]}↙{text»соль амина»}$.
Малорастворимый гидроксид алюминия под воздействием гидроксид-ионов $ОН^{–}$ переходит в раствор в виде иона $[Al(OH)_4]^{–}$:
$Al(OH)_3 + OH^{–} = [Al(OH)_4]^{–}$.
Комплексные, или, как их еще называют, координационные соединения, построены так: в центре находится атом или ион (он называется комплексообразователем), а вокруг него — атомы, молекулы или ионы, образовавшие с ним ковалентные связи по донорно-акцепторному механизму (называются лигандами). Это могут быть анионы кислот, молекулы небольшого размера ($H_2O, NH_3, CO$), имеющие атомы с неподеленными электронными парами.
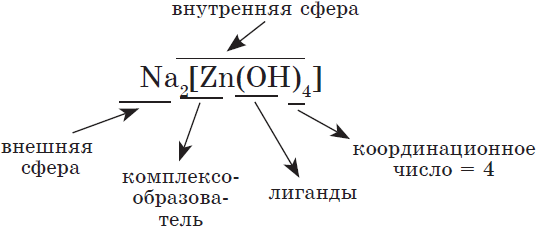
Общее число лигандов, непосредственно связанных с центральным атомом, называется координационным числом. Последнее изменяется от $1$ до $12$ (но чаще атом образует внутреннюю сферу комплекса (ее заключают в квадратные скобки). Внешняя сфера состоит из ионов, не связанных непосредственно с комплексообразователем. Внутренняя сфера участвует в химических реакциях как один многоатомный ион, внешняя сфера — как обычные ионы.
Например, строение тетрагидроксоалюмината натрия:
и уравнение его диссоциации:
$Na_2[Zn(OH)_4]→2Na^{+}+[Zn(OH)_4]^{2–}$.
Комплексные соединения играют большую роль в жизнедеятельности живых организмов. Почти все ферменты, гормоны, хлорофилл растений и гемоглобин животных, лекарства представляют собой комплексные соединения.
Электролитическая диссоциация в водных растворах. Слабые и сильные электролиты
Электролиты и неэлектролиты
Из уроков физики известно, что растворы одних веществ способны проводить электрический ток, а других — нет.
Вещества, растворы которых проводят электрический ток, называются электролитами.
Растворы сахара, спирта, глюкозы и некоторых других веществ не проводят электрический ток.
Вещества, растворы которых не проводят электрический ток, называются неэлектролитами.
Электролитические диссоциация и ассоциация
Почему же растворы электролитов проводят электрический ток?
Шведский ученый Сванте Аррениус, изучая электропроводность различных веществ, пришел в 1877 г. к выводу, что причиной электропроводности является наличие в растворе ионов, которые образуются при растворении электролита в воде.
Процесс распада электролита на ионы называется электролитической диссоциацией.
С. Аррениус, который придерживался физической теории растворов, не учитывал взаимодействия электролита с водой и считал, что в растворах находятся свободные ионы. В отличие от него, русские химики И. А. Каблуков и В. А. Кистяковский применили к объяснению электролитической диссоциации химическую теорию Д. И. Менделеева и доказали, что при растворении электролита происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы. Они считали, что в растворах находятся не свободные, не «голые» ионы, а гидратированные, т.е. «одетые в шубку» из молекул воды.
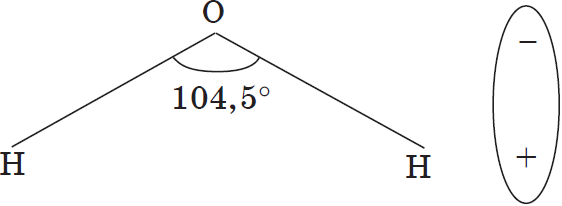
Молекулы воды представляют собой диполи (два полюса), так как атомы водорода расположены под углом $104.5°$, благодаря чему молекула имеет угловую форму. Молекула воды схематически представлена ниже.
Как правило, легче всего диссоциируют вещества с ионной связью и соответственно с ионной кристаллической решеткой, так как они уже состоят из готовых ионов. При их растворении диполи воды ориентируются противоположно заряженными концами вокруг положительных и отрицательных ионов электролита.
Между ионами электролита и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, и происходит переход ионов из кристалла в раствор. Очевидно, что последовательность процессов, происходящих при диссоциации веществ с ионной связью (солей и щелочей), такова:
а) ориентация молекул (диполей) воды около ионов кристалла;
б) гидратация (взаимодействие) молекул воды с ионами поверхностного слоя кристалла;
в) диссоциация (распад) кристалла электролита на гидратированные ионы.
Упрощенно происходящие процессы можно отразить с по мощью следующего уравнения:
$NaCl=Na^{+}+Cl^{–}$.
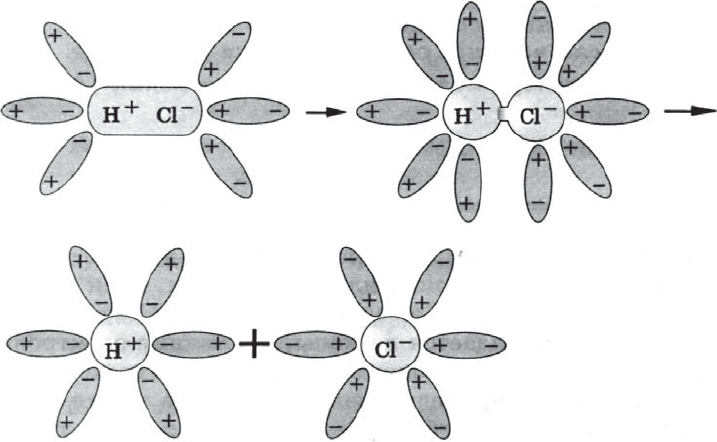
Аналогично диссоциируют и электролиты, в молекулах которых — ковалентная связь (например, молекулы хлороводорода $HCl$); только в этом случае под влиянием диполей воды происходит превращение ковалентной полярной связи в ионную и последовательность процессов, происходящих при этом, такова:
а) ориентация молекул воды вокруг полюсов молекул электролита;
б) гидратация (взаимодействие) молекул воды с молекулами электролита;
в) ионизация молекул электролита (превращение ковалентной полярной связи в ионную);
г) диссоциация (распад) молекул электролита на гидратированные ионы.
Упрощенно уравнение диссоциации соляной кислоты можно отразить с помощью следующего уравнения:
$HCl=H^{+}+Cl^{–}$.
Следует учитывать, что в растворах электролитов хаотически движущиеся гидратированные ионы могут столкнуться и вновь объединиться между собой. Этот обратный процесс называется ассоциацией. Свойства гидратированных ионов отличаются от свойств негидратированных. Например, негидратированный ион меди $Cu^{2+}$ — белый в безводных кристаллах сульфата меди (II) и имеет голубой цвет, когда гидратирован, т.е. связан с молекулами воды $Cu^{2+}·nH_2O$. Гидратированные ионы имеют как постоянное, так и переменное число молекул воды.
Степень электролитической диссоциации
В растворах электролитов наряду с ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации, которая обозначается греческой буквой $α$ (альфа).
Степень диссоциации — это отношение числа частиц, распавшихся на ионы ($N_g$), к общему числу растворенных частиц ($N_р$):
$α={N_g}/{N_p}$.
Степень диссоциации электролита определяется опытным путем и выражается в долях или процентах. Если $α=0$, то диссоциация отсутствует, а если $α=1$, или $100%$, то электролит полностью распадается на ионы. Различные электролиты имеют различную степень диссоциации, т.е. степень диссоциации зависит от природы электролита. Она также зависит и от концентрации: с разбавлением раствора степень диссоциации увеличивается.
По степени электролитической диссоциации электролиты делятся на сильные и слабые.
Сильные и слабые электролиты
Сильные электролиты — это электролиты, которые при растворении в воде практически полностью диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к единице.
К сильным электролитам относятся:
1) все растворимые соли;
2) сильные кислоты, например: $H_2SO_4, HCl, HNO_3$;
3) все щелочи, например: $NaOH, KOH$.
Слабые электролиты — это такие электролиты, которые при растворении в воде почти не диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к нулю.
К слабым электролитам относятся:
1) слабые кислоты — $H_2S, H_2CO_3, HNO_2$;
2) водный раствор аммиака $NH_3·H_2O$;
3) вода;
4) некоторые соли.
Константа диссоциации
В растворах слабых электролитов вследствие их неполной диссоциации устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Например, для уксусной кислоты:
$CH_3COOH⇄H^{+}+CH_3COO^{–}$,
Можно применить к этому равновесию закон действующих масс и записать выражение константы равновесия:
$K_{равн.}={[H^{+}]·[CH_3COO^{-}]}/{[CH_3COOH]}$
Константу равновесия, характеризующую процесс диссоциации слабого электролита, называют константой диссоциации.
Константа диссоциации характеризует способность электролита (кислоты, основания, воды) диссоциировать на ионы. Чем больше константа, тем легче электролит распадается на ионы, следовательно, тем он сильнее. Значения констант диссоциации для слабых электролитов приводятся в справочниках.
Основные положения теории электролитической диссоциации
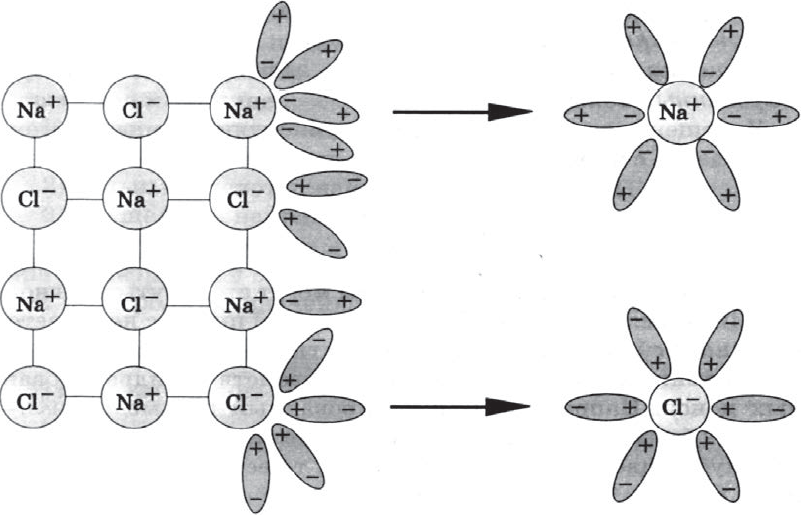
1. При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы.
Ионы — это одна из форм существования химического элемента. Например, атомы металла натрия $Na0$ энергично взаимодействуют с водой, образуя при этом щелочь ($NaOH$) и водород $Н_2$, в то время как ионы натрия $Na^{+}$ таких продуктов не образуют. Хлор $Cl_2$ имеет желто-зеленый цвет и резкий запах, ядовит, а ионы хлора $Cl^{–}$ бесцветны, не ядовиты, лишены запаха.
Ионы — это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов одного или нескольких химических элементов в результате отдачи или присоединения электронов.
В растворах ионы беспорядочно передвигаются в различных направлениях.
По составу ионы делятся на простые — $Cl^{–}, Na^{+}$ и сложные — $NH_4^{+}, SO_4^{2−}$.
2. Причиной диссоциации электролита в водных растворах является его гидратация, т.е. взаимодействие электролита с молекулами воды и разрыв химической связи в нем.
В результате такого взаимодействия образуются гидратированные, т.е. связанные с молекулами воды, ионы.
Следовательно, по наличию водной оболочки ионы делятся на гидратированные (в растворах и кристаллогидратах) и негидратированные (в безводных солях).
3. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу источника тока — катоду и поэтому называются катионами, а отрицательно заряженные ионы движутся к положительному полюсу источника тока — аноду и поэтому называются анионами.
Следовательно, существует еще одна классификация ионов — по знаку их заряда. Сумма зарядов катионов ($Н^{+}, Na^{+}, NH_4^{+}, Cu^{2+}$) равна сумме зарядов анионов ($Cl^{–}, OH^{–}, SO_4^{2−}$), вследствие чего растворы электролитов ($HCl, (NH_4)_2SO_4, NaOH, CuSO_4$) остаются электронейтральными.
4. Электролитическая диссоциация — процесс обратимый для слабых электролитов.
Наряду с процессом диссоциации (распад электролита на ионы) протекает и обратный процесс — ассоциация (соединение ионов). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости, например:
$HNO_2⇄H^{+}+NO_2^{-}$
5. Не все электролиты в одинаковой мере диссоциируют на ионы. Степень диссоциации зависит от природы электролита и его концентрации.
6. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
Реакции ионного обмена
Свойства растворов слабых электролитов обусловлены молекулами и ионами, образовавшимися в процессе диссоциации, которые находятся в динамическом равновесии друг с другом.
Запах уксусной кислоты обусловлен наличием молекул $CH_3COOH$, кислый вкус и изменение окраски индикаторов связаны с наличием в растворе ионов $H^{+}$.
Свойства растворов сильных электролитов определяются свойствами ионов, которые образуются при их диссоциации.
При растворении в воде кислоты диссоциируют с образованием катионов водорода $Н^{+}$ (точнее, ионов оксония $Н_3О^{–}$), которые определяют общие свойства кислот, такие как кислый вкус, изменение окраски индикатора и др., и отрицательно заряженных ионов, соответствующих кислотным остаткам. При ионной необратимой диссоциации, когда в растворе молекул нет, кислота называется сильной. При обратимой диссоциации, когда в растворе кислоты, наряду с соответствующими ионами, остаются и молекулы, кислота называется слабой. К сильным кислотам относятся азотная, серная, соляная и некоторые другие. Слабые кислоты — фтороводородная (плавиковая), угольная, сероводородная, фосфорная, органические кислоты и др.
Свойства кислот можно разделить на три группы.
Первая группа объединяет общие свойства кислот, определяемые наличием в их растворах ионов водорода. Это вкус, окраска индикаторов, взаимодействие с металлами, основными оксидами, щелочами, основаниями. Приведем соответствующие сокращенные ионные уравнения:
— с металлами, стоящими в ряду напряжений металлов левее водорода:
$Zn + 2H^{+} = Zn^{2+} + H_2↑;$
— с основными оксидами:
$CuO + 2H^{+} = Cu^{2+} + H_2O;$
— с щелочами:
$H^{+} + OH^{–} = H_2O;$
— с нерастворимыми основаниями:
$Fe(OH)_3 + 2H^{+} + 2H_2O$.
Ко второй группе относятся реакции, определяемые свойствами кислотных остатков. Это специфические для каждой кислоты реакции: образование малорастворимых, иногда окрашенных солей.
Для серной кислоты $H_2SO_4$:
$Ba^{2+} + SO_4^{2–}={BaSO_4↓}↙{белый}$,
для угольной кислоты $H_2CO_3$:
$Ca+CO_3^{2-}={CaCO_3↓}↙{белый}$,
Третью группу составляют реакции, протекание которых обусловлено такими свойствами кислот, как сила кислоты, ее растворимость в воде, прочность молекулы, летучесть. Сильная кислота вытесняет слабую:
${3H_2SO_4}↙{сильная}+Ca_3(PO_4)_2={2H_3PO_4}↙{слабая}+3CaSO_4$
При растворении в воде основания образуют гидроксид-ионы ОН– и положительно заряженные ионы аммония $NH_4^{+}$). Растворимые в воде щелочи являются сильными электролитами, в их растворах молекул гидроксидов нет. Нерастворимые основания — слабые электролиты. Слабым электролитом является и гидроксид аммония $NH_4OH$, который представляет собой соединение молекулы аммиака с молекулой воды $NH_3·H_2O$. Специфические свойства оснований определяются свойствами иона металла.
Соли при растворении в воде диссоциируют с образованием положительно заряженных ионов металла (или аммония $NH_4^{+}$) и отрицательно заряженных кислотных остатков. Эти молекулы определяют поведение солей в растворах.
Например, общие свойства кислот, такие как кислый вкус, изменение окраски индикаторов, обусловлены наличием в их растворах катионов водорода (точнее, ионов оксония $H_3O^{–}$). Общие свойства щелочей, такие, как мылкость на ощупь, изменение окраски индикаторов и др., связаны с присутствием в их растворах гидроксид-ионов $OH^{–}$, а свойства солей — с распадом их в растворе на катионы металла (или аммония) и анионы кислотных остатков.
Как известно, высокая скорость многих химических реакций в растворах электролитов объясняется тем, что они протекают не между молекулами, а между ионами.
Реакции, протекающие между ионами, называют ионными реакциями.
Реакции ионного обмена в водных растворах могут протекать:
1) необратимо, до конца;
2) обратимо, т.е. протекать одновременно в двух противоположных направлениях.
Как вам известно, реакции обмена между сильными электролитами в растворах протекают до конца или практически необратимы, когда ионы, соединяясь друг с другом, образуют вещества:
а) нерастворимые;
б) малодиссоциирующие (слабые электролиты);
в) газообразные.
Приведем несколько примеров молекулярных и сокращенных ионных уравнений:
a) $AgNO_3+HCl=AgCl↓+HNO_3$
$Ag^{+}+Cl^{–}=AgCl↓$
Реакция необратима, потому что один из ее продуктов уходит из сферы реакции в виде нерастворимого вещества.
б) $Ba(OH)_2+2HNO_3=Ba(NO_3)_2+2H_2O$
$H^{+}+OH^{–}=H_2O$
Реакция нейтрализации необратима, т.к. образуется малодиссоциирующее вещество — вода.
в) $H_2SO_4+Na_2CO_3=Na_2SO_4+H_2O+CO_2↑$
$2H^{+}+CO_3^{2-}=H_2O+CO_2↑$
Реакция необратима, т.к. образуется углекислый газ $CO_2$ и малодиссоциирующее вещество — вода.
Если среди исходных веществ и среди продуктов реакции имеются слабые электролиты или малорастворимые вещества, то такие реакции являются обратимыми, т.е. до конца не протекают. В обратимых реакциях равновесие смещается в сторону образования наименее растворимых или наименее диссоциированных веществ.
Например:
${CH_3COOH}↙{text»слабый электролит»}+NaOH⇄CH_3COONa+{H_2O}↙{text»слабый электролит»}$
$CH_3COOH+OH^{-}⇄CH_3COO^{-}+H_2O$
Равновесие смещается в сторону образования более слабого электролита — $H_2O$. Однако до конца такая реакция протекать не будет: в растворе остаются недиссоциированные молекулы уксусной кислоты и гидроксид-ионы.
Если исходные вещества — сильные электролиты, которые при взаимодействии не образуют нерастворимых или малодиссоциирующих веществ или газов, то такие реакции не протекают: при смешивании растворов образуется смесь ионов.
Ключевые слова конспекта: щелочные металлы, элементы IA-группы, литий, натрий, цезий, калий, рубидий, надпероксиды, пероксид натрия, щелочи, получение и применение щелочных металлов.
Щелочными металлами называют элементы IA-группы Периодической системы. Групповое название «щелочные» обусловлено тем, что растворимые в воде гидроксиды натрия и калия известны с древних времён, их называли щелочами. Важнейшие параметры этих элементов приведены в таблице.
Вы видите, как меняются свойства элементов в подгруппе: от лития к цезию радиусы атомов увеличиваются, значения энергии ионизации и электроотрицательности уменьшаются, металлические свойства усиливаются.
Электронная конфигурация валентного электронного слоя атомов щелочных металлов ns1, где n – номер валентного энергетического уровня. Щелочные металлы являются s-элементами.
В соединениях щелочных металлов преобладает ионный характер связи. В своих соединениях щелочные металлы могут быть только одновалентны. Во всех своих соединениях щелочные металлы имеют степень окисления +1.
Высшими оксидами являются соединения состава Ме2O, они имеют ярко выраженный основный характер. Высшие гидроксиды щелочных металлов МеОН – типичные основания, щёлочи. Водородные соединения щелочных металлов – твёрдые гидриды состава МеН.
ЩЕЛОЧНЫЕ МЕТАЛЛЫ – ПРОСТЫЕ ВЕЩЕСТВА
Щелочные металлы – вещества немолекулярного строения, их кристаллическая решётка металлическая.
При обычных условиях щелочные металлы – твёрдые вещества, имеют металлический блеск на свежем срезе (быстро тускнеют вследствие окисления), лёгкие (литий – самый лёгкий металл, его плотность составляет 0,53 г/см3), легкоплавкие, мягкие (легко режутся ножом).
При внесении щелочных металлов или их соединений в бесцветное пламя оно приобретает характерную окраску:
|
Элемент |
Окраска пламени | Элемент |
Окраска пламени |
|
Li |
карминово-красная |
Rb |
розовато-фиолетовая |
|
Na |
жёлтая |
Cs |
фиолетово-синяя |
|
К |
бледно–фиолетовая |
Щелочные металлы являются активными восстановителями. В атмосфере хлора и фтора они воспламеняются при обычных условиях.
Взаимодействие щелочных металлов с жидким бромом сопровождается взрывом.
Нагретые щелочные металлы легко сгорают на воздухе или в кислороде, но только при сгорании лития образуется оксид:
При сгорании натрия обычно образуется пероксид (Na2O2):
Пероксид натрия Na2O2 – кристаллы светло-жёлтого цвета – можно рассматривать как соль пероксида водорода H2O2.
При сгорании остальных щелочных металлов образуются надпероксиды (например, КO2). Получить оксиды Na2О, К2O, Rb2O, Cs2O можно восстановлением пероксидов и надпероксидов щелочными металлами, например, по реакции: КO2 + 3К = 2К2O
Щелочные металлы взаимодействуют с серой при нагревании.
Литий – единственный металл, который реагирует с азотом с образованием нитрида уже при комнатной температуре:
Остальные щелочные металлы с азотом не реагируют (натрий реагирует с азотом при 100 °С, при электрическом разряде).
При нагревании щелочные металлы взаимодействуют с водородом с образованием твёрдых гидридов:
Щелочные металлы активно взаимодействуют с водой с образованием щёлочи и водорода. При этом кусочек лития или натрия с шипением «бегает» по поверхности воды, при взаимодействии калия происходит возгорание выделяющегося водорода (бледно-фиолетовое пламя), рубидий и цезий взаимодействуют со взрывом:
Щелочные металлы активно реагируют с разбавленными кислотами с образованием соли и водорода, но при этом параллельно протекают реакции щелочного металла с водой и образовавшейся щёлочи с кислотой.
Иначе протекают реакции с концентрированными растворами кислот или с самими кислотами – сильными окислителями, например с азотной и серной. В этих реакциях происходит восстановление азота в высшей степени окисления (в HNO3) или серы в высшей степени окисления (в H2SO4). Образуется соль, продукт восстановления азота или серы и вода:
Щелочные металлы активно взаимодействуют с растворами солей, но при этом происходит не замещение металла, входящего в состав соли, щелочным металлом, а прежде всего взаимодействие щелочного металла с водой раствора.
Натрий получают электролизом расплава поваренной соли (с добавками СаCl2 для понижения температуры плавления смеси):
Щелочные металлы находят широкое применение в промышленности и в технике:
- литий – в литий-ионных аккумуляторах, в термоядерной энергетике для получения изотопа водорода – трития, а также в качестве теплоносителя в ядерных реакторах;
- натрий используют как теплоноситель в ядерных реакторах, для синтеза некоторых органических соединений (например, как катализатор в синтезе каучука, как активный восстановитель в других реакциях, часто в сплаве с калием), в металлотермии (натрийтермия);
- цезий легко теряет электроны даже под действием света, поэтому он применяется в фотоэлементах.
Наиболее распространёнными соединениями щелочных металлов являются (приведены исторические названия):
NaOH – едкий натр (каустическая сода),
NaCl – поваренная соль,
NaNO3 – чилийская селитра,
Na2SO4 • 10H2O – глауберова соль,
Na2CO3 • 10H2O – сода кристаллическая,
КОН – едкое кали,
КCl – хлорид калия, входит в состав калийной соли (NaCl • КCl + КCl),
KNO3 – индийская селитра,
К2СO3 – поташ.
Конспект урока по химии «Щелочные металлы. Элементы IA-группы». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии