Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с выпадением осадка и выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: азотная кислота (конц.), хлорид калия, фторид серебра(I), нитрит калия, фосфид алюминия. Допустимо использование водных растворов веществ.
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Спрятать решение
Решение.
Запишем уравнение реакции:
Составим электронный баланс:
Фосфор в степени окисления −3 является восстановителем. Азот в степени окисления +5 — окислителем.
Спрятать критерии
Критерии проверки:
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Ответ правильный и полный, содержит следующие элементы:
— выбраны вещества, и записано уравнение окислительно-восстановительной реакции; — составлен электронный баланс, указаны окислитель и восстановитель |
2 |
| Правильно записан один элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 2 |
| Щелочная фосфатаза | |||||||
|---|---|---|---|---|---|---|---|
 Ленточная диаграмма (цвет радуги, N-конец, = синий, С-конец = красный) димерной структуры бактериальной щелочной фосфатазы. Ленточная диаграмма (цвет радуги, N-конец, = синий, С-конец = красный) димерной структуры бактериальной щелочной фосфатазы. |
|||||||
| Идентификаторы | |||||||
| Номер ЕС | 3.1.3.1 | ||||||
| Номер CAS | 9001-78 -9 | ||||||
| Базы данных | |||||||
| IntEnz | Представление IntEnz | ||||||
| BRENDA | Запись BRENDA | ||||||
| ExPASy | Представление NiceZyme | ||||||
| KEGG | Запись KEGG | ||||||
| MetaCyc | метаболический путь | ||||||
| PRIAM | профиль | ||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||
| Онтология гена | AmiGO / QuickGO | ||||||
|
| Щелочная фосфатаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
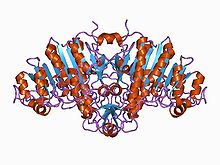 Структура щелочной фосфатазы. Структура щелочной фосфатазы. |
|||||||||
| Идентификаторы | |||||||||
| Символ | Алк_фосфатаза | ||||||||
| Pfam | PF00245 | ||||||||
| InterPro | IPR001952 | ||||||||
| SMART | SM00098 | ||||||||
| PROSITE | PDOC00113 | ||||||||
| SCOPe | 1alk / SUPFAM | ||||||||
|
Щелочная фосфатаза (ALP, ALKP, ALPase, Alk Phos ) (EC 3.1.3.1 ) или основная фосфатаза, является гомодимером белок фермент 86 килодальтон. Каждый мономер содержит пять остатков цистеина, два атома цинка и один атом магния, важные для его каталитической функции, и он оптимально активен в щелочной pH среде.
ALP выполняет физиологическую роль дефосфорилирования соединений. Фермент встречается у множества организмов, прокариот и эукариот одинаково, с одинаковой общей функцией, но в различных структурных формах, подходящих для среды, в которой они функционируют. Щелочная фосфатаза находится в периплазматическом пространстве E. coli бактерии. Этот фермент термостабилен и проявляет максимальную активность при высоком pH. У людей он встречается во многих формах в зависимости от его происхождения в организме — он играет важную роль в метаболизме в печени и развитии в скелете. Из-за его широкой распространенности в этих областях его концентрация в кровотоке используется диагностами в качестве биомаркера для определения таких диагнозов, как гепатит или остеомаляция.
Уровень щелочной фосфатазы в крови. проверяется с помощью теста ALP, который часто является частью обычных анализов крови. Уровни этого фермента в крови зависят от таких факторов, как возраст, пол или группа крови. Уровень щелочной фосфатазы в крови также увеличивается в два-четыре раза во время беременности. Это результат дополнительной щелочной фосфатазы, продуцируемой плацентой. Кроме того, аномальные уровни щелочной фосфатазы в крови могут указывать на проблемы, связанные с печенью, желчным пузырем или костями. Опухоли и инфекции почек, а также недоедание также показали аномальный уровень щелочной фосфатазы в крови. Уровни щелочной фосфатазы в клетке можно измерить с помощью процесса, называемого «метод подсчета очков». Обычно берут и окрашивают мазок крови, чтобы классифицировать каждый лейкоцит по определенным «индексам щелочной фосфатазы лейкоцитов». Этот маркер предназначен для различения лейкоцитов и определения различной активности ферментов в зависимости от степени окрашивания каждого образца.
Содержание
- 1 Бактериальное
- 1.1 Внутригенное дополнение
- 2 Использование в исследованиях
- 2.1 Текущие исследования
- 2.2 Молочная промышленность
- 2.3 Ингибиторы
- 3 Человек
- 3.1 Физиология
- 3.1.1 Щелочная фосфатаза кишечника
- 3.1.1.1 В раковых клетках
- 3.1.1 Щелочная фосфатаза кишечника
- 3.2 Повышенные уровни
- 3.3 Пониженные уровни
- 3.4 Использование для прогнозов
- 3.4.1 Лейкоцитарная щелочная фосфатаза
- 3.5 Структура и свойства
- 3.1 Физиология
- 4 См. Также
- 5 Ссылки
- 6 Дополнительная литература
- 7 Внешние ссылки
Бактериальные
У грамотрицательных бактерий, таких как Escherichia coli (E. coli), щелочная фосфатаза расположена в периплазматическом пространстве, вне внутреннего клеточная мембрана и в части пептидогликана клеточной стенки. Поскольку периплазматическая щель более подвержена изменениям окружающей среды, чем внутренняя клетка, щелочная фосфатаза подходяще устойчива к инактивации, денатурации или деградации. Эта характеристика фермента необычна для многих других белков.
Точная структура и функция четырех изоферментов (Int в E.coli) предназначены исключительно для обеспечения источника неорганического фосфата, когда в окружающей среде отсутствует этот метаболит.. Четыре фермента зависят от локализации тканевой экспрессии. Четыре участка тканевой экспрессии — это кишечная ЩФ, Плацентарная ЩФ, ЩФ зародышевых клеток и ЩФ в печени / костях / почках. Неорганические фосфаты, продуцируемые этими изоферментами, затем связываются с белками-носителями, которые доставляют неорганические фосфаты в специфическую высокоаффинную транспортную систему, известную как система Pst, которая транспортирует фосфат через цитоплазматическую мембрану.
В то время как внешняя Мембрана E. coli содержит порины, проницаемые для фосфорилированных соединений, внутренняя мембрана — нет. Затем возникает вопрос, как транспортировать такие соединения через внутреннюю мембрану в цитозоль. Конечно, с сильным анионным зарядом фосфатных групп вместе с остальной частью соединения они очень не смешиваются в неполярной области бислоя. Решение возникает при отщеплении фосфатной группы от соединения посредством ALP. Фактически, вместе с сопутствующим соединением, с которым был связан фосфат, этот фермент дает чистый неорганический фосфат, который в конечном итоге может быть нацелен (система Pst) для перемещения в цитозоль. Таким образом, основной целью дефосфорилирования щелочной фосфатазой является увеличение скорости диффузии молекул в клетки и ингибирование их диффузии наружу.
Щелочная фосфатаза представляет собой цинкосодержащий димерный фермент с молекулярной массой: 86000 Да, каждая субъединица содержит 429 аминокислот с четырьмя остатками цистеина, связывающими две субъединицы. Щелочная фосфатаза содержит четыре иона Zn и два иона Mg, причем Zn занимает активные центры A и B, а Mg — сайт C, поэтому полностью активная природная щелочная фосфатаза называется ферментом (Zn AZnBMgC)2. Механизм действия щелочного фосфатаза включает геометрическую координацию субстрата между ионами Zn в активных центрах, тогда как сайт Mg, по-видимому, не находится достаточно близко, чтобы напрямую участвовать в механизме гидролиза, однако он может вносить вклад в форму электростатического потенциала вокруг Активный центр. Щелочная фосфатаза имеет Km 8,4 x 10.
Щелочная фосфатаза в E. coli редко растворима и активна в условиях повышенных температур, таких как 80 ° C. Из-за кинетической энергии, индуцированной этой температурой слабые водородные связи и гидрофобные взаимодействия обычных белков разрушаются и, следовательно, сливаются и выпадают в осадок. Однако при димеризации ALP связи, поддерживающие его вторичную и третичную структуры, становятся e Они должны быть захоронены таким образом, чтобы не подвергаться такому воздействию при этой температуре. Более того, даже при более высоких температурах, таких как 90 ° C, ALP имеет необычную характеристику обратной денатурации. Благодаря этому, в то время как ALP в конечном итоге денатурирует примерно при 90 ° C, он обладает дополнительной способностью точно реформировать свои связи. и вернуться к своей исходной структуре и функции после охлаждения.
Щелочная фосфатаза в E. coli находится в периплазматическом пространстве и, таким образом, может высвобождаться с использованием методов, которые ослабляют клеточную стенку и высвобождают белок. Из-за расположения фермента и белковой структуры фермента, фермент находится в растворе с меньшим количеством белков, чем в другой части клетки. Тепловая стабильность белков также может быть использована при выделении этого фермента (посредством тепловой денатурации). Кроме того, щелочная фосфатаза может быть проанализирована с использованием п-нитрофенилфосфата. Реакция, при которой щелочная фосфатаза дефосфорилирует неспецифический субстрат, п-нитрофенилфосфат, с образованием п-нитрофенола (PNP) и неорганического фосфата. Желтый цвет PNP и его λ max при 410 позволяют спектрофотометрии определять важную информацию о ферментативной активности. Некоторые сложности бактериальной регуляции и метаболизма предполагают, что другие, более тонкие, цели фермента также могут играть роль для клетки. В лаборатории, однако, мутант Escherichia coli, лишенный щелочной фосфатазы, выживают довольно хорошо, как и мутанты, неспособные остановить выработку щелочной фосфатазы.
Оптимальный pH для активность фермента E. coli составляет 8,0, тогда как оптимальное значение pH фермента крупного рогатого скота немного выше и составляет 8,5. На щелочную фосфатазу приходится 6% всех белков в дерепрессированных клетках.
Внутригенная комплементация
Когда несколько копий полипептида, кодируемого геном, образуют агрегат, эта структура белка называется мультимером. Когда мультимер формируется из полипептидов, продуцируемых двумя разными мутантными аллелями конкретного гена, смешанный мультимер может проявлять большую функциональную активность, чем несмешанные мультимеры, образованные каждым из мутантов по отдельности. В таком случае явление упоминается как внутригенная комплементация. Щелочная фосфатаза E. coli, димерный фермент, проявляет внутригенную комплементацию. Когда были объединены определенные мутантные версии щелочной фосфатазы, гетеродимерные ферменты, образованные в результате, проявляли более высокий уровень активности, чем можно было бы ожидать, исходя из относительной активности исходных ферментов. Эти результаты показали, что димерная структура щелочной фосфатазы E.coli допускает кооперативные взаимодействия между составляющими мономерами, которые могут генерировать более функциональную форму холофермента.
Использование в исследованиях
Изменяя аминокислоты фермента щелочной фосфатазы дикого типа, продуцируемого Escherichia coli, создается мутантная щелочная фосфатаза, уровень фермента которой увеличивается не только в 36 раз. активность, но также сохраняет термостабильность. Типичное применение щелочных фосфатаз в лаборатории включает удаление сложных моноэфиров фосфата для предотвращения самолигирования, что нежелательно при клонировании плазмидной ДНК.
Общие щелочные фосфатазы, используемые в исследованиях, включают:
- щелочную фосфатазу креветок (SAP), из вид арктических креветок (Pandalus borealis ). Эта фосфатаза легко инактивируется при нагревании, что является полезным свойством в некоторых применениях.
- Щелочная фосфатаза кишечника теленка (CIP)
- Плацентарная щелочная фосфатаза (PLAP) и ее усеченная на С-конце версия, в которой отсутствует последние 24 аминокислоты (составляющие домен, нацеленный на закрепление GPI-мембраны) — секретируемая щелочная фосфатаза (SEAP). Он обладает определенными характеристиками, такими как термостойкость, специфичность к субстрату и устойчивость к химической инактивации.
- Щелочная фосфатаза кишечника человека. В организме человека присутствует несколько типов щелочной фосфатазы, которые определяются как минимум тремя локусами генов. Каждый из этих трех локусов контролирует разные виды изофермента щелочной фосфатазы . Однако развитие этого фермента может строго регулироваться другими факторами, такими как термостабильность, электрофорез, ингибирование или иммунология.
АЛФаза кишечника человека демонстрирует около 80% гомологии с АЛФазой кишечника крупного рогатого скота, что подтверждает их общее эволюционное происхождение. Тот же самый бычий фермент более чем на 70% гомологичен человеческому плацентарному ферменту. Однако кишечные ферменты человека и плацентарные ферменты имеют только 20% гомологии, несмотря на их структурное сходство.
Щелочная фосфатаза стала полезным инструментом в лабораториях молекулярной биологии, поскольку ДНК обычно содержит фосфатные группы на 5 ‘ конце. Удаление этих фосфатов предотвращает лигирование ДНК (5 ‘конец, прикрепленный к 3’ концу), таким образом, молекулы ДНК остаются линейными до следующего этапа процесса, для которого они подготовлен; кроме того, удаление фосфатных групп позволяет маркировать радиоактивной меткой (заменой радиоактивными фосфатными группами) для измерения присутствия меченой ДНК на дальнейших этапах процесса или эксперимента. Для этих целей наиболее полезна щелочная фосфатаза креветок, поскольку ее легче всего деактивировать, как только она сделает свою работу.
Еще одно важное применение щелочной фосфатазы — это метка для иммуноферментных анализов.
Недифференцированные плюрипотентные стволовые клетки имеют повышенные уровни щелочной фосфатазы на их клеточной мембране, поэтому используется для обнаружения этих клеток и тестирования плюрипотентности (т.е. эмбриональные стволовые клетки или клетки эмбриональной карциномы ).
Существует положительная корреляция между сывороткой Уровни костной щелочной фосфатазы (B-ALP) и формирование костей у людей, хотя ее использование в качестве биомаркера в клинической практике не рекомендуется.
Текущие исследования
Текущие исследователи изучают увеличение фактора некроза опухоли-α и его прямое влияние на экспрессию щелочной фосфатазы в гладкомышечных клетках сосудов, а также то, как щелочная фосфатаза (ЩФ) влияет на воспалительные реакции и может играть прямую роль в предотвращении повреждения органов.
- Щелочная фосфатаза (ЩФ) влияет на воспалительные реакции у пациентов с Хроническая болезнь почек и напрямую связана с анемией, устойчивой к возбудителям эритропоэза.
- Щелочная фосфатаза кишечника (IAP) и механизм, который она использует для регулирования pH и гидролиза АТФ в двенадцатиперстной кишке крыс.
- Тестирование эффективности ингибитора и его влияние на ВБД при остром кишечном воспалении, а также изучение молекулярных механизмов ВБД в «улучшении кишечной проницаемости».
Молочная промышленность
Обычно используется щелочная фосфатаза в молочной промышленности как показатель успешной пастеризации. Это связано с тем, что наиболее термостойкие бактерии, обнаруженные в молоке, Mycobacterium paratuberculosis, разрушаются при температурах более низких, чем те, которые необходимы для денатурации ЩФ. Следовательно, присутствие ALP идеально подходит для индикации неудачной пастеризации.
Проверка пастеризации обычно выполняется путем измерения флуоресценции раствора, который становится флуоресцентным при воздействии активной ALP. Производители молока в Великобритании требуют проведения флуориметрических анализов, чтобы доказать, что щелочная фосфатаза денатурирована, поскольку тесты на р-нитрофенилфосфат не считаются достаточно точными, чтобы соответствовать санитарным стандартам.
В качестве альтернативы можно использовать изменение цвета субстрата пара-нитрофенилфосфат в буферном растворе (тест Ашаффенбурга-Маллена). Сырое молоко обычно приобретает желтый цвет в течение нескольких минут, тогда как правильно пастеризованное молоко не должно иметь изменений. Есть исключения из этого, как в случае термостойких щелочных фосфатаз, продуцируемых некоторыми бактериями, но эти бактерии не должны присутствовать в молоке.
Ингибиторы
Все изоферменты щелочной фосфатазы млекопитающих, кроме плацентарных (PALP и SEAP), ингибируются, и аналогичным образом блокируются все, кроме кишечных и плацентарных. левамизолом. Фосфат является другим ингибитором, который конкурентно ингибирует щелочную фосфатазу.
Другим известным примером ингибитора щелочной фосфатазы является [(4-нитрофенил) метил] фосфоновая кислота.
В почве, загрязненной металлами, щелочная фосфатаза ингибируется Cd (кадмием). Кроме того, температура увеличивает ингибирование активности Cd на активность ЩФ, что проявляется в увеличивающихся значениях Km.
Человек
Физиология
У людей присутствует щелочная фосфатаза во всех тканях по всему телу, но особенно сконцентрирован в печени, желчном протоке, почке, кости, кишечнике слизистая оболочка и плацента. В сыворотке преобладают два типа изоферментов щелочной фосфатазы : скелетные и печеночные. В детстве большая часть щелочной фосфатазы имеет скелетное происхождение. Человек и большинство других млекопитающих содержат следующие изоферменты щелочной фосфатазы:
- ALPI — кишечный (молекулярная масса 150 кДа)
- ALPL — тканеспецифический (экспрессируется в основном в печени, костях и почках)
- ALPP — плацентарный (изофермент Регана)
- ALPG — половая клетка
Четыре гена кодируют четыре изофермента. Ген тканевой неспецифической щелочной фосфатазы расположен на хромосоме 1, а гены трех других изоформ — на хромосоме 2.
Щелочная фосфатаза кишечника
Щелочная кишка фосфатаза секретируется энтероцитами и, по-видимому, играет ключевую роль в гомеостазе и защите кишечника, а также в опосредовании воспаления посредством репрессии нижележащего Toll-подобного рецептора (TLR) -4-зависимого и MyD88- зависимый воспалительный каскад. Он дефосфорилирует токсичные / воспалительные микробные лиганды, такие как липополисахариды, неметилированные цитозин-гуаниндинуклеотиды, флагеллин и внеклеточные нуклеотиды, такие как уридиндифосфат или АТФ. Таким образом, измененная экспрессия IAP вовлечена в хронические воспалительные заболевания, такие как воспалительное заболевание кишечника (IBD). Он также, по-видимому, регулирует всасывание липидов и секрецию бикарбонатов в слизистой оболочке двенадцатиперстной кишки, что регулирует поверхностный pH.
В раковых клетках
Исследования показывают, что белок щелочной фосфатазы, обнаруженный в раковых клетках, аналогичен белку, обнаруженному в незлокачественных тканях организма, и что белок происходит из одного и того же гена в обоих. В одном исследовании сравнивали ферменты метастазов в печень гигантоклеточной карциномы легкого и незлокачественных клеток плаценты. Они были похожи по NH 2 -концевой последовательности, пептидной карте, молекулярной массе субъединицы и изоэлектронной точке.
В другом исследовании, в котором ученые изучали присутствие белка щелочной фосфатазы в толстой кишке человека линия раковых клеток, также известная как HT-29, показала, что активность фермента аналогична активности незлокачественного кишечника. Однако это исследование показало, что без влияния бутирата натрия активность щелочной фосфатазы в раковых клетках довольно низкая. Исследование, основанное на воздействии бутирата натрия на раковые клетки, показывает, что он влияет на экспрессию ко-регулятора рецептора андрогена, активность транскрипции, а также на ацетилирование гистонов в раковых клетках. Это объясняет, почему добавление бутирата натрия показывает повышенную активность щелочной фосфатазы в раковых клетках толстой кишки человека. Кроме того, это еще раз подтверждает теорию о том, что активность фермента щелочной фосфатазы действительно присутствует в раковых клетках.
В другом исследовании клетки хориокарциномы выращивали в присутствии 5-бром-2’-дезоксиуридина (BrdUrd), и результаты показали 30-40-кратное увеличение активности щелочной фосфатазы. Эта процедура повышения активности фермента известна как индукция фермента. Фактические данные показывают, что активность щелочной фосфатазы в опухолевых клетках действительно существует, но она минимальна и требует повышения. Результаты этого исследования также показывают, что активность этого фермента различается в зависимости от клеточных линий хориокарциномы и что активность белка щелочной фосфатазы в этих клетках ниже, чем в незлокачественных клетках плаценты. но уровни значительно выше у детей и беременных женщин. Анализы крови всегда следует интерпретировать с использованием эталонного диапазона из лаборатории, проводившей анализ. Высокий уровень ЩФ может возникать, если желчные протоки заблокированы.
Кроме того, ЩФ увеличивается, если происходит активное костеобразование, поскольку ЩФ является побочным продуктом активности остеобластов (например, костная болезнь Педжета ).
ЩФ гораздо больше повышена в метастатических клетках рака простаты, чем в клетках неметастатического рака простаты. Высокие уровни ЩФ у пациентов с раком простаты связаны со значительным снижением выживаемости.
Уровни также повышены у людей с нелеченой глютеновой болезнью. Пониженные уровни ЩФ встречаются реже, чем повышенные. Источник повышенных уровней ЩФ может быть определен путем определения сывороточных уровней гамма-глутамилтрансферазы (GGT). Сопутствующее повышение ЩФ с GGT должно вызвать подозрение на гепатобилиарное заболевание.
Некоторые заболевания не влияют на уровень щелочной фосфатазы, например, гепатит С. Высокий уровень этого фермента влияет на уровень щелочной фосфатазы. не отражают какого-либо повреждения печени, даже если высокий уровень щелочной фосфатазы может быть результатом блокирования кровотока в желчных путях или повышения давления в печени.
Повышенный уровень
Если неясно, почему уровень щелочной фосфатазы повышен, исследования изофермента с использованием электрофореза могут подтвердить источник ЩФ. Скельфосфатаза (которая локализуется в остеобластах и внеклеточных слоях вновь синтезированного матрикса) попадает в кровоток по еще неясному механизму. Уровень щелочной фосфатазы в плаценте повышен при семиномах и активных формах рахита, а также при следующих заболеваниях и состояниях:
- Обструкция желчных путей
- Состояние костей
- Остеобластические опухоли костей
- Остеомаляция
- Остеопороз
- Гепатит
- Цирроз
- Острый холецистит
- Миелофиброз
- Лейкемоидная реакция
- Лимфома
- Болезнь Педжета
- Гипертиреоз
- Гиперпаратиреоз
- Инфаркт миокарда
- Беременность
Пониженный уровень
Следующие состояния или заболевания могут привести к снижению уровня щелочной фосфатазы:
- Гипофосфатазия, аутосомно-рецессивное заболевание
- Постменопаузальные женщины, получающие терапию эстрогенами из-за старения
- Мужчины, недавно перенесшие операцию на сердце, недоедание, дефицит магния или тяжелая анемия
- Дети с ахондроплазией и
- Дети после тяжелого эпизода энтерита
- Пагубная анемия
- Апластическая анемия
- Болезнь Вильсона
- Гипотиреоз
Кроме того, было доказано, что оральные контрацептивы снижают щелочную фосфатазу.
Использование для прогнозов
Измерение щелочной фосфатазы ( вместе с простатоспецифическим антигеном) во время и после шести месяцев лечения метастатическим раком простаты гормональной терапией прогнозирует выживаемость пациентов.
Щелочная фосфатаза лейкоцитов
Обнаружена лейкоцитарная щелочная фосфатаза (LAP) внутри зрелых белых кровяных телец. Уровни лейкоцитов LAP могут помочь в диагностике определенных состояний.
- Более высокие уровни наблюдаются при физиологической реакции, лейкемоидной реакции и при патологиях, включающих зрелые лейкоциты, таких как истинная полицитемия (PV), эссенциальная тромбоцитоз (ЕТ) и первичный миелофиброз (PM).
- Более низкие уровни обнаруживаются при патологиях, связанных с неразвитыми лейкоцитами, таких как хронический миелогенный лейкоз (CML), пароксизмальная ночная гемоглобинурия (PNH) и острый миелогенный лейкоз (AML).
Структура и свойства
Щелочная фосфатаза является гомодимерным ферментом, что означает состоит из двух молекул. Три иона металла, два Zn и один Mg, содержатся в каталитических центрах, и оба типа имеют решающее значение для возникновения ферментативной активности. Ферменты катализируют гидролиз сложных моноэфиров в фосфорной кислоте, которая может дополнительно катализировать реакцию трансфосфорилирования с большими концентрациями акцепторов фосфата. В то время как основные черты каталитического механизма и активности сохраняются между щелочным фосфатом млекопитающих и бактерий, щелочная фосфатаза млекопитающих имеет более высокую удельную активность и значения K m, таким образом, более низкое сродство, более щелочной оптимум pH, более низкая термостойкость., и обычно связаны с мембраной и ингибируются l-аминокислотами и пептидами посредством неконкурентного механизма. Эти свойства заметно различаются между различными изоферментами щелочной фосфатазы млекопитающих и, следовательно, демонстрируют различие в функциях in vivo.
Щелочная фосфатаза гомологична большому количеству других ферментов и составляет часть суперсемейства ферментов с несколькими перекрывающимися каталитическими аспектами и характеристиками субстрата. Это объясняет, почему наиболее заметные структурные особенности щелочных веществ у млекопитающих являются такими, какие они есть, и отсылают их субстратную специфичность и гомологию к другим членам семейства изоферментов нуклеозидпирофосфатазы / фосфодиэстеразы. Исследования показали связь между членами семейства щелочной фосфатазы и арилсульфатазами. Сходство в структуре указывает на то, что эти два семейства ферментов произошли от общего предка. Дальнейший анализ связал щелочные фосфаты и арилсульфатазы с более крупным суперсемейством. Некоторые из общих генов этого суперсемейства кодируют как фосфодиэстеразы, так и аутотоксин.
См. Также
- Кислая фосфатаза
- Функциональные тесты печени
Ссылки
Далее чтение
Внешние ссылки
- Щелочная фосфатаза в Lab Tests Online
| Alkaline phosphatase | |||||||
|---|---|---|---|---|---|---|---|

Ribbon diagram (rainbow-color, N-terminus = blue, C-terminus = red) of the dimeric structure of bacterial alkaline phosphatase.[1] |
|||||||
| Identifiers | |||||||
| EC no. | 3.1.3.1 | ||||||
| CAS no. | 9001-78-9 | ||||||
| Databases | |||||||
| IntEnz | IntEnz view | ||||||
| BRENDA | BRENDA entry | ||||||
| ExPASy | NiceZyme view | ||||||
| KEGG | KEGG entry | ||||||
| MetaCyc | metabolic pathway | ||||||
| PRIAM | profile | ||||||
| PDB structures | RCSB PDB PDBe PDBsum | ||||||
| Gene Ontology | AmiGO / QuickGO | ||||||
|
| Alkaline phosphatase | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Structure of alkaline phosphatase.[1] |
|||||||||
| Identifiers | |||||||||
| Symbol | Alk_phosphatase | ||||||||
| Pfam | PF00245 | ||||||||
| InterPro | IPR001952 | ||||||||
| SMART | SM00098 | ||||||||
| PROSITE | PDOC00113 | ||||||||
| SCOP2 | 1alk / SCOPe / SUPFAM | ||||||||
|
The enzyme alkaline phosphatase (EC 3.1.3.1, alkaline phosphomonoesterase; phosphomonoesterase; glycerophosphatase; alkaline phosphohydrolase; alkaline phenyl phosphatase; orthophosphoric-monoester phosphohydrolase (alkaline optimum), systematic name phosphate-monoester phosphohydrolase (alkaline optimum))[2] catalyses the following reaction:
- a phosphate monoester + H2O = an alcohol + phosphate
Alkaline phosphatase has the physiological role of dephosphorylating compounds. The enzyme is found across a multitude of organisms, prokaryotes and eukaryotes alike, with the same general function but in different structural forms suitable to the environment they function in. Alkaline phosphatase is found in the periplasmic space of E. coli bacteria. This enzyme is heat stable and has its maximum activity at high pH. In humans, it is found in many forms depending on its origin within the body – it plays an integral role in metabolism within the liver and development within the skeleton. Due to its widespread prevalence in these areas, its concentration in the bloodstream is used by diagnosticians as a biomarker in helping determine diagnoses such as hepatitis or osteomalacia.[3]
The level of alkaline phosphatase in the blood is checked through the ALP test, which is often part of routine blood tests. The levels of this enzyme in the blood depend on factors such as age, sex, or blood type.[4] Blood levels of alkaline phosphatase also increase by two to four times during pregnancy. This is a result of additional alkaline phosphatase produced by the placenta and the liver.[5][6] Additionally, abnormal levels of alkaline phosphatase in the blood could indicate issues relating to the liver, gall bladder or bones. Kidney tumors and infections as well as malnutrition have also shown abnormal level of alkaline phosphatase in blood.[7] Alkaline phosphatase levels in a cell can be measured through a process called «The scoring method». A blood smear is usually taken and stained to categorize each leukocyte into specific «leukocyte alkaline phosphatase indices». This marker is designed to distinguish leukocytes and determine different enzyme activity from each sample’s extent of staining.[8]
Bacterial[edit]
In Gram-negative bacteria, such as Escherichia coli, alkaline phosphatase is located in the periplasmic space, external to the inner cell membrane and within the peptidoglycan portion of the cell wall. Since the periplasmic gap is more prone to environmental variation than the inner cell, alkaline phosphatase is suitably resistant to inactivation, denaturation, or degradation. This characteristic of the enzyme is uncommon to many other proteins.[9]
The precise structure and function of the isozyme in E. coli is solely geared to supply a source of inorganic phosphate when the environment lacks this metabolite. The inorganic phosphates are then bound to carrier proteins which deliver the inorganic phosphates to a specific high-affinity transport system, known as the phosphate-specific transport system (Pst system), which transports phosphate across the cytoplasmic membrane.[10]
While the outer membrane of E. coli contains porins that are permeable to phosphorylated compounds, the inner membrane does not. An issue arises in how to transport such compounds across the inner membrane and into the cytosol. The strong anionic charge of phosphate groups along with the remainder of the compound make phosphorylated compounds very much immiscible in the nonpolar region of the bilayer. The solution arises in cleaving the phosphate group away from the compound via ALP. The dephosphorylation reaction that ALP catalyzes yields pure inorganic phosphate, which can be ultimately targeted by the Pst system[11] for translocation into the cytosol,[12] with concomitant production of a dephosphorylated compound. As such, the main purpose of dephosphorylation by alkaline phosphatase is to increase the rate of diffusion of phosphorylated molecules into the cells while inhibiting them from diffusing out.[13]
Alkaline phosphatase is a zinc-containing dimeric enzyme with the MW: 86,000 Da, each subunit containing 429 amino acids with four cysteine residues linking the two subunits.[14] Alkaline phosphatase contains four Zn ions and two Mg ions, with Zn occupying active sites A and B, and Mg occupying site C, so the fully active native alkaline phosphatase is referred to as (ZnAZnBMgC)2 enzyme. The mechanism of action of alkaline phosphatase involves the geometric coordination of the substrate between the Zn ions in the active sites, whereas the Mg site doesn’t appear to be close enough to directly partake in the hydrolysis mechanism, however, it may contribute to the shape of the electrostatic potential around the active center.[14]
Alkaline phosphatase in E. coli is uncommonly soluble and active within elevated temperature conditions such as 80 °C. Due to the kinetic energy induced by this temperature the weak hydrogen bonds and hydrophobic interactions of common proteins become degraded and therefore coalesce and precipitate. However, upon dimerization of alkaline phosphatase the bonds maintaining its secondary and tertiary structures are effectively buried such that they are not affected as much at this temperature. Furthermore, even at more elevated temperatures such as 90 °C alkaline phosphatase has the unusual characteristic of reverse denaturation. Due to this, although it ultimately denatures at about 90 °C it has the added ability to accurately reform its bonds and return to its original structure and function once cooled back down.[9]
Alkaline phosphatase in E. coli is located in the periplasmic space and can thus be released using techniques that weaken the cell wall and release the protein. Due to the location of the enzyme, and the protein layout of the enzyme, the enzyme is in solution with a smaller amount of proteins than there are in another portion of the cell.
[15] The proteins’ heat stability can also be taken advantage of when isolating this enzyme (through heat denaturation). In addition, alkaline phosphatase can be assayed using p-Nitrophenyl phosphate. A reaction where alkaline phosphatase dephosphorylates the non-specific substrate, p-Nitrophenyl phosphate in order to produce p-Nitrophenol(PNP) and inorganic phosphate. PNP’s yellow color, and its λmax at 410 allows spectrophotometry to determine important information about enzymatic activity.[16] Some complexities of bacterial regulation and metabolism suggest that other, more subtle, purposes for the enzyme may also play a role for the cell. In the laboratory, however, mutant Escherichia coli lacking alkaline phosphatase survive quite well, as do mutants unable to shut off alkaline phosphatase production.[17]
The optimal pH for the activity of the E. coli enzyme is 8.0[18] while the bovine enzyme optimum pH is slightly higher at 8.5.[19] Alkaline phosphatase accounts for 6% of all proteins in derepressed cells.[20]
Intragenic complementation[edit]
When multiple copies of a polypeptide encoded by a gene form an aggregate, this protein structure is referred to as a multimer. When a multimer is formed from polypeptides produced by two different mutant alleles of a particular gene, the mixed multimer may exhibit greater functional activity than the unmixed multimers formed by each of the mutants alone. In such a case, the phenomenon is referred to as intragenic complementation. E. coli alkaline phosphatase, a dimer enzyme, exhibits intragenic complementation.[21] When particular mutant versions of alkaline phosphatase were combined, the heterodimeric enzymes formed as a result exhibited a higher level of activity than would be expected based on the relative activities of the parental enzymes. These findings indicated that the dimer structure of E.coli alkaline phosphatase allows cooperative interactions between the constituent monomers that can generate a more functional form of the holoenzyme.[citation needed]
Use in research[edit]
By changing the amino acids of the wild-type alkaline phosphatase enzyme produced by Escherichia coli, a mutant alkaline phosphatase is created which not only has a 36-fold increase in enzyme activity, but also retains thermal stability.[22] Typical uses in the lab for alkaline phosphatases include removing phosphate monoesters to prevent self-ligation, which is undesirable during plasmid DNA cloning.[23]
Common alkaline phosphatases used in research include:
- Shrimp alkaline phosphatase (SAP), from a species of Arctic shrimp (Pandalus borealis). This phosphatase is easily inactivated by heat, a useful feature in some applications.
- Calf-intestinal alkaline phosphatase (CIP)
- Placental alkaline phosphatase (PLAP) and its C terminally truncated version that lacks the last 24 amino acids (constituting the domain that targets for GPI membrane anchoring) – the secreted alkaline phosphatase (SEAP). It presents certain characteristics like heat stability, substrate specificity, and resistance to chemical inactivation.[24]
- Human-intestinal alkaline phosphatase. The human body has multiple types of alkaline phosphatase present, which are determined by a minimum of three gene loci. Each one of these three loci controls a different kind of alkaline phosphatase isozyme. However, the development of this enzyme can be strictly regulated by other factors such as thermostability, electrophoresis, inhibition, or immunology.[25]
Human-intestinal alkaline phosphatase shows around 80% homology with the bovine intestinal enzyme which holds true their shared evolutionary origins. That same bovine enzyme has more than 70% homology with human placental enzyme. However, the human intestinal enzyme and the placental enzyme only share 20% homology despite their structural similarities.[26]
Alkaline phosphatase has become a useful tool in molecular biology laboratories, since DNA normally possesses phosphate groups on the 5′ end. Removing these phosphates prevents the DNA from ligating (the 5′ end attaching to the 3′ end), thereby keeping DNA molecules linear until the next step of the process for which they are being prepared; also, removal of the phosphate groups allows radiolabeling (replacement by radioactive phosphate groups) in order to measure the presence of the labeled DNA through further steps in the process or experiment. For these purposes, the alkaline phosphatase from shrimp is the most useful, as it is the easiest to inactivate once it has done its job.[citation needed]
Another important use of alkaline phosphatase is as a label for enzyme immunoassays.[citation needed]
Undifferentiated pluripotent stem cells have elevated levels of alkaline phosphatase on their cell membrane, therefore alkaline phosphatase staining is used to detect these cells and to test pluripotency (i.e., embryonic stem cells or embryonal carcinoma cells).[27]
There is a positive correlation between serum bone alkaline phosphatase levels and bone formation in humans, although its use as a biomarker in clinical practice is not recommended.[28]
Ongoing research[edit]
Current researchers are looking into the increase of tumor necrosis factor-α and its direct effect on the expression of alkaline phosphatase in vascular smooth muscle cells as well as how alkaline phosphatase (AP) affects the inflammatory responses and may play a direct role in preventing organ damage.[29]
- Alkaline phosphatase (AP) affects the inflammatory responses in patients with Chronic kidney disease and is directly associated with Erythropoiesis stimulating agent resistant anemia.[30]
- Intestinal alkaline phosphatase (IAP) and the mechanism it uses to regulate pH and ATP hydrolysis in rat duodenum.[31]
- Testing the effectiveness of the inhibitor and its impact on IAP in acute intestinal inflammation as well as explore the molecular mechanisms of IAP in «ameliorating intestinal permeability.»[32]
Dairy industry[edit]
Alkaline phosphatase is commonly used in the dairy industry as an indicator of successful pasteurization. This is because the most heat stable bacterium found in milk, Mycobacterium paratuberculosis, is destroyed by temperatures lower than those required to denature the enzyme. Therefore, its presence is ideal for indicating failed pasteurization.[33][34]
Pasteurization verification is typically performed by measuring the fluorescence of a solution which becomes fluorescent when exposed to active alkaline phosphatase. Fluorimetry assays are required by milk producers in the UK to prove alkaline phosphatase has been denatured,[35] as p-Nitrophenylphosphate tests are not considered accurate enough to meet health standards.
Alternatively the colour change of p-nitrophenylphosphate as substrate in a buffered solution (Aschaffenburg Mullen Test) can be used.[36] Raw milk would typically produce a yellow coloration within a couple of minutes, whereas properly pasteurised milk should show no change. There are exceptions to this, as in the case of heat-stable alkaline phosphatases produced by some bacteria, but these bacteria should not be present in milk.[citation needed]
Inhibitors[edit]
All mammalian alkaline phosphatase isoenzymes except placental (PALP and SEAP) are inhibited by homoarginine, and, in similar manner, all except the intestinal and placental ones are blocked by levamisole.[37] Phosphate is another inhibitor which competitively inhibits alkaline phosphatase.[38]
Another known example of an alkaline phosphatase inhibitor is [(4-Nitrophenyl)methyl]phosphonic acid.[39]
In metal contaminated soil, alkaline phosphatase are inhibited by Cd (Cadmium). In addition, temperature enhances the inhibition of Cd on the enzyme activity, which is shown in the increasing values of Km.[40]
Human[edit]
Physiology[edit]
In humans, alkaline phosphatase is present in all tissues throughout the body, but is particularly concentrated in the liver, bile duct, kidney, bone, intestinal mucosa and placenta. In the serum, two types of alkaline phosphatase isozymes predominate: skeletal and liver. During childhood the majority of alkaline phosphatase are of skeletal origin.[41] Humans and most other mammals contain the following alkaline phosphatase isozymes:[citation needed]
- ALPI – intestinal (molecular mass of 150 kDa)
- ALPL – tissue-nonspecific (expressed mainly in liver, bone, and kidney)
- ALPP – placental (Regan isozyme)
- ALPG – germ cell
Four genes encode the four isozymes. The gene for tissue-nonspecific alkaline phosphatase is located on chromosome 1, and the genes for the other three isoforms are located on chromosome 2.[42]
Intestinal alkaline phosphatase[edit]
Intestinal alkaline phosphatase is secreted by enterocytes, and seems to play a pivotal role in intestinal homeostasis and protection[43][44] as well as in suppressing inflammation[45] via repression of the downstream Toll-like receptor (TLR)-4-dependent and MyD88-dependent inflammatory cascade.[46] It dephosphorylates toxic/inflammatory microbial ligands like lipopolysaccharides (LPSs),[47] unmethylated cytosine-guanine dinucleotides, flagellin, and extracellular nucleotides such as uridine diphosphate or ATP. Dephosphorylation of LPS by IAP can reduce the severity of Salmonella tryphimurium and Clostridioides difficile infection restoring normal gut microbiota.[47] Thus, altered IAP expression has been implicated in chronic inflammatory diseases such as inflammatory bowel disease (IBD).[47][48] It also seems to regulate lipid absorption[49] and bicarbonate secretion[50] in the duodenal mucosa, which regulates the surface pH. Since the 1960s intestinal alkaline phosphatase has been utilized in drug delivery. As it cleaves phosphate substructures from drugs, auxiliary agents, and even from the surface of nanocarriers, this enzyme enables the design of drug delivery systems that can alter their properties in the body on demand.[51] The solubility of many drugs can be substantially improved by the design of phosphate prodrugs. On the intestinal mucosa the phosphate substructures are cleaved off by alkaline phosphatase and the drug is absorbed.[52] Furthermore, anionic nanocarriers exhibiting bioinert properties can alter their surface to interactive once having reached the intestinal epithelium as due to an alkaline phosphatase triggered cleavage of anionic phosphate groups from their surface charge converts to cationic improving for instance cellular uptake.[53]
In cancer cells[edit]
Studies show that the alkaline phosphatase protein found in cancer cells is similar to that found in nonmalignant body tissues and that the protein originates from the same gene in both. One study compared the enzymes of liver metastases of giant-cell lung carcinoma and nonmalignant placental cells. The two were similar in NH2-terminal sequence, peptide map, subunit molecular weight, and isoelectronic point.[54]
In a different study in which scientists examined alkaline phosphatase protein presence in a human colon cancer cell line, also known as HT-29, results showed that the enzyme activity was similar to that of the non-malignant intestinal type. However, this study revealed that without the influence of sodium butyrate, alkaline phosphatase activity is fairly low in cancer cells.[55] A study based on sodium butyrate effects on cancer cells conveys that it has an effect on androgen receptor co-regulator expression, transcription activity, and also on histone acetylation in cancer cells.[56] This explains why the addition of sodium butyrate show increased activity of alkaline phosphatase in the cancer cells of the human colon.[55] In addition, this further supports the theory that alkaline phosphatase enzyme activity is actually present in cancer cells.[citation needed]
In another study, choriocarcinoma cells were grown in the presence of 5-bromo-2′-deoxyuridine and results conveyed a 30- to 40-fold increase in alkaline phosphatase activity. This procedure of enhancing the activity of the enzyme is known as enzyme induction. The evidence shows that there is in fact activity of alkaline phosphatase in tumor cells, but it is minimal and needs to be enhanced. Results from this study further indicate that activities of this enzyme vary among the different choriocarcinoma cell lines and that the activity of the alkaline phosphatase protein in these cells is lower than in the non-malignant placenta cells.[57][58] but levels are significantly higher in children and pregnant women. Blood tests should always be interpreted using the reference range from the laboratory that performed the test. High alkaline phosphatase levels can occur if the bile ducts are obstructed.[59]
Also, the level of alkaline phosphatase increases if there is active bone formation occurring, as the enzyme is a byproduct of osteoblast activity (such as the case in Paget’s disease of bone).[citation needed]
The level of alkaline phosphatase is much more elevated in metastatic prostate cancer cells than non-metastatic prostate cancer cells.[60] High levels of ALP in prostate cancer patients is associated with a significant decrease in survival.[60]
Levels are also elevated in people with untreated coeliac disease.[61] Lowered levels of the level of alkaline phosphatase are less common than elevated levels. The source of elevated levels can be deduced by obtaining serum levels of γ-glutamyltransferase. Concomitant increases of alkaline phosphatase with γ-glutamyltransferase should raise the suspicion of hepatobiliary disease.[62]
Some diseases do not affect the levels of alkaline phosphatase, for example, hepatitis C. A high level of this enzyme does not reflect any damage in the liver, even though high alkaline phosphatase levels may result from a blockage of flow in the biliary tract or an increase in the pressure of the liver.[63]
Elevated levels[edit]
If it is unclear why the level of alkaline phosphatase is elevated, isoenzyme studies using electrophoresis can confirm the source of the increase. Skelphosphatase (which is localized in osteoblasts and extracellular layers of newly synthesized matrix) is released into circulation by a yet unclear mechanism.[64] Placental alkaline phosphatase is elevated in seminomas[65] and active forms of rickets, as well as in the following diseases and conditions:[66]
- Biliary obstruction
- Bone conditions
- Osteoblastic bone tumors
- Osteomalacia
- Osteoporosis[67]
- Hepatitis
- Cirrhosis
- Acute cholecystitis
- Myelofibrosis
- Leukemoid reaction
- Lymphoma
- Paget’s disease
- Sarcoidosis
- Hyperthyroidism
- Hyperparathyroidism
- Myocardial infarction
- Pregnancy[6]
- Very high doses of estrogens[6][68][69]
Lowered levels[edit]
The following conditions or diseases may lead to reduced levels of alkaline phosphatase:[70]
- Hypophosphatasia, a genetic disorder
- Women receiving estrogen therapy for menopausal symptoms[citation needed]
- Estrogen-containing oral contraceptives[71]
- Men with recent heart surgery, malnutrition, magnesium deficiency, or severe anemia
- Children with achondroplasia and congenital iodine deficiency
- Children after a severe episode of enteritis
- Pernicious anemia
- Aplastic anemia
- Wilson’s disease
- Hypothyroidism
- Zinc deficiency
- Malnutrition
- Steroid treatment
- Colitis
Prognostic uses[edit]
Measuring alkaline phosphatase (along with prostate specific antigen) during, and after six months of hormone treated metastatic prostate cancer was shown to predict the survival of patients.[72]
Leukocyte alkaline phosphatase[edit]
Leukocyte alkaline phosphatase is found within mature white blood cells. White blood cell levels of LAP can help in the diagnosis of certain conditions.[citation needed]
- Higher than typical levels are seen in the physiological response, the leukemoid reaction, and in pathologies that include mature white blood cells, such as polycythemia vera, essential thrombocytosis, and in primary myelofibrosis.
- Lower than typical levels are found in pathologies that involve undeveloped leukocytes, such as chronic myelogenous leukemia[73] (CML), paroxysmal nocturnal hemoglobinuria and acute myelogenous leukaemia.
Structure and properties[edit]
Alkaline phosphatase is homodimeric enzyme, meaning it is formed with two molecules. Three metal ions, two Zn and one Mg, are contained in the catalytic sites, and both types are crucial for enzymatic activity to occur. The enzymes catalyze the hydrolysis of monoesters in phosphoric acid which can additionally catalyze a transphosphorylation reaction with large concentrations of phosphate acceptors. While the main features of the catalytic mechanism and activity are conserved between mammalian and bacterial alkaline phosphate, mammalian alkaline phosphatase has a higher specific activity and Km values thus a lower affinity, more alkaline pH optimum, lower heat stability, and are typically membrane bound and are inhibited by l-amino acids and peptides via a means of uncompetitive mechanism. These properties noticeably differ between different mammalian alkaline phosphatase isozymes and therefore showcase a difference in in vivo functions.[citation needed]
Alkaline phosphatase has homology in a large number of other enzymes and composes part of a superfamily of enzymes with several overlapping catalytic aspects and substrate traits. This explains why most salient structural features of mammalian alkaline are the way they are and reference their substrate specificity and homology to other members of the nucleoside pyrophosphatase/phosphodiesterase family of isozyme.[42] Research has shown a relationship between members of the alkaline phosphatase family with aryl sulfatases. The similarities in structure indicate that these two enzyme families came from a common ancestor. Further analysis has linked alkaline phosphates and aryl sulfatases to a larger superfamily. Some of the common genes found in this superfamily, are ones that encode phosphodiesterases as well as autotoxin.[74]
See also[edit]
- Acid phosphatase
- Liver function tests
References[edit]
- ^ a b PDB: 1ALK: Kim EE, Wyckoff HW (March 1991). «Reaction mechanism of alkaline phosphatase based on crystal structures. Two-metal ion catalysis». Journal of Molecular Biology. 218 (2): 449–64. doi:10.1016/0022-2836(91)90724-K. PMID 2010919.
- ^ Tamás L, Huttová J, Mistrk I, Kogan G (2002). «Effect of Carboxymethyl Chitin-Glucan on the Activity of Some Hydrolytic Enzymes in Maize Plants» (PDF). Chem. Pap. 56 (5): 326–329. Archived from the original (PDF) on 2011-07-25. Retrieved 2009-04-28.
- ^ «Alkaline Phosphatase Level Test (ALP)». Healthline. Retrieved 2017-05-07.
- ^ Dhruv L, Savio J (22 October 2017). «Alkaline Phosphatase». StatPearls. StatPearls. PMID 29083622.
- ^ Shipman KE, Holt AD, Gama R (April 2013). «Interpreting an isolated raised serum alkaline phosphatase level in an asymptomatic patient». BMJ. 346: f976. doi:10.1136/bmj.f976. PMID 23553977. S2CID 20385424.
- ^ a b c Gronowski AM (2004). «Human Pregnancy». Handbook of Clinical Laboratory Testing During Pregnancy. Humana Press. pp. 1–13. doi:10.1007/978-1-59259-787-1_1. ISBN 978-1-4684-9862-2.
- ^ «Alkaline Phosphatase Level Test (ALP)». Healthline. Retrieved 2017-05-15.
- ^ Kaplow LS (October 1955). «A histochemical procedure for localizing and evaluating leukocyte alkaline phosphatase activity in smears of blood and marrow» (PDF). Blood. 10 (10): 1023–9. doi:10.1182/blood.v10.10.1023.1023. PMID 13260361.
- ^ a b Schlesinger MJ, Barrett K (November 1965). «The reversible dissociation of the alkaline phosphatase of Escherichia coli. I. Formation and reactivation of subunits» (PDF). The Journal of Biological Chemistry. 240 (11): 4284–92. doi:10.1016/S0021-9258(18)97057-2. PMID 4954367.
- ^ Ninfa A (2010). Fundamental Laboratory Approaches for Biochemistry and Biotechnology. United States of America: John Wiley & Sons, INC. p. 230. ISBN 978-0-470-08766-4.
- ^ Rao NN, Torriani A (July 1990). «Molecular aspects of phosphate transport in Escherichia coli». Molecular Microbiology. 4 (7): 1083–90. doi:10.1111/j.1365-2958.1990.tb00682.x. PMID 1700257. S2CID 43220370.
- ^ Willsky GR, Bennett RL, Malamy MH (February 1973). «Inorganic phosphate transport in Escherichia coli: involvement of two genes which play a role in alkaline phosphatase regulation». Journal of Bacteriology. 113 (2): 529–39. doi:10.1128/JB.113.2.529-539.1973. PMC 285262. PMID 4570598.
- ^ Horiuchi T, Horiuchi S, Mizuno D (May 1959). «A possible negative feedback phenomenon controlling formation of alkaline phosphomonoesterase in Escherichia coli«. Nature. 183 (4674): 1529–30. Bibcode:1959Natur.183.1529H. doi:10.1038/1831529b0. PMID 13666805. S2CID 4294310.
- ^ a b Coleman JE (1992). «Structure and mechanism of alkaline phosphatase». Annual Review of Biophysics and Biomolecular Structure. 21: 441–83. doi:10.1146/annurev.bb.21.060192.002301. PMID 1525473. S2CID 34764597.
- ^ Ammerman JW, Azam F (March 1985). «Bacterial 5-nucleotidase in aquatic ecosystems: a novel mechanism of phosphorus regeneration». Science. 227 (4692): 1338–40. Bibcode:1985Sci…227.1338A. doi:10.1126/science.227.4692.1338. PMID 17793769. S2CID 24216177.
- ^ «p-Nitrophenyl Phosphate (PNPP)». New England Biolabs. Retrieved 2017-05-15.
- ^ Wanner BL, Latterell P (October 1980). «Mutants affected in alkaline phosphatase, expression: evidence for multiple positive regulators of the phosphate regulon in Escherichia coli». Genetics. 96 (2): 353–66. doi:10.1093/genetics/96.2.353. PMC 1214304. PMID 7021308.
- ^ Garen A, Levinthal C (March 1960). «A fine-structure genetic and chemical study of the enzyme alkaline phosphatase of E. coli. I. Purification and characterization of alkaline phosphatase». Biochimica et Biophysica Acta. 38: 470–83. doi:10.1016/0006-3002(60)91282-8. PMID 13826559.
- ^ Harada M, Udagawa N, Fukasawa K, Hiraoka BY, Mogi M (February 1986). «Inorganic pyrophosphatase activity of purified bovine pulp alkaline phosphatase at physiological pH». Journal of Dental Research. 65 (2): 125–7. doi:10.1177/00220345860650020601. PMID 3003174. S2CID 20508311.
- ^ Yeh MF, Trela JM (May 1976). «Purification and characterization of a repressible alkaline phosphatase from Thermus aquaticus» (PDF). The Journal of Biological Chemistry. 251 (10): 3134–9. doi:10.1016/S0021-9258(17)33509-3. PMID 5454.
- ^ Hehir MJ, Murphy JE, Kantrowitz ER (December 2000). «Characterization of heterodimeric alkaline phosphatases from Escherichia coli: an investigation of intragenic complementation». Journal of Molecular Biology. 304 (4): 645–56. doi:10.1006/jmbi.2000.4230. PMID 11099386.
- ^ Mandecki W, Shallcross MA, Sowadski J, Tomazic-Allen S (October 1991). «Mutagenesis of conserved residues within the active site of Escherichia coli alkaline phosphatase yields enzymes with increased kcat». Protein Engineering. 4 (7): 801–4. doi:10.1093/protein/4.7.801. PMID 1798702.
- ^ Maxam AM, Gilbert W (1980). Sequencing end-labeled DNA with base-specific chemical cleavages. Methods in Enzymology. Vol. 65. pp. 499–560. doi:10.1016/S0076-6879(80)65059-9. ISBN 978-0-12-181965-1. PMID 6246368.
- ^ Birkett DJ, Done J, Neale FC, Posen S (May 1966). «Serum alkaline phosphatase in pregnancy; an immunological study». British Medical Journal. 1 (5497): 1210–2. doi:10.1136/bmj.1.5497.1210. JSTOR 25407775. PMC 1845009. PMID 5933831.
- ^ Benham FJ, Harris H (August 1979). «Human cell lines expressing intestinal alkaline phosphatase». Proceedings of the National Academy of Sciences of the United States of America. 76 (8): 4016–9. Bibcode:1979PNAS…76.4016B. doi:10.1073/pnas.76.8.4016. JSTOR 69758. PMC 383967. PMID 291061.
- ^ Hua JC, Berger J, Pan YC, Hulmes JD, Udenfriend S (April 1986). «Partial sequencing of human adult, human fetal, and bovine intestinal alkaline phosphatases: comparison with the human placental and liver isozymes». Proceedings of the National Academy of Sciences of the United States of America. 83 (8): 2368–72. Bibcode:1986PNAS…83.2368H. doi:10.1073/pnas.83.8.2368. JSTOR 27284. PMC 323298. PMID 3458202.
- ^ «Appendix E: Stem Cell Markers». Stem Cell Information. National Institutes of Health, U.S. Department of Health and Human Services. Archived from the original on 2015-09-21. Retrieved 2013-09-24.
- ^ Szulc P, Seeman E, Delmas PD (2000). «Biochemical measurements of bone turnover in children and adolescents». Osteoporosis International. 11 (4): 281–94. doi:10.1007/s001980070116. PMID 10928217. S2CID 8223812.
- ^ Charnow JA, ed. (April 16, 2010). «Alkaline Phosphatase May Be a Marker of Inflammation in CKD Patients». Renal and Urology News.
- ^ Badve SV, Zhang L, Coombes JS, Pascoe EM, Cass A, Clarke P, Ferrari P, McDonald SP, Morrish AT, Pedagogos E, Perkovic V, Reidlinger D, Scaria A, Walker R, Vergara LA, Hawley CM, Johnson DW (2015). «Association between serum alkaline phosphatase and primary resistance to erythropoiesis stimulating agents in chronic kidney disease: a secondary analysis of the HERO trial». Canadian Journal of Kidney Health and Disease. 2: 33. doi:10.1186/s40697-015-0066-5. PMC 4538753. PMID 26284153.
- ^ Mizumori M, Ham M, Guth PH, Engel E, Kaunitz JD, Akiba Y (July 2009). «Intestinal alkaline phosphatase regulates protective surface microclimate pH in rat duodenum». The Journal of Physiology. 587 (Pt 14): 3651–63. doi:10.1113/jphysiol.2009.172270. PMC 2742288. PMID 19451200.
- ^ Wang W, Chen SW, Zhu J, Zuo S, Ma YY, Chen ZY, Zhang JL, Chen GW, Liu YC, Wang PY (2015). «Intestinal alkaline phosphatase inhibits the translocation of bacteria of gut-origin in mice with peritonitis: mechanism of action». PLOS ONE. 10 (5): e0124835. Bibcode:2015PLoSO..1024835W. doi:10.1371/journal.pone.0124835. PMC 4422672. PMID 25946026.
- ^ Kay H (1935). «Some Results of the Application of a Simple Test for Efficiency of Pasteurisation». The Lancet. 225 (5835): 1516–1518. doi:10.1016/S0140-6736(01)12532-8.
- ^ Hoy WA, Neave FK (1937). «The Phosphatase Test for Efficient Pasteurisation». The Lancet. 230 (5949): 595–598. doi:10.1016/S0140-6736(00)83378-4.
- ^ «BS EN ISO 11816-1:2013 — Milk and milk products. Determination of alkaline phosphatase activity. Fluorimetric method for milk and milk-based drinks». British Standards Institution (BSI). Retrieved 23 August 2016.
- ^ Aschaffenburg R, Mullen JE (1949). «A rapid and simple phosphatase test for milk». Journal of Dairy Research. 16 (1): 58–67. doi:10.1017/S0022029900005288. S2CID 85673728.
- ^ Sharma U, Pal D, Prasad R (July 2014). «Alkaline phosphatase: an overview». Indian Journal of Clinical Biochemistry. 29 (3): 269–78. doi:10.1007/s12291-013-0408-y. PMC 4062654. PMID 24966474.
- ^ Iqbal J (July 2011). «An enzyme immobilized microassay in capillary electrophoresis for characterization and inhibition studies of alkaline phosphatases». Analytical Biochemistry. 414 (2): 226–31. doi:10.1016/j.ab.2011.03.021. PMID 21439261.
- ^ Ganellin CR, Triggle DJ, eds. (1999). Dictionary of pharmacological agents (1st ed.). London: Chapman & Hall. ISBN 978-0-412-46630-4.
- ^ Tan X, Machmuller MB, Wang Z, Li X, He W, Cotrufo MF, Shen W (April 2018). «Temperature enhances the affinity of soil alkaline phosphatase to Cd». Chemosphere. 196: 214–222. Bibcode:2018Chmsp.196..214T. doi:10.1016/j.chemosphere.2017.12.170. PMID 29304459.
- ^ Reiss I, Inderrieden D, Kruse K (January 1996). «Bestimmung der knochenspezifischen alkalischen Phosphatase bei Störungen des Kalziumstoffwechsels im Kindesalter». Monatsschrift Kinderheilkunde. 144 (9): 885–890. doi:10.1007/s001120050054. S2CID 12764174.
- ^ a b Millán JL (June 2006). «Alkaline Phosphatases : Structure, substrate specificity and functional relatedness to other members of a large superfamily of enzymes». Purinergic Signalling. 2 (2): 335–41. doi:10.1007/s11302-005-5435-6. PMC 2254479. PMID 18404473.
- ^ Alam SN, Yammine H, Moaven O, Ahmed R, Moss AK, Biswas B, Muhammad N, Biswas R, Raychowdhury A, Kaliannan K, Ghosh S, Ray M, Hamarneh SR, Barua S, Malo NS, Bhan AK, Malo MS, Hodin RA (April 2014). «Intestinal alkaline phosphatase prevents antibiotic-induced susceptibility to enteric pathogens». Annals of Surgery. 259 (4): 715–22. doi:10.1097/sla.0b013e31828fae14. PMC 3855644. PMID 23598380.
- ^ Lallès JP (February 2014). «Intestinal alkaline phosphatase: novel functions and protective effects». Nutrition Reviews. 72 (2): 82–94. doi:10.1111/nure.12082. PMID 24506153.
- ^ Ghosh SS, Gehr TW, Ghosh S (December 2014). «Curcumin and chronic kidney disease (CKD): major mode of action through stimulating endogenous intestinal alkaline phosphatase». Molecules. 19 (12): 20139–56. doi:10.3390/molecules191220139. PMC 6271001. PMID 25474287.
- ^ Vaishnava S, Hooper LV (2007). «Alkaline phosphatase: keeping the peace at the gut epithelial surface». Cell Host & Microbe. 2 (6): 365–367. doi:10.1016/j.chom.2007.11.004. PMID 18078687.
- ^ a b c Bilski J, Mazur-Bialy A, Wojcik D, Zahradnik-Bilska J, Brzozowski B, Magierowski M, Mach T, Magierowska K, Brzozowski T (2017). «The Role of Intestinal Alkaline Phosphatase in Inflammatory Disorders of Gastrointestinal Tract». Mediators of Inflammation. 2017: 9074601. doi:10.1155/2017/9074601. PMC 5339520. PMID 28316376.
- ^ Molnár K, Vannay A, Szebeni B, Bánki NF, Sziksz E, Cseh A, Győrffy H, Lakatos PL, Papp M, Arató A, Veres G (July 2012). «Intestinal alkaline phosphatase in the colonic mucosa of children with inflammatory bowel disease». World Journal of Gastroenterology. 18 (25): 3254–9. doi:10.3748/wjg.v18.i25.3254 (inactive 31 December 2022). PMC 3391762. PMID 22783049.
{{cite journal}}: CS1 maint: DOI inactive as of December 2022 (link) - ^ Narisawa S, Huang L, Iwasaki A, Hasegawa H, Alpers DH, Millán JL (November 2003). «Accelerated fat absorption in intestinal alkaline phosphatase knockout mice». Molecular and Cellular Biology. 23 (21): 7525–30. doi:10.1128/mcb.23.21.7525-7530.2003. PMC 207564. PMID 14560000.
- ^ Akiba Y, Mizumori M, Guth PH, Engel E, Kaunitz JD (December 2007). «Duodenal brush border intestinal alkaline phosphatase activity affects bicarbonate secretion in rats». American Journal of Physiology. Gastrointestinal and Liver Physiology. 293 (6): G1223–33. doi:10.1152/ajpgi.00313.2007. PMID 17916646. S2CID 3091278.
- ^ Le-Vinh, B; Akkuş-Dağdeviren, ZB; Le, NMN; Nazir, I; Bernkop-Schnürch, A (2022). «Alkaline Phosphatase: A Reliable Endogenous Partner for Drug Delivery and Diagnostics». Adv. Therap. 5 (2): 2100219. doi:10.1002/adtp.202100219. S2CID 245865286.
- ^ Tantra, T; Singh, Y; Patekar, R; Kulkarni, S; Kumar, P; Thareja, S (2023). «Phosphate Prodrugs: An Approach to Improve the Bioavailability of Clinically Approved Drugs». Curr. Med. Chem. 30. doi:10.2174/0929867330666230209094738. PMID 36757029. S2CID 256697019.
- ^ Le, NN; Steinbring, C; Le-Vinh, B; Jalil, A; Matuszczak, B; Bernkop-Schnürch, A (2021). «Polyphosphate coatings: A promising strategy to overcome the polycation dilemma». J. Colloid Interface Sci. 587: 279–289. Bibcode:2021JCIS..587..279L. doi:10.1016/j.jcis.2020.12.019. PMID 33360901. S2CID 229694823.
- ^ Greene PJ, Sussman HH (October 1973). «Structural comparison of ectopic and normal placental alkaline phosphatase». Proceedings of the National Academy of Sciences of the United States of America. 70 (10): 2936–40. Bibcode:1973PNAS…70.2936G. doi:10.1073/pnas.70.10.2936. JSTOR 63137. PMC 427142. PMID 4517947.
- ^ a b Herz F, Schermer A, Halwer M, Bogart LH (September 1981). «Alkaline phosphatase in HT-29, a human colon cancer cell line: influence of sodium butyrate and hyperosmolality». Archives of Biochemistry and Biophysics. 210 (2): 581–91. doi:10.1016/0003-9861(81)90224-1. PMID 7305346.
- ^ Paskova L, Smesny Trtkova K, Fialova B, Benedikova A, Langova K, Kolar Z (August 2013). «Different effect of sodium butyrate on cancer and normal prostate cells». Toxicology in Vitro. 27 (5): 1489–95. doi:10.1016/j.tiv.2013.03.002. PMID 23524101.
- ^ Chou JY, Robinson JC (July 1977). «Induction of placental alkaline phosphatase in choriocarcinoma cells by 5-bromo-2′-deoxyuridine». In Vitro. 13 (7): 450–60. doi:10.1007/bf02615106. JSTOR 4291955. PMID 18400. S2CID 6726390.
- ^ «ALP isoenzyme test». MedlinePlus Medical Encyclopedia. U.S. National Library of Medicine.
- ^ «ALP: The Test — Alkaline Phosphatase». Lab Tests Online. American Association for Clinical Chemistry (AACC). Retrieved 23 August 2016.
- ^ a b Rao SR, Snaith AE, Marino D, Cheng X (2017). «Tumour-derived alkaline phosphatase regulates tumour growth, epithelial plasticity and disease-free survival in metastatic prostate cancer». British Journal of Cancer. 116 (2): 227–236. doi:10.1038/bjc.2016.402. PMC 5243990. PMID 28006818.
- ^ Pruessner HT (March 1998). «Detecting celiac disease in your patients». American Family Physician. 57 (5): 1023–34, 1039–41. PMID 9518950.
- ^ Vroon D (1990). «Alkaline Phosphatase and Gamma Glutamyltransferase». Clinical Methods: The History, Physical, and Laboratory Examinations. 3rd edition. Butterworths. ISBN 9780409900774. PMID 21250047.
- ^ «Alkaline phosphatase: Liver Function Test — Viral Hepatitis». www.hepatitis.va.gov. Retrieved 2016-05-02.
- ^ Delmas PD (December 1991). «What do we know about biochemical bone markers?». Bailliere’s Clinical Obstetrics and Gynaecology. 5 (4): 817–30. doi:10.1016/s0950-3552(05)80289-5. PMID 1822819. Retrieved 1 May 2016.
- ^ Lange PH, Millan JL, Stigbrand T, Vessella RL, Ruoslahti E, Fishman WH (August 1982). «Placental alkaline phosphatase as a tumor marker for seminoma». Cancer Research. 42 (8): 3244–7. PMID 7093962.
- ^ Dugdale DC. «ALP-bloodtest:MedlinePlus Medical Encyclopedia». MedlinePlus. Retrieved 2014-02-26.
- ^ Foucault P, Foucault MH, Kucharewicz B, Bureau F, Alix M, Drosdowsky MA (1991). «[Value of the study of total alkaline phosphatases and bone isoenzyme in a population of subjects with osteoporosis]». Annales de Biologie Clinique. 49 (9): 477–81. PMID 1789501.
- ^ McComb RB, Bowers GN, Posen S (1979). «Clinical Utilization of Alkaline Phosphatase Measurements». Alkaline Phosphatase. Springer US. pp. 525–786. doi:10.1007/978-1-4613-2970-1_9. ISBN 978-1-4613-2972-5.
- ^ Mueller MN, Kappas A (October 1964). «Estrogen pharmacology. I. The influence of estradiol and estriol on hepatic disposal of sulfobromophthalein (BSP) in man». J Clin Invest. 43 (10): 1905–14. doi:10.1172/JCI105064. PMC 289635. PMID 14236214.
- ^ Fukushima K, Kawai-Kowase K, Yonemoto Y, Fujiwara M, Sato H, Sato M, et al. (April 2019). «Adult hypophosphatasia with compound heterozygous p.Phe327Leu missense and c.1559delT frameshift mutations in tissue-nonspecific alkaline phosphatase gene: a case report». Journal of Medical Case Reports. 13 (1): 101. doi:10.1186/s13256-019-2045-4. PMC 6480864. PMID 31014398.
- ^ Schiele F, Vincent-Viry M, Fournier B, Starck M, Siest G (November 1998). «Biological effects of eleven combined oral contraceptives on serum triglycerides, γ-glutamyltransferase, alkaline phosphatase, bilirubin and other biochemical variables». Clinical Chemistry and Laboratory Medicine. 36 (11): 871–8. doi:10.1515/CCLM.1998.153. PMID 9877094. S2CID 23437978.
- ^ Robinson D, Sandblom G, Johansson R, Garmo H, Stattin P, Mommsen S, Varenhorst E (January 2008). «Prediction of survival of metastatic prostate cancer based on early serial measurements of prostate specific antigen and alkaline phosphatase». The Journal of Urology. 179 (1): 117–22, discussion 122–3. doi:10.1016/j.juro.2007.08.132. PMID 17997442.
- ^ Arceci RJ, Hann IM, Smith OP, eds. (2006). Pediatric hematology (3rd ed.). Wiley-Blackwell. p. 763. ISBN 978-1-4051-3400-2.
- ^ O’Brien PJ, Herschlag D (May 2001). «Functional interrelationships in the alkaline phosphatase superfamily: phosphodiesterase activity of Escherichia coli alkaline phosphatase». Biochemistry. 40 (19): 5691–9. CiteSeerX 10.1.1.322.8876. doi:10.1021/bi0028892. PMID 11341834.
Further reading[edit]
- Coleman JE (1992). «Structure and mechanism of alkaline phosphatase». Annual Review of Biophysics and Biomolecular Structure. 21: 441–83. doi:10.1146/annurev.bb.21.060192.002301. PMID 1525473. S2CID 34764597.
External links[edit]
- Alkaline phosphatase at Lab Tests Online
| Alkaline phosphatase | |||||||
|---|---|---|---|---|---|---|---|

Ribbon diagram (rainbow-color, N-terminus = blue, C-terminus = red) of the dimeric structure of bacterial alkaline phosphatase.[1] |
|||||||
| Identifiers | |||||||
| EC no. | 3.1.3.1 | ||||||
| CAS no. | 9001-78-9 | ||||||
| Databases | |||||||
| IntEnz | IntEnz view | ||||||
| BRENDA | BRENDA entry | ||||||
| ExPASy | NiceZyme view | ||||||
| KEGG | KEGG entry | ||||||
| MetaCyc | metabolic pathway | ||||||
| PRIAM | profile | ||||||
| PDB structures | RCSB PDB PDBe PDBsum | ||||||
| Gene Ontology | AmiGO / QuickGO | ||||||
|
| Alkaline phosphatase | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Structure of alkaline phosphatase.[1] |
|||||||||
| Identifiers | |||||||||
| Symbol | Alk_phosphatase | ||||||||
| Pfam | PF00245 | ||||||||
| InterPro | IPR001952 | ||||||||
| SMART | SM00098 | ||||||||
| PROSITE | PDOC00113 | ||||||||
| SCOP2 | 1alk / SCOPe / SUPFAM | ||||||||
|
The enzyme alkaline phosphatase (EC 3.1.3.1, alkaline phosphomonoesterase; phosphomonoesterase; glycerophosphatase; alkaline phosphohydrolase; alkaline phenyl phosphatase; orthophosphoric-monoester phosphohydrolase (alkaline optimum), systematic name phosphate-monoester phosphohydrolase (alkaline optimum))[2] catalyses the following reaction:
- a phosphate monoester + H2O = an alcohol + phosphate
Alkaline phosphatase has the physiological role of dephosphorylating compounds. The enzyme is found across a multitude of organisms, prokaryotes and eukaryotes alike, with the same general function but in different structural forms suitable to the environment they function in. Alkaline phosphatase is found in the periplasmic space of E. coli bacteria. This enzyme is heat stable and has its maximum activity at high pH. In humans, it is found in many forms depending on its origin within the body – it plays an integral role in metabolism within the liver and development within the skeleton. Due to its widespread prevalence in these areas, its concentration in the bloodstream is used by diagnosticians as a biomarker in helping determine diagnoses such as hepatitis or osteomalacia.[3]
The level of alkaline phosphatase in the blood is checked through the ALP test, which is often part of routine blood tests. The levels of this enzyme in the blood depend on factors such as age, sex, or blood type.[4] Blood levels of alkaline phosphatase also increase by two to four times during pregnancy. This is a result of additional alkaline phosphatase produced by the placenta and the liver.[5][6] Additionally, abnormal levels of alkaline phosphatase in the blood could indicate issues relating to the liver, gall bladder or bones. Kidney tumors and infections as well as malnutrition have also shown abnormal level of alkaline phosphatase in blood.[7] Alkaline phosphatase levels in a cell can be measured through a process called «The scoring method». A blood smear is usually taken and stained to categorize each leukocyte into specific «leukocyte alkaline phosphatase indices». This marker is designed to distinguish leukocytes and determine different enzyme activity from each sample’s extent of staining.[8]
Bacterial[edit]
In Gram-negative bacteria, such as Escherichia coli, alkaline phosphatase is located in the periplasmic space, external to the inner cell membrane and within the peptidoglycan portion of the cell wall. Since the periplasmic gap is more prone to environmental variation than the inner cell, alkaline phosphatase is suitably resistant to inactivation, denaturation, or degradation. This characteristic of the enzyme is uncommon to many other proteins.[9]
The precise structure and function of the isozyme in E. coli is solely geared to supply a source of inorganic phosphate when the environment lacks this metabolite. The inorganic phosphates are then bound to carrier proteins which deliver the inorganic phosphates to a specific high-affinity transport system, known as the phosphate-specific transport system (Pst system), which transports phosphate across the cytoplasmic membrane.[10]
While the outer membrane of E. coli contains porins that are permeable to phosphorylated compounds, the inner membrane does not. An issue arises in how to transport such compounds across the inner membrane and into the cytosol. The strong anionic charge of phosphate groups along with the remainder of the compound make phosphorylated compounds very much immiscible in the nonpolar region of the bilayer. The solution arises in cleaving the phosphate group away from the compound via ALP. The dephosphorylation reaction that ALP catalyzes yields pure inorganic phosphate, which can be ultimately targeted by the Pst system[11] for translocation into the cytosol,[12] with concomitant production of a dephosphorylated compound. As such, the main purpose of dephosphorylation by alkaline phosphatase is to increase the rate of diffusion of phosphorylated molecules into the cells while inhibiting them from diffusing out.[13]
Alkaline phosphatase is a zinc-containing dimeric enzyme with the MW: 86,000 Da, each subunit containing 429 amino acids with four cysteine residues linking the two subunits.[14] Alkaline phosphatase contains four Zn ions and two Mg ions, with Zn occupying active sites A and B, and Mg occupying site C, so the fully active native alkaline phosphatase is referred to as (ZnAZnBMgC)2 enzyme. The mechanism of action of alkaline phosphatase involves the geometric coordination of the substrate between the Zn ions in the active sites, whereas the Mg site doesn’t appear to be close enough to directly partake in the hydrolysis mechanism, however, it may contribute to the shape of the electrostatic potential around the active center.[14]
Alkaline phosphatase in E. coli is uncommonly soluble and active within elevated temperature conditions such as 80 °C. Due to the kinetic energy induced by this temperature the weak hydrogen bonds and hydrophobic interactions of common proteins become degraded and therefore coalesce and precipitate. However, upon dimerization of alkaline phosphatase the bonds maintaining its secondary and tertiary structures are effectively buried such that they are not affected as much at this temperature. Furthermore, even at more elevated temperatures such as 90 °C alkaline phosphatase has the unusual characteristic of reverse denaturation. Due to this, although it ultimately denatures at about 90 °C it has the added ability to accurately reform its bonds and return to its original structure and function once cooled back down.[9]
Alkaline phosphatase in E. coli is located in the periplasmic space and can thus be released using techniques that weaken the cell wall and release the protein. Due to the location of the enzyme, and the protein layout of the enzyme, the enzyme is in solution with a smaller amount of proteins than there are in another portion of the cell.
[15] The proteins’ heat stability can also be taken advantage of when isolating this enzyme (through heat denaturation). In addition, alkaline phosphatase can be assayed using p-Nitrophenyl phosphate. A reaction where alkaline phosphatase dephosphorylates the non-specific substrate, p-Nitrophenyl phosphate in order to produce p-Nitrophenol(PNP) and inorganic phosphate. PNP’s yellow color, and its λmax at 410 allows spectrophotometry to determine important information about enzymatic activity.[16] Some complexities of bacterial regulation and metabolism suggest that other, more subtle, purposes for the enzyme may also play a role for the cell. In the laboratory, however, mutant Escherichia coli lacking alkaline phosphatase survive quite well, as do mutants unable to shut off alkaline phosphatase production.[17]
The optimal pH for the activity of the E. coli enzyme is 8.0[18] while the bovine enzyme optimum pH is slightly higher at 8.5.[19] Alkaline phosphatase accounts for 6% of all proteins in derepressed cells.[20]
Intragenic complementation[edit]
When multiple copies of a polypeptide encoded by a gene form an aggregate, this protein structure is referred to as a multimer. When a multimer is formed from polypeptides produced by two different mutant alleles of a particular gene, the mixed multimer may exhibit greater functional activity than the unmixed multimers formed by each of the mutants alone. In such a case, the phenomenon is referred to as intragenic complementation. E. coli alkaline phosphatase, a dimer enzyme, exhibits intragenic complementation.[21] When particular mutant versions of alkaline phosphatase were combined, the heterodimeric enzymes formed as a result exhibited a higher level of activity than would be expected based on the relative activities of the parental enzymes. These findings indicated that the dimer structure of E.coli alkaline phosphatase allows cooperative interactions between the constituent monomers that can generate a more functional form of the holoenzyme.[citation needed]
Use in research[edit]
By changing the amino acids of the wild-type alkaline phosphatase enzyme produced by Escherichia coli, a mutant alkaline phosphatase is created which not only has a 36-fold increase in enzyme activity, but also retains thermal stability.[22] Typical uses in the lab for alkaline phosphatases include removing phosphate monoesters to prevent self-ligation, which is undesirable during plasmid DNA cloning.[23]
Common alkaline phosphatases used in research include:
- Shrimp alkaline phosphatase (SAP), from a species of Arctic shrimp (Pandalus borealis). This phosphatase is easily inactivated by heat, a useful feature in some applications.
- Calf-intestinal alkaline phosphatase (CIP)
- Placental alkaline phosphatase (PLAP) and its C terminally truncated version that lacks the last 24 amino acids (constituting the domain that targets for GPI membrane anchoring) – the secreted alkaline phosphatase (SEAP). It presents certain characteristics like heat stability, substrate specificity, and resistance to chemical inactivation.[24]
- Human-intestinal alkaline phosphatase. The human body has multiple types of alkaline phosphatase present, which are determined by a minimum of three gene loci. Each one of these three loci controls a different kind of alkaline phosphatase isozyme. However, the development of this enzyme can be strictly regulated by other factors such as thermostability, electrophoresis, inhibition, or immunology.[25]
Human-intestinal alkaline phosphatase shows around 80% homology with the bovine intestinal enzyme which holds true their shared evolutionary origins. That same bovine enzyme has more than 70% homology with human placental enzyme. However, the human intestinal enzyme and the placental enzyme only share 20% homology despite their structural similarities.[26]
Alkaline phosphatase has become a useful tool in molecular biology laboratories, since DNA normally possesses phosphate groups on the 5′ end. Removing these phosphates prevents the DNA from ligating (the 5′ end attaching to the 3′ end), thereby keeping DNA molecules linear until the next step of the process for which they are being prepared; also, removal of the phosphate groups allows radiolabeling (replacement by radioactive phosphate groups) in order to measure the presence of the labeled DNA through further steps in the process or experiment. For these purposes, the alkaline phosphatase from shrimp is the most useful, as it is the easiest to inactivate once it has done its job.[citation needed]
Another important use of alkaline phosphatase is as a label for enzyme immunoassays.[citation needed]
Undifferentiated pluripotent stem cells have elevated levels of alkaline phosphatase on their cell membrane, therefore alkaline phosphatase staining is used to detect these cells and to test pluripotency (i.e., embryonic stem cells or embryonal carcinoma cells).[27]
There is a positive correlation between serum bone alkaline phosphatase levels and bone formation in humans, although its use as a biomarker in clinical practice is not recommended.[28]
Ongoing research[edit]
Current researchers are looking into the increase of tumor necrosis factor-α and its direct effect on the expression of alkaline phosphatase in vascular smooth muscle cells as well as how alkaline phosphatase (AP) affects the inflammatory responses and may play a direct role in preventing organ damage.[29]
- Alkaline phosphatase (AP) affects the inflammatory responses in patients with Chronic kidney disease and is directly associated with Erythropoiesis stimulating agent resistant anemia.[30]
- Intestinal alkaline phosphatase (IAP) and the mechanism it uses to regulate pH and ATP hydrolysis in rat duodenum.[31]
- Testing the effectiveness of the inhibitor and its impact on IAP in acute intestinal inflammation as well as explore the molecular mechanisms of IAP in «ameliorating intestinal permeability.»[32]
Dairy industry[edit]
Alkaline phosphatase is commonly used in the dairy industry as an indicator of successful pasteurization. This is because the most heat stable bacterium found in milk, Mycobacterium paratuberculosis, is destroyed by temperatures lower than those required to denature the enzyme. Therefore, its presence is ideal for indicating failed pasteurization.[33][34]
Pasteurization verification is typically performed by measuring the fluorescence of a solution which becomes fluorescent when exposed to active alkaline phosphatase. Fluorimetry assays are required by milk producers in the UK to prove alkaline phosphatase has been denatured,[35] as p-Nitrophenylphosphate tests are not considered accurate enough to meet health standards.
Alternatively the colour change of p-nitrophenylphosphate as substrate in a buffered solution (Aschaffenburg Mullen Test) can be used.[36] Raw milk would typically produce a yellow coloration within a couple of minutes, whereas properly pasteurised milk should show no change. There are exceptions to this, as in the case of heat-stable alkaline phosphatases produced by some bacteria, but these bacteria should not be present in milk.[citation needed]
Inhibitors[edit]
All mammalian alkaline phosphatase isoenzymes except placental (PALP and SEAP) are inhibited by homoarginine, and, in similar manner, all except the intestinal and placental ones are blocked by levamisole.[37] Phosphate is another inhibitor which competitively inhibits alkaline phosphatase.[38]
Another known example of an alkaline phosphatase inhibitor is [(4-Nitrophenyl)methyl]phosphonic acid.[39]
In metal contaminated soil, alkaline phosphatase are inhibited by Cd (Cadmium). In addition, temperature enhances the inhibition of Cd on the enzyme activity, which is shown in the increasing values of Km.[40]
Human[edit]
Physiology[edit]
In humans, alkaline phosphatase is present in all tissues throughout the body, but is particularly concentrated in the liver, bile duct, kidney, bone, intestinal mucosa and placenta. In the serum, two types of alkaline phosphatase isozymes predominate: skeletal and liver. During childhood the majority of alkaline phosphatase are of skeletal origin.[41] Humans and most other mammals contain the following alkaline phosphatase isozymes:[citation needed]
- ALPI – intestinal (molecular mass of 150 kDa)
- ALPL – tissue-nonspecific (expressed mainly in liver, bone, and kidney)
- ALPP – placental (Regan isozyme)
- ALPG – germ cell
Four genes encode the four isozymes. The gene for tissue-nonspecific alkaline phosphatase is located on chromosome 1, and the genes for the other three isoforms are located on chromosome 2.[42]
Intestinal alkaline phosphatase[edit]
Intestinal alkaline phosphatase is secreted by enterocytes, and seems to play a pivotal role in intestinal homeostasis and protection[43][44] as well as in suppressing inflammation[45] via repression of the downstream Toll-like receptor (TLR)-4-dependent and MyD88-dependent inflammatory cascade.[46] It dephosphorylates toxic/inflammatory microbial ligands like lipopolysaccharides (LPSs),[47] unmethylated cytosine-guanine dinucleotides, flagellin, and extracellular nucleotides such as uridine diphosphate or ATP. Dephosphorylation of LPS by IAP can reduce the severity of Salmonella tryphimurium and Clostridioides difficile infection restoring normal gut microbiota.[47] Thus, altered IAP expression has been implicated in chronic inflammatory diseases such as inflammatory bowel disease (IBD).[47][48] It also seems to regulate lipid absorption[49] and bicarbonate secretion[50] in the duodenal mucosa, which regulates the surface pH. Since the 1960s intestinal alkaline phosphatase has been utilized in drug delivery. As it cleaves phosphate substructures from drugs, auxiliary agents, and even from the surface of nanocarriers, this enzyme enables the design of drug delivery systems that can alter their properties in the body on demand.[51] The solubility of many drugs can be substantially improved by the design of phosphate prodrugs. On the intestinal mucosa the phosphate substructures are cleaved off by alkaline phosphatase and the drug is absorbed.[52] Furthermore, anionic nanocarriers exhibiting bioinert properties can alter their surface to interactive once having reached the intestinal epithelium as due to an alkaline phosphatase triggered cleavage of anionic phosphate groups from their surface charge converts to cationic improving for instance cellular uptake.[53]
In cancer cells[edit]
Studies show that the alkaline phosphatase protein found in cancer cells is similar to that found in nonmalignant body tissues and that the protein originates from the same gene in both. One study compared the enzymes of liver metastases of giant-cell lung carcinoma and nonmalignant placental cells. The two were similar in NH2-terminal sequence, peptide map, subunit molecular weight, and isoelectronic point.[54]
In a different study in which scientists examined alkaline phosphatase protein presence in a human colon cancer cell line, also known as HT-29, results showed that the enzyme activity was similar to that of the non-malignant intestinal type. However, this study revealed that without the influence of sodium butyrate, alkaline phosphatase activity is fairly low in cancer cells.[55] A study based on sodium butyrate effects on cancer cells conveys that it has an effect on androgen receptor co-regulator expression, transcription activity, and also on histone acetylation in cancer cells.[56] This explains why the addition of sodium butyrate show increased activity of alkaline phosphatase in the cancer cells of the human colon.[55] In addition, this further supports the theory that alkaline phosphatase enzyme activity is actually present in cancer cells.[citation needed]
In another study, choriocarcinoma cells were grown in the presence of 5-bromo-2′-deoxyuridine and results conveyed a 30- to 40-fold increase in alkaline phosphatase activity. This procedure of enhancing the activity of the enzyme is known as enzyme induction. The evidence shows that there is in fact activity of alkaline phosphatase in tumor cells, but it is minimal and needs to be enhanced. Results from this study further indicate that activities of this enzyme vary among the different choriocarcinoma cell lines and that the activity of the alkaline phosphatase protein in these cells is lower than in the non-malignant placenta cells.[57][58] but levels are significantly higher in children and pregnant women. Blood tests should always be interpreted using the reference range from the laboratory that performed the test. High alkaline phosphatase levels can occur if the bile ducts are obstructed.[59]
Also, the level of alkaline phosphatase increases if there is active bone formation occurring, as the enzyme is a byproduct of osteoblast activity (such as the case in Paget’s disease of bone).[citation needed]
The level of alkaline phosphatase is much more elevated in metastatic prostate cancer cells than non-metastatic prostate cancer cells.[60] High levels of ALP in prostate cancer patients is associated with a significant decrease in survival.[60]
Levels are also elevated in people with untreated coeliac disease.[61] Lowered levels of the level of alkaline phosphatase are less common than elevated levels. The source of elevated levels can be deduced by obtaining serum levels of γ-glutamyltransferase. Concomitant increases of alkaline phosphatase with γ-glutamyltransferase should raise the suspicion of hepatobiliary disease.[62]
Some diseases do not affect the levels of alkaline phosphatase, for example, hepatitis C. A high level of this enzyme does not reflect any damage in the liver, even though high alkaline phosphatase levels may result from a blockage of flow in the biliary tract or an increase in the pressure of the liver.[63]
Elevated levels[edit]
If it is unclear why the level of alkaline phosphatase is elevated, isoenzyme studies using electrophoresis can confirm the source of the increase. Skelphosphatase (which is localized in osteoblasts and extracellular layers of newly synthesized matrix) is released into circulation by a yet unclear mechanism.[64] Placental alkaline phosphatase is elevated in seminomas[65] and active forms of rickets, as well as in the following diseases and conditions:[66]
- Biliary obstruction
- Bone conditions
- Osteoblastic bone tumors
- Osteomalacia
- Osteoporosis[67]
- Hepatitis
- Cirrhosis
- Acute cholecystitis
- Myelofibrosis
- Leukemoid reaction
- Lymphoma
- Paget’s disease
- Sarcoidosis
- Hyperthyroidism
- Hyperparathyroidism
- Myocardial infarction
- Pregnancy[6]
- Very high doses of estrogens[6][68][69]
Lowered levels[edit]
The following conditions or diseases may lead to reduced levels of alkaline phosphatase:[70]
- Hypophosphatasia, a genetic disorder
- Women receiving estrogen therapy for menopausal symptoms[citation needed]
- Estrogen-containing oral contraceptives[71]
- Men with recent heart surgery, malnutrition, magnesium deficiency, or severe anemia
- Children with achondroplasia and congenital iodine deficiency
- Children after a severe episode of enteritis
- Pernicious anemia
- Aplastic anemia
- Wilson’s disease
- Hypothyroidism
- Zinc deficiency
- Malnutrition
- Steroid treatment
- Colitis
Prognostic uses[edit]
Measuring alkaline phosphatase (along with prostate specific antigen) during, and after six months of hormone treated metastatic prostate cancer was shown to predict the survival of patients.[72]
Leukocyte alkaline phosphatase[edit]
Leukocyte alkaline phosphatase is found within mature white blood cells. White blood cell levels of LAP can help in the diagnosis of certain conditions.[citation needed]
- Higher than typical levels are seen in the physiological response, the leukemoid reaction, and in pathologies that include mature white blood cells, such as polycythemia vera, essential thrombocytosis, and in primary myelofibrosis.
- Lower than typical levels are found in pathologies that involve undeveloped leukocytes, such as chronic myelogenous leukemia[73] (CML), paroxysmal nocturnal hemoglobinuria and acute myelogenous leukaemia.
Structure and properties[edit]
Alkaline phosphatase is homodimeric enzyme, meaning it is formed with two molecules. Three metal ions, two Zn and one Mg, are contained in the catalytic sites, and both types are crucial for enzymatic activity to occur. The enzymes catalyze the hydrolysis of monoesters in phosphoric acid which can additionally catalyze a transphosphorylation reaction with large concentrations of phosphate acceptors. While the main features of the catalytic mechanism and activity are conserved between mammalian and bacterial alkaline phosphate, mammalian alkaline phosphatase has a higher specific activity and Km values thus a lower affinity, more alkaline pH optimum, lower heat stability, and are typically membrane bound and are inhibited by l-amino acids and peptides via a means of uncompetitive mechanism. These properties noticeably differ between different mammalian alkaline phosphatase isozymes and therefore showcase a difference in in vivo functions.[citation needed]
Alkaline phosphatase has homology in a large number of other enzymes and composes part of a superfamily of enzymes with several overlapping catalytic aspects and substrate traits. This explains why most salient structural features of mammalian alkaline are the way they are and reference their substrate specificity and homology to other members of the nucleoside pyrophosphatase/phosphodiesterase family of isozyme.[42] Research has shown a relationship between members of the alkaline phosphatase family with aryl sulfatases. The similarities in structure indicate that these two enzyme families came from a common ancestor. Further analysis has linked alkaline phosphates and aryl sulfatases to a larger superfamily. Some of the common genes found in this superfamily, are ones that encode phosphodiesterases as well as autotoxin.[74]
See also[edit]
- Acid phosphatase
- Liver function tests
References[edit]
- ^ a b PDB: 1ALK: Kim EE, Wyckoff HW (March 1991). «Reaction mechanism of alkaline phosphatase based on crystal structures. Two-metal ion catalysis». Journal of Molecular Biology. 218 (2): 449–64. doi:10.1016/0022-2836(91)90724-K. PMID 2010919.
- ^ Tamás L, Huttová J, Mistrk I, Kogan G (2002). «Effect of Carboxymethyl Chitin-Glucan on the Activity of Some Hydrolytic Enzymes in Maize Plants» (PDF). Chem. Pap. 56 (5): 326–329. Archived from the original (PDF) on 2011-07-25. Retrieved 2009-04-28.
- ^ «Alkaline Phosphatase Level Test (ALP)». Healthline. Retrieved 2017-05-07.
- ^ Dhruv L, Savio J (22 October 2017). «Alkaline Phosphatase». StatPearls. StatPearls. PMID 29083622.
- ^ Shipman KE, Holt AD, Gama R (April 2013). «Interpreting an isolated raised serum alkaline phosphatase level in an asymptomatic patient». BMJ. 346: f976. doi:10.1136/bmj.f976. PMID 23553977. S2CID 20385424.
- ^ a b c Gronowski AM (2004). «Human Pregnancy». Handbook of Clinical Laboratory Testing During Pregnancy. Humana Press. pp. 1–13. doi:10.1007/978-1-59259-787-1_1. ISBN 978-1-4684-9862-2.
- ^ «Alkaline Phosphatase Level Test (ALP)». Healthline. Retrieved 2017-05-15.
- ^ Kaplow LS (October 1955). «A histochemical procedure for localizing and evaluating leukocyte alkaline phosphatase activity in smears of blood and marrow» (PDF). Blood. 10 (10): 1023–9. doi:10.1182/blood.v10.10.1023.1023. PMID 13260361.
- ^ a b Schlesinger MJ, Barrett K (November 1965). «The reversible dissociation of the alkaline phosphatase of Escherichia coli. I. Formation and reactivation of subunits» (PDF). The Journal of Biological Chemistry. 240 (11): 4284–92. doi:10.1016/S0021-9258(18)97057-2. PMID 4954367.
- ^ Ninfa A (2010). Fundamental Laboratory Approaches for Biochemistry and Biotechnology. United States of America: John Wiley & Sons, INC. p. 230. ISBN 978-0-470-08766-4.
- ^ Rao NN, Torriani A (July 1990). «Molecular aspects of phosphate transport in Escherichia coli». Molecular Microbiology. 4 (7): 1083–90. doi:10.1111/j.1365-2958.1990.tb00682.x. PMID 1700257. S2CID 43220370.
- ^ Willsky GR, Bennett RL, Malamy MH (February 1973). «Inorganic phosphate transport in Escherichia coli: involvement of two genes which play a role in alkaline phosphatase regulation». Journal of Bacteriology. 113 (2): 529–39. doi:10.1128/JB.113.2.529-539.1973. PMC 285262. PMID 4570598.
- ^ Horiuchi T, Horiuchi S, Mizuno D (May 1959). «A possible negative feedback phenomenon controlling formation of alkaline phosphomonoesterase in Escherichia coli«. Nature. 183 (4674): 1529–30. Bibcode:1959Natur.183.1529H. doi:10.1038/1831529b0. PMID 13666805. S2CID 4294310.
- ^ a b Coleman JE (1992). «Structure and mechanism of alkaline phosphatase». Annual Review of Biophysics and Biomolecular Structure. 21: 441–83. doi:10.1146/annurev.bb.21.060192.002301. PMID 1525473. S2CID 34764597.
- ^ Ammerman JW, Azam F (March 1985). «Bacterial 5-nucleotidase in aquatic ecosystems: a novel mechanism of phosphorus regeneration». Science. 227 (4692): 1338–40. Bibcode:1985Sci…227.1338A. doi:10.1126/science.227.4692.1338. PMID 17793769. S2CID 24216177.
- ^ «p-Nitrophenyl Phosphate (PNPP)». New England Biolabs. Retrieved 2017-05-15.
- ^ Wanner BL, Latterell P (October 1980). «Mutants affected in alkaline phosphatase, expression: evidence for multiple positive regulators of the phosphate regulon in Escherichia coli». Genetics. 96 (2): 353–66. doi:10.1093/genetics/96.2.353. PMC 1214304. PMID 7021308.
- ^ Garen A, Levinthal C (March 1960). «A fine-structure genetic and chemical study of the enzyme alkaline phosphatase of E. coli. I. Purification and characterization of alkaline phosphatase». Biochimica et Biophysica Acta. 38: 470–83. doi:10.1016/0006-3002(60)91282-8. PMID 13826559.
- ^ Harada M, Udagawa N, Fukasawa K, Hiraoka BY, Mogi M (February 1986). «Inorganic pyrophosphatase activity of purified bovine pulp alkaline phosphatase at physiological pH». Journal of Dental Research. 65 (2): 125–7. doi:10.1177/00220345860650020601. PMID 3003174. S2CID 20508311.
- ^ Yeh MF, Trela JM (May 1976). «Purification and characterization of a repressible alkaline phosphatase from Thermus aquaticus» (PDF). The Journal of Biological Chemistry. 251 (10): 3134–9. doi:10.1016/S0021-9258(17)33509-3. PMID 5454.
- ^ Hehir MJ, Murphy JE, Kantrowitz ER (December 2000). «Characterization of heterodimeric alkaline phosphatases from Escherichia coli: an investigation of intragenic complementation». Journal of Molecular Biology. 304 (4): 645–56. doi:10.1006/jmbi.2000.4230. PMID 11099386.
- ^ Mandecki W, Shallcross MA, Sowadski J, Tomazic-Allen S (October 1991). «Mutagenesis of conserved residues within the active site of Escherichia coli alkaline phosphatase yields enzymes with increased kcat». Protein Engineering. 4 (7): 801–4. doi:10.1093/protein/4.7.801. PMID 1798702.
- ^ Maxam AM, Gilbert W (1980). Sequencing end-labeled DNA with base-specific chemical cleavages. Methods in Enzymology. Vol. 65. pp. 499–560. doi:10.1016/S0076-6879(80)65059-9. ISBN 978-0-12-181965-1. PMID 6246368.
- ^ Birkett DJ, Done J, Neale FC, Posen S (May 1966). «Serum alkaline phosphatase in pregnancy; an immunological study». British Medical Journal. 1 (5497): 1210–2. doi:10.1136/bmj.1.5497.1210. JSTOR 25407775. PMC 1845009. PMID 5933831.
- ^ Benham FJ, Harris H (August 1979). «Human cell lines expressing intestinal alkaline phosphatase». Proceedings of the National Academy of Sciences of the United States of America. 76 (8): 4016–9. Bibcode:1979PNAS…76.4016B. doi:10.1073/pnas.76.8.4016. JSTOR 69758. PMC 383967. PMID 291061.
- ^ Hua JC, Berger J, Pan YC, Hulmes JD, Udenfriend S (April 1986). «Partial sequencing of human adult, human fetal, and bovine intestinal alkaline phosphatases: comparison with the human placental and liver isozymes». Proceedings of the National Academy of Sciences of the United States of America. 83 (8): 2368–72. Bibcode:1986PNAS…83.2368H. doi:10.1073/pnas.83.8.2368. JSTOR 27284. PMC 323298. PMID 3458202.
- ^ «Appendix E: Stem Cell Markers». Stem Cell Information. National Institutes of Health, U.S. Department of Health and Human Services. Archived from the original on 2015-09-21. Retrieved 2013-09-24.
- ^ Szulc P, Seeman E, Delmas PD (2000). «Biochemical measurements of bone turnover in children and adolescents». Osteoporosis International. 11 (4): 281–94. doi:10.1007/s001980070116. PMID 10928217. S2CID 8223812.
- ^ Charnow JA, ed. (April 16, 2010). «Alkaline Phosphatase May Be a Marker of Inflammation in CKD Patients». Renal and Urology News.
- ^ Badve SV, Zhang L, Coombes JS, Pascoe EM, Cass A, Clarke P, Ferrari P, McDonald SP, Morrish AT, Pedagogos E, Perkovic V, Reidlinger D, Scaria A, Walker R, Vergara LA, Hawley CM, Johnson DW (2015). «Association between serum alkaline phosphatase and primary resistance to erythropoiesis stimulating agents in chronic kidney disease: a secondary analysis of the HERO trial». Canadian Journal of Kidney Health and Disease. 2: 33. doi:10.1186/s40697-015-0066-5. PMC 4538753. PMID 26284153.
- ^ Mizumori M, Ham M, Guth PH, Engel E, Kaunitz JD, Akiba Y (July 2009). «Intestinal alkaline phosphatase regulates protective surface microclimate pH in rat duodenum». The Journal of Physiology. 587 (Pt 14): 3651–63. doi:10.1113/jphysiol.2009.172270. PMC 2742288. PMID 19451200.
- ^ Wang W, Chen SW, Zhu J, Zuo S, Ma YY, Chen ZY, Zhang JL, Chen GW, Liu YC, Wang PY (2015). «Intestinal alkaline phosphatase inhibits the translocation of bacteria of gut-origin in mice with peritonitis: mechanism of action». PLOS ONE. 10 (5): e0124835. Bibcode:2015PLoSO..1024835W. doi:10.1371/journal.pone.0124835. PMC 4422672. PMID 25946026.
- ^ Kay H (1935). «Some Results of the Application of a Simple Test for Efficiency of Pasteurisation». The Lancet. 225 (5835): 1516–1518. doi:10.1016/S0140-6736(01)12532-8.
- ^ Hoy WA, Neave FK (1937). «The Phosphatase Test for Efficient Pasteurisation». The Lancet. 230 (5949): 595–598. doi:10.1016/S0140-6736(00)83378-4.
- ^ «BS EN ISO 11816-1:2013 — Milk and milk products. Determination of alkaline phosphatase activity. Fluorimetric method for milk and milk-based drinks». British Standards Institution (BSI). Retrieved 23 August 2016.
- ^ Aschaffenburg R, Mullen JE (1949). «A rapid and simple phosphatase test for milk». Journal of Dairy Research. 16 (1): 58–67. doi:10.1017/S0022029900005288. S2CID 85673728.
- ^ Sharma U, Pal D, Prasad R (July 2014). «Alkaline phosphatase: an overview». Indian Journal of Clinical Biochemistry. 29 (3): 269–78. doi:10.1007/s12291-013-0408-y. PMC 4062654. PMID 24966474.
- ^ Iqbal J (July 2011). «An enzyme immobilized microassay in capillary electrophoresis for characterization and inhibition studies of alkaline phosphatases». Analytical Biochemistry. 414 (2): 226–31. doi:10.1016/j.ab.2011.03.021. PMID 21439261.
- ^ Ganellin CR, Triggle DJ, eds. (1999). Dictionary of pharmacological agents (1st ed.). London: Chapman & Hall. ISBN 978-0-412-46630-4.
- ^ Tan X, Machmuller MB, Wang Z, Li X, He W, Cotrufo MF, Shen W (April 2018). «Temperature enhances the affinity of soil alkaline phosphatase to Cd». Chemosphere. 196: 214–222. Bibcode:2018Chmsp.196..214T. doi:10.1016/j.chemosphere.2017.12.170. PMID 29304459.
- ^ Reiss I, Inderrieden D, Kruse K (January 1996). «Bestimmung der knochenspezifischen alkalischen Phosphatase bei Störungen des Kalziumstoffwechsels im Kindesalter». Monatsschrift Kinderheilkunde. 144 (9): 885–890. doi:10.1007/s001120050054. S2CID 12764174.
- ^ a b Millán JL (June 2006). «Alkaline Phosphatases : Structure, substrate specificity and functional relatedness to other members of a large superfamily of enzymes». Purinergic Signalling. 2 (2): 335–41. doi:10.1007/s11302-005-5435-6. PMC 2254479. PMID 18404473.
- ^ Alam SN, Yammine H, Moaven O, Ahmed R, Moss AK, Biswas B, Muhammad N, Biswas R, Raychowdhury A, Kaliannan K, Ghosh S, Ray M, Hamarneh SR, Barua S, Malo NS, Bhan AK, Malo MS, Hodin RA (April 2014). «Intestinal alkaline phosphatase prevents antibiotic-induced susceptibility to enteric pathogens». Annals of Surgery. 259 (4): 715–22. doi:10.1097/sla.0b013e31828fae14. PMC 3855644. PMID 23598380.
- ^ Lallès JP (February 2014). «Intestinal alkaline phosphatase: novel functions and protective effects». Nutrition Reviews. 72 (2): 82–94. doi:10.1111/nure.12082. PMID 24506153.
- ^ Ghosh SS, Gehr TW, Ghosh S (December 2014). «Curcumin and chronic kidney disease (CKD): major mode of action through stimulating endogenous intestinal alkaline phosphatase». Molecules. 19 (12): 20139–56. doi:10.3390/molecules191220139. PMC 6271001. PMID 25474287.
- ^ Vaishnava S, Hooper LV (2007). «Alkaline phosphatase: keeping the peace at the gut epithelial surface». Cell Host & Microbe. 2 (6): 365–367. doi:10.1016/j.chom.2007.11.004. PMID 18078687.
- ^ a b c Bilski J, Mazur-Bialy A, Wojcik D, Zahradnik-Bilska J, Brzozowski B, Magierowski M, Mach T, Magierowska K, Brzozowski T (2017). «The Role of Intestinal Alkaline Phosphatase in Inflammatory Disorders of Gastrointestinal Tract». Mediators of Inflammation. 2017: 9074601. doi:10.1155/2017/9074601. PMC 5339520. PMID 28316376.
- ^ Molnár K, Vannay A, Szebeni B, Bánki NF, Sziksz E, Cseh A, Győrffy H, Lakatos PL, Papp M, Arató A, Veres G (July 2012). «Intestinal alkaline phosphatase in the colonic mucosa of children with inflammatory bowel disease». World Journal of Gastroenterology. 18 (25): 3254–9. doi:10.3748/wjg.v18.i25.3254 (inactive 31 December 2022). PMC 3391762. PMID 22783049.
{{cite journal}}: CS1 maint: DOI inactive as of December 2022 (link) - ^ Narisawa S, Huang L, Iwasaki A, Hasegawa H, Alpers DH, Millán JL (November 2003). «Accelerated fat absorption in intestinal alkaline phosphatase knockout mice». Molecular and Cellular Biology. 23 (21): 7525–30. doi:10.1128/mcb.23.21.7525-7530.2003. PMC 207564. PMID 14560000.
- ^ Akiba Y, Mizumori M, Guth PH, Engel E, Kaunitz JD (December 2007). «Duodenal brush border intestinal alkaline phosphatase activity affects bicarbonate secretion in rats». American Journal of Physiology. Gastrointestinal and Liver Physiology. 293 (6): G1223–33. doi:10.1152/ajpgi.00313.2007. PMID 17916646. S2CID 3091278.
- ^ Le-Vinh, B; Akkuş-Dağdeviren, ZB; Le, NMN; Nazir, I; Bernkop-Schnürch, A (2022). «Alkaline Phosphatase: A Reliable Endogenous Partner for Drug Delivery and Diagnostics». Adv. Therap. 5 (2): 2100219. doi:10.1002/adtp.202100219. S2CID 245865286.
- ^ Tantra, T; Singh, Y; Patekar, R; Kulkarni, S; Kumar, P; Thareja, S (2023). «Phosphate Prodrugs: An Approach to Improve the Bioavailability of Clinically Approved Drugs». Curr. Med. Chem. 30. doi:10.2174/0929867330666230209094738. PMID 36757029. S2CID 256697019.
- ^ Le, NN; Steinbring, C; Le-Vinh, B; Jalil, A; Matuszczak, B; Bernkop-Schnürch, A (2021). «Polyphosphate coatings: A promising strategy to overcome the polycation dilemma». J. Colloid Interface Sci. 587: 279–289. Bibcode:2021JCIS..587..279L. doi:10.1016/j.jcis.2020.12.019. PMID 33360901. S2CID 229694823.
- ^ Greene PJ, Sussman HH (October 1973). «Structural comparison of ectopic and normal placental alkaline phosphatase». Proceedings of the National Academy of Sciences of the United States of America. 70 (10): 2936–40. Bibcode:1973PNAS…70.2936G. doi:10.1073/pnas.70.10.2936. JSTOR 63137. PMC 427142. PMID 4517947.
- ^ a b Herz F, Schermer A, Halwer M, Bogart LH (September 1981). «Alkaline phosphatase in HT-29, a human colon cancer cell line: influence of sodium butyrate and hyperosmolality». Archives of Biochemistry and Biophysics. 210 (2): 581–91. doi:10.1016/0003-9861(81)90224-1. PMID 7305346.
- ^ Paskova L, Smesny Trtkova K, Fialova B, Benedikova A, Langova K, Kolar Z (August 2013). «Different effect of sodium butyrate on cancer and normal prostate cells». Toxicology in Vitro. 27 (5): 1489–95. doi:10.1016/j.tiv.2013.03.002. PMID 23524101.
- ^ Chou JY, Robinson JC (July 1977). «Induction of placental alkaline phosphatase in choriocarcinoma cells by 5-bromo-2′-deoxyuridine». In Vitro. 13 (7): 450–60. doi:10.1007/bf02615106. JSTOR 4291955. PMID 18400. S2CID 6726390.
- ^ «ALP isoenzyme test». MedlinePlus Medical Encyclopedia. U.S. National Library of Medicine.
- ^ «ALP: The Test — Alkaline Phosphatase». Lab Tests Online. American Association for Clinical Chemistry (AACC). Retrieved 23 August 2016.
- ^ a b Rao SR, Snaith AE, Marino D, Cheng X (2017). «Tumour-derived alkaline phosphatase regulates tumour growth, epithelial plasticity and disease-free survival in metastatic prostate cancer». British Journal of Cancer. 116 (2): 227–236. doi:10.1038/bjc.2016.402. PMC 5243990. PMID 28006818.
- ^ Pruessner HT (March 1998). «Detecting celiac disease in your patients». American Family Physician. 57 (5): 1023–34, 1039–41. PMID 9518950.
- ^ Vroon D (1990). «Alkaline Phosphatase and Gamma Glutamyltransferase». Clinical Methods: The History, Physical, and Laboratory Examinations. 3rd edition. Butterworths. ISBN 9780409900774. PMID 21250047.
- ^ «Alkaline phosphatase: Liver Function Test — Viral Hepatitis». www.hepatitis.va.gov. Retrieved 2016-05-02.
- ^ Delmas PD (December 1991). «What do we know about biochemical bone markers?». Bailliere’s Clinical Obstetrics and Gynaecology. 5 (4): 817–30. doi:10.1016/s0950-3552(05)80289-5. PMID 1822819. Retrieved 1 May 2016.
- ^ Lange PH, Millan JL, Stigbrand T, Vessella RL, Ruoslahti E, Fishman WH (August 1982). «Placental alkaline phosphatase as a tumor marker for seminoma». Cancer Research. 42 (8): 3244–7. PMID 7093962.
- ^ Dugdale DC. «ALP-bloodtest:MedlinePlus Medical Encyclopedia». MedlinePlus. Retrieved 2014-02-26.
- ^ Foucault P, Foucault MH, Kucharewicz B, Bureau F, Alix M, Drosdowsky MA (1991). «[Value of the study of total alkaline phosphatases and bone isoenzyme in a population of subjects with osteoporosis]». Annales de Biologie Clinique. 49 (9): 477–81. PMID 1789501.
- ^ McComb RB, Bowers GN, Posen S (1979). «Clinical Utilization of Alkaline Phosphatase Measurements». Alkaline Phosphatase. Springer US. pp. 525–786. doi:10.1007/978-1-4613-2970-1_9. ISBN 978-1-4613-2972-5.
- ^ Mueller MN, Kappas A (October 1964). «Estrogen pharmacology. I. The influence of estradiol and estriol on hepatic disposal of sulfobromophthalein (BSP) in man». J Clin Invest. 43 (10): 1905–14. doi:10.1172/JCI105064. PMC 289635. PMID 14236214.
- ^ Fukushima K, Kawai-Kowase K, Yonemoto Y, Fujiwara M, Sato H, Sato M, et al. (April 2019). «Adult hypophosphatasia with compound heterozygous p.Phe327Leu missense and c.1559delT frameshift mutations in tissue-nonspecific alkaline phosphatase gene: a case report». Journal of Medical Case Reports. 13 (1): 101. doi:10.1186/s13256-019-2045-4. PMC 6480864. PMID 31014398.
- ^ Schiele F, Vincent-Viry M, Fournier B, Starck M, Siest G (November 1998). «Biological effects of eleven combined oral contraceptives on serum triglycerides, γ-glutamyltransferase, alkaline phosphatase, bilirubin and other biochemical variables». Clinical Chemistry and Laboratory Medicine. 36 (11): 871–8. doi:10.1515/CCLM.1998.153. PMID 9877094. S2CID 23437978.
- ^ Robinson D, Sandblom G, Johansson R, Garmo H, Stattin P, Mommsen S, Varenhorst E (January 2008). «Prediction of survival of metastatic prostate cancer based on early serial measurements of prostate specific antigen and alkaline phosphatase». The Journal of Urology. 179 (1): 117–22, discussion 122–3. doi:10.1016/j.juro.2007.08.132. PMID 17997442.
- ^ Arceci RJ, Hann IM, Smith OP, eds. (2006). Pediatric hematology (3rd ed.). Wiley-Blackwell. p. 763. ISBN 978-1-4051-3400-2.
- ^ O’Brien PJ, Herschlag D (May 2001). «Functional interrelationships in the alkaline phosphatase superfamily: phosphodiesterase activity of Escherichia coli alkaline phosphatase». Biochemistry. 40 (19): 5691–9. CiteSeerX 10.1.1.322.8876. doi:10.1021/bi0028892. PMID 11341834.
Further reading[edit]
- Coleman JE (1992). «Structure and mechanism of alkaline phosphatase». Annual Review of Biophysics and Biomolecular Structure. 21: 441–83. doi:10.1146/annurev.bb.21.060192.002301. PMID 1525473. S2CID 34764597.
External links[edit]
- Alkaline phosphatase at Lab Tests Online
- ИНВИТРО
- Библиотека
- Лабораторная…
- Щелочная фосфатаза
Щелочная фосфатаза
Напоминаем вам, что самостоятельная интерпретация результатов недопустима, приведенная ниже информация носит исключительно справочный характер
Щелочной фосфатазой (ЩФ) называют закрепленный на плазматической мембране фермент, который участвует в реакции дефосфолирования. Реакция представляет собой процесс отсоединения фосфора от определенных органических веществ.
Щелочная фосфатаза: показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Показание к назначению исследования
Щелочная фосфатаза (ЩФ) присутствует во многих тканях человеческого организма, но ее наибольшее количество определяется в эпителии тонкого кишечника, остеобластах (клетках, синтезирующих межклеточное вещество костной ткани), в гепатоцитах (клетках печени), плаценте, почечных канальцах и слизистой кишечника.
В сыворотке крови определяется несколько изоферментов щелочной фосфатазы (изоферменты – это ферменты, различающиеся по аминокислотной последовательности, существующие в одном организме, но в разных его клетках):
- костная ЩФ — секретируется остеобластами и участвует в созревании межклеточного вещества костной ткани и его минерализации. Уровень костной щелочной фосфатазы может быть повышен во время активного роста костей у детей – вплоть до периода полового созревания, при переломах, у женщин в постменопаузе, а также в результате заболеваний, связанных с процессом разрушения костной ткани;
- печеночная ЩФ представлена двумя изоферментами: первый повышается в сыворотке крови в случае застоя желчи в печени и/или снижения ее выделения; второй изофермент повышается при разрушении клеток печени;
- кишечная ЩФ синтезируется клетками, выстилающими просвет кишечника, поступает в просвет тонкого кишечника и частично всасывается в кровь. Активность кишечной щелочной фосфатазы может увеличиваться после приема пищи и при заболеваниях кишечника;
- плацентарная ЩФ присутствует в сыворотке крови во время беременности, уровень ее повышается при нормально протекающей беременности и достигает максимума в третьем триместре. Вследствие повреждения плаценты при преэклампсии отмечается выраженное повышение щелочной фосфатазы. Низкая активность ЩФ у беременных — признак недостаточности развития плаценты.
В клинической практике определяется суммарная активность щелочной фосфатазы.
В сыворотке крови преимущественно обнаруживают печеночный и костный изоферменты щелочной фосфатазы (до половины от общего количества у взрослых людей). Соотношение этих форм в сыворотке крови зависит от возраста.
Таким образом, показаниями для назначения анализа крови на щелочную фосфатазу могут быть следующие состояния и заболевания:
- заболевания печени;
- заболевания костной ткани;
- заболевания, протекающие с поражением печени и/или костной ткани (туберкулез, заболевания почек, метастатический рак печени, метастатическое поражение костной ткани и др.);
- инфекционный мононуклеоз (в дебюте заболевания».
Подготовка к процедуре
Взятие крови предпочтительно проводить утром натощак, после 8-14 часов ночного периода голодания (воду пить можно), допустимо днем через 4 часа после легкого приема пищи.
Накануне исследования следует придерживаться стандартной диеты без избыточного употребления пищи, богатой белками и пуринами (мяса, печени, почек, рыбы, мясных бульонов, грибов, бобов, фасоли и чечевицы).
Исключить повышенные психоэмоциональные и физические нагрузки (спортивные тренировки), прием алкоголя.
Срок исполнения
1 рабочий день, указанный срок не включает день взятия биоматериала.
Что может повлиять на результат
В случае несоблюдения правил подготовки полученный результат может быть некорректным.
В медицинских литературных источниках есть сведения о том, что уровень ЩФ может повышаться после приема некоторых лекарственных препаратов (парацетамола, аспирина, ряда антибактериальных средств) и понижаться при использовании оральных контрацептивов.
Фосфатаза щёлочная (ЩФ, Alkaline phosphatase, ALP)
Сдать анализ крови на щелочную фосфатазу можно в ближайшем медицинском офисе ИНВИТРО. Список офисов, где принимается биоматериал для лабораторного исследования, представлен в разделе «Адреса».
Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т. д.
Метод определения: колориметрический с p-нитрофенолом.
Исследуемый материал: сыворотка крови.
Нормальные показатели
Единицы измерения: Ед/л.
Референсные значения
| Возраст | Референсные значения (Ед/л) | |
| <15 дней | 90-273 | |
| 15 дней — 1 год | 134-518 | |
| 1 год — 10 лет | 156-369 | |
| 10 — 13 лет | 141-460 | |
| Женщины | Мужчины | |
| 13 -15 лет | 62-280 | 127-517 |
|
>15 лет (для ж)
|
40-150 | 89-365 |
| 17 -19 лет | 59-164 | |
| >19 лет | 40-150 |
Расшифровка показателей
У детей первого года жизни, когда происходит усиленный рост костной ткани, наблюдается максимальная концентрация щелочной фосфатазы. Высокий уровень ЩФ выявляется и в период полового созревания. Более высокий уровень ЩФ у юношей объясняется более выраженным процессом роста костной ткани по сравнению с девушками.
Нормальный уровень ЩФ для девушек старше 15 лет и юношей старше 19 лет составляет 40-150 Ед/л.
Что значат пониженные результаты
Понижение уровня щелочной фосфатазы регистрируется при следующих заболеваниях и состояниях:
- гипотиреоз — эндокринное заболевание, при котором щитовидная железа вырабатывает недостаточное количество гормонов;
- тяжелая анемия;
- квашиоркор — патологическое состояние, развивающееся у детей раннего возраста вследствие первичной белковой недостаточности и характеризующееся задержкой физического развития;
- ахондроплазия — наследственное заболевание, при котором нарушается рост костей скелета и основания черепа, в результате чего наблюдаются неправильные пропорции тела;
- кретинизм — эндокринное заболевание, развивающееся с рождения на фоне недостаточности щитовидной железы, с задержкой психомоторного и физического развития;
- наследственная гипофосфатазия – прогрессирующее наследственное метаболическое заболевание, вызванное дефицитом щелочной фосфатазы, проявляющееся нарушением минерализации костей скелета и зубов;
- дефицит витамина В12;
- дефицит цинка и магния.
Что значат повышенные результаты
Повышение уровня щелочной фосфатазы регистрируется при следующих заболеваниях и состояниях:
- физиологическое повышение щелочной фосфатазы (у недоношенных детей, у детей в период быстрого роста, у женщин в последнем триместре беременности и после менопаузы);
- заживление переломов костей;
- патологическое повышение щелочной фосфатазы:
- заболевания печени (цирроз, некроз печеночной ткани, первичная гепатокарцинома, метастатический рак печени; инфекционные, токсические, лекарственные гепатиты; холангиты, камни желчных протоков и желчного пузыря; опухоли желчевыводящих путей); заболевания, протекающие с поражением печени (паразитарные поражения, инфекционный мононуклеоз);
- заболевания костной ткани (болезнь Педжета — деформирующий остеит, остеосаркомы); заболевания, протекающие с резорбцией костной ткани (рахит, миеломная болезни, лимфогранулематоз, метастазы злокачественных опухолей в кости, первичный или вторичный гиперпаратиреоз, болезнь Гоше с резорбцией костей и др.);
- инфаркт легкого, почки;
- нарушения питания (недостаток кальция и фосфатов в пище);
- прием гепатотоксичных препаратов (метотрексата, хлорпромазина, антибиотиков широкого спектра действия, сульфаниламидов, больших доз витамина С, магнезии).
Дополнительное обследование при отклонении от нормы
При отклонении показателя ЩФ от нормы следует проводить комплексную диагностику для установления точной причины данного состояния.
Общеклиническое исследование крови:
- клинический анализ крови, который включает определение концентрации гемоглобина, количества эритроцитов, лейкоцитов и тромбоцитов, величины гематокрита и эритроцитарных индексов (MCV, RDW, MCH, MCHC), лейкоцитарную формулу и СОЭ (с микроскопией мазка крови при наличии патологических сдвигов);
Ретикулоциты (Reticulocytes)
Есть ограничения по дням взятия проб в медицинских офисах и приема проб самостоятельно собранных для данного исследования (кал, моча и др.).
Рекомендуем уточнить и�…
Оценка функции печени:
- обследование печени: расширенное;
Общий белок (в крови) (Protein total)
Синонимы: Общий белок сыворотки крови; Общий сывороточный белок.
Total Protein; Serum Тotal Protein; Total Serum Protein; TProt; ТР.
Краткая характеристика определяемого вещества Общий бе�…
Комплексное ультразвуковое обследование органов брюшной полости (печени, желчного пузыря, поджелудочной железы, селезенки) назначают с целью визуальной диагностики протекающего в организме патологическогот процесса.
Оценка метаболизма костной ткани и остепороза:
- кальций общий (Ca, Calcium total);
Кальций общий (Ca, Calcium total)
Общий кальций – это основной компонент костной ткани и важнейший биогенный элемент, обладающий важными структурными, метаболическими и регуляторными функция�…
Диагностика неблагоприятных исходов при подозрении на преэклампсию у беременных:
- плацентарный фактор роста (Placental growth factor, PlGF);
Источники:
- Лелевич С.В. Т 11 Клиническая лабораторная диагностика : уч.-метод. пособие для студентов лечебного, педиатрического и медико-психологического факультетов / С.В. Лелевич, В.В. Воробьев.
- Клиническая лабораторная диагностика: учебник / Под ред. В.В. Долгова, ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования». – М.: ФГБОУ ДПО РМАНПО, 2016. – 668 с.
- Кишкун А.А. Клиническая лабораторная диагностика: учебное пособие. — М.: ГЭОТАР Медиа, 2010. 976 с.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Информация проверена экспертом

Лишова Екатерина Александровна
Высшее медицинское образование, опыт работы — 19 лет
Поделитесь этой статьей сейчас
Рекомендации
-
4255
13 Мая
-
8514
04 Мая
-
21370
13 Апреля
Похожие статьи
Иммуноферментный анализ
Иммуноферментный анализ: показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов.
Щелочная фосфатаза – важный фермент в организме человека.
Если у пациента есть признаки заболевания печени или проблемы с костями, врач может назначить тест на щелочную фосфатазу (ЩФ), чтобы измерить количество фермента в крови и диагностировать проблему.
Что показывает щелочная фосфатаза?
В организме человека происходят многие биохимические процессы, в том числе реакция дефосфорилирования. В этом случае фосфорная кислота отделяется от органических эфирных соединений, участвуя в кальций-фосфорном обмене. Этот процесс происходит в присутствии фермента щелочная фосфатаза.
Щелочная фосфатаза – это фермент, обнаруженный во многих тканях организма. Но в основном она сконцентрирована в клетках печени, костях, плаценте. Основной объем приходится на слизистую кишечника.
Щелочная фосфатаза представлена в организме 11 изоферментами. Для определения причины повышенной щелочной фосфатазы необходимо также определить ее изоферменты, специфичные для определенных тканей:
- α2 – фракция печени;
- β1 – фракция кости;
- β2 – фракция кишечника.
Щелочная фосфатаза вырабатывается верхним слоем слизистой оболочки кишечника, но только вторично участвует в пищеварительных процессах. Основная функция щелочной фосфатазы – дефосфорилирование, то есть отделение фосфорной кислоты от фосфорсодержащих соединений. Этот фермент также способствует транспортировке фосфора по организму.
Фермент называют «щелочным», потому что он проявляет наибольшую активность в щелочной среде с pH в диапазоне от 8,6 до 10,1.
Соблюдение содержания щелочной фосфатазы отражает метаболическую эффективность фосфора и кальция в организме.
Щелочная фосфатаза у детей – норма, причины отклонения от нормы
Контрольные значения для теста на щелочную фосфатазу меняются в зависимости от возраста из-за роста.
Нормальный уровень щелочной фосфатазы в плазме зависит от возраста и пола. Норма для детей и подростков:
|
Возраст |
Норма фосфатазы |
|
Новорожденные |
до 250 ед / д |
|
1 – 9 лет |
до 350 ед / д |
|
10 – 15 лет |
до 280 ед / л |
|
16 – 19 лет |
до 150 ед / л |
Уровень этого фермента в сыворотке крови может незначительно отличаться в зависимости от используемых методов тестирования и реагентов.
В педиатрической практике исследование активности щелочной фосфатазы играет важную роль в диагностике заболеваний печени, что дополняется снижением оттока желчи в двенадцатиперстной кишке. Кроме того, уровень щелочной фосфатазы в крови ребенка часто повышен. Высокий уровень фосфатазы нарушает отток желчи из-за камней в желчных протоках или опухолей желчных протоков.
Ребенку с повышенной щелочной фосфатазой врач может поставить следующие диагнозы:
- заболевания костей, включая опухоли, саркомы, метастазы рака костей;
- гиперпаратиреоз;
- поражение костей при лимфогранулематозе;
- рахит;
- педиатрические заболевания – болезни скелета;
- инфекционный мононуклеоз;
- миелома;
- детская цитомегалия;
- кишечные инфекции.
Большое значение у детей имеет показатель щелочной фосфатазы в ранней диагностике рахита. В этом случае активность фермента увеличивается задолго до появления клинических симптомов заболевания.
Иногда происходит физиологическое, то есть естественное, повышение уровня щелочной фосфатазы в сыворотке крови: у недоношенных детей или подростков в период полового созревания и интенсивного роста костей.
Лекарственные препараты с побочными гепатотоксическими эффектами могут также повышать уровень фермента щелочной фосфатазы у ребенка. К таким препаратам относятся парацетамол, пенициллины, сульфаниламиды, эритромицин и многие другие. Повышенный метаболизм в костной ткани во время заживления переломов костей часто увеличивает уровень этого фермента.
Снижение уровня фермента щелочной фосфатазы не имеет клинического значения. Снижение уровня ферментов может происходить при различных нарушениях роста костей, дефиците цинка, магния, витаминов C и B12 в пище, анемии и гипотиреозе, а также в редких случаях врожденной гипофосфатазии.
Как уменьшить щелочную фосфатазу?
Чтобы уровень щелочной фосфатазы у ребенка был нормальным, необходимо вылечить основное заболевание, а не просто довести его до нормы.
Активность щелочной фосфатазы у детей всегда выше, чем у взрослых. В некоторых случаях повышенная активность фосфатазы – единственный признак злокачественного новообразования печени. Именно поэтому так важно провести все необходимые клинические испытания и вовремя начать лечение ребенка, чтобы оно привело к скорейшему выздоровлению.
Щелочная фосфатаза у взрослых – норма, причины отклонения от нормы
Тест на определение уровня фермента в крови проводится в следующих случаях:
- плановый осмотр;
- подготовка к операции;
- выполнение комплекса биохимических анализов – пробы печени на выявление заболеваний печени;
- диагностика костной ткани и повреждений костей;
- если пациенты жалуются на тяжесть и боль в правом боку под ребрами, тошноту, потерю аппетита и хроническую усталость.
Норма для женщин
После шестнадцати лет количество щелочной фосфатазы начинает снижаться. Но диапазон его нормальной концентрации все же достаточно широк.
При наступлении зрелого и солидного возраста уровень ферментов снова повышается и должен быть (ед / л):
|
Возраст женщины |
Норма фосфатазы |
|
20-30 лет |
85-105 ед / л |
|
30-45 лет |
95 — 115 ед / л |
|
45-55 лет |
100 — 125 ед / л |
|
55-70 лет |
130 — 145 ед / л |
|
старше 70 лет |
165 — 190 ед / л |
Норма для мужчин
У взрослых значения количества щелочной фосфатазы незначительно различаются в зависимости от пола, для мужчин норма на 20-25 ед / л выше, чем для женщин того же возраста:
|
Возраст мужчины |
Норма фосфатазы |
|
20 – 30 лет |
100-115 ед / л |
|
30 – 45 лет |
135 — 145 ед / л |
|
45 – 55 лет |
135 — 150 ед / л |
|
55 – 70 лет |
135 — 160 ед / л |
|
старше 70 лет |
145 — 190 ед / л |
Аномальная щелочная фосфатаза – причины
Причины повышения уровня щелочной фосфатазы можно сгруппировать следующим образом:
- Поражение или деструкция (разрушение) печени, проблемы с движением желчи:
- вирусный и аутоиммунный гепатит;
- патология печени, вызванная токсинами и лекарствами;
- образование желчи в протоках камней;
- первичный склерозирующий холангит – проявляется воспалением и сужением внутрипеченочных протоков;
- инфекционный мононуклеоз;
- застой желчи – холестаз.
- Патология костной ткани:
- остеомаляция или размягчение костей – это системное повреждение характеризуется нарушением минерального обмена и потерей солей кальция, витаминов и фосфорной кислоты, в результате кости размягчаются и деформируются;
- повышенный метаболизм в костной ткани, возникающий при заживлении переломов;
- болезнь Педжета – характеризуется значительным разрушением костной ткани, деформацией и ослаблением костей, чаще болеют мужчины старше 50 лет;
- остеосаркома и метастазы, проникающие в костную ткань.
III. Прочие патологии:
- первичный и вторичный гиперпаратиреоз – это заболевания эндокринной системы с выраженными нарушениями обмена фосфора и кальция;
- инфаркт миокарда;
- желудочно-кишечная патология.
- Непатологические причины:
- алкогольное отравление;
- третий триместр беременности;
- кормление грудью;
- применение препаратов с гепатотоксическим действием – они могут негативно повлиять на печень и вызвать структурные и функциональные нарушения;
- чрезмерные физические нагрузки;
- неправильное питание и авитаминоз;
- возможные отклонения во время родов и после менопаузы индивидуальны.
Превышение нормы фермента не всегда указывает на тип заболевания. Может быть, человек здоров и рост щелочной фосфатазы обусловлен физиологическими свойствами. Поэтому необходимо провести дополнительные анализы, чтобы определить точные причины.
Уровень щелочной фосфатазы ниже нормы
Понижение содержания фермента может сигнализировать о появлении или наличии в организме опасных заболеваний.
Причины снижения содержания ферментов:
- тяжелая анемия;
- гипотиреоз – снижение уровня гормонов щитовидной железы;
- значительные переливания крови;
- пороки развития плода, например, плацентарная недостаточность – частое осложнение беременности;
- частое использование оральных контрацептивов;
- гипофосфатазия – редкое, но опасное для жизни заболевание;
- радиоактивное загрязнение – в этом случае измерение параметров крови покажет накопление радиоактивных изотопов;
- недоедание, недостаток магния, цинка и витамина С;
- избыток витамина D может вызвать изменение реагента при диагностике некоторых заболеваний, например, рахита.
В каких случаях проводится анализ крови на щелочную фосфатазу?
В клинической практике уровни щелочной фосфатазы приобретают важное диагностическое значение только в сочетании с другими лабораторными и инструментальными исследованиями. Поэтому пациентам обычно сдают биохимический анализ крови, который включает щелочную фосфатазу.
Это исследование показано всем амбулаторным и стационарным пациентам с нарушениями функции печени, почек, пищеварения и эндокринной системы. В настоящее время в большинстве случаев они ограничиваются определением общего уровня щелочной фосфатазы, поскольку фракционный анализ, хотя и более информативный, очень дорог и проводится только в специализированных лабораториях.
Как проводится анализ на щелочную фосфатазу?
Чтобы получить правильный результат теста, нужно соблюдать следующие правила:
- тест может быть проведен в лаборатории, из которой медицинский работник берет образец крови из кровотока и помещает его в закрытый контейнер для анализа;
- забор крови проводится утром из локтевой вены в количестве 5-10 мл;
- анализ следует проводить натощак и лучше всего не есть в течение как минимум 12 часов до взятия крови;
- за день до сдачи крови нельзя заниматься тяжелой физической работой и спортом, сопряженным с сильным стрессом;
- воздержитесь от употребления алкоголя и наркотиков, повышающих уровень щелочной фосфатазы.
Обычно результаты анализов готовы через 1 – 2 дня.
Особенности определения щелочной фосфатазы
Для анализа используется сыворотка крови. В большинстве случаев берут верхний слой, образовавшийся в трубке сепаратора. Активность этого фермента может незначительно отличаться при хранении образцов крови при комнатной температуре. Гемолиз in vitro не влияет на результаты анализа.
Что делать при аномальном уровне щелочной фосфатазы?
При лечении следует указывать этиологическое направление. При заболеваниях печени или желчевыводящих путей стоит обратиться к гастроэнтерологу. Наличие холестаза, панкреатита, алкогольного гепатита или цирроза печени требует соответствующей медицинской коррекции, размер которой определяет только врач. Самолечение в этом случае может обострить основное заболевание.
Изменения уровней ферментов, в том числе щелочной фосфатазы, могут наблюдаться при сердечной недостаточности, раке и серьезных проблемах с почками, а также при диабете, поэтому следует проконсультироваться с кардиологом, нефрологом или эндокринологом. Врач определяет лечебную тактику в зависимости от клинической картины.
За счет устранения этиологических факторов нормализуется активность щелочной фосфатазы. При назначении терапии следует учитывать, что, например, физиологическое повышение этого показателя возможно при переломах, активном росте скелета и вынашивании плода. Это не требует медицинского вмешательства. Интерпретацию результатов лабораторного исследования следует проводить комплексно с учетом других биохимических показателей и жалоб пациентов.
Синонимы: Фосфатаза щёлочная, ЩФ, Alkaline phosphatase, ALP.
Степень активности щелочной фосфатазы определяется методом биохимического анализа крови. Данный показатель считается наиболее важным диагностическим критерием при заболеваниях опорно-двигательного аппарата, печени, почек и других внутренних органов.
Щелочная фосфатаза – это общее название группы ферментов, которые принимают активное участие в кальциево-фосфорном обмене, а именно, в процессе расщепления фосфорной кислоты. Фосфатазы локализуются в мембранах практически всех клеток организма, но большая их часть находится в тканях печени, желчного протока, кишечника, почек, костей, плаценты.
Основные сведения
Группа фосфатаз в организме человека представлена 11 изоферментами, из которых самыми основными являются:
- ALPI – кишечная фосфатаза;
- ALPL – неспецифическая (из тканей печени, костей, почек) фосфатаза;
- ALPP – плацентарная фосфатаза.
В норме щелочная фосфатаза состоит из 2-х фракций: костного и печеночного изоферментов (костный — в остеобластах, печеночный выделяется с желчью), количественное содержание которых в сыворотке крови примерно одинаково. Но в ряде случаев это соотношение может меняться или «разбавляться» включением других видов изоферментов. К подобным ситуациям можно отнести патологические состояния, например, поражение клеток механического, воспалительного характера или какие-либо физиологические особенности организма.
Спровоцировать рост активности щелочной фосфатазы могут заболевания:
- органов гепатобилиарной системы;
- опорно-двигательного аппарата;
- органов пищеварительного тракта;
- злокачественные новообразования;
- эндокринные нарушения.
Кроме того, повышение значений фосфатаз может наблюдаться у вполне здоровых людей с интенсивным (сильнее обычного) обменом веществ, у беременных и у детей в период активного роста костей.
Снижение активности щелочной фосфатазы фиксируется крайне редко и чаще всего это происходит на фоне недостаточности функции щитовидной железы, нарушения питания (голодание, строгие диеты), дефицита витаминов и микроэлементов и пр.
Показания к исследованию
Назначают и интерпретируют результаты специалисты: терапевт, гастроэнтеролог, гепатолог, инфекционист, гематолог, эндокринолог, хирург, врач общей практики, педиатр.
- Обструктивные заболевания печени и желчевыводящих путей;
- Воспалительные заболевания желчевыводящих путей;
- Патологии костной системы, в т.ч. рак первичный и метастатический;
- Онкологические заболевания почек;
- Инфекционный мононуклеоз (острое вирусное заболевание, в ходе которого происходит поражение печени).
- Индивидуальный мониторинг пациентов с остеопорозом, получающих антирезорбтивные средства1.
Анализ на щелочную фосфатазу является обязательным в программе плановых медосмотров и при подготовке пациента к хирургическому вмешательству. Также тест на фосфатазы включен в перечень «печеночных проб», когда назначается диагностическое исследование функции печени.
Кроме того, оценить активность щелочной фосфатазы рекомендуется при жалобах пациента на:
- повышенную утомляемость;
- слабость;
- нарушение или отсутствие аппетита;
- тошноту/рвоту;
- боли в области живота/правого подреберья;
- желтушность кожных покровов;
- изменение цвета мочи и/или кала;
- кожный зуд;
- чувство ломоты в костях;
- частые переломы и/или деформации костей.
Повторный анализ на щелочную фосфатазу обычно назначается с целью контроля за течением заболевания и/или оценки эффективности проводимого лечения.
Подготовка
Выполнения сложных подготовительных мероприятий к данному исследованию не требуется. Подготовка проводится соответственно биохимическому анализу крови. Подробнее о правилах можно посмотреть здесь.
Референсные значения
Важно! Нормы могут различаться в зависимости от реактивов и оборудования, используемого в каждой конкретной лаборатории. Именно поэтому при интерпретации результатов необходимо пользоваться стандартами, принятыми в той лаборатории, где сдавался анализ. Также необходимо обращать внимание на единицы измерения.
Нормы щелочной фосфатазы по данным независимой лаборатории Инвитро2:
|
Пол |
Возраст | Нормы (Ед/л) |
| И мальчики, и девочки | до 15 дней | 90-273 |
| 15 дней — 1 года | 134-518 | |
| 1 год — 10 лет | 156-369 | |
| 10 лет — 13 лет | 141-460 | |
| Женщины | 13 лет-15 лет | 62-280 |
| старше 15 лет | 40-150 | |
|
Мужчины |
13 лет – 15 лет | 127-517 |
| 15 лет-17 лет | 89-365 | |
| 17 лет -19 лет | 59-164 | |
| старше 19 лет | 40-150 |
Нормы лаборатории Хеликс3:
| Возраст, пол | Референсные значения | |
| до 15 дней | 83 — 248 Ед/л | |
| 15 дней — 1 год | 122 — 469 Ед/л | |
| 1-10 лет | 142 — 335 Ед/л | |
| 10-13 лет | 129 — 417 Ед/л | |
| 13-15 лет | женский | 57 — 254 Ед/л |
| мужской | 116 — 468 Ед/л | |
| 15-17 лет | женский | 50 — 117 Ед/л |
| мужской | 82 — 331 Ед/л | |
| 17-19 лет | женский | 45 — 87 Ед/л |
| мужской | 55 — 149 Ед/л | |
| старше 19 лет | женский | 35 — 105 Ед/л |
| мужской | 40 — 130 Ед/л |
Данные по щелочной фосфатазе Руководства по лабораторным методам диагностики4:
| Возраст | Общая, МЕ/л | Костная,% |
| Новорождённые | 35 — 106 | |
| 1 месяц | 71 — 213 | 85 |
| 3 года | 71 — 142 | 85 |
| 10 лет | 106 — 213 | 85 |
| Взрослые до 31 года | 39 — 92 | 60 |
| Взрослые старше 31 года | 39 — 117 | 40 |
Факторы влияния
Повышают значения:
- последний триместр беременности (щелочная фосфатаза содержится в плаценте);
- постменопауза (период после наступления менопаузы);
- состояние после переломов костей (стадия заживления);
- недоношенность (у новорожденных детей);
- детский/подростковый возраст (активный рост костей);
- нарушение правил транспортировки и хранения биоматериала (охлаждение крови после взятия);
- прием лекарственных препаратов, обладающих высокой гепатотоксичностью (агрессивное действие на печень):
- метотрексат;
- хлорпромазин;
- парацетамол;
- аспирин;
- аллопуринол;
- антибиотики широкого спектра действия;
- сульфаниламиды;
- прием больших доз аскорбиновой кислоты (витамин С), магнезии;
- дефицит фосфатов и кальция в пищевом рационе.
Понижают значения
- нарушение питания (недостаток магния и цинка в пище);
- прием медикаментозных средств:
- оральные контрацептивы;
- эстрогены;
- клофибрат;
- даназол;
- азатиоприн;
- наличие примесей в лабораторной посуде: мышьяк, цитрат, бериллий, ЭДТА и др. (ошибка лаборанта при выборе емкости).
Важно! Интерпретация результатов всегда проводится комплексно. Поставить точный диагноз на основании только одного анализа невозможно.
Повышение значений
Заболевания печени и желчевыводящих путей:
- непроходимость желчевыводящих протоков и, как следствие, механическая желтуха:
- камни желчных путей,
- опухолевые образования желчных протоков;
- рак головки поджелудочной железы, желудка (провоцирует механическое сдавливание общего желчного протока);
- первичный и/или вторичный (метастазирующий) рак печени;
- цирроз печени (патологический процесс замещения здоровой ткани органа соединительной (рубцовой) тканью, в результате которого угнетается функция печени);
- гепатиты любой этиологии (активность щелочной фосфатазы в этом случае в 3 раза превышает нормальные показатели);
- инфекционный мононуклеоз (острая вирусная патология, в ходе которой страдает функция печени);
- аутоиммунные поражения желчных путей (редко встречающиеся наследственные заболевания: первичный билиарный цирроз и первичный склерозирующий холангит). В этом случае также наблюдается одновременное повышение значений щелочной фосфатазы и гамма-ГТП до высоких цифр;
Патология костной ткани:
- болезнь Педжета (аномальный рост костей и локальное нарушение их структуры);
- остеомаляция (патологическое размягчение костной ткани, спровоцированное дефицитом кальция);
- рахит (нарушение костеобразования и недостаточность минерализации костей, проявляется у детей грудного и раннего возраста);
- остеосаркома (первичный рак костей) и метастазы из очагов рака в других органах;
Другие причины:
- инфаркт миокарда, легкого, почки;
- язвенный колит, перфорация кишечника;
- цитомегалия у детей (вирусное заболевание, в патологический процесс вовлекается печень и селезенка);
- гиперпаратиреоз (интенсивное вымывание кальция из костной ткани на фоне гиперфункции околощитовидных желез).
Неспецифическая щелочная фосфатаза присутствует на мембране нейронов и может играть роль в нейродегенерации при болезни Альцгеймера, практический у всех пациентов с болезнью Альцгеймера отмечается повышение щелочной фосфатазы в крови5.
Примечание: если наряду с высокой активностью щелочной фосфатазы другие биохимические показатели крови (билирубин, АЛТ, АСТ) тоже повышены, то вполне вероятно поражение печени. Если повышается уровень кальция и фосфора, то предполагают патологию костей. Одновременное повышение щелочной фосфатазы и гамма-ГТП является признаком заболеваний желчевыводящих путей.
Понижение значений
- Анемия (низкий гемоглобин крови, тяжелое течение);
- Цинга (острый дефицит витамина С, проявляется разрыхлением и кровоточивостью десен);
- Дефицит витамина В12;
- Гемотрансфузия (переливание крови);
- Квашиоркор (тяжелая дистрофия, вызванная дефицитом белков, чаще развивается у детей 1-4 лет);
- Гипотиреоз (недостаточность функции щитовидной железы);
- Ахондроплазия (наследственное нарушение процессов роста длинных костей, карликовость);
- Гипофосфатазия (редкое врожденное заболевание, провоцирующее размягчение костной ткани);
- Кретинизм (аномальное развитие щитовидной железы, слабоумие);
- У беременных недостаточность плаценты.
Источники:
- 1. Sonia A Talwar, MD. Bone Markers in Osteoporosis. — Medscape, Jan 2017.
- 2. Данные независимой лаборатории Инвитро.
- 3. Данные лаборатории Хеликс.
- 4. А.А.Кишкун, д.м.н., проф. Руководство по лабораторным методам диагностики, — ГЭОТАР-Медиа, 2007г.
- 5. Vardy ER. Alkaline phosphatase is increased in both brain and plasma in Alzheimer’s disease. — Neuro-degenerative diseases 2012;9(1):31-7