Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) гидрокарбонат натрия
2) сульфат магния
3) сульфат натрия
4) соляная кислота
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») — водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
1
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) нитрит натрия
2) гидроксид рубидия
3) дихромат калия
4) нитрат хрома(III)
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
2
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) нитрит натрия
2) гидроксид рубидия
3) дихромат калия
4) нитрат хрома(III)
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») — водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
1
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) гидрокарбонат натрия
2) сульфат магния
3) сульфат натрия
4) соляная кислота
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
3
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) нитрат бария
2) карбонат натрия
3) серная кислота
4) сульфат железа(III)
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») — водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
1
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) гидрокарбонат натрия
2) сульфат магния
3) сульфат натрия
4) соляная кислота
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
4
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) сульфат калия
2) сульфат алюминия
3) гидроксид лития
4) гидроксид аммония
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») — водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
1
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) гидрокарбонат натрия
2) сульфат магния
3) сульфат натрия
4) соляная кислота
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
5
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) иодид бария
2) нитрат железа(III)
3) карбонат калия
4) уксусная кислота
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») — водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
1
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) гидрокарбонат натрия
2) сульфат магния
3) сульфат натрия
4) соляная кислота
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Пройти тестирование по этим заданиям

-шкала-ph.jpg
О прикрепленном файле
гидролиз шкала ph
14.10.2021
x px
Добавить комментарий
Ваш адрес email не будет опубликован. Обязательные поля помечены *
Комментарий *
Имя *
Email *
Сайт
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Спешите записаться!
Полный курс ЕГЭ по химии
ЕГЭ на 100! Наша рассылка ВКонтакте
Свежие записи
- Тренировочный вариант ОГЭ по химии-2 16.12.2022
- Тренировочный вариант ОГЭ по химии 16.12.2022
- Тренировочный вариант ЕГЭ по химии-2023
- Тренировочные варианты ОГЭ по химии
- Тренажер задания 20 ОГЭ по химии
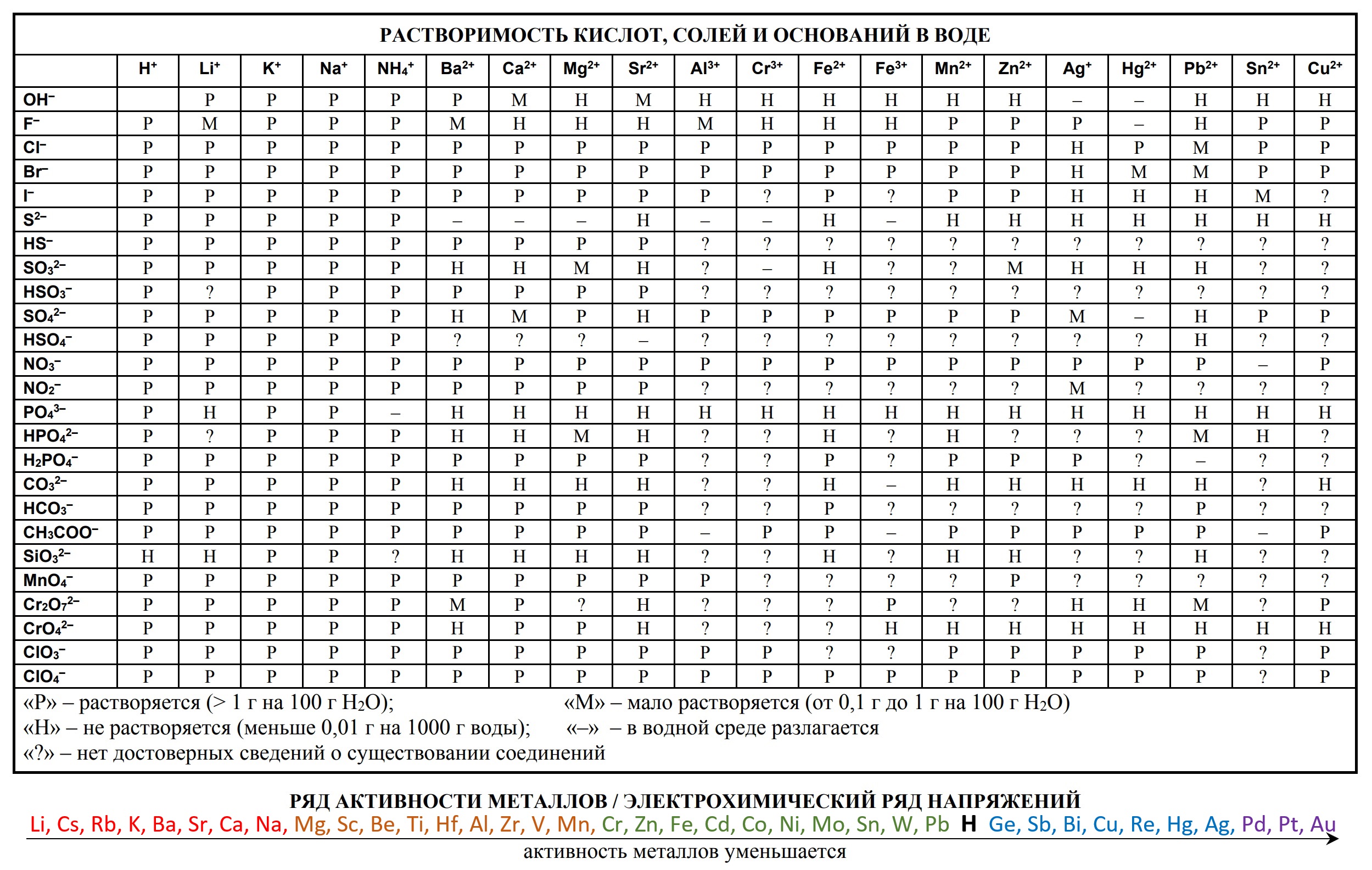
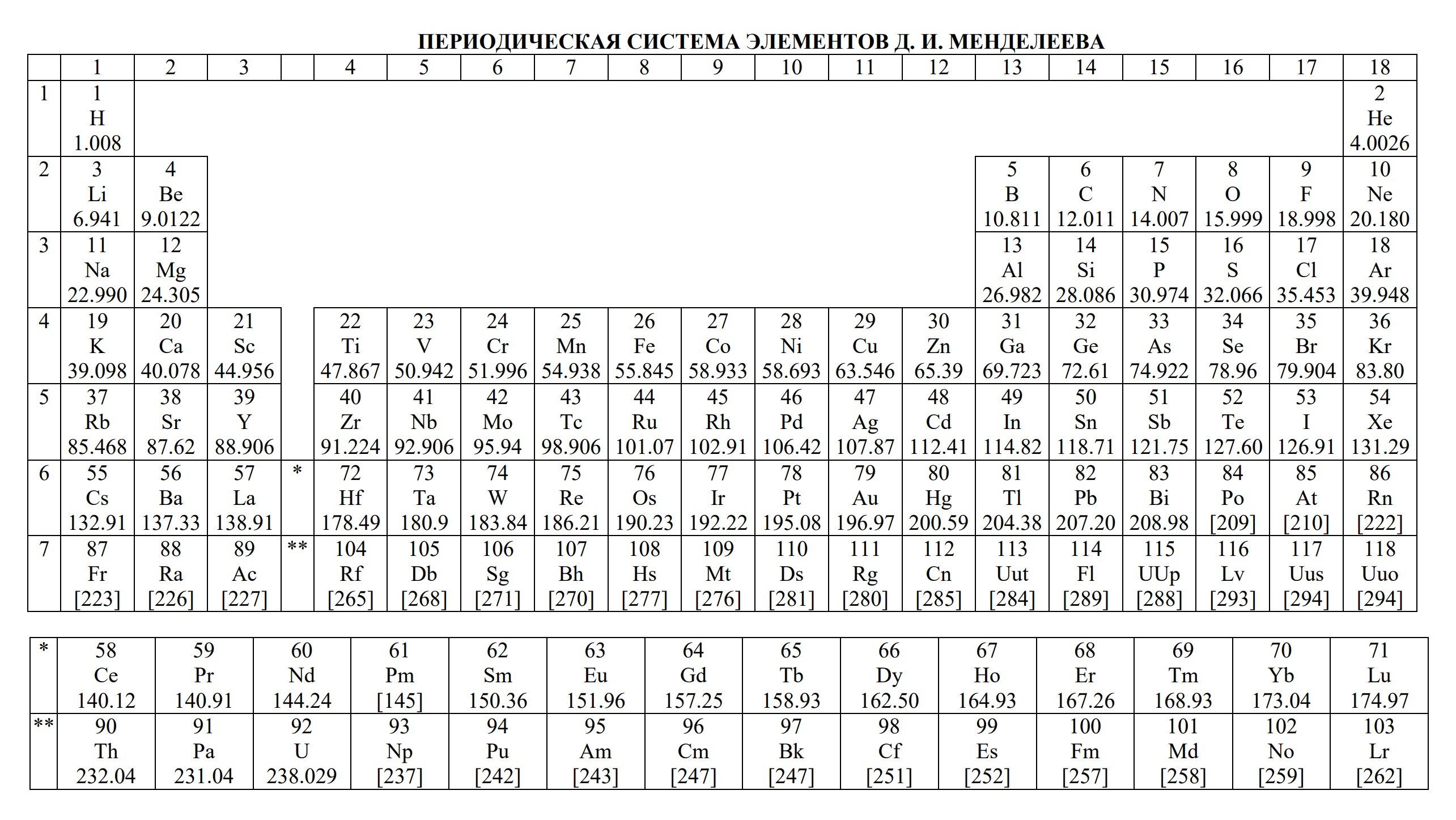
Таблицы на ЕГЭ и ОГЭ по химии
На сдаче ЕГЭ и ОГЭ по химии можно использовать три таблицы:
- периодическая система химических элементов Д.И. Менделеева
- таблица растворимости
- ряд активности металлов.
Они содержат в себе 80% информации, необходимой для решения большинства заданий.
Однако таблицы на форзацах разных учебников, продаваемые в книжных магазинах, располагающиеся на просторах интернета отличаются не только оформлением, но и содержанием. Что бы они оказались надёжно шпаргалкой, а не приятной неожиданностью, лучше с самого начала начинать работать с тем форматом, который официально разрешен на ЕГЭ твоего года.
Скачать эти таблицы можно ниже. А как сделать эти безликие таблицы наиболее информационными для тебя я расскажу на уроке.
- Таблица Д.И. Менделеева для ОГЭ и ЕГЭ
- Таблица растворимости и ряд активности для ОГЭ и ЕГЭ
- Таблица растворимости с расширенным рядом активности
- Таблица Д.И. Менделеева длиннопериодная для олимпиады
Содержание
- 1 Понятие о водородном показателе
- 2 Шкала pH
- 3 Методы определения величины pH
- 3.1 Использование индикаторов
- 3.2 Ионометрический метод
- 3.3 Аналитический объемный метод
- 4 Влияние температуры на значение pH
- 5 Значения pH некоторых растворов
- 5.1 pH растворов кислот
- 5.2 pH растворов оснований
- 5.3 Значения pH некоторых бытовых веществ и пищевых продуктов
- 6 Роль показателя кислотности
Важной характеристикой водных растворов является уровень концентрации в них положительно заряженных ионов водорода и отрицательно заряженных гидроксид-ионов относительно друг друга. При одинаковых концентрациях и раствор считается нейтральным, при избытке катионов – кислотным и при избытке анионов – основным (щелочным). Величина, называемая водородным показателем, или pH раствора, – это количественное выражение кислотности.
Понятие о водородном показателе
Определение pH-фактора базируется на кислотно-основных свойствах воды. Ее молекулы способны к самопроизвольной диссоциации, благодаря чему в воде всегда присутствует некоторое количество ионов и . Их концентрация мала вследствие обратимости процесса диссоциации, который выражается формулой
⇄
+
Из формулы видно, что ионы водорода и гидроксила содержатся в воде в равной концентрации: []=[
]. В стандартных условиях (при температуре 22–25° C) она составляет
моль⁄л.
Величина =[
]∙[
] называется ионным произведением воды. При заданной температуре она является постоянной (при 22–25° C
=
моль
/л
) не только для воды, но и для разбавленных растворов. При добавлении кислоты к воде повышается концентрация [
] и понижается [
] (кислотность возрастает), при добавлении щелочи падает [
] и растет [
] (кислотность понижается).
В качестве показателя кислотности удобно использовать десятичный логарифм величины [] с обратным знаком:
pH = -lg []
Для воды и любой нейтральной среды водородный показатель составит: pH = — lg = -(-7) = 7
Шкала pH
На основе постоянства значения ионного произведения воды построена шкала величин pH различных растворов. Отметка «7» в ней соответствует нейтральной среде, числа слева от 7 – кислотной, и справа – основной (щелочной).
Важно помнить, что, поскольку для определения показателя кислотности для избавления от знака «минус» в показателе степени используется отрицательный логарифм, понижение pH означает повышение концентрации , то есть кислотных свойств, и наоборот. Так, значение
5 соответствует концентрации [
] =
моль⁄л и большей кислотности, чем
9, означающее, что в растворе содержится
моль⁄л катионов водорода.
Методы определения величины pH
В зависимости от целей и условий значение водородного показателя устанавливается различными методами. Качественно оценить кислотность среды позволяет применение индикаторов. Точные количественные результаты получают с помощью измерительных методов.
Использование индикаторов
Метод основан на способности ряда органических веществ к изменению окраски в зависимости от кислотности среды. Распространенные индикаторы – лакмус, метилоранж, фенолфталеин. Каждый из них проявляет свои свойства в ограниченном диапазоне значений pH.
| Индикатор | Интервал шкалы pH | Характер изменения цвета
по мере уменьшения кислотности |
| Лакмус | 5,0–8,0 | красный → фиолетовый → синий |
| Метилоранж | 3,1–4,4 | красный → оранжевый → желтый |
| Фенолфталеин | 8,2–10,0 | бесцветный → малиновый |
Индикаторный метод отличает простота наглядность и быстрота, но он недостаточно точен и зависит от субъективного восприятия цвета.
Достичь большей точности позволяет применение универсального индикатора. Он представляет собой смесь веществ и охватывает широкий диапазон pH от 0 до 14. Цвет, приобретенный нанесенным на бумажную полосу индикатором в той или иной среде, сравнивают с эталонной шкалой. Универсальный индикатор дает возможность определять pH с точностью до десятых долей.
Индикаторные методы неэффективны в случаях, когда раствор слишком слабый, имеет собственную яркую окраску или замутнен.
Ионометрический метод
Водородный показатель можно определить с точностью до 0,01 в широком диапазоне, применяя pH-метр. Прибор представляет собой электронный милливольтметр, определяющий разность потенциалов на электродах, один из которых (измерительный pH-электрод) помещен в исследуемый раствор. Другой (электрод сравнения) погружен в электролит с определенным pH. На нем создается стабильный потенциал, относительно которого измеряют pH анализируемой среды. Разность потенциалов пропорциональна величине показателя кислотности.
pH-метр требует тщательной калибровки. Для нее используются специально приготовленные буферные растворы с эталонными значениями pH, устойчивыми при разбавлении или добавкам небольших количеств сильных кислот или оснований. В приготовлении буферных растворов для pH-метрии применяются стандарт-титры – наборы чистых реактивов с точно известной массой, которые разводят дистиллированной водой до необходимой концентрации.
Конструкция современных pH-метров предусматривает вместо двух электродов один комбинированный, что значительно упрощает их использование.
Аналитический объемный метод
В данном способе определения водородного показателя применяется процедура кислотно-основного титрования, ведущую роль в которой играет реакция нейтрализации исследуемого образца титрантом – стандартным раствором с определенным pH. Если титруется раствор кислоты, в качестве титранта используют щелочь (гидроксид натрия или калия), если основание – титрантом является раствор сильной кислоты (соляной или серной).
Титрант медленно добавляют к образцу до достижения точки эквивалентности – момента, когда происходит полная нейтрализация титруемого раствора. Фиксация конечной точки титрования может производиться несколькими способами: с помощью индикатора, потенциометрии, спектрофотометрии или измерения электропроводности. Определив необходимый для нейтрализации объем титранта и зная его концентрацию, вычисляют pH препарата.
Влияние температуры на значение pH
Повышение температуры приводит к росту диссоциации слабых электролитов, в том числе и воды. Повышается равновесная концентрация ионов и и возрастает величина ионного произведения. Соответственно меняется и водородный показатель для нейтральной среды:
| Температура
T, 0° C |
0 | 20 | 25 | 40 | 60 | 80 | 100 |
| Ионное произведение воды, |
|||||||
| Нейтральный pH = — lg(√(K_W ))=-lg K_W/2 | 7,5 | 7,1 | 7 | 6,8 | 6,5 | 6,3 | 6,1 |
Температурные изменения оказывают сложное и неоднозначное влияние на измерения pH. В целом органические и щелочные пробы более зависимы от них, чем неорганические и кислотные. При pH-метрии и титровании температура строго контролируется, а полученные результаты пересчитываются с целью приведения к значению, характерному при 25° C.
Значения pH некоторых растворов
При определении величины pH для растворов кислот и оснований принято выражать концентрацию раствора в единицах нормальности. Нормальная концентрация – это количество моль-эквивалентов вещества в 1 л раствора: .
Эквивалентом называется частица (реальная либо условная), которая в химических реакциях равноценна одному катиону или одному электрону. Моль-эквивалент содержит эквивалентов, а его масса в единицах называется молярной массой эквивалента .
Многоосновные кислоты могут отдавать один или более ионов водорода, поэтому число моль-эквивалентов в растворе и, соответственно, нормальность будет в разных случаях неодинакова. Она имеет обозначение «н.» с указанием доли нормальной концентрации. Например, серная кислота, молекула которой при диссоциации отдает два протона , при молярной концентрации имеет нормальность 1н.
pH растворов кислот
| Кислота | Концентрация | pH |
| Азотная | 0,1 н. | 1,0 |
| Борная | 0,1 н. | 5,2 |
| Муравьиная | 0,1 н. | 2,3 |
| Серная | н. | 0,3 |
| 0,1 н. | 1,2 | |
| 0,01 н. | 2,1 | |
| Сернистая | 0,1 н. | 1,5 |
| Сероводородная | 0,1 н. | 4,1 |
| Уксусная | н. | 2,4 |
| 0,1 н. | 2,9 | |
| 0,01 н. | 3,4 | |
| Соляная | н. | 0,1 |
| 0,1 н. | 1,1 | |
| 0,01 н. | 2,0 | |
| Щавелевая | 0,1 н. | 1,3 |
pH растворов оснований
Нормальность щелочей определяется аналогично нормальности кислот, исходя из количества гидроксид-ионов, которые отщепляются при диссоциации.
| Основание | Концентрация | pH |
| Гидроксид калия | н. | 14,0 |
| 0,1 н. | 13,0 | |
| 0,01 н. | 12,0 | |
| Гидроксид кальция | насыщенный | 12,4 |
| Гидроксид натрия | н. | 14,0 |
| 0,1 н. | 13,0 | |
| 0,01 н. | 12,0 |
Значения pH некоторых бытовых веществ и пищевых продуктов
| Вещество | pH | Продукт | pH |
| электролит аккумуляторный на основе | <1 | сок лимонный | 2,0–2,6 |
| шампуни | 4,5–7,0 | уксус пищевой | 2,4–3,1 |
| мыла жидкие на основе синтетических ПАВ | 5,5–7,0 | кетчуп | 3,9 |
| средства для мытья стекол | 6,2–7,3 | томаты | 4,3–4,9 |
| средства для мытья пола | 6,9–8,6 | сыр | 4,8–6,4 |
| вода морская | 8,0 | кофе | 5,0 |
| мыло натуральное | 9,0–11,0 | чай | 5,5 |
| нашатырный спирт | 11,5 | вода питьевая | 6,5–8,5 |
| хлорная известь (отбеливатель) | 12,5 | молоко | 6,5–6,9 |
| раствор соды | 13,5 | яйцо куриное свежее | 7,6–8,0 |
Роль показателя кислотности
Знание и использование водородного показателя играет значительную роль во многих областях жизни людей, особенно в здравоохранении и медицине, в водоснабжении, в производстве и грамотном потреблении продуктов питания и средств бытовой химии. Оно также важно в организации сельского хозяйства, в производстве кормов и удобрений. Показатель pH имеет большое значение при проведении научно-исследовательских работ в химии и биологии, а также при мониторинге многих технологических процессов в нефтехимической, топливной, атомной и других отраслях промышленности.
Таблицы для ЕГЭ по химии
- 31.10.2020
Приводим таблицы, которые можно использовать на ЕГЭ по химии, эти таблицы можно использовать на ЕГЭ в любом году, входит в пакет разрешённых документов, т.е. то, чем можно пользоваться на ЕГЭ по химии.
Из года в год эти таблицы не меняются. В 2023 году поменялась только таблица растворимости — информацию обновили. Используйте ссылки ниже.
В состав документа входят:
- Таблица растворимости солей
- Таблица Менделеева
Добавить комментарий
Комментарии без регистрации. Несодержательные сообщения удаляются.