- 09.09.2012
Подрборка шпаргалок по ХИМИИ.
Дата обновления: 01.11.2022
Полный набор теоретического материала для подготовки к ЕГЭ. Таблицы, схемы, формулы, теория. Всё, что необходимо для самостоятельной работы по химии.
- Тренировочные варианты ЕГЭ по химии
Что содержите в себе сборник шпаргалок по химии
- Все темы по химии в таблицах и схемах
- Полезности для ЕГЭ по химии
- Вся химия на 3 листах — краткий курс
- Теория по химии в картинках
- Шпаргалки по химииОгромная шпаргалка по химии
Для чтения шпаргалок необходимы бесплатные программы: WinDJView и Adobe Reader
СКАЧАТЬ
https://down.ctege.info/ege/obshee/shpory/himiya-ege-shpora.zip
12 сентября 2022
В закладки
Обсудить
Жалоба
Памятка по органической химии
Таблица.
pm-h.doc
pm-h.pdf
Класс | Химические свойства | Способы получения
Алканы
Алкены
Алкины
Алкадиены
Арены
Предельные одноатомные спирты
Многоатомные спирты
Альдегиды
Предельные одноосновные карбоновые кислоты
Моносахариды
Дисахариды
Полисахариды
Амины
Аминокислоты
Белки
Автор: Столярова В.А.
Таблицы на ЕГЭ и ОГЭ по химии
На сдаче ЕГЭ и ОГЭ по химии можно использовать три таблицы:
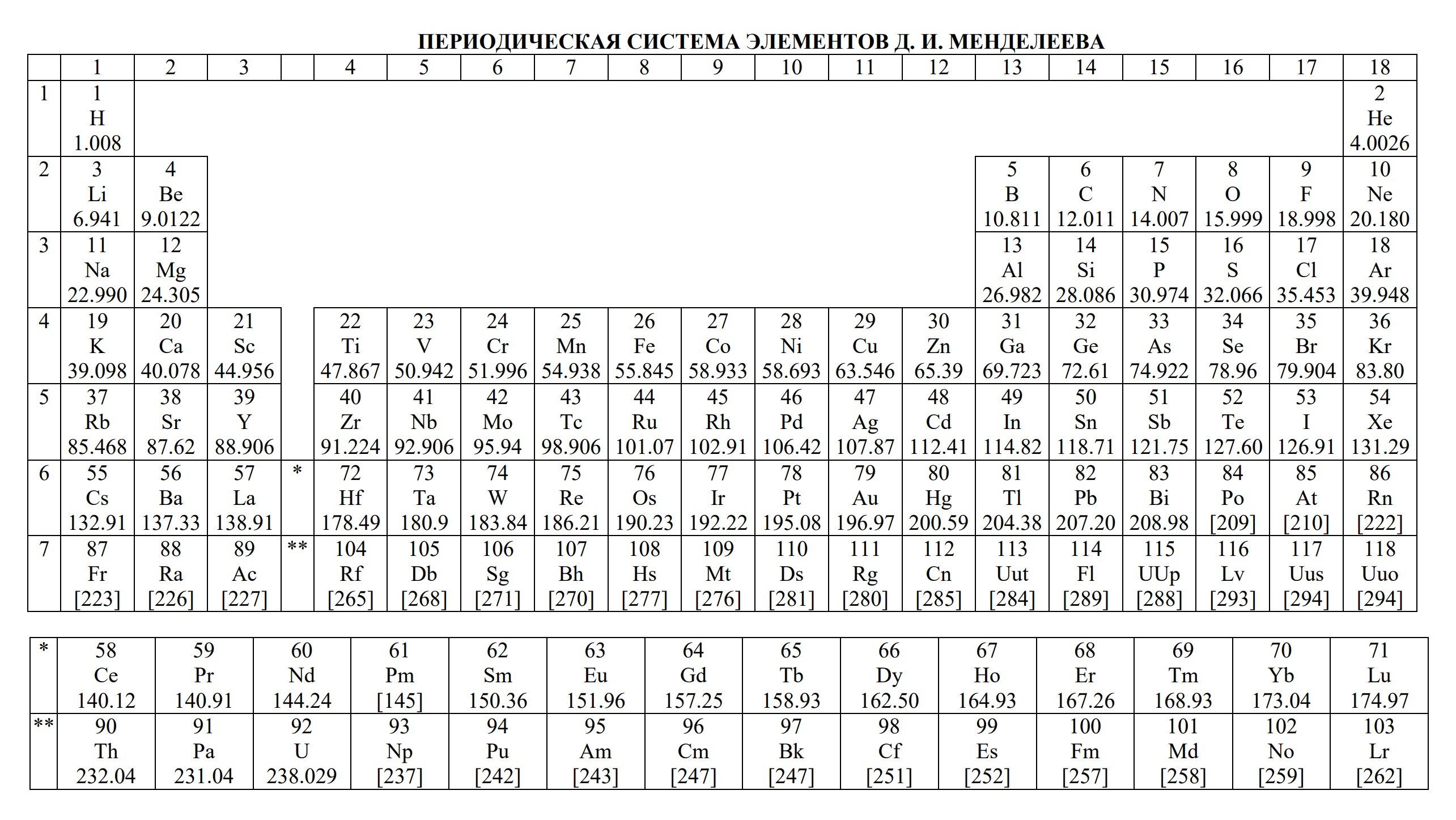
- периодическая система химических элементов Д.И. Менделеева
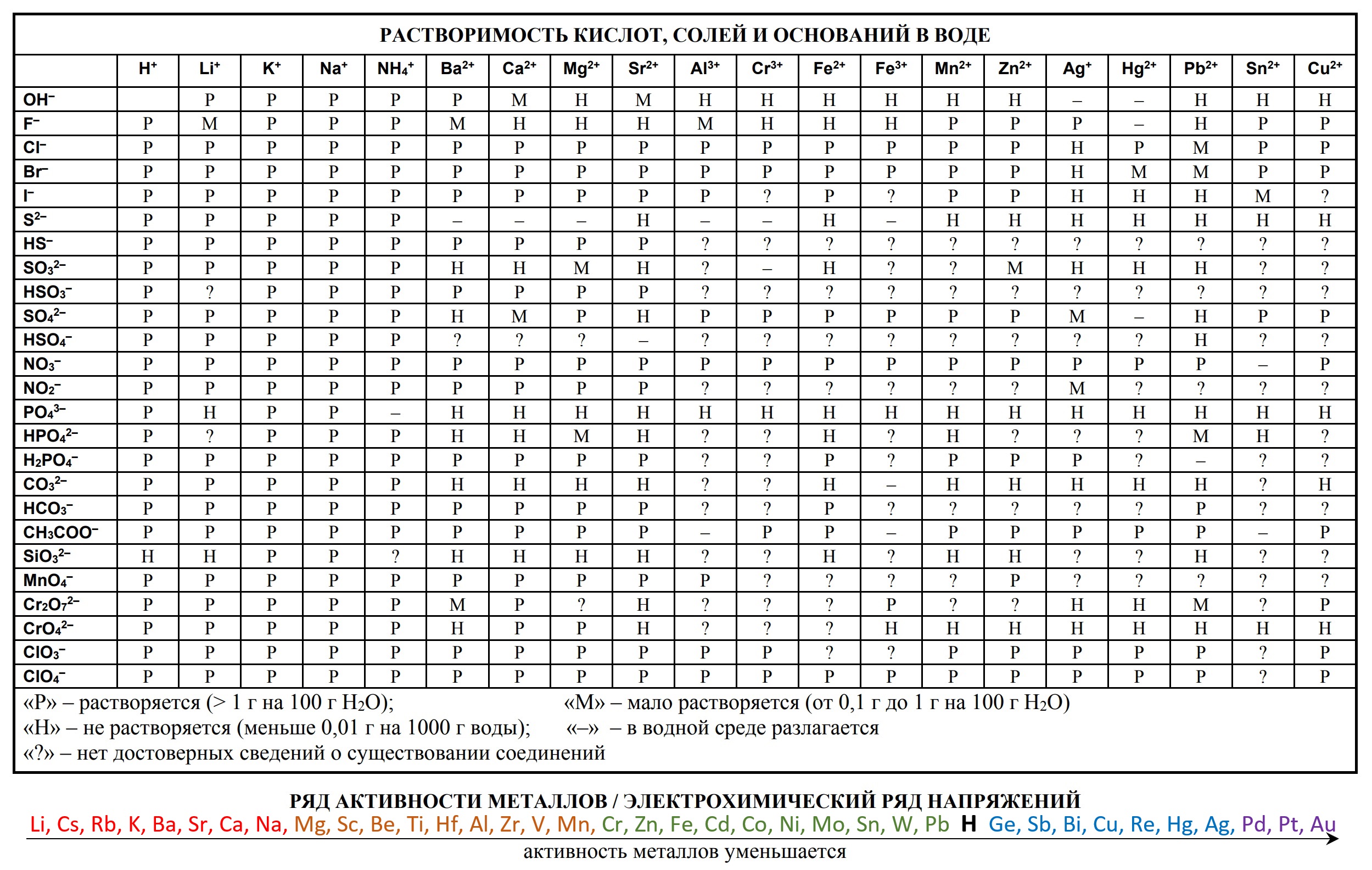
- таблица растворимости
- ряд активности металлов.
Они содержат в себе 80% информации, необходимой для решения большинства заданий.
Однако таблицы на форзацах разных учебников, продаваемые в книжных магазинах, располагающиеся на просторах интернета отличаются не только оформлением, но и содержанием. Что бы они оказались надёжно шпаргалкой, а не приятной неожиданностью, лучше с самого начала начинать работать с тем форматом, который официально разрешен на ЕГЭ твоего года.
Скачать эти таблицы можно ниже. А как сделать эти безликие таблицы наиболее информационными для тебя я расскажу на уроке.
- Таблица Д.И. Менделеева для ОГЭ и ЕГЭ
- Таблица растворимости и ряд активности для ОГЭ и ЕГЭ
- Таблица растворимости с расширенным рядом активности
- Таблица Д.И. Менделеева длиннопериодная для олимпиады
© 2007 — 2023 Сообщество учителей-предметников «Учительский портал»
Свидетельство о регистрации СМИ: Эл № ФС77-64383 выдано 31.12.2015 г. Роскомнадзором.
Территория распространения: Российская Федерация, зарубежные страны.
Учредитель / главный редактор: Никитенко Е.И.
Сайт является информационным посредником и предоставляет возможность пользователям размещать свои материалы на его страницах.
Публикуя материалы на сайте, пользователи берут на себя всю ответственность за содержание этих материалов и разрешение любых спорных вопросов с третьими лицами.
При этом администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта.
Если вы обнаружили, что на сайте незаконно используются материалы, сообщите администратору через форму обратной связи — материалы будут удалены.
Все материалы, размещенные на сайте, созданы пользователями сайта и представлены исключительно в ознакомительных целях. Использование материалов сайта возможно только с разрешения администрации портала.
Фотографии предоставлены
Все шпаргалки по химии в одном архиве
Полный архив шпаргалок по химии для подготовки к предстоящим экзаменам. Шпаргалки имеются в виде документов, а также графические. Таблицы, формулы, задачи. Органическая и неорганическая химия.
Скачать архив
Скриншот:
- 1
- 2
- 3
- 4
- 5
Оценка: 3.3 из 21
Комментарии
Всего комментариев: 0
МАОУ многопрофильный лицей №20
г. Ульяновск
Краткая памятка—шпаргалка по органической химии
(для подготовки к ЕГЭ)
Составитель Селезнева Ольга Николаевна
учитель химии
высшей категории
Алканы: 1) замещение (R
0
, + Q, в 3 стадии) + галоген(не бромная вода); + азотная кислота
2) разложение
—крекинг (+ термический крекинг метана до ацетилена)
—дегидрирование
3) изомеризация (AlCl
3
) – c бутана
4) окисление на кат—ре (метан + О
2
до формальдегида, бутан до уксусной кислоты)
Алкены: 1) присоединение (по ионному механизму с образованием карбокатиона)
+ галоген, + галогеноводород, + вода (по правилу Марковникова для несимметричных алкенов)
2) полимеризация –R
3) окисление с KMnO
4
—в нейтральной среде при комнатной t до двухатомных спиртов
—при повышенной t и в кислой среде до карбоновых кислот (кетонов) или СО
2
(с разрывом цепи по двойной связи)
—в щелочной среде до солей
4) замещение по R при 500ºС
Алкины: 1) присоединение
+галоген, + галогеноводород, + вода (до этаналя и кетонов!)
димеризация до винилацетилена
тримеризация до бензола и его гомологов
2) окисление – ацетилен до щавелевой кислоты или её соли, остальные до карбоновых кислот и СО
2
(или солей)
3) замещение для НС≡СR + Na, + [Ag(NH
3
)
2
]OH , +[Cu(NH
3
)
2
]Cl
Арены: 1) замещение
+ галоген – в присутствии kat в кольце (монохлорбензол или 2,4,6—для гомологов); на свету для гомологов – в боковой
цепи (но не с бромной водой!)
+ азотная кислота
+ монохлоралкан (алкилирование)
2) р—ии присоединения
+ водород, + хлор на свету для бензола, + алкен (алкилирование в кислой среде)
3) р—ии окисления только для гомологов бензола до бензойной кислоты или солей.
Спирты: 1) + акт. Ме до алкоголятов (метилат,этилат) (О – Н)
2) + галогеноводород (С – О)
3) дегидратация до алкена (С – О) или до простого эфира (С – О и О – Н)
4) этерификация с карбоновыми кислотами и HNO
3
, H
2
SO
4
(О – Н)
5) окисление оксидом меди (II) до альдегида (первичный спирт) или кетона (вторичный спирт)
6) для многоатомных спиртов + Cu(OH)
2
Фенол: 1) + акт. Ме 2) + щёлочь в отличие от спиртов! 3) + бромная вода 4) + HNO
3
5) FeCl
3
6) + формальдегид;
легко окисляется.
Альдегиды: 1) окисление + Cu(OH)
2
;
+ [Ag(NH
3
)
2
]OH; + KMnO
4
2) присоединение + Н
2
; + спирт; + вода; + гидросульфит натрия
3) замещение по R
4) поликонденсация – формальдегид + фенол; 5) полимеризация для метаналя и этаналя
Карбоновые кислоты: 1) общие свойства кислот + Ме до Н; + МеО; + МеОН; + аммиак; + соли более слабых кислот (карб, силик,
фенолят)
2) + спирт (этерификация)
3) замещение по R с галогенами (не с бромной водой) 4) – Н
2
О → ангидрид
Муравьиная кислота + окисление + Cu(OH)
2
;
+ [Ag(NH
3
)
2
]OH; + KMnO
4
+ разложение до СО и Н
2
О в присутствии конц. серной кислоты
+Сl
2
→ HCl + CO
Олеиновая кислота +H
2
; +Br
2
; + KMnO
4
Щавелевая кислота под действием H
2
SO
4
разлагается до СО, СО
2
, Н
2
О
Амины (основные свойства): 1) + вода для низших аминов
2) + кислота, ZnCl
2
(кислая среда)
3) + монохлоралкан
4) + HNO
2
→ спирт + азот + вода (для низших аминов)
Анилин (очень слабое основание—нейтральная среда) + бромная вода, HNO
3
; легко окисляется
Аминокислоты (амфотерные свойства): 1) + кислота 2) + щёлочь +Ме до Н; + МеОН; + соль более слабых кислот; + аммиак
3) + спирт
4) + аминокислота → пептиды (поликонденсация)
Глюкоза (свойства альдегидов и многоатомных спиртов): 1) окисление + Cu(OH)
2
при нагревании
;
+[Ag(NH
3
)
2
]OH;
2) присоединение + водород
→ сорбит
3) + кислота карбоновая, ангидрид уксусной кислоты, серная; азотная 4) + спирт
5) брожение – спиртовое, молочнокислое, маслянокислое
6) качественная реакция на многоатомные спирты с Cu(OH)
2
без нагревания!
Сахароза: 1) + Н
2
О (гидролиз)
2) + Cu(OH)
2
как многоатомный спирт без нагревания! 3) + Cа(OH)
2
4) + кислота карбоновая, серная, азотная
Целлюлоза и крахмал: 1) + вода (гидролиз)
2) + карбоновая кислота или ангидрид, + серная кислота, + азотная кислота
3) крахмал + йод → синее окрашивание
Белки: 1) гидролиз; 2) ксантопротеиновая реакция с HNO
3
– жёлтое окрашивание; 3) биуретовая реакция с CuSO
4
и NaOH –
фиолетовое окрашивание
Список литературы:
1. Д.Д. Дзудцова, Л.Б. Бестаева «Окислительно—восстановительные реакции» — Москва,
«Дрофа», 2005
2. Н. Кузьменко, В. Еремин, В. Попков «Химия для школьников старших классов и
поступающих в вузы» — Москва, «Дрофа», 1999
3. Р.А. Лидин, Л. Ю. Аликберова «Справочник для старшеклассников и поступающих в вузы»
— Москва, «Аст—пресс»,2012
4. В.М. Потапов «Органическая химия» — Москва, «Просвещение», 1983
5. «Органическая химия» под редакцией Тюкавкиной – Москва, «Медицина». 1989
Справочное пособие предназначено учащимся общеобразовательных школ. В наглядных таблицах и схемах изложен материал школьной программы по органической химии, который можно использовать для подготовки к урокам, контрольным и самостоятельным работам.А также для абитуриентов при подготовке к экзаменам.
Теория химического строения органических веществ А.М. Бутлерова
Типы химических реакций в органической химии
Органические вещества
Классификация органических веществ
Валентные состояния атома углерода
Изомерия органических веществ
Природные источники углеводородов
Алканы. Химические свойства. Получение. Применение
Алканы. Номенклатура. Изомерия. Физические свойства
Алкены. Номенклатура. Изомерия.
Алкены. Химические свойства. Получение. Применение
Алкины. Номенклатура. Изомерия
Алкины. Химические свойства. Получение. Применение
Алкадиены. Классификация. Номенклатура. Изомерия
Алкадиены. Химические свойства. Получение. Применение
Арены
Толуол
Спирты. Номенклатура. Классификация. Изомерия
Спирты. Физические и химические свойства. Получение Применение
Фенолы
Альдегиды
Карбоновые кислоты. Номенклатура. Классификация. Изомерия. Физические свойства
Карбоновые кислоты. Химические свойства. Получение. Применение
Сложные эфиры. Жиры
Углеводы
Моносахариды
Полисахариды
Амины
Аминокислоты
Белки
Нуклеиновые кислоты
Полимеры
По материалам учебного пособия авторов-составителей: Коноплева О. А. (математика), Соболева С. А. (физика), Левина Э. М. (химия), Гусева И. Ю. (информатика), Жеребцова Е. Л. (биология). «Весь курс школьной программы в схемах и таблицах: математика, физика, химия, информатика, биология».