поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,623 -
гуманитарные
33,648 -
юридические
17,917 -
школьный раздел
611,569 -
разное
16,897
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Качественные реакции органической химии.
1. Качественная реакция на алканы. Определить, что какое-то вещество в смеси или в чистом виде алкан, несложно. Для этого газ либо поджигают — горение алканов сопровождается синим пламенем, либо пропускают через раствор перманганата калия. Алканы не окисляются перманганатом калия на холоду, вследствие этого раствор не будет изменять окраску.
2. Качественная реакция на алкены. Чтобы убедиться в наличии алкена, нужно пропустить его в раствор перманганата калия (реакция Вагнера). В ходе реакции раствор обесцветится, выпадает бурый диоксид марганца MnO2 (реакция на примере этилена):
3C2H4 + 2KMnO4 + 4H2O ——> 3CH2OH-CH2OH + 2KOH + 2MnO2↓
Так же, алкены обесцвечивают бромную воду:
C2H4 + Br2 ——> C2H4Br2
Бромная вода обесцвечивается, образуется дибромпроизводное.
3. Качественная реакция на алкины. Алкины можно выявить и по реакции Вагнера или с помощью бромной воды:
3C2H2 + 8KMnO4 ——> 3KOOC-COOK + 8MnO2↓ + 2KOH + 2H2O
C2H2 + 2Br2 —-> C2H2Br4
Алкины с тройной связью у крайнего атома углерода реагируют с аммиачным раствором оксида серебра (гидроксид диаминсеребра (I)) (реактив Толленса):
C2H2 + 2[Ag(NH3)2]OH ——-> Ag2C2↓ + 4NH3↑ + 2H2O
Получившийся ацетиленид серебра (I) выпадает в осадок.
Алкины, у которых тройная связь в середине (R-C-=C-R) в эту реакцию невступают.
Такая способность алкинов — замещать протон на атом металла, подобно кислотам — обусловлено тем, что атом углерода находится в состоянии sp-гибридизации и электроотрицательность атома углерода в таком состоянии такая же, как у азота. Вследствие этого, атом углерода сильнее обогощается электронной плотностью и протон становится подвижным.
4. Качественная реакция на альдегиды. Одна из самых интересных качественных реакций в органической химии — на альдегиды, предназначена исключительно для выявления соединений, содержащих альдегидную группу. К альдегиду приливают аммиачный раствор оксида серебра, реакция идет при нагревании:
CH3-CHO + 2[Ag(NH3)2]OH —t—> CH3-COOH + 2Ag↓ + 4NH3↑ + H2O
Если опыт проведен грамотно, то выделяющееся серебро покрывает колбу ровным слоем, создавая эффект зеркала. Именно поэтому реакция называется реакцией серебряного зеркала.
Примечание: реакцией серебряного зеркала также можно выявить метановую (муравьиную) кислоту HCOOH. При чем тут кислота, если мы говорим про альдегиды? Все просто: муравьиная кислота — единственная из карбоновых кислот, содержащая одновременно альдегидную и карбоксильную группы:
В ходе реакции метановая кислота окисляется до угольной, которая разлагается на углекислый газ и воду:
HCOOH + 2[Ag(NH3)2]OH —t—> CO2↑ + 2H2O + 4NH3↑ + 2Ag↓
Помимо реакции серебряного зеркала существует также реакция с гидроксидом меди (II) Cu(OH)2. Для этого к свежеприготовленному гидроксиду меди (II) добавляют альдегид и нагревают смесь:
CuSO4 + 2NaOH ——> Na2SO4 + Cu(OH)2↓
CH3-CHO + 2Cu(OH)2 —t—> CH3-COOH + Cu2O↓ + 2H2O
Выпадает оксид меди (I) Cu2O — осадок красного цвета.
Еще один метод определения альдегидов — реакция с щелочным раствором тетраиодомеркурата (II) калия, известный нам из предыдущей статьи как реактив Несслера:
CH3-CHO + K2[HgI4] + 3KOH ——> CH3-COOK + Hg↓ + 4KI + 2H2O
При добавлении альдегида к раствору фуксинсернистой кислоты раствор окрашивается в светло-фиолетовый цвет.
5. Качественные реакции на спирты. Спирты по количеству гидроксильных групп бывают одно-, двух-, многоатомными. Для одно- и многоатомных реакции различны.
Качественные реакции на одноатомные спирты:
Простейшая качественная реакция на спирты — окисление спирта оксидом меди. Для этого пары спирта пропускают над раскаленным оксидом меди. Затем полученный альдегид улавливают фуксинсернистой кислотой, раствор становится фиолетовым:
CH3-CH2-OH + CuO —t—> CH3-CHO + Cu + H2O
Спирты идентифицируются пробой Лукаса — конц. раствор соляной кислоты и хлорида цинка. При пропускании вторичного или третичного спирта в такой раствор образуется маслянистый осадок соответствующего алкилхлорида:
CH3-CHOH-CH3 + HCl —ZnCl2—> CH3-CHCl-CH3↓ + H2O
Первичные спирты в реакцию не вступают.
Еще одним известным методом является иодоформная проба:
CH3-CH2-OH + 4I2 + 6NaOH ——> CHI3↓ + 5NaI + HCOONa + 5H2O
Качественные реакции на многоатомные спирты.
Наиболее известная качественная реакция на многоатомные спирты — взаимодействие их с гидроксидом меди (II). Гидроксид растворяется, образуется хелатный комплекс темно-синего цвета. Обратите внимание на то, что в отличии от альдегидов многоатомные спирты реагируют с гидроксидом меди (II) без нагревания. К примеру, при приливании глицерина образуется глицерат меди (II):
6. Качественные реакции на карбоновые кислоты. На карбоновые кислоты обычно подчеркивают образование цветных осадков с тяжелыми металлами. Но наиболее осуществимая качественная реакция на метановую кислоту HCOOH. При добавлении концентрированной серной кислоты H2SO4 к раствору муравьиной кислоты образуется угарный газ и вода:
HCOOH —H2SO4—> CO↑ + H2O
Угарный газ можно поджечь. Горит синем пламенем:
2CO + O2 —t—> 2CO2
Из многоосновных кислот рассмотрим качественную реакцию на щавелевую H2C2O4(HOOC-COOH). При добавлении к раствору щавелевой кислоты раствор соли меди (II) выпадет осадок оксалата меди (II):
Cu2+ + C2O42- ——> CuC2O4↓
Щавелевая кислота также, как и муравьиная, разлагается концентрированной серной кислотой:
H2C2O4 —-H2SO4—> CO↑ + CO2↑ + H2O
7. Качественные реакции на амины. На амины качественных реакций нет (за исключением анилина). Можно доказать наличие амина окрашиванием лакмуса в синий цвет. Если же амины нельзя выявить, то можно различить первичный амин от вторичного путем взаимодействия с азотистой кислотой HNO2. Для начала нужно ее приготовить, а затем добавить амин:
NaNO2 + HCl ——> NaCl + HNO2
Первичные дают азот N2:
CH3-NH2 + HNO2 ——> CH3-OH + N2↑ + H2O
Вторичные — алкилнитрозоамины — вещества с резким запахом (на примере диметилнитрозоамина):
CH3-NH-CH3 + HNO2 ——> CH3-N(NO)-CH3 + H2O
Третичные амины в мягких условиях с HNO2 не реагируют.
Анилин образует осадок при добавлении бромной воды:
C6H5NH2 + 3Br2 ——> C6H2NH2(Br)3↓ + 3HBr
Анилин также можно обнаружить по сиреневой окраске при добавлении хлорной извести.
8. Качественные реакции на фенол. Фенол лучше всего обнаруживает хлорид железа (III) — образуется фиолетовое окрашивание раствора. Это лучший метод обнаружения фенола, т.к. реакция очень чувствительна.
Также фенол наряду с анилином дает осадок желтоватого цвета при пропускании в водный раствор брома — 2,4,6 — трибромфенол:
C6H5OH + 3Br2 ——> C6H2OH(Br)3↓ + 3HBr
Фенолы дают фенол-альдегидные смолы при реакции с альдегидом в кислой среде. При этом образуются мягкие пористые массы фенол-альдегидных смол (реакция поликонденсации).
9. Качественная реакция на алкилхлориды. Вещества, содержащие хлор, могут окрашивать пламя в зеленый цвет. Для этого нужно обмакнуть медную проволоку в алкилхлориде и поднести к пламени (проба Бельштейна).
10. Качественная реакция на углеводы. Большинство углеводов имеют альдегидные и гидроксильные группы, поэтому для них характерны все реакции альдегидов и многоатомных спиртов.
Существует способ, который помогает различить глюкозу от фруктозы — проба Селиванова. Для того, чтобы различить эти углеводы, к ним приливают смесь резорцина и соляной кислоты. Реагирует со смесью фруктоза, при этом раствор окрашивается в малиновый цвет.
Крахмал в присутствии иода окрашивается в темно-синий цвет. При нагревании окраска исчезает, при охлаждении появляется вновь.
11. Качественная реакция на белки. Белки выявляются в основном на реакциях, основанных на окрасках.
Ксантопротеиновая реакция. Данная реакция обнаруживает ароматические аминокислоты, входящие в белки (на примере тирозина):
(OH)C6H4CH(NH2)COOH + HNO3 —-H2SO4——> (OH)C6H3(NO2)CH(NH2)COOH↓ + H2O — выпадает осадок желтого цвета.
(OH)C6H3(NO2)CH(NH2)COOH + 2NaOH ——-> (ONa)C6H3(NO2)CH(NH2)COONa + H2O — раствор становится оранжевым.
Обнаружение серосодержащих аминокислот:
Белок + (CH3COO)2Pb —NaOH—> PbS↓ (осадок черного цвета).
Биуретовая реакция для обнаружения пептидной связи (CO-NH):
Белок + CuSO4 + NaOH ——> красно-фиолетовое окрашивание.
Спецефический запах при горении:
Белок —-обжиг—-> запах паленой шерсти.

Силикагель является высокопористым телом, образованным мельчайшими сферическими частицами, по химическому составу — двуокисью кремния SiO2 (кремнезёмом). По внешнему виду представляет собой зерна или шаровидные гранулы.
Структурная формула:
Физические свойства: температура плавления +1610°С; точка кипения + 2950°С; растворимость в воде 149мг/100мл; растворимость в жирах — нет. В большинстве обычно применяемых органических растворителей и кислотах (кроме плавиковой, с которой реагирует) практически не растворяется. Водородный показатель силикагеля составляет рН 6-7. Без запаха, не летуч, нет продуктов разложения, не самовоспламеняется. Температура регенерации 110-200 °С
Способы получения:
Получается при подкислении водных растворов силикатов щелочных металлов с последующей промывкой от соли щелочного металла и высушиванием образовавшегося геля, например:
Na2SiO3 + 2HCl → 2NaCl + H2SiO3↓
Обезвоживанием концентрированных золей коллоидного кремнезёма:
H2SiO3 → SiO2 + H2O
Гидролизом соединений кремния, например, тетрахлорида кремния или разложением сложных эфиров ортокремниевой кислоты.
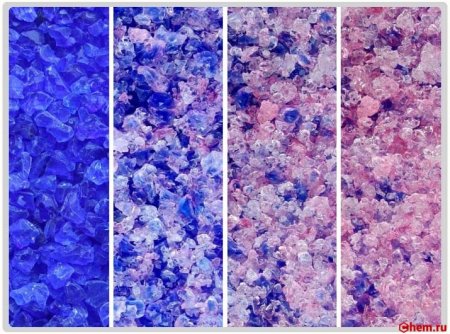
При изготовлении некоторых марок силикагеля в него добавляют в небольшом количестве цветовые индикаторы влажности, — вещества, изменяющие свой цвет при изменении степени гидратации. Обычно в качестве такого вещества используют соли двухвалентного кобальта, например, хлорид кобальта. В обезвоженном состоянии эта соль имеет темно-синий цвет, при гидратации изменяет цвет на светло-розовый.
Также в качестве цветового индикатора влажности используют органический краситель — метилвиолет, который при изменении влажности изменяет цвет от зелёного до оранжевого или бесцветного.
В качестве индикатора влажности, зёрна индикаторного силикагеля добавляют в небольшом количестве к зёрнам обычного, неокрашенного силикагеля.
Цветовые индикаторы небезопасны, так, хлорид кобальта токсичен и является канцерогеном. Имеются сведения, что и метилвиолет может являться канцерогеном, но он менее вреден и допускается для применения даже в медицине.
Силикагель
Гранулы сухого силикагеля
Силикагель — высушенный гель, образующийся из перенасыщенных растворов кремниевых кислот (nSiO2·mH2O) при pH > 5—6.
Применяется как твёрдый гидрофильный сорбент.
Содержание
- 1 Получение
- 2 Цветовые индикаторы влажности
- 3 Адсорбционные свойства
- 4 Классификация и марки силикагелей
- 5 Применение
- 6 Техника безопасности
Силикагель индикатор
Силикагель индикатор (импортный)
Получение
Получается при подкислении водных растворов силикатов щелочных металлов с последующей промывкой от соли щелочного металла и высушиванием образовавшегося геля, например:
- Na2SiO3 + 2HCl → 2NaCl + H2SiO3↓
Обезвоживанием концентрированных золей коллоидного кремнезёма:
- H2SiO3 → SiO2 + H2O
Гидролизом соединений кремния, например, тетрахлорида кремния или разложением сложных эфиров ортокремниевой кислоты.
Цветовые индикаторы влажности
Гранулы силикагеля с индикатором влажности — хлоридом кобальта.
Пакетик с силикагелем к которому добавлены зёрна индикаторного силикагеля
При изготовлении некоторых марок силикагеля в него добавляют в небольшом количестве цветовые индикаторы влажности, — вещества, изменяющие свой цвет при изменении степени гидратации. Обычно в качестве такого вещества используют соли двухвалентного кобальта, например, хлорид кобальта. В обезвоженном состоянии эта соль имеет темно-синий цвет, при гидратации изменяет цвет на светло-розовый.
Также в качестве цветового индикатора влажности используют органический краситель — метилвиолет, который при изменении влажности изменяет цвет от зелёного до оранжевого или бесцветного.
В качестве индикатора влажности, зёрна индикаторного силикагеля добавляют в небольшом количестве к зёрнам обычного, неокрашенного силикагеля.
Цветовые индикаторы небезопасны, так, хлорид кобальта токсичен и является канцерогеном. Имеются сведения, что и метилвиолет может являться канцерогеном, но он менее вреден и допускается для применения даже в медицине.
Адсорбционные свойства
Силикагель имеет огромную площадь поверхности (до 1000 м²/1 г), состоящую из групп —SiOH, расположенных на расстоянии 0,5 нм друг от друга. Эти группы являются активными центрами, причём активность конкретной марки силикагеля зависит от числа и активности таких центров. В активном адсорбенте, то есть таком, из которого удалена адсорбированная на его поверхности вода, многие центры будут активны. Такая активация происходит при нагревании геля до 150—200 °C.
При нагревании до более высокой температуры в интервале 200—400 °C адсорбционная активность теряется в результате образования связей Si-O, происходящего с отщеплением воды. Этот процесс обратим. При нагревании выше 400 °C площадь сорбирующей поверхности силикагеля необратимо уменьшается.
Активные центры взаимодействуют с полярными растворёнными веществами главным образом за счёт образования водородных связей.
Классификация и марки силикагелей
Силикагель
Согласно ГОСТ 3956-76 силикагели классифицируются по:
- форме зёрен (гранулированные или кусковые);
- размерам зёрен (крупные и мелкие);
- размерам пор (крупнопористые и мелкопористые).
Принято четырёхбуквенное обозначение марки силикагеля согласно ГОСТ 3956-76.
- 1-я буква характеризует размер гранул (К — крупный, М — мелкий, А — активированный, Ш — шихтовый);
- 2-я буква всегда С (силикагель);
- 3-я буква размер пор (К — крупнопористый, М — мелкопористый);
- 4-я буква форма частиц (Г — гранулированный, К — кусковой).
Силикагель индикатор ГОСТ 8984-75
Товарный силикагель обычно выпускают в виде зёрен или шаровидных гранул размером от 5—7 до 10−2 мм. Различные марки силикагелей имеют средний эффективный диаметр пор 20—150Å и удельную поверхность 100—1000 м²/г.
Также существуют гидрогели (аквагели), в которых поры заполнены водой, алкогели (спиртовые гели), ксерогели, в которых из геля удалены любые жидкости, аэрогели (высушенные в автоклаве при нагревании выше критической точки).
Существуют силикагели специального назначения, например, силикагель-индикатор влажности (пропитанный солями кобальта, по мере впитывания влаги и снижения активности гранулы изменяют окраску с голубой на розовую), силикагели для хроматографии, силикагели для бытовых холодильников и ряд других марок.
Изменение цвета силикагель индикатор
Изменение цвета силикагель индикатор (импортный)
Применение
Основное применение силикагели находят при осушке различных газов — воздуха, углекислого газа, водорода, кислорода, азота, хлора и других промышленных газов (например, в осушителях сжатого воздуха).
Способность силикагеля поглощать значительное количество воды используется для осушки различных жидкостей, в особенности, в том случае, когда в обезвоживаемой жидкости плохо растворяется вода (например, сушка галогенированных органических жидкостей типа фреонов).
Силикагели служат также осушителями при консервации оборудования для предохранения его от коррозии.
Наряду с водой силикагели хорошо поглощают пары многих органических веществ. Этим его свойством пользуются для улавливания (рекуперации) паров бензина, бензола, эфира, ацетона и т. п. из воздуха, бензола, из газовых коксовых печей и бензина из природных газов.
Свойство силикагеля поглощать многие вещества из жидкой фазы используют в промышленной очистке различных масел, удаления серы из продуктов дистилляции нефти и для удаления из нефти высокополимерных смолистых веществ.
Также силикагель используют как адсорбент для наполнения хроматографических колонок в хроматографии, как поглотитель воды (осушитель) органических растворителей, адсорбционной очистки неполярных жидкостей; для разделения спиртов, аминокислот, витаминов, антибиотиков и др.). Крупнопористые силикагели применяются как носители катализаторов.
Также силикагель хорошо адсорбирует атомы радона и его изотопов.
В быту силикагель широко используется для производства наполнителей для кошачьих туалетов.
Обычно силикагелем наполняют какую-либо газопроницаемую или перфорированную оболочку, например, пластиковые пакетики — осушители. Осушители до их использования хранят в герметичной таре для предотвращения поглощения ими влаги из воздуха. Осушители начинают действовать сразу же, как только их вынимают из влагонепроницаемой защитной упаковки, поэтому они должны оставаться в герметичной таре как можно дольше.
Для повышения эффективности осушителей их целесообразнее всего, по возможности, свободно подвешивать в верхней части упаковки с изделием. Желательно, чтобы упаковка изделия или товара была герметична. Также выпускаются «контейнерные осушители» — осушители с большим количествам силикагеля из-за большой массы относительно поверхности осушителя оно действуют медленнее, что увеличивает срок службы осушителя до насыщения влагой и потери им осушающих свойств.
Нормы закладки «контейнерных осушителей» при перевозке товара, чувствительного к влажности, устанавливают примерно из расчета 1 кг на 1 м³ объема транспортной тары. При перевозке и хранении продукции, изделий в тропическом влажном климате нормы закладки силикагеля в осушителях должны быть соответственно увеличены в 3,5 раза.
Техника безопасности
Силикагель пожаро- и взрывобезопасен, по степени воздействия на организм относится к веществам 3-го класса опасности. Пыль силикагеля содержит от 10 до 70 % свободного диоксида кремния при хроническом вдыхании такой пыли возможно развитие болезни лёгких — силикоза. Поэтому при регулярной работе с силикагелем рекомендуют использовать индивидуальные средства защиты органов дыхания от пыли.
Силикагель с цветовым индикатором влажности может содержать хлорид кобальта(II), который токсичен и является канцерогеном.
OBRAZOVALKA.COM
OBRAZOVALKA.COM — образовательный портал
Наш сайт это площадка для образовательных консультаций, вопросов и ответов для школьников и студентов .
На вопросы могут отвечать также любые пользователи, в том числе и педагоги.
Консультацию по вопросам и домашним заданиям может получить любой школьник или студент.
From Wikipedia, the free encyclopedia
«Do not eat» redirects here. For the packet found in foods, see oxygen scavenger.

|
|
| Identifiers | |
|---|---|
|
CAS Number |
|
| ChemSpider |
|
| ECHA InfoCard | 100.065.880 |
| UNII |
|
|
CompTox Dashboard (EPA) |
|
| Properties | |
|
Chemical formula |
SiO2 |
| Molar mass | 60.08 g/mol |
| Appearance | Transparent beads |
| Odor | Odorless |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Silica gel is an amorphous and porous form of silicon dioxide (silica), consisting of an irregular tridimensional framework of alternating silicon and oxygen atoms with nanometer-scale voids and pores. The voids may contain water or some other liquids, or may be filled by gas or vacuum. In the last case, the material is properly called silica xerogel.
Silica xerogel with an average pore size of 2.4 nanometers has a strong affinity for water molecules and is widely used as a desiccant. It is hard and translucent, but considerably softer than massive silica glass or quartz; and remains hard when saturated with water.
Silica xerogel is usually commercialized as coarse granules or beads, a few millimeters in diameter. Some grains may contain small amounts of indicator substance that changes color when they have absorbed some water. Small paper envelopes containing silica xerogel pellets, usually with a «do not eat» warning, are often included in dry food packages to absorb any humidity that might cause spoilage of the food.
‘Wet’ silica gel, as may be freshly prepared from alkali silicate solutions, may vary in consistency from a soft transparent gel, similar to gelatin or agar, to a hard solid, namely a water-logged xerogel. It is sometimes used in laboratory processes, for example to suppress convection in liquids or prevent settling of suspended particles.[4]
History[edit]
Silica gel was in existence as early as the 1640s as a scientific curiosity.[5] It was used in World War I for the adsorption of vapors and gases in gas mask canisters.[6] The synthetic route for producing silica gel was patented in 1918 by Walter A. Patrick, a chemistry professor at Johns Hopkins University.
In World War II, silica gel was indispensable in the war effort for keeping penicillin dry, protecting military equipment from moisture damage,[citation needed] as a fluid cracking catalyst for the production of high octane gasoline, making carbon disulphide, and as a catalyst support for the manufacture of butadiene from ethanol (feedstock for synthetic rubber production).
Types[edit]
- Type A – clear pellets, approximate pore diameter: 2.5 nm, drying and moistureproof properties, can be used as catalyst carriers, adsorbents, separators and variable-pressure adsorbent.
- Type B – translucent white pellets, pore diameter: 4.5–7.0 nm, liquid adsorbents, drier and perfume carriers, also may be used as catalyst carriers, cat litter.
- Type C – translucent, micro-pored structure, raw material for preparation of silica gel cat litter. Additionally dried and screened, it forms macro-pored silica gel which is used as drier, adsorbent and catalyst carrier.
Silica alumina gel — light yellow, chemically stable, flame-resistant, insoluble except in alkali or hydrofluoric acid. Superficial polarity, thermal stability, performance greater than fine-pored silica gel.
Stabilizing silica gel — non-crystalline micro-porous solid powder, nontoxic, flame-resisting, used in brewery of grains for beer to improve taste, clearness, color, and foam and for removal of non-micro-organism impurities.
Properties[edit]
Silica gel’s high specific surface area (around 750–800 m2/g (230,000–240,000 sq ft/oz))[7] allows it to adsorb water readily, making it useful as a desiccant (drying agent). Silica gel is often described as «absorbing» moisture, which may be appropriate when the gel’s microscopic structure is ignored, as in silica gel packs or other products. However, material silica gel removes moisture by adsorption onto the surface of its numerous pores rather than by absorption into the bulk of the gel.
Silica gel is able to adsorb up to 37% of its own weight in moisture in high humidity environments.[8] This moisture can be released upon heating at 120°C for extended periods of time. This makes it reusable multiple times with very little, if any, loss of efficiency.
Regeneration[edit]
Once saturated with water, the gel may be regenerated by heating it to 120 °C (248 °F) for 1–2 hours.[9] Some types of silica gel will «pop» when exposed to enough water. This is caused by breakage of the silica spheres when contacting the water.[10]
Preparation[edit]
An aqueous solution of sodium silicate is acidified to produce a gelatinous precipitate that is washed, then dehydrated to produce colorless silica gel.[7] When a visible indication of the moisture content of the silica gel is required, ammonium tetrachlorocobaltate(II) (NH4)2[CoCl4] or cobalt(II) chloride CoCl2 is added.[7] This will cause the gel to be blue when dry and pink when hydrated.[7] Due to link between the cancer and cobalt chloride, it has been forbidden in Europe for use in silica gel.[11] An alternative indicator is methyl violet which is orange when dry and green when hydrated.
Uses[edit]
Desiccant[edit]
Silica gel, as beads packed in a permeable bag, is a commonly used desiccant.
In many items, moisture encourages the growth of mold and spoilage. Condensation may also damage other items such as electronics and may speed the decomposition of chemicals, such as those in vitamin pills. Through the inclusion of silica gel packets, these items can be preserved longer. It may aid the drying out of electronic equipment during attempts to restore items that have been exposed to moisture accidentally.
Silica gel may also be used to keep the relative humidity inside a high frequency radio or satellite transmission system waveguide as low as possible (see also humidity buffering). Excessive moisture buildup within a waveguide can cause arcing inside the waveguide itself, damaging the power amplifier feeding it. Also, the beads of water that form and condense inside the waveguide change the characteristic impedance and frequency, degrading the signal. It is common for a small compressed air system (similar to a small home aquarium pump) to be employed to circulate the air inside the waveguide over a jar of silica gel.
Silica gel can adsorb about 40 percent of its weight in moisture and can take the relative humidity in a closed container down to about 40 percent. Once saturated, you can propel the moisture off and reuse silica gel by heating it above 300 degrees F (150 C).[12]
Silica gel is also used to dry the air in industrial compressed air systems. Air from the compressor discharge flows through a bed of silica gel beads. The silica gel adsorbs moisture from the air, preventing damage at the point of use of the compressed air due to condensation or moisture. The same system is used to dry the compressed air on railway locomotives, where condensation and ice in the brake air pipes can lead to brake failure.
Prior to widespread use of air-conditioning, salt shakers with caps containing silica gel beads to keep the salt dry enough to prevent clumping were marketed in the USA, replacing the practice of including a few grains of rice in salt shakers to effect the same drying.
Silica gel is sometimes used as a preservation tool to control relative humidity in museum and library exhibitions and storage.
Other applications include diagnostic test strips, inhalation devices, syringes, drug test kits, and hospital sanitation kits.
Chemistry[edit]
In chemistry, silica gel is used in chromatography as a stationary phase. In column chromatography, the stationary phase is most often composed of silica gel particles of 40–63 μm. Different particle sizes are used for different kinds of column chromatography as the particle size is related to surface area. The differences in particle size dictate if the silica gel should be used for flash or gravity chromatography. In this application, due to silica gel’s polarity, non-polar components tend to elute before more polar ones, hence the name normal phase chromatography. However, when hydrophobic groups (such as C18 groups) are attached to the silica gel then polar components elute first and the method is referred to as reverse phase chromatography. Silica gel is also applied to aluminium, glass, or plastic sheets for thin layer chromatography.
The hydroxy (OH) groups on the surface of silica can be functionalized to afford specialty silica gels that exhibit unique stationary phase parameters. These so-called functionalized silica gels are also used in organic synthesis and purification as insoluble reagents and scavengers.
Chelating groups have also been covalently bound to silica gel. These materials have the ability to remove metal ions selectively from aqueous solutions. Chelating groups can be covalently bound to polyamines that have been grafted onto a silica gel surface producing a material of greater mechanical integrity. Silica gel is also combined with alkali metals to form a M-SG reducing agent. (See SiGNa chemistry)
Silica gel is not expected to biodegrade in either water or soil.[13]
Cat litter[edit]
Silica gel is also used as cat litter,[14] by itself or in combination with more traditional materials, such as clays including bentonite. It is non-tracking and virtually odorless.
Food additive[edit]
Silica gel, also referred to as silicon dioxide or synthetic amorphous silica (SAS), is listed by the FDA in the United States as generally recognized as safe (GRAS), meaning it can be added to food products without needing approval. Silica is allowed to be added to food in the USA at up to 2% as permitted under 21 CFR 172.480. In the EU, it can be in up to 5% concentrations.[15] In 2018, a re-evaluation by the EFSA Panel on Food Additives and Nutrient Sources added to Food found no indications of toxicity even at the highest estimates of exposure level.[16]
Listed uses include: anticaking agent, defoaming agent, stabilizer, adsorbent, carrier, conditioning agent, chillproofing agent, filter aid, emulsifying agent, viscosity control agent, and anti-settling agent.[17] Silica can be found commonly in foods including baked goods, spices and herbs, dairy products, cocoa products, and more.[18]
Water filtration[edit]
Given the water adsorption properties of silica gel, it is used in domestic water filters.[19] The surface structure of silica gel allows the adsorption of some minerals that are dissolved in the water,[20] or «Ion-exchange» as it is marketed. Due to the lack of regulations for domestic water filtration products, no studies validate the manufacturer claims regarding the effectiveness of the filtration system.
Humidity indicator (color-changing silica gel)[edit]
Silica gel may be doped with a moisture indicator that gradually changes its color when it transitions from the anhydrous (dry) state to the hydrated (wet) state. Common indicators are cobalt(II) chloride and methyl violet. Cobalt (II) chloride is deep blue when dry and pink when wet, but it is toxic and carcinogenic, and was reclassified by the European Union in July 2000 as a toxic material.[21] Methyl violet may be formulated to change from orange to green, or orange to colorless. It also is toxic and potentially carcinogenic,[22] but is safe enough to have medicinal uses. A more ecologically friendly indicator solution is ferric ammonium sulfate, which results in a color change from deep orange/amber when dry to colorless/white when saturated.[23]
Hazards[edit]
Silica gel is non-toxic, non-flammable, and non-reactive and stable with ordinary usage. It will react with hydrogen fluoride, fluorine, oxygen difluoride, chlorine trifluoride, strong acids, strong bases, and oxidizers.[13] Silica gel is irritating to the respiratory tract and may cause irritation of the digestive tract. Dust from the beads may cause irritation to the skin and eyes, so precautions should be taken.[24] Crystalline silica dust can cause silicosis, but synthetic amorphous silica gel is indurated so does not cause silicosis. Additional hazards may occur when doped with a humidity indicator.
References[edit]
- ^ Silica gel, site www.jtbaker.com
- ^ Silica gel, site www.chemcas.org
- ^ Silicon dioxide, site echa.europa.eu
- ^ H.K. Henisch (1988): Crystals in Gels and Liesegang Rings. Cambridge University Press. ISBN 0521345030
- ^ Maryann Feldman and Pierre Desrochers (March 2003). «Research Universities and Local Economic Development: Lessons from the History of the Johns Hopkins University» (PDF). Industry and Innovation. 10 (1): 5–24. doi:10.1080/1366271032000068078. S2CID 154423229. Archived from the original (PDF) on 2005-11-12.
- ^ http://hengyeusa.com/community/desiccants-at-war
- ^ a b c d Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Chandradhas, Susheel (27 August 2016). «How To Recharge Silica Gel Crystals». Beyond Photo Tips. Beyond Photo Tips. Retrieved 2 November 2022.
- ^ How To Dry Silica Gel, Susheel Chandradhas, beyondphototips.com
- ^ Spence Konde, «Preparation of High-Silica Zeolite Beads From Silica Gel,» retrieved 2011-09-26
- ^ «Blue Silicagel & Conclusions: Safety information on blue silicagel». Archived from the original on 2016-01-05.
- ^ «What is silica gel and why do I find little packets of it in everything I buy?». HowStuffWorks. 2000-04-01. Retrieved 2022-11-29.
- ^ a b Environmental Health and Safety (2007-09-10). «Silica Gel». Retrieved 2008-01-12.
- ^ Andrew Kantor (2004-12-10). «Non-Tech High Tech Litters the Landscape». USA Today. Retrieved 2008-03-02.
- ^ «Notification of the GRAS Determination of Silicon Dioxide When Added Directly or Indirectly to Human Food» (PDF). Archived from the original (PDF) on April 18, 2013.
- ^ [M. Younes, P. Aggett, F. Aguilar (2018). «Scientific Opinion on the re-evaluation of silicon dioxide (E 551) as a food additive». EFSA Journal. 16 (1): 5088, 70pp. doi:10.2903/j.efsa.2018.5088. PMC 7009582. PMID 32625658. S2CID 79503431.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ «GRAS Notice (GRN) No. 298» (PDF). Archived from the original (PDF) on April 9, 2011.
- ^ [M. Younes, P. Aggett, F. Aguilar (2018). «Scientific Opinion on the re-evaluation of silicon dioxide (E 551) as a food additive». EFSA Journal. 16 (1): 5088, 70pp. doi:10.2903/j.efsa.2018.5088. PMC 7009582. PMID 32625658. S2CID 79503431.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ ZeroWater
- ^ J. B. Peri , A. L. Hensley Jr. (1968). «The surface structure of silica gel». The Journal of Physical Chemistry. 72 (8): 2926–2933. doi:10.1021/j100854a041.
- ^ «Classifications — CL Inventory».
- ^ «Methyl Violet Safety Data Sheet» (PDF). labchem.
- ^ «SORBSIL CHAMELEON Safety Data Sheet» (PDF). OkerChemie.
- ^ Fisher Scientific (1997-02-09). ««Silica Gel Dessiccant»[sic]». Retrieved 2008-01-12.
External links[edit]
Wikimedia Commons has media related to Silica gel.
- Record in the Household Products Database of NLM
- UK Material Safety Datasheet
- Silica Gel with Moisture indicator: Instructions for Use Detailed use and re-drying info (broken link?)
- Silica Gel Dehumidifier FAQs Helpful Information on Rechargeable Silica Packs for Home Usage
- Silica-bound reagents Information on development and Tables illustrating reactivity
- Silica-bound scavengers General notes and Tables that summarize scavenging capacity
From Wikipedia, the free encyclopedia
«Do not eat» redirects here. For the packet found in foods, see oxygen scavenger.

|
|
| Identifiers | |
|---|---|
|
CAS Number |
|
| ChemSpider |
|
| ECHA InfoCard | 100.065.880 |
| UNII |
|
|
CompTox Dashboard (EPA) |
|
| Properties | |
|
Chemical formula |
SiO2 |
| Molar mass | 60.08 g/mol |
| Appearance | Transparent beads |
| Odor | Odorless |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Silica gel is an amorphous and porous form of silicon dioxide (silica), consisting of an irregular tridimensional framework of alternating silicon and oxygen atoms with nanometer-scale voids and pores. The voids may contain water or some other liquids, or may be filled by gas or vacuum. In the last case, the material is properly called silica xerogel.
Silica xerogel with an average pore size of 2.4 nanometers has a strong affinity for water molecules and is widely used as a desiccant. It is hard and translucent, but considerably softer than massive silica glass or quartz; and remains hard when saturated with water.
Silica xerogel is usually commercialized as coarse granules or beads, a few millimeters in diameter. Some grains may contain small amounts of indicator substance that changes color when they have absorbed some water. Small paper envelopes containing silica xerogel pellets, usually with a «do not eat» warning, are often included in dry food packages to absorb any humidity that might cause spoilage of the food.
‘Wet’ silica gel, as may be freshly prepared from alkali silicate solutions, may vary in consistency from a soft transparent gel, similar to gelatin or agar, to a hard solid, namely a water-logged xerogel. It is sometimes used in laboratory processes, for example to suppress convection in liquids or prevent settling of suspended particles.[4]
History[edit]
Silica gel was in existence as early as the 1640s as a scientific curiosity.[5] It was used in World War I for the adsorption of vapors and gases in gas mask canisters.[6] The synthetic route for producing silica gel was patented in 1918 by Walter A. Patrick, a chemistry professor at Johns Hopkins University.
In World War II, silica gel was indispensable in the war effort for keeping penicillin dry, protecting military equipment from moisture damage,[citation needed] as a fluid cracking catalyst for the production of high octane gasoline, making carbon disulphide, and as a catalyst support for the manufacture of butadiene from ethanol (feedstock for synthetic rubber production).
Types[edit]
- Type A – clear pellets, approximate pore diameter: 2.5 nm, drying and moistureproof properties, can be used as catalyst carriers, adsorbents, separators and variable-pressure adsorbent.
- Type B – translucent white pellets, pore diameter: 4.5–7.0 nm, liquid adsorbents, drier and perfume carriers, also may be used as catalyst carriers, cat litter.
- Type C – translucent, micro-pored structure, raw material for preparation of silica gel cat litter. Additionally dried and screened, it forms macro-pored silica gel which is used as drier, adsorbent and catalyst carrier.
Silica alumina gel — light yellow, chemically stable, flame-resistant, insoluble except in alkali or hydrofluoric acid. Superficial polarity, thermal stability, performance greater than fine-pored silica gel.
Stabilizing silica gel — non-crystalline micro-porous solid powder, nontoxic, flame-resisting, used in brewery of grains for beer to improve taste, clearness, color, and foam and for removal of non-micro-organism impurities.
Properties[edit]
Silica gel’s high specific surface area (around 750–800 m2/g (230,000–240,000 sq ft/oz))[7] allows it to adsorb water readily, making it useful as a desiccant (drying agent). Silica gel is often described as «absorbing» moisture, which may be appropriate when the gel’s microscopic structure is ignored, as in silica gel packs or other products. However, material silica gel removes moisture by adsorption onto the surface of its numerous pores rather than by absorption into the bulk of the gel.
Silica gel is able to adsorb up to 37% of its own weight in moisture in high humidity environments.[8] This moisture can be released upon heating at 120°C for extended periods of time. This makes it reusable multiple times with very little, if any, loss of efficiency.
Regeneration[edit]
Once saturated with water, the gel may be regenerated by heating it to 120 °C (248 °F) for 1–2 hours.[9] Some types of silica gel will «pop» when exposed to enough water. This is caused by breakage of the silica spheres when contacting the water.[10]
Preparation[edit]
An aqueous solution of sodium silicate is acidified to produce a gelatinous precipitate that is washed, then dehydrated to produce colorless silica gel.[7] When a visible indication of the moisture content of the silica gel is required, ammonium tetrachlorocobaltate(II) (NH4)2[CoCl4] or cobalt(II) chloride CoCl2 is added.[7] This will cause the gel to be blue when dry and pink when hydrated.[7] Due to link between the cancer and cobalt chloride, it has been forbidden in Europe for use in silica gel.[11] An alternative indicator is methyl violet which is orange when dry and green when hydrated.
Uses[edit]
Desiccant[edit]
Silica gel, as beads packed in a permeable bag, is a commonly used desiccant.
In many items, moisture encourages the growth of mold and spoilage. Condensation may also damage other items such as electronics and may speed the decomposition of chemicals, such as those in vitamin pills. Through the inclusion of silica gel packets, these items can be preserved longer. It may aid the drying out of electronic equipment during attempts to restore items that have been exposed to moisture accidentally.
Silica gel may also be used to keep the relative humidity inside a high frequency radio or satellite transmission system waveguide as low as possible (see also humidity buffering). Excessive moisture buildup within a waveguide can cause arcing inside the waveguide itself, damaging the power amplifier feeding it. Also, the beads of water that form and condense inside the waveguide change the characteristic impedance and frequency, degrading the signal. It is common for a small compressed air system (similar to a small home aquarium pump) to be employed to circulate the air inside the waveguide over a jar of silica gel.
Silica gel can adsorb about 40 percent of its weight in moisture and can take the relative humidity in a closed container down to about 40 percent. Once saturated, you can propel the moisture off and reuse silica gel by heating it above 300 degrees F (150 C).[12]
Silica gel is also used to dry the air in industrial compressed air systems. Air from the compressor discharge flows through a bed of silica gel beads. The silica gel adsorbs moisture from the air, preventing damage at the point of use of the compressed air due to condensation or moisture. The same system is used to dry the compressed air on railway locomotives, where condensation and ice in the brake air pipes can lead to brake failure.
Prior to widespread use of air-conditioning, salt shakers with caps containing silica gel beads to keep the salt dry enough to prevent clumping were marketed in the USA, replacing the practice of including a few grains of rice in salt shakers to effect the same drying.
Silica gel is sometimes used as a preservation tool to control relative humidity in museum and library exhibitions and storage.
Other applications include diagnostic test strips, inhalation devices, syringes, drug test kits, and hospital sanitation kits.
Chemistry[edit]
In chemistry, silica gel is used in chromatography as a stationary phase. In column chromatography, the stationary phase is most often composed of silica gel particles of 40–63 μm. Different particle sizes are used for different kinds of column chromatography as the particle size is related to surface area. The differences in particle size dictate if the silica gel should be used for flash or gravity chromatography. In this application, due to silica gel’s polarity, non-polar components tend to elute before more polar ones, hence the name normal phase chromatography. However, when hydrophobic groups (such as C18 groups) are attached to the silica gel then polar components elute first and the method is referred to as reverse phase chromatography. Silica gel is also applied to aluminium, glass, or plastic sheets for thin layer chromatography.
The hydroxy (OH) groups on the surface of silica can be functionalized to afford specialty silica gels that exhibit unique stationary phase parameters. These so-called functionalized silica gels are also used in organic synthesis and purification as insoluble reagents and scavengers.
Chelating groups have also been covalently bound to silica gel. These materials have the ability to remove metal ions selectively from aqueous solutions. Chelating groups can be covalently bound to polyamines that have been grafted onto a silica gel surface producing a material of greater mechanical integrity. Silica gel is also combined with alkali metals to form a M-SG reducing agent. (See SiGNa chemistry)
Silica gel is not expected to biodegrade in either water or soil.[13]
Cat litter[edit]
Silica gel is also used as cat litter,[14] by itself or in combination with more traditional materials, such as clays including bentonite. It is non-tracking and virtually odorless.
Food additive[edit]
Silica gel, also referred to as silicon dioxide or synthetic amorphous silica (SAS), is listed by the FDA in the United States as generally recognized as safe (GRAS), meaning it can be added to food products without needing approval. Silica is allowed to be added to food in the USA at up to 2% as permitted under 21 CFR 172.480. In the EU, it can be in up to 5% concentrations.[15] In 2018, a re-evaluation by the EFSA Panel on Food Additives and Nutrient Sources added to Food found no indications of toxicity even at the highest estimates of exposure level.[16]
Listed uses include: anticaking agent, defoaming agent, stabilizer, adsorbent, carrier, conditioning agent, chillproofing agent, filter aid, emulsifying agent, viscosity control agent, and anti-settling agent.[17] Silica can be found commonly in foods including baked goods, spices and herbs, dairy products, cocoa products, and more.[18]
Water filtration[edit]
Given the water adsorption properties of silica gel, it is used in domestic water filters.[19] The surface structure of silica gel allows the adsorption of some minerals that are dissolved in the water,[20] or «Ion-exchange» as it is marketed. Due to the lack of regulations for domestic water filtration products, no studies validate the manufacturer claims regarding the effectiveness of the filtration system.
Humidity indicator (color-changing silica gel)[edit]
Silica gel may be doped with a moisture indicator that gradually changes its color when it transitions from the anhydrous (dry) state to the hydrated (wet) state. Common indicators are cobalt(II) chloride and methyl violet. Cobalt (II) chloride is deep blue when dry and pink when wet, but it is toxic and carcinogenic, and was reclassified by the European Union in July 2000 as a toxic material.[21] Methyl violet may be formulated to change from orange to green, or orange to colorless. It also is toxic and potentially carcinogenic,[22] but is safe enough to have medicinal uses. A more ecologically friendly indicator solution is ferric ammonium sulfate, which results in a color change from deep orange/amber when dry to colorless/white when saturated.[23]
Hazards[edit]
Silica gel is non-toxic, non-flammable, and non-reactive and stable with ordinary usage. It will react with hydrogen fluoride, fluorine, oxygen difluoride, chlorine trifluoride, strong acids, strong bases, and oxidizers.[13] Silica gel is irritating to the respiratory tract and may cause irritation of the digestive tract. Dust from the beads may cause irritation to the skin and eyes, so precautions should be taken.[24] Crystalline silica dust can cause silicosis, but synthetic amorphous silica gel is indurated so does not cause silicosis. Additional hazards may occur when doped with a humidity indicator.
References[edit]
- ^ Silica gel, site www.jtbaker.com
- ^ Silica gel, site www.chemcas.org
- ^ Silicon dioxide, site echa.europa.eu
- ^ H.K. Henisch (1988): Crystals in Gels and Liesegang Rings. Cambridge University Press. ISBN 0521345030
- ^ Maryann Feldman and Pierre Desrochers (March 2003). «Research Universities and Local Economic Development: Lessons from the History of the Johns Hopkins University» (PDF). Industry and Innovation. 10 (1): 5–24. doi:10.1080/1366271032000068078. S2CID 154423229. Archived from the original (PDF) on 2005-11-12.
- ^ http://hengyeusa.com/community/desiccants-at-war
- ^ a b c d Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Chandradhas, Susheel (27 August 2016). «How To Recharge Silica Gel Crystals». Beyond Photo Tips. Beyond Photo Tips. Retrieved 2 November 2022.
- ^ How To Dry Silica Gel, Susheel Chandradhas, beyondphototips.com
- ^ Spence Konde, «Preparation of High-Silica Zeolite Beads From Silica Gel,» retrieved 2011-09-26
- ^ «Blue Silicagel & Conclusions: Safety information on blue silicagel». Archived from the original on 2016-01-05.
- ^ «What is silica gel and why do I find little packets of it in everything I buy?». HowStuffWorks. 2000-04-01. Retrieved 2022-11-29.
- ^ a b Environmental Health and Safety (2007-09-10). «Silica Gel». Retrieved 2008-01-12.
- ^ Andrew Kantor (2004-12-10). «Non-Tech High Tech Litters the Landscape». USA Today. Retrieved 2008-03-02.
- ^ «Notification of the GRAS Determination of Silicon Dioxide When Added Directly or Indirectly to Human Food» (PDF). Archived from the original (PDF) on April 18, 2013.
- ^ [M. Younes, P. Aggett, F. Aguilar (2018). «Scientific Opinion on the re-evaluation of silicon dioxide (E 551) as a food additive». EFSA Journal. 16 (1): 5088, 70pp. doi:10.2903/j.efsa.2018.5088. PMC 7009582. PMID 32625658. S2CID 79503431.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ «GRAS Notice (GRN) No. 298» (PDF). Archived from the original (PDF) on April 9, 2011.
- ^ [M. Younes, P. Aggett, F. Aguilar (2018). «Scientific Opinion on the re-evaluation of silicon dioxide (E 551) as a food additive». EFSA Journal. 16 (1): 5088, 70pp. doi:10.2903/j.efsa.2018.5088. PMC 7009582. PMID 32625658. S2CID 79503431.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ ZeroWater
- ^ J. B. Peri , A. L. Hensley Jr. (1968). «The surface structure of silica gel». The Journal of Physical Chemistry. 72 (8): 2926–2933. doi:10.1021/j100854a041.
- ^ «Classifications — CL Inventory».
- ^ «Methyl Violet Safety Data Sheet» (PDF). labchem.
- ^ «SORBSIL CHAMELEON Safety Data Sheet» (PDF). OkerChemie.
- ^ Fisher Scientific (1997-02-09). ««Silica Gel Dessiccant»[sic]». Retrieved 2008-01-12.
External links[edit]
Wikimedia Commons has media related to Silica gel.
- Record in the Household Products Database of NLM
- UK Material Safety Datasheet
- Silica Gel with Moisture indicator: Instructions for Use Detailed use and re-drying info (broken link?)
- Silica Gel Dehumidifier FAQs Helpful Information on Rechargeable Silica Packs for Home Usage
- Silica-bound reagents Information on development and Tables illustrating reactivity
- Silica-bound scavengers General notes and Tables that summarize scavenging capacity