Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt)
Факторы, влияющие на скорость химической реакции
1. Температура
Самый простой способ изменить скорость реакции – изменить температуру. Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетический барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается.
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10оС.
Правило Вант-Гоффа звучит так: повышение температуры на 10оС приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.
здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
2. Концентрация
Также изменить число эффективных соударений можно, изменив концентрацию реагирующих веществ. Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции.
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например, для реакции образования аммиака:
N2 + 3H2 ↔ 2NH3
закон действующих масс выглядит так:
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
3. Давление
Концентрация газов напрямую зависит от давления. При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона:
pV = νRT
Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается.
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
CaCO3 + SiO2 ↔ CaSiO3 + CO2↑
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
4. Катализатор
Еще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором.
Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.
Пример гетерогенного катализа – синтез аммиака:
N2 + 3H2 ↔ 2NH3
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Например, для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
5. Площадь соприкосновения реагирующих веществ
Для гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности. Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод «кипящего слоя».
Например, при производстве серной кислоты методом «кипящего слоя» производят обжиг колчедана.
6. Природа реагирующих веществ
На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ.
Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества.
Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе.
Например, хлорид натрия NaCl (поваренная соль), или воды H2O, или металлическое железо Fe.
Более активные вещества мы можем встретить в быту и природе сравнительно редко.
Например, оксид натрия Na2O или сам натрий Na в быту и в природе не не встречаем, т.к. они активно реагируют с водой.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.
463
Создан на
11 января, 2022 От Admin
Скорость химических реакций
Тренажер задания 18 ЕГЭ по химии
1 / 10
Из предложенного перечня выберите две химические реакции, для которых увеличение давления приводит к увеличению скорости реакции.
1) Ba(тв.) + 2H2О(ж) = Ba(OH)2(тв.) + H2(г)
2) Fe2О3(тв.) + H2(г) = 2FeO(тв.) + H2(г)
3) Fe(тв.) + CuSO4(p-p) = FeSO4(p-p) + Cu(тв.)
4) 2KOH(р-p) + H2SO4(p-p) = K2SO4(p-p) + 2H2О(ж)
5) 2P(тв.) + 5Cl2 = 2PCl5(тв.)
Запишите в поле ответа номера выбранных реакций.
2 / 10
Из предложенного перечня выберите все факторы, влияющие на скорость химической реакции кальция с соляной кислотой.
1) измельчение кусочка металла
2) повышение давления в системе
3) увеличение концентрации кислоты
4) разбавление кислоты
5) уменьшение температуры
3 / 10
Из предложенного перечня выберите два внешних воздействия, которые приводят к увеличению скорости реакции цинка с соляной кислотой.
1) понижение температуры
2) повышение давления в системе
3) измельчение цинка
4) увеличение концентрации кислоты
5) понижение давления в системе
Запишите в поле ответа номера выбранных внешних воздействий.
4 / 10
Из предложенного перечня выберите все внешние воздействия, которые оказывают влияние на скорость химической реакции между железом и серой.
1) понижение давления
2) измельчение серы
3) охлаждение системы
4) повышение температуры
5) измельчение железа
Запишите номера выбранных ответов.
5 / 10
Из предложенного перечня выберите два фактора, которые приводят к увеличению скорости химической реакции между алюминием и раствором гидроксида калия.
1) увеличение концентрации раствора щёлочи
2) добавление индикатора
3) добавление воды
4) измельчение алюминия
5) понижение температуры
Запишите в поле ответа номера выбранных факторов.
6 / 10
Из предложенного перечня выберите два внешних воздействия, которые приводят к увеличению скорости реакции азота с водородом.
1) понижение температуры
2) повышение давления в системе
3) уменьшение концентрации водорода
4) увеличение концентрации азота
5) использование ингибитора
Запишите в поле ответа номера выбранных внешних воздействий.
7 / 10
Из предложенного перечня выберите все внешние воздействия, которые приводят к увеличению скорости химической реакции между фосфором и кислородом.
1) охлаждение реакционной смеси
2) повышение температуры
3) добавление ингибитора
4) увеличение концентрации кислорода
5) понижение давления
Запишите номера выбранных ответов.
8 / 10
Из предложенного перечня выберите все внешние воздействия, которые способствуют увеличению скорости реакции цинка с соляной кислотой.
1) уменьшение концентрации кислоты
2) увеличение температуры
3) пропускание хлороводорода через реакционную смесь
4) увеличение площади поверхности соприкосновения реагентов
5) добавление индикатора
Запишите номера выбранных ответов.
9 / 10
Из предложенного перечня выберите все реакции, для которых увеличение давления приводит к увеличению скорости реакции.
1) Cl2 + H2 = 2HCl
2) 4P(белый) + 5O2 = 2P2O5
3) Fe(порошок) + S(порошок) = FeS
4) Zn + 2HCl(р-р) = ZnCl2 + H2
5) C + 2H2 = CH4
Запишите номера выбранных ответов.
10 / 10
Из предложенного перечня выберите все внешние воздействия, которые оказывают влияние на скорость реакции, протекающей по схеме:
CuO(тв.) + 2H+(p-p) = Cu2+(p-p) + H2O(ж)
1) повышение температуры
2) разбавление раствора кислоты
3) применение индикатора
4) увеличение концентрации кислоты в растворе
5) увеличение давления
Ваша оценка
The average score is 37%
Скорость химической реакции — основное понятие химической кинетики, выражающее отношения количества
прореагировавшего вещества (в молях) к отрезку времени, за которое произошло взаимодействие.
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции:
моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в
другое в единице объема.
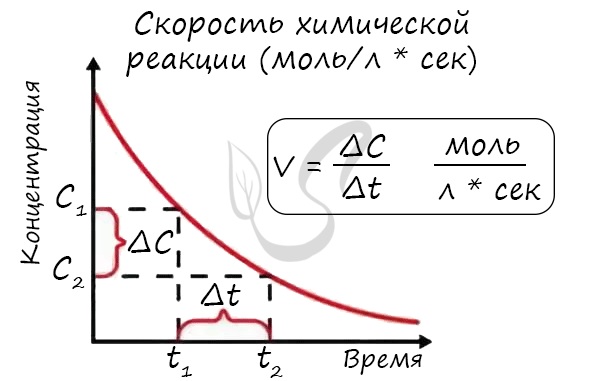
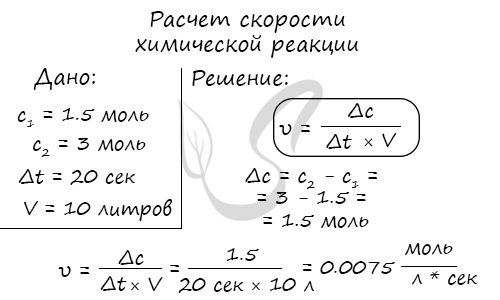
Мне встречались задачи, где была дана молярная концентрация вещества до реакции и после, время и объем. Требовалось посчитать скорость
реакции. Давайте решим подобное несложное задание для примера:
Молярная концентрация вещества до реакции составляла 1.5 моль/л по итогу реакции — 3 моль/л. Объем смеси 10 литров, реакция заняла 20 секунд.
Рассчитайте скорость реакции.
Влияние природы реагирующих веществ
При изучении агрегатных состояний веществ возникает вопрос: где же быстрее всего идут реакции: между газами, растворами или твердыми веществами?
Запомните, что самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже.

Если реакция гетерогенная: жидкость + твердое вещество, газ + твердое вещество, жидкость + газ, то большую роль играет площадь соприкосновения
реагирующих веществ.
Очевидно, что большой кусок железа, положенный в соляную кислоту, будет гораздо дольше реагировать с ней, нежели чем измельченное
железо — железная стружка.

Химическая активность также играет важную роль. Например, отвечая на вопрос «какой из металлов Fe или Ca быстрее прореагирует с серой?» мы отдадим
предпочтение кальцию, так как в ряду активности металлов он стоит левее железа, а значит кальций активнее железа.

Иного подхода требуют реакции металлов с водой, где нужно учитывать радиус атома. Например, отвечая на вопрос «какой из металлов Li или K быстрее прореагирует с водой?» мы отдадим предпочтение калию, так как калий имеет больший радиус атома. Калий будет быстрее взаимодействовать с водой, чем литий.
Иногда для верного ответа на вопрос о скорости реакции требуется знание активности кислот. Мы подробнее обсудим эту тему в гидролизе, однако сейчас
я замечу: чем сильнее (активнее) кислота, тем быстрее идет реакция.
Например, реакцию магния с серной кислотой протекает гораздо быстрее реакции магния с уксусной кислотой. Причиной этому служит то, что серная кислота
относится к сильным (активным) кислотам, а активность уксусной кислоты меньше, она является слабой кислотой.
Как я уже упомянул, слабые и сильные кислоты и основания изучаются в теме гидролиз.
Влияние изменения концентрации
Влияние концентрации «прямо пропорционально» скорости реакции: при увлечении концентрации реагирующего вещества скорость реакции повышается, при
уменьшении — понижается.
Замечу деталь, которая может оказаться важной, если в реакции участвуют газы: при увеличении давления концентрация вещества на единицу объема
возрастает (представьте, как газ сжимается). Поэтому увеличение давление, если среди исходных веществ есть газ, увеличивает скорость реакции.

Закон действующих масс устанавливает соотношение между концентрациями реагирующих веществ и их продуктами. Скорость простой реакции
aA + bB → cC определяют по уравнению:
υ = k × СaA × СbB
Физический смысл константы скорости — k — в том, что она численно равна скорости реакции при том условии, что концентрации реагирующих
веществ равны 1. Обратите внимание, что стехиометрические коэффициенты уравнения переносятся в степени — a и b.
Записанное выше следствие закона действующих масс нужно не только «зазубрить», но и понять. Поэтому мы решим пару задач, где потребуется
написать подобную формулу.
Окисление диоксида серы протекает по уравнению: 2SO2(г) + O2 = 2SO3(г). Как изменится скорость этой реакции,
если объемы системы уменьшить в три раза?

По итогу решения становится ясно, что скорость реакции в таком случае возрастет в 27 раз.
Решим еще одну задачу. Дана реакция синтеза аммиака: N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции
образования аммиака, если уменьшить концентрацию водорода в два раза?

В результате решения мы видим, что при уменьшении концентрации водорода в два раза скорость реакции замедлится в 8 раз.
Влияние изменения температуры на скорость реакции
Постулат, который рекомендую временно взять на вооружение: «Увеличение температуры увеличивает скорость абсолютно любой химической реакции: как
экзотермической, так и эндотермической. Исключений нет!»
Очень часто в заданиях следующей темы — химическом равновесии, вас будут пытаться запутать и ввести в заблуждение, но вы не поддавайтесь
и помните про постулат!
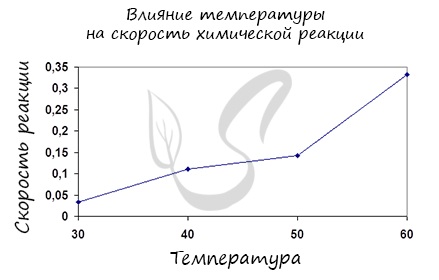
Итак, влияние температуры на скорость реакции «прямо пропорционально»: чем выше температура, тем выше скорость реакции — чем ниже
температура, тем меньше и скорость реакции. Однако, как и в случае с концентрацией, это больше чем простая «пропорция».
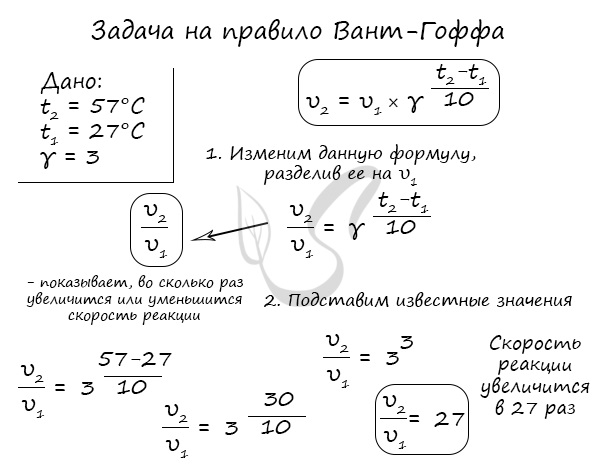
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так:
«При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза»

В формуле, написанной выше, используются следующие обозначение:
- υ1 — скорость реакции при температуре t1
- υ2 — скорость реакции при температуре t2
- γ — температурный коэффициент, который может быть равен 2-4
Если по итогам решения задач у вас получится температурный коэффициент меньше 2 или больше 4, то, скорее всего, где-то вы допустили ошибку.
Используйте этот факт для самопроверки.
Для тренировки решим пару задач, в которых потребуется использование правило Вант-Гоффа.
Как изменится скорость гомогенной реакции при повышении температуры от 27°C до 57°C при температурном коэффициенте, равном трем?
Иногда в задачах требуется рассчитать температурный коэффициент, как, например, здесь: «Рассчитайте, чему равен температурный коэффициент
скорости, если известно, что при понижении температуры от 250°C до 220°C скорость реакции уменьшилась в 8 раз».

Катализаторы и ингибиторы
Катализатор (греч. katalysis — разрушение) — вещество, ускоряющее химическую реакцию, но не участвующее в ней. Катализатор не расходуется в химической реакции.
Многие химические реакции в нашем организме протекают с участием катализаторов — белковых молекул, ферментов. Без катализаторов
подобные реакции шли бы сотни лет, а с катализаторами идут одну долю секунды.
Катализом называют явление ускорения химической реакции под действием катализатора, а химические реакции, идущие с участием катализатора
— каталитическими.

Ингибитор (лат. inhibere — задерживать) — вещество, замедляющее или предотвращающее протекание какой-либо химической реакции.
Ингибиторы применяют для замедления коррозии металла, окисления топлива, старения полимеров. Многие лекарственные вещества
являются ингибиторами.
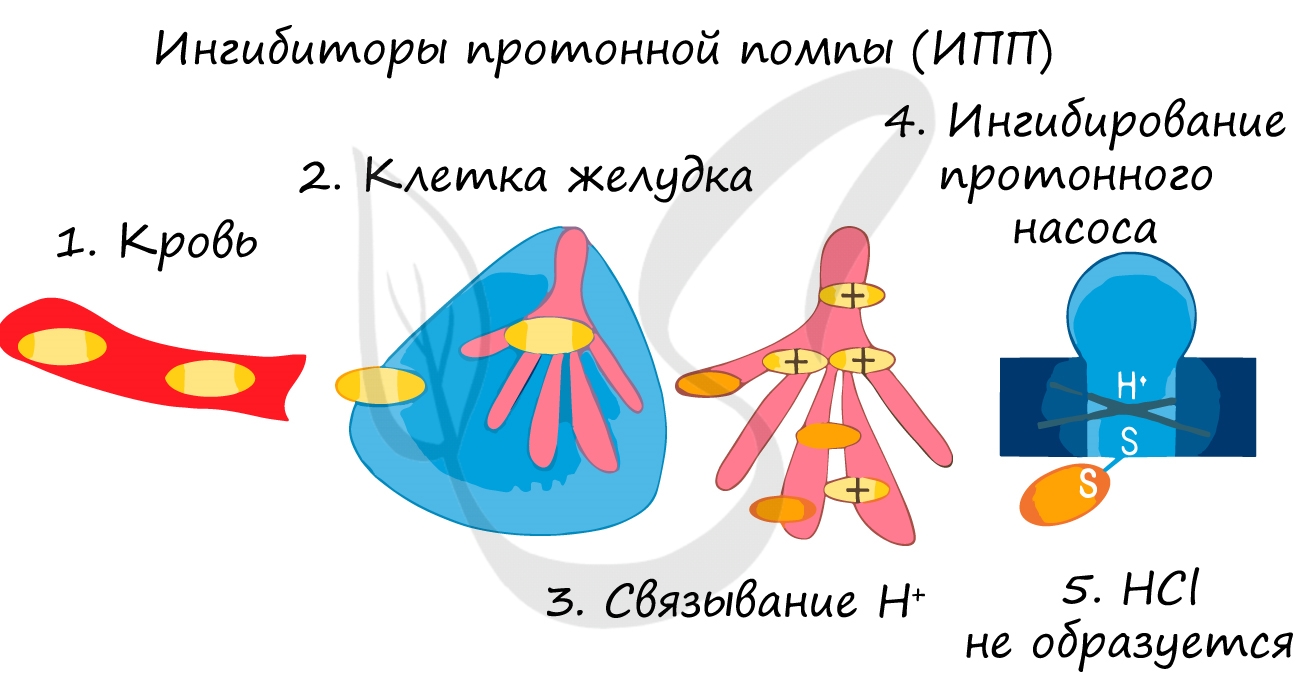
Так при лечении гастрита — воспаления желудка (греч. gaster — желудок) или язв часто назначаются ингибиторы протонной помпы — химические вещества,
которые блокирует выработку HCl слизистой желудке. В результате этого соляная кислота прекращает воздействие на поврежденную стенку желудка,
воспаление стихает.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Гомогенные и гетерогенные химические реакции
Химические реакции протекают с различными скоростями: с малой скоростью — при образовании сталактитов и сталагмитов, со средней скоростью — при варке пищи, мгновенно — при взрыве. Очень быстро проходят реакции в водных растворах, практически мгновенно. Смешаем растворы хлорида бария и сульфата натрия — сульфат бария в виде осадка образуется немедленно. Быстро, но не мгновенно, горит сера, магний растворяется в соляной кислоте, этилен обесцвечивает бромную воду. Медленно образуется ржавчина на железных предметах, налет на медных и бронзовых изделиях, медленно гниет листва, разрушаются зубы.
Предсказание скорости химической реакции, а также выяснение ее зависимости от условий проведения процесса — задача химической кинетики — науки о закономерностях протекания химических реакций во времени.
Если химические реакции происходят в однородной среде, например, в растворе или в газовой фазе, то взаимодействие реагирующих веществ происходит во всем объеме. Такие реакции, как вы знаете, называют гомогенными.
Скорость гомогенной реакции ($v_{гомог.}$) определяется как изменение количества вещества в единицу времени в единице объема:
$υ_{гомог.}={∆n}/{∆t·V},$
где $∆n$ — изменение числа молей одного вещества (чаще всего исходного, но может быть и продукта реакции); $∆t$ — интервал времени (с, мин.); $V$ — объем газа или раствора (л).
Поскольку отношение количества вещества к объему представляет собой молярную концентрацию $С$, то
${∆n}/{V}=∆C.$
Таким образом, скорость гомогенной реакции определяется как изменение концентрации одного из веществ в единицу времени:
$υ_{гомог.}={∆C}/{∆t}[{моль}/{л·с}]$
если объем системы не меняется. Если реакция идет между веществами, находящимися в разных агрегатных состояниях (например, между твердым веществом и газом или жидкостью), или между веществами, неспособными образовывать гомогенную среду (например, между несмешивающимися жидкостями), то она проходит только на поверхности соприкосновения веществ. Такие реакции называют гетерогенными.
Скорость гетерогенной реакции определяется как изменение количества вещества в единицу времени на единице поверхности:
$υ_{гомог.}={∆C}/{∆t·S}[{моль}/{c·м^2}]$
где $S$ — площадь поверхности соприкосновения веществ ($м^2, см^2$).
Если при какой-либо протекающей реакции экспериментально измерять концентрацию исходного вещества в разные моменты времени, то графически можно отобразить ее изменение с помощью кинетической кривой для этого реагента.
Скорость реакции не является постоянной величиной. Мы указывали лишь некоторую среднюю скорость данной реакции в определенном интервале времени.
Представьте себе, что мы определяем скорость реакции
$H_2+Cl_2→2HCl$
а) по изменению концентрации $Н_2$;
б) по изменению концентрации $HCl$.
Одинаковые ли мы получим значения? Ведь из $1$ моль $Н_2$ образуется $2$ моль $HCl$, поэтому и скорость в случае б) окажется больше в два раза. Следовательно, значение скорости реакции зависит и от того, по какому веществу ее определяют.
Изменение количества вещества, по которому определяют скорость реакции, — это внешний фактор, наблюдаемый исследователем. По сути, все процессы осуществляются на микроуровне. Очевидно, для того, чтобы какие-то частицы прореагировали, они прежде всего должны столкнуться, причем столкнуться эффективно: не разлететься, как мячики, в разные стороны, а так, чтобы в частицах разрушились или ослабли старые связи и смогли образоваться новые, а для этого частицы должны обладать достаточной энергией.
Расчетные данные показывают, что, например, в газах столкновения молекул при атмосферном давлении исчисляются миллиардами за $1$ секунду, т.е. все реакции должны были бы идти мгновенно. Но это не так. Оказывается, что лишь очень небольшая доля молекул обладает необходимой энергией, приводящей к эффективному соударению.
Минимальный избыток энергии, который должна иметь частица (или пара частиц), чтобы произошло эффективное соударение, называют энергией активации $E_a$.
Таким образом, на пути всех частиц, вступающих в реакцию, имеется энергетический барьер, равный энергии активации $E_a$. Когда он мал, то находится много частиц, которые могут его преодолеть, и скорость реакции велика. В противном случае требуется толчок. Когда вы подносите спичку, чтобы зажечь спиртовку, вы сообщаете дополнительную энергию $E_a$, необходимую для эффективного соударения молекул спирта с молекулами кислорода (преодоление барьера).
В заключение сделаем вывод: многие возможные реакции практически не идут, т.к. высока энергия активации.
Это имеет огромное значение для нашей жизни. Представьте, что бы случилось, если бы все термодинамически разрешенные реакции могли идти, не имея никакого энергетического барьера (энергии активации). Кислород воздуха прореагировал бы со всем, что может гореть или просто окисляться. Пострадали бы все органические вещества, они превратились бы в углекислый газ $CO_2$ и воду $H_2O$.
Скорость химической реакции зависит от многих факторов. Основными из них являются: природа и концентрация реагирующих веществ, давление (в реакциях с участием газов), температура, действие катализаторов и поверхность реагирующих веществ в случае гетерогенных реакций. Рассмотрим влияние каждого из этих факторов на скорость химической реакции.
Температура
Вам известно, что при повышении температуры в большинстве случаев скорость химической реакции значительно возрастает. В XIX в. голландский химик Я. Х. Вант-Гофф сформулировал правило:
Повышение температуры на каждые $10°С$ приводит к увеличению скорости реакции в 2–4 раза (эту величину называют температурным коэффициентом реакции).
При повышении температуры средняя скорость молекул, их энергия, число столкновений увеличиваются незначительно, зато резко повышается доля активных молекул, участвующих в эффективных соударениях, преодолевающих энергетический барьер реакции.
Математически эта зависимость выражается соотношением:
$υ_{t_2}=υ_{t_1}γ^{{t_2-t_1}/{10}},$
где $υ_{t_1}$ и $υ_{t_2}$ — скорости реакции соответственно при конечной $t_2$ и начальной $t_1$ температурах, а $γ$ — температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры на каждые $10°С$.
Однако для увеличения скорости реакции повышение температуры не всегда применимо, т.к. исходные вещества могут начать разлагаться, могут испаряться растворители или сами вещества.
Концентрация реагирующих веществ
Изменение давления при участии в реакции газообразных веществ также приводит к изменению концентрации этих веществ.
Чтобы осуществилось химическое взаимодействие между частицами, они должны эффективно столкнуться. Чем больше концентрация реагирующих веществ, тем больше столкновений и, соответственно, выше скорость реакции. Например, в чистом кислороде ацетилен сгорает очень быстро. При этом развивается температура, достаточная для плавления металла. На основе большого экспериментального материала в 1867 г. норвежцами К. Гульденбергом и П. Вааге и независимо от них в 1865 г. русским ученым Н. И. Бекетовым был сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ.
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам в уравнении реакции.
Этот закон называют также законом действующих масс.
Для реакции $А+В=D$ этот закон выражается так:
$υ_1=k_1·C_A·C_B$
Для реакции $2А+В=D$ этот закон выражается так:
$υ_2=k_2·C_A^2·C_B$
Здесь $С_А, С_В$ — концентрации веществ $А$ и $В$ (моль/л); $k_1$ и $k_2$ — коэффициенты пропорциональности, называемые константами скорости реакции.
Физический смысл константы скорости реакции нетрудно установить — она численно равна скорости реакции, в которой концентрации реагирующих веществ равны $1$ моль/л или их произведение равно единице. В таком случае ясно, что константа скорости реакции зависит только от температуры и не зависит от концентрации веществ.
Закон действующих масс не учитывает концентрации реагирующих веществ, находящихся в твердом состоянии, т.к. они реагируют на поверхности, и их концентрации обычно являются постоянными.
Например, для реакции горения угля
$C+O_2=CO_2$
выражение скорости реакции должно быть записано так:
$υ=k·C_{O_2}$,
т. е. скорость реакции пропорциональна только концентрации кислорода.
Если же уравнение реакции описывает лишь суммарную химическую реакцию, проходящую в несколько стадий, то скорость такой реакции может сложным образом зависеть от концентраций исходных веществ. Эта зависимость определяется экспериментально или теоретически на основании предполагаемого механизма реакции.
Действие катализаторов
Можно увеличить скорость реакции, используя специальные вещества, которые изменяют механизм реакции и направляют ее по энергетически более выгодному пути с меньшей энергией активации. Их называют катализаторами (от лат. katalysis — разрушение).
Катализатор действует как опытный проводник, направляющий группу туристов не через высокий перевал в горах (его преодоление требует много сил и времени и не всем доступно), а по известным ему обходным тропам, по которым можно преодолеть гору значительно легче и быстрее. Правда, по обходному пути можно попасть не совсем туда, куда ведет главный перевал. Но иногда именно это и требуется! Именно так действуют катализаторы, которые называют селективными. Ясно, что нет необходимости сжигать аммиак и азот, зато оксид азота (II) находит применение в производстве азотной кислоты.
Катализаторы — это вещества, участвующие в химической реакции и изменяющие ее скорость или направление, но по окончании реакции остающиеся неизменными количественно и качественно.
Изменение скорости химической реакции или ее направления с помощью катализатора называют катализом. Катализаторы широко используют в различных отраслях промышленности и на транспорте (каталитические преобразователи, превращающие оксиды азота выхлопных газов автомобиля в безвредный азот).
Различают два вида катализа.
Гомогенный катализ, при котором и катализатор, и реагирующие вещества находятся в одном агрегатном состоянии (фазе).
Гетерогенный катализ, при котором катализатор и реагирующие вещества находятся в разных фазах. Например, разложение пероксида водорода в присутствии твердого катализатора оксида марганца (IV):
$2H_2O_2{→}↖{MnO_2(I)}2H_2O_{(ж)}+O_2↑(г)$
Сам катализатор не расходуется в результате реакции, но если на его поверхности адсорбируются другие вещества (их называют каталитическими ядами), то поверхность становится неработоспособной, требуется регенерация катализатора. Поэтому перед проведением каталитической реакции тщательно очищают исходные вещества.
Например, при производстве серной кислоты контактным способом используют твердый катализатор — оксид ванадия (V) $V_2O_5$:
$2SO_2+O_2⇄2SO_3$
При производстве метанола используют твердый цинкохромовый катализатор ($8ZnO·Cr_2O_3×CrO_3$):
$CO_{(г)}+2H_{2(г)}⇄CH_3OH_{(г)}$
Очень эффективно работают биологические катализаторы — ферменты. По химической природе это белки. Благодаря им в живых организмах при невысокой температуре с большой скоростью протекают сложные химические реакции. Ферменты отличаются особой специфичностью, каждый из них ускоряет только свою реакцию, идущую в нужное время и в нужном месте с выходом, близким к $100%$. Создание аналогичных ферментам искусственных катализаторов — мечта химиков!
Вы, конечно, слышали и о других интересных веществах — ингибиторах (от лат. inhibere — задерживать). Они с высокой скоростью реагируют с активными частицами с образованием малоактивных соединений. В результате реакция резко замедляется и затем прекращается. Ингибиторы часто специально добавляют в разные вещества, чтобы предотвратить нежелательные процессы.
Например, с помощью ингибиторов стабилизируют растворы пероксида водорода, мономеры для предотвращения преждевременной полимеризации, соляную кислоту, чтобы была возможность ее транспортировки в стальной таре. Ингибиторы содержатся и в живых организмах, они подавляют различные вредные реакции окисления в клетках тканей, которые могут инициироваться, например, радиоактивным излучением.
Природа реагирующих веществ (их состав, строение)
Значение энергии активации является тем фактором, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции.
Если энергия активации мала ($< 40$ кДж/моль), то это означает, что значительная часть столкновений между частицами реагирующих веществ приводит к их взаимодействию, и скорость такой реакции очень большая. Все реакции ионного обмена протекают практически мгновенно, ибо в этих реакциях участвуют разноименно заряженные ионы, и энергия активации в этих случаях ничтожно мала.
Если энергия активации велика ($> 120$ кДж/моль), то это означает, что лишь ничтожная часть столкновений между взаимодействующими частицами приводит к реакции. Скорость такой реакции поэтому очень мала. Например, протекание реакции синтеза аммиака при обычной температуре заметить практически невозможно.
Если энергии активации имеют промежуточные значения ($40–120$ кДж/моль), то скорости таких реакций будут средними. К таким реакциям можно отнести взаимодействие натрия с водой или этиловым спиртом, обесцвечивание бромной воды этиленом, взаимодействие цинка с соляной кислотой и др.
Поверхность соприкосновения реагирующих веществ
Скорость реакций, идущих на поверхности веществ, т.е. гетерогенных, зависит при прочих равных условиях от свойств этой поверхности. Известно, что растертый в порошок мел гораздо быстрее растворяется в соляной кислоте, чем равный по массе кусочек мела.
Увеличение скорости реакции объясняется, в первую очередь, увеличением поверхности соприкосновения исходных веществ, а также рядом других причин, например, разрушением структуры правильной кристаллической решетки. Это приводит к тому, что частицы на поверхности образующихся микрокристаллов значительно реакционноспособнее, чем те же частицы на гладкой поверхности.
В промышленности для проведения гетерогенных реакций используют кипящий слой, чтобы увеличить поверхность соприкосновения реагирующих веществ, подвод исходных веществ и отвод продуктов. Например, при производстве серной кислоты с помощью кипящего слоя проводят обжиг колчедана; в органической химии с применением кипящего слоя проводят каталитический крекинг нефтепродуктов и регенерацию (восстановление) вышедшего из строя (закоксованного) катализатора.
Описание презентации по отдельным слайдам:
-
1 слайд
Скорость
химической реакции -
2 слайд
Скорость химической реакции определяется изменением концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени.
n -
-
-
-
-
-
-
9 слайд
Скорость химической реакции зависит от природы реагирующих веществ
Задание
Запишите уравнения реакций и сделайте вывод о скорости двух реакций.Опыт
Лабораторный опыт
Взаимодействие
цинка с соляной кислотой.
Взаимодействие
цинка с уксусной кислотой. -
-
-
-
13 слайд
Скорость химической реакции зависит от температуры
Задание
Сделайте вывод о влиянии температуры на скорость реакций.Опыт
Лабораторный опыт
Взаимодействие
цинка с соляной кислотой при н.у.
Взаимодействие
цинка с соляной кислотой при нагревании -
14 слайд
Правило Вант – Гоффа :
При увеличении температуры на каждые 100С, скорость химической реакции увеличивается в 2-4 раза. -
-
16 слайд
Задание
Как изменится скорость реакции:
а) при повышении температуры
от 100С до 500С
б) при понижении температуры
от 100С до 00С -
-
18 слайд
Скорость химической реакции зависит от поверхности соприкосновения реагирующих веществ
Задание
Сделайте вывод о влиянии поверхности соприкосновения реагирующих веществ на скорость реакций.Опыт
Лабораторный опыт
Взаимодействие
карбоната кальция (кусочек и порошок) с соляной кислотой -
19 слайд
Первая стадия – колчедан размалывают и подают в печь ленточным транспортёром.
Через размолотый колчедан пропускают сильную струю воздуха. Создаётся иллюзия кипящей жидкости.
(метод кипящего слоя) -
20 слайд
Скорость химической реакции зависит от концентрации реагирующих веществ
Задание
Сделайте вывод о скорости двух реакций.Опыт
Где сгорит быстрее деревянный предмет:
а) на воздухе
б) в чистом кислороде? -
21 слайд
Закон действующих масс:
скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, возведённых в степень их коэффициентов в уравнении реакции
-
22 слайд
v =k • [A]a • [B]b
aA + bB = cC + dD -
23 слайд
Составить кинетические уравнения для следующих реакций:
а) взаимодействие водорода с йодом
б) взаимодействие железа с хлором
в) гидрирование этилена
Как изменится скорость реакции
2А + В → АВ если,
а) концентрацию вещества А увеличить в 3 раза
б) концентрацию вещества В уменьшить в 3 раза
в) давление увеличить в 3 раза
Задание -
24 слайд
Скорость химической реакции зависит от катализатора
Задание
Сделайте вывод о влиянии катализатора на скорость реакций.Опыт
Демонстрационный эксперимент
Скорость химической реакции.
1. С наибольшей скоростью протекает химическая реакция:
1) Al + H+ → 2) Al3+ + OH— → 3) Al + I2 → 4) Al2O3 + NaOH →
2. Площадь поверхности соприкосновения реагирующих веществ не влияет на
скорость химической реакции между:
1) Zn и HCl 2) FeS2 и O2 3) N2 и H2 4) CuO и Al
3. В меньшей степени изменение давления скажется на скорости реакции:
1) Fe + 2HCl(г) → FeCl2 + H2 3) Fe + H2O(г) → FeO + H2
2) 2H2 + O2 → 2H2O 4) Fe + 2HCl(р-р) → FeCl2 + H2
4. Скорость химической реакции 2NO2(г) = 2NO(г) +O2(г) не зависит от изменения
1) концентрации диоксида азота 3) концентрации кислорода
2) давления в системе 4) температуры
5. Для увеличения скорости химической реакции Mg(тв) + 2H+ → Mg2+ + H2(г)
необходимо
1) добавить несколько кусочков магния
2) увеличить концентрацию ионов водорода
3) уменьшить температуру
4) увеличить концентрацию ионов магния
6. Скорость химической реакции CuO + 2H+ = Cu2+ + 2H2O не зависит от:
1) степени измельчения оксида меди(II) 2) температуры
3) концентрации ионов меди 4) концентрации ионов водорода
7. С наименьшей скоростью протекает реакция между
1) Fe и О2 2) CaCO3 и HCl(р-р) 3) Na и О2 4) Na2SO4(р-р) и BaCl2(р-р)
8. Не зависит от давления скорость взаимодействия веществ
1) H2(г) и I2(г) 2) NH3 и HCl(г) 3) Zn(OH)2 и H2SO4 4) Na(ж) и Cl2(г)
9. Скорость прямой реакции 2NO(г) + O2 (г) = 2NO2(г) + Q , протекающей в замкнутой
системе, возрастает при:
1) уменьшении концентрации NO2 2) добавлении оксида азота (IV)
3) увеличении температуры 4) разбавлении газовой смеси азотом
1) уменьшение температуры
2) изменение площади платинового катализатора
3) увеличение концентрации аммиака
4) уменьшение давления
20. Скорость реакции не зависит от давления для веществ
1) Cu и HNO3(разб) 2) H2(г) и Cl2(г) 3) SO2(г) и О2(г) 4) С(кр) и О2(г)
21. Скорость прямой реакции 2SO2(г) + O2 (г) = 2SO3(г) + Q снизится при
1) отравлении катализатора 2) уменьшении концентрации SO3
3) увеличении температуры 4) изменении твердого катализатора – V2O5
22. Для уменьшения скорости химической реакции необходимо
1) увеличить концентрацию реагирующих веществ
2) ввести в систему катализатор 3) повысить температуру
4) понизить температуру
23. При обычных условиях с наибольшей скоростью протекает реакция
1) 2Ba + O2 = 2BaO 2) Ba2+ + CO32- = BaCO3
3) Ba + 2H+ = Ba2+ + H2 4) Ba + S = BaS
24. С наибольшей скоростью протекает реакция
1) нейтрализации
2) горения серы в воздухе
3) растворения магния в кислороде
4) восстановления оксида меди(II) водородом
25. При обычных условиях с наименьшей скоростью происходит взаимодействие
между
1) Fe и О2 2) Mg и HCl (10%-ный р-р) 3) Cu и О2 4) Zn и HCl (10%-ный р-р)
26. С наибольшей скоростью происходит
1) коррозия металлов на воздухе 2) брожение глюкозы
3) реакция нейтрализации 4) взаимодействия водорода с бромом
27. Для увеличения скорости химической реакции FeO + CO → Fe + CO2 + 17 кДж
необходимо
1) увеличить концентрацию CO2 2) уменьшить концентрацию CO2
3) уменьшить температуру 4) увеличить степень измельчения FeO
36. Скорость химической реакции между цинком и кислотой зависит от:
1) понижения давления 2) природы кислоты
3) повышения давления 4) присутствия индикатора
37. С наибольшей скоростью при комнатной температуре протекает реакция
взаимодействия:
1) углерода с кислородом
2) железа с раствором уксусной кислоты
3) железа с соляной кислотой
4) растворов гидроксида натрия и серной кислоты
38. Для увеличения скорости химической реакции
2CuS(тв) + 3O2(г) = 2CuO(тв) + 2SO2(г) + 2920 кДж необходимо:
1) увеличить концентрацию SO2 2) уменьшить концентрацию SO2
3) уменьшить температуру 4) увеличить степень измельчения СuS
39.Увеличение температуры поведения реакции:
1) не влияет на ее скорость, так как теплота не может быть участником
превращения веществ
2) увеличивает скорость реакции, так как увеличивается число эффективных
соударений молекул
3) уменьшает скорость реакции, так как увеличивается число упругих
соударений молекул
4) не влияет на скорость реакции, так как в равной мере увеличивается число
эффективных и упругих соударений молекул
40. С большей скоростью идет взаимодействие соляной кислоты с:
1) Cu 2) Fe 3) Mg 4) Zn
41. Скорость химической реакции горения угля в кислороде уменьшается при:
1) увеличении концентрации кислорода 2) повышении температуры
3) понижении температуры 4) повышении давления
42. Катализатор AlCl3 увеличивает скорость:
1) любой химической реакции между органическими веществами
2) некоторых химических реакций между органическими веществами
3) любой химической реакции между неорганическими веществами
4) некоторых реакций между неорганическими веществами
52. Для увеличения скорости реакции 2СО + О2 = 2 СО2 + Q необходимо:
1) увеличить концентрацию СО 2) уменьшить концентрацию О2
3) понизить давление 4) понизить температуру
53. Оцените справедливость суждений:
А. При нагревании скорость многих химических реакций уменьшается.
Б. Катализатор – это вещество, которое увеличивает скорость химической
реакции, но само в ней не участвует.
1) Верно только А; 2) верно только Б;
3) верны оба суждения 4) оба суждения неверны.
54. На скорость реакции между уксусной кислотой и этанолом не влияет:
1) катализатор 2) температура проведения реакции
3) концентрация исходных веществ 4) давление
55. С наибольшей скоростью с водородом реагирует
1) Cl2 2) F2 3) S 4) С
56. Скорость реакции водорода с азотом увеличится при:
1) понижении температуры 2) понижении давления
3) разбавлении смеси воздухом 4) использовании катализатора
57. Скорость реакции угарного газа с кислородом уменьшится при:
1) понижении температуры 3) повышении концентрации кислорода
2) повышении давления 4) понижении концентрации углекислого газа
58. Скорость реакции оксида серы(IV) с кислородом увеличится при:
1) понижении температуры 2). понижении давления
2) разбавлении смеси азотом 4) использовании катализатора
59. Скорость реакции горения метана уменьшится при:
1) понижении температуры 3) повышении концентрации кислорода
2) повышении давления 4) понижении концентрации углекислого газа
60. Скорость реакции оксида углерода(II) с водородом увеличится при:
1) понижении температуры 2).повышении давления
3) разбавлении смеси азотом 4) понижении концентрации СН3ОН
69. Из приведенных утверждений:
А. При увеличении температуры на каждые 100 скорость химической реакции
увеличится в 2 – 4 раза.
Б. По мере протекания реакции ее скорость уменьшается.
1) верно только А; 2) верно только Б
3) верно А и Б; 4) оба суждения неверны
70. Для увеличения скорости выделения углекислого газа при действии соляной
кислоты на мрамор нужно
1) разбавить кислоту; 2) измельчить мрамор
3) добавить индикатор; 4) проводить реакцию в атмосфере инертного газа
71. Реакция, скорость которой зависит от площади поверхности соприкосновения
реагирующих веществ, — это
1) нейтрализация серной кислоты раствором гидроксида натрия;
2) горение водорода в кислороде;
3) взаимодействие растворов хлорида меди и гидроксида калия;
4) горение алюминия в кислороде
10. Повышение давления не повлияет на скорость реакции
1) FeO(кр) и Н2(г) 2) 2SO2(г) и O2(г) 3) Н2(г) и I2(г) 4) СaCO3(кр) и HCl(ж)
11. Скорость обратной реакции NH4Cl (кр) = NH3(г) + HCl(г) – Q , протекающей в
замкнутом сосуде, возрастает при
1) добавлении кристаллов соли 2) понижении температуры
3) повышении концентрации HCl 4) удалении аммиака
12. Скорость реакции не зависит от давления для веществ:
1) H2(г) и Fe2O3(кр) 2) СО(г) и Н2О(г) 3) СаО и HNO3(разб) 4) N2(г) и О2(г)
13. Скорость прямой реакции Ca(HCO3)2(р-р) = CaCO3(кр) + СО2(г) + Н2О(ж) — Q ,
протекающей в замкнутой системе, возрастает при
1) уменьшении концентрации СО2 2) увеличении концентрации СО2
3) уменьшении температуры 4) увеличении температуры
14. Скорость реакции не зависит от давления для веществ:
1) С(кр) и О2(г) 2) CaO(кр) и С(кр) 3) NH3(г) и HCl(г) 4) S (кр) и Н2(г)
15. Скорость прямой реакции N2(г) + 3H2(г) = 2NH3(г) + Q возрастает при
1) увеличении температуры 2) увеличении концентрации аммиака
3) уменьшении температуры 4) уменьшении концентрации аммиака
16. Скорость реакции не зависит от давления для веществ:
1) Н2(г) и О2(г) 2) Na и Н2О 3) H2(г) и WO3 4) H2O и СО2(г)
17. Скорость прямой реакции О2(г) + 2SO2(г) = 2SO3(г) + Q возрастает при
1) увеличении температуры 2) увеличении концентрации оксида серы(VI)
3) уменьшении температуры 4) уменьшении концентрации оксида серы(VI)
18. Скорость реакции не зависит от давления для веществ
1) С(кр) и СО2(г) 2) H2(г) и Br2(г) 3) NO(г) и O2(г) 4) Hg и HNO3(разб)
19. На скорость прямой реакции N2(г) + 3H2(г) ======= 2NH3(г) + Q существенно не
повлияет
28. Для увеличения скорости химической реакции Zn + 2H+ → Zn2+ + H2 + 154 кДж
необходимо
1) уменьшить концентрацию ионов цинка
2) увеличить концентрацию ионов водорода
3) уменьшить температуру 4) увеличить концентрацию ионов цинка
29. Для увеличения скорости химической реакции
Zn(тв) + 2HСl9г) → ZnСl2(тв) + H2(г) + 231 кДж необходимо
1) увеличить концентрацию водорода 2) увеличить количество цинка
3) уменьшить температуру 4) увеличить концентрацию хлороводорода
30. При повышении температуры на 200 скорость реакции, температурный
коэффициент которой равен 3, возрастает в
1) 2 раза 2) 3 раза 3) 8 раз 4) 9 раз
31. При обычных условиях с наибольшей скоростью происходит взаимодействие
между
1) N2 и О2 2)Fe и S 3) C2H5OH и О2 4) Na2CO3 и HCl
32. Скорость химической реакции характеризует:
1) изменение количеств веществ за единицу времени в единице объема или
единице площади
2) время, за которое заканчивается химическая реакция
3) число структурных единиц вещества, вступивших в химическую реакцию
4) движение молекул или ионов реагирующих веществ относительно друг друга
33. Скорость химической реакции между медью и азотной кислотой зависит от:
1) массы меди 2) объема кислоты
3) концентрации кислоты 4) объема колбы
34. При увеличении температуры на 300С скорость реакции возрастает в 8 раз.
Чему равен температурный коэффициент реакции?
1) 8 2) 2 3) 3 4) 4
35. Для увеличения скорости химической реакции
Мg + 2H+ → Mg2+ + H2 + 462 кДж необходимо
1) уменьшить концентрацию ионов водорода
2) увеличить концентрацию ионов водорода
3) понизить температуру
4) повысить давление
43. Скорость прямой реакции N2 + 3H2 → 2NH3 + Q возрастает при:
1) увеличении концентрации азота 2) уменьшении концентрации азота
3) увеличении концентрации аммиака 4) уменьшении концентрации аммиака
44. Какой из факторов не оказывает влияния на скорость химической реакции в
растворах?
1) концентрация веществ 2) использование катализатора
3) использование индикатора 4) объем реакционного сосуда
45. Во сколько раз увеличивается скорость химической реакции при повышении
температуры на 200С, если температурный коэффициент 3?
1) в3 раза 2) в 6 раз 3) в 9 раз 4) в 90 раз
46. Скорость химической реакции между металлом и серой не зависит от:
1) температуры 2) площади поверхности соприкосновения веществ
3) давления 4) природы металла
47. Реакция, протекающая на границе раздела двух фаз, называется:
1) гетерогенной 2) окислительно-восстановительной
3) гомогенной 4) каталитической
48. Взаимодействие какой пары веществ будет протекать с большей скоростью,
если известно, что концентрация растворов кислот во всех случаях одинакова?
1) Pb и HCl 2) Fe и HCl 3) Zn и HCl 4) Mg и HCl
49. С наименьшей скоростью протекает реакция между:
1) железным гвоздем и 4%-ным раствором CuSO4
2) железной стружкой и 4%-ным раствором CuSO4
3) железным гвоздем и 10%-ным раствором CuSO4
4) железной стружкой и 10%-ным раствором CuSO4
50. Во сколько раз изменится скорость реакции 2А + В = 2С, если концентрацию
вещества А уменьшить в 2 раза?
1) увеличится в 4 раза 2) уменьшится в 2 раза
3) уменьшится в 4 раза 4) увеличится в 2 раза
51. Как повлияет на скорость реакции CaO + CO2 = CaCO3 увеличение давления
в 3 раза?
1) скорость увеличится в 3 раза 2) скорость уменьшится в 9 раз
3) скорость уменьшится в 3 раза 4) скорость не изменится
61. Катализатор требуется для проведения реакции
1) бромирования гексана 2) нейтрализации уксусной кислоты
3) бромировании фенола 4) этерификации уксусной кислоты
62. Для увеличения скорости взаимодействия железа с соляной кислотой следует
1) добавить ингибитор; 2) понизить температуру
3) повысить давление; 4) увеличить концентрацию HCl
63. Давление влияет на скорость реакции между
1) гидроксидом цинка и азотной кислотой; 2) цинком и серной кислотой;
3) аммиаком и кислородом; 4) серой и алюминием
64. Реакцию, уравнение которой FeO + 2H+ = Fe2+ + H2O + Q можно ускорить, если
1) повысить давление; 2) понизить давление
3) повысить температуру; 4) понизить температуру
65. Скорость реакции Zn + H2SO4 = ZnSO4 + H2 + Q понизится при
1) повышении температуры; 2) понижении давления
3) повышении давления; 4) разбавлении раствора кислоты
66. Скорость реакции 2А + В = А2В при уменьшении концентрации вещества А
в 2 раза
1) понизится в 2 раза; 2) повысится в 4 раза
3) понизится в 4 раза; 4) не изменится
67. Оцените справедливость суждений:
А. Катализатор увеличивает скорость реакции, но не вызывает смещение
химического равновесия.
Б. Увеличение давления реагирующих газов приводит к увеличению скорости
реакции.
1) верно только А; 2) верно только Б
3) верны оба суждения; 4) оба суждения неверны
68. Скорость реакции N2 + 3H2 = 2NH3 + Q увеличится при:
1) понижении температуры; 2) понижении концентрации NH3
3) разбавлении смеси аргоном; 4) использовании катализатора
Ответы на вопросы
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
2 |
3 |
4 |
3 |
2 |
3 |
1 |
3 |
3 |
4 |
3 |
3 |
4 |
2 |
1 |
|
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
|
2 |
1 |
4 |
3 |
1 |
1 |
4 |
2 |
1 |
3 |
3 |
4 |
2 |
4 |
4 |
|
31 |
32 |
33 |
34 |
35 |
36 |
37 |
38 |
39 |
40 |
41 |
42 |
43 |
44 |
45 |
|
4 |
1 |
3 |
2 |
2 |
2 |
4 |
4 |
2 |
3 |
3 |
2 |
1 |
3 |
3 |
|
46 |
47 |
48 |
49 |
50 |
51 |
52 |
53 |
54 |
55 |
56 |
57 |
58 |
59 |
60 |
|
3 |
1 |
4 |
1 |
3 |
1 |
1 |
4 |
4 |
2 |
4 |
1 |
4 |
1 |
2 |
|
61 |
62 |
63 |
64 |
65 |
66 |
67 |
68 |
69 |
70 |
71 |
72 |
73 |
74 |
75 |
|
4 |
4 |
3 |
3 |
4 |
3 |
3 |
4 |
3 |
2 |
4 |
Скорость реакции
Автор статьи — профессиональный репетитор И. Давыдова (Юдина).
Скоростью химической реакции называется изменение концентрации вещества в единицу времени, , где концентрация С выражена в моль/л. В ЕГЭ не требуется применение этой формулы, необходимо лишь уметь сравнивать скорости различных реакций и определять, как на них влияют изменения внешних условий.
Скорость реакции зависит от нескольких факторов:
- — Природы взаимодействующих веществ
- — Температуры
- — Концентрации реагирующих веществ
- — Присутствия в реакционной смеси катализатора или ингибитора
- — Площади поверхности соприкосновения реагентов (для гетерогенных процессов).
Важно помнить, что на скорость реакции влияет только состояние исходных веществ. Состояние продуктов на скорость не влияет.
Рассмотрим каждый пункт отдельно:
1) Природа реагентов
Очевидно, что разные реакции при одних и тех же условиях протекают с различными скоростями. Нейтрализация щелочи кислотой протекает почти моментально, растворение цинка в соляной кислоте — быстро, ржавление железа под действием воды и кислорода – намного дольше. Общее правило очевидно: чем активнее реагирующие вещества, тем быстрее они взаимодействуют друг с другом. (Например: чем активнее металл, вступающий в реакцию, тем быстрее происходит реакция)
Самые быстрые реакции – гомогенные, протекающие в одной фазе (газы или смешивающиеся жидкости). В них взаимодействие происходит во всем объеме смеси реагентов.
Гетерогенные реакции – взаимодействие не смешивающихся друг с другом веществ – протекают на границе раздела фаз. Эти процессы медленнее, и скорость определяется площадью поверхности соприкосновения.
Среди всех реакций самую высокую скорость имеют реакции ионного обмена.
2) Температура
При увеличении температуры молекулы начинают двигаться быстрее, следовательно, чаще сталкиваются друг с другом. Таким образом, скорость реакции всегда возрастает при повышении температуры и уменьшается – при понижении. Мы активно пользуемся этим в быту: например, для замедления процессов гниения (сложных химических реакций) храним продукты в холодильнике, а для ускорения реакции Майяра (взаимодействие белков с сахарами) готовим пищу при высокой температуре.
Зависимость скорости реакции от температуры определяется уравнением Вант-Гоффа: , где v2 и v1 – скорости реакции при температурах Т2 и Т1 соответственно, γ – температурный коэффициент, принимающий значения от 2 до 4. Например, если γ=3, при повышении температуры на 20 градусов скорость реакции возрастет в
раз.
3) Концентрация реагентов
Очевидно, что чем выше концентрации реагирующих веществ, тем чаще их молекулы будут сталкиваться друг с другом, следовательно, тем быстрее будет протекать взаимодействие. Зависимость скорости от концентрации реагентов выражается законом действующих масс.
Например, для реакции aA + bB = cC + dD скорость . На самом деле часто зависимость скорости от концентраций реагентов носит более сложный характер, так как многие процессы протекают через образование промежуточных продуктов, но мы оставим эти случаи университетскому курсу.
Пожалуйста, не путайте: скорость реакции зависит от концентраций реагентов и не зависит от концентраций продуктов!
Здесь же рассмотрим влияние давления на скорость реакции. Жидкости и твердые тела практически несжимаемы и давление не влияет на их концентрации. Для газов увеличение давления вызывает возрастание концентрации, следовательно, ускоряет реакцию.
4) Катализаторы и ингибиторы
Катализатор – вещество, увеличивающее скорость реакции, но не расходующееся в ней, ингибитор – это «катализатор наоборот», он замедляет реакцию.
5) Площадь границы раздела фаз
Для примера рассмотрим реакцию цинка с соляной кислотой:
Zn + 2HCl = ZnCl2 + H2.
Кусочек цинка будет постепенно растворяться в кислоте: сначала прореагирует верхний слой молекул, потом следующий, — и так далее. «Внутренние» атомы смогут прореагировать только после того, как перейдут в раствор «внешние».
Если же этот кусочек измельчить (то есть увеличить площадь его поверхности) реакция пойдет заметно быстрее, т.к. возрастет количество «доступных для кислоты» частиц.
Таким образом, чем сильнее измельчено твердое вещество, тем выше скорость реакции. Количество твердого вещества на скорость влияет намного слабее, чем степень его измельченности и концентрация жидких или газообразных реагентов.
Потренируемся. Ниже приведены вопросы из ЕГЭ разных лет:
| А) Скорость химической реакции 2С(тв) + СО2(г) = 2СО(г) не зависит от | 1) температуры
2) концентрации СО 3) степени измельченности угля 4) давления |
| Б) С наибольшей скоростью при комнатной температуре протекает реакция меду водородом и | 1) серой
2) иодом 3) фтором 4) бромом |
| В) Для увеличения скорости химической реакции Mg(тв) + 2HCl(р-р) = MgCl2(р-р) + H2(г) необходимо | 1) увеличить давление
2) уменьшить температуру 3) увеличить концентрацию HCl 4) увеличить количество магния. |
| Г) Повышение давления приведет к увеличению скорости реакции | 1) 2P(тв) + 3S(тв) = P2S3(тв)
2) Br2(ж) + 2Na(тв) = 2NaBr 3) H2O(ж) + 2Na(тв) = 2NaOH + H2(г) 4) N2(г) + 3H2(г) = 2NH3(г) |
| Ответы: |
Если вам понравился наш материал — записывайтесь на курсы подготовки к ЕГЭ по химии онлайн
Благодарим за то, что пользуйтесь нашими публикациями.
Информация на странице «Скорость реакции» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из разделов нашего сайта.
Публикация обновлена:
08.03.2023


























![v =k • [A]a • [B]b aA + bB = cC + dD v =k • [A]a • [B]b aA + bB = cC + dD](https://documents.infourok.ru/43228241-a551-4108-a646-7d33e7a8059e/0/slide_22.jpg)

