Описание презентации по отдельным слайдам:
-
1 слайд
Скорость
химической реакции -
2 слайд
Скорость химической реакции определяется изменением концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени.
n -
-
-
-
-
-
-
9 слайд
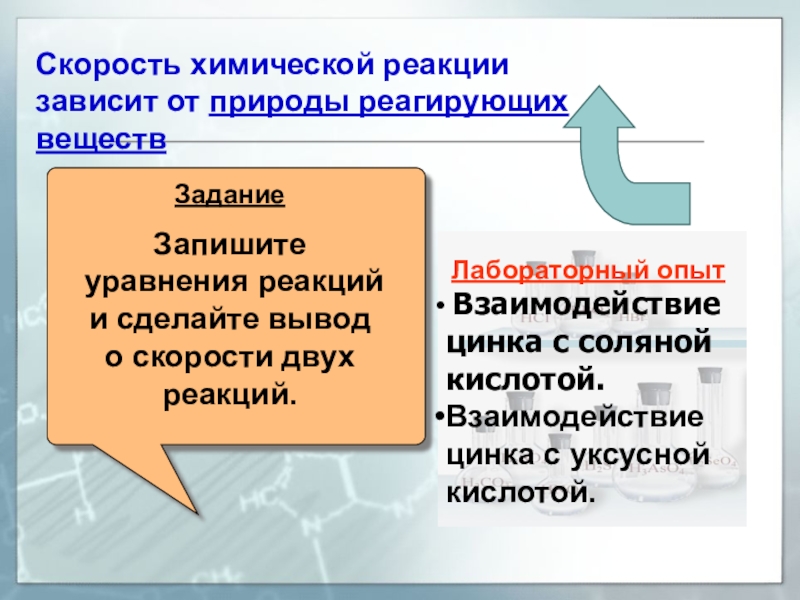
Скорость химической реакции зависит от природы реагирующих веществ
Задание
Запишите уравнения реакций и сделайте вывод о скорости двух реакций.Опыт
Лабораторный опыт
Взаимодействие
цинка с соляной кислотой.
Взаимодействие
цинка с уксусной кислотой. -
-
-
-
13 слайд
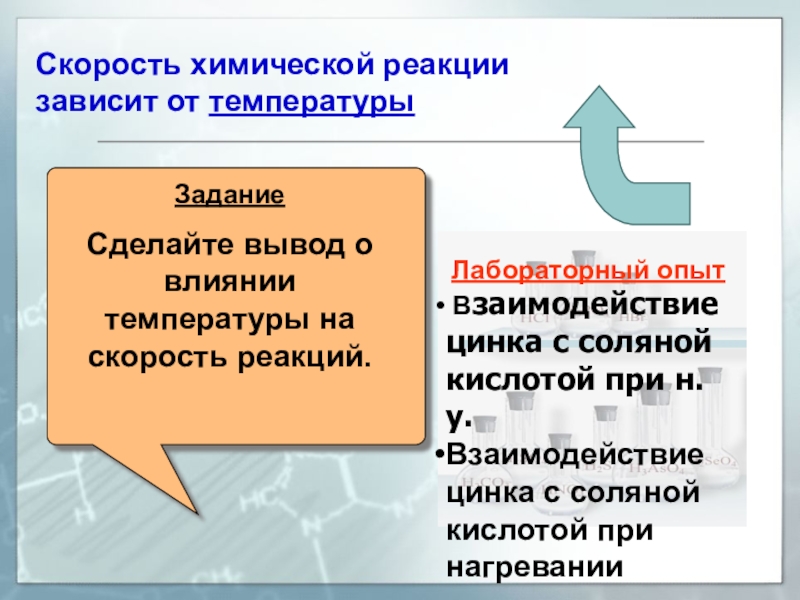
Скорость химической реакции зависит от температуры
Задание
Сделайте вывод о влиянии температуры на скорость реакций.Опыт
Лабораторный опыт
Взаимодействие
цинка с соляной кислотой при н.у.
Взаимодействие
цинка с соляной кислотой при нагревании -
14 слайд
Правило Вант – Гоффа :
При увеличении температуры на каждые 100С, скорость химической реакции увеличивается в 2-4 раза. -
-
16 слайд
Задание
Как изменится скорость реакции:
а) при повышении температуры
от 100С до 500С
б) при понижении температуры
от 100С до 00С -
-
18 слайд
Скорость химической реакции зависит от поверхности соприкосновения реагирующих веществ
Задание
Сделайте вывод о влиянии поверхности соприкосновения реагирующих веществ на скорость реакций.Опыт
Лабораторный опыт
Взаимодействие
карбоната кальция (кусочек и порошок) с соляной кислотой -
19 слайд
Первая стадия – колчедан размалывают и подают в печь ленточным транспортёром.
Через размолотый колчедан пропускают сильную струю воздуха. Создаётся иллюзия кипящей жидкости.
(метод кипящего слоя) -
20 слайд
Скорость химической реакции зависит от концентрации реагирующих веществ
Задание
Сделайте вывод о скорости двух реакций.Опыт
Где сгорит быстрее деревянный предмет:
а) на воздухе
б) в чистом кислороде? -
21 слайд
Закон действующих масс:
скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, возведённых в степень их коэффициентов в уравнении реакции
-
22 слайд
v =k • [A]a • [B]b
aA + bB = cC + dD -
23 слайд
Составить кинетические уравнения для следующих реакций:
а) взаимодействие водорода с йодом
б) взаимодействие железа с хлором
в) гидрирование этилена
Как изменится скорость реакции
2А + В → АВ если,
а) концентрацию вещества А увеличить в 3 раза
б) концентрацию вещества В уменьшить в 3 раза
в) давление увеличить в 3 раза
Задание -
24 слайд
Скорость химической реакции зависит от катализатора
Задание
Сделайте вывод о влиянии катализатора на скорость реакций.Опыт
Демонстрационный эксперимент
Слайд 1
« C корость химических реакций». Тема урока:
Слайд 2
Химическая кинетика – раздел химии, изучающий скорость и механизм химических реакций.
Слайд 3
Системы: Гомогенные (однородные) – системы, в которых не видна поверхность раздела между компонентами. Газовые смеси, растворы. Гетерогенные (неоднородные) – системы, в которых видна поверхность раздела между компонентами. Тв. в-во + тв. в-во, газ + тв. в-во, жидкость + тв. в-во.
Слайд 4
Реакции: Гомогенные – реакции, протекающие в гомогенных системах. Протекают во всем объеме системы. Гетерогенные – реакции, протекающие в гетерогенных системах. Протекают на границе раздел фаз.
Слайд 5
Скорость химической реакции — изменение концентрации одного из реагирующих веществ за единицу времени в единице объёма. + c 2 – c 1 + ∆c − t 2 – t 1 − ∆ t C – концентрация, в моль / л t – время, в секундах = = МОЛЬ Л ∙ С
Слайд 6
Влияние площади соприкосновения реагирующих веществ на скорость реакции. 1. Скорость гетерогенных реакций зависит от площади соприкосновения веществ. 2. Гетерогенные реакции идут только на поверхности раздела реагирующих веществ. 3. Скорость гетерогенной реакции: ∆ n ∆ t ∙ S гетерог. =
Слайд 7
Молярная концентрация – показывает количество молей вещества, находящееся в 1 литре. С = n / V [ C ] = [ моль/л ]
Слайд 8
Задание 1. 1 .В сосуде объёмом 5 литров находится 1 моль водорода. Рассчитайте молярную концентрацию водорода. 2 . В растворе объёмом 2 л содержится 392 грамма серной кислоты. Рассчитайте молярную концентрацию раствора.
Слайд 9
Изменение концентрации реагирующего вещества во времени С Концентрацця Время С 1 С 2 t 1 t 2 ∆ c ∆ t = ∆ c ∆ t
Слайд 10
Факторы, влияющие на скорость реакции 1. Концентрация реагирующих веществ. 2.Температура. 3. Природа реагирующих веществ. 4. Площадь соприкосновения реагирующих веществ. 5. Катализатор.
Слайд 11
Влияние концентрации реагирующих веществ на скорость реакции. Чем больше концентрация реагирующих веществ, тем чаще сталкиваются частицы веществ, а значит скорость реакции увеличивается.
Слайд 12
Закон действия масс: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степени стехиометрических коэффициентов. Гульдберг, Вааге, 1867г.
Слайд 13
m А + nB = A m B n = k ٠ С А m ٠ C B n k – константа скорости реакции: k = , при с А = с в = 1 моль/л при с А ٠ с в = 1 моль/л k – зависит от природы реагирующих веществ и от t
Слайд 14
Запишите выражение ЗДМ для реакций: 2СО + О 2 = 2СО 2 N 2 + 3H 2 = 2NH 3 4P + 5O 2 = 2P 2 O 5 = k ٠ [ СО ] 2 ∙ [ О 2 ] = k ٠ [N 2 ] ∙ [H 2 ] 3 = k ٠ [O 2 ] 5
Слайд 15
Расчетные задачи: 2. Во сколько раз необходимо повысить давление в системе: N 2(г) + 3 H 2(г) 2 NH 3(г) , чтобы повысить скорость прямой реакции в 256 раз? В системе: 4NH 3(г) + 3O 2(г) 2N 2(г) + 6H 2 O (г) концентрацию аммиака повысили с 0,3 моль/л до 0,6 моль/л, а концентрацию кислорода понизили с 0,4 моль/л до 0,1 моль/л. Как изменилась скорость реакции?
Слайд 16
Температура. Правило Вант-Гоффа: при повышении температуры на каждые 10 0 С скорость большинства реакций увеличивается в 2 – 4 раза. t 2 – t 1 10 Ү – температурный коэффициент, который показывает, во сколько раз увеличивается скорость реакции при повышении t на 10 0 С. 2 = 1 ٠ Ү
Слайд 17
Расчетные задачи: Как изменится скорость некоторой реакции при уменьшении температуры 30 0 С до 0 0 С, если температурный коэффициент равен 2? При температуре 20 0 С скорость реакции равна 2,7 моль/л.с. Чему равна скорость реакции при температуре 0 0 С, если температурный коэффициент равен 3?
Слайд 18
Влияние температуры на скорость реакции. При повышении температуры, увеличивается скорость движения частиц, поэтому они чаще сталкиваются, а значит скорость реакции возрастает.
Слайд 19
Влияние природы реагирующих веществ на скорость реакции. 2К+2Н 2 О=2КОН+Н 2 ↑ 2Н 2 +О 2 =2Н 2 О
Слайд 20
Влияние природы реагирующих веществ на скорость реакции. Са+2Н 2 О=Са(ОН) 2 +Н 2 ↑
Слайд 21
Влияние природы реагирующих веществ на скорость реакции. Чем активнее вещество, тем скорость реакции с его участием больше.
Слайд 22
Взаимодействие металлов с кислотами Zn + 2HCl = ZnCl 2 + H 2 ↑ 1 Fe + 2HCl = FeCl 2 + H 2 ↑ 2 Cu + 2HCl = реакция невозможна 1 > 2 Zn активнее Fe , а Cu малоактивный металл
Слайд 23
Влияние площади соприкосновения реагирующих веществ на скорость реакции. 1. Скорость гетерогенных реакций зависит от площади соприкосновения веществ. 2. Гетерогенные реакции идут только на поверхности раздела реагирующих веществ. 3. Скорость гетерогенной реакции: ∆ n ∆ t ∙ S гетерог. =
Слайд 24
Влияние площади соприкосновения реагирующих веществ на скорость реакции. Чем больше поверхность соприкосновения веществ, тем больше скорость реакции.
Слайд 25
Влияние катализатора на скорость реакции. Катализаторами называются вещества, изменяющие скорость химических реакций. Химические реакции, протекающие при участии катализаторов, называют каталитическими. Сам катализатор в реакциях не расходуется и в конечные продукты не входит.
Слайд 26
Влияние катализатора на скорость реакции. С 12 Н 22 О 11 + 12О 2 = 12СО 2 +11Н 2 О
Слайд 27
Механизм каталитических реакций Для реакции: А + В = АВ Механизм: Катализатор взаимодействует с исходным веществом: А + К = АК Промежуточное соединение взаимодействует с другим исходным веществом: АК + В = АВ + К Суммарное уравнение: А + В = АВ
Слайд 28
Как необходимо изменить условия в системе: 2 SO 2(г) + O 2(г) 2 SO 3(г) + Q , находящейся в равновесии, чтобы добиться максимальной концентрации оксида серы ( IV )? Как сместится равновесие в системе: 2 H 2 S (г) + SO 2(г) 2 H 2 O (г) + 3 S (т) + Q , если : а) повысить температуру; б) понизить дав-ление; в) ввести катализатор; г) повысить концентрацию сероводорода; д) понизить концентрацию оксида серы ( IV ).
Слайд 29
Домашнее задание: 1. Учить теорию и определения. 2. Письменно: О. стр 31 №48 записать выражение ЗДМ для реакций: 2 SO 2 + O 2 = 2SO 3 4NH 3 + 3O 2 = 2N 2 + 6H 2 O 4NH 3 + 5O 2 = 4NO + 6H 2 O 2H 2 O 2 = 2H 2 O + O 2 Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
1. Скорость химических реакций.
2. Химическая реакция
Это активное столкновение
молекул, при котором
происходит разрыв «старых»
связей и образование «новых»
связей
Скорость химической реакции — это
число элементарных актов
в единицу времени в единице объёма
3.
При протекании химических реакций
происходит изменение концентраций
веществ, участвующих в реакции:
•Концентрация реагирующих веществ
уменьшается;
•Концентрация продуктов увеличивается
Скорость гомогенной
химической реакции Изменение концентрации
продукта
ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ
реагента или продукта в
единицу времени.
4. Формулы для расчета скорости реакции
V — для гомогенной реакции
Реагирующие вещества
находятся в одном агрегатном
состоянии или фазе.
V — для гетерогенной реакции
Реагирующие вещества
находятся в разных
агрегатных состояниях или
разных фазах.
V= ΔC/Δt
V= ΔC/Δt ∙S
ΔC = C2 — C1 ( молярные
концентрации реагирующих или
образующихся веществ)
t = t2 – t1 (момент времени)
Единица измерения скорости
реакции — моль/ л∙с
S – площадь соприкосновения
реагирующих веществ
Единица измерения скорости
реакции — моль/ м2∙с
по приведённым формулам можно
рассчитать лишь некоторую среднюю
скорость данной реакции в
выбранном интервале времени (ведь
для большинства реакций скорость
уменьшается по мере их протекания)
5.
Задача:
Химическая реакция протекает в
растворе, согласно уравнению:
А+В=С
Исходная концентрация: вещества А –
0,80 моль/л. Через 20 минут
концентрация вещества А снизилась до
0, 74 моль/л.
Определите среднюю скорость реакции
за этот промежуток времени?
6. Решение:
Дано: С(А) = 0,80 моль/л; С(А1) = 0,74
моль/л; Δt = 20 минут.
Найти: Vгомог.=?
Решение:
1. Определение средней скорости реакции в
растворе производится по формуле: V= ΔC/Δt
Подставим значения в формулу:
V= 0,8 – 0,74 / 20 = 0,003 моль / л∙мин.
Ответ: 0,003 моль / л∙мин.
7. Факторы, влияющие на скорость реакции
Природа реагирующих веществ
Площадь поверхности твердого
вещества
Концентрация реагирующих
веществ
Температура
Катализатор
8. 1. Природа реагирующих веществ
Под природой реагирующих веществ понимают их состав,
строение, взаимное влияние атомов в веществах.
Примером взаимного влияния атомов в веществах могут
служить серная и сернистая кислоты:
9. 2. Площадь поверхности твердого вещества
Если в реакции кроме жидкости (или газа) участвуют твердые
вещества, площадь их поверхности влияет на скорость реакции. Чем
больше поверхность твердых тел, тем больше и поверхность
соприкосновения реагирующих веществ, и выше скорость реакции.
Расплющим гранулы цинка – площадь их поверхности увеличится.
10. 3. Концентрация реагирующих веществ
Чем больше концентрация реагирующих веществ, тем больше
скорость химической реакции.
Закон действующих масс (Н.И.Бекетов)
Скорость химической реакции прямо пропорциональна
произведению концентраций реагирующих веществ
2А + 3В = 2С v = k·C А 2 ·С В 3,
k – константа скорости.
11. 4. Влияние температуры
Правило Вант-Гоффа:
При повышении
температуры на каждые 10
градусов скорость реакций увеличивается в 24 раза
Математическая формула:
V2/ V1 = Υ t/10
где V2 –скорость реакции при температуре t2,
V1 – скорость реакции при температуре t1,
Υ – температурный коэффициент
Число, показывающее, во сколько раз
увеличивается скорость реакции при
повышении температуры на 10° С, называют
температурным коэффициентом.
12. 5. Катализатор
Катализаторами называются вещества, которые влияют
на скорость реакции, но сохраняют свой химический
состав.
Изменение скорости реакции под действием
катализатора называется катализом.
Катализаторы снижают энергию активации, что приводит
к возрастанию активных молекул, скорость реакции
увеличивается.
13. Закон действующих масс Н.И. Бекетов
Скорость химической реакции пропорциональна
произведению концентраций реагирующих веществ,
взятых в степенях равных их стехиометрическим
коэффициентам в уравнении реакции.
Для реакции: А+В=С
Для реакции: А+4В=D
V1= k₁CA∙CB,
V2= k₂CA∙CB⁴.
В этих формулах: CA и CB – концентрации веществ А и В
(моль/л), k₁ и k₂ – коэффициенты пропорциональности,
называемые константами скоростей реакции.
Эти формулы также называют кинетическими
уравнениями.
14. Теория активации
Выводы:
1. Повышение температуры усиливает скорость
движения молекул, увеличивая тем самым
число столкновений между ними.
2. Реакция протекает только тогда когда
сталкивающиеся молекулы имеют избыток
энергии ( по сравнению с величиной энергии
всех молекул при данной температуре) Такие
молекулы называются активными.
3. Один из способов активации молекул повышение температуры, благодаря чему
резко увеличивается скорость реакции.
Энергия, которую надо сообщить молекулам,
чтобы превратить их в активные, называется
энергией активации( Еа).
15. Энергия активации Реакция, которая происходит в замкнутом сосуде между некими газообразными веществами А и Б по уравнению: А +
Энергия активации
Реакция, которая происходит в замкнутом сосуде между некими
газообразными веществами А и Б по уравнению:
А+Б=В
Для того, чтобы молекулы А и Б
прореагировали между собой, они
должны сначала столкнуться. Причем
столкновение должно быть достаточно
энергичным. Энергия, запасенная в
молекулах А и Б, должна быть больше
какой-то определенной величины иначе они просто отталкиваются друг
от друга, не вступая в реакцию
Если же энергия
столкновения
достаточна,
образуется
продукт В
16. Примеры химических реакций
Необратимые х.р.
Na2SO4 +BaCl2 BaSO4 ↓+ 2NaCl
Zn(OH)2 +2HCl ZnCl2 + H2O
Mg +H2SO4 MgSO4 + H2↑
Обратимые х.р.
H2 + I2 ↔ 2HI
CaCO3 ↔ CaO + CO2
N2 + 3H2 ↔ 2NH3
17. Химическое равновесие
Обратимая химическая реакция
H2 + I2 ↔ 2HI
По закону действующих масс
Vпр.=k₁ [H2]∙[I2]
Vобр.=k₂ [HI]²
Когда [H2]∙[I2] = [HI]² или Vпр.= Vобр.
Наступает химическое равновесие
Состояние обратимого процесса, при
котором скорости прямой и обратной
реакций равны, называют химическим
равновесием.
18.
19.
Переход системы из одного состояния
равновесия в другое называется
смещением химического равновесия.
Правило смещения химического равновесия
(принцип Ле-Шателье 1884 год)
Если на систему находящуюся в равновесие произвести
внешнее воздействие, то равновесие сместится в ту
сторону, где это воздействие ослабевает.
Факторы, влияющие на смещение
равновесия:
1. Концентрация – С
2. Температура – t
3. Давление – p ( для газов)
20.
1. Концентрация
N2 + 3 H2
2 NH3
Реагирующие вещества
Продукты реакции
С Р.В.
равновесие сместится
вправо
СП.Р.
равновесие сместится
влево
При увеличении концентрации реагирующих веществ,
равновесие смещается в сторону продуктов реакции,
преобладает прямая реакция.
При увеличении концентрации продуктов реакции,
равновесие смещается в сторону реагирующих веществ
реакции, преобладает обратная реакция.
21.
2. Температура
эндотермическая реакция ( — Q )
экзотермическая реакция ( + Q)
t0c = + Q
t0c= — Q
+Q
N2 + 3 H2
2 NH3 + Q
-Q
t0 c
равновесие сместится
t0c равновесие сместится
влево
вправо
При увеличении температуры равновесие смещается в
сторону эндотермической реакции. При уменьшении
температуры – в сторону экзотермической реакции.
22.
3. Давление
Давление применяется только для газов!
P — V
1V
P — V
3V
N2(г) + 3 H2(г)
4V
2V
2NH3(г)
2V
Р
равновесие сместится
вправо
Р
равновесие сместится
влево
23.
При увеличения давления равновесие смещается в
сторону той реакции, при которой объем
образовавшихся газообразных продуктов уменьшается.
При уменьшении давления равновесие смещается в
сторону той реакции, при которой объем
образовавшихся газообразных продуктов увеличивается.
Если объемы газообразных продуктов одинаковы как в
прямой, так и в обратной реакции — изменение давления
не оказывает смещения равновесия.
24.
Обобщение и выводы:
Химические реакции протекают с различными скоростями.
Скорость химической реакции это изменение концентрации
одного из реагирующих веществ за единицу времени.
Чтобы началась химическая реакция нужно активировать
молекулы. Энергия, которую надо сообщить молекулам, для их
активизации, называется энергией активации.
Скорость химической реакции зависит от температуры,
концентрации, поверхности соприкосновения реагирующих
веществ, природы реагирующих веществ, катализатора.
В обратимых химических реакциях наступает динамическое
химическое равновесие, когда скорости прямой и обратной
реакции равны.
Факторы влияющие на смещение химического равновесия –
давление, температура, концентрация.
Смещение химического равновесия происходит согласно
принципа Ле-Шателье.
28 ноября 2021
В закладки
Обсудить
Жалоба
Скорость химических реакций
Презентация на урок.
→ Что понимается под скоростью химической реакции?
→ Формула скорости химической реакции.
→ Управление скоростью химической реакции.
→ Факторы влияния на скорость химической реакции.
→ Заключение.
sc-him.pptx
sc-him.pdf
Знание скорости химических реакций имеет очень большое практическое и научное значение. Например, в химической промышленности от скорости химической реакции зависят размеры, производительность аппаратов, качество вырабатываемого продукта и в конечном итоге зарплата работников и себестоимость продукции.
Автор: Печёнкин Артём Михайлович.
Слайд 2Скорость химической реакции определяется изменением концентрации одного из реагирующих веществ или
одного из продуктов реакции в единицу времени.
n

Слайд 9Скорость химической реакции зависит от природы реагирующих веществ
Задание
Запишите уравнения реакций и
сделайте вывод о скорости двух реакций.
Опыт
Лабораторный опыт
Взаимодействие
цинка с соляной кислотой.
Взаимодействие
цинка с уксусной кислотой.
Слайд 13Скорость химической реакции зависит от температуры
Задание
Сделайте вывод о влиянии температуры на
скорость реакций.
Опыт
Лабораторный опыт
Взаимодействие
цинка с соляной кислотой при н.у.
Взаимодействие
цинка с соляной кислотой при нагревании
Слайд 14Правило Вант – Гоффа :
При увеличении температуры на каждые
100С, скорость химической реакции увеличивается в 2-4 раза.

Слайд 16Задание
Как изменится скорость реакции:
а) при повышении температуры
от
100С до 500С
б) при понижении температуры
от 100С до 00С

Слайд 18Скорость химической реакции зависит от поверхности соприкосновения реагирующих веществ
Задание
Сделайте вывод о
влиянии поверхности соприкосновения реагирующих веществ на скорость реакций.
Опыт
Лабораторный опыт
Взаимодействие
карбоната кальция (кусочек и порошок) с соляной кислотой

Слайд 19Первая стадия – колчедан размалывают и подают в печь ленточным транспортёром.
Через
размолотый колчедан пропускают сильную струю воздуха. Создаётся иллюзия кипящей жидкости.
(метод кипящего слоя)

Слайд 20Скорость химической реакции зависит от концентрации реагирующих веществ
Задание
Сделайте вывод о скорости
двух реакций.
Опыт
Где сгорит быстрее деревянный предмет:
а) на воздухе
б) в чистом кислороде?

Слайд 21 Закон действующих масс:
скорость химической реакции пропорциональна произведению концентраций
реагирующих веществ, возведённых в степень их коэффициентов в уравнении реакции

Слайд 22
v =k • [A]a • [B]b
aA + bB =
cC + dD
![Презентация по химии на тему Скорость химической реакции (подготовка к ЕГЭ) v =k • [A]a • [B]b aA + bB = cC + dD v =k • [A]a • [B]b aA + bB = cC + dD](https://shareslide.ru/img/thumbs/8c18f9c43aa190d9799f5937f8c34601-800x.jpg)
Слайд 23Составить кинетические уравнения для следующих реакций:
а) взаимодействие водорода с йодом
б) взаимодействие
железа с хлором
в) гидрирование этилена
Как изменится скорость реакции
2А + В → АВ если,
а) концентрацию вещества А увеличить в 3 раза
б) концентрацию вещества В уменьшить в 3 раза
в) давление увеличить в 3 раза
Задание

Слайд 24Скорость химической реакции зависит от катализатора
Задание
Сделайте вывод о влиянии катализатора на
скорость реакций.
Опыт
Демонстрационный эксперимент

ТЕМА УРОКА
«Скорость химических реакций. Факторы, влияющие на скорость химической реакции»
ЦЕЛЬ
Выяснить, какие условия необходимо создать, чтобы началась химическая реакция;
научиться определять скорость химической реакции;
рассмотреть единицу измерения скорости химической реакции;
выяснить от каких факторов зависит скорость химических реакций.
ХИМИЧЕСКИЕ РЕАКЦИИ ПРОТЕКАЮТ С РАЗЛИЧНЫМИ СКОРОСТЯМИ
— Мгновенно ( при взрыве; в водных растворах, например, при смешивании растворов хлорида бария и сульфата натрия образуется сульфат бария в виде белого осадка);
- Быстро ( растворение цинка в соляной кислоте; горение магния);
— Медленно (образование ржавчины на железных предметах; окисление меди).
УСЛОВИЕ ВОЗНИКНОВЕНИЯ ХИМИЧЕСКОЙ РЕАКЦИИ
Соприкосновение веществ
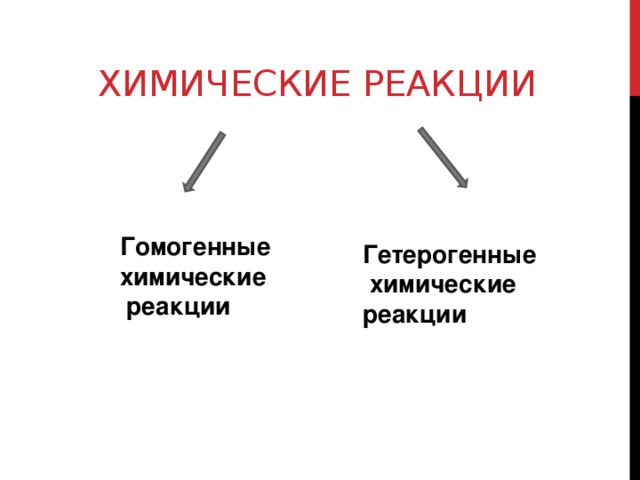
ХИМИЧЕСКИЕ РЕАКЦИИ
Гетерогенные химические реакции
Гомогенные
химические
реакции
ГОМОГЕННЫЕ ХИМИЧЕСКИЕ РЕАКЦИИ
— химические реакции, протекающие в однородной среде, например в растворе или газовой фазе, то взаимодействие реагирующих веществ происходит во всём объёме
ГЕТЕРОГЕННЫЕ ХИМИЧЕСКИЕ РЕАКЦИИ
Если реакция идет между веществами, находящихся в разных агрегатных состояниях или между веществами, неспособными образовывать гомогенную среду (между несмешивающимися жидкостями), то она происходит только на поверхности соприкосновения веществ .
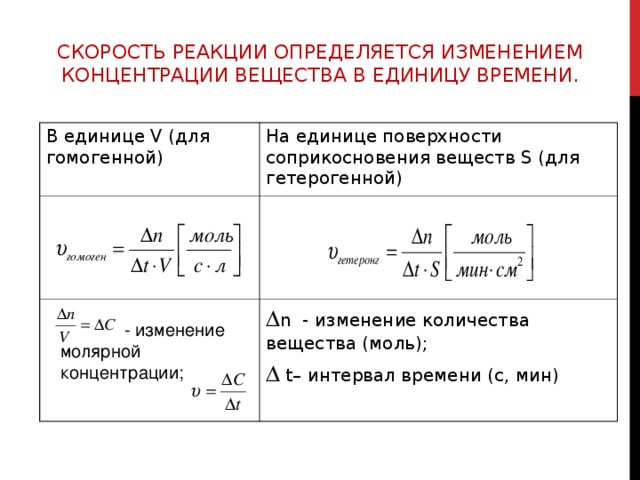
СКОРОСТЬ РЕАКЦИИ ОПРЕДЕЛЯЕТСЯ ИЗМЕНЕНИЕМ КОНЦЕНТРАЦИИ ВЕЩЕСТВА В ЕДИНИЦУ ВРЕМЕНИ.
В единице V (для гомогенной)
На единице поверхности соприкосновения веществ S (для гетерогенной)
n — изменение количества вещества (моль);
t– интервал времени (с, мин)
— изменение молярной концентрации;
АНАЛИЗ ТАБЛИЦЫ, ВЫВОДЫ:
по приведённым формулам можно рассчитать лишь некоторую среднюю скорость данной реакции в выбранном интервале времени (ведь для большинства реакций скорость уменьшается по мере их протекания);
Значение скорости реакции зависит от того, по какому веществу её определяют
Например, для реакции Н 2 +CI 2 = 2НCI
из 1 моль Н 2 образуется 2 моль НCI
скорость реакции увеличится в 2 раза ( по изменению концентрации HCI )
ЗАДАЧА НА ПРИМЕНЕНИЕ ЗНАНИЙ ПО «СКОРОСТИ ХИМИЧЕСКИХ РЕАКЦИЙ»
Химическая реакция протекает в растворе, согласно уравнению: А+В = С. Исходные концентрация: вещества А – 0,80 моль/л. Через 20 минут концентрация вещества А снизилась до 0, 74 моль/л.
Определите:
среднюю скорость реакции за этот промежуток времени;
САМОПРОВЕРКА.
Дано:
С (А) 1 = 0,80 моль/л
С (А) 2 = 0,74 моль/л
= 20 мин
Найти.
гомоген =?
Решение:
а) определение средней скорости реакции в растворе производится по формуле:
Ответ: гомоген. = 0,003 моль/л
ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
— природа реагирующих веществ;
— температура;
— концентрация реагирующих веществ;
— действие катализаторов;
— поверхность соприкосновения реагирующих веществ (в гетерогенных реакциях).
Суть: реакции происходят при столкновении частиц реагентов, которые обладают определённой энергией.
Чем больше частиц реагентов, чем ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать.
К реакции приводят лишь эффективные соударения , т.е. такие при которых разрушаются или ослабляются «старые связи» и поэтому могут образоваться «новые». Но для этого частицы должны обладать достаточной энергией.
Минимальный избыток энергии (над средней энергией частиц в системе), необходимый для эффективного соударения частиц в системе), необходимый для эффективного соударения частиц реагентов, называется энергией активации Е а.
ИЗМЕНЕНИЕ КОЛИЧЕСТВА ВЕЩЕСТВА, ПО КОТОРОМУ ОПРЕДЕЛЯЮТ СКОРОСТЬ РЕАКЦИИ – ВНЕШНИЙ ФАКТОР
Суть: реакции происходят при столкновении частиц реагентов, которые обладают определённой энергией.
Чем больше частиц реагентов, чем ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать.
К реакции приводят лишь эффективные соударения , т.е. такие при которых разрушаются или ослабляются «старые связи» и поэтому могут образоваться «новые». Но для этого частицы должны обладать достаточной энергией.
Минимальный избыток энергии (над средней энергией частиц в системе), необходимый для эффективного соударения частиц в системе), необходимый для эффективного соударения частиц реагентов, называется энергией активации Е а.
1. ПРИРОДА РЕАГИРУЮЩИХ ВЕЩЕСТВ.
Под природой реагирующих веществ понимают их состав, строение, взаимное влияние атомов в неорганических и органических веществах.
Величина энергии активации веществ – это фактор, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции.
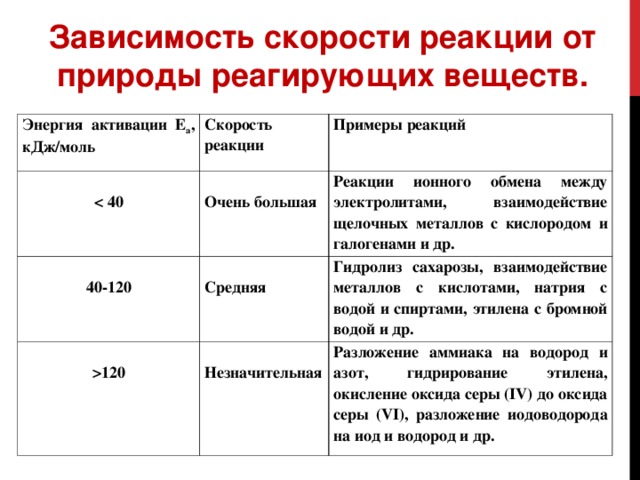
Зависимость скорости реакции от природы реагирующих веществ.
Энергия активации Е а , кДж/моль
Скорость реакции
Примеры реакций
Очень большая
40-120
Средняя
Реакции ионного обмена между электролитами, взаимодействие щелочных металлов с кислородом и галогенами и др.
120
Гидролиз сахарозы, взаимодействие металлов с кислотами, натрия с водой и спиртами, этилена с бромной водой и др.
Незначительная
Разложение аммиака на водород и азот, гидрирование этилена, окисление оксида серы (IV) до оксида серы (VI), разложение иодоводорода на иод и водород и др.
ЗАДАНИЕ НА ПРИМЕНЕНИЕ ЗНАНИЙ
Объясните разную скорость взаимодействия цинка и магния с уксусной кислотой; цинка с соляной и уксусной кислотой.
Напишите соответствующие реакции
2. ТЕМПЕРАТУРА
При увеличении температуры на каждые 10° С скорость реакции увеличивается в 2-4 раза.
Число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры на 10° С, называют температурным коэффициентом.
Правило Вант-Гоффа математически выражается следующей формулой:
где –скорость реакции при температуре t 2 ,
– скорость реакции при температуре t 1 ,
– температурный коэффициент.
ЗАДАЧА НА ПРИМЕНЕНИЕ ЗНАНИЙ:
Определите, как изменится скорость некоторой реакции:
при повышении температуры от 10° до 50° С;
Температурный коэффициент реакции равен 3.
САМОПРОВЕРКА
подставить данные задачи в формулу:
скорость реакции увеличится в 81 раз
3. КОНЦЕНТРАЦИЯ РЕАГИРУЮЩИХ ВЕЩЕСТВ.
На основе большого экспериментального материала в 1867 г. норвежские учёные К. Гульдберг, и П Вааге и независимо от них в 1865 г. русский учёный Н.И. Бекетов сформулировали основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентраций реагирующих веществ:
скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях равных их коэффициентам в уравнении реакции.
Этот закон ещё называют
законом действующих масс.
МАТЕМАТИЧЕСКОЕ ВЫРАЖЕНИЕ ЗАКОНА ДЕЙСТВУЮЩИХ МАСС.
По закону действующих масс скорость реакции, уравнение которой А+В=С может быть вычислена по формуле:
v 1 = k 1 C A C B ,
а скорость реакции, уравнение которой А+2В=D, может быть вычислена по формуле:
v 2 = k 2 C A C B .
В этих формулах: C A и C B – концентрации веществ А и В (моль/л), k 1 и k 2 – коэффициенты пропорциональности, называемые константами скоростей реакции . Эти формулы также называют кинетическими уравнениями.
ЗАДАЧА НА ПРИМЕНЕНИЕ ЗНАНИЙ:
1.Составьте кинетические уравнения для следующих реакций:
А) H 2 +I 2 =2HI;
Б) 2 Fe + 3CI 2 = 2 FeCI 3 .
2. Как изменится скорость реакции, имеющей кинетическое уравнение
2A + B = C,
если
концентрацию вещества А увеличить в 3 раза;
САМОПРОВЕРКА.
Решение. Подставим соответствующие данные в кинетическое уравнение, сравним скорости реакций.
скорость реакции увеличится в 9 раз.
4. ДЕЙСТВИЕ КАТАЛИЗАТОРА
Обсуждение вопросов:
1.Что такое катализатор и каталитические реакции?
2. Приведите примеры известных вам каталитических реакций из органической и неорганической химии. Укажите названия веществ – катализаторов.
3. Выскажите предположение о механизме действия катализаторов (на основе теории столкновений).
4. Каково значение каталитических реакций?
5.ПОВЕРХНОСТЬ СОПРИКОСНОВЕНИЯ РЕАГИРУЮЩИХ ВЕЩЕСТВ.
Скорость реакции увеличивается благодаря:
-увеличению площади поверхности соприкосновения реагентов (измельчение);
-повышению реакционной способности частиц на поверхности образующихся при измельчении микрокристаллов;
-непрерывному подводу реагентов и хорошему отводу продуктов с поверхности, где идёт реакция.
Фактор связан с гетерогенными реакциями, которые протекают на поверхности соприкосновения реагирующих веществ: газ — твердое вещество, газ — жидкость, жидкость — твердое вещество, жидкость — другая жидкость, твердое вещество — другое твердое вещество, при условии, что они не растворимы друг в друге.
Приведите примеры гетерогенных реакций.
ВЫВОДЫ ПО ТЕМЕ УРОКА
Химические реакции протекают с различными скоростями. Величина скорости реакции зависит от объёма в гомогенной системе и от площади соприкосновения реагентов – в гетерогенной.
На пути всех частиц, вступающих в химическую реакцию, имеется энергетический барьер, равный энергии активации Eа.
Скорость реакции зависит от факторов :
-природа реагирующих веществ;
-температура;
-концентрация реагирующих веществ;
— действие катализаторов;
-поверхность соприкосновения реагирующих веществ (в гетерогенных реакциях).
ВЫВОДЫ ПО ТЕМЕ УРОКА
Величина энергии активации веществ – это фактор, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции. Чем меньше энергия активации, тем больше эффективных соударений реагирующих частиц.
При увеличении температуры на 10º С общее число активных соударений увеличивается в 2-4 раза.
Чем больше концентрации реагентов, тем больше соударений реагирующих частиц, а среди них и эффективных соударений.
Катализатор изменяет механизм реакции и направляет её по энергетически более выгодному пути с меньшей энергией активации. Ингибитор замедляет ход реакции.
Гетерогенные реакции протекают на поверхности соприкосновения реагирующих веществ. Нарушение правильной структуры кристаллической решётки приводит к тому, что частицы на поверхности образующихся микрокристаллов значительно реакционноспособнее, чем те же частицы на «гладкой» поверхности.
Презентация на тему «Тема: СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ. Химическое равновесие.»
-
Скачать презентацию (0.52 Мб)
-
108 загрузок -
0.0 оценка
Ваша оценка презентации
Оцените презентацию по шкале от 1 до 5 баллов
- 1
- 2
- 3
- 4
- 5
Комментарии
Добавить свой комментарий
Аннотация к презентации
«Тема: СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ. Химическое равновесие.» состоит из 23 слайдов: лучшая powerpoint презентация на эту тему с анимацией находится здесь! Вам понравилось? Оцените материал! Загружена в 2018 году.
-
Формат
pptx (powerpoint)
-
Количество слайдов
23
-
Слова
-
Конспект
Отсутствует
Содержание
-
Слайд 1
Тема: СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ. Химическое равновесие.
Урок № 11
-
Слайд 2
Раздел химии, изучающий скорости химических реакций, называется химической кинетикой.
Реакции, протекающие в гомогенной системе, идут во всем объеме этой системе.
Реакции, протекающие между веществами, образующими гетерогенную систему, идут только на поверхности раздела фаз, образующих систему.
В связи с этим скорость гомогенной реакции и скорость гетерогенной реакции определяются различно. -
Слайд 3
Скорость гомогенной реакции называется количество вещества, вступившего в реакцию или образующегося при реакции за единицу времени в единице объема системы.
где: – изменение количества вещества, моль;
– объем, ;
– время протекания реакции, сек.
-
Слайд 4
Скорость гетерогенной реакции называется количество вещества, вступившего в реакцию или образующегося при реакции за единицу времени на единице поверхности фазы.
где – изменение количества вещества, моль;
– площадь поверхности раздела фаз, ;
– время протекания реакции, сек. -
Слайд 5
Факторы, влияющие на скорость реакции
природа реагирующих веществ,
Концентрации веществ,
температура,
присутствие в системе катализаторов.
Скорость некоторых гетерогенных реакций зависит от интенсивности (скорости) перемешивания жидкости или газа около поверхности, на которой происходит реакция. -
Слайд 6
Зависимость скорости реакции от концентрации реагирующих веществ.
Зависимость скорости реакции от концентрации реагирующих веществ выражается основным законом химической кинетики – законом действия масс: скорость химической реакции при постоянной температуре прямо пропорциональна произведению молярных концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам.
-
Слайд 7
Так скорость реакции
аА + bВ = сС + dD,где [A], [B] – молярные концентрации реагентов, моль/л;
k – константа скоростиданной реакции, равная скорости реакции при концентрациях реагирующих веществ, равных 1 моль/л;
a, b – стехиометрические коэффициенты. -
Слайд 8
Величина константы скорости k зависит от природы реагирующих веществ, от температуры и от присутствия катализаторов, но не зависит от концентраций веществ.
-
Слайд 9
В случае гетерогенных реакций в уравнения закона действия масс входят концентрации только тех веществ, которые находятся в газовой фазе или в растворе.
1)2)
-
Слайд 10
Зависимость скорости реакции от температуры и от природы веществ.
Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации данной реакции.
Молекулы, обладающие такой энергией, называются активными молекулами.
При повышении температуры скорость реакции, как правило, увеличивается. Это вызвано увеличением числа частиц, энергия которых превышает энергию активации. -
Слайд 11
Правило Вант – Гоффа: при повышении температуры на каждые десять градусов скорость реакции увеличивается в 2-4 раза.
где: , -скорость реакции при температуре,
– температурный коэффициент;
, — температура.
-
Слайд 12
Зависимость константы скорости реакции от температуры выражается уравнением Аррениуса:
где k – константа скорости
k0 = Z0∙P -
Слайд 13
Z0 – число, пропорциональное количеству соударений, зависящее от массы и размера частиц;
Р – стерический множитель, показывающий вероятность столкновений в направлении, которое благоприятно для перераспределения связей;
Ea – энергия активации, кДж/моль;
R= 8,31 кДж/моль – газовая постоянная
T – температура, К. -
Слайд 14
Влияние катализатора на скорость реакции. Катализ.
Вещества, не расходующиеся в результате протекания реакции, но влияющие на ее скорость называются катализаторами.
Явление изменения скорости реакции под действием катализатора называется катализом.
Реакции, протекающие под действием катализаторов, называются каталитическими. -
Слайд 15
Различают гомогенный, гетерогенный катализ и автокатализ.
В случае гомогенного катализа катализатор и реагирующие вещества образуют одну фазу (газ или раствор). Гомогенный катализ происходит во всем объеме системы.
Гетерогенный катализ – катализатор находится в самостоятельной фазе. Гетерогенный катализ протекает на поверхности катализатора.
Автокатализ происходит, когда одно из веществ в системе является катализатором данной реакции. -
Слайд 16
ХИМИЧЕСКОЕ РАВНОВЕСИЕ.
Все химические реакции можно разбить на две группы: необратимые и обратимые. Необратимые реакции протекают практически до конца – до полного израсходования одного из реагирующих веществ.
Обратимыереакции протекают не до конца, они могут протекать как в прямом, так и в обратном направлении.
Когда скорости прямой и обратной реакций становятся равными, наступает химическое равновесие. -
Слайд 17
Количественной характеристикой химического равновесия служит величина, называемая константой химического равновесия.
аА + bВ = сС + dD -
Слайд 18
— константа равновесия.
-
Слайд 19
Величина константы равновесия зависит от природы реагирующих веществ и от температуры. От присутствия катализаторов она не зависит. Поскольку катализатор изменяет энергию активации и прямой, и обратной реакций на одну и ту же величину, то на отношение констант их скорости он не оказывает влияния.
-
Слайд 20
СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ.
Принцип ЛеШателье: если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в сторону, ослабляющую это воздействие.
-
Слайд 21
Нарушение равновесия вследствие изменения концентрации какого-либо из веществ, участвующих в реакции.
При увеличении концентрации какого-либо из веществ, участвующих в реакции, равновесие смещается в сторону расхода этого вещества;
при уменьшении концентрации какого-либо из веществ равновесие смещается в сторону образования этого вещества. -
Слайд 22
Нарушение равновесия вследствие изменения давления (путем уменьшения или увеличения объема системы).
При увеличении давления путем сжатия системы равновесие сдвигается в сторону уменьшения числа молекул газов, т. е. в сторону понижения давления;
при уменьшении давления равновесие сдвигается в сторону возрастания числа молекул газов, т. е. в сторону увеличения давления. -
Слайд 23
Нарушение равновесия вследствие изменения температуры.
При повышении температуры равновесие смещается в направлении эндотермической реакции,
при понижении – в направлении экзотермической реакции.
Посмотреть все слайды
Сообщить об ошибке
Похожие презентации









Спасибо, что оценили презентацию.
Мы будем благодарны если вы поможете сделать сайт лучше и оставите отзыв или предложение по улучшению.
Добавить отзыв о сайте






















![v =k • [A]a • [B]b aA + bB = cC + dD v =k • [A]a • [B]b aA + bB = cC + dD](https://documents.infourok.ru/43228241-a551-4108-a646-7d33e7a8059e/0/slide_22.jpg)