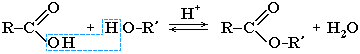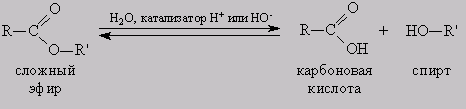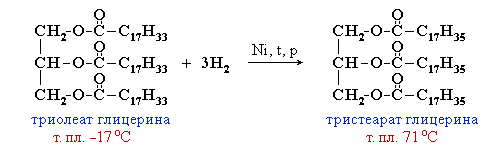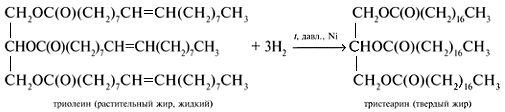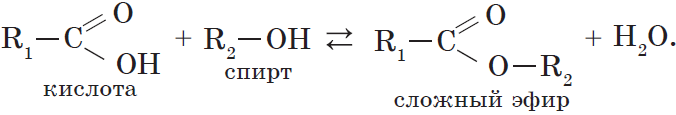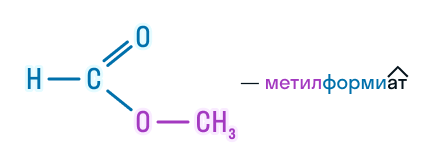Сложные эфиры: способы получения, химические и физические свойства, строение.
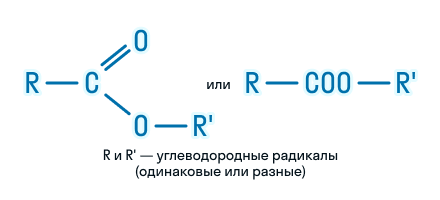
Сложные эфиры – это органические вещества, в молекулах которых углеводородные радикалы соединены через карбоксильную группу -СОО-, а именно R1-COOH-R2.
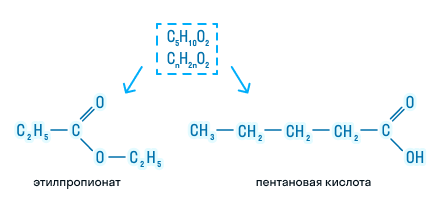
Общая формула предельных сложных эфиров: СnH2nO2
Классификация сложных эфиров
По числу карбоксильных групп:
- сложные эфиры одноосновных карбоновых кислот — содержат одну карбоксильную группу -СОО-. Общая формула CnH2nO2.
H-COO-CH3
- сложные эфиры многоатомных спиртов — содержат две и более карбоксильные группы -СОО-.
Например, тристеарат глицерина
- Сложные эфиры многоосновных органических кислот.
Например, общая формула сложных эфиров двухосновных карбоновых кислот CnH2n-2O4
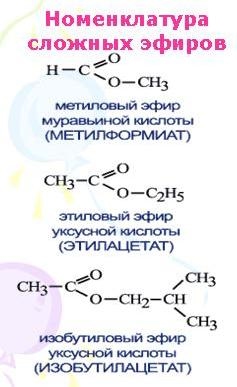
Номенклатура сложных эфиров
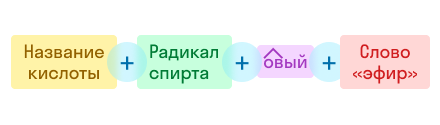
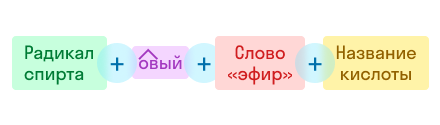
В названии сложного эфира сначала указывают алкильную группу, связанную с кислородом, затем кислоту, заменяя суффикс в названии кислоты (-овая кислота) на суффикс -оат.
| Название сложного эфира | Тривиальное название | Формула эфира |
| Метилметаноат | Метилформиат | HCOOCH3 |
| Этилметаноат | Этилформиат | HCOOC2H5 |
| Метилэтаноат | Метилацетат | CH3COOCH3 |
| Этилэтаноат | Этилацетат | CH3COOC2H5 |
| Пропилэтаноат | Пропилацетат | CH3COOCH2CH2CH3 |
Химические свойства сложных эфиров
.1. Гидролиз
Сложные эфиры устойчивы в нейтральной среде, но легко разлагаются при нагревании в присутствии кислот или в присутствии щелочей.
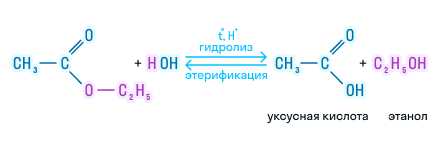
В присутствии кислот гидролиз сложных эфиров протекает как реакция, обратная этерификации. при гидролизе сложных эфиров образуются спирты и карбоновые кислоты.
R-COO-R’ + H2O = R-COOH + R’-OH
Например, при гидролизе метилацетата образуются уксусная кислота и метанол.
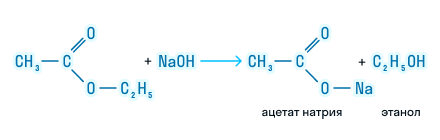
При щелочном гидролизе сложных эфиров образуются соли карбоновых кислот и спирты.
Например, при щелочном гидролизе этилформиата образуются этанол и формиат натрия:
При щелочном гидролизе этилацетата образуются ацетат и этанол:
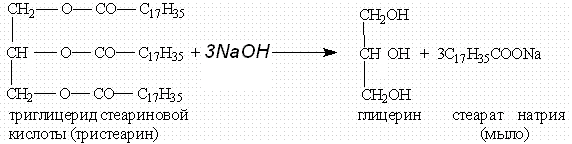
Щелочной гидролиз сложных эфиров — реакция, имеющая промышленное значение. Гидролиз жиров в присутствии оснований — древнейший способ получения мыла. Первые способы получения мыла связаны со смешиванием жира с золой. Один из основных компонентов животного жира — тристеарат глицерина. В щелочной среде тристеарат глицерина разлагается на глицерин и соль стеариновой кислоты:
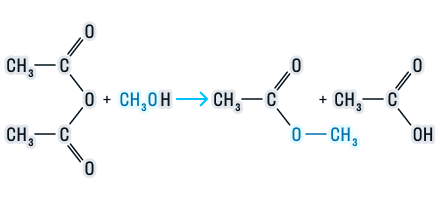
2. Переэтерификация
Переэтерификация — это реакция превращения одного сложного эфира в другой под действием соответствующих спиртов в присутствии катализатора (кислоты или основания)
R-COO-CH3 + R’-OH = R-COOR’ + CH3-OH
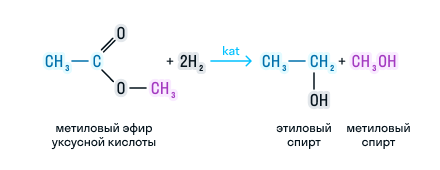
3.Восстановление сложных эфиров
Сложные эфиры восстанавливаются с разрывом связи С-О карбоксильной группы. При этом образуется смесь спиртов.
Например, этилбензоат восстанавливается литийалюминийгидридом до бензилового спирта и этанола
C6H5-COO-C2H5 + [H] = C6H5-CH2OH + C2H5-OH
Получение сложных эфиров
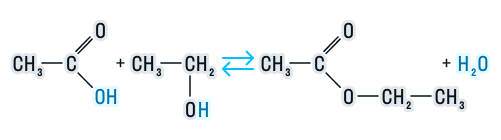
1. Этерификация карбоновых кислот спиртами
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.
Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты):
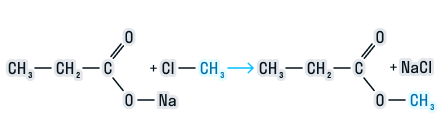
2. Соли карбоновых кислот с галогеналканами
При взаимодействии солей карбоновых кислот с галогеналканами образуются сложные эфиры.
Например, при взаимодействии ацетата натрия с хлорметаном образуется метилацетат.
CH3-COONa + CH3-Cl = CH3-COOCH3 + NaCl
Например, при взаимодействии формиата натрия с хлорэтаном образуется этилформиат.
H-COONa + C2H5-Cl = H-COOC2H5 + NaCl
Чтобы поделиться, нажимайте
Сложные эфиры – функциональные производные карбоновых кислот,
в молекулах которых гидроксильная группа (-ОН) замещена на остаток спирта (-OR)
Сложные эфиры карбоновых кислот – соединения с общей формулой
R–COOR’, где R и R’ – углеводородные радикалы.
Физические свойства:
- · Летучие, бесцветные жидкости
- · Плохо растворимы в воде
- · Чаще с приятным запахом
- · Легче воды
Сложные эфиры содержатся в цветах, фруктах, ягодах. Они определяют их специфический запах.
Являются составной частью эфирных масел (известно около 3000 эф.м. – апельсиновое, лавандовое, розовое и т. д.)
Эфиры низших карбоновых кислот и низших одноатомных спиртов имеют приятный запах цветов, ягод и фруктов. Эфиры высших одноосновных кислот и высших одноатомных спиртов – основа природных восков. Например, пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат):
CH3(CH2)14–CO–O–(CH2)29CH3
Краткие названия сложных эфиров строятся по названию радикала (R’) в остатке спирта и названию группы RCOO— в остатке кислоты. Например, этиловый эфир уксусной кислоты CH3COOC2H5 называется этилацетат.
Применение
· В качестве отдушек и усилителей запаха в пищевой и парфюмерной (изготовление мыла, духов, кремов) промышленности;
· В производстве пластмасс, резины в качестве пластификаторов.
Пластификаторы – вещества, которые вводят в состав полимерных материалов для придания (или повышения) эластичности и (или) пластичности при переработке и эксплуатации.
Применение в медицине
В конце XIX — начале ХХ века, когда органический синтез делал свои первые шаги, было синтезировано и испытано фармакологами множество сложных эфиров. Они стали основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время практически вытесненный более эффективными средствами.
Получение сложных эфиров
Cложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации). Катализаторами являются минеральные кислоты.
Реакция этерификации в условиях кислотного катализа обратима. Обратный процесс – расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта – называют гидролизом сложного эфира.
RCOOR’ + H2O (H+)↔ RCOOH + R’OH
Гидролиз в присутствии щелочи протекает необратимо (т.к. образующийся отрицательно заряженный карбоксилат-анион RCOO– не вступает в реакцию с нуклеофильным реагентом – спиртом).
Эта реакция называется омылением сложных эфиров (по аналогии со щелочным гидролизом сложноэфирных связей в жирах при получении мыла).
Жиры
Жиры — сложные эфиры глицерина и высших одноатомных карбоновых кислот .
Общее название таких соединений — триглицериды или триацилглицерины, где ацил — остаток карбоновой кислоты -C(O)R.
В состав природных триглицеридов входят остатки насыщенных кислот (пальмитиновой C15H31COOH, стеариновой C17H35COOH) и ненасыщенных (олеиновой C17H33COOH, линолевой C17H29COOH).
Жиры содержатся во всех растениях и животных. Животные жиры (бараний, свиной, говяжий и т.п.), как правило, являются твердыми веществами с невысокой температурой плавления (исключение — рыбий жир). Они состоят главным образом из триглицеридов предельных кислот.
Растительные жиры (подсолнечное масло, соевое, хлопковое и др.) – жидкости (исключение — кокосовое масло). В состав этих триглицеридов входят остатки непредельных кислот.
Жидкие жиры превращают в твердые путем реакции гидрогенизации (гидрирования). При этом водород присоединяется по двойной связи, содержащейся в углеводородном радикале молекул масел .
Продукт гидрогенизации масел — твердый жир (искусственное сало, саломас).
Маргарин — пищевой жир, состоит из смеси гидрогенизированных масел (подсолнечного, кукурузного, хлопкого и др.), животных жиров, молока и вкусовых добавок (соли, сахара, витаминов и др.).
Жирам как сложным эфирам свойственна обратимая реакция гидролиза, катализируемая минеральными кислотами. При участии щелочей гидролиз жиров происходит необратимо. Продуктами в этом случае являются мыла – соли высших карбоновых кислот и щелочных металлов.
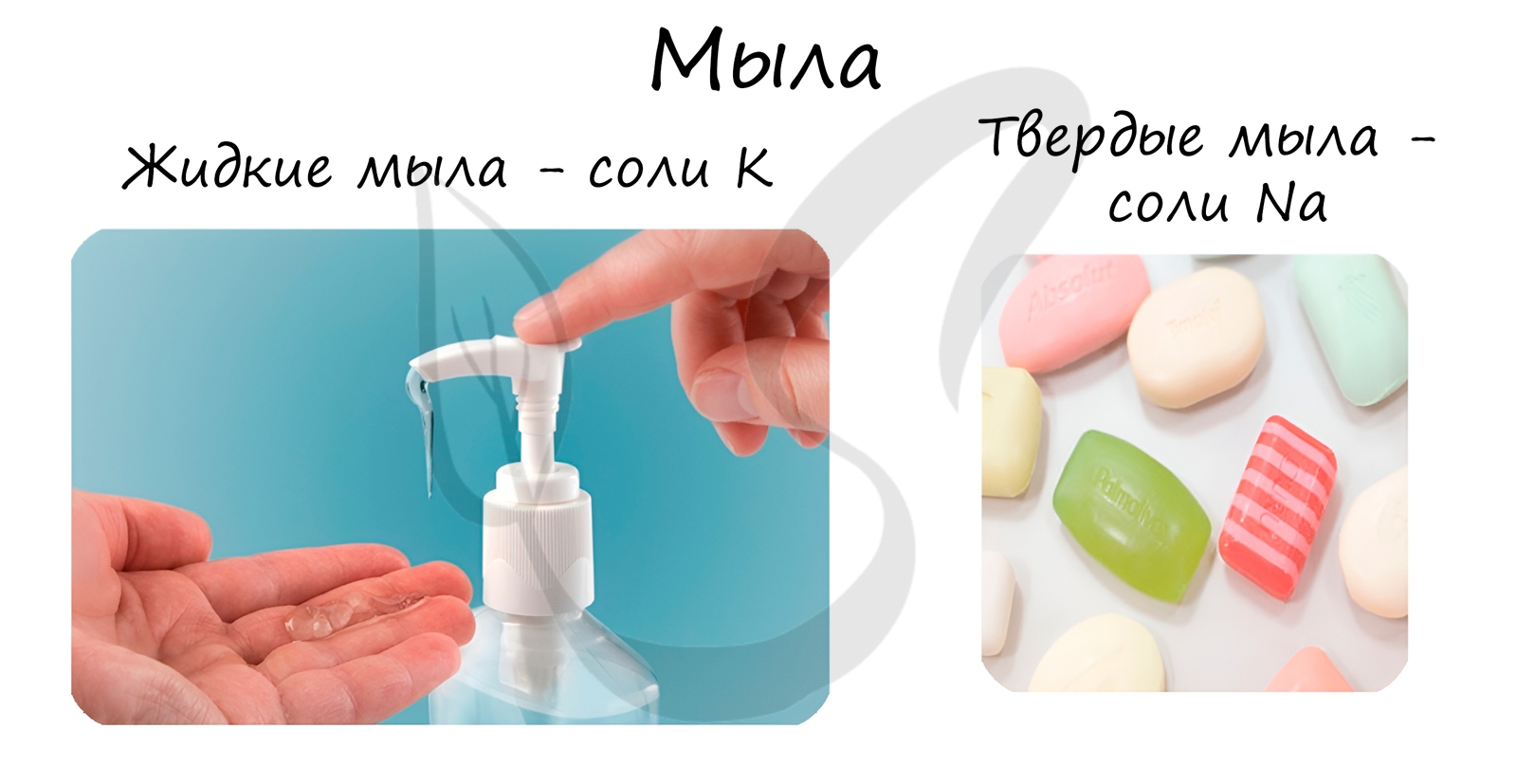
Натриевые соли — твердые мыла, калиевые — жидкие. Реакция щелочного гидролиза жиров, и вообще всех сложных эфиров, называется также омылением.
Природные жиры содержат следующие жирные кислоты
| Насыщенные:
стеариновая (C17H35COOH) пальмитиновая (C15H31COOH) Масляная (C3H7COOH) |
В СОСТАВЕ
ЖИВОТНЫХ ЖИРОВ |
| Ненасыщенные:
олеиновая (C17H33COOH, 1 двойная связь) линолевая (C17H31COOH, 2 двойные связи) линоленовая (C17H29COOH, 3 двойные связи) арахидоновая (C19H31COOH, 4 двойные связи, реже встречается) |
В СОСТАВЕ
РАСТИТЕЛЬНЫХ ЖИРОВ |
Жиры содержатся во всех растениях и животных. Они представляют собой смеси полных сложных эфиров глицерина и не имеют чётко выраженной температуры плавления.
Физические свойства жиров
- Животные жиры (бараний, свиной, говяжий и т.п.), как правило, являются твердыми веществами с невысокой температурой плавления (исключение – рыбий жир). В твёрдых жирах преобладают остатки насыщенных кислот.
- Растительные жиры – масла (подсолнечное, соевое, хлопковое и др.) – жидкости (исключение – кокосовое масло, масло какао-бобов). Масла содержат в основном остатки ненасыщенных (непредельных) кислот.
Химические свойства жиров
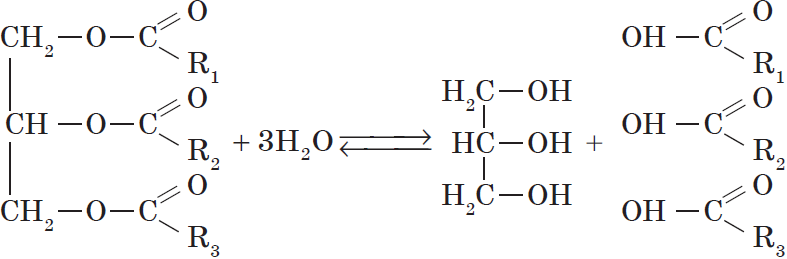
1. Гидролиз, или омыление, жиров происходит под действием воды, с участием ферментов или кислотных катализаторов (обратимо) , при этом образуются спирт — глицерин и смесь карбоновых кислот:
или щелочей (необратимо). При щелочном гидролизе образуются соли высших жирных кислот, называемые мылами. Мыла получаются при гидролизе жиров в присутствии щелочей:
Мыла — это калиевые и натриевые соли высших карбоновых кислот.
2.Гидрирование жиров – превращение жидких растительных масел в твердые жиры – имеет большое значение для пищевых целей. Продукт гидрогенизации масел – твердый жир (искусственное сало, саломас). Маргарин – пищевой жир, состоит из смеси гидрогенизированных масел (подсолнечного, кукурузного, хлопкого и др.), животных жиров, молока и вкусовых добавок (соли, сахара, витаминов и др.).
Так в промышленности получают маргарин:
В условиях процесса гидрогенизации масел (высокая температура, металлический катализатор) происходит изомеризация части кислотных остатков, содержащих цис-связи С=С, в более устойчивые транс-изомеры. Повышенное содержание в маргарине (особенно, в дешевых сортах) остатков транс-ненасыщенных кислот увеличивает опасность атеросклероза, сердечно-сосудистых и других заболеваний.
Реакция получения жиров (этерификация)
Применение жиров
-
- Пищевая промышленность
-
- Фармацевтика
-
- Производство мыла и косметических изделий
-
- Производство смазочных материалов
Эфиры – простые и сложные
Разбор сложных заданий в тг-канале:
Сложные эфиры
При взаимодействии карбоновых кислот со спиртами (реакция этерификации) образуются сложные эфиры:
Эта реакция обратима. Продукты реакции могут взаимодействовать друг с другом с образованием исходных веществ — спирта и кислоты. Таким образом, реакция сложных эфиров с водой — гидролиз сложного эфира — обратна реакции этерификации. Химическое равновесие, устанавливающееся при равенстве скоростей прямой (этерификация) и обратной (гидролиз) реакций, может быть смещено в сторону образования эфира присутствием водоотнимающих средств.
Жиры — производные соединения, которые представляют собой сложные эфиры глицерина и высших карбоновых кислот.
Все жиры, как и другие сложные эфиры, подвергаются гидролизу:
При проведении гидролиза жира в щелочной среде $(NaOH)$ и в присутствии кальцинированной соды $Na_2CO_3$ он протекает необратимо и приводит к образованию не карбоновых кислот, а их солей, которые называются мылами. Поэтому гидролиз жиров в щелочной среде называются омылением.
Сложные эфиры — R1—C=O
— CnH2n
О2– общая
формула.
O—R2
Получают реакцией этерификации из спирта и
карбоновых кислот;
(для жиров – спирт глицерин CH2—OH и высшие
карбоновые кислоты)
|
СН-ОН
|
CH2—OH
Реакция этерификации:
H+
СН3-С=О + H] –O— CH3 ßà
CH3—C=O +H2O
NaOH
[OH метанол
O—CH3 à уксуснометиловый
эфир,
Уксусная кислота метилацетат,
метиловый эфир уксусной кислоты
Необратимая реакция гидролиза в присутствии NaOH с образованием мыла — омыление жиров.
Ж ,З, н в H2O
Ржир<Р(H2O); tкип< низкая;
Воск — сл. эфир высших карбоновых кислот и
высших одноосновных спиртов, например, пчелиный воск — эфир пальмитиновой кислоты
и мирицилового спирта, C15H31COOC31H63
Жир
CH2—O—CO—R1 Большинство жиров образованы тремя карбоновыми
кислотами:
| 2мя
предельными – С15Н31СООН пальмитиновой, С17Н35СООН
стеариновой
СН-О-СО-R2 1ой непредельной – С17Н33СООН
олеиновой
|
CH2— O— CO—R3
Жир, в состав которого входят непредельные
кислоты, называются маслами, они растительного происхождения, исключение рыбий
жир).
Твёрдый жир состоит из предельные кислот (животного
происхождении, исключение — пальмовое масло твёрдое).
Для жиров, содержащие остатки ненасыщенных
кислот характерны реакции непредельных соединений: Br2
(обеспечивают), Н2(гидрирование à получение маргарина) и др.
реакции присоединения, С17Н35СООNa –
твёрдое мыло, С17Н35СООК – жидкое мыло,
Стеарат Na(Тв) Стеарат К(Ж)
В жесткой воде (Са 2+,
Mg 2+) моющее действие слабое, т. к . часть мыла идет на осаждение
Са2+, (C17H35COO)2Ca
Синтетические моющие средства – СМС- Na
соли моноэфиров серной кислоты с высшими спиртами
-R-CH2-O-SO2-ONa
CMC
…
Сложные эфиры карбоновых кислот: Строение
Сложные эфиры являются производными карбоновых кислот, в молекулах которых группа -ОН (в карбоксильной группе) замещена на спиртовый остаток –O-R:
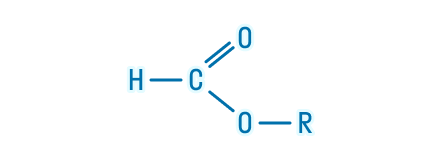
Общая формула сложных эфиров карбоновых кислот R–COOR’, где R и R’ — углеводородные радикалы. В сложных эфирах муравьиной кислоты R – это атом водорода.
Общая формула сложных эфиров предельных одноосновных карбоновых кислот, имеющих в качестве спиртового остатка предельные одноатомные спирты совпадает с общей формулой карбоновых кислот: CnH2nO2 или СnH2n+1-COO-СnH2n+1
Например, молекула метилацетата выглядит следующим образом:
Сложные эфиры карбоновых кислот: Классификация
Сложные эфиры карбоновых кислот можно разделить на три группы.
- Сложные эфиры, образованные низшими карбоновыми кислотами и спиртами. Например, этилацетат, метилпропионат, пропилформиат:
- Сложные эфиры, образованные высшими карбоновыми кислотами и высшими одноосновными спиртами (воски).
Воски делятся на:
- Растительные, например, пальмовый воск, японский воск
- Животные, например, пчелиный воск, шерстяной (шерстный) воск –
ланолин, кожное сало, ушная сера. - Ископаемые, например, торфяной
воск, буроугольный воск (монтан-воск) горный, воск (озокерит). - Синтетические, например, канифоль — хрупкая стекловидная прозрачная масса.
Например, пчелиный воск – сложный эфир пальмитиновой кислоты и мирицилового спирта; кашалотовый воск (спермацет) сложный эфир пальмитиновой кислоты и цетилового спирта:
- Сложные эфиры, образованные трехатомным спиртом глицерином и высшими карбоновыми кислотами (жиры). См. раздел Жиры: Строение, получение, химические свойства
Сложные эфиры карбоновых кислот: Изомерия и номенклатура
Изомерия сложных эфиров карбоновых кислот
Для сложных эфиров характерны изомерия углеродной цепи, положения сложноэфирной группировки, и межклассовая виды изомерии. Для сложных эфиров, образованных непредельной кислотой или непредельным спиртом, возможна пространственная изомерия (цис- , транс-изомерия) и изомерия положения кратной связи.
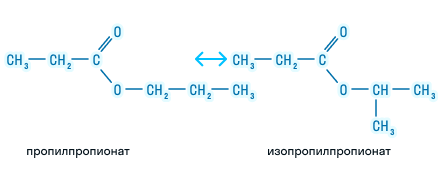
- Изомерия углеродной цепи может наблюдаться по кислотному остатку, начиная с бутановой кислоты, и по спиртовому остатку, начиная с пропилового спирта. Например, сложный эфир с брутто формулой С5H10O2 может иметь такие изомеры, как: метиловый эфир бутановой (масляной) кислоты, бутирату, метиловый эфир изобутановой (изомасляной) кислоты, пропиловый эфир уксусной кислоты и изопропиловый эфир уксусной кислоты изомерны метилизобутират, пропилацетат и изопропилацетат.
- Изомерия положения сложноэфирной группировки наблюдается у сложных эфиров, состоящих не мене чем из 4 атомов углерода, например этиловый эфир пропановой кислоты и метиловый эфир бутановой (масляной) кислоты.
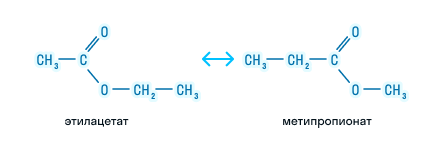
- Межклассовая изомерия. Сложные эфиры изомерны карбоновым кислотам, например, изомерами являются метиловый эфир уксусной кислоты (метилацетат) и пропановая кислота.
- Изомерия положения кратной связи. Например, метиловый эфир 2-пентеновой кислоты и метиловый эфир 3-пентеновой кислоты:
- Пространственная цис-, транс-изомерия. Например, метиловый эфир цис-2-бутеновой кислоты и метиловый эфир транс-2-бутеновой кислоты:
Номенклатура сложных эфиров карбоновых кислот
Согласно систематической номенклатуры ИЮПАК названия сложных эфиров строятся исходя из названий двух остатков: спиртового и кислотного. К названию спиртового остатка прибавляют название кислотного остатка и суффикс –оaт, например:
Согласно тривиальной номенклатуры названия сложных эфиров строятся исходя из названий образующих его кислот и спиртов с добавлением слова эфир. Например:
Кроме этого, название сложного эфира может быть построено из названий кислотной и спиртовой частей, добавляя окончание «ый» и слово «эфир». Например, приведенное в примере соединение по этому правилу можно назвать маслянопропиловый эфир.
Примеры названий сложных эфиров карбоновых кислот:
Жиры — органические соединения, по строению являющиеся сложными эфирами трехатомного спирта глицерина и высших карбоновых (жирных)
кислот.
К жирным кислотам (их формулы лучше выучить 
- Пальмитиновая — C15H31COOH (предельная)
- Стеариновая — C17H35COOH (предельная)
- Олеиновая — C17H33COOH (непредельная, 1 двойная связь в радикале)
- Линолевая — C17H31COOH (непредельная, 2 двойные связи в радикале)
- Линоленовая — C17H29COOH (непредельная, 3 двойные связи в радикале)
Растительные и животные жиры
Жиры образуются в организме растений и животных, служат запасным питательным веществом. В строении растительных и животных жиров
есть некоторые важные отличия.
Заметьте, что растительные жиры чаще жидкие и в них входят преимущественно остатки непредельных жирных кислот, а животные жиры — твердые и
содержат остатки предельных жирных кислот.

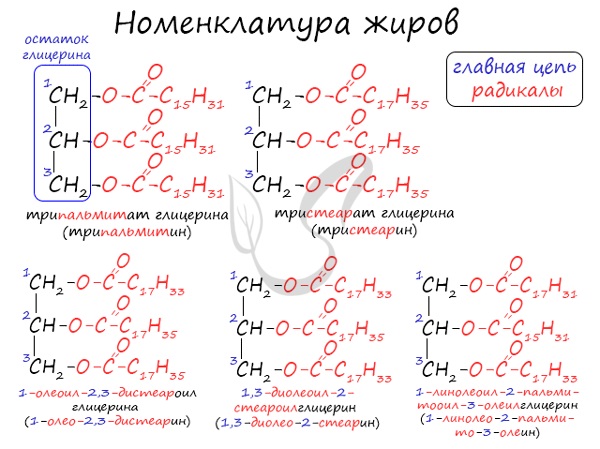
Номенклатура жиров
По систематической номенклатуре жиры принято называть триацилглицеринами. Названия жирам дают в зависимости от ацилов — остатков жирных
кислот, входящих в их состав. Для формирования единого названия к остаткам кислот добавляют суффикс «оил».
В соответствии с тривиальной номенклатурой, жиры называют, добавляя окончание «ин» к названию кислоты и приставку, указывая, сколько гидроксогрупп
в молекуле глицерина подверглось этерификации. В общем лучше 1 раз увидеть, чем 100 раз услышать 
Получение жиров
Жиры (по строению сложные эфиры) получаются в реакции этерификации, протекающей между трехатомным спиртом глицерином и высшими карбоновыми
(жирными) кислотами.
В зависимости от того, какие именно кислоты участвуют в реакции, образуются различные жиры.

Химические свойства жиров
- Гидрирование растительных жиров
- Гидролиз
В состав растительных жиров входят непредельные кислоты, которые поддаются гидрированию и превращаются в предельные. Таким путем в пищевой
промышленности получают маргарин.
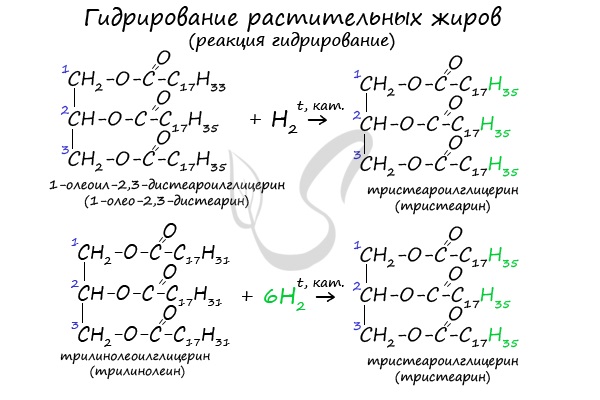
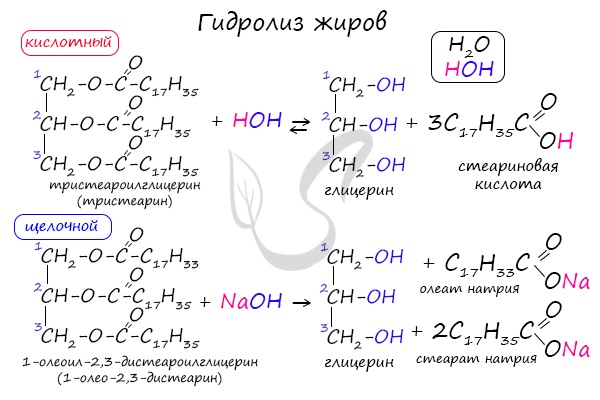
Как сложные эфиры, жиры способны вступать в реакцию гидролиза, который может быть кислотным и щелочным. В результате кислотного гидролиза
образуется глицерин и исходные жирные кислоты, в результате щелочного гидролиза — глицерин и соли жирных кислот.
Реакция щелочного гидролиза жиров называется реакцией омыления, в результате получаются соли жирных кислот — мыла. Кислотный гидролиз протекает
обратимо, щелочной — необратимо.
В состав твердого мыла входят соли Na, в состав жидкого — K.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Для начала дадим определение и разберемся, почему эти эфиры — сложные.
Сложные эфиры или эсте́ры (от древнегреческого αἰθήρ — «эфир») — это класс соединений на основе неорганических (минеральных) или органических (карбоновых) одно- или многоосновных кислот, у которых атом водорода в гидроксогруппе замещен на радикал. Эпитет «сложные» они получили для того, чтобы их не путали с простыми эфирами — производными спиртов.
Общая формула сложных эфиров выглядит так:
Однако представители сложных эфиров муравьиной кислоты выглядят иначе. Для них общая формула приобретает такой вид:
Номенклатура сложных эфиров
Теперь поговорим о том, как называть представителей данного класса. Различают два способа, позволяющие назвать сложные эфиры: по систематической номенклатуре (ИЮПАК) или по рациональной номенклатуре. Рассмотрим оба варианта.
-
По номенклатуре ИЮПАК название строится следующим образом:
Например:
-
По рациональной номенклатуре название строится так:
Например:
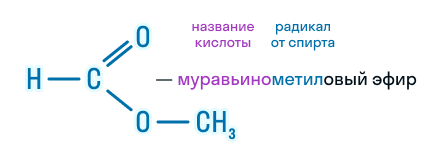
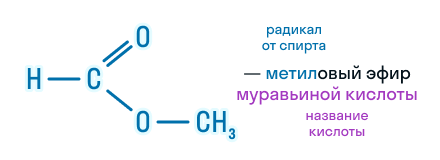
По этой же номенклатуре эфиры можно называть, используя четыре слова: радикал спирта + слово «эфир» + название кислоты + слово «кислота». Например, муравьинометиловый эфир можно иначе назвать метиловый эфир муравьиной кислоты:
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Изомерия сложных эфиров
Возможна ли изомерия для сложных эфиров? Давайте разбираться.
-
Возможна изомерия углеродного скелета у радикала кислоты и радикала спирта при наличии трех и более углеродных атомов.
-
Изомерия положения функциональной группы:
-
Межклассовая изомерия также определяется общей формулой органических соединений. Например:
Физические свойства сложных эфиров
Агрегатное состояние сложного эфира напрямую зависит от молекулярной массы образующих его кислоты и спирта. Так, например, сложные эфиры низших и средних гомологов являются летучими жидкостями с характерным запахом. Чаще всего у них фруктовые или плодовые ароматы. Сложные эфиры хуже растворяются в воде, чем образующие их кислоты и спирты. Чем больше атомов углерода в составе сложного эфира, тем хуже его растворимость в воде.
Эфиры высших карбоновых кислот и высших одноатомных первичных спиртов — основа природного воска. Например, известный пчелиный воск — это сложный эфир пальмитиновой кислоты (C15H31COOH) и мирицилового спирта (С31H63OH).
Химические свойства сложных эфиров
Сложные эфиры подвергаются гидролизу (разложению под действием воды), который бывает двух видов: в кислой среде и в щелочной. Рассмотрим каждый из этих видов.
-
В кислой среде реакция протекает следующим образом:
Эта реакция обратима, так как образующиеся в процессе кислота и спирт подвергаются взаимодействию с образованием этого же сложного эфира. Обратная реакция имеет название реакция этерификации.
-
Щелочной гидролиз или реакция омыления:
Этот вид гидролиза протекает необратимо, так как образовавшаяся в ходе реакции соль не может реагировать со спиртом.
Сложные эфиры можно восстановить водородом в присутствии катализатора до двух спиртов. Причем один из спиртов будет иметь в составе столько атомов углерода, сколько было в кислоте, а во втором спирте количество углерода будет соответствовать исходному спирту. Рассмотрим на примере:
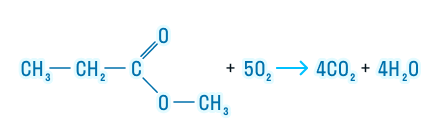
Эфиры подвергаются полному окислению, то есть горят с образованием углекислого газа и воды:
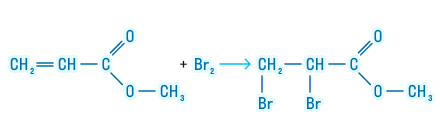
Следующее химическое свойство относится только к тем сложным эфирам, которые образованы непредельной карбоновой кислотой. Сложные эфиры таких кислот могут подвергаться галогенированию. Посмотрим, как происходит эта реакция:
Способы получения сложных эфиров
-
Реакция этерификации.
Реакция обратимая, поэтому требуется либо избыток одного из реагентов, либо отгонка образующегося сложного эфира, чтобы предотвратить обратную реакцию гидролиза.
-
Взаимодействие ангидрида карбоновой кислоты со спиртом с образованием сложного эфира и карбоновой кислоты.
-
Взаимодействие солей карбоновых кислот с галогеналканами.
Нахождение сложных эфиров в природе и применение
Сложные эфиры широко представлены в природе, но их количество минимально. Они участвуют в процессах, которые протекают в живых организмах, а также являются компонентами аромата ряда растений.
Некоторые эфиры получают искусственным способом. Например, за грушевый вкус в лимонаде отвечает уксусноизоамиловый эфир, а за яблочный — изовалерианоэтиловый эфир.
Помимо пищевой промышленности, сложные эфиры применяют в качестве растворителей для приготовления лаков, а также как пластификаторы для приготовления пластических масс.
Сложные эфиры на основе ароматических спиртов нашли применение в парфюмерной промышленности.