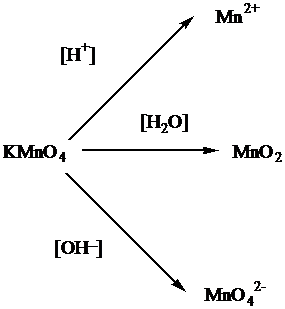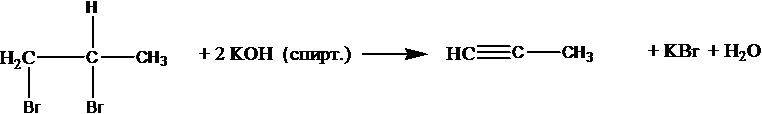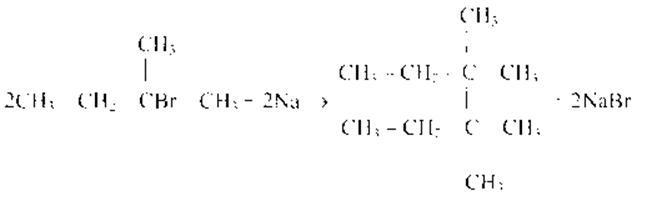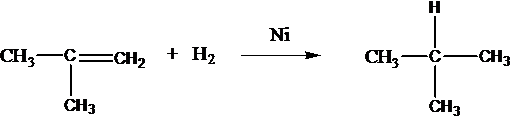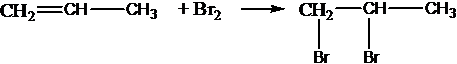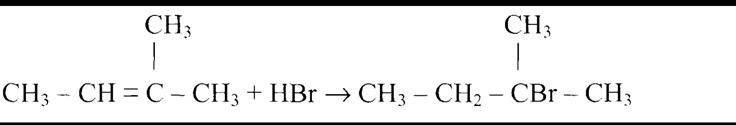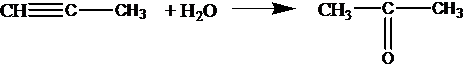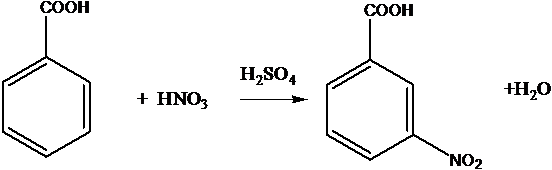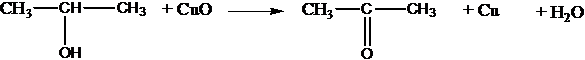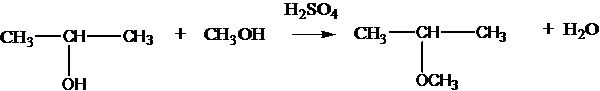Чтобы поделиться, нажимайте
Задания ЕГЭ по номерам (по темам)
Предлагаем вам Задания ЕГЭ по номерам формата ЕГЭ 2022 по химии с ответами и видео-объяснениями. Листайте ниже и выбирайте тот номер задания, который вы хотите выполнить.
- Первая часть (указывается только ответ, без решения)
1. Электронная конфигурация атома
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
2. Закономерности изменения химических свойств элементов. Характеристика элементов
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
3. Электроотрицательность, степень окисления и валентность химических элементов
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
4. Характеристики химических связей. Зависимость свойств веществ от их состава и строения
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
5. Классификация и номенклатура неорганических веществ
- Часть 1 (30 заданий с ответами) — старый формат
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения) — старый формат
- Часть 3 (10 заданий с ответами) — новый формат 2022 года
6. Свойства оснований, амфотерных гидроксидов, кислот и солей. Ионный обмен и диссоциация
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
7. Свойства неорганических веществ
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
8. Свойства неорганических веществ
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
9. Взаимосвязь неорганических веществ
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
10. Классификация и номенклатура органических веществ
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
11. Теория строения органических соединений. Типы связей в молекулах органических веществ. Изомеры. Гомологи
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
12. Свойства углеводородов и кислородосодержащих соединений. Получение углеводородов и кислородосодержащих соединений
- Часть 1 (30 заданий с ответами) — старый формат
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения) — старый формат
- Часть 3 (30 заданий с ответами) — старый формат
- Часть 4 (30 заданий с ответами, а для некоторых заданий — видеообъяснения) — старый формат
- Часть 5 (5 заданий с ответами) — новый формат 2022 года
13. Свойства азотсодержащих органических соединений. Белки, жиры, углеводы
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
14. Характерные химические свойства углеводородов. Механизмы реакций
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
15. Свойства спиртов, альдегидов, кислот, сложных эфиров, фенола
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
16. Взаимосвязь углеводородов и кислородосодержащих органических соединений
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
17. Классификация химических реакций в неорганической и органической химии
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
18. Скорость реакции, ее зависимость от различных факторов
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
19. Реакции окислительно-восстановительные
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
20. Электролиз расплавов и растворов
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
21. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная. pH
- Часть 1 (30 заданий с ответами) — старый формат
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения) — старый формат
- Часть 3 (5 заданий с ответами) — новый формат 2022 года
22. Обратимые и необратимые химические реакции. Химическое равновесие
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
23. Химическое равновесие. Расчёты концентраций — новое задание 2022 года
- Часть 1 (5 заданий с ответами)
24. Качественные реакции органических и неорганических соединений
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
25. Химическая лаборатория. Химическая промышленность. Полимеры
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
26. Расчёты с использованием понятия «массовая доля вещества в растворе»
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
27. Расчеты теплового эффекта (по термохимическим уравнениям)
- Часть 1 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
28. Расчет массы или объёма вещества по параметрам одного из участвующих в реакции веществ. Выход продукта. Примеси. Массовая доля вещества в смеси
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
- Часть 3 (29 заданий с ответами, а для некоторых заданий — видеообъяснения)
- Часть 4 (5 заданий с ответами, а для некоторых заданий — видеообъяснения) — задачи, которых не было до 2022 года
- Вторая часть (оформляется подробным решением на бланках ответов)
29. Окислительно-восстановительные реакции
- Часть 1 (30 заданий с ответами)
- Часть 2 (17 заданий с ответами, реальный ЕГЭ 2018)
- Часть 3 (22 задания с ответами, а также для некоторых заданий — видеообъяснения)
- Часть 4 (23 задания с ответами, реальный ЕГЭ 2019)
- Часть 5 (33 задания с ответами, реальный ЕГЭ 2020)
30. Реакции ионного обмена
- Часть 1 (30 заданий с ответами)
- Часть 2 (17 заданий с ответами, реальный ЕГЭ 2018)
- Часть 3 (22 задания с ответами, а также для некоторых заданий — видеообъяснения)
- Часть 4 (23 заданий с ответами, реальный ЕГЭ 2019)
- Часть 5 (32 задания с ответами, реальный ЕГЭ 2020)
31. Взаимосвязь различных классов неорганических веществ: описание реакций
- Часть 1 (30 заданий с ответами)
- Часть 2 (17 заданий с ответами, реальный ЕГЭ 2018)
- Часть 3 (22 задания с ответами, а также для некоторых заданий — видеообъяснения)
- Часть 4 (23 задания с ответами, реальный ЕГЭ 2019)
- Часть 5 (36 заданий с ответами, реальный ЕГЭ 2020)
32. Взаимосвязь органических соединений
- Часть 1 (30 заданий с ответами)
- Часть 2 (17 заданий с ответами, реальный ЕГЭ 2018)
- Часть 3 (22 задания с ответами, а также для некоторых заданий — видеообъяснения)
- Часть 4 (23 задания с ответами, реальный ЕГЭ 2019)
- Часть 5 (35 заданий с ответами, реальный ЕГЭ 2020)
33. Расчёты с использованием понятий растворимость, массовая доля вещества в растворе, избыток, примеси. Расчёты массовой доли химического соединения (атомов элемента) в смеси
- Часть 1 (17 задач с решениями и видео-объяснениями, реальный ЕГЭ 2018)
- Часть 2 (30 задач с решениями и видео-объяснениями, реальный ЕГЭ 2019)
- Часть 3 (27 задач с решениями и видео-объяснениями, пробные и тренеровочные варианты)
- Часть 4 (43 задачи с решениями и видео-объяснениями, реальный ЕГЭ 2020)
- Часть 5. Задачи на «атомистику» (66 задач с видео-объяснениями, появились на ЕГЭ 2020)
- Часть 6 (16 задач с видео-объяснениями и ответами, реальный ЕГЭ 2021)
- Часть 7 (38 задач с видео-объяснениями и ответами, возможные задачи ЕГЭ 2022)
34. Нахождение молекулярной и структурной формулы органического вещества
- Часть 1 (17 задач с решениями и видео-объяснениями, реальный ЕГЭ 2018)
- Часть 2 (21 задача с решениями и видео-объяснениями, реальные ЕГЭ 2019)
- Часть 3 (27 задач с решениями и видео-объяснениями, пробные и тренеровочные варианты)
- Часть 4 (43 задачи с решениями и видео-объяснениями, реальный ЕГЭ 2020)
- Часть 5 (31 задача с решениями и видео-объяснениями, возможные задачи ЕГЭ 2022)
Задания ЕГЭ 2021, которых НЕ будет в таком формате в ЕГЭ 2022:
Химические свойства неорганических веществ
- Часть 1 (30 заданий с ответами)
- Часть 2 (30 заданий с ответами, а для некоторых заданий — видеообъяснения)
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Реальный вариант ЕГЭ по химии 2021. Центр
- Реальный вариант ЕГЭ по химии 2021. Сибирь
- Реальный вариант ЕГЭ по химии 2021. Урал
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку
-
Продолжая рубрику про ЕГЭ по химии, конечно же, нельзя не упомянуть о самых сложных заданиях. Разбираемся в тонкостях и узнаем лайфхаки сегодня. Поехали!
Структура экзамена
И начинаем мы, как обычно, со структуры – основополагающего фактора, не разобравшись в котором справиться с КИМом на высокие баллы невозможно.
ЕГЭ по химии состоит из двух частей:
- Первая часть – тестовая, предусматривает краткий ответ в виде одного числа или последовательности чисел. Состоит из 28 заданий;
- Вторая часть требует подробного решения на бланках ответа №2 и состоит из 6 заданий;
То есть всего экзамен состоит из 34 заданий, за безошибочное решение которых можно получить 56 первичных баллов.
Кстати, на решение экзамена вам будет отведено 3 с половиной часа. Время более, чем реальное. Опыт прошлых лет показывает, что вы успеете не просто решить все задания и перенести их в бланки ответов, но сможете даже перепроверить написанное, что не может не радовать.
Самые сложные задания ЕГЭ по химии
После того, как мы вспомнили структуру экзамена, предлагаем перейти непосредственно к наиболее каверзным заданиям КИМа по химии.
Естественно, первая часть экзамена намного проще второй, однако и с тестовыми заданиями порой возникают проблемы. Поэтому давайте обо всем по порядку.
Задания 1-3
Самой обидной трудностью на пути к получению заветного балла бывает путанница из-за измененной формулировки задания. Очень часто ребята, нарешивая десятки пробников, привыкают к определенным установкам и потом просто не понимают, что от них требуется ровно то же самое, только другими словами.
Как решить проблему:
- быть внимательнее;
- готовиться по нескольким сборникам и пособиями, чтобы узнать различные формулировки;
Задание 7
Задание на растворы, в котором также пригодится внимательность. Если в состав добавляют вещество Y, то нужно сделать нехитрый вывод, что все нерастворимые вещества из списка потенциальных Y следует вычеркнуть.
Как не допустить ошибку:
- знать на зубок, в каких случаях выделяются газы;
- научиться работать с таблицей растворимости;
- научиться грамотно составлять схемы реакций;
Задания на свойства неорганических веществ (8, 30, 31 и 32)
В заданиях 30-31 важно помнить, что даже если вы верно составите уравнение реакции, то засчитано оно будет лишь при условии абсолютного соответствия условиям задания.
Что касается теории, то для номера 30 нужно вспомнить, что такое окислитель, а что восстановитель. Кстати подробная статья об овр уже есть на нашем сайте. (можно сделать ссылку на статью) А для номера 31 придется вспомнить формулы малодиссоциирующих веществ, которые нельзя записывать в виде ионов.
Как избежать ошибок:
- тщательно проверять, какие продукты получаются у вас из исходных веществ, ведь, к примеру, из кислоты никак не может выйти основание или основная соль (советуем еще раз вспомнить подробную теорию);
Главное о номере 8: приступая к заданию, обязательно рассмотрите предложенные формулы как с позиции кислотно-основных, так и окислительно-восстановительных свойств. Это поможет сразу отсеять “затесавшиеся” списки реагентов.
Самое важное при выполнении задания 32 – запомнить палитру, то есть цвета осадков и растворов. Кстати, для лучшего запоминания уже давно придуманы забавные стишки. Ну а если дружба с поэзией не складывается, то предлагаем запастись карандашами и раскрасить таблицу растворимости, отмечая все известные цветовые признаки соединений.
Задание 13
Задание на свойства углеводородов уже давно считается одним из самых провальных.
Самое “коварное” место: определение механизма реакции.
Как избежать трудностей:
- запомнить, что ионный механизм всегда связан с присутствием разноименных заряженных частиц;
- учитывать, что вещества определенных типов вступают в свойственные им реакции: кратная связь – реакции присоединения, одинарная связь – реакции замещения;
- не забывать о температурных условиях;
Задания 15 и 17
Номера на азотосодержащие и кислородосодержащие органические вещества и углеводы. Реакции идут по двум типам:
- по функциональной группе;
- по радикалу;
Как усовершенствовать умения в решении заданий 15 и 17:
- выписывать и заучивать как можно больше уравнений каждого класса;
- решать цепочки на взаимосвязь органических веществ;
Задания 34 и 35
Вот мы и добрались до расчетных задач – самого сложного “элемента” КИМа ЕГЭ по химии, на котором ежегодно проваливается большинство одиннадцатиклассников.
Задание 34 сложно тем, что для него нет единого алгоритма решения. Есть задачи на электролиз, смеси, атомистику, а бывает, что в условии переплетается несколько типов задач. Конечно, советуем прорешать каждый из возможных типов задач, чтобы при встрече в июне вам точно было, что сказать, ой, вернее расписать)
Ошибки в задании 35 чаще всего случаются из-за неправильного определения структурной формулы. Обычно это связано с недостаточным знанием химических свойств органических веществ.
Что нужно делать: стараться каждый день выполнять хотя бы одну цепочку превращений, писать уравнения реакций.
И напоследок немного общих советов для решения расчетных задач:
- максимально сконцентрируйтесь, даже когда решаете пробник: перечитывайте условие, зачеркивайте массы веществ, уходящие из раствора на черновиках, пересчитывайте результат;
- на всякий случай повторите даже самые простые формулы, известные вам как дважды два: “лучше перебдеть, чем недобдеть”;
- внимательно следите за массами: не забывайте их складывать;
- если в начале задачи трудно определить избыток или недостаток щелочи, можно написать два возможных уравнения – образования гидроксида и образования комплексной соли;
Сегодня мы разобрали самые хитрые места ЕГЭ по химии. Уверены, что теперь ошибок в них вы точно не сделайте. Желаем удачи в постижении очень непростой, но интересной науки! Ваш Умскул.
Как показали результаты репетиционного экзамена по химии, наиболее трудными оказались задания, направленные на проверку знаний химических свойств веществ. К числу таких заданий можно отнести задание С3 – «Цепочка органических веществ», С2 – «Реакции между неорганическими веществами и их растворами».
При решении задания С3 «Цепочка органических веществ» учащийся должен написать пять уравнений химических реакций, среди которых одно является окислительно-восстановительным.
Рассмотрим составление одного из таких окислительно-восстановительных уравнений:
СН3СНО X1
Чтобы составить уравнение окислительно-восстановительной реакции с участием органических веществ, нужно научиться определять степень окисления в органическом веществе по его структурной формуле. Для этого нужно иметь знания о химической связи, знать, что такое электроотрицательность.
Структурная формула помогает оценить смещение электронов по каждой из связей. Так атом углерода метильной группы (–СН3) сместит электрон по каждой из связей к себе. Таким образом, степень окисления углерода метильной группы будет равна (-3). Атом углерода карбонильной группы (СО) отдаст 2 электрона атому кислорода, но частично компенсирует недостачу, приняв 1 электрон от атома водорода. Следовательно, его степень окисления будет равна +1:
В продукте реакции степень окисления углерода метильной группы не изменится. Карбонильная группа атомов превратится в карбоксильную с замещенным водородом на натрий, вследствие щелочной среды (-СООNa). Атом углерода карбоксильной группы сместит два электрона в сторону карбонильного кислорода и один электрон в сторону кислорода замещенной гидроксильной группы. Таким образом, степень окисления атома углерода карбоксильной группы будет равна (+3):
Следовательно, одна молекула этаналя отдает 2 электрона:
С+1-2е=С+3
Рассмотрим теперь процессы, происходящие с перманганатом натрия. Обращает внимание, что в схеме дан перманганат натрия, а не калия. Свойства перманганата натрия должны быть аналогичны свойствам перманганта калия, который в зависимости от кислотности среды способен давать различные продукты:
Так как в нашем случае перманганат натрия используется в щелочной среде, то продуктом реакции будет манганат ион – MnO42-.
Определим степень окисления иона марганца в перманганате калия NaMnO4 пользуясь правилом равенства числа положительных и отрицательных зарядов в нейтральной структурной единице вещества. Четыре кислорода каждый по (-2) дадут восемь отрицательных зарядов, так как степень окисления у калия +1, то у марганца будет +7:
Na+1Mn+7O4-2
Записав формулу манганата натрия Na2MnO4, определим степень окисления марганца:
Na2+1Mn+6O4-2
Таким образом, марганец принял один электрон:
Mn+7+1e=Mn+6
Полученные уравнения позволяют определить множители перед формулами в уравнении химической реакции, которые называют коэффициентами:
С+1-2е=С+3 ·1
Mn+7+1e=Mn+6 ·2
Уравнение реакции приобретет следующий вид:
2NaMnO4+CH3CHO+3NaOH=CH3COONa+2Na2MnO4+2H2O
Задание С2 требует от участника ЕГЭ знание свойств разнообразных свойств неорганических веществ, связанных с протеканием как окислительно-восстановительных реакций между веществами, находящимися как в одном, так и в различных агрегатных состояниях, так и обменных реакций протекающих в растворах. Такими свойствами могут быть некоторые индивидуальный свойства простых веществ и их соединений, например, реакция лития или магния с азотом:
2Li+3N2=2Li3N
2Mg+N2=Mg2N2
горение магния в углекислом газе:
Mg+CO2=MgO+CO
2Mg+CO2=2MgO+C
Особую трудность у учащихся вызывают сложные случаи взаимодействия растворов веществ солей подвергающихся гидролизу. Так для взаимодействия раствора сульфата магния с карбонатом натрия можно записать целых три уравнения возможных процессов:
MgSO4+Na2CO3=MgCO3+Na2SO4
2MgSO4+2Na2CO3+H2O=(MgOH)2CO3¯+2Na2SO4+CO2
2MgSO4+2Na2CO3+2H2O=2Mg(OH)2¯+2Na2SO4+2CO2
Традиционно трудны для написания уравнения с участием комплексных соединений. Так растворы амфотерных гидроксидов в избытке щелочи обладают всеми свойствами щелочей. Они способны вступать в реакции с кислотами и кислотными оксидами:
Na[Al(OH)4]+HCl=NaCl+Al(OH)3¯+H2O
Na[Al(OH)4]+2HCl=NaCl+Al(OH)2Cl+2H2O
Na[Al(OH)4]+3HCl=NaCl+Al(OH)Cl2+3H2O
Na[Al(OH)4]+4HCl=NaCl+AlCl3+4H2O
Na[Al(OH)4]+CO2=NaHCO3+Al(OH)3¯
2Na[Al(OH)4]+CO2=Na2CO3+2Al(OH)3¯+H2O
Растворы солей, имеющие кислую реакцию среды, вследствие гидролиза, способны растворять активные металлы, например, магний или цинк:
Mg+MgCl2+2H2O=2MgOHCl+H2
На экзамене желательно помнить об окислительных свойствах солей трехвалентного железа:
2FeCl3+Cu=CuCl2+2FeCl2
Могут пригодиться знания об аммиачных комплексах:
CuSO4+4NH3=[Cu(NH3)4]SO4
AgCl+2NH3=[Ag(NH3)2]Cl
Традиционно вызывают затруднения, связанные с проявлением основных свойств раствором аммиака. В результате чего могут протекать обменные реакции в водных растворах:
MgCl2+2NH3+2H2O=Mg(OH)2+2NH4Cl
В заключение приведем серию уравнений химических реакций, которые нужно знать участникам ЕГЭ по химии:
ОБЩАЯ ХИМИЯ
Кислоты. Основания. Соли. Оксиды.
Кислотные оксиды (кроме SiO2) реагируют с водой, как амфотерным оксидом с образованием кислот:
P2O5 + 3H2O = 2H3PO4
SO3 + H2O = H2SO4
Для получения азотной кислоты азот оксид азота (IV) должен быть доокислен, например кислородом воздуха:
4NO2 + O2 + 2H2О = 4HNO3
Лабораторный способ получения хлороводорода: к твердому хлориду натрия приливают концентрированную серную кислоту:
NaCl + H2SO4 = NaHSO4 + HCl
Для получения бромоводорода из бромида натрия, концентрированная серная кислота не подойдет, так как выделяющийся бромоводород будет загрязнен парами брома. Можно использовать концентрированную фосфорную кислоту:
NaBr+ H3PO4 = NaH2PO4 + HBr
Кислоты реагируют с металлами, стоящими в ряду напряжений до водорода:
Fe + 2 HCl = FeCl2 + H2
И их оксидами:
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Обратите внимание на валентность переходных элементов в солях.
Щелочные и щелочноземельные металлы взаимодействуют с водой:
K + H2O = KOH + ½ H2
В условиях избытка кислоты могут образовываться и кислые соли:
2Н3РО4 + 2Na = 2NaH2PO4 + Н2
Органические кислоты также проявляют кислотные свойства:
2СН3СООН + 2Na = 2CH3COONa + Н2
СНзСООН + NaOH = CH3COONa + Н2О
Комплексные гидроксиды реагируют с кислотами с образованием солей и воды:
Na[Al(OH)4] + HCl = AlCl3 + 4H2O + NaCl
LiOH + HNO3 = LiNO3 + H2O
Многоосновные кислоты в реакции с гидроксидами могут образовывать кислые соли:
Н3РО4 + КОН = КН2РО4 + Н2О
Продуктом реакции аммиака с фосфорной кислотой может также быть кислая соль:
NH3 + H3PO4 = NH4H2PO4
Обратим внимание на свойства оснований, их взаимодействие с кислотами:
2Н3РО4 + ЗСа(ОН)2 = Са3(РО4)2¯ + 6Н2О
с кислотными оксидами:
Ca(OH)2 + CO2 = CaCO3¯ + H2O
2Ca(OH)2 + CO2=(СaOH)2CO3+H2O
Реакция гидроксидов с кислотными оксидами может приводить и к кислым солям:
KOH + CO2 = KHCO3
Основные оксиды реагируют с амфотерными оксидами:
CaO + H2O = Ca(OH)2
Средние соли в воде реагируют с кислотными оксидами с образованием кислых солей:
CaCO3 + CO2 + H2O = Ca(HCO3)2
Более сильные кислоты вытесняют более слабые из их солей:
CH3COONH4 + HCl = CH3COOH + NH4Cl
K2CO3 + H2SO4 = K2SO4 + H2O + CO2
Кислоты в присутствии серной кислоты реагируют со спиртами с образованием сложных эфиров:
CH3COOH + C2H5OH = CH3COOC2H5 + H2O
Более сильное основание вытесняет более слабое из его солей:
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl
MgCl2 + KOH = MgOHCl + KCl
NH4С1 + NaOH = NaCl + NH3 + H2O
Чтобы получить из основной соли получить среднюю соль нужно подействовать кислотой:
MgOHCl + HCl = MgCl2 + H2O
Гидроксиды металлов (кроме щелочных металлов) разлагаются при нагревании в твердом виде до оксидов:
2Al(OH)3 = Al2O3 + 3H2O
2Fe(OH)3 = Fe2O3 + 3H2O
Гидрокарбонаты при нагревании разлагаются до карбонатов:
2KHCO3 = K2CO3 + H2O + CO2
Нитраты обычно разлагаются до оксидов (обратите внимание на повышение степени окисления переходного элемента находящегося в промежуточной степени окисления):
2Fe(NO3)2 = Fe2O3 + 4NO2 + 0,5O2
2Fe(NO3)3 ® Fe2O3 + 6NO2 + 1,5 O2
2Cu(NO3)2 = 2CuO + 4NO2 + О2
Нитраты щелочных металлов разлагаются до нитритов:
NaNO3 = NaNO2 + ½ O2
Карбонаты металлов (кроме щелочных) разлагаются до оксидов:
CaCO3 = CaO + CO2
При составлении уравнений реакций ионного обмена пользуйтесь таблицей растворимости:
K2SO4 + BaCl2 = BaSO4¯ + 2KCl
[C6H5-NH3]C1 + AgNО3 = [C6H5NH3]NO3 + AgCl¯
Электролиз
Электролиз расплавов солей:
2KCl = 2K + Cl2
Электролиз растворов солей металлов, стоящих в ряду напряжения после водорода:
2HgSO4 + 2H2O = 2Hg + О2 + 2H2SO4
1) на катоде: Hg2+ + 2e = Hg°
2) на аноде: 2Н2О – 4е = О2 + 4Н+
Электролиз раствора сульфата натрия
1) на катоде: 2H2O + 2e = H2 + 2OH–
2) на аноде: 2H2O – 4e = O2 + 4H+
3) Составлено общее уравнение электролиза:
2H2O = 2H2 + O2
до водорода:
СаI2 + 2Н2О = Н2 + I2 + Са(ОН)2
1) на катоде: 2Н2О + 2e = 2ОН + Н2
2) на аноде: 2I— — 2e = I2
Сравните свойства одноэлементных и кислородсодержащих анионов.
Химические реакции, возможные при электролизе сульфата хрома (III):
1)Сг3+ + e = Сг2+
2) Cr2+ + 2e = Сг°
3) Сг3+ + 3 e= Сг°
4) 2Н+ + 2e = Н2
Электролиз водных растворов солей карбоновых кислот:
2CH3COONa + 2H2O = CH3CH3 + 2CO2 + H2 + 2NaOH
Гидролиз
Пример взаимного гидролиза солей:
A12(SO4)3 + 3K2CO3 + 3H2O = 2A1(OH)3 + 3CO2 + 3K2SO4
Амфотерность
Амфотерные гидроксиды растворяются в водных растворах щелочей:
A1(OH)3 + 3KOH = K3[A1(OH)6]
A1(OH)3 + KOH = K[Al(OH)4]
реагируют с твердыми щелочами при сплавлении:
Al(OH)3 + KOH KAlO2 + 2H2O
Амфотерные металлы реагируют с водными растворами щелочей:
Al + NaOH + 3H2O = Na[Al(OH)4] + 3/2 H2
Продукт сплавления амфотерного гидроксида со щелочью легко разлагается водой:
KAlO2 + 2H2O = KOH + Al(OH)3¯
Комплексные гидроксиды реагируют с кислотами:
K[Al(OH)4] + HCl =KCl + Al(OH)3¯ + H2O
Бинарные соединения
Способ получения:
СаО + 3С = СаС2 + СО
Бинарные соединения реагируют с кислотами:
Al2S3 + 3H2SO4 := Al2(SO4)3 + 3H2S
Mg3N2 + 8HNO3 = Mg(NO3)2 + 2NH4NO3
и водой:
A14C3 + 12Н2О = 4А1(ОН)3 + ЗСН4
PCl3 + H2O = 3H3PO3 + 3HCl
НЕОРГАНИЧЕСКАЯ ХИМИЯ
Азот
Азотная кислота является сильным окислителем:
окисляют неметаллы:
ЗР + 5HNO3 + 2Н2О = Н3РО4 + 5NO
P + 5HNO3 = H3PO4 + 5NO2 + H2O
металлы:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 = 4Mg(NO3)2 + N2O + 5H2O
оксиды переходных металлов в промежуточных степенях окисления:
3Cu2O + 14HNO3 = 6Cu(NO3)2 + 2NO+ 7H2O (возможно выделение NО2)
оксиды азота также проявляют окислительные свойства:
5N2O + 2P = 5N, + P2O
но по отношению к кислороду являются восстановителями:
2NO + O2 = 2NO2
Азот реагирует с некоторыми простыми веществами:
N2+3H2= 2NH3
N2 + O2 = 2NO
3Mg + N2 = Mg3N2
Галогены
обычно проявляют окислительные свойства:
PH3 + 4Br2 + 4Н2О = Н3РО4 + 8НВг
2P + 5Cl2 = 2PCl5
2P + 3PCl5 = 5PCl3
PH3 + 4Br2 + 4H2O = H3PO4 + 8HBr
Cl2 + H2 = 2HCl
2HCl + F2 = 2HF + Cl2
2NH3 + 3Br2 = N2 + 6HBr
Галогены в растворах щелочей диспропорционируют при комнатной температуре:
Cl2 + 2KOH = KCl + H2O + KClO
и при нагревании:
Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
Окислительные свойства перманганата калия:
5Н3РО3 + 2КМnО4 + 3H2SO4 = K2SO4 + 2MnSO4 + 5Н3РО4 + ЗН2О
2NH3 + 2KMnO4 = N2 + 2MnO2 + 2KOH + 2H2O
Сера
реагирует с простыми веществами:
S + O2 = SO2
3S + 2А1 = A12S3
оксид серы (IV) может быть доокислен кислородом:
2SO2 + O2 = 2SO3
2SO2 + O2 + 2H2O = 2H2SO4
и выступать в роли окислителя:
SO2 + 2H2S = 3S + 2H2O
Концентрированная серная кислота проявляет окислительные свойства:
Cu + H2SO4 = CuSO4 + SO2 +2H2O
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
Фосфор
получение фосфора:
Са3(Р04)2 + 5С + 3SiO2 = 3CaSiO3 + 5СО + 2Р
Металлы
реагируют с галогенами:
2Fe + 3Cl2 = 2FeCl3
Алюминий без оксидной пленки растворяется в воде:
Al (без оксидной пленки) + Н2О = Al(OH)3 + 3/2 H2
методы получения металлов:
Fe2O3 + CO = 2FeO + CO2
FeO + CO = Fe + CO2
CuO + H2 = Cu + H2O
Гидроксид железа (II) может быть легко доокислен пероксидом водорода:
2Fe(OH)2 + H2O2 = 2Fe(OH)3
обжиг пирита:
2FeS2 + O2 = Fe2O3 + 4SO2
ОРГАНИЧЕСКАЯ ХИМИЯ
Горение органических веществ
2С10Н22 + 31O2 = 20CО2 + 22H2О
Алканы
Методы получения алканов из простых веществ:
С + 2H2 = CH4
сплавлением солей щелочных металлов с щелочами:
СН3СООК + КОН ® СН4 + К2СО3
Химические свойства алканов — промышленное окисление метана:
CH4 + O2 = CH2O + H2O
Взаимодействие алканов с галогенами:
С2Н6 + Сl2 С2Н5Сl + НСl
Изомеризация алканов:
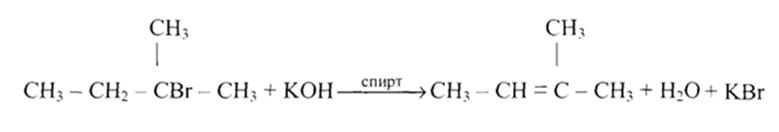
Галогеналканы
Реакция со спиртовыми растворами щелочей:
С6Н5-СНВг-СН3 + КОН  С6Н5СН=СН2 + КВг + Н2О
С6Н5СН=СН2 + КВг + Н2О
с водными растворами щелочей:
С6Н5-СНВг-СН3 + КОН (водн.) ® С6Н5-СНОН-СН3 + KBr
C6H5Br + KOH ® C6H5OH + KBr
По правилу Зайцева водород отщепляется от наименее гидрированного атома
Из дигалогеналканов можно получить алкины:
Реакция Вюрца:
Алкены
Присоединяют водород:
присоединяют галогены:
присоединяют галогенводороды:
присоединят воду:
СН2=СН2 + Н2О ® СН3СН2ОН
С водным раствором перманганата калия без нагревания образуют гликоли (двухатомные спирты)
ЗС6Н5СН=СН2 + 2КМnО4 + 4Н2О ® ЗС6Н5СН(ОН)-СН2ОН + MnO2¯ + 2KOH
Алкины
промышленный способ получения ацетилена
2СН4 ® С2Н2 + ЗН2
карбидный способ получения ацетилена:
CaC2 + 2H2O = Ca(OH)2 + C2H2
реакция Кучерова — альдегид можно получить только из ацетилена:
С2Н2 + Н2О СН3СНО
Реакция алкинов с концевой тройной связью с аммиачным раствором оксида серебра:
2CH3-CH2-CºCH + Ag2O 2CH3-CH2-CºCAg +H2O
использование полученных продуктов в органическом синтезе:
CH3-CH2-CºCAg + C2H5Br ® CH3-CH2-CºC-C2H5 + AgBr
Бензол и его производные
Получение бензола из алкенов:
из ацетилена:
3C2H2 C6H6
Нитрование бензола и его производных в присутствие серной кислоты
C6H6 + HNO3 ® C6H5-NO2 + H2O
карбоксильная группа является ориентантом второго рода
реакция бензола и его производных с галогенами:
C6H6 + Cl2 C6H5Cl + HCl
С6Н5С2Н5 + Вг2 С6Н5-СНВг-СН3 + НВг
галогеналканами:
C6H6 + С2Н5С1 C6H5C2H5 + НС1
алкенами:
C6H6 + CH2=CH-CH3 ® C6H5-CH(CH3)2
Окисление бензола перманганатом калия в присутствии серной кислоты при нагревании:
5C6H5-CH3 + 6KMnO4 + 9H2SO4 = 5C6H5-COOH + 3K2SO4 + 6MnSO4 + 14H2O
Спирты
Промышленный способ получения метанола:
CO + 2H2 = CH3OH
при нагревании с серной кислотой в зависимости от условий могут образовываться простые эфиры:
2С2Н5OH C2Н5ОС2Н5 + Н2О
или алкены:
2С2Н5OH CH2=CH2 + H2O
спирты реагируют с щелочными металлами:
С2Н5OH + Na ® C2H5ONa + ½ H2
с галогенводородами:
СН3СН2ОН + НСl ® CH3CH2Cl + H2O
с оксидом меди (II):
СН3СН2ОН + СuO ® CH3CHO + Cu + H2O
более сильная кислота вытесняет более слабые из их солей:
C2H5ONa + HCl ® C2H5OH + NaCl
при нагревании смеси спиртов с серной кислотой образуются несимметричные простые эфиры:
Альдегиды
Образуют с аммиачным раствором оксида серебра серебряное зеркало:
CH3CHO + Ag2O CH3COONH4 + 2Ag
реагируют со свежеосажденным гидроксидом меди (II):
CH3CHO + 2Cu(OH)2 ® CH3COOH + 2CuOH + H2O
могут быть восстановлены до спиртов:
CH3CHO + H2 ® CH3CH2OH
окисляются перманганатом калия:
ЗСН3СНО + 2КМnО4® 2СН3СООК + СН3СООН + 2МnО2 + Н2О
Амины
можно получить восстановлением нитросоединений в присутствии катализатора:
C6H5-NO2 + 3H2 = C6H5-NH2 + 2H2O
реагируют с кислотами:
C6H5-NH2 + HC1 =[C6H5-NH3]C1
Углеводы
Глюкозу можно получить гидролизом крахмала или целлюлозы:
(С6Н10О5)n + n H2O = nC6H12O6
Для глюкозы характерно спиртовое брожение:
C6H12O6 ® 2C2H5OH + 2CO2
молочнокислое брожение:
C6H12O6 ® 2СН3СН(ОН)СООН
реакция серебряного зеркала:
C6H12O6+Ag2O 2Ag¯+C6H12O7
Аминокислоты
Аминокислоты реагируют как с кислотами:
H2N-CH-COOH+HCl ® Cl— H3N+-CH-COOH
так и c щелочами:
H2N-CH-COOH+NaOH ® H2N-CH-COONa+H2O
соли аминокислот также способны участвовать в реакциях обмена в водном растворе:
Cl— H3N+-CH-COOH+NaOH ® H2N-CH-COOH +NaCl + H2O
Cl— H3N+-CH-COOH+2NaOH ® H2N-CH-COONa +NaCl + 2H2O
H2N-CH-COONa+HCl ® H2N-CH-COOH +NaCl
H2N-CH-COONa+2HCl ® Cl— H3N+-CH-COOH +NaCl
В этом разделе представлен тематический классификатор задачной базы. Вы можете прорешать все задания по интересующим вас темам. Зарегистрированные пользователи получат информацию о количестве заданий, которые они решали, и о том, сколько из них было решено верно. Цветовая маркировка: если правильно решено меньше 40% заданий, то цвет результата красный, от 40% до 80% — желтый, больше 80% заданий — зеленый. Если в оба столбца таблицы выделены зеленым, уровень вашей готовности можно считать достаточно высоким. В столбцах первое число — количество различных уникальных заданий (прототипов), второе число — общее количество заданий, включая задания (клоны), отличающиеся от прототипов только числовыми данными.
| Тема | Кол-во заданий в базе |
Кол-во решенных заданий |
Из них решено правильно |
Проверить себя |
|---|
Дополнительные задания для подготовки
Все реакции из заданий 32, которые могут вызвать затруднения при составлении. На ЕГЭ 99% реакций в заданиях 32 будут либо они, либо аналогичные.
1) Si + 2Cl2 SiCl4
2) SiCl4 + 3H2O H2SiO3 + 4HCl
3) Ca3(PO4)2 + 5C + 3SiO2 2P + 5CO + 3CaSiO3
4) Ca3N2 + 6H2O 3Ca(OH)2 + 2NH3↑
5) 2NH3 + 3CuO 3Cu + 3H2O + N2↑
6) Cu + 4HNO3(конц.) Cu(NO3)2 + 2NO2↑ + 2H2O
7) 2Cu(NO3)2 2CuO + 4NO2 + O2↑

2Fe2O3 + 4SO2↑
9) 2H2S + SO2 3S↓ + 2H2O
10) S + 6HNO3 H2SO4 + 6NO2↑ + 2H2O
11) 4Al(NO3)3 2Al2O3 + 12NO2↑ + 3O2↑
12) 2Al2O3 4Al + 3O2↑ (электролиз раствора Al2O3 в расплаве криолита)
13) 3KNO3 + 8Al + 5KOH + 18H2O 3NH3↑ + 8K[Al(OH)4]
14) CrO3 + 2KOH K2CrO4 + H2O
15) 2K2CrO4 + H2SO4 K2Cr2O7 + K2SO4 + H2O
16) 14HBr + K2Cr2O7 2CrBr3 + 3Br2 + 7H2O + 2KBr
17) H2S + Br2 S↓ + 2HBr
18) 3Mg + N2 Mg3N2
19) Mg3N2 + 6H2O 3Mg(OH)2↓ + 2NH3↑
20) Cr2(SO4)3 + 6NH3 + 6H2O 2Cr(OH)3↓ + 3(NH4)2SO4
21) 2Cr(OH)3 + 4KOH + 3H2O2 2K2CrO4 + 8H2O
22) 2Ag + 2H2SO4(конц.) Ag2SO4 + SO2↑ + 2H2O
23) 2KClO3 2KCl + 3O2↑ (в присутствии кат-ра)
24) 3Fe + 2O2 Fe3O4
25) Fe3O4 + 8HCl FeCl2 + 2FeCl3 + 4H2O
26) 6FeCl2 + 14HCl + K2Cr2O7 6FeCl3 + 2CrCl3 + 2KCl + 7H2O
27) 2Na + H2 2NaH
28) NaH + H2O NaOH + H2↑
29) 2NO2 + 2NaOH NaNO2 + NaNO3 + H2O
30) 2Al + 2NaOH + 6H2O 2Na[Al(OH)4] + 3H2↑
31) Cu + 2H2SO4 CuSO4 + SO2↑ + 2H2O
32) 2CuSO4 + 4KI 2CuI↓ + I2↓ + 2K2SO4
33) 2NaCl + 2H2O H2↑ + Cl2↑ + 2NaOH (электролиз раствора)
34) Fe2O3 + 6HI 2FeI2 + I2↓ + 3H2O
35) Na[Al(OH)4] + CO2 NaHCO3 + Al(OH)3↓
36) Al2O3 + Na2CO3 (тв.) 2NaAlO2 + CO2↑ (сплавление)
37) Al4C3 + 12HBr 4AlBr3 + 3CH4↑
38) 2AlBr3 + 3K2SO3 + 3H2O 2Al(OH)3↓ + 3SO2↑ + 6KBr
39) 3SO2 + K2Cr2O7 + H2SO4 K2SO4 + Cr2(SO4)3 + H2O
40) Zn + 2KOH + 2H2O K2[Zn(OH)4] + H2↑
41) K2[Zn(OH)4] K2ZnO2 + 2H2O
42) K2ZnO2 + 4HCl 2KCl + ZnCl2 + 2H2O
43) HI + KHCO3 KI + H2O + CO2↑
44) 6KI + K2Cr2O7 + 7H2SO4 4K2SO4 + 3I2↓ + Cr2(SO4)3 + 7H2O
45) 2AlI3 + 3Na2S + 6H2O 2Al(OH)3↓ + 3H2S↑ + 6NaI
46) Fe3O4 + 10HNO3 3Fe(NO3)3 + NO2↑ + 5H2O
47) Fe2O3 + Fe 3FeO
48) 2Na + O2 Na2O2 (горение)
49) Na2O2 + 4HCl 2NaCl + 2H2O + Cl2↑
50) 3Cl2 + 10KOH + Cr2O3 2K2CrO4 + 6KCl + 5H2O
51) K2CrO4 + BaCl2 BaCrO4↓ + 2KCl
52) 2Cu(NO3)2 + 2H2O 2Cu + O2↑ + 4HNO3 (электролиз раствора)
53) 6KOH + 3S K2SO3 + 2K2S + 3H2O
54) 6KHCO3 + Fe2(SO4)3 2Fe(OH)3↓ + 3K2SO4 + 6CO2↑
55) KH + H2O KOH + H2↑
56) K2ZnO2 + 2H2SO4 K2SO4 + ZnSO4 + 2H2O
57) FeSO4 + 2NH3 + 2H2O Fe(OH)2↓ + (NH4)2SO4
58) Fe(OH)2 + 4HNO3(конц.) Fe(NO3)3 + NO2↑ + 3H2O
59) 2Fe(NO3)3 + 3K2CO3 + 3H2O 2Fe(OH)3↓ + 3CO2↑ + 6KNO3
60) 4NO2 + 2Ca(OH)2 Ca(NO3)2 + Ca(NO2)2 + 2H2O
61) 3Ca + 2P Ca3P2
62) Ca3P2 + 6H2O 3Ca(OH)2 + 2PH3↑
63) PH3 + 8NaMnO4 + 11NaOH 8Na2MnO4 + Na3PO4 + 7H2O
64) Na2MnO4 + Na2SO3 + H2O MnO2↓ + Na2SO4 + 2NaOH
65) P + 5HNO3 H3PO4 + 5NO2↑ + H2O
66) 4Zn + 2NO2 4ZnO + N2↑
67) 2NaNO3 2NaNO2 + O2↑
68) NaNO2 + NH4I NaI + N2↑ + 2H2O
69) 2NaI + H2O2 + H2SO4 Na2SO4 + I2↓ + 2H2O
70) 3I2 + 6NaOH(р−р) NaIO3 + 5NaI + 3H2O
71) H2O2 + Ag2O 2Ag↓ + O2↑ + H2O
72) 2ZnS + 3O2 2ZnO + 2SO2↑
73) Na2[Zn(OH)4] Na2ZnO2 + 2H2O
74) 3Cu2O + Na2Cr2O7 + 10H2SO4 6CuSO4 + Cr2(SO4)3 + Na2SO4 + 10H2O
75) NaHCO3 + NaOH Na2CO3 + H2O
76) K2Cr2O7(тв.) + 14HCl(конц.) 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
77) 3NaNO2 + 2KMnO4 + H2O 2MnO2↓ + 2KOH + 3NaNO3
78) MnO2 + 4HCl(конц.) MnCl2 + Cl2↑ + 2H2O
79) 2Fe(OH)3 + 6HI 2FeI2 + I2↓ + 6H2O
80) 3Na2CO3 + 2CrBr3 + 3H2O 2Cr(OH)3↓ + 6NaBr + 3CO2↑
81) 5FeCl2 + KMnO4 + 8HCl 5FeCl3 + MnCl2 + KCl + 4H2O
82) K2SiO3(р—р) + 2H2O + 2CO2 H2SiO3↓ + 2KHCO3
83) Ba(OH)2 + 2NaHCO3 = Na2CO3 + BaCO3↓ + 2H2O (при избытке NaHCO3)
либо
Ba(OH)2 + NaHCO3 = BaCO3 + NaOH + H2O (при избытке Ba(OH)2)
84) 6KOH + 3Cl2 KClO3 + 5KCl + 3H2O
85) Cr2O3 + KClO3 + 4KOH 2K2CrO4 + KCl + 2H2O
86) 4NH3 + 5O2 4NO + 6H2O (кат. Pt, Cr2O3, t, p)
87) 2NO + O2 2NO2
88) NaNO2 + 2KMnO4 + 2KOH 2K2MnO4 + NaNO3 + H2O
89) 8KI(тв.) + 9H2SO4(конц.) 8KHSO4 + 4I2↓ + H2S↑ + 4H2O
90) Al2O3 + 2NaOH + 3H2O 2Na[Al(OH)4]
91) Na[Al(OH)4] + 4HNO3 NaNO3 + Al(NO3)3 + 4H2O
92) 2Ca(OH)2 + 4NO2 + O2 2Ca(NO3)2 + 2H2O
93) K[Al(OH)4] + SO2 KHSO3 + Al(OH)3↓
94) 8KOH + PCl5 K3PO4 + 5KCl + 4H2O
95) 2KBr(тв) + 2H2SO4(конц., гор.) K2SO4 + Br2 + SO2↑ + 2H2O
96) 3Br2 + 6KOH 5KBr + KBrO3 + 3H2O
97) Br2 + K2SO3 + 2NaOH 2NaBr + K2SO4 + H2O
98) Fe2O3 + 6HI 2FeI2 + I2 + 3H2O
99) Fe2O3 + 2NaOH(тв.) 2NaFeO2 + H2O (сплавление)
100) 4NO2 + O2 + 2H2O 4HNO3
101) NaFeO2 + 4HNO3(изб.) NaNO3 + Fe(NO3)3 + 2H2O
102) FeO + 4HNO3(конц.) Fe(NO3)3 + NO2↑ + 2H2O
103) Ca2Si + 4H2O 2Ca(OH)2 + SiH4↑
104) 3Na2SO3 + Na2Cr2O7 + 4H2SO4 Cr2(SO4)3 + 4Na2SO4 + 4H2O
105) 4Mg + 5H2SO4(конц.) 4MgSO4 + H2S↑ + 4H2O
106) CuS + 10HNO3 Cu(NO3)2 + H2SO4 + 8NO2 + 4H2O
либо (одинаково верно)
CuS + 8HNO3(конц.) CuSO4 + 8NO2↑ + 4H2O
107) 3Cu + 8HNO3(разб.) 3Cu(NO3)2 + 2NO↑ + 4H2O
108) 2Cu(NO3)2 + 2H2O 2Cu↓ + O2↑ + 4HNO3 (электролиз раствора)
109) Cu2O + 3H2SO4(конц.) 2CuSO4 + SO2↑ + 3H2O
110) 2NaI + 2NaMnO4 I2↓ + 2Na2MnO4 (в щелочном растворе)
111) 2Na2O2 + 2CO2 2Na2CO3 + O2
112) 8NaOH(р-р, изб.) + Al2S3 2Na[Al(OH)4] + 3Na2S
113) 4Ca + 5H2SO4(конц.) H2S↑ + 4CaSO4↓ + 4H2O
114) 2Fe(OH)2 + H2O2 2Fe(OH)3
115) Na2O2 + 2H2O(хол.) H2O2 + 2NaOH
116) Ag2S + 10HNO3(конц.) = 2AgNO3 + H2SO4 + 8NO2 + 4H2O
либо (одинаково верно)
Ag2S + 8HNO3 → Ag2SO4 + 8NO2 + 4H2O
Строение алкенов. Уместно начинать с него, так как все свойства алкенов тесно связаны с особенностями их строения. У алкенов в составе электронных орбиталей находится одно негибридное облако, которое образует пи-связь с атомом углерода. Для молекул алкенов характерна геометрическая структурная изометрия: из-за того, что P-орбитали перекрываются в двух местах, затруднено вращение относительно углерод-углеродной связи. А если так, значит, есть возможность различного взаиморасположения групп (пример: цис-бутен-2, транс-бутен-2).
Химические свойства алкенов и алканов: сравнение. Наиболее характерный механизм реакции у алканов — радикальный цепной механизм, и реакция начинается с образования свободного радикала. Для алкенов же характерен ионный механизм взаимодействия. Далее, поскольку активная форма молекулы у алкена — двойная углерод-углеродная, то, в отличие от алканов, алкены относятся к ненасыщенным углеводородам и им характерна реакция присоединения. Для алканов характерна реакция замещения. Благодаря высокой химической активности, алкены вступают в реакцию при обычных условиях, а алканам нужны дополнительные факторы — свет, тепло, искра или какой-то другой внешний фактор. И алкены, и алканы реагируют с галогенами (хлор и бром), но для алкенов это реакция присоединения (радикального характера), а для алканов — замещения. Водород присоединяется к алкенам при отсутствии катализатора; алкены могут также присоединять воду и взаимодействовать с кислотами (при этом характер реакций будет ионный). Алканы ни с водой, ни с водородом не реагируют.
Правило Марковникова гласит, что при присоединении протонных кислот или воды к несимметричным алкенам атом водорода будет присоединяться к тому атому углерода, который наиболее гидрогенизирован. Удобно, что все реакции с участием алкинов типовые и запоминаются относительно легко. Научите учеников моделировать реакцию: одни и те же связи разрываются и возникают, например, при взаимодействии алкина с водородом и с бромовой водой.
Из правила Марковникова есть исключения:
1. Когда двойная связь в молекуле алкена соседствует с электронно-акцепторной группой (например, трифторметил). Электронная плотность изменяется, и продукты реакции получаются иные, чем по правилу Марковникова. Атомы фтора сильно электроотрицательны и смещают двойную P-связь.
2. Строго для гидробромирования: взаимодействие несимметричного алкена с бромоводородом при участии органической перекиси. Тогда реакция протекает по радикальному механизму.
3. Сопряженные системы: двойная углерод-углеродная связь сопряжена с двойной углерод-водородной или углерод-азотной связью. Здесь также происходит смещение электронной плотности по P-связи. На атоме углерода возникает избыточный отрицательный заряд, в результате происходит «антимарковниковский» эффект.
Всегда ли для алкенов возможны только реакции присоединения? Согласно теории Бутлерова, достаточно знать строение молекулы, чтобы предсказать свойства вещества. Рассмотрим молекулу алкена пропена. В ней отчетливо выделяются две части: первая от этилена, где атомы углерода в sp2 гибридном состоянии, вторая — от алкана (метана), в которой находится sp3 гибридный атом углерода. Следовательно, пропен сочетает в себе свойства этилена и метана; а для метана характерна реакция замещения под воздействием внешних факторов (например, внешнего облучения). Реакция замещения у пропена возможна благодаря устойчивости аллельного радикала. Для всех алкенов, начиная от пропена, возможны аналогичные реакции, хотя это и не самое характерное свойство данной группы.
Реакция полимеризации. Эта реакция имеет огромное практическое значение, потому что с ее помощью возникает целый ряд углеводородов и их производных — полимеров. Чтобы реакция началась, нужен инициатор — радикал. Он взаимодействует с молекулой, например, этилена; двойная связь в этилене распадается, образовавшаяся частица взаимодействует с другой CH-группой, затем с ещё одной, и так процесс полимеризации идет до тех пор, пока связь не оборвется (это произойдет тогда, когда встретятся два радикала).

Органическая химия в тестовых заданиях. Профильный уровень. 10–11 классы. Учебное пособие
Учебное пособие предназначено для учащихся 10-11 классов общеобразовательных учреждений. Оно окажет помощь в закреплении и углублении знаний по органической химии. В пособии предлагаются задания различной степени сложности, представленные в тестовой форме.
Купить
У учеников часто возникают трудности, когда в задании требуется написать уравнение подобной реакции. Есть простой прием: объемные заместители пишем внизу. Так формула становится нагляднее.
Окисление алкенов. С одной стороны, двойная связь всегда энергетически обязательно сильнее, чем одинарная. С другой стороны, двойная связь — это наиболее активная часть молекулы, поэтому именно двойная связь подвержена окислению. При мягком окислении разрывается двойная связь, образуются двухатомные спирты. Эта реакция проходит в нейтральной среде без нагревания.
Что ещё почитать?
- Демоверсия ЕГЭ-2019 по химии
- Методические подходы к изучению ОВР в основной школе
- Методическая помощь учителю химии
- Изучение сероорганических соединений
- К методике изучения классов неорганических соединений
Если в реакции присутствует серная кислота, происходит жесткое окисление: атом углерода максимально окружает себя атомами кислорода, но одинарные связи по-прежнему не разрушаются. Здесь основная сложность — правильно определить степени окисления и расставить коэффициенты (см. видео).
Получение алкенов. Опорой для изучения этой темы должна быть хорошо усвоенная информация о химических свойствах алканов. Дегидрирование алканов по сути и является процессом получения алкенов. Другой способ — крекинг алканов: при этой реакции всегда образуется два углеводорода, алкен и алкан; интуитивно это ясно, так как на два алкена просто не хватит атомов водорода. Другие способы получения алкенов можно изучить через повторение химических свойств самих алкенов. Например: гидратация алкенов дает спирты, а если от спирта отщепить воду, нагревая его с серной кислотой, получим алкен.
Правило Зайцева. При отщеплении воды от спирта, водород преимущественно отделяется от того атома углерода, у которого водородов меньше (то есть, от вторичного). Примерно та же ситуация наблюдается при дегидрохлорировании, однако, если хлороводород присоединяется к алкену легко, то отщепить его можно только при воздействии щелочи, растворенной в спирте.
Можно присоединить галоген к алкену, получается дигалогеналкан. Отщепить галогены тоже можно, под действием активного двухвалентного металла. Часто у учеников возникает вопрос, можно ли использовать одновалентный металл? Отвечаем: можно, но это нетипичная реакция.
Циклоалканы. Снова начнем со строения. Перед нами цикличные молекулы, изомерные алкенам, не содержащие двойных углерод-углеродных связей. Здесь возможна геометрическая изомерия. Ученикам, сдающим ЕГЭ по химии, полезно знать устойчивые конформации, свойственные тем или иным циклоалканам. Еще запомним правило: малые циклы (трехчлены и четырехчлены) — напряженные, как сжатые пружины, а большие циклы (пяти- и шестичлены) менее напряжены. Для первых характерны реакции присоединения, для вторых — замещения.
Химические свойства циклоалканов. Что могут присоединить малые циклы? Водород, галоген, галогеноводород, при определенных условиях — воду. Большие циклы реагируют примерно так же, как и большие алканы: с бромом, азотной кислотой, возможны реакции дегидрирования.
Получение циклоалканов. Здесь нужно повторить уравнения реакций при взаимодействии дигалогеналканов с активными двухвалентными металлами. Эти уравнения будут очень нужны при выполнении заданий на восстановление цепочки превращений и при решении задач на нахождение формулы вещества.
#ADVERTISING_INSERT#
Вебинар по теме
Если выпускник хочет получить профессию, которая связана с такими сферами как наука, медицина, ветеринария, промышленность, фармакология, агрономия и селекция, он выбирает ЕГЭ по химии. Успешная сдача зависит от того, насколько внимательны и усидчивы были ученики в период посещения школы.
Как готовиться
Чтобы получить отличную оценку по единому экзамену по химии, важны следующие
моменты:
- Хорошая подготовленность в теории;
-
достижения в области чтения и составления формул;
-
«натренированность» в решении задач и уравнений;
-
способность разбираться в таких способах структурирования данных как таблицы и
схемы.
Работа должна быть основательной и комплексной. Предпочтительны
различные методы тренировки:
- Использование учебных материалов за все годы с
акцентом на объемные и сложные темы; -
изучение дополнительной специализированной литературы: это обязательно пригодится во время тестирования;
-
прохождение онлайн-тестов для закрепления полученной информации и выработки навыков правильного и качественного заполнения бланков теста.
Упражнения с тестами помогают выявлять «уязвимые места» и направлять силы в нужное русло.
Нюансы
На ЕГЭ придется блеснуть познаниями по всем ячейкам школьного курса. В
процессе подготовки рекомендуется обратить внимание на теоретические разделы по следующим вопросам:
- Химические элементы — характеристика;
- атом — строение;
- органические соединения — особенности;
- массовые доли, масса в растворах и соединениях — расчеты;
- оксиды;
- простые вещества, основания, кислоты, соли,
углеводороды, спирты, альдегиды и другие; - реакции и связи;
- неорганика — классификация, свойства, взаимосвязи классов.
Советы
Лучше всего придерживаться стратегии, включающей как повторение легких,
так и доскональная проработка тех тем, которые вызывают сложности. При переключении деятельности качество занятий повышается;
Не пытайтесь перегружать мозг потоком информации одного типа – очень
полезно дополнять тексты цифровыми выражениями и условными записями;
Чтобы уложить в голове непростые вопросы, не ленитесь делать заметки и
составлять схематические изображения.