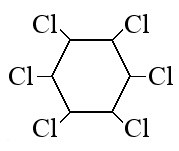
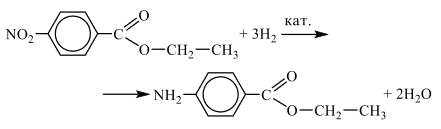
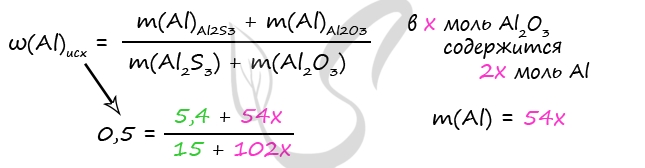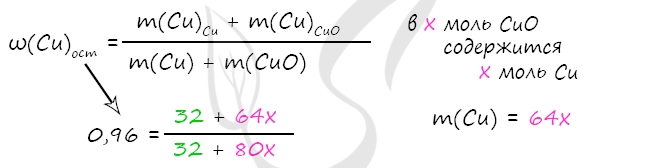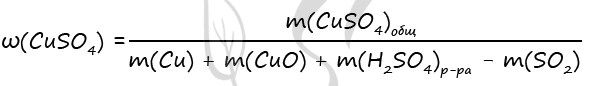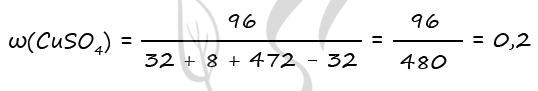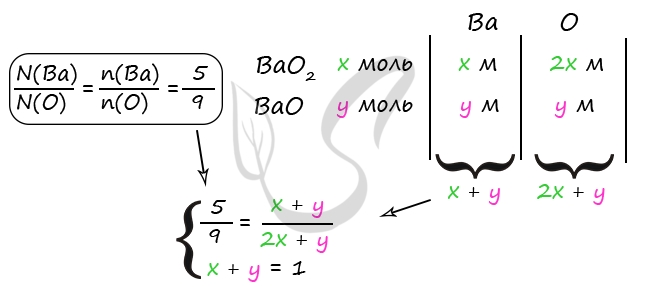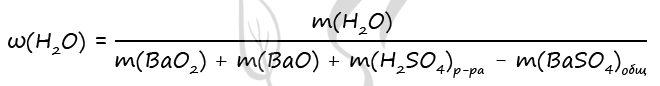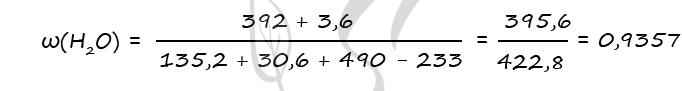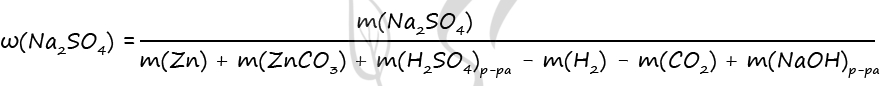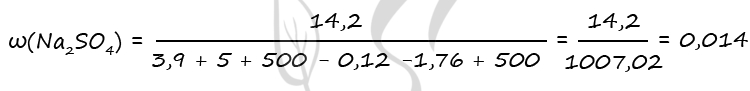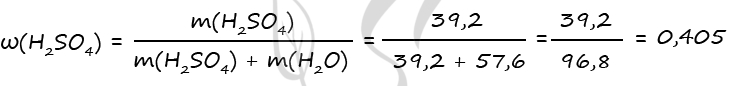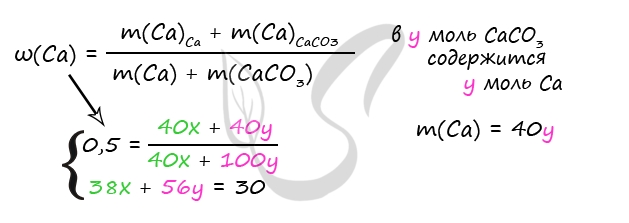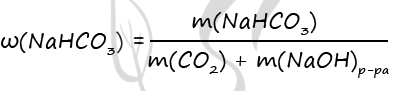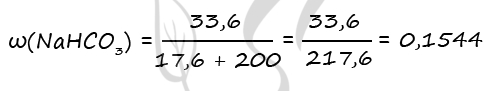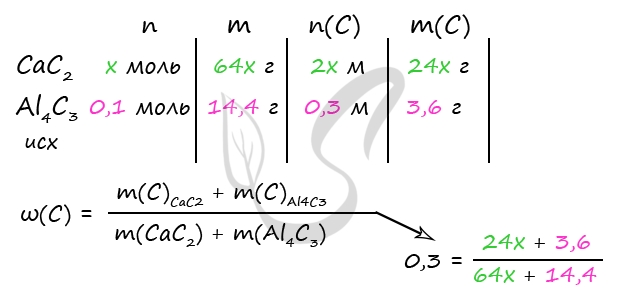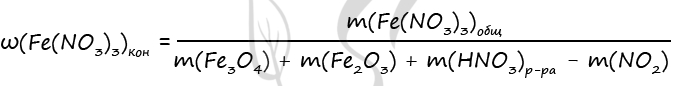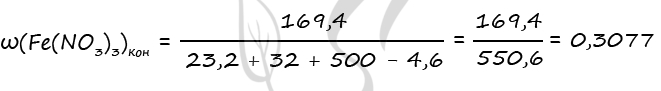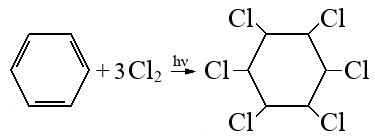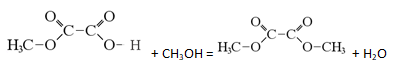Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Тип 34 № 44
К раствору гидроксида натрия массой 1200 г прибавили 490 г 40%-ного раствора серной кислоты. Для нейтрализации получившегося раствора потребовалось 143 г кристаллической соды Na2CO3·10H2O. Рассчитайте массу и массовую долю гидроксида натрия в исходном растворе.
Источник: Демонстрационная версия ЕГЭ—2012 по химии
2
Определите массовые доли (в%) сульфата железа (II) и сульфида алюминия в смеси, если при обработке 25 г этой смеси водой выделился газ, который полностью прореагировал с 960 г 5%-ного раствора сульфата меди.
Источник: Демонстрационная версия ЕГЭ—2013 по химии
3
Смесь хлорида натрия и бромида натрия может прореагировать с 4,48 л хлора (н. у.) или с 850 г 10%-ного раствора нитрата серебра. Определите массовую долю бромида натрия в исходной смеси.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 1
4
Если смесь хлоридов калия и кальция добавить к избытку раствора карбоната натрия, то образуется 10 г осадка. Если ту же смесь добавить к избытку раствора нитрата серебра, то образуется 57,4 г осадка. Определите массовую долю хлорида калия в исходной смеси.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 2
5
Смесь натрия и оксида натрия растворили в воде. При этом выделилось 4,48 л (н. у.) газа и образовалось 240 г раствора с массовой долей гидроксида натрия 10%. Определите массовую долю натрия в исходной смеси.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 4
Пройти тестирование по этим заданиям
Задание №1
При разложении навески нитрата меди (II) выделилась смесь газов объемом 11,2 л (н.у.), а масса навески уменьшилась до 81,315% от исходной. К остатку добавили 292 г раствора соляной кислоты, в результате массовая доля хлороводорода в образовавшемся растворе составила 3,78%. Определите массовую долю хлороводорода в исходном растворе. В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Решение
При разложении Cu(NO3)2 образуется CuO и выделяются NO2 и O2:
2Cu(NO3)2 = 2CuO + 4NO2 + O2 (I)
С раствором соляной кислоты взаимодействует только оксид меди (II):
CuO + 2HCl = CuCl2 + H2O (II)
Вычислим количество смеси газов, выделившихся при прокаливании нитрата меди (II):
ν(NO2 + O2) = V/Vm = 11,2 л/22,4 л/моль = 0,5 моль.
Пусть в смеси газов содержалось х моль кислорода. Поскольку по уравнению реакции (I) количества газов NO2 и O2 соотносятся как 4:1, тогда можно составить и решить следующее уравнение:
х + 4х = 0,5
х = 0,1;
ν(NO2) = 4 · 0,1 моль = 0,4 моль; ν(O2) = 0,1 моль.
Далее вычислим массы газов:
m(NO2) = M · ν = 46 г/моль · 0,4 моль = 18,4 г;
m(O2) = M · ν = 32 г/моль · 0,1 моль = 3,2 г.
Масса навески при прокаливании уменьшается за счет выделяющихся газов, следовательно, потеря массы при прокаливании навески составит:
Δm = m(NO2) + m(O2) = 18,4 г + 3,2 г = 21,6 г.
Вычислим количество образовавшегося оксида меди (II) (по уравнению реакции (I)):
ν(CuO) = ν(NO2)/2 = 0,4 моль/2 = 0,2 моль.
Обозначим за х массу остатка, образовавшегося в результате прокаливания нитрата меди (II) (этот остаток представляет собой неразложившийся нитрат меди (II) и образовавшийся оксид меди (II)), тогда
m(газов) — (100-81,315)%
m(остатка) — 81,315%;
21,6 — 18,685%
х — 81,315%;
х = 94 г.
Вычислим массу раствора соляной кислоты после добавления к нему остатка:
m(конеч. р-ра HCl) = m(исх. р-ра HCl) + m(остат.) = 292 г + 94 г = 386 г;
mконеч.(HCl) = m(конеч. р-ра HCl) · ωконеч.(HCl)/100% = 386 г · 3,78%/100% = 14,59 г.
Обратим внимание на то, что часть соляной кислоты израсходовалась при взаимодействии с оксидом меди (II) (уравнение реакции (II)). Вычислим количество вещества и массу израсходованной на взаимодействие с CuO соляной кислоты:
νрасх(HCl) = 2ν(CuO) = 0,2 моль · 2 = 0,4 моль;
mрасх.(HCl) = M · ν = 36,5 г/моль · 0,4 моль = 14,6 г.
Далее вычислим исходную массу HCl и его долю в исходном растворе:
mисх.(HCl) = mрасх.(HCl) + mконеч.(HCl) = 14,6 г + 14,59 г = 29,19 г;
ω(HCl) = mисх.(HCl)/m(исх. р-ра HCl) · 100% = 10%.
Ответ: ω(HCl) = 10%.
Задание №2
К раствору, полученному при растворении в воде 100 г медного купороса (CuSO4 · 5H2O), добавили 28,8 г порошка магния. После завершения реакции масса раствора уменьшилась на 5%. К полученной смеси добавили 292 г 25%-ного раствора соляной кислоты. Рассчитайте массовую долю хлороводорода в образовавшемся растворе (процессами гидролиза пренебречь). В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Магний, как более активный металл, вытесняет менее активный – медь – из его соли:
CuSO4 + Mg = MgSO4 + Cu (I)
Из оставшихся и образовавшихся веществ с соляной кислотой может реагировать только магния:
Mg + 2HCl = MgCl2 + H2 (II)
Вычислим исходные количества магния и прореагировавшего с ним сульфата меди и магния:
ν(CuSO4) = ν(CuSO4 · 5H2O) = m/M = 100 г/250 г/моль = 0,4 моль;
νисх.(Mg) = m/M = 28,8 г/24 г/моль = 1,2 моль.
Далее вычислим массу исходного раствора сульфата меди (II), для этого обозначим массу этого раствора за х. В ходе реакции в осадок выпадает медь (ее массу необходимо вычесть из массы исходного раствора), а магний превращается в растворимый сульфат магния (массу магния необходимо добавить к исходному раствору). Поскольку масса исходного раствора уменьшилась на 5% (или 0,05), следовательно, масса полученного раствора составит 95% (или 0,95) от исходного, тогда справедливо следующее уравнение:
х — m(Cu) + m(Mg) = 0,95x, поскольку m = M · ν, тогда
х – 64 г/моль · 0,4 моль + 24 г/моль · 0,4 моль = 0,95х;
0,05х = 16
х = 320 г;
m(исх. р-ра CuSO4) = 320 г.
Вычислим количество оставшегося после первой реакции магния, а также исходные массу и количество вещества хлороводорода, реагирующего с оставшимся магнием.
По уравнению реакции (I) ν(CuSO4) = νреаг.(Mg), следовательно:
νост.(Mg) = νисх.(Mg исх) — νреаг.(Mg) = 1,2 моль — 0,4 моль = 0,8 моль;
mисх.(HCl) = m(р-ра HCl) · ω(HCl)/100% = 292 г · 25%/100% = 73 г;
νисх.(HCl) = m/M = 73 г/36,5 г/моль = 2 моль.
Поскольку по уравнению реакции (II) νрасх.(HCl) = 2νост.(Mg),
вычислим количество и массу хлороводорода, оставшиеся после реакции с магнием:
νрасх.(HCl) = 2νост.(Mg) = 0,8 моль · 2 = 1,6 моль;
νост.(HCl) = νисх.(HCl) – νрасх.(HCl) = 2 моль — 1,6 моль = 0,4 моль;
mост.(HCl) = M · ν = 36,5 г/моль · 0,4 моль = 14,6 г.
Далее вычислим количество вещества и массу выделившегося по реакции (II) водорода:
ν(H2) = νост.(Mg) = 0,8 моль;
m(H2) = M · ν = 2 г/моль · 0,8 моль = 1,6 г.
Масса конечного раствора рассчитывается сложением масс растворов сульфата меди, соляной кислоты и магния за вычетом масс меди и водорода. Проведем необходимые вычисления:
m(Cu) = M · ν = 64 г/моль · 0,4 моль = 25,6 г;
m(конеч. р-ра) = m(исх. р-ра CuSO4) + m(р-ра HCl) + mисх.(Mg) — m(Cu) — m(H2) = 320 г + 292 г + 28,8 г — 25,6 г — 1,6 г = 613,6 г.
Вычислим массовую долю хлороводорода в конечном растворе:
ω(HCl) = mост.(HCl)/m(конеч. р-ра) · 100% = 14,6 г/613,6 г · 100% = 2,38%.
Ответ: ω(HCl) = 2,38%.
Задание №3
К 20%-ному раствору соли, полученному при растворении в воде 57,4 г кристаллогидрата сульфата цинка (ZnSO4 · 7H2O) добавили 14,4 г порошка магния. После завершения реакции к полученной смеси добавили 292 г раствора соляной кислоты. Рассчитайте массовую долю хлороводорода в образовавшемся растворе, если известно, что она снизилась в 4 раза относительно исходной (процессами гидролиза пренебречь). В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Магний, как более активный металл, способен вытеснять менее активный – цинк – из его соли:
ZnSO4 + Mg = MgSO4 + Zn (I)
С соляной кислотой могут взаимодействовать образовавшийся по реакции (I) цинк, и непрореагировавший цинк:
Mg + 2HCl = MgCl2 + H2 (II)
Zn + 2HCl = ZnCl2 + H2 (III)
Вычислим исходные количества сульфата цинка и металлического магния:
ν(ZnSO4) = ν(ZnSO4 · 7H2O) = m/M = 57,4 г/287 г/моль = 0,2 моль;
νисх.(Mg) = m/M = 14,4 г/24 г/моль = 0,6 моль.
По уравнению реакции (I) ν(ZnSO4) = νреаг.(Mg), следовательно, магний содержится в избытке и после взаимодействия с сульфатом цинка остается его некоторая часть.
С соляной кислотой реагируют не прореагировавший по реакции (I) магний и образовавшийся цинк. Вычислим количества и массы кислоты и водорода, участвующие в реакциях (II) и (III):
νост.(Mg) = νисх.(Mg) — νреаг.(Mg) = ν(ZnSO4) = 0,6 моль — 0,2 моль = 0,4 моль.
По уравнениям реакции (II) и (III): νII(Н2) = νост.(Mg), νIII(Н2) = ν(Zn), то
ν(Н2) = νII(Н2) + νIII(Н2) = 0,4 моль + 0,2 моль = 0,6 моль; следовательно,
m(Н2) = M · ν = 2 г/моль · 0,6 моль = 1,2 г.
По уравнению реакциям (II) и (III) νII(HCl) = 2νост.(Mg) и νIII(HCl) = 2ν(Zn), следовательно, общее содержание прореагировавшей соляной кислоты составляет:
νрасх.(HCl) = νII(HCl) + νIII(HCl) = 2νост.(Mg) + 2ν(Zn)= 0,4 моль · 2 + 0,2 моль · 2 = 1,2 моль.
mрасх.(HCl) = M · ν = 36,5 г/моль · 1,2 моль = 43,8 г.
Далее вычислим массу исходного раствора сульфата цинка.
По уравнению реакции (III)
m(ZnSO4) = M · ν = 161 г/моль · 0,2 моль = 32,2 г;
m(р-ра ZnSO4) = m(ZnSO4)/ω(ZnSO4) · 100% = 32,2 г/20% · 100% = 161 г.
Масса конечного раствора рассчитывается сложением масс растворов сульфата цинка, кислоты и магния за вычетом массы водорода. Проведем необходимые расчеты:
m(конеч. р-ра) = m(р-ра ZnSO4) + m(р-ра HCl) + mисх.(Mg) = 161 г + 292 г + 14,4 г — 1,2 г = 466,2 г.
Пусть в конечном растворе осталось х г хлороводорода, тогда его исходная масса составляет (х + 43,8) г. Зная соотношение массовых долей в исходном и конечном растворах хлороводорода, составим уравнение:
(х + 43,8)/292 = 4х/466,2
1168х = 466,2х + 20419,56;
701,8х = 20419,56;
х = 29,1г.
mост.(HCl) = 29,1 г.
Вычислим массовую долю хлороводорода в конечном растворе:
ω(HCl) = mост.(HCl)/m(конеч. р-ра) · 100% = 29,1 г/466,2 г · 100% = 6,24%.
Ответ: ω(HCl) = 6,24%.
Задание №4
Для проведения электролиза (на инертных электродах) взяли 640 г 15%-ного раствора сульфата меди (II). К моменту остановки процесса масса раствора уменьшилась на 5%. К образовавшемуся раствору добавили 400 г 20%-ный раствор гидроксида натрия. Определите массовую долю щелочи в полученном растворе. В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Реакция водного раствора сульфата меди (II) протекает с образованием меди (на катоде), выделением кислорода (на аноде) и образованием в растворе серной кислоты:
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4 (I)
С раствором щелочи может реагировать образовавшаяся серная кислота и непрореагировавший сульфат меди (II):
H2SO4 + 2NaOH = Na2SO4 + 2H2O (II)
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2 (III)
Вычислим исходные массы и количество вещества сульфата меди (II) в растворе:
mисх.(CuSO4) = m(р-ра CuSO4) · ω(CuSO4)%/100% = 640 · 15%/100% = 96 г;
νисх.(CuSO4) = m/M = 96 г/160 г/моль = 0,6 моль.
Поскольку к моменту остановки процесса масса исходного раствора уменьшилась на 5%, следовательно, масса конечного раствора составила 95% от исходного:
mост.(р-ра CuSO4) = 640 г · 0,95 = 608 г.
Масса исходного раствора уменьшилась за счет выпавшей в осадок меди и выделившегося кислорода.
Пусть x моль кислорода образовалось в результате реакции (I), тогда 2x моль меди выпало в осадок. Изменение массы раствора по сравнению с исходным (640 г – 608 г) 32 г происходит за счет выделившегося кислорода и выпавшей в осадок меди.
Составит уравнение:
ν(Cu) · M(Cu) + ν(O2) · M(O2) = 2x · 64 + 32x = 160x = 32, следовательно,
x = 0,2, т.е.
по уравнению реакции (I) образовалось ν(H2SO4) = 2 · 0,2 моль = 0,4 моль,
νост.(CuSO4) = νисх.(CuSO4) – 2x = 0,6 моль – 0,4 моль = 0,2 моль.
Вычислим массу и количество вещества прореагировавшей по уравнениям реакций (II) и (III) щелочи:
mисх.(NaOH) = m(р-ра NaOH) · ω(NaOH)%/100% = 400 г · 20%/100% = 80 г;
νисх.(NaOH) = m/M = 80 г/40 г/моль = 2 моль.
По уравнению реакции (II) νII(NaOH) = 2ν(H2SO4) = 2 · 0,4 моль = 0,8 моль;
по уравнению реакции (III) νIII(NaOH) = 2νост.(CuSO4) = 2 · 0,2 моль = 0,4 моль, следовательно,
νобщ.(NaOH) = νII(NaOH) + νIII(NaOH) = 0,8 моль + 0,4 моль = 1,2 моль;
νост.(NaOH) = νисх.(NaOH) — νобщ.(NaOH) = 2 моль – 1,2 моль = 0,8 моль;
mост.(NaOH) = M · ν = 40 г/моль · 0,8 моль = 32 г.
В результате реакции (III) в осадок выпадает гидроксид меди (II), следовательно,
ν(Cu(OH)2) = νост.(CuSO4) = 0,2 моль,
m((Cu(OH)2) = M · ν = 98 г/моль · 0,2 моль = 19,6 г.
Рассчитаем массу конечного раствора:
m(конеч. р-ра) = mост.(р-ра CuSO4) + m(р-ра NaOH) — m((Cu(OH)2) = 608 г + 400 г – 19,6 г = 988,4 г.
Вычислим массовую долю щелочи в конечном растворе:
ω(NaOH) = mост.(NaOH)/m(конеч. р-ра) · 100% = 32 г/988,4 г · 100% = 3,24%.
Ответ: ω(NaOH) = 3,24%.
Задание №5
В результате электролиза (на инертных электродах) 170 г 40%-ного раствора нитрата серебра массовая доля соли в растворе уменьшилась на 16,84%. К образовавшемуся в результате электролиза раствору добавили 175,5 г раствора хлорида натрия, в котором на 4 хлорид-иона приходится 117 молекул воды. Определите массовую долю хлорида натрия в полученном растворе. (Принять, что степень диссоциации сильных электролитов в растворе равна 100%.) В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения исходных физических величин).
Решение
Реакция водного раствора нитрата серебра протекает с образованием серебра (на катоде), выделением кислорода (на аноде) и образованием в растворе азотной кислоты:
4AgNO3 + 2H2O = 4Ag + O2 + 4HNO3 (I)
Из всех возможных веществ, присутствующих в растворе, с хлоридом натрия может взаимодействовать только нитрат серебра:
AgNO3 + NaCl = AgCl + NaNO3 (II)
Вычислим массу соли и количество вещества в исходном растворе:
mисх.(AgNO3) = mисх.(р-ра AgNO3) · ω(AgNO3) = 170 г · 40%/100% = 68 г;
νисх.(AgNO3) = m/M = 68 г/170 г/моль = 0,4 моль;
ω(AgNO3) = ωисх.(AgNO3) — 16,84% = 40% — 16,84% = 23,16%.
Пусть на аноде выделилось х моль кислорода, тогда на катоде выделилось 4х моль серебра. Составим уравнение для вычисления их количеств:
M(Ag) · 4x + M(O2) · 32x = 108 г/моль · 4х + 32 г/моль · х = 464 x г, следовательно, в процессе электролиза масса раствора уменьшилась на 464 x г, тогда массы оставшейся соли и раствора составляют:
m(AgNO3) = M · ν = 170 · (0,4 – 4x),
m(р-ра AgNO3) = 170 – 464x,
0,2316 = 170 · (0,4 – 4x)/(170 – 464x),
0,2316 · (170 – 464x) = 170 · (0,4 – 4x); откуда
x = 0,05.
Отсюда ν(AgNO3) = νисх.(AgNO3) – 4x = 0,4 моль – 4 · 0,05 моль = 0,2 моль,
m(р-ра AgNO3) = 170 г – 464x г = 170 г – 464 · 0,05 г = 146,8 г.
Для вычисления количества хлорида натрия необходимо учесть, что соотношения числа частиц в растворе будет равно соотношению числа моль этих частиц. Тогда справедливо следующее соотношение:
ν(NaCl)/ν(H2O) = N(NaCl)/N(H2O) = N(Cl—)/N(H2O) = 4/117.
Обозначим за 4y моль количество хлорида натрия, тогда количество воды составит 117y моль. Зная общую массу раствора, составим уравнение:
M(NaCl) · 4y + M(H2O) · 117y = m(р-ра NaCl);
58,5 г/моль · 4y моль + 18 г/моль · 117y моль = 175,5 г;
2340y = 175,5
y = 0,075 моль, т.е.
ν(NaCl) = 0,075 моль · 4 = 0,3 моль.
По уравнению реакции (II) ν(AgNO3) = νреаг.(NaCl), следовательно,
νост.(NaCl) = ν(NaCl) — νреаг.(NaCl) = 0,3 моль — 0,2 моль = 0,1 моль;
mост.(NaCl) = M · ν = 58,5 г/моль · 0,1 моль = 5,85 г.
Масса конечного раствора рассчитывается сложением масс раствора нитрата серебра после электролиза и исходного раствора хлорида натрия за вычетом осадка хлорида серебра. Рассчитаем количество вещества и массу хлорида серебра, образующегося по реакции (II):
ν(AgCl) = ν(AgNO3) = 0,2 моль;
m(AgCl) = M · ν = 143,5 г/моль · 0,2 моль = 28,7 г.
Вычислим массу конечного раствора:
m(конеч. р-ра) = mобр.(р-ра AgNO3) + m(р-ра NaCl) — m(AgCl) = 146,8 г + 175,5 г — 28,7 г = 293,6 г.
Вычислим массовую долю хлорида натрия в конечном растворе:
ω(NaCl) = mост.(NaCl)/m(конеч. р-ра) · 100% = 5,85 г/293,6 г · 100% = 1,99%.
Ответ: ω(NaCl) = 1,99%.
Друзья! В статье собраны задачи 34 на так называемую «атомистику» из реального ЕГЭ по химии 16.07.2020. Эти задачи стали новинкой ЕГЭ по химии-2020 и вызвали сложности у участников экзамена. Условия задач не оригинальные, а восстановлены по рассказам и записям участников экзамена. Решения я привожу с подробными объяснениями.
Для всех задач:
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Остановимся на задаче на атомистику с запутанным материальным балансом:
1. Смесь оксида кальция и карбоната кальция с массовой долей атомов кальция 62,5% растворили в 300 г раствора соляной кислоты. При этом наблюдалось выделение газа, и масса полученного раствора составила 361,6 г. Выделившийся в результате реакции газ пропустили через 80 г 10%-ного раствора гидроксида натрия. Вычислите массовую долю соли в конечном растворе.
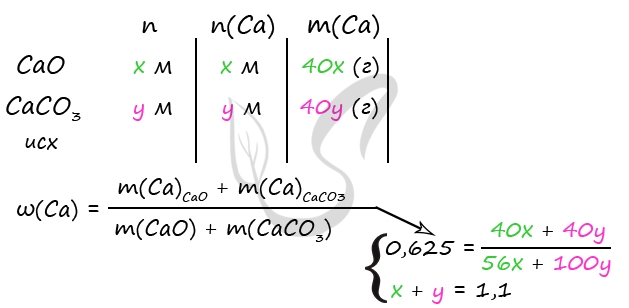
Пусть n(CaO) = х моль, n(CaCO3) = y моль, тогда:
количество вещества атомов кальция в оксида n1(Ca) = х моль, в карбонате: n2(Са) = у моль,
общее количество вещества атомов кальция: n(Са) = (x + y) моль.
Масса атомов кальция: m(Ca) = n(Са)·M(Ca) = 40(x + y) г.
Масса оксида кальция: m(CaО) = n(СаО)·M(CaО) = 56x г.
Масса карбоната кальция: m(CaCO3) = n(CaCO3)·M(CaCO3) = 100у г.
Масса смеси: mсм = m(CaО) + m(CaCO3) = (56х + 100у) г
Получаем выражение:
40(x + y)/(56х + 100у) = 0,625
Преобразуя приведённое выше равенство, получаем х = 4,5у.
Далее протекают реакции:
CaO + 2HCl = CaCl2 + H2O
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
Количество образовавшегося углекислого газа n(CO2) = y моль, масса m(CO2) = 44y г.
Запишем уравнение материального баланса для конечного раствора:
mр-ра = m(CaO) + m(CaCO3) + mр-ра(HCl) — m(CO2)
361,6 = 56х + 100у + 300 — 44у
или
61,6 = 56х + 56у
Получаем систему:
х + у = 1,1
х = 4,5у
5,5у = 1,1
у = 0,2 моль, х = 0,9 моль.
Количество углекислого газа: n(CO2) = 0,2 моль, масса m(CO2) = 44·0,2 = 8,8 г.
При взаимодействии углекислого газа с гидроксидом натрия возможно образование средней или кислой соли:
2NaOH + CO2 = Na2CO3 + H2O (1)
NaOH + CO2 = NaHCO3 (2)
Какие продукты образуются, определяется соотношением количества вещества реагентов.
Масса щелочи: m(NaOH) = mр-ра(NaOH) · ω(NaOH) = 80 · 0,1 = 8 г
Количество вещества: n(NaOH) = m(NaOH) / M(NaOH) = 8/40 = 0,2 моль
Соотношение количества вещества реагентов n(NaOH):n(CO2) = 0,2:0,2 = 1:1
Следовательно, протекает только вторая реакция с образованием кислой соли — гидрокарбоната натрия.
n(NaHCO3) = n(CO2) = 0,2 моль
m(NaHCO3) = n(NaHCO3)·M(NaHCO3) = 0,2·84 = 16,8 г
Масса конечного раствора гидрокарбоната:
mр-ра = m(CO2) + mр-ра(NaOH) = 8,8 + 80 = 88,8 г
Массовая доля гидрокарбоната натрия в конечном растворе:
ω(NaHCO3) = m(NaHCO3)/mр-ра = 16,8/88,8 = 0,1892 или 18,92%
Ответ: ω(NaHCO3) = 18,92%
2. Смесь оксида кальция и карбоната кальция с массовой долей атомов кальция 50% растворили в 300 г раствора избытка соляной кислоты. Выделившийся при этом газ полностью прореагировал с раствором гидроксида натрия массой 200г и массовой долей 8%. Вычислите массовую долю соли в конечном растворе.
3. (ЕГЭ-2020, Центр) Смесь меди и оксида меди (II), в которой массовая доля атомов меди составляет 96%, растворили в 472 г концентрированной серной кислоты, взятой в избытке. При этом наблюдалось выделение газа. Минимальная масса 10%-го раствора NaOH, который может прореагировать с выделившимся газом, равна 200 г. Определите массовую долю соли в растворе, образовавшемся после добавления серной кислоты к исходной смеси веществ. (20%)
4. Смесь из оксида и сульфида алюминия, в которой массовая доля атомов алюминия равна 50%, растворили в 700 г соляной кислоты, взятой в избытке. Для полного поглощения выделившегося при этом газа потребовалось 240 г 20%-ного раствора сульфата меди (II). Вычислите массовую долю соли в растворе, образовавшемся после растворения сульфида и оксида алюминия в кислоте.
5. (ЕГЭ-2020, Дальний Восток) В смеси оксида магния и фосфида магния массовая доля атомов магния равна 54,4%. Смесь полностью прореагировала с 34%-ным раствором соляной кислоты массой 365 г. К полученному раствору добавили 232 г 30%-ного раствора фторида калия. Определите массовую долю хлорида калия в конечном растворе.
6. (ЕГЭ-2020, Центр) Смесь оксида и пероксида натрия, в которой молярное соотношение числа атомов натрия к числу атомов кислорода равно 3:2, нагрели с избытком углекислого газа. Полученное вещество растворили в воде. В результате образовался раствор массой 600 г, к которому добавили 229,6 г раствора хлорида железа(III). Найдите массовую долю оксида натрия в исходной смеси, если в результате образовался раствор массой 795 г с массовой долей карбоната натрия 4%.
7. (ЕГЭ-2020, Центр) Смесь карбида алюминия и карбида кальция, в которой массовая доля атомов углерода равна 30%, полностью растворили в соляной кислоте массой 547,5 г. При этом хлороводород прореагировал полностью. К образовавшемуся раствору добавили 1260 г 8%-ного раствора гидрокарбоната натрия. Определите массовую долю хлороводорода в исходном растворе массой 547,5 г.
8. Смесь железной окалины и оксида железа(III), в которой число атомов железа относится к числу атомов кислорода как 7:10, поместили в 500 г раствора концентрированной азотной кислоты. При этом исходная смесь прореагировала полностью и наблюдалось выделение газа. Для полного поглощения выделившегося газа потребовалось 20 г 20 %-ного раствора гидроксида натрия. Определите массу соли, которая образовалась после растворения исходной смеси в кислоте.
9. Смесь оксида и пероксида бария, в которой число атомов бария относится к числу атомов кислорода как 5:9, полностью растворили в 490 г 20%-ного раствора холодной серной кислоты. При этом смесь прореагировала полностью и раствор стал нейтральным. Определить массовую долю воды в полученном растворе.
10. (ЕГЭ-2020, Дальний Восток) Смесь из оксида лития и нитрида лития, в которой массовая доля атомов лития составляет 56%, смешали с 265 г раствора соляной кислоты с массовой долей 20%. При этом все вещества полностью прореагировали и раствор стал нейтральным. К образовавшемуся раствору добавили 410 г 20%- ного раствора фосфата натрия. Определите массовую долю хлорида натрия в конечном растворе.
11. Дан холодный раствор серной кислоты. К нему добавили пероксид бария, при этом вещества прореагировали полностью. В полученном растворе соотношение атомов водорода к кислороду составило 9 к 5. Затем к этому раствору добавили каталитическое количество оксида марганца (IV), в результате масса раствора уменьшилась на 6,4 г. Вычислите массовую долю серной кислоты в исходном растворе.
12. (ЕГЭ-2020, Сибирь) К холодному раствору серной кислоты добавили пероксид бария, при этом вещества прореагировали полностью. В полученном растворе соотношение атомов водорода к кислороду составило 9 к 5. Затем к этому раствору добавили каталитическое количество оксида марганца (IV), в результате масса раствора уменьшилась на 6,4 г. Вычислите массовую долю серной кислоты в исходном растворе.
Холодный раствор серной кислоты реагирует с пероксидом бария без ОВР:
H2SO4 + BaO2 = BaSO4 + H2O2
При этом в растворе присутствует пероксид водорода, а сульфат бария выпадает в осадок.
Пусть n(H2O2) = х моль, n(H2O) = y моль, тогда:
количество вещества атомов водорода в пероксиде n1(H) = 2х моль, в воде: n2(Н) = 2у моль,
количество вещества атомов кислорода в пероксиде n1(О) = 2х моль, в воде: n2(О) = у моль,
общее количество вещества атомов водорода: n(Н) = (2x + 2y) моль,
общее количество вещества атомов кислорода: n(О) = (2x + y) моль.
Получаем соотношение:
(2x + 2y)/(2x + y) = 9/5
Упрощаем его:
у = 8х
При добавлении каталитического количества оксида марганца (IV) пероксид водорода разлагается:
2H2O2 = 2H2O + O2
Пусть весь пероксид водорода разложился, тогда изменение массы раствора равно массе выделившегося газа, то есть массе кислорода:
m(O2) = 6,4 г
n(O2) = m(O2)/M(O2) = 6,4 / 32 = 0,2 моль
Отсюда
n(H2O2) = 2·n(O2) = 2·0,2 = 0,4 моль
х = 0,4 моль
у = 3,2 моль
Отсюда количество вещества серной кислоты с исходном растворе:
n(H2SO4) = n(H2O2) = 0,4 моль
m(H2SO4) = n(H2SO4)·M(H2SO4) = 0,4·98 = 39,2 г
Количество и масса воды не изменялись:
m(H2O) = n(H2O)·M(H2O) = 3,2·18 = 57,6 г
Массовая доля серной кислоты в исходном растворе:
ω(H2SO4) = m(H2SO4)/(m(H2O)+ m(H2SO4)) = 39,2/(39,2 + 57,6) = 0,405 или 40,5%
Ответ: ω(H2SO4) = 40,5%
13. (ЕГЭ-2020, Дальний Восток) В смесь бромида калия и хлорида калия общей массой 3,125 г добавили 20% -ный раствор нитрата серебра массой 42,5 г. При этом образовался осадок 5,195 г. Определите массовую долю ионов калия в исходном растворе.
14. (ЕГЭ-2020, Дальний Восток) В смеси сульфата железа (II) и сульфата железа (III) соотношение количества атомов железа к количеству атомов серы составляет 3 : 4. К этой смеси добавили 126,4 г 5%-го раствора перманганата калия, при этом вся смесь полностью вступила в реакцию. Определите, какая масса 20%-го раствора NaOH может прореагировать с образовавшимся раствором.
15. (ЕГЭ-2020, Центр) Смесь кальция и карбоната кальция, массовая доля атомов кальция в которой составляет 50%, добавили избытку соляной кислоты массой 300 г. При этом масса полученного раствора составила 330 г, а для полного поглощения одного из выделившихся газов потребовалось 200 г 8%-ного раствора гидроксида натрия. Определите массовую долю соли в конечном растворе.
16. (ЕГЭ-2020, Сибирь) Железную пластинку полностью растворили в 500 г раствора азотной кислоты. При этом образовалась смесь газов: оксида азота (II) и оксида азота (IV), объем которой при н.у. равен 20,16 л, а число атомов кислорода относится к числу атомов азота, как 5 к 3. Определите массовую долю соли в растворе, полученном растворением пластинки в азотной кислоте.
17. (ЕГЭ-2020) Смесь цинка и карбоната цинка, в которой количество атомов цинка относится к количеству атомов кислорода, как 5 к 6, полностью растворили в 500 г разбавленного раствора серной кислоты. При этом все исходные вещества прореагировали полностью и выделилось 22,4 л смеси газов (н.у.). К полученному раствору добавили 500 г 40%-го раствора гидроксида натрия. Определить массовую долю сульфата натрия в конечном растворе.
.
За это задание ты можешь получить 4 балла. На решение дается около 15 минут. Уровень сложности: высокий.
Средний процент выполнения: 23.8%
Ответом к заданию 34 по химии может быть развернутый ответ (полная запись решения с обоснованием выполненных действий).
Разбор сложных заданий в тг-канале
Задачи для практики
Задача 1
Коэффициент растворимости хлорида меди(II) при 100 °С — 110 г / 100 г $Н_2О$, при 20 °С — 72,7 г. 420 г насыщенного при 100 °С раствора соли охладили до 20 °С и выделившийся осадок кристаллогидрата $CuCl_2 ∙ 2H_2O$ отделили. К оставшемуся раствору добавили 200 г 10%-ного раствора гидроксида натрия. Определите массовую долю веществ в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
1) Уравнения реакций:
$CuCl_2 + 2H_2O = CuCl_2 ∙ 2H_2O$ (1)
$CuCl_2 + 2NaOH = Cu(OH)_2↓ + 2KCl$ (2)
2) Находим количество вещества и массу хлорида меди(II) и воды в исходном растворе (при 100 °С).
Пусть $m(CuCl_2)$ = x моль, тогда справедливо соотношение
${m(CuCl_2)}/{m_{p-pa}(CuCl_2)} = {110}/{110 + 100} = {x}/{420}$
x = 220 г $CuCl_2$; $m(H_2O)$ = 420 – 220 = 200 г
$M(CuCl_2)$ = 135 г/моль; $n(CuCl_2)_{100}$ = 220 / 135 ≈ 1.63 моль
3) Находим количество вещества хлорида меди(II) после кристаллизации кристаллогидрата (при 20 °С).
Пусть выделилось x моль $CuCl_2$. тогда справедливо соотношение
$m(CuCl_2)_{выделился}$ = 135x г; $m(H_2O)$ = 2 ∙ 18x = 36x г
${m(CuCl_2)_{20}}/{m_{p-pa}(CuCl_2)} = {72.7}/{72.7 + 100} = {220 – 135х}/{420 – 135х – 36х}$
x ≈ 0.69 моль $CuCl_2$
$m(CuCl_2)_{выделился}$ = 0.69 ∙ 135 = 93.15 г
$m(H_2O)$ = 0.69 ∙ 36 = 24.84 г
$n(CuCl_2)_{20 (осталось)}$ = 1.63 – 0.69 = 0.94 моль
4) По уравнению (2):
а) $m(NaOH)_{чист.}$ = 0.1 ∙ 200 = 20 г
M(NaOH) = 40 г/моль; n(NaOH) = 20 / 40 = 0.5 моль
б) имеется $CuCl_2$ — 0.94 моль
прореагирует $CuCl_2$ — 0.25 моль
останется $CuCl_2$ — (0.94 – 0.25) = 0.69 моль
$m(CuCl_2)_{остался}$ = 0.69 ∙ 135 = 93.15 г
в) $n(Cu(OH)_2)$ = 0.5n(NaOH) = 0.5 ∙ 0.5 = 0.25 моль
$M(Cu(OH)_2)$ = 98 г/моль; $m(Cu(OH)_2)$ = 0.25 ∙ 98 = 24.5 г
г) n(NaCl) = n(NaOH) = 0.5 моль
M(NaCl) = 58.5 г/моль; m(NaCl) = 0.5 ∙ 58.5 = 29.25 г
5) $m_{р-ра}$ = 420 – 93.15 – 24.84 + 200 – 24.5 = 477.51 г
$ω(CuCl_2)$ = 93.15 / 477.51 ≈ 0.1951. или 19.51 %
ω(NaCl) = 29.25 / 477.51 ≈ 0.0613. или 6.13 %
$ω(H_2O)$ = 100 – 19.51 – 6.13 = 74.36 %
Ответ:
Задача 2
Растворимость безводного сульфида натрия при определённой температуре 18,8 г на 100 г воды. При этой температуре приготовили 29,6 г насыщенного раствора сульфида натрия. Раствор разделили на две части. К первой части прилили избыток раствора сульфата алюминия. Ко второй части раствора добавили 36,5 г соляной кислоты (избыток), причём объём выделившегося газа в первой порции в два раз меньше, чем во второй. Вычислите массовую долю хлорида натрия во второй колбе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
1) Уравнения реакций:
$3Na_2S_{(1)} +Al_2(SO_4)_3 + 6H_2O = 3Na_2SO_4 + 3H_2S_{(1)}↑ + 2Al(OH)_3↓$ (1)
$Na_2S_{(2)} + 2HCl = 2NaCl + H_2S_{(2)}$↑
2) Находим количество $Na_2S$ в исходном растворе.
Составляем пропорцию:
18.8 / (18.8 + 100) = x / 29.6
x = 18.8 ∙ 29.6 / 118.8 ≈ 4.68 г
M($Na_2S$) = 78 г/моль, $n(Na_2S)_{(1 + 2)}$ = 4.68 / 78 = 0.06 моль
3) Находим количество $Na_2S$, прореагировавшего по уравнению (2).
Пусть по уравнению (1) прореагировало x моль $Na_2S$, по уравнению (2) – y моль $Na_2S$, тогда:
а) x + y = 0.06
б) $n(H_2S)_{(1)} = n(Na_2S)_{(1)}$ = x моль
$n(H_2S)_{(2)} = n(Na_2S)_{(2)}$ = y моль
y = 2x
${tablex + y = 0.6; y = 2x;$ ${tablex = 0.02 моль H_2S_{(1)}; y = 0.04 моль H_2S_{(2)};$
4) По уравнению (2):
а) $n(NaCl)_{(2)} = 2n(H_2S)_{(2)}$ = 2 ∙ 0.04 / 1 = 0.08 моль
M(NaCl) = 58.5 г/моль, $m(NaCl)_{(2)}$ = 0.08 ∙ 58.5 = 4.68 г
б) $n(Na_2S)_{(2)} = n(H_2S)_{(2)}$ = 0.04 моль
в) $M(H_2S)$ = 34 г/моль, $m(H_2S)$ = 0.04 ∙ 34 = 1.36 г
г) находим массу второй части раствора $Na_2S$.
Так как концентрация вещества в растворе и в любой его части одинакова, то
0.06 / 29.6 = 0.04 / x
x = 0.04 ∙ 29.6 / 0.06 ≈ 19.73 г
5) $ω_2(NaCl)$ = 4.68 / (19.73 + 36.5 – 1.36) = 4.68 / 54.87 ≈ 0.0853, или 8.53 %
Ответ:
Задача 3
При электролизе 9,4 %-ного раствора нитрата меди(II) на катоде выделилось в 1,5 раза больше газа по объёму, чем на аноде. Рассчитайте массовые доли веществ в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
1) Уравнения реакций:
$2Cu(NO_3)_2 + 2H_2O = 2Cu↓ + O_2↑ + 4HNO_3$ (1)
$2H_2O = 2H_2 + O_2$ (2)
Уравнение (1) описывает электролиз раствора $Cu(NO_3)_2$. После полного осаждения меди будет происходить электролиз воды (раствора $HNO_3$) (уравнение 2).
2) Пусть в реакции (1) выделился 1 моль $O_2$. тогда рассчитываем по уравнению (1):
а) $М(O_2)$ = 32 г/моль; $m(O_2)_{(1)}$ = 1 · 32 = 32 г
б) $n(Cu(NO_3)_2$ = 2n$(O_2)$ = 2 моль
$M(Cu(NO_3)_2)$ = 188 г/моль; $m(Cu(NO_3)_2)$ = 2 · 188 = 376 г
$m_{р-ра}(Cu(NO_3)_2)$ = 376 / 0,094 = 4000 г
в) n(Cu) = 2n($O_2$) = 2 моль
M(Cu) = 64 г/моль; m(Cu) = 2 · 64 = 128 г
г) $n(HNO_3) = 4n(O_2)$ = 4 моль
$M(HNO_3)$ = 63 г/моль; $m(HNO_3)$ = 4 · 63 = 252 г
3) Пусть по реакции (2) выделилось x моль $O_2$. тогда:
а) $n(H_2) = 2n(O_2)$ = 2x моль
$V(H_2)$ = 2x · 22.4 л
б) общий объём выделившегося кислорода:
$V(O_2)$ = (1 + x) · 22.4 л
в) так как объём водорода в 1.5 раза больше суммарного объёма выделившегося кислорода, то:
2x / (1 + x) = 1.5
x = 3
$n(H_2)_{(2)}$ = 6 моль; $n(O_2)_{(2)}$ = 3 моль
г) рассчитываем массу выделившихся газов:
$M(H_2)$ = 2 г/моль; $m(H_2)$ = 6 · 2 = 12 г
$m(O_2)_{(2)}$ = 3 · 32 = 96 г
4) $ω(HNO_3) = m(HNO_3)$ / $m_{р-ра}(HNO_3)$
$m_{р-ра}(HNO_3)$ = 4000 – (128 + 32 + 12 + 96) = 3732 г
$ω(HNO_3)$ = 252 / 3732 ≈ 0.0675, или 6.75 %
$ω(H_2O)$ = 100 – 6.75 = 93.25 %
Ответ:
Задача 4
При обжиге образца сульфида меди(II) часть вещества прореагировала и образовался остаток массой 16,8 г. После добавления этого остатка в 182,5 г 10%-ного раствора соляной кислоты в растворе осталось 40 % хлороводорода. Рассчитайте первоначальную массу сульфида и массовую долю соли в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
1) Уравнения реакций:
$2CuS + 3O_2 = 2CuO + 2SO_2↑$ (1)
$CuO + 2HCl = CuCl_2 + H_2O$ (2)
$CuS + HCl ≠$ (3)
2) Находим количество вещества HCl, вступившего в реакцию с CuO:
$m_1(HCl)_{чист.}$ = 0.10 ∙ 182.5 = 18.25 г
M(HCl) = 36.5 г/моль, $n(HCl)_{начальн.}$ = 18.25 / 36.5 = 0.5 моль
$n(HCl)_{прорегировало}$ = 0.5 ∙ 0.6 = 0.3 моль
3) По уравнению (2):
n(CuO) = 0.5n(HCl) = 0.5 ∙ 0.3 = 0.15 моль
M(CuO) = 80 г/моль, m(CuO) = 0.15 ∙ 80 = 12 г
4) Находим количество CuS, вступившего в реакцию окисления.
По уравнению (1):
$n(CuS)_{(1)}$ = n(CuO) = 0.15 моль
M(CuS) = 96 г/моль, $m(CuS)_{прореаг.}$ = 0.15 ∙ 96 = 14.4 г
5) Находим массу исходной смеси:
$m(CuS)_{осталось}$ = 16.8 – 12 = 4.8 г
$m(CuS)_{исходное}$ = 4.8 + 14.4 = 19.2 г
6) По уравнению (2):
$n(CuCl_2)$ = 0.5n(HCl) = 0.5 ∙ 0.3 = 0.15 моль
$M(CuCl_2)$ = 135 г/моль, $m(CuCl_2)$ = 0.15 ∙ 135 = 20.25 г
7) $ω(CuCl_2)$ = 20.25 / (182.5 + 12) = 0.1041, или 10.41 %
Ответ:
Задача 5
Определите массовую долю карбоната калия в растворе, полученном кипячением 150 г 15 %-ного раствора гидрокарбоната калия. Какой объём 15,6 %-ного раствора хлорида бария (плотностью 1,11 г/мл) прореагирует с полученным карбонатом калия? Испарением воды можно пренебречь. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Не знаешь, с чего начать решение? Посмотри подсказку тут:
Решение
1) Уравнения реакций:
$2KHCO_3 = K_2CO_3 + H_2O + CO_2↑$ (1)
$K_2CO_3 + BaCl_2 = BaCO_3↓ + 2KCl$ (2)
2) Количество вещества гидрокарбоната калия $KHCO_3$:
$m(KHCO_3)_{чист.}$ = 0.15 · 150 = 22.5 г
$M(KHCO_3)$ = 100 г/моль; $n(KHCO_3)$ = 22.5 / 100 = 0.225 моль
3) По уравнению (1):
$n(K_2CO_3) = 0.5n(KHCO_3)$ = 0.225 / 2 = 0.1125 моль
$M(K_2CO_3)$ = 138 г/моль; $m(K_2CO_3)$ = 0.1125 · 138 = 15.525 г
4) По уравнению (1):
$n(CO_2) = 0.5n(KHCO_3)$ = 0.1125 моль
$M(CO_2)$ = 44 г/моль; $m(CO_2)$ = 0.1125 · 44 = 4.95 г
5) Массовая доля $K_2CO_3$:
$m_{р-ра}(K_2CO_3) = m_{р-ра}(KHCO_3) – m(CO_2)$ = 150 – 4.95 = 145.05 г
$ω(K_2CO_3)$ = 15.525 / 145.05 ≈ 0.107, или 10.7 %
6) По уравнению (2):
$n(BaCl_2) = n(K_2CO_3)$ = 0.1125 моль
$M(BaCl_2)$ = 208 г/моль; $m(BaCl_2)_{чист.}$ = 0.1125 · 208 = 23.4 г
$m_{р-ра}(BaCl_2)$ = 23.4 / 0.156 ≈ 150 г
$V_{р-ра}(BaCl_2)$ = 150 / 1.11 ≈ 135.14 мл
Ответ:
Задача 6
Железный купорос ($FeSO_4 · 7H_2O$) массой 55,6 г растворили в воде и получили раствор с массовой долей соли 10 %. К этому раствору добавили 39 г цинка. После завершения реакции добавили 250 г 29,2 %-ного раствора соляной кислоты. Определите массовые доли веществ в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
1) Уравнения реакций:
$FeSO_4 · 7H_2O = FeSO_4 + 7H_2O$ (1)
$FeSO_4 + Zn = Fe↓ + ZnSO_4$ (2)
$Fe + 2HCl = FeCl_2 + H_2↑$ (3)
$Zn + 2HCl = ZnCl_2 + H_2↑$ (4)
2) Находим количество вещества $FeSO_4$ и массу раствора:
а) $M(FeSO_4 · 7H_2O)$ = 278 г/моль, $n(FeSO_4 · 7H_2O)$ = 55.6 / 278 = 0.2 моль
б) По уравнению (1):
$n(FeSO_4) = n(FeSO_4 · 7H_2O)$ = 0.2 моль
$M(FeSO_4)$ = 152 г/моль, $m(FeSO_4)$ = 0.2 · 152 = 30.4 г
$m_{р-ра}(FeSO_4) = m_{в-ва} / ω$; $m_{р-ра}$ = 30.4 / 0.1 = 304 г
3) По уравнению (2):
а) M(Zn) = 65 г/моль; n(Zn) = 39 / 65 = 0.6 моль
б) имеется — 0.6 моль Zn
прореагирует — 0.2 моль Zn
останется — (0.6 – 0.2) = 0.4 моль Zn (избыток)
в) n(Fe) = $n(FeSO_4)$ = 0.2 моль
г) $n(ZnSO_4)$ = n(Fe) = 0.2 моль
$M(ZnSO_4)$ = 161 г/моль, $m(ZnSO_4)$ = 0.2 · 161 = 32.2 г
4) По уравнению (3):
а) $m(HCl)_{чист.}$ = 0.292 · 250 = 73 г
M(HCl) = 36.5 г/моль; n(HCl) = 73 / 36.5 = 2 моль (избыток)
б) $n(FeCl_2)$ = n(Fe) = 0.2 моль
$M(FeCl_2)$ = 127 г/моль, $m(FeCl_2)$ = 0.2 · 127 = 25.4 г
в) $n(H_2)_{(3)}$ = n(Fe) = 0.2 моль
$M(H_2)$ = 2 г/моль; $m(H_2)_{(3)}$ = 0.2 · 2 = 0.4 г
г) $n(HCl)_{(3)}$ = 2n(Fe) = 0.4 моль
5) По уравнению (4):
а) $n(ZnCl_2)$ = n(Zn) = 0.4 моль
$M(ZnCl_2)$ = 136 г/моль, $m(ZnCl_2)$ = 0.4 · 136 = 54.4 г
б) $n(H_2)_{(4)}$ = n(Zn) = 0.4 моль
$m(H_2)_{(4)}$ = 0.4 · 2 = 0.8 г
в) $n(HCl)_{(4)}$ = 2n(Zn) = 0.8 моль
6) Рассчитываем массовые доли веществ в растворе:
а) $m_{р-ра} = m_{р-ра}(FeSO_4) + m(Zn) + m_{р-ра}(HCl) — m(H2)_{(3) + (4)}$ = 304 + 39 + 250 – 0.4 – 0.8 = 591.8 г
б) $ω(ZnSO_4) = m(ZnSO_4)$ / $m_{р-ра}$ = 32.2 / 591.8 ≈ 0.0544. или 5.44 %
в) $ω(FeCl_2) = m(FeCl_2)$ / $m_{р-ра}$ = 25.4 / 591.8 ≈ 0.0429. или 4.29 %
г) $ω(ZnCl_2) = m(ZnCl_2)$ / $m_{р-ра}$ = 54.4 / 591.8 ≈ 0.0919. или 9.19 %
д) $n(HCl)_{изб.}$ = 2 – 0.4 – 0.8 = 0.8 моль
$m(HCl)_{изб.}$ = 0.8 · 36.5 = 29.2 г
ω(HCl) = m(HCl) / $m_{р-ра}$ = 29.2 / 591.8 ≈ 0.0493. или 4.93 %
е) $ω(H_2O)$ = 100 – 5.44 – 4.29 – 9.19 – 4.93 = 76.15 %
Ответ:
Задача 7
Через 120 г 10%-ного раствора едкого натра пропустили электрический ток, в результате выделилось 134,4 л (н. у.) газов. Часть полученного раствора, 12,8 г, использовали для полного осаждения меди из 32 г раствора сульфата меди(II). Вычислите массовую долю сульфата меди(II) в растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
1) Уравнения реакций:
$2H_2O = 2H_2 + O_2$ (1)
$CuSO_4 + 2NaOH = Cu(OH)↓ + Na_2SO_4$ (2)
2) Количество вещества реагентов:
$m(NaOH)_{чист.}$ = 0.1 ‧ 120 = 12 г
M(NaOH) = 40 г/моль; n(NaOH) = 12 / 40 = 0.3 моль
3) По уравнению (1).
Пусть выделилось x моль $O_2$. тогда:
а) $V(O_2)$ = 22.4x л
б) $n(H_2)$ = 2x моль, $V(H_2)$ = 2x ‧ 22.4 л
в) 2x ‧ 22.4 + 22.4x = 134.4
x = 2
г) $M(H_2)$ = 2 г/моль, $n(H_2)$ = 2 ∙ 2 = 4 моль, $m(H_2)$ = 4 ‧ 2 = 8 г
$M(O_2)$ = 32 г/моль, $n(O_2)$ = 2 моль, $m(O_2)$ = 2 ‧ 32 = 64 г
4) Находим количество NaOH в отобранной порции раствора:
а) масса раствора после электролиза
$m_{р-ра}(NaOH)_{после электролиза}$ = 120 – 8 – 64 = 48 г
б) так как концентрация вещества в растворе и в любой его части одинакова, то
0.3 / 48 = x / 12.8
x = 0.3 ∙ 12.8 / 48 = 0.08 моль NaOH
5) Находим массовую долю $CuSO_4$ в растворе:
а) по уравнению (2):
$n(CuSO_4)$ = 0.5n(NaOH) = 1 ∙ 0.08 / 2 = 0.04 моль
$M(CuSO_4)$ = 160 г/моль, $m(CuSO_4)$ = 0.04 ∙ 160 = 6.4 г
б) $ω(CuSO_4)$ = 6.4 / 32 = 0.2. или 20 %
Ответ:
Задача 8
Цинковую пластинку массой 50 г поместили в 120 г раствора, содержащего 6% сульфата магния и нитрат серебра. После завершения реакции пластинку вынули, промыли водой, высушили и взвесили. К оставшемуся раствору добавили 135, 14 мл 11,2%-ного раствора гидроксида калия (плотность 1,11 г/мл). Осадок отделили и взвесили; масса осадка 10,41 г. Вычислите массу пластинки после реакции. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
1) Уравнения реакций.
$Zn + MgSO_4 ≠$ (1)
$Zn + 2AgNO_3 = Zn(NO_3)_2 + 2Ag↓$ (2)
$MgSO_4 + 2KOH = Mg(OH)_2↓ + K_2SO_4$ (3)
$Zn(NO_3)_2 + 2KOH = Zn(OH)_2↓ + 2KNO_3$ (4)
$Zn(NO_3)_2 + 4KOH_{(изб.)} = K_2[Zn(OH)_4] + 2KNO_3$ (5)
2) Находим количество реагирующих веществ:
а) $m(MgSO_4)_{чист.}$ = 0.06 ∙ 120 = 7.2 г
$M(MgSO_4)$ = 120 г/моль, $n(MgSO_4)$ = 7.2 / 120 = 0.06 моль
б) $m_{р-ра}(KOH)$ = 1.11 ∙ 135.14 ≈ 150.0054 г
$m(KOH)_{чист.}$ = 0.112 ∙ 150 = 16.8 г
M(KOH) = 56 г/моль, n(KOH) = 16.8 / 56 = 0.3 моль
3) По уравнению (3):
а) $n(Mg(OH)_2) = n(MgSO_4)$ = 0.06 моль
$M(Mg(OH)_2)$ = 58 г/моль, $m(Mg(OH)_2)$ = 0.06 ∙ 58 = 3.48 г
б) $n(КOH)_{(2)} = 2n(MgSO_4)$ = 2 ∙ 0.06 = 0.12 моль
4) По уравнению (4):
а) $m(Zn(OH)_2)$ = 10.41 – 3.48 = 6.93 г
$M(Zn(OH)_2)$ = 99 г/моль, $n(Zn(OH)_2)_{(4)}$ = 6.93 / 99 = 0.07 моль
б) $n(КOH)_{(4)} = 2n(Zn(OH)_2)_4$ = 2 ∙ 0.07 = 0.14 моль
в) $n(Zn)_{(4)} = n(Zn(NO_3)_2)_{(4)} = n(Zn(OH)_2)_{(4)}$ = 0.07 моль
5) По уравнению (5):
а) $n(KOH)_{(5)}$ = 0.3 – (0.12 + 0.14) = 0.04 моль
б) $n(Zn) = n(Zn(NO_3)_2)_{(5)} = 0.25n(KOH)_{(5)}$ = 0.25 ∙ 0.04 = 0.01 моль
6) Находим массу пластинки после реакции:
а) $n(Zn)_{(4) + (5)}$ = 0.07 + 0.01 = 0.08 моль
M(Zn) = 65 г/моль, $m(Zn)_{(4) + (5)}$ = 0.08 ∙ 65 = 5.2 г
б) по уравнению (2):
$n(Ag) = 2n(Zn)_{(4) + (5)}$ = 2 ∙ 0.08 = 0.16 моль
M(Ag) = 108 г/моль, $m(Ag)_{(2)}$ = 0.16 ∙ 108 = 17.28 г
m(пластинки после реакции) = 50 – 5.2 + 17.28 = 62.08 г
Ответ:
Задача 9
Газ, полученный при сжигании 6,4 г серы, без остатка прореагировал с 138 мл 8%-ного раствора NaOH (плотностью 1,087 г/мл). Рассчитайте массовые доли веществ в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Не знаешь, с чего начать решение? Посмотри подсказку тут:
Решение
1) Уравнения реакций:
$S + O_2 = SO_2$ (1)
$2NaOH_{(изб.)} + SO_2 = Na_2SO_3 + H_2O$ (2)
и если $SO_2$ в избытке, то
$SO_2 + H_2O + Na_2SO_3 = 2NaHSO_3$ (3)
2) Количество вещества S и NaOH:
а) M(S) = 32 г/моль; n(S) = 6.4 / 32 = 0.2 моль
б) $m_{р-ра}$(NaOH) = 138 · 1.087 = 150 г
$m_{в-ва}$(NaOH) = 0.08 · 150 = 12 г
M(NaOH) = 40 г/моль; n(NaOH) = 12 / 40 = 0.3 моль
3) По уравнению (1):
n($SO_2$) = n(S) = 0.2 моль
M($SO_2$) = 64 г/моль; m($SO_2$) = 0.2 · 64 = 12.8 г
4) По уравнению (2):
а) имеется $SO_2$ — 0.2 моль
прореагирует $SO_2$ — 0.15 моль
избыток $SO_2$ — (0.2 – 0.15) = 0.05 моль
б) $n(Na_2SO_3)$ = 0.5n(NaOH) = 0.5 · 0.3 = 0.15 моль
5) По уравнению (3):
а) имеется $Na_2SO_3$ — 0.15 моль
прореагирует $Na_2SO_3$ — 0.05 моль
избыток $Na_2SO_3$ = (0.15 – 0.05) = 0.1 моль
M($Na_2SO_3$) = 126 г/моль; $m(Na_2SO_3)_{изб.}$ = 0.1 · 126 = 12.6 г
б) n($NaHSO_3$) = 2n($SO_2$) = 2 · 0.05 = 0.1 моль
M($NaHSO_3$) = 104 г/моль; m($NaHSO_3$) = 0.1 · 104 = 10.4 г
6) Массовые доли веществ в растворе:
а) $m_{р-ра} = m_{р-ра}(NaOH) + m(SO_2)$ = 150 + 12.8 = 162.8 г
б) ω($Na_2SO_3$) = 12.6 / 162.8 ≈ 0.0774. или 7.74 %
в) ω($NaHSO_3$) = 10.4 / 162.8 ≈ 0.0639, или 6.39 %
г) ω($H_2O$) = 100 – (7.74 + 6.39) = 85.87 %
Ответ:
Задача 10
При растворении 69,5 г железного купороса ($FeSO_4 ‧ 7H_2O$) в воде был получен раствор с массовой долей соли 9,5 %. В этот раствор добавили смесь калия и оксида калия, содержащую 92,34 % оксида. Смесь растворилась, при этом выделилось 560 мл (н. у.) газа. Найдите массовые доли веществ в конечном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
1) Уравнения реакций:
$FeSO_4 ‧ 7H_2O = FeSO_4 + 7H_2O$ (1)
$2K + 2H_2O = 2KOH + H_2↑$ (2)
$K_2O + H_2O = 2KOH$ (3)
$FeSO_4 + 2KOH = Fe(OH)_2↓ + K_2SO_4$ (4)
2) Количество реагирующих веществ:
а) $M(FeSO_4 ‧ 7H_2O)$ = 278 г/моль; $n(FeSO_4 ‧ 7H_2O)$ = 69.5 / 278 = 0.25 моль
б) n($H_2$) = 0.56 / 22.4 = 0.025 моль; m($H_2$) = 0.025 ‧ 2 = 0.05 г
3) По уравнению (1):
$n(FeSO_4) = n(FeSO_4 ‧ 7H_2O)$ = 0.25 моль
$M(FeSO_4)$ = 152 г/моль; $m(FeSO_4)$ = 0.25 ‧ 152 = 38 г
$m_{р-ра}(FeSO_4)$ = 38 / 0.095 = 400 г
4) По уравнению (2):
а) n(K) = 2n($H_2$) = 2 ‧ 0.025 = 0.05 моль
M(K) = 39 г/моль; n(K) = 0.05 моль; m(K) = 1.95 г
ω = $m_{в-ва}$ / $m_{смеси}$; $m_{смеси} = m_{в-ва}$ / ω
$m_{смеси}(K + K_2O)$ = 1.95 / (1 – 0.9234) = 1.95 / 0.0766 ≈ 25.46 г
б) $m(K_2O)$ = 25.46 – 1.95 = 23.51 г
$M(K_2O)$ = 94 г/моль; $n(K_2O)$ = 23.51 / 94 ≈ 0.25 моль
в) n(KOH)(2) = n(K) = 0.05 моль
5) По уравнению (3):
а) $n(KOH)_{(3)} = 2n(K_2O)$ = 2 ‧ 0.25 = 0.5 моль
б) $n(KOH)_{общее}$ = 0.05 + 0.5 = 0.55 моль
6) По уравнению (4):
а) имеется KOH — 0.55 моль
прореагирует KOH — 0.5 моль
останется KOH — (0.55 – 0.5) = 0.05 моль
M(KOH) = 56 г/моль; $m(KOH)_{останется}$ = 0.05 ‧ 56 = 2.8 г
б) $n(Fe(OH)_2) = n(FeSO_4)$ = 0.25 моль
$M(Fe(OH)_2)$ = 90 г/моль; $m(Fe(OH)_2)$ = 0.25 ‧ 90 = 22.5 г
в) $n(K_2SO_4) = n(FeSO_4)$ = 0.25 моль
$M(K_2SO_4)$ = 174 г/моль; $m(K_2SO_4)$ = 0.25 ‧ 174 = 43.5 г
7) а) $m_{р-ра}$ = 400 + 25.46 – 0.05 – 22.5 = 402.91 г
б) ω(KOH) = 2.8 / 402.91 ≈ 0.0069, или 0.69 %
в) $ω(K_2SO_4)$ = 43.5 / 402.91 ≈ 0.1080. или 10.8 %
г) $ω(H_2O)$ = 100 – (0.69 + 10.8) = 88.51 %
Ответ:
Задача 11
Насыщенный раствор хлорида алюминия (растворимость 46 г в 100 г воды при 20 °С) массой 50,85 г разлили в две колбы: в первую добавили избыток раствора $Na_2CO_3$, во вторую 20,4 г 25%-ного раствора аммиака. Во второй колбе осадок в 2 раза тяжелее, чем в первой. Найдите концентрацию аммиака во второй колбе после окончания реакции. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
1) Уравнения реакций.
$2AlCl_{3(1-я часть)} + 3Na_2CO_3 + 3H_2O = 2Al(OH)_3↓ + 3CO_2↑ + 6NaCl$ (1)
$AlCl_{3(2-я часть)} + 3NH_3 + 3H_2O = Al(OH)_3↓ + 3NH_4Cl$ (1)
2) Находим количество $AlCl_3$ в исходном растворе.
Составляем пропорцию:
46 / (46 + 100) = x / 50.85
x = 46 ∙ 50.85 / 146 ≈ 16.02 г
M($AlCl_3$) = 133.5 г/моль, $n(AlCl_3)_{(1 + 2)}$ = 16.02 / 133.5 = 0.12 моль
3) Находим количество $AlCl_3$, прореагировавшего по уравнению (2).
Пусть по уравнению (1) прореагировало x моль $AlCl_3$,
по уравнению (2) — y моль $AlCl_3$, тогда:
а) x + y = 0.12
б) $n(Al(OH)_3)_{(1)} = n(AlCl_3)_{(1)}$ = x моль
$n(Al(OH)_3)_{(2)} = n(AlCl_3)_{(2)}$ = y моль
y = 2x
в) ${table x + y = 0.12; y = 2x;$ ${table x = 0.04 моль AlCl_3(1); y = 0.08 моль AlCl_3 (2);$
4) По уравнению (2):
а) $m(NH_3)_{чист.}$ = 0.25 ∙ 20.4 = 5.1 г
$M(NH_3)$ = 17 г/моль, $n(NH_3)$ = 5.1 / 17 = 0.3 моль
б) имеется 0.3 моль $NH_3$
прореагирует (0.08 ∙ 3/1) = 0.24 моль $NH_3$
останется (0.3 – 0.24) = 0.06 моль $NH_3$ (избыток)
$m(NH_3)_{изб.}$ = 0.06 ∙ 17 = 1.02 г
в) $n(Al(OH)_3)_{(2)} = n(AlCl_3)_{(2)}$ = 0.08 моль
$M(Al(OH)_3)$ = 78 г/моль, $m(Al(OH)_3)_{(2)}$ = 0.08 ∙ 78 = 6.24 г
г) находим массу 2-й части раствора $AlCl_3$.
Концентрация вещества в растворе и в любой его части одинакова, следовательно
0.12 / 50.85 = 0.08 / x
x = 0.08 ∙ 50.85 / 0.12 = 33.9 г
5) $ω_2(NH_3)$ = 1.02 / (33.9 + 20.4 – 6.24) = 1.02 / 48.06 ≈ 0.0212, или 2.12 %
Ответ:
Задача 12
В 250 мл воды растворили 13,8 г натрия, затем добавили 10%-ный раствор сульфата меди(II), полученный растворением в воде 62,5 г медного купороса. Определите массовую долю соли в полученном растворе и укажите характер среды. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
1) Уравнения реакций:
$2Na + 2H_2O = 2NaOH + H_2↑$ (1)
$CuSO_4 ∙ 5H_2O = CuSO_4 + 5H_2O$ (2)
$2NaOH + CuSO_4 = Na_2SO_4 + Cu(OH)_2↓$ (3)
2) Рассчитываем количество реагирующих веществ:
а) M(Na) = 23 г/моль, n(Na) = 13.8 / 23 = 0.6 моль
б) $M(H_2O)$ = 18 г/моль, $n(H_2O)$ = 1 · 250 / 18 ≈ 13.9 моль
3) По уравнению (1):
n(Na) = $n(H_2O)$, следовательно,
$H_2O$ — в избытке в количестве (13.9 – 0.6) = 13.3 моль
n(NaOH) = n(Na) = 0.6 моль
n($H_2$) = 0.5n(Na) = 0.5 · 0.6 = 0.3 моль
M($H_2$) = 2 г/моль, m($H_2$) = 0.3 · 2 = 0.6 г
4) По уравнению (2):
а) $M(CuSO_4 ∙ 5H_2O)$ = 250 г/моль, $n(CuSO_4 ∙ 5H_2O)$ = 62.5 / 250 = 0.25 моль
б) $n(CuSO_4) = n(CuSO_4 ∙ 5H_2O)$ = 0.25 моль
$M(CuSO_4)$ = 160 г/моль, $m(CuSO_4)$ = 0.25 ∙ 160 = 40 г
в) $m_{р-ра}(CuSO_4)$ = 40 / 0.1 = 400 г
5) По уравнению (3):
а) имеется NaOH — 0.6 моль
прореагирует NaOH — 0.5 моль
избыток NaOH = (0.6 – 0.5) = 0.1 моль, щелочная среда
б) $n(Na_2SO_4) = n(CuSO_4)$ = 0.25 моль
$M(Na_2SO_4)$ = 142 г/моль, $m(Na_2SO_4)$ = 0.25 · 142 = 35.5 г
в) $n(Cu(OH)_2) = n(CuSO_4)$ = 0.25 моль
$M(Cu(OH)_2)$ = 98 г/моль, $m(Cu(OH)_2)$ = 0.25 · 98 = 24.5 г
6) Рассчитываем массовую долю соли в растворе:
$ω(Na_2SO_4) = m(Na_2SO_4) / m_{(р-ра)}$
$m_{(р-ра)} = m(H_2O) + m(Na) – m(H_2) + m_{р-ра}(CuSO_4) – m(Cu(OH)_2)$ = 250 · 1 + 13.8 – 0.6 + 400 – 24.5 = 638.7 г
$ω(Na_2SO_4)$ = 35.5 / 638.7 ≈ 0.0556, или 5.56 %
Ответ:
Задача 13
При прокаливании нитрата алюминия часть вещества разложилась и выделилось 6,72 л газа (н. у.). Твёрдый остаток массой 25,38 г растворили в минимально возможном количестве 20%-ного раствора гидроксида калия. Рассчитайте массовую долю нитрата калия в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Не знаешь, с чего начать решение? Посмотри подсказку тут:
Решение
Вариант ответа:
Составлены уравнения реакций:
$4Al(NO_3)_3 = 2Al_2O_3 + 12NO_2↑ + 3O_2↑$ (1)
$Al_2O_3 + 2KOH + 3H_2O = 2K[Al(OH)_4]$ (2)
$Al(NO_3)_3 + 4KOH = K[Al(OH)_4] + 3KNO_3$ (3)
Рассчитан количественный состав твёрдого остатка, образовавшегося при прокаливании $Al(NO_3)_3$:
а) по уравнению (1):
V($O_2$) = 3 · 6.72 / 15 = 1.344 л
n($O_2$) = 1.344 / 22.4 = 0.06 моль
V($NO_2$) = 12 · 6.72 / 15 = 5.376 л
n($NO_2$) = 5.376 / 22.4 = 0.24 моль
б) по уравнению (1):
n($Al_2O_3$) = 2 / 3n($O_2$) = 2 · 0.06 / 3 = 0.04 моль
M($Al_2O_3$) = 102 г/моль; m($Al_2O_3$) = 0.04 · 102 = 4.08 г
в) m($Al(NO_3)_3$)осталось = 25.38 – 4.08 = 21.3 г
M($Al(NO_3))3$) = 213 г/моль
n($Al(NO_3)_3$) = 21.3 / 213 = 0.1 моль
Рассчитана масса раствора KOH, израсходованного на растворение остатка:
а) по уравнению (2):
n(KOH) = 2n($Al_2O_3$) = 2 · 0.04 = 0.08 моль
б) по уравнению (3):
n(KOH) = 4n($Al(NO_3)_3$)осталось = 4 · 0.1 = 0.4 моль
в) n(KOH)по ур-ям 2 и 3 = 0.08 + 0.4 = 0.48 моль
M(KOH) = 56 г/моль; m(KOH) = 0.48 · 56 = 26.88 г
$m_{р-ра}$(KOH) = 26.88 / 0.2 = 134.4 г
Рассчитана массовая доля $KNO_3$:
а) по уравнению (3):
n($KNO_3$) = 3n($Al(NO_3)_3$)осталось = 3 · 0.1 = 0.3 моль
M($KNO_3$) = 101 г/моль; m($KNO_3$) = 0.3 · 101 = 30.3 г
б) $m_{р-ра}(KNO_3) = m_{(твёрдого остатка)} + m_{р-ра}(KOH)$ = 25.38 + 134.4 = 159.78 г
в) $ω(KNO_3)$ = 30.3 / 159.78 ≈ 0.1896, или 18.96 %
Ответ:
Задача 14
Растворимость безводного карбоната калия при некоторой температуре составляет 117,7 г в 100 г воды. Приготовленный насыщенный раствор карбоната калия массой 306,3 г разделили на две части. К первой части прилили избыток раствора хлорида бария. При этом образовалось 157,6 г осадка. Вторую часть раствора использовали для нейтрализации 9,8%-ного раствора серной кислоты. Определите массовую долю соли в образовавшемся растворе.
В ответе приведите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение
Вариант ответа:
Составлены уравнения реакций:
$K_2CO_{3(1-я часть)} + BaCl_2 = 2KCl + BaCO_3↓$ (1)
$K_2CO_{3(2-я часть)} + H_2SO_4 = K_2SO_4 + CO_2↑ + H_2O$ (2)
Рассчитано количество $K_2CO_3$ в исходном растворе.
Составляем пропорцию:
117.7/(117.7 + 100) = x/306.3
x = 117.7 ∙ 306.3/217.7 ≈ 165.6 г
M($K_2CO_3$) = 138 г/моль, n($K_2CO_3$)(1 + 2) = 165.6/138 = 1.2 моль
Рассчитано количество $K_2CO_3$, вступившего в реакцию с $BaCl_2$:
а) M($BaCO_3$) = 197 г/моль, n($BaCO_3$) = 157.6/197 = 0.8 моль
б) n($K_2CO_3)_{(1-я часть)}$ = n($BaCO_3$) = 0.8 моль
Рассчитана масса образовавшегося $K_2SO_4$:
а) n($K_2CO_3)_{(2-я часть)}$ = n($K_2CO_3)_{(1 + 2)} – n(K_2CO_3)_{(1-я часть)}$ = 1.2 – 0.8 = 0.4 моль
б) n($K_2SO4$) = n($K_2CO_3)_{(2-я часть)}$ = 0.4 моль
M($K_2SO_4$) = 174 г/моль, m($K_2SO_4$) = 0.4 ∙ 174 = 69.6 г
Рассчитана массовая доля $K_2SO_4$:
а) n($H_2SO_4$) = n($K_2CO_3)_{(2-я часть)}$ = 0.4 моль
M($H_2SO_4$) = 98 г/моль, m($H_2SO_4$) = 0.4 ∙ 98 = 39.2 г
$m_{р-ра}(H_2SO_4$) = 39.2/0.098 = 400 г
б) n($CO_2$) = n($K_2CO_3)_{(2-я часть)}$ = 0.4 моль
M($CO_2$) = 44 г/моль, m($CO_2$) = 0.4 ∙ 44 = 17.6 г
в) находим массу 2-й части раствора $K_2CO_3$.
Концентрация вещества в растворе и в любой его части одинакова, следовательно
1.2/306.3= 0.4/x
x = 0.4 ∙ 306.3/1.2 = 102.1 г
г) $ω_2(K_2SO4)$ = 69.6/(102.1 + 400 – 17.6) = 69.6/484.5 ≈ 0.1436, или 14.36 %
Ответ:
Рекомендуемые курсы подготовки
7935. Смесь оксида алюминия и сульфида алюминия, в которой массовая доля алюминия составляет 50%, растворили в избытке 700 г соляной кислоты. Выделившийся газ полностью поглотили 240 г 20% раствора сульфата меди (II), причём исходные вещества прореагировали без остатка. Вычислите массовую долю соли, образовавшейся при взаимодействии исходной твёрдой смеси с соляной кислотой.

1) Уравнения реакций
Al2O3 + 6HCl = 2AlCl3 + 3H2O (1)
Al2S3 + 6HCl = 2AlCl3 + 3H2S↑ (2)
H2S + CuSO4 = CuS↓ + H2SO4 (3)
2) Вычислим количество Al2O3
m(CuSO4) = 240 ⋅ 0,2 = 48 г
n(CuSO4) = 48 : 160 = 0,3 моль
n(CuSO4) = n(H2S) = 0,3 моль (по уравнению 3)
n(Al2S3) = 1/3 ⋅ n(H2S) = 1/3 ⋅ 0,3 = 0,1 моль (по уравнению 2)
m(Al2S3) = 0,1 ⋅ 150 = 15 г
n(Al)в Al2S3 = n(Al2S3) ⋅ 2 = 0,1 ⋅ 2 = 0,2 моль
m(Al)в Al2S3 = 0,2 ⋅ 27 = 5,4 г
Примем x = n(Al2O3)
n(Al)в Al2O3 = n(Al) ⋅ 2 = 2x моль
m(Al2O3) = x ⋅ 102 = 120x (г)
m(Al)в Al2O3 = 2x ⋅ 27 = 54x (г)
Решив уравнение получим x = 0,7 = n(Al2O3)
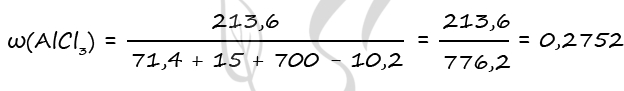
3) Рассчитаем массовую долю хлорида алюминия
n1(AlCl3) = 2n(Al2O3) = 2 ⋅ 0,7 = 1,4 моль (по уравнению 1)
n2(AlCl3) = 2n(Al2S3) = 2 ⋅ 0,1 = 0,2 моль (по уравнению 2)
n(AlCl3)общ = 1,4 + 0,2 = 1,6 моль
m(AlCl3)общ = 1,6 ⋅ 133,5 = 213,6 г
m(Al2O3) = 0,7 ⋅ 102 = 71,4 г
m(H2S) = 0,3 ⋅ 34 = 10,2 г
Ответ: ω(AlCl3) = 27,52%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7935.
7900. Смесь меди и оксида меди (II), в которой массовая доля атомов меди составляет 96%, растворили в концентрированной серной кислоте массой 472 г, взятой в избытке. Полученный газ растворили в минимальном количестве раствора гидроксида натрия массой 200 г с массовой долей щёлочи 10%. Вычислите массовую долю соли в растворе, полученном после реакции исходной смеси с кислотой.

1) Уравнения реакций
Cu + 2H2SO4 = CuSO4 + SO2↑ + 2H2O (1)
CuO + H2SO4 = CuSO4 + H2O (2)
NaOH + SO2 = NaHSO3 (3)
2) Вычислим массу CuO
m(NaOH) = 200 ⋅ 0,1 = 20 г
n(NaOH) = 20 : 40 = 0,5 моль
n(NaOH) = n(SO2) = n(Cu) = 0,5 по уравнению 1 и 3
m(Cu) = 0,5 ⋅ 64 = 32 г
Примем x = n(CuO) = n(Cu)в CuO, тогда
m(Cu)в CuO = x ⋅ 64 = 64x (г)
m(CuO) = x ⋅ 80 = 80x (г)
В результате вычислений x = 0,1 моль = n(CuO)
m(CuO) = 0,1 ⋅ 80 = 8 г
3) Рассчитаем массовую долю соли в растворе, полученном после реакции исходной смеси с кислотой
n(Cu) = n(SO2) = n1(CuSO4) = 0,5 моль (по уравнению 1)
n(CuO) = n2(CuSO4) = 0,1 моль (по уравнению 2)
n(CuSO4)общ = 0,5 + 0,1 = 0,6 моль
m(CuSO4) = 0,6 ⋅ 160 = 96 г
m(SO2) = 0,5 ⋅ 64 = 32 г
Ответ: ω(CuSO4) = 20%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7900.
7865. К смеси пероксида и оксида бария, где отношение количества атомов бария к количеству атомов кислорода равно 5:9, добавили 490 г холодного 20%-го раствора серной кислоты. В результате соединения бария прореагировали полностью, а полученный раствор оказался нейтральным. Найдите массовую долю воды в образовавшемся растворе.

1) Уравнения реакций
BaO2 + H2SO4 = BaSO4↓ + H2O2 (1)
BaO + H2SO4 = BaSO4↓ + H2O (2)
2) Вычислим количество вещества оксида бария и пероксида бария
m(H2SO4) = 490 ⋅ 0,2 = 98 г
n(H2SO4) = 98 : 98 = 1 моль
n(H2SO4) = n(исх. смеси) = 1 моль (по уравнению 1)
n(H2SO4) = n(BaO2) (по уравнению 1)
n(H2SO4) = n(BaSO4) (по уравнению 2)
m(H2O)исх = 490 — 98 = 392 г
Решив данную систему получаем y = 0,2 моль = n(BaO), x = 0,8 моль = n(BaO2)
3) Вычислим массовую долю воды в образовавшемся растворе
n(BaO) = n(H2O)образов. в ур-нии 2 = 0,2 моль (по уравнению 2)
n(H2O)образов. = 0,2 ⋅ 18 = 3,6 г
m(BaO2) = 0,8 ⋅ 169 = 135,2 г
m(BaO) = 0,2 ⋅ 153 = 30,6 г
n(BaO2) = n1(BaSO4) = 0,8 моль (по уравнению 1)
n(BaO) = n2(BaSO4) = 0,2 моль (по уравнению 2)
n(BaSO4)общ = 0,8 + 0,2 = 1 моль
m(BaSO4)общ = 1 ⋅ 233 = 233 г
Ответ: ω(H2O) = 93,57%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7865.
7830. Смесь цинка и карбоната цинка, в которой соотношение атомов цинка и кислорода 5:6, обработали 500 г раствора разбавленной серной кислоты. В результате исходная смесь и кислота прореагировали без остатка и выделилось 2,24 л газов (н.у.). К получившемуся раствору прилили 500 г раствора гидроксида натрия с массовой долей 40%. Найдите массовую долю сульфата натрия в получившемся растворе.

1) Уравнения реакций
Zn + H2SO4 = ZnSO4 + H2↑ (1)
ZnCO3 + H2SO4 = ZnSO4 + H2O + CO2↑ (2)
2) Найдем количество вещества цинка и карбоната цинка
n(CO2+H2) = 2,24 : 22,4 = 0,1 моль
Решив данную систему получим y = n(CO2) = 0,04 моль, x = n(Zn) = 0,06 моль
3) Вычислим количество вещества сульфата цинка и гидроксида натрия
n(Zn) = n1(ZnSO4) = 0,06 моль (по уравнению 1)
n(ZnCO3) = n2(ZnSO4) = 0,04 моль (по уравнению 2)
n(ZnSO4)общ = 0,06 + 0,04 = 0,1 моль
m(NaOH) = 500 ⋅ 0,2 = 200 г
n(NaOH) = 200 : 40 = 5 моль
Сравнивая количество вещества сульфата цинка и гидроксида натрия, можно сделать вывод о том, что гидроксид натрия в избытке — реакция 3 идет с образованием комплексной соли
Zn(SO4) + 4NaOH = Na2[Zn(OH)4] + Na2SO4
4) Вычислим массовую долю сульфата натрия в получившемся растворе
n(ZnSO4)общ = n(Na2SO4) = 0,1 моль (по уравнению 3)
m(Na2SO4) = 0,1 ⋅ 142 = 14,2 г
m(Zn) = 0,06 ⋅ 65 = 3,9 г
m(ZnCO3) = 0,04 ⋅ 125 = 5 г
m(H2) = 0,06 ⋅ 2 = 0,12 г
m(CO2) = 0,04 ⋅ 44 = 1,76 г
Ответ: ω(Na2SO4) = 1,4%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7830.
7795. Смесь твёрдых сульфата железа (II) и сульфата железа (III), в которой соотношение атомов серы и железа 4:3, добавили в подкисленный 5% раствор перманганата калия массой 126,4 г. Все вещества, участвовавшие в окислительно-восстановительной реакции, прореагировали полностью. Рассчитайте максимальную массу 20%-го раствора гидроксида натрия, который прореагирует с полученным раствором.

1) Уравнения реакций
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O (1)
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3↓ + 3Na2SO4 (2)
MnSO4 + 2NaOH = Mn(OH)2↓ + Na2SO4 (3)
2) Вычислим массу исходного сульфата железа (III)
m(KMnO4) = 126,4 ⋅ 0,05 = 6,32 г
n(KMnO4) = 6,32 : 158 = 0,04 моль
n(FeSO4)исх = 5n(KMnO4) = 5 ⋅ 0,04 = 0,2 (по уравнению 1)
По итогу вычислений получаем x = 0,2 моль = n(Fe2(SO4)3)исх
3) Найдем количество вещества MnSO4
n(Fe2(SO4)3)обр = 1/2 ⋅ n(FeSO4) = 1/2 ⋅ 0,2 = 0,1 моль (по уравнению 1)
n(Fe2(SO4)3)общ = 0,2 + 0,1 = 0,3 моль
n(NaOH) = 6n(Fe2(SO4)3)общ = 6 ⋅ 0,3 = 1,8 моль
n(MnSO4) = n(KMnO4) = 0,04 моль
4) Вычислим массу 20%-ного раствора NaOH
n(NaOH) = 2n(MnSO4) = 2 ⋅ 0,04 = 0,08 моль (по уравнению 3)
n(NaOH)общ = 1,8 моль + 0,08 моль = 1,88 моль
m(NaOH) = 1,88 ⋅ 40 = 75,2 г
m(NaOH)р-ра = 75,2 : 0,2 = 376 г
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7795.
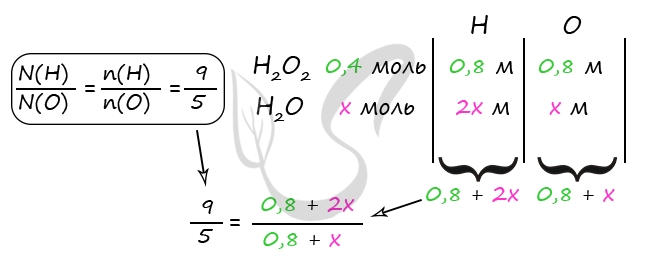
7760. В холодный раствор серной кислоты добавили пероксид бария, при этом вещества прореагировали полностью. В полученном растворе соотношение атомов водорода к кислороду составило 9 к 5. Затем к этому раствору добавили каталитическое количество оксида марганца (IV), в результате масса раствора уменьшилась на 6,4 г. Вычислите массовую долю серной кислоты в исходном растворе.

1) Уравнения реакций
H2SO4 + BaO2 = BaSO4↓ + H2O2 (1)
2H2O2 = (кат. MnO2) 2H2O + O2↑ (2)
2) Вычислим количество воды в исходном растворе
Δm = m(O2) = 6,4 г
n(O2) = 6,4 : 32 = 0,2 моль
2n(O2) = n(H2O2) = n(H2SO4) = 0,4 моль (по уравнению 1 и 2)
m(H2SO4) = 0,4 ⋅ 98 = 39,2 г
Примем n(H2O) = x моль
В результате вычислений получаем x = 3,2 моль = n(H2O) в исходном растворе
m(H2O)исх = 3,2 ⋅ 18 = 57,6 г
3) Вычислим массовую долю серной кислоты в исходном растворе
Ответ: ω(H2SO4) = 40,5%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7760.
7725. Смесь кальция и карбоната кальция, в которой массовая доля атомов кальция равна 50%, растворили в избытке соляной кислоты массой 300 г. После завершения всех реакций масса раствора составила 330 г, а выделившуюся газовую смесь пропустили через 200 г 8%-ного раствор гидроксида натрия. В результате чего один из газов полностью поглотился. Определите массовую долю соли в конечном растворе.

1) Уравнения реакций
Ca + 2HCl = CaCl2 + H2↑ (1)
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ (2)
(?) 2NaOH + CO2 = Na2CO3 + H2O (3)
(?) CO2 + NaOH = NaHCO3 (4)
2) Запишем формулу массы раствора после реакций 1 и 2
m(р-ра после реакций 1 и 2) = m(Ca) + m(CaCO3) + m(HCl)р-ра — m(H2) — m(CO2)
3) Примем n(Ca) = x моль, n(CaCO3) = y моль
m(Ca) = 40x (г)
m(CaCO3) = 100y (г)
n(Ca) = n(H2)по ур-нию 1 = x моль; m(H2) = 2x (г)
n(CaCO3) = n(CO2)по ур-нию 2 = y моль; m(CO2) = 44y (г)
Подставим все найденные значения в формулу массы раствора, записанную в пункте 2
330 = 40x + 100y + 300 — 2x — 44y
В результате решения системы получим: x = 0,2 моль = n(Ca), y = 0,4 моль = n(CaCO3)
4) Вычислим количество гидроксида натрия, массу и массовую долю гидрокарбоната натрия
n(CaCO3) = n(CO2) = 0,4 моль (по уравнению 2)
m(NaOH) = 200 ⋅ 0,08 = 16 г
n(NaOH) = 16 : 40 = 0,4 моль
n(CO2) : n(NaOH) = 0,4 моль : 0,4 моль = 1 : 1 (уравнение 4)
n(CO2) = n(NaOH) = n(NaHCO3) = 0,4 моль (по уравнению 4)
m(NaHCO3) = 0,4 ⋅ 84 = 33,6 г
m(CO2) = 0,4 ⋅ 44 = 17,6 г
Ответ: ω(NaHCO3) = 15,44%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7725.
7690. Смесь оксида кальция и карбоната кальция, в которой массовая доля кальция 62,5%, растворили в 300 г соляной кислоты, которая была в избытке. Масса раствора стала 361,6 г. Выделившийся газ пропустили через 80 г 10%-ного раствора гидроксида натрия. Вычислите массовую долю соли в конечном растворе.

1) Уравнения реакций
CaO + 2HCl = CaCl2 + H2O (1)
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ (2)
CO2 + NaOH = NaHCO3 (3)
CO2 + 2NaOH = Na2CO3 + H2O (4)
2) Запишем формулу массы раствора после реакций 1 и 2
m (р-ра после реакции 1, 2) = m(CaO) + m(CaCO3) + m(HCl)р-ра — m(CO2)
3) Примем n(CaO) = x моль, n(CaCO3) = y моль
m(CaO) = 56x (г)
m(CaCO3) = 100y (г)
n(CaCO3) = n(CO2) = y моль (по уравнению 2)
m(CO2) = 44y (г)
Составим систему уравнений:
361,6 = 56x + 100y + 300 — 44y
x + y = 1,1
Решая систему получаем y = 0,2 = n(CaCO3) = n(CO2)
n(CO2) = n(CaCO3) = 0,2 моль
m(NaOH) = 80 ⋅ 0,1 = 8 г
n(NaOH) = 8 : 40 = 0,2 моль
n(NaOH) = n(CO2) (по уравнению 3)
n(CO2) = n(NaOH) = n(NaHCO3) = 0,2 моль
4) Вычислим массовую долю гидрокарбоната натрия в растворе
m(CO2) = 0,2 ⋅ 44 г/моль = 8,8 г
Ответ: ω(NaHCO3) = 18,92%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7690.
7655. Смесь карбида кальция и карбида алюминия, в которой массовая доля углерода 30%, растворили в 547,5 г соляной кислоты, взятой в необходимом стехиометрическом количестве. В полученный раствор добавляли 1260 г 8%-ного раствора гидрокарбоната натрия до завершения реакции. Найдите массовую долю хлороводорода в растворе, в котором растворяли смесь карбидов.

1) Уравнения реакций
CaC2 + 2HCl = CaCl2 + C2H2↑ (1)
Al4C3 + 12HCl = 4AlCl3 + 3CH4↑ (2)
AlCl3 + 3NaHCO3 = Al(OH)3↓ + 3CO2↑ + 3NaCl (3)
CaCl2 + 2NaHCO3 = CaCO3 + CO2 + H2O + 2NaCl (4 — данная реакция не идет, так как ее обязательным условием является нагревание, о котором в тексте задачи не упоминается)
2) Вычислим массу карбида алюминия
m(NaHCO3) = 1260 ⋅ 0,08 = 100,8 г
n(NaHCO3) = 100,8 : 84 = 1,2 моль
n(AlCl3) = 1/3 ⋅ n(NaHCO3) = 1/3 ⋅ 1,2 = 0,4 моль (по уравнению 3)
n(Al4C3) = 1/4 ⋅ n(AlCl3) = 1/4 ⋅ 0,4 = 0,1 моль (по уравнению 2)
m(Al4C3) = 0,1 моль ⋅ 144 г/моль = 14,4 г
3) Вычислим количество вещества карбида кальция
Примем n(CaC2) = x моль
В результате вычислений получим x = 0,15 моль = n(CaC2)
4) Вычислим массовую долю HCl в растворе
n1(HCl) = 2 ⋅ n(CaC2) = 2 ⋅ 0,15 = 0,3 моль (по уравнению 1)
n2(HCl) = 12 ⋅ n(Al4C3) = 12 ⋅ 0,1 = 1,2 моль (по уравнению 2)
n(HCl)общ. = 0,3 + 1,2 = 1,5 моль (уравнение 1 + уравнение 2)
m(HCl) = 1,5 ⋅ 36,5 = 54,75 г
ω(HCl) = 54,75 : 547,5 = 0,1 * 100% = 10%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7655.
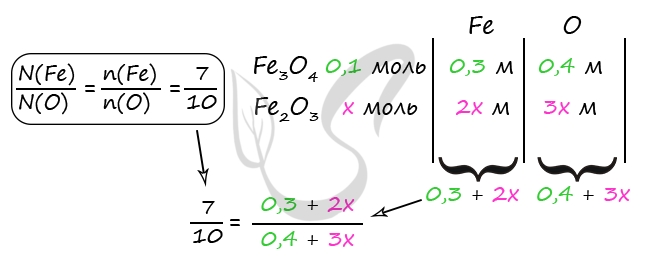
7620. Смесь железной окалины и оксида железа (III), в которой отношение числа атомов железа к числу атомов кислорода 7/10, полностью растворили в 500 г концентрированной азотной кислоты. Для поглощения полученного газа необходимо 20 г 20%-ного раствора гидроксида натрия. Найдите массовую долю соли железа в растворе, полученном после растворения смеси оксидов в кислоте.

1) Уравнения реакций
Fe3O4 + 10HNO3(к) = 3Fe(NO3)3 + NO2 + 5H2O (1)
Fe2O3 + 6HNO3(к) = 2Fe(NO3)3 + 3H2O (2)
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O (3)
2) Вычислим количество Fe3O4
m(NaOH) = 20 ⋅ 0,2 = 4 г
n(NaOH) = 4 : 40 = 0,1 моль
n(NaOH) = n(NO2) = 0,1 моль (по уравнению 3)
n(Fe3O4) = n(NO2) = 0,1 моль (по уравнению 1)
3) Пусть n(Fe2O3) = x моль
В результате решения системы получаем x = 0,2 моль = n(Fe2O3)
4) Запишем формулу массовой доли нитрата железа (III) в конечном растворе и проведем необходимые вычисления
n1(Fe(NO3)3) = 3 ⋅ n(Fe3O4) = 3 ⋅ 0,1 = 0,3 моль (по уравнению 1)
n2(Fe(NO3)3) = 2 ⋅ n(Fe2O3) = 2 ⋅ 0,2 = 0,4 моль (по уравнению 2)
n(Fe(NO3)3)общ. = 0,3 + 0,4 = 0,7 моль (уравнение 1 + уравнение 2)
m(Fe(NO3)3)общ. = 0,7 ⋅ 242 = 169,4 г
m(Fe3O4) = 0,1 ⋅ 232 = 23,2 г
m(Fe2O3) = 0,2 ⋅ 160 = 32 г
m(NO2) = 0,1 ⋅ 46 = 4,6 г
Подставим все вычисленные значения в формулу, записанную в пункте 4
Ответ: ω(Fe(NO3)3) = 30,77%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 7620.
Для вас приятно генерировать тесты, создавайте их почаще
Муниципальное автономное общеобразовательное учреждение
гимназия №4 г. Канска
Методическое пособие для обучающихся 11 классов
профильного направления «Химия»
Алгоритмы решения 34 задания ЕГЭ по химии
Подготовил:
ученик 11Б класса
МАОУ гимназии №4
Ходасевич Егор
Канск, 2022 г.
Оглавление
|
Спецификация:………………………………… |
3 |
|
Оценивание 34 задания………………………. |
4 |
|
Типы задач…………………………………….. |
5 |
|
Что нужно знать для выполнения?……………. |
7 |
|
Химические свойства………………………… |
8 |
|
• Оксиды …………………………………… |
8 |
|
• Основания………………………………… |
9 |
|
• Соли……………………………………….. |
10 |
|
• Кислоты…………………………………… |
11 |
|
Алгоритм решения……………………………. |
12 |
|
Примеры решения задач по алгоритму……… |
13 |
|
Задача на электролиз………………………….. |
13 |
|
Задача на кристаллогидрат…………………… |
18 |
|
Задача на пластинку …………………………… |
21 |
|
Задача на выход реакции……………………… |
24 |
|
Задача на растворимость……………………… |
26 |
34 задание ЕГЭ по химии является расчётной задачей высокого уровня сложности. При решении данного типа задач задействуются все алгоритмы, механизмы и знания по неорганической химии за школьный курс.
Спецификация:
- Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе».
- Расчёты массы (объёма, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси).
- Расчёты массы (объёма, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определённой массовой долей растворённого вещества.
- Расчёты массовой доли (массы) химического соединения в смеси
Так как задание повышенного уровня сложности, решает его маленький процент сдающих экзамен.
Правильный ответ должен включать в себя:
- Правильно записанные уравнения всех реакций
- Правильно выполненные вычисления
- Логическую взаимосвязь физических величин, на основании которой проводятся расчёты
- Правильно определённая искомая величина
Оценивание 34 задания
|
Ответ правильный и полный, содержит следующие элементы: • правильно записаны уравнения реакций, соответствующих условию задания; • правильно произведены вычисления, в которых используются необходимые физические величины, заданные в условии задания; • продемонстрирована логически обоснованная взаимосвязь физических величин, на основании которой проводятся расчёты; • в соответствии с условием задания определена искомая физическая величина |
4 |
|
Правильно записаны три элемента ответа |
3 |
|
Правильно записаны два элемента ответа |
2 |
|
Правильно записаны один элемента ответа |
1 |
|
Все элементы ответа записаны неверно |
0 |
|
Максимальный балл |
4 |
Типы задач
Существует несколько типов 34 задания
- На атомы
Смесь малахита ((CuOH)2CO3) и карбоната цинка, в которой
соотношение числа атомов углерода к числу атомов кислорода равно 5 : 19, растворили в 580,1 г разбавленного раствора серной кислоты. При этом все исходные вещества прореагировали полностью, и выделилось 11,2 л газа (н.у.). К полученному раствору добавили 52 г цинка. После того как массовая доля сульфата меди(II) уменьшилась до 2,5%, всю смесь цинка и меди отделили. Вычислите массовую долю сульфата цинка в конечном растворе.
- На растворимость
Растворимость карбоната аммония составляет 96 г на 100 г воды. Приготовили насыщенный раствор с 250 мл воды, разделили его на две колбы. В первую колбу добавили избыток твёрдого гидроксида натрия и нагрели, а во вторую — 250 г соляной кислоты (тоже в избытке). При этом из второй колбы выделилось в три раза меньше газа (при одинаковых условиях), чем из первой. Определите массовую долю соли во второй пробирке.
- На электролиз
Для проведения электролиза взяли раствор нитрата серебра. После того
как объём газа, выделившийся на аноде, оказался в 1,2 раза меньше
объёма газа, выделившегося на катоде, процесс остановили. (Объёмы
газов измерены при одинаковых условиях). Масса образовавшегося в
процессе электролиза раствора оказалась на 51,8% меньше массы
исходного раствора. К полученному раствору добавили равный ему по
массе 20%-ный раствор гидроксида натрия. Определите среду конечного
раствора и массовую долю соли в нём.
- На неполное разложение
При нагревании образца нитрата алюминия часть вещества разложилась.
При этом образовался твёрдый остаток массой 37,98 г. В этом остатке
число атомов алюминия в 5 раз меньше числа атомов кислорода.
Остаток полностью растворили в необходимом для реакции
минимальном объёме 24%-ного раствора гидроксида натрия. При этом
образовался тетрагидроксоалюминат натрия. Определите массовую
долю нитрата натрия в полученном растворе.
- На пластинку
Магниевую пластинку поместили в 483 г 20%-ного раствора сульфата цинка. После того как масса раствора уменьшилась на 20,5 г, пластинку вынули. К оставшемуся раствору добавили 224 г 40%-ного раствора гидроксида калия. Определите массовую долю гидроксида калия в образовавшемся растворе. (Процессами гидролиза пренебречь.)
- Определение типа соли
Раствор гидрокарбоната кальция содержит 88,8% кислорода по массе.
Этот раствор массой 540 г по каплям добавили к 120 г 0,4%-ного
раствора гидроксида натрия. Выпавший осадок отделили, а оставшийся
раствор нагрели до прекращения выделения газа. Вычислите массу
конечного раствора и массу соли в нём.
- Выход реакции
При обжиге 65,79 г известняка, содержащего 5% примесей, был получен углекислый газ с выходом 80%, который пропустили через 328 мл 20%-ого раствора гидроксида натрия (p=1,22 г/мл). Определите состав и массовые доли веществ в полученном растворе.
- На смесь
Смесь, состоящую из порошков алюминия и угля, прокалили без доступа воздуха. После завершения реакции масса твёрдого остатка составила 12,24 г. К этому остатку добавили 300 г раствора гидроксида калия, взятого в избытке. При этом выделилось 10,752 л (н.у.) смеси газов. Вычислите массовую долю тетрагидроксоалюмината калия в конечном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
- На кристаллогидрат
Оксид меди (II) массой 16 г обработали 40 мл 5,0%-ного раствора серной кислоты (р = 1,03 г/см3). Полученный раствор отфильтровали, фильтрат упарили. Определите массу полученного кристаллогидрата.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Что нужно знать для выполнения?
- Формулы
- Химические свойства веществ, чтобы записать уравнения реакций
- Примерный алгоритм решения
Начнём с формул. На самом деле формулы для решения задач запомнить не так трудно, потому что их небольшое количество. Большую часть формул можно вывести из других.
Пример: m = n ∙ M
n = m/М
Для решения расчетных задач по химии понадобятся следующие физические величины и формулы для их вычисления.
|
Формула |
|
|
Количество вещества n (моль) |
n=m/Mr n=V/22.4 (л/моль) |
|
Масса вещества m (г) |
m=n•Mr |
|
Объем вещества V (л) |
V=n • 22.4 (л/моль) V=m/ρ |
|
Массовая доля W (%) |
А)элемента W=Ar*n/Mr*100% Б)веществаW=m(ч.в.)/m(р-ра)*100% |
|
Плотность ρ (г/мл) |
ρ=m(р-ра)/V(р-ра) |
|
Выход продукта реакции (%) |
η=m(пр.)/m(теор.) |
|
Относительная плотность газа А по газу В |
Dв(A)=M(A)/M(B) |
Химические свойства
Для составления уравнений реакций в решении задачи, следует знать все химические свойства всех веществ. Ведь это обязательное условие для решения задачи.
-
Оксиды
это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Оксиды делятся на две группы солеобразующие (ВеО, ZnO, CaO) и несолеобразующие (NO, N2O, CO).
В свою очередь солеобразующие делятся ещё на три группы: основные (степень окисления метала +1,+2), амфотерные (степень окисления метала +3,+4,+5), кислотные (степень окисления метала +6,+7; степень окисления не метала +3 и больше)
Основные
1.Взаимодействие оксидов щелочных и щелочноземельных металлов с водой
CaO + H2O → Ca(OH)2
2.Взаимодействие с кислотами
MgO+ 2HNO3 → Mg(NO3)2+ 2H2O
3.Взаимодействие с кислотными оксидами
BaO + SO3 → BaSO4
4. Взаимодействие с амфотерными оксидами
Na2O + Al2O33 → NaAlO2
Кислотные
1.Взаимодействие с водой (образование кислоты)
SO3 + H2O → H2SO4
2. Взаимодействие с основными оксидами
SO3 + CuO → CuSO4
3. Взаимодействие с амфотерными оксидами
SO3 + Al2O3 → Al2 (SO4) 3
4. Взаимодействие с основаниями
N2O5 + 2NaOH → 2NaNO3 + H2O
Амфотерные
1. С кислотами (образование соли этой кислоты и воды)
Al2O3 + 6HCl → 2AlCl3 + 3H2O
2. Взаимодействие с кислотными оксидами
Al2O3 + N2O5 → 2Al(NO3) 3
3.Взаимодействие с основными оксидами
Al2O3 + Na2O → 2NaAlO2
4. Взаимодействие с щелочами (раствор)
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH) 4]
5. Взаимодействие с щелочами (расплав)
ZnO + 2KOH → K2ZnO2 + H2O
-
Основания
это сложные вещества, которые состоят из катиона металла и гидроксильной группы (OH).
1.Взаимодействие с кислотными оксидами
N2O5 + 2NaOH → 2NaNO3 + H2O
2. Взаимодействие с кислотами
Ba(OH) 2 + 2HNO3 → Ba(NO3) 2 + 2H2O
3. Взаимодействие с солями
KOH + MgSO4 → Mg(OH) 2↓ + K2SO4
4. Термическое разложение (только нерастворимые основания)
Cu(OH) 2 → CuO +H2O
5. Взаимодействие амфотерных гидроксидов со щелочами
Al(OH) 3(тв.) + KOH(тв.) → KAlO2 + 2H2O
Al(OH) 3(р-р) + KOH(р-р) → K[Al(OH) 4]
-
Соли
это сложные вещества, в состав которых входят катионы металла и анионы кислотного остатка. Иногда в состав солей входят водород или гидроксид-ион.
Соли делятся на 4 группы: средние (метал + кислотный остаток), кислые (метал + Н + кислотный остаток), основные (метал + ОН + кислотный остаток), комплексные(K[Al(OH)4])
Средние
1.Диссоциация
NaCl → Na+ + Cl—
2. Термическое разложение
CaCO3 → CaO + CO2
3. Взаимодействие солей с металлами
Fe + CuSO4 → FeSO4 + Cu
4. Гидролиз
Na2 CO3 + H2 O → NaOH + NaHCO3
5.Взаимодействие с кислотами
K2 CO3 + 2HCl → 2KCl + CO2 +H2 O
6. Взаимодействие с основаниями
Fe(NO3)3 + 3NaOH → Fe(OH)3 + 3NaNO3
7.Взаимодействие с солями
AgCl + 2Na2 S2 O3 → Nа3 [Ag(S2 O3)2] + NaCl
Кислые
1.Диссоциация.
NaHCO3 → Na + +HCO3 — HCO3− → H + + CO3 2-
2. Термическое разложение
Ca(HCO3)2 → CaCO3 + CO2 + H2 O
3. Взаимодействие солей со щелочью.
Ba(HCO3)2 + Ba(OH)2 → 2BaCO3 + 2H2 O
Основные
1.Термическое разложение
[Cu(OH)]2 CO3 → 2CuO + CO2 + H2 O
2.Взаимодействие с кислотами
Sn(OH)Cl + HCl → SnCl2 + H2 O
3. Диссоциация
Mg(OH)Cl → Mg(OH)+ + Cl— Mg(OH)+ → Mg2+ + OH—
Комплексные
1.Взаимодействие с кислотами
Na[Al(OH)4] + 4HCl(изб.) → NaCl + AlCl3 + 4H2 O
Na[Al(OH)4] + HCl(нед.) → NaCl + Al(OH)3 + H2 O
2.Диссоциация
K[Al(OH)4] → K++ [Al(OH)4] —
3. Взаимодействие с сероводородом
K[Al(OH)4]+ H2 S → KHS+Al(OH)3 ↓ +H2 O
4. Взаимодействие с кислотными оксидами
K[Al(OH)4]+CO2 → KHCO3+Al(OH)3 ↓
5.Термическое разложение
K[Al(OH)4] → KAlO2 +2H2 O
-
Кислоты
это сложные вещества, состоящие из атомов водорода (которые могут замещаться на атомы металлов) и кислотных остатков.
1. Диссоциация
HNO3 → H + + NO -3
2. Разложение
H2CO3 → H2O + CO2 ↑
3. Взаимодействие с металлами (до Н)
Mg + 2HCl → MgCl2 + H2 ↑
4. Взаимодействие с основаниями
H3 PO4+3NaOH →Na 3 PO4+3H2O
5. Взаимодействие с солями
BaCl2 + H2SO4 → BaSO4↓ + 2HCl↑
6. Взаимодействие с основными оксидами
K2O + 2HNO3 → 2KNO3 + H2O
7. Взаимодействие с амфотерными оксидами
2HNO 3 +ZnO → Zn(NO3) 2+H2O
Алгоритм решения
На самом деле все задачи уникальны и сложны по-своему. Очень трудно составить один алгоритм для решения всех задач. Можно только выявить некоторые базовые модули, определяющие общую стратегию и основные этапы решения задачи. А уже из них выстраивать ход решения, наполняя пустой алгоритм содержанием.
Поэтому я разработал алгоритм, которым можно пользоваться при решении этих задач
А) Определяем тип задачи
Б) Структурируем все данные (пишем дано)
В) Проводим анализ условия (составляем уравнения химических реакций, о которых упоминается в условии задачи)
Г) Устанавливаем логические связи (формулируем главный вопрос задачи, т.е. находим вещество, количество которого необходимо рассчитать, и логическую цепочку, связывающую количество этого вещества с веществами, количество которых мы знаем или можем вычислить).
Д)Решаем задачу
Примеры решения задач по алгоритму
Задача на электролиз
Электролиз 640 г 15%-го раствора сульфата меди(II) прекратили, когда масса раствора уменьшилась на 32,0 г. К образовавшемуся раствору добавили 400 г 20%-го раствора гидроксида натрия. Определите массовую долю щёлочи в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
А) Определяем тип задачи
Данная задача относится к типу задач на электролиз. Нужно вспомнить что мы знаем про электролиз.
Электролиз (греч. elektron — янтарь + lysis — разложение) — химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
- NaCl + H2O → H2 + Cl2 + NaOH
- CuSO4 + H2O → Cu + O2 + H2SO4
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
- В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
AlCl3 → Al + Cl2
LiBr → Li + Br2
Если в условии задачи электролиз прекратили, то в дальнейшем взаимодействует не только продукт реакции, но и то вещество, которое подверглось электролизу.
Пример: При проведении электролиза 500 г 16%-го раствора сульфата меди(II) процесс прекратили, когда на аноде выделилось 1,12 л газа (н. у.). К образовавшемуся раствору прибавили 53,0 г 10%-го раствора карбоната натрия. Определите массовую долю сульфата меди(II) в полученном растворе.
В данном случае будет составлено 3 уравнения реакций:
- Электролиз сульфата меди (II).
- Реакция остатка сульфата меди (II) с карбонатом натрия
- Реакция серной кислоты с карбонатом натрия
Б) Структурируем все данные (пишем дано)
m (р-ра)(CuSO4)=640г
w (CuSO4)=15%
m (р-ра)(NaOH)=400г
w (NaOH)=20%
В) Проводим анализ условия (составляем уравнения химических реакций, о которых упоминается в условии задачи)
1) 2 CuSO4 + 2 H2O → O2 + 2 H2SO4 + 2 Cu
(электролиз 640 г 15%-го раствора сульфата меди(II) прекратили)
2) H2SO4 + 2 NaOH → 2 H2O+ Na2SO4
(К образовавшемуся раствору добавили 400 г 20%-го раствора гидроксида натрия)
3) CuSO4 + 2 NaOH → Na2SO4 + Cu(OH)2
(так как электролиз прекратили, в нём осталась какая-то доля сульфата меди(II), которая тоже будет реагировать с гидроксидом натрия)
Вывод: у нас получилось 3 уравнения реакций по которым мы будем вести вычисления
Г) Устанавливаем логические связи
Требуется найти массовую долю гидроксида натрия в полученном растворе.
1.Чтобы найти массовую долю гидроксида натрия в полученном растворе нужно знать массу раствора и массу самого гидроксида в этом растворе
W=m(ч.в.)/m(р-ра)*100%
2. Сульфат меди количественно связан с гидроксидом натрия- гидроксида натрия в 2 раза больше (3 реакция)
3. Гидроксид натрия связан с серной кислотой- гидроксида натрия в 2 раза больше (2 реакция)
4. Сульфат меди связан с серной кислотой – равны (1 реакция)
5.Сульфат меди связан с гидроксидом меди- равны (3 реакция)
Д)Решаем задачу
1.m(ч-в)(CuSO4)= 640г*15%/100% = 96г
2.n(CuSO4)= m/Mr = 96г/160 = 0,6 моль
3.m(ч-в)(NaOH)= 400г*20%/100% = 80г
4.n(NaOH)= m/Mr = 80г/40 = 2 моль
Пусть количество вещества образовавшегося кислорода n(O2) = х моль. Тогда количество вещества образовавшейся меди n(Сu) = 2xмоль. m(O2) = 32x(г), а m(Сu) = 64∙2x = 128x(г). По условию задачи: m(O2) + m(Сu) = 32.
32x + 128x = 32
х = 0,2(моль)
5.n(O2)=0,2 моль, а n(Cu)=0,4 моль, тогда n( изр)(CuSO4)=0,4 моль
6. n(ост)(CuSO4)(3ур.)=0,2 моль, а n(NaOH) в 2 раза больше (по 3 уравнению).
n(NaOH)=0,4 моль (в 3 реакции)
7.m(NaOH)=0,4 моль*40г/моль=16г
8.n( изр)(CuSO4)(1ур)=n(H2SO4)=0,4 моль
9.m(1ур)(H2SO4)=0,4 моль*98г/моль=39,2г
10.n(2ур.)(NaOH) в 2 раза больше n(H2SO4) (по 2 реакции)
n (2ур.) (NaOH)=0,8 моль
11.n(изр)(NaOH)=0,8+0,4=1,2 моль
12.n(ост)(NaOH)=2 моль-1,2 моль=0,8моль
13.m(ост)(NaOH)=0,8*40=32г
14.n(Cu(OH2)=n(CuSO4)=0,2 моль (по 3 реакции)
15.m(Cu(OH2)=0,2 моль *98г/моль=19,6 г
16.m(кон.раств.)=m(CuSO4)+ m(NaOH)-32г- m(Cu(OH2)=640+400-32- 19,6=988,4г
17.w(NaOH)= m(NaOH)/ m(кон.раств.)=32г*100%/988,4г=3,24%
Ответ: w(NaOH)= 3,24%
Задача на кристаллогидрат
Смесь цинка и цинкового купороса (ZnSO4 · 7H2O) полностью растворилась в 160 г раствора гидроксида натрия, при этом выделилось 2,24 л газа (н.у.) и образовался раствор массой 172,04 г. Вычислите массовые доли солей в полученном растворе
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
А) Определяем тип задачи
Кристаллогидраты — это сложные вещества, которые содержат в кристаллической решетке молекулы воды.
Многие соединения (чаще всего соли) выкристаллизовываются из водных растворов в виде кристаллогидратов.
При расчёте молярной массы нельзя забывать про воду.
Пример: ZnSO4 · 7H2O
Его молярная масса будет не 161г/моль, а 287г/моль (161 — ZnSO4 ,126 — 7H2O)
Часто встречающиеся кристаллогидраты в ЕГЭ
|
Кристаллогидрат |
Тривиальное название/ название по систематической номенклатуре |
|
Na2CO3 · 10H2O |
Кристаллическая сода, декагидрат карбоната натрия |
|
CaSO4 · 2H2O |
Гипс, дигидрат сульфата кальция |
|
CuSO4 · 5H2O |
Медный купорос, пентагидрат сульфата меди(II) |
|
Na2SO4 · 10H2O |
Кристаллическая сода, декагидрат карбоната натрия |
|
FeSO4 · 7H2O |
Железный купорос, гептагидрат сульфата железа(II) |
|
ZnSO4 · 7H2O |
Цинковый купорос, гептагидрат сульфата цинка(II) |
Б) Пишем «дано» исходя из условия задачи
m(NaOH)=160г
V(H2)=2,24л
m(кон.раств.)=172,04г
В) Проводим анализ условия (составляем уравнения химических реакций, о которых упоминается в условии задачи)
1) ZnSO4 + 4NaOH → Na2 [Zn(OH)4] + Na2SO4
(Смесь цинка и цинкового купороса (ZnSO4 ·7H2O) полностью растворилась в 160 г раствора гидроксида натрия)
2) Zn + 2NaOH + 2H2O → Na2 [Zn(OH)4] + H2
(Смесь цинка и цинкового купороса (ZnSO4 · 7H2O) полностью растворилась в 160 г раствора гидроксида натрия)
Г) Устанавливаем логические связи
Требуется найти массовые доли солей в полученном растворе
1.Чтобы найти массовые доли солей в полученном растворе нужно знать массу раствора и массу самих солей в этом растворе
W=m(ч.в.)/m(р-ра)*100%
2. Цинк связан с водородом –равны (2 реакция)
3. Сульфат натрия связан с сульфатом цинка- равны(1 реакция)
Д)Решаем задачу
1.n(H2)=2,24л/22,4л/моль=0,1 моль
2.m(H2)=0,1 моль*2 г/моль=0,2 г
3. n(Zn)= n(H2)=0,1 моль
4. m(Zn)= 0,1 моль* 65г/моль=6,5г
5. m(кон.раств.)= m(исх)+m(Zn)+m(ZnSO4 · 7H2O)-m(H2)
m(ZnSO4 · 7H2O)=m(кон.раств.)-m(исх)— m(Zn)-m(H2)=172,04г-160г-6,5г+0,2г=5,74г
6.n (ZnSO4 · 7H2O)=n(ZnSO4)=5,74г/287г/моль=0,02 моль
7.n(Na2SO4)=n(ZnSO4)= 0,02 моль
8.n(Na2 [Zn(OH)4])=n(Zn)+ n(ZnSO4)=0,1 моль+0,02 моль=0,12 моль
9. m(Na2SO4)=0,02 моль*142г/моль=2,84г
10. m(Na2 [Zn(OH)4])=0,12 моль*179г/моль=21,48г
11.w(Na2SO4)=2,84г/172,04г*100%=1,65%
12. w(Na2 [Zn(OH)4])=21,48г/172,04г*100%=12,49%
Ответ: w(Na2SO4)= 1,65%; w(Na2 [Zn(OH)4])=12,49%
Задача на пластинку
Навеску оксида меди(II) массой 12,0 г растворили в 200 г 9,8 %-й серной кислоты. В полученный раствор опустили железную пластинку, выдержали до прекращения реакции и удалили из раствора. Найдите массовую долю соли в полученном растворе. Примите Ar(Cu)=64. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите необходимые вычисления (указывайте единицы измерения искомых физических величин).
А) Определяем тип задачи
Данная задача относится к типу задач на пластинку. Решая задачи, важно понимать, что реакции металлов с солями являются окислительно-восстановительными и протекают на поверхности металла, погруженного в раствор соли а выделившийся в результате реакции металл осаждается на данной поверхности.
Б) Пишем «дано» исходя из условия задачи
m(CuO)=12,0г
m(H2SO4)=200г
w(H2SO4)=9,8%
Ar(Cu)=64
В) Проводим анализ условия (составляем уравнения химических реакций, о которых упоминается в условии задачи)
1) CuO+ H2SO4→ CuSO4+ H2O
(Навеску оксида меди(II) массой 12,0 г растворили в 200 г 9,8 %-й серной кислоты)
2) CuSO4+Fe→FeSO4+Cu
(В полученный раствор опустили железную пластинку, выдержали до прекращения реакции и удалили из раствора)
3) H2SO4+ Fe→ FeSO4+ H2
( В полученный раствор опустили железную пластинку, выдержали до прекращения реакции и удалили из раствора)
Г) Устанавливаем логические связи
Требуется найти массовую долю соли в полученном растворе
1.Чтобы найти массовую долю соли в полученном растворе нужно знать массу раствора и массу самой соли в этом растворе
W=m(ч.в.)/m(р-ра)*100%
2.Сульфид меди связан с оксидом меди — равны (1 реакция)
3.Сульфид железа связан с сульфидом меди – равны (2 реакция)
4.Серная кислота связана с оксидом меди – равны
5.Сульфид железа связан с серной кислотой – равны (3 реакция)
Д)Решаем задачу
1)n(CuO)=12/80=0,15 моль
2) m(H2SO4)=200*9,8%/100%=19,6г
3) n(H2SO4)=200*0,098/98=0,2 моль
4) n(CuSO4)= n(CuO)=0,15 моль (1 реакция)
5) n(FeSO4)= n(CuSO4)= )=0,15 моль (2 реакция)
6) n(H2SO4)= n(CuO)=0,15 моль
7) n(H2SO4)=0,2 моль-0,15 моль=0,05 моль (3 реакция)

9)m(FeSO4)=(0,15+0,05)*152=30,4г
10)m(H2O в FeSO4)= m(H2O в H2SO4)+ m(H2O) = (200 -19,6)+0,15*18= 183,1г
11)mраств(FeSO4)=m(FeSO4)+m(H2O)=30,4+183,1= 213,5
12) w(FeSO4)=30,4*100/213,5=14,2%
Ответ: w(FeSO4)= 14,2%
Задача на выход реакции
При взаимодействии в сернокислой среде 17,4 г диоксида марганца с 58 г бромида калия при 77%-ном выходе выделился бром. Какой объём (н. у.) пропена может провзаимодействовать с полученным количеством брома?
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
А) Определяем тип задачи
Данная задача относится к типу задач на выход реакции. Выход продукта реакции (выход реакции) — это коэффициент, определяющий полноту протекания химической реакции. Он численно равен отношению количества (массы, объема) реально полученного продукта к его количеству (массе, объему), которое может быть получено по стехиометрическим расчетам (по уравнению реакции).
Б) Пишем «дано» исходя из условия задачи
m (MnO2)=17,4г
m (KBr)=58г
η=77%=0,77
В) Проводим анализ условия (составляем уравнения химических реакций, о которых упоминается в условии задачи)
1)MnO2+2KBr+2 H2SO4 →MnSO4+Br2+K2SO4+2 H2O
(При взаимодействии в сернокислой среде 17,4 г диоксида марганца с 58 г бромида калия при 77%-ном выходе выделился бром)
2)C3H6+Br2→C3H6Br2
(Какой объём (н. у.) пропена может провзаимодействовать с полученным количеством брома)
Г) Устанавливаем логические связи
1)Требуется найти объём пропена. Что бы найти объём нужно знать его количество
V=n • 22.4 (л/моль)
2)Бром связан с диоксидом марганца – равны (1 реакция)
3)Пропен связан с бромом – равны (2 реакция)
Д)Решаем задачу
1) n(MnO2)=17,4/81=0,2 моль
2) n(KBr)=58/119=0,49
KBr – избыток
3) n(Br2)= n(MnO2)=0,2 моль (1 реакция)
4) n(Br2)=0,2 моль*0,77=0,154 моль (с учётом выхода реакции)
5) n(C3H6)= n(Br2)=0,154 моль (2 реакция)
6)V(C3H6)=0,154 моль *22,4 л/моль=3,450 л
Ответ: V(C3H6)= 3,450 л
Задача на расстворимость
Растворимость карбоната аммония составляет 96 г на 100 г воды. Приготовили насыщенный раствор с 250 мл воды, разделили его на две колбы. В первую колбу добавили избыток твёрдого гидроксида натрия и нагрели, а во вторую — 250 г соляной кислоты (тоже в избытке). При этом из второй колбы выделилось в три раза меньше газа (при одинаковых условиях), чем из первой. Определите массовую долю соли во второй пробирке. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
А) Определяем тип задачи
Данная задача относится к типу задач на растворимость.
Б) Пишем «дано» исходя из условия задачи
m(H2O)=250г
m(HCl)=250г
В) Проводим анализ условия (составляем уравнения химических реакций, о которых упоминается в условии задачи)
1) (NH4)2CO3+2NaOH→Na2CO3+NH3+2H2O
(В первую колбу добавили избыток твёрдого гидроксида натрия и нагрели)
2) (NH4)2CO3+2HCl→2NH4Cl+H2O+CO2
(а во вторую — 250 г соляной кислоты (тоже в избытке))
Г) Устанавливаем логические связи
Требуется найти массовую долю соли во 2 пробирке
1.Чтобы найти массовую долю соли во 2 пробирке нужно знать массу раствора и массу самой соли в этом растворе
W=m(ч.в.)/m(р-ра)*100%
2)Углекислый газ связан с карбонатом амония – равны (2 реакция)
3)Хлорид амония связан с карбонатом амония – в 2 раза меньше (2 реакция)
Д)Решаем задачу
1) m((NH4)2CO3)= 96г – m(H2O)=100г
m((NH4)2CO3)=x г — m(H2O)=250г
m((NH4)2CO3)=96г*250г/100г=240г
2)n((NH4)2CO3)=240г/96г/моль=2,5 моль
3) Пусть n((NH4)2CO3) во 2 колбе = х моль, тогда n((NH4)2CO3) в 1 колбе =1,5х моль
х+1,5х=2,5
х=1 моль n((NH4)2CO3)=1 моль (2 реакция)
4)m((NH4)2CO3)=1 моль*96г/моль= 96г (2 реакция)
5) m раств((NH4)2CO3)=196г
6) n(CO2)= n((NH4)2CO3)=1 моль (2 реакция)
7) m(CO2)=1 моль *44г/ моль =44г

9) m(NH4Cl)= 2 моль * 53,5 г/моль= 107 г
10)w(NH4Cl)= m(NH4Cl)/ (m раств((NH4)2CO3)+ m(HCl) — m(CO2))*100%=107г/(196+250-44)*100%=107г/402г*100%=26,6%
Ответ: w(NH4Cl)= 26,6%
Чтобы поделиться, нажимайте
Задание 34 из ЕГЭ по химии 2022
Предлагаем вашему вниманию задачи с подробными видео-объяснениями и (или) решениями, которые могут быть использованы при проведении ЕГЭ по химии 2022
Составитель — репетитор по химии в Skype или Zoom — Александр Владимирович Коньков (подробнее здесь)
ЕГЭ по химии 2022. Задание 34. Вариант 1
При нагревании с водным раствором гидроксида натрия некоторое органическое вещество подвергается гидролизу с образованием двух продуктов в соотношении 2 : 1. О первом продукте известно, что в нём массовая доля углерода равна 29,27%, водорода 3,66%, кислорода 39,02%, а остальное приходится на натрий. При сжигании образца второго продукта гидролиза массой 46,4 г можно получить 53,76 л (н.у.) углекислого газа и 43,2 г воды. Также о втором продукте известно, что оно относится к насыщенным алициклическим соединениям, в котором все атомы углерода входят в состав цикла, функциональные группы находятся рядом, а относительная плотность паров этого вещества по водороду равна 58.
На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества, которое подвергли гидролизу; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции гидролиза исходного вещества в растворе гидроксида натрия.
ЕГЭ по химии 2022. Задание 34. Вариант 2
При взаимодействии 41,4 г предельной одноосновной карбоновой кислоты с избытком раствора гидрокарбоната натрия выделилось 20,16 л (н.у.) газа. На основании данных условия задания: 1) произведите вычисления, необходимые для установления молекулярной формулы исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции окисления этого вещества сернокислым раствором перманганата калия.
ЕГЭ по химии 2022. Задание 34. Вариант 3
При полном сгорании органического вещества массой 29,6 г образовалось 26,88 л (н.у.) углекислого газа и 21,6 г воды. Относительная плотность паров этого вещества по водороду равна 37. Установлено, что оно не реагирует с гидрокарбонатом натрия, не даёт реакции «серебряного зеркала», но взаимодействует со щелочами. На основании данных условия задания: 1) произведите вычисления, необходимые для установления молекулярной формулы исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможные структурные формулы этого вещества, которые однозначно отражают порядок связи атомов в молекуле; 4) напишите уравнение реакции этого вещества с гидроксидом натрия.
ЕГЭ по химии 2022. Задание 34. Вариант 4
При дегидрировании 52,8 г предельного спирта над медным катализатором образовалось 51,6 г кетона. На основании данных условия задания: 1) произведите вычисления, необходимые для установления молекулярной формулы исходного спирта; 2) запишите молекулярные формулы спирта и кетона; 3) составьте возможные структурные формулы спирта и кетона, которые однозначно отражают порядок связи атомов в молекуле; 4) напишите уравнение реакции спирта с натрием в молекулярном виде.
ЕГЭ по химии 2022. Задание 34. Вариант 5
При обработке первичного предельного одноатомного спирта натрием выделилось 6,72 л газа (н.у.). При полной дегидратации такого же количества спирта образуется этиленовый углеводород массой 33,6 г. На основании данных условия задания: 1) произведите вычисления, необходимые для установления молекулярной формулы исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнения описанных в условии задания реакций.
ЕГЭ по химии 2022. Задание 34. Вариант 6
Органическое вещество А содержит 3,61% водорода и 38,55% кислорода по массе и образуется при взаимодействии органического вещества Б с раствором перманганата калия в присутствии серной кислоты. Известно, что вещество Б относится к ароматическим соединениям и содержит по одному радикалу в пара-положениях. Также известно, что вещество А имеет молярную массу 166 г/моль. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества А. 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле. 3) напишите уравнение реакции получения вещества А из вещества Б (используйте структурные формулы органических веществ).
ЕГЭ по химии 2022. Задание 34. Вариант 7
Органическое вещество А содержит 40% углерода, 6,7% водорода и 53,3% кислорода по массе. Относительная плотность паров этого вещества по водороду равна 30. Вещество А образуется при взаимодействии органического вещества Б с аммиачным раствором оксида серебра (I). На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества А. 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле. 3) напишите уравнение реакции получения вещества А из вещества Б (используйте структурные формулы органических веществ).
ЕГЭ по химии 2022. Задание 34. Вариант 8
Органическое вещество А содержит 9,68% водорода и 51,61% кислорода по массе и образуется при взаимодействии органического вещества Б с водным раствором перманганата калия. Относительная плотность паров вещества А по гелию равна 15,5. Известно, что вещество Б является углеводородом. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества А. 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле. 3) напишите уравнение реакции получения вещества А из вещества Б (используйте структурные формулы органических веществ).
ЕГЭ по химии 2022. Задание 34. Вариант 9
Органическое вещество А содержит 6,67% водорода и 13,33% кислорода по массе и образуется при взаимодействии органического вещества Б с хлорангидридом уксусной кислоты в присутствии хлорида алюминия. Известно, что вещество А относится к ароматическим кетонам. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества А. 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле. 3) напишите уравнение реакции получения вещества А из вещества Б (используйте структурные формулы органических веществ).
ЕГЭ по химии 2022. Задание 34. Вариант 10
Органическое вещество А содержит 8,11% водорода и 43,24% кислорода по массе и образуется при взаимодействии с органическим веществом Б. Известно, что вещество Б содержит один атом углерода и является ядом. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества. 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле. 3) напишите уравнение реакции получения вещества А из вещества Б (используйте структурные формулы органических веществ).
ЕГЭ по химии 2022. Задание 34. Вариант 11
При сгорании 26,2 г органического вещества получили 26,88 л углекислого газа (н.у.), 2,24 л азота (н.у.) и 23,4 г воды. При нагревании с бромоводородной кислотой данное вещество подвергается гидролизу, продуктами которого являются соединение состава C2H6NO2Br и третичный спирт.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение гидролиза вещества в присутствии бромоводородной кислоты (используйте структурные формулы органических веществ).
ЕГЭ по химии 2022. Задание 34. Вариант 12
При сгорании органического вещества А массой 43,65 г получили 20,16 л (н.у.) углекислого газа и 20,16 л (н.у.) хлороводорода.
Вещество А образуется при взаимодействии вещества Б с хлором под действием ультрафиолетового освещения. Известно, что в молекуле вещества Б все атомы углерода находятся в sp2-гибридизации, а в молекуле вещества Б — в sp3-гибридизации. На основании данных задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А при хлорировании вещества Б (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
1. n = m/M, n = V/Vm
m = n ∙ M,
n (CO2) = 20,16 л / 22,4 л/моль = 0,9 моль
n (С) = n (СО2) = 0,9 моль
m (C) = 0,9 моль ∙ 12 г/моль = 10,8 г
n (HCl) = 20,16 л / 22,4 л/моль = 0,9 моль
n (H) = n (HCl) = 0,9 моль
m (H) = 0,9 моль ∙ 1 г/моль = 0,9 г
m (Cl) = 0,9 моль ∙ 35,5 г/моль = 31,95 г
m (C) + m (H) + m (Cl) = 10,8 г + 0,9 г + 31,95 г = 43,65 г
m (O) = 43,65 г – 43,65 г = 0
n (C) : n (H) : n (Cl) = 0,9 : 0,9 : 0,9 = 1 : 1 : 1 = 6 : 6 : 6
Следовательно молекулярная формула C6H6Cl6
- Структурная формула
- Уравнение реакции
ЕГЭ по химии 2022. Задание 34. Вариант 13
Неизвестное органическое вещество А содержит 34,62% углерода, а также водород и кислород, причём массовая доля кислорода в 15,982 раза больше массовой доли водорода. Известно, что 1 моль вещества А может вступить в реакцию с 2 моль гидроксида натрия, или 1 моль гидрокарбоната калия, или 1 моль метанола.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции вещества А с избытком метанола (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
1. Общая формула вещества CxHyOz
ω (O + H) = 100% — 34,62% = 65,38%
Пусть ω (Н) = х %, тогда ω (О) = 15,982х %, следовательно получаем математическое уравнение:
х + 15,982х = 65,38
16,982х = 65,38
х = 3,85% (ω (Н)), ω (О) = 15,982∙3,67 = 61,53%
x : y : z = 34,62/12 : 3,85/1 : 61,53/16 = 2,885 : 3,85 : 3,85 = 3 : 4 : 4
Следовательно, молекулярная формула C3H4O4.
- По описанным данным, можно предположить, что раз это вещество реагирует только с 1 моль гидрокарбоната или 1 моль спирта, то значить в этом веществе находится одна карбоксильная группа, но так как это же вещество может реагировать с 2 моль щелочи, то значит есть эфирная связь, которая будет подвергаться щелочному гидролизу. Поэтому это монометиловый эфир щавелевой кислоты.
Структурная формула:
- Уравнение реакции:
ЕГЭ по химии 2022. Задание 34. Вариант 14
При сгораниии 9,9 г органического вещества А получили 12,096 л углекислого газа, 0,672 л азота (н.у.) и 5,94 г воды.
Известно, что вещество А подвергается и щелочному и кислотному гидролизу, при этом образуется первичный насыщенный одноатомный спирт (молекула которого содержит 2 атома углерода) и органическая соль (соль образуется при любом типе гидролиза). Также известно, что вещество А можно получить каталитическим гидрированием вещества Б, в котором заместители максимально удалены друг от друга.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А путём каталитического гидрирования вещества Б (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
1) исходное органическое вещество точно содержит в своём составе атомы элементов углерод, азот и водород, так как при сгорании этого вещества образуются углекислый газ, газ азот и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода, азота и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода, азота и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, n = V/Vm
m = n ∙ M,
n (CO2) = 12,096 л / 22,4 л/моль = 0,54 моль
n (С) = n (СО2) = 0,54 моль
m (C) = 0,54 моль ∙ 12 г/моль = 6,48 г
М(Н2О) = 18 г/моль
n (H2O) = 5,94 г / 18 г/моль = 0,33 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,33 моль = 0,66 моль
m (H) = 0,66 моль ∙ 1 г/моль = 0,66 г
n (N2) = 0,672 л / 22,4 л/моль = 0,03 моль
n (N) = 2 ∙ n (N2) = 2 ∙ 0,03 моль = 0,06 моль
m (N) = 0,06 моль ∙ 14 г/моль = 0,84 г
m (C) + m (H) + m (N) = 6,48 г + 0,66 г + 0,84 г = 7,98 г, что НЕ равно массе исходного вещества, а значит атомы кислорода присутствуют в веществе.
m (O) = 9,9 г – 7,48 г = 1,92 г
n (O) = 1,92 г / 16 г/моль = 0,12 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (N) : n (O) = 0,54 : 0,66 : 0,06 : 0,12 = 9 : 11 : 1 : 2
Следовательно молекулярная формула вещества: C9H11NO2.
2) Анализируя информацию о веществе А, можно предположить, что гидролизу подвергаются такие классы органических веществ, как эфиры (включая жиры), углеводы, пептиды, ангидриды кислот и некоторые другие. Но с образованием спирта гидролизуются только эфиры. Причём если молекула спирта содержит только два атома углерода, то делаем вывод, что вещество А – это сложный эфир некой кислоты и спирта этанола. Необходимо заметить, что в независимости от тиипа гидролиза образуется соль, а такое возможно для аминокислот. Следовательно мы имеем сложный эфир, состоящий из остатков спирта этанола и некой аминокислоты, причем ароматической, так как молекулярная формула содержит малое количество атомов водорода. Используя информацию о получении вещества А гидрированием вещества Б, делаем вывод, что вещество Б –нитросоединение, содержащее NO2-группу, потому что при гидрировании нитро-группа переходит в амино-группу (NH2-). А также понимаем, что эта нитро-группа находится в пара-положении, так как только это положение подходит под описание, когда заместители максимально удалены друг от друга, там же будет и NH2-группа.
Следовательно, структурная формула —
3) Уравнение получения вещества А путём гидрирования вещества Б:
ЕГЭ по химии 2022. Задание 34. Вариант 15
При сгорании 13,28 г органического вещества А получили 3,8528∙1023 молекул углекислого газа и 4,32 мл воды.
Известно, что вещество А содержит атомы углерода только в sp2-гибридизации, заместители максимально удалены друг от друга, а также может вступать в реакцию с метанолом (в присутствии серной кислоты) в соотношении либо 1:1 либо 1:2.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции взаимодействия вещества А с метанолом (в присутствии серной кислоты) в соотношении 1:2 соответственно (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
1) исходное органическое вещество точно содержит в своём составе атомы элементов углерод и водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = N/NA, n = m/M
m = n ∙ M,
n (CO2) = 3,8528 молекул / 6,02∙1023 моль-1 = 0,64 моль
n (С) = n (СО2) = 0,64 моль
m (C) = 0,64 моль ∙ 12 г/моль = 7,68 г
т.к. плотность воды 1 г/мл, то m (H2O) = 4,32 мл ∙ 1 г/мл = 4,32 г
М(Н2О) = 18 г/моль
n (H2O) = 4,32 г / 18 г/моль = 0,24 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,24 моль = 0,48 моль
m (H) = 0,48 моль ∙ 1 г/моль = 0,48 г
m (C) + m (H) = 7,68 г + 0,48 г = 8,16 г, что НЕ равно массе исходного вещества, а значит атомы кислорода присутствуют в веществе.
m (O) = 13,28 г – 8,16 г = 5,12 г
n (O) = 5,12 г / 16 г/моль = 0,32 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 0,64 : 0,48 : 0,32 = 2 : 1,5 : 1 = 4 : 3 : 2. Но составить структурную формулу с таким соотношением атомов не представляется возможным, поэтому данные индексы надо ещё раз удвоить.
Следовательно молекулярная формула вещества: C8H6O4.
2) Анализируя информацию о веществе А, можно предположить, что данное вещество является ароматическим, так как молекула содержит небольшое число атомов водорода. И так как реагирует со спиртами, то это может быть карбоновая кислота, но с учётом разного соотношения – дикарбоновая кислота, причем вторая карбоксильная группа находится в пара-полложении, так как сказано, что заместители максимально удалены друг от друга.
Следовательно, структурная формула — 
ЕГЭ по химии 2022. Задание 34. Вариант 16
При сгораниии 13,7 г органического вещества А получили 15,68 л углекислого газа, 1,12 л азота (н.у.) и 6,3 г воды.
Известно, что вещество А содержит в составе одной молекулы 5 вторичных атомов углерода , один третичный и один первичный атом, а функциональная группа находится в пара-положении. Вещество А при реакции с парами хлороводорода в присутствии железа при нагревании переходит в органическое вещество Б немолекулярного строения.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества;
2) составьте структурную формулу вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции вещества А парами хлороводорода в присутствии железа при нагревании (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
1) исходное органическое вещество точно содержит в своём составе атомы элементов углерод, азот и водород, так как при сгорании этого вещества образуются углекислый газ, газ азот и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода, азота и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода, азота и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, n = V/Vm
m = n ∙ M,
n (CO2) = 15,68 л / 22,4 л/моль = 0,7 моль
n (С) = n (СО2) = 0,7 моль
m (C) = 0,7 моль ∙ 12 г/моль = 8,4 г
М(Н2О) = 18 г/моль
n (H2O) = 6,3 г / 18 г/моль = 0,35 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,35 моль = 0,7 моль
m (H) = 0,7 моль ∙ 1 г/моль = 0,7 г
n (N2) = 1,12 л / 22,4 л/моль = 0,05 моль
n (N) = 2 ∙ n (N2) = 2 ∙ 0,05 моль = 0,1 моль
m (N) = 0,1 моль ∙ 14 г/моль = 1,4 г
m (C) + m (H) + m (N) = 8,4 г + 0,7 г + 1,4 г = 10,5 г, что НЕ равно массе исходного вещества, а значит атомы кислорода присутствуют в веществе.
m (O) = 13,7 г – 10,5 г = 3,2 г
n (O) = 3,2 г / 16 г/моль = 0,2 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (N) : n (O) = 0,7 : 0,7 : 0,1 : 0,2 = 7 : 7 : 1 : 2
Следовательно молекулярная формула вещества: C7H7NO2.
2) Анализируя информацию о веществе А, можно предположить, что это вещество является ароматическим (по указанию первичных, вторичных и третичных атомов углерода). Также для определения класса/группы перебираем известные в школе кислородсодержащие соединения и делаем вывод, что под получившуюся молекулярную формулу подходят либо нитросоединение либо аминокислота. Но так как вещество реагирует с железом и хлороводородом, то узнаём реакцию Зинина, по которой нитрогруппа переходит в аминогруппу с последующей реакцией с кислотой и с образованием органической соли, которая и является веществом Б немолекулярного строения. Вариант с аминокислотой исключаем, так как для реакции аминокислоты с HCl железо не нужно.
2) следовательно, структурная формула: 
ЕГЭ по химии 2022. Задание 34. Вариант 17
Вещество А содержит 65,06% углерода, 6,02% водорода, 28,92% кислорода по массе. Известно, что вещество А окисляется до бензойной кислоты. Также известно, что вещество А при взаимодействии с бромоводородом даёт бромопроизводное Б. При воздействии на это бромопроизводное Б спиртового раствора щёлочи происходит дегидрогалогенирование и образуется соль ненасыщенной кислоты.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции окисления вещества А перманганатом калия в присутствии серной кислоты (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
1. Общая формула вещества А – CxHyOz
x : y : z = 65,06/12 : 6,02/1 : 28,92/16 = 5,422 : 6,02 : 1,808 = 3 : 3,33 : 1 = 9 : 10 : 3. Следовательно, молекулярная формула С9Н10О3.
2. Соединение С9Н10О3 окисляется до бензойной кислоты, значит его основу составляет бензолное кольцо. Отсюда следует, что заместитель имеет три атома углерода. Так как в конце всех превращений (описанных в задаче) образуется соль ненасыщенной кислоты, то вещество А содержит карбоксильную группу. Из трёх атомов кислорода в веществе А два входят в состав карбоксила, а третий принадлежит спиртовому гидроксилу, так как вещество А при взаимодействии с бромоводородом образует бромпроизводное Б, что невозможно в случае наличия фенольного гидроксила. При взаимодействии на это бромпроизводное спиртового раствора щёлочи происходит дегидрогалогенирование и образуется соль ненасыщенной карбоновой кислоты, следовательно, спиртовой гидроксил находится в β-положении по отношению к карбоксильной группе, так как именно β-гидроксикислоты при нагревании отщепляют воду и образуют ненасыщенные соединения.
Структурная формула:
3. Уравнение реакции:
ЕГЭ по химии 2022. Задание 34. Вариант 18
При сгорании органического вещества Н массой 7 г получено 8,96 л (н.у.) углекислого газа и 5,4 г воды. Известно, что вещество Н подвергается полному гидрированию при нагревании, повышенном давлении и в присутствии катализатора, в результате чего образуется предельный одноатомный первичный спирт В. Про исходное вещество Н также известно, что один из его концевых атомов углерода в молекуле находится в состоянии sp3-гибридизации.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества Н;
2) составьте структурную формулу вещества Н, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции полного гидрирования вещества Н при нагревании, повышенном давлении и в присутствии катализатора (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
1. Исходное органическое вещество Н точно содержит в своём составе атомы элементов углерод, водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Но так как в условии задачи сказано, что при гидрировании вещества Н (а это реакция с водородом) образуется спирт (в котором есть атомы кислорода), то делаем вывод, что исходное вещество Н точно содержит атомы кислорода. Разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, n = V/Vm
m = n ∙ M,
n (CO2) = 8,96 л / 22,4 л/моль = 0,4 моль
n (С) = n (СО2) = 0,4 моль
m (C) = 0,4 моль ∙ 12 г/моль = 4,8 г
М(Н2О) = 18 г/моль
n (H2O) = 54 г / 18 г/моль = 0,3 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,3 моль = 0,6 моль
m (H) = 0,6 моль ∙ 1 г/моль = 0,6 г
m (C) + m (H) = 4,8 г + 0,6 г = 5,4 г
m (O) = 7 г – 5,4 г = 1,6 г
n (O) = 1,6 г / 16 г/моль = 0,1 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 0,4 : 0,6 : 0,1 = 4 : 6 : 1
Следовательно молекулярная формула вещества: C4H6O.
- Как правило, спирты образуются при гидрировании либо альдегидов, либо кетонов. Но первичные спирты образуются из альдегидов, поэтому делаем вывод, что СНО-группа находится на конце. Составляя структурную формулу, замечаем, что не хватает атомов водорода, чтобы получить насыщенный альдегид. Поэтому понимаем, что альдегид ненасыщенный, т.е. содержит двойную связь (именно двойная связь подходит по числу атомов водорода в молекуле). Но так как сказано, что один из концевых атомов углерода в молекуле находится в состоянии sp3-гибридизации, делаем вывод, что двойная связь НЕ может быть на конце (так как атом углерода при двойной связи находится в состоянии sp2-гибридизации). Отсюда получаем, что кратная (двойная) связь отходит от второго атома углерода (между вторым и третьим).
Структурная формула:
3. Уравнение реакции:
ЕГЭ по химии 2022. Задание 34. Вариант 19
Вещество А содержит 48% углерода, 4% водорода и 48% кислорода по массе. Известно, что вещество А относится к гетероциклическим соединениям и получается дегидратацией при нагревании вещества Б, которое не содержит третичных и четвертичных атомов углерода.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А путём дегидратации вещества Б при нагревании (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
- Общая формула вещества А – CxHyOz
x : y : z = 48/12 : 4/1 : 48/16 = 4 : 4 : 3. Следовательно, молекулярная формула С4Н4О3.
- Соединение С4Н4О3 является гетероциклическим, а значит в состав цикла входят не только атому углерода, но и атомы кислорода. Учитывая, что это вещество образуется путём дегидратации, то можно предположить, что вещество А получается из карбоновой кислоты, так как при дегидратации спиртов образуются алкены, а альдегиды и простейшие эфиры не подвергаются дегидратации . Но так как образуется цикл, то в веществе Б должно быть две карбоксильные группы. И так как по условию задачи сказано, что вещество Б не содержит третичные и четвертичные атомы углерода, то значит его цепочка прямая и неразветвлённая, а значит карбоксильные группы расположены по концам. Как следствие, будет образовываться пятичленный цикл вещества А.
Структурная формула вещества А:
- 3. Уравнение реакции:
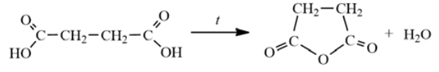
ЕГЭ по химии 2022. Задание 34. Вариант 20
Неизвестное ациклическое органическое вещество содержит 73,17% углерода, 7,32% водорода и 19,51% кислорода по массе. Это вещество можно получить в реакции избытка спиртового раствора щёлочи с дихлорпроизводным, содержащим такое же число атомов углерода в молекуле как и неизвестное органическое вещество, причём атомы хлора располагаются по разным концам молекулы.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу неизвестного органического вещества;
2) составьте структурную формулу неизвестного органического вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения неизвестного органического вещества путём взаимодействия дихлорпроизводного с избытком спиртового раствора щёлочи (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
- Общая формула вещества А – CxHyOz
x : y : z = 73,17/12 : 7,32/1 : 19,51/16 = 6,098 : 7,32 : 1,219 = 5 : 6 : 1. Следовательно, молекулярная формула С5Н6О.
- Анализируя условие задачи, можно предположить, что неизвестное органическое вещество будет либо спиртом, либо альдегидом, либо кетоном, либо карбоновой кислотой, либо эфиром. Но так как сказано, что вещество является ациклическим и получается из дихлопроизводного, в котором атомы хлора располагаются по противоположным концам молекулы, то значит при щелочном гидролизе отщепляются две молекулы хлороводорода и по концам образуются двойные связи, и, значит, кислород находится по центру у третьего атома углерода, а значит это ненасыщенный кетон.
Структурная формула неизвестного вещества:

ЕГЭ по химии 2022. Задание 34. Вариант 21
Устойчивое органическое соединение количеством 0,25 моль окислили водным раствором перманганата натрия. В результате образовались только карбонат натрия массой 8,798 г, гидрокарбонат натрия массой 14,028 г, оксид марганца (IV) массой 28,971 г и вода.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу неизвестного органического вещества;
2) составьте структурную формулу неизвестного органического вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции описанное в условии задачи (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
Видео-объяснение смотрите на Ютуб по ссылке или ниже
ЕГЭ по химии 2022. Задание 34. Вариант 22
Вещество А содержит 72% углерода, 6,67% водорода и 21,33% кислорода по массе. Известно, что вещество А содержит два заместителя, которые максимально удалены друг от друга. Также известно, что вещество А получается при нагревании ацетилхлорида (хлорангидрид уксусной кислоты) с веществом Б, которое не вступает в реакции этерификации.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А путём взаимодействия ацетилхлорида с веществом Б при нагревании (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть
1. Общая формула вещества А – CxHyOz
x : y : z = 72/12 : 6,67/1 : 21,33/16 = 6 : 6,67 : 1,333 = 4,5 : 5 : 1 = 9 : 10 : 2. Следовательно, молекулярная формула С9Н10О2.
- Соединение С9Н10О2 является ароматическим, так как содержит небольшое число атомов водорода. Также по условию известно, что имеется два заместителя, которые максимально удплены друг от друга, а значит, что один из заместителей находится в пара-положении. Учитывая, что вещество А образуется путём взаимодействия с ацетилхлоридом, то можно предположить, что в первом заместителе содержится два атома углерода, а во втором – один. Учитывая, что исходное вещество Б не вступает в реакции этерефикации, но содержит один атом кислорода (так как один из атомов кислорода находится в ацетилхлориде), то оно относится к классу фенолов, в частности это пара-крезол. Отсюда получаем структурную формулу вещества А:
- Уравнение реакции:
ЕГЭ по химии 2022. Задание 34. Вариант 23
Неизвестное органическое вещество содержит 17,98% углерода, 2,25% водорода и 79,77% хлора по массе. Известно, что в этом веществе все атомы хлора находятся у одного атома углерода и это вещество подвергается щелочному гидролизу. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение щелочного гидролиза вещества в присутствии избытка гидроксида калия (используйте структурные формулы органических веществ).
Развернуть/свернуть
Найдем соотношение количества вещества углерода, водорода и хлора.
Примем массу соединения за 100 грамм, тогда количество вещества элементов следующее:
n(С) = 17,98/12 = 1,5
n(Сl) = 79,77/35,5 = 2,25
n(H) = 2,25/1 = 2,25
Соотношение углерода к хлору и водороду 1,5 : 2,25 : 2,25 = 1 : 1,5 : 1,5 = 2 : 3 : 3
Молекулярная формула вещества C2H3Cl3
Структурная формула
Уравнение щелочного гидролиза в избытке гидроксида калия:
CH3-CCl3 + 4KOH = CH3COOK + 3KCl + 2H2O.
ЕГЭ по химии 2022. Задание 34. Вариант 24
При сгорании 40,5 г неизвестного органического вещества получили 40,32 л углекислого газа (н.у.) и 40,5 г воды. Из навески этого вещества массой 20,25 г вся сера была переведена в сульфат-ион, который дал осадок BaSO4 массой 52,425 г. Неизвестное органическое вещесто относится к классу тиоэфиров, которые по строению схожи с простыми эфирами, только вместо атомов кислорода содержат атомы серы. Известно, что это вещество имеет симметричное строение и может быть получено по реакции моногалогеналкана с сульфидом натрия при нагревании. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение получения этого органического вещества из моногалогеналкана и сульфида натрия (используйте структурные формулы органических веществ).
Развернуть/свернуть
Исходное органическое вещество точно содержит в своём составе углерод, водород и серу, так как при сгорании этого вещества образуются углекислый газ и вода, и серу выделяют через осадок сульфида бария. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода, водорода и серы, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода,водорода и серы и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, m = n ∙ M, n = V/Vm.
n (CO2) = 40,32 л/22,4 л/моль = 1,8 моль
n (С) = n (СО2) = 1,8 моль
m (C) = 1,8 моль ∙ 12 г/моль = 21,6 г
n (H2O) = 40,5 г / 18 г/моль = 2,25 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 2,25 моль = 4,5 моль
m (H) = 4,5 моль ∙ 1 г/моль = 4,5 г
Надо заметить, что при сжигании, масса вещества была 40,5 г, а при выделении серы – 20,25 г. Поэтому надо привести эти массы к одному значению. Эти массы отличаются в 2 раза, значит при из 40,5 г вещества можно выделить в 2 раза больше осадка сульфата бария: 2 ∙ 52,425 = 104,85 г.
n (BaSO4) = 104,85 г/233 г/моль = 0,45 моль
n (S) = n (BsSО4) = 0,45 моль
m (S) = 0,45 моль ∙ 32 г/моль = 14,4 г
m (C) + m (H) + m (S) = 21,6 г + 4,5 г + 14,4 г = 40,5 г, что равно массе исходного вещества, а значит там НЕТ кислорода.
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (S) = 1,8 : 4,5 : 0,45 = 4 : 10 : 1
Следовательно молекулярная формула вещества: C4H10S.
Так как вещество имеет симметричное строение, то структурная формула:
CH3 – CH2 – S – CH2 – CH3
Уравнение получения по реакции моногалогеналкана с сульфидом натрия при нагревании:
2CH3 – CH2 – Cl + Na2S → CH3 – CH2 – S – CH2 – CH3 + 2NaCl
ЕГЭ по химии 2022. Задание 34. Вариант 25
К смеси газообразного углеводорода с аммиаком общим объёмом 300 л прибавили избыток кислорода и смесь подожгли. После полного сгорания объём смеси стал равен 1250 л, после конденсации паров воды уменьшился до 550 л, а после обработки щёлочью уменьшился до 250 л, из которых 100 л приходится на азот. Объёмы газов измерены в одинаковых условиях. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение нитрования этого вещества по Коновалову (используйте структурные формулы органических веществ).
Развернуть/свернуть
Запишем уравнения полного сгорания углеводорода и аммиака:
2CxHy + (2x + 0,5y)O2 = 2xCO2 + yH2O (уравнение 1)
4NH3 + 3O2 = 2N2 + 6H2O (уравнение 2)
Для вывода формулы, надо знать количество углерода, которое перешло из углеводорода в углекислый газ и количество водорода, перешедшего в воду по уравнению 1.
Вода при условиях опыта – газ. Поэтому по данным условия находим объём газообразной воды с учётом того, что вода выделяется в обоих уравнениях:
Vобщ (H2O) = 1250 л – 550 л = 700 л
Так как нам по условию задачи известен объём азота, то по уравнению 2 мы можем найти воду, которая образовалась в этом уравнении и потом найти объём газообразной воды, образовавшейся по уравнению 1.
V2 (H2O) = 3V (N2) = 3 ∙ 100 л = 300 л (по уравнению 2)
V1 (H2O) = Vобщ (H2O) – V2 (H2O) = 700 л – 300 л = 400 л
Находим химическое количество водорода в воде, образовавшейся по уравнению 1:
n1 (H2O) 400 л/22,4 л/моль = 17,86 моль
n (H) = 2n1 (H2O) = 2 ∙ 17,86 моль = 35,72 моль
Теперь найдём химическое количество углерода через углекислый газ, который поглотился щёлочью:
CO2 + NaOH = NaHCO3 или CO2 + 2NaOH = Na2CO3 + H2O
Анализируя уравнения, делаем вывод, что объём смеси уменьшился за счёт поглощённого углекислого газа, значит V (CO2) = 550 л – 250 л = 300 л
n (CO2) = 300 л/22,4 л/моль = 13,39 моль
n (C) = n (CO2) = 13,39 моль
Теперь выводим формулу углеводорода. Для этого необходимо сделать перерасчёт на 1 моль вещества. Значит, необходимо узнать, сколько углеводорода было в смеси.
V (NH3) = 2V (N2) = 200 л (по уравнению 2)
V (CxHy) = V (исходной смеси) – V (NH3) = 300 л -200 л = 100 л
n (CxHy) = 100 л/22,4 л/моль = 4,46 моль
4,46 моль углеводорода содержит 13,39 моль углерода и 35,72 моль водорода
1 моль углеводорода содержит x моль углерода и y моль водорода.
По пропорции:
x = 3
y = 8
Следовательно, молекулярная формула углеводорода C3H8
Структурная формула CH3 – CH2 – CH3
Уравнение нитрования по Коновалову:
ЕГЭ по химии 2022. Задание 34. Вариант 26
При сгорании 69 г органического вещества получили 89,6 л углекислого газа (н.у.) и 45 г воды. Это вещество можно получить мягким окислением ароматического углеводорода водным раствором перманганата калия на холоду. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение получения этого вещества окислением ароматического углеводорода водным раствором перманганата калия (используйте структурные формулы органических веществ).
Развернуть/свернуть
Исходное органическое вещество точно содержит в своём составе углерод и водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, m = n ∙ M, n = V/Vm.
n (CO2) = 89,6 л/22,4 л/моль = 4 моль
n (С) = n (СО2) = 4 моль
m (C) = 4 моль ∙ 12 г/моль = 48 г
n (H2O) = 45 г / 18 г/моль = 2,5 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 2,5 моль = 5 моль
m (H) = 5 моль ∙ 1 г/моль = 5 г
m (C) + m (H) = 48 г + 5 г = 53 г, что НЕ равно массе исходного вещества, а значит там есть кислород.
m (O) = m (в-ва) – m (C+H) = 69 г – 53 г = 16 г
n (O) = 16 г / 16 г/моль = 1 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 4 : 5 : 1
Следовательно простейшая формула вещества: C4H5O.
Но так как в условии сказано, что исходное вещество получается мягким окислением ароматического УВ водным раствором перманганата калия, то значит исходное вещество должно содержать бензольное кольцо (так как при мягком окислении не наблюдается разрыва цикла). Следовательно, простейшую формулу необходимо удвоить.
Молекулярная формула C8H10O2.
При мягком окислении кратных связей между атомами углерода образуются многоатомные спирты.
Структурная формула
ЕГЭ по химии 2022. Задание 34. Вариант 27
Неизвестное органическое вещество содержит 60% углерода, 5% водорода и 35% азота по массе. Относительная плотность паров этого вещества по водороду равна 40. Это вещество можно отнести к производным циановодородной кислоты и алкана. А получить его можно нагреванием дибромалкана с цианидом калия. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение получения исходного органического соединения нагреванием дибромалкана с цианидом калия (используйте структурные формулы органических веществ).
Развернуть/свернуть
Найдем соотношение количества вещества углерода, водорода и азота.
Примем массу соединения за 100 грамм, тогда количество вещества элементов следующее:
n(С) = 60 г/12 г/моль = 5 моль
n(N) = 35 г/14 г/моль = 2,5 моль
n(H) = 5 г/1 г/моль = 5 моль
Соотношение углерода к азоту и водороду 5 : 2,5 : 5 = 2 : 1 : 2
Простейшая формула C2H2N, М (C2H2N) = 40 г/моль
А по относительной плотности по водороду находим, что М (исходного вещества) = 2 г/моль ∙ 40 = 80 г/моль
Значит, простейшую формулу необходимо удвоить.
Молекулярная формула вещества C4H4N2
Так как исходное вещество является производным циановодородной кислоты, то там должна сохраняться структура кислотного остатка С≡N
Структурная формула N≡C – CH2 – CH2 – C≡N
Уравнение получения:
Br – CH2 – CH2 – Br + 2KCN = N≡C – CH2 – CH2 – C≡N + 2KBr.
ЕГЭ по химии 2022. Задание 34. Вариант 28
При сгорании 33,2 г органического вещества получили 35,84 л углекислого газа (н.у.) и 10,8 г воды. При нагревании данное вещество подвергается внутримолекулярной дегидратации. Также известно, что исходное вещество содержит две одинаковые функциональные группы и находятся они у соседних атомов углерода. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение гидролиза вещества в присутствии бромоводородной кислоты (используйте структурные формулы органических веществ).
Развернуть/свернуть
Исходное органическое вещество точно содержит в своём составе углерод и водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, m = n ∙ M, n = V/Vm.
n (CO2) = 35,84 л/22,4 л/моль = 1,6 моль
n (С) = n (СО2) = 1,6 моль
m (C) = 1,6 моль ∙ 12 г/моль = 19,2 г
n (H2O) = 10,8 г / 18 г/моль = 0,6 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,6 моль = 1,2 моль
m (H) = 1,2 моль ∙ 1 г/моль = 1,2 г
m (C) + m (H) = 19,2 г + 1,2 г = 20,4 г, что НЕ равно массе исходного вещества, а значит там есть кислород.
m (O) = m (в-ва) – m (C+H) = 33,2 г – 20,4 г = 12,8 г
n (O) = 12,8 г / 16 г/моль = 0,8 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 1,6 : 1,2 : 0,8 = 4 : 3 : 2
Следовательно простейшая формула вещества: C4H3O2.
Попытки составить структурную формулу, удовлетворяющие условию задания с полученной простейшей формулой, не увенчаются успехом. Либо вещества будут неустойчивыми. Поэтому надо удвоить простейшую формулу.
Молекулярная формула C8H6O2.
Структурная формула
ЕГЭ по химии 2022. Задание 34. Вариант 29
В состав органического вещество входит 6,78% водорода, 20,34% кислорода и 11,86% азота по массе. Это вещество подвергается гидролизу с образованием двух веществ, одно из которых является производным первого, в котором один атом водорода замещён фенильной группой. Известно, что одно из веществ, образующихся при гидролизе имеет очень важную биологическую функцию и является незаменимым для организма человека. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение гидролиза вещества в присутствии кислоты (используйте структурные формулы органических веществ).
Развернуть/свернуть
Найдём массовую долю углерода, так как в состав всех органических соединений входит углерод.
w (C) = 100% — 6,78% — 20,34% — 11,86% = 61,02%
Найдем соотношение количества вещества углерода, водорода, кислорода и азота.
Примем массу соединения за 100 грамм, тогда количество вещества элементов следующее:
n (С) = 61,02 г/12 г/моль = 5,085 моль
n (H) = 6,78 г/1 г/моль = 6,78 моль
n (O) = 20,34 г/16 г/моль = 1,271 моль
n (N) = 11,86 г/14 г/моль = 0,847 моль
Соотношение углерода к водороду, кислороду и азоту 5,085 : 6,78 : 1,271 : 0,847 = 6 : 8 : 1,5 : 1= 12 : 16 : 3 : 2
Молекулярная формула вещества C12H16O3N2
Анализируя рописание вещества, делаем вывод, что исходное вещество – дипептид аланина и незаменимой аминокислоты фенилаланина, которое и является производным аланина.
Структурная формула
Уравнение кислотного гидролиза:
ЕГЭ по химии 2022. Задание 34. Вариант 30
В состав вещества входят атомы углерода, водорода и азота, причём массовая доля атомов углерода в нём 53,33%. Масса азота, полученного из 0,546 г вещества, равна 0,170 г. Относительная плотность этого вещества по озону равна 0,9375. Известно, что данное вещество реагирует раствором нитрита калия в присутствиии соляной кислоты с образованием органического вещества, относящегося к другому классу, и выделением газа, входящего в состав атмосферы. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение реакции этого вещества с раствором нитрита калия в присутствии соляной кислоты (используйте структурные формулы органических веществ).
Развернуть/свернуть
M (CxHyNz) = M (O3) ∙ DO3 (CxHyNz) = 48 г/моль ∙ 09375 = 45 г/моль
n (CxHyNz) = 0546 г/45 г/моль = 0,012 моль
n (N2) = 0,170 г/28 г/моль = 0,006 моль
n (N) = 2 ∙ n (N2) = 2 ∙ 0,006 моль = 0,012 моль
0,012 моль вещества содержат 0,012 моль N, следовательно 1 моль вещества содержит 1 моль N, т.е. в формуле 1 атом азота.
m (C) = Mr (CxHyNz) ∙ w (CxHyNz) = 45 ∙ 0,5333 = 24 (г)
n (С) = 24 г/12 г/моль = 2 моль.
Следовательно 1 моль вещества содержит 2 моль углерода, т.е. в формуле 2 атома углерода.
N (H) = (M (CxHyNz) – M (C2N)) /1 г/моль = (45 г/моль – 38 г/моль) /1 г/моль = 7
Следовательно, молекулярная формула C2H7N
Азотсодержащим веществом может быть либо амин либо нитросоединения. Предполагаем, что исходное вещество амин. Так как вещество реагирует с азотистой кислотой (нитрит калия + соляная кислота), то оно относится к первичным аминам, потому что вторичные амины в эту реакцию не вступают, равно как и нитросоединения.
Структурная формула CH3 – CH2 – NH2
Уравнение реакции:
CH3 – CH2 – NH2 + KNO2 + HCl → CH3 – CH2 – OH + N2 + KCl + H2O
ЕГЭ по химии 2022. Задание 34. Вариант 31
Органическое ещество А при нагревании реагирует с двухатомным спиртом Б с образованием воды и органического вещества С, которое является гетероциклическим и содержит радикал этил. В состав вещества А входит 62,07% углерода, 10,34% водорода и 27,59% кислорода, функциональная группа находится у первого атома углерода. А при сжигании двухатомного спирта Б массой 62 г образуется 54 г воды и 88 г углекислого газа.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества С;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение получения вещества С из веществ А и Б (используйте структурные формулы органических веществ).
Развернуть/свернуть
Найдём формулу вещества А.
Примем массу соединения А за 100 грамм, тогда количество вещества элементов следующее:
n (С) = 62,07 г/12 г/моль = 5,173 моль
n (H) = 10,34 г/1 г/моль = 10,34 моль
n (O) = 27,59 г/16 г/моль = 1,724 моль
Соотношение углерода к водороду, кислороду и азоту 5,173 : 10,34 : 1,724 = 3 : 6 : 1
Молекулярная формула вещества А C3H6O – это пропаналь.
Найдём формулу вещества Б.
n (CO2) = 88 г/44 г/моль = 2 моль
n (С) = n (СО2) = 2 моль
m (C) = 2 моль ∙ 12 г/моль = 24 г
n (H2O) = 54 г / 18 г/моль = 3 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 3 моль = 6 моль
m (H) = 6 моль ∙ 1 г/моль = 6 г
m (O) = 62 г – 24 г – 6 г = 32 г
n (O) = 32 г / 16 г/моль = 2 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 2 : 6 : 2
Следовательно молекулярная формула вещества Б: C2H6O2 – это этиленгликоль.
Чтобы вывести структурную формулу вещества С, лучше сначало написать уравнение взаимодействия пропаналя с этиленгликолем, с учётом образования воды и того, что вещество С является гетероциклическим (т.е. в состав цикла входят НЕ только атомы углерода) и содержит радикал этил:
В случае, если вы нашли ошибку или опечатку, просьба сообщать об этом автору проекта в контакте https://vk.com/id30891697 или на электронную почту yoursystemeducation@gmail.com
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет (реальные, пробные и тренировочные задания) вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку