Задания
Версия для печати и копирования в MS Word
Установите соответствие между веществом и его воздействием на окружающую среду: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) углекислый газ
Б) сернистый газ
В) полиэтилен
ВОЗДЕЙСТВИЕ НА ОКРУЖАЮЩУЮ СРЕДУ
1) загрязнение мирового океана
2) образование «кислотных дождей»
3) высыхание водоёмов
4) усиление парникового эффекта
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Спрятать решение
Решение.
A. «Парниковый эффект» атмосферы Земли создаётся в результате накопления в ней углекислого газа (4);
Б. Сернистый газ — кислотный оксид, его накопление в воздухе и облаках приводит к понижению pH и, как следствие, кислотным дождям. (2);
В. Полиэтилен накапливается в океане, убивает морских животных и может попасть в рацион человека (1).
Ответ: 421.
Предмет: Химия,
автор: kolesnikovaliy
Ответы
Автор ответа: SilberStein
0
источники появления: заводы, фабрики, выхлопные газы машин) so2 накапливается в воздухе и выделяется в виде осадков(кислотный дождь), что вредно для живого(появление ожогов на коже, облысение и т п)
Автор ответа: nesterenkoartem
0
SO2 выделяют фабрики заводы и прочее загрязняет воздух, попадает в малых дозах к нам в организм
Автор ответа: nesterenkoartem
0
еще пагубно влияет на растения и всякое такое
Предыдущий вопрос
Следующий вопрос
Интересные вопросы
Предмет: Математика,
автор: Аноним
ДАМ 15 БАЛЛОВ ПОМОГИТЕ С ИНФОРМАТИКОЙ СРОЧНО !!! И ПОБЛАГОДАРЮ ЗА ХОРОШИЙ ОТВЕТ!!!
5 лет назад
Предмет: Алгебра,
автор: Агния666
Помогите решить уравнение!!!
2•(x+2)-3•(y-1)=6
Очень надо!!!!!((((
5 лет назад
Предмет: Биология,
автор: PulDar
Наличие в цветке сросшихся лепестков характерно для растений из семейства:
Розоцветные
Паслёновые
Злаки
Крестоцветные
5 лет назад
Предмет: Алгебра,
автор: Аноним
Докажите,что выражение -у^2+2у-5 при любых значениях у принимает отрицательные значения.
8 лет назад
Предмет: Геометрия,
автор: Woronok
Через концы отрезка длиной 6 проходит каждая из двух окружностей, имеющих радиусы 4 и 5. Чему равно расстояние между центрами этих окружностей?
8 лет назад

SO2 является компонентом атмосферы, вызывающим наибольшую озабоченность, и используется в качестве индикатора для большей группы газообразных оксидов серы (SOx). Другие газообразные оксиды серы типа SOx (например, SO3) встречаются в атмосфере в концентрациях значительно ниже, чем SO2.
Как правило, можно ожидать, что меры контроля, снижающие содержание SO2, снизят воздействие всех газообразных SOx на людей. Это может иметь важные благоприятные эффекты, заключающиеся в сокращении образования твердых сернистых загрязнителей, таких как мелкодисперсные сульфатные частицы.
Выбросы, которые приводят к высоким концентрациям SO2, как правило, также приводят к образованию других SOx. Крупнейшими источниками выбросов SO2 являются сжигание ископаемого топлива на электростанциях и других промышленных объектах.
Мы осуществляем измерения диоксида серы в воздухе по самым надежным методикам.
Как диоксид серы попадает в воздух?
Самым крупным источником SO2 в атмосфере является сжигание ископаемого топлива на электростанциях и других промышленных объектах.
К более мелким источникам выбросов SO2 относятся: промышленные процессы, такие как добыча металла из руды; природные источники, такие как вулканы; а также локомотивы, корабли и другие транспортные средства и тяжелое оборудование, сжигающие топливо с высоким содержанием серы.
Каково влияние диоксида серы?
SO2 может влиять как на здоровье, так и на окружающую среду. При контакте с кислородом и затем с водой данный оксид образует серную кислоту, измерения которой мы осуществляем.
Каково влияние диоксида серы на здоровье?
Кратковременное воздействие SO2 может нанести вред дыхательной системе человека и затруднить дыхание. Люди, страдающие астмой, особенно дети, чувствительны к этим последствиям SO2.
Выбросы SO2, которые приводят к высоким концентрациям SO2 в воздухе, как правило, также приводят к образованию других оксидов серы (SOx). SOx может вступать в реакцию с другими соединениями в атмосфере с образованием мелких частиц. Эти частицы способствуют загрязнению атмосферы твердыми частицами (ТЧ). Мелкие частицы могут проникать глубоко в легкие и в достаточном количестве может способствовать проблемам со здоровьем.
Каково воздействие оксидов серы на природу?
При высоких концентрациях газообразный SOx может нанести вред деревьям и растениям, повреждая листву и снижая рост.
SO2 и другие оксиды серы могут способствовать выпадению кислотных дождей, которые могут нанести вред чувствительным экосистемам.
SO2 и другие оксиды серы могут вступать в реакцию с другими соединениями в атмосфере, образуя мелкие частицы, которые снижают видимость.
Осаждение частиц также может окрасить и повредить камень и другие материалы, в том числе культурно значимые объекты, такие как статуи и памятники.
Как предотвратить загрязнение воздуха диоксидом серы?
Нормативы выбросов загрязняющих веществ, назначаемые предприятиям способствуют сокращению выбросов SO2 и загрязняющих веществ, образующих оксиды серы, и помогут им соответствовать национальным стандартам качества воздуха.
Если в населенных пунктах качество воздуха не соответствует стандартам по вине предприятия, то далее последуют штрафные санкции.
Цель урока: изучить соединения
серы, их вредное воздействие на окружающую
среду, используя результаты
научно-исследовательской деятельности учащихся
и местный экологический материал.
Задачи урока:
- На примере оксидов серы конкретизировать общее
свойства кислотных оксидов. - Закрепить знание учащихся по
окислительно-восстановительным процессам. - Показать общность химических свойств кислот.
- Рассмотреть такие понятия, как кислотные дожди,
фотохимический туман (смог), разработать меры по
борьбе с источниками загрязнения атмосферы. - Рассмотреть отрицательное влияние соединений
серы на природу, привлечь внимание к актуальным
экологическим проблемам своей местности. - Развивать познавательный интерес
учащихся. - Развивать практические умения и навыки, умение
анализировать, сравнивать, делать выводы.
Знания, умения, навыки и качества, которые
приобретут и закрепят ученики в ходе урока
В ходе урока учащиеся познакомятся с
нестандартными формами ведения урока.
Рассмотрят на новом качественном уровне
(экологическом) о свойствах соединений серы и их
влияния на окружающую среду. Закрепят знания по
химическим свойствам кислотных оксидов,
сернистой и серной кислот.
Оборудование: Компьютер,
мультимедиа-проектор, колонки, лабораторное
оборудование, химические реактивы.
ХОД УРОКА
I. Организационный момент
II. Актуализация знаний
1) Фронтальный опрос: положение серы в
Периодической системе, ее физические и
химические свойства.
2) Химическая разминка(Слайд 2).
а) назовите возможные степени окисления серы,
б) в каких случаях сера будет проявлять
окислительные свойства, и в каких –
восстановительные?
в) перечислите физические свойства серы,
г) что такое «аллотропия», какие вы знаете
аллотропные модификации серы?
д) в каком виде сера встречается в природе?
е) какова роль серы в природе?
III. Изучение нового материала
Учитель предлагает вспомнить, что ребятам
известно о сероводороде. Ученики предлагают свои
варианты ответов.
1) Постановка проблемного вопроса (Слайд
3).
– Сероводород выделяется в результате
вулканической деятельности, при гниении белков
животных и растений, при работе химической,
текстильной, кожевенной промышленности, но,
не смотря на это, он не накапливается в
больших количествах в воздухе. Почему?
2) Ученики записывают реакцию
взаимодействия сероводорода с кислородом:
2H2S + O2 = 2S + 2H2O
Составляют окислительно-восстановительную
схему реакции.
Формулируют вывод: сероводород взаимодействует
с кислородом воздуха, поэтому в больших
количествах не накапливается в атмосфере. (Слайд
4)
3) Учитель рассказывает о солях
сероводородной кислоты. (Слайд 5)
Учитель: При горении сера образует
оксид серы ЅО2. Сейчас мы посмотрим
видеоролик «Горение серы» (http://experiment.edu.ru)
4) Итак сера образует два оксида, оба они
кислотные. Сравним эти оксиды. Заполним таблицу
(слайд 6)
Ученики: извлекают новые знания из учебника стр.
101
Учитель при заполнении таблицы обращает
внимание ребят, на знак обратимости в уравнении,
который указывает на то, что сернистая кислота
является слабой, неустойчивой. Она образует два
ряда солей: кислых и средних. (Слайд 7, 
Учитель: Оксид серы ЅО2 растворяется
в воде, которая всегда содержится в атмосфере.
Так получается сернистая кислота, которая
выпадает на Землю в виде «кислотных дождей».
Кислотные дожди – серьезная проблема для всей
биосферы Земли. Они убивают рыбу и других
животных, повреждают листья зеленых растений,
которые вырабатывают для нас кислород, разрушают
исторические памятники архитектуры. Решением
этой проблемы занимается специальная наука –
экология – это наука о природе, о ее сохранении.
(Слайды 9-15)
В настоящее время также сильно беспокоят природу
и человечество фотохимические туманы – смог –
влажностью 70%, содержащий чрезмерно токсичные
примеси ЅО2; ЅО3; NО2 и др.
Смог в основном наблюдается в осенне-зимний
период (с октября по февраль). Главную
опасность представляет содержащийся в нем
сернистый газ, в концентрации – 5-10 мг/ м и более.
Фотохимический туман сопровождается неприятным
запахом, резко снижает видимость, у людей
воспаляются глаза, слизистые оболочки носа
и горла, возникает удушье, обостряются
легочные заболевания, бронхиальная астма.
Фотохимический туман повреждает и растения.
Сначала на листьях появляется водное набухание,
нижняя поверхность листьев приобретает
серебристый или бронзовый оттенок, а верхняя
становится пятнистой с белым налетом, затем
наступает их быстрое увядание.
Фотохимический туман вызывает коррозию
металлов, растрескивание красок, резиновых и
синтетических изделий, портит одежду, нарушает
работу транспорта.
Наибольшее количества ЅО2 выбрасывают
тепловые электростанции и предприятия цветной
металлургии, серно-кислого производства,
нефтеперерабатывающая промышленность.
– Сегодня у нас на уроке ученик 11 класса
Матюшин Сергей. Он занимался
научно-исследовательской работой «Изучение
механизма образования и влияния кислотных
дождей на окружающую среду». Сергей поставил
эксперимент имитирующий образование кислотных
дождей, исследовал влияния кислотных дождей
на растения, вычислил массу сернистой кислоты,
образующейся в результате работы котельной,
составил карту основных источников кислотных
дождей на территории п. Новозавидовский.
Сейчас он сделает небольшое выступление по этой
теме.
5) Выступление Матюшина С. (ученик 11
класса рассказывает о своей
исследовательской работе и показывает свою
презентацию – 5 мин.)
6) Фронтальная беседа.
– О каких кислородосодержащих соединениях
серы мы услышали? (ЅО2; ЅО3; H2ЅО3;
H2ЅО4)
– К каким оксидам относятся соединения ЅО2
и ЅО3? (К кислотным)
– Какие оксиды называются кислотными (+ H2О
= кислота)
– Что собой представляет ЅО2,
взаимодействует ли он с водой и что образует? (Сернистый
газ, очень ядовитый с резким удушающим запахом,
при растворении в воде образует сернистую
кислоту H2ЅО3)
ЅО2 + H2О <––> H2ЅО3
– Может ли сернистый газ окисляться, если да
то во что? (ЅО2 окисляется в летучую
жидкость – ЅО3
Записать уравнение реакции 2 ЅО2 + О2
––> 2 ЅО3 (оксид серы VІ).
– Может ли оксид серы (VІ) взаимодействовать
с H2О, если да, то что при этом получается. (H2О
+ ЅО3 ––>H2ЅО4)
Предложить схему, как из сернистого газа
можно получить серную кислоту.
ЅО2 ––> ЅО3 ––> H2ЅО4
– Что представляет собой серная кислота? (Маслянистая,
тяжелая жидкость, поглощает водяные пары.
Прекрасно растворяется в воде. При растворении
происходит выделение большое количества
теплоты.
H2ЅО4 + nH2О
––> H2ЅО4 · nH2О
– гидратH2ЅО4)
7) Правила техники безопасности,
которые нужно соблюдать при работе с серной
кислотой:
- Разбавлять в толстостенной посуде
- Всегда приливать кислоту в воду и не наоборот.
H2ЅО4 – ядовита, огнеопасна, в
концентрированном виде обугливает ткани, бумагу,
кожу.
Вывод: с H2ЅО4 – нужно
вести себя очень осторожно.
– Какими общими химическими свойствами
обладают разбавленные кислоты в том числе и
серная H2ЅО4
– взаимодействие с металлами, стоящими до
H2
– взаимодействие с основными оксидами
– взаимодействие с основаниями
– взаимодействие с солями
– Как вы думаете, есть ли у H2ЅО4 –
специфические химические свойства, присущие
только для нее? Вспомните тему Металлы, это
может вас навести на мысль.
(Да, это взаимодействие с металлами, стоящими
после H2, например с Сu. Записать уравнение
(составить уравнения электронного баланса)
Сuо + 2 H2ЅО4 ––> СuЅО4 +
ЅО2+ 2 H2О
В зависимости от активности металлов,
концентрированная серная кислота при
взаимодействии с ними образует разные продукты.
Учитель: А сейчас решим задачу: (Слайд
16)

образующейся в результате работы котельной.
В поселке Новозавидовский проживает около 10
тысяч человек. Теплом и горячей водой жителей
поселка снабжают несколько котельных, в которых
до последнего времени в качестве топлива
использовался мазут.
Котельная, которая находится на территории
Завидовского эксперементально –
механического завода в течение отопительного
сезона ежедневно сжигала около 18 т мазута.
Известно, что среднее содержание серы в топочном
мазуте составляет 2,5 %. Рассчитать массу
сернистой кислоты, которая может выпасть с
дождем в результате суточной работы только одной
котельной.
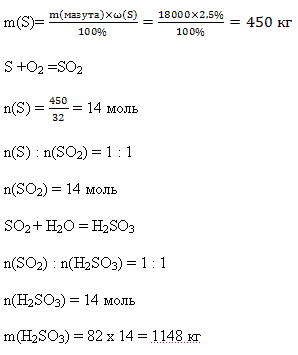
Вывод: тлько за одни сутки, в
результате работы одной котельной образуется
больше тонны сернистой кислоты. (Слайд 18)
Учитель: Итак, ребята, давайте еще раз
заострим внимание: о каких соединениях мы
сегодня говорили? (ЅО2; ЅО3; H2
ЅО3; H2 ЅО4).
– Вредны эти соединения? (Да, и очень)
Учитель: Какие меры защиты от
воздействия вы бы предложили?
1) Ставить очистители и охладители.
2) Создавать производства, работающие по
замкнутому циклу.
3) Замена углеводородного топлива на
альтернативное.
4) Посадка зеленых насаждений.
Охрана природы закреплена во многих
законодательных документах: (Слайд 19)
1. Конституция РФ (закреплено право
человека на благоприятную окружающую среду).
2. Закон РФ «Об охране окружающей среды» (19
декабря 1991г.)
3. Законодательные акты, регулирующие
использование и охрану отдельных природных
ресурсов
– Земельный кодекс (23 мая 1991 г.)
– Лесной кодекс (27 января 1997 г.)
– Водный кодекс (18 октября 1995 г.)
4. Экологические службы.
5. Гринпис.
6. Движение зеленых.
IV. Итог
Учитель: На следующем уроке мы
продолжим знакомство с соединениями серы, а
именно подробно остановимся на вопросах
получения оксидов Ѕ, промышленном способе
получения серной кислоты. А также с их
положительной ролью, т. е их применением в
народном хозяйстве (применение их солей, которые
они образуют).
V. Домашнее задание
§ 22 стр. 100-104 – (до производства H2ЅО4); упр. 3 стр. 107, упр. 5 стр. 107 (Слайд
20)
Ответка
Задайте свой вопрос и получите ответ от профессионального преподавателя. Выберите лучший ответ.
Задать вопрос
- Подготовка к ЕГЭ
-
Подготовка к ОГЭ
- Подготовка к олимпиаде
- Решение задач
Задать вопрос
-
Все вопросы
Мария
Химия
10 — 11 классы
30.10.2022 23:21
Ответы на вопрос
Записаться
Бесплатные вебинары с ответами на все вопросы у нас на канале!
Смотреть
Репетиторы в городах:
- Репетитор в Каргате
- Репетитор в Порхове
- Репетитор в Абудже
- Репетитор в Карши
- Репетитор в Правдинске
- Репетитор в Аддис-Абебе
- Репетитор в Катайске
- Репетитор в Приозерске
- Репетитор в Ак-Довураке
- Репетитор в Кедровом
- Репетитор в Пскове
Репетиторы по предметам:
- Репетитор по русскому языку
- Репетитор по английскому языку
- Репетитор по немецкому языку
- Репетитор по математике
- Репетитор по биологии
- Репетитор по физике
- Репетитор по химии
- Репетитор по французскому языку
- Репетитор по итальянскому языку
- Репетитор по китайскому языку
Чистая терефталевая кислота (ЧТФК) получается в результате окисления п-ксилола в среде уксусной кислоты в присутствии соединений кобальта и марганца в качестве катализаторов и соединений брома в качестве промоторов. Очистка ТФК от примесей осуществляется каталитическим гидрированием.
Рис. 1. Брутто-реакция синтеза ТФК
Процесс окисления сопровождается выделением тепла в количестве 326 ккал/г. моль. Окисление осуществляется в реакторе барботажного типа со встроенной колонной ректификации в верхней части аппарата при следующих условиях:
• расход п-ксилола — 16557,8 кг/ч;
• расход воздуха — 61888,3 нм3/ч;
• давление — 0,9 — 1,1 МПа;
• температура — 185 — 195°С;
• соотношение уксусная кислота: п-ксилол — 5^6 : 1 масс/масс;
• содержание кислорода в отходящем газе — 3 — 3,5% об.;
• соотношение Со: Мп в каталитической системе — 2 : 1 масс/масс;
• содержание Бг — (1,0 — 1,2) х 10-5 г/атом/ч растворителя;
• уровень оксидата — 85-90%.
Образующаяся в процессе вода за счет тепла реакции отгоняется из оксидата и выводится из верха колонной части реактора.
Выход ТФК составляет ~ 97% моль от теории [2].
Список литературы
Хатмуллина Д.Д. Значение и получение терефталевой кислоты // Технические науки: традиции и инновации: материалы II Междунар. науч. конф. (г. Челябинск, октябрь 2013 г.). Челябинск: Два комсомольца, 2013. С. 86-88.
Абдрашитов Я.М., Сабиров Р.Г., Мазитов М.Ф., Назимок В.Ф. Оптимальные условия синтеза терефталевой кислоты. АО «ПОЛИЭФ», АО НИПИМ, 2004. 69 с.
ДИОКСИД СЕРЫ И ОСНОВНЫЕ ИСТОЧНИКИ ЗАГРЯЗНЕНИЯ АТМОСФЕРЫ ДИОКСИДОМ СЕРЫ Акимов В.С.
Акимов Владислав Сергеевич — студент магистратуры, факультет компьютерных информационных технологий и автоматики, Донецкий национальный технический университет, г. Донецк, Украина
Аннотация: в статье приводятся определение диоксида серы, различные источники загрязнений атмосферы данным газом. Рассматривается концентрация в различных типах местности, а также на разных высотах. Кратко рассматривается процесс коксования. Ключевые слова: атмосфера, загрязнение, сульфид, диоксид серы, серная кислота.
Диоксид серы — бесцветный газ с очень характерным запахом. Источники загрязнения этим веществом окружающей среды, что и для взвешенных частиц, особенно сжигание угля и нефти. Вступает в каталитические или фотохимические реакции с другими загрязняющими веществами с образованием SO3, серной кислоты и сульфатов. Типичные процессы образования дисперсионных аэрозолей — измельчение угля, ветровая эрозия почвы [1].
Атмосфера. В промышленных районах концентрация диоксида серы обычно достигает 0,05-0,1 мг/м3; в сельских районах она в несколько раз меньше, а над океаном меньше в 10-100 раз. В сельской местности фоновая концентрация близка к 0,5 мкг/м3, а концентрация в городах в 50-100 раз выше. Из-за химических превращений время жизни диоксида серы в атмосфере невелико (порядка нескольких часов). В связи с этим возможность загрязнения и опасность воздействия непосредственно диоксида серы носят, как правило, локальный, а в отдельных случаях региональный характер.
Наиболее крупными источниками выбросов двуокиси серы являются тепловые электростанции, работающие на твердом и жидком топливе, а также металлургические предприятия. Большинство этих источников осуществляет выбросы из труб на высотах 100— 200 м от поверхности земли, в результате чего они значительно рассеиваются до попадания в приземный слой атмосферы.
Значительную роль в загрязнении атмосферного воздуха городов двуокисью серы играют такие источники: мелкие котельные с низкими трубами, небольшие предприятия местной промышленности, печные трубы жилых домов. Таких источников в современном городе может насчитываться до нескольких сотен.
Влияние на окружающую среду. Высокие концентрации диоксида серы вызывают серьезное повреждение растительности. Острое повреждение, вызванное диоксидом серы, отражается в появлении белесых пятен на широколистных растениях или обесцвеченных некротических полос на листьях с продольным жилкованием. Хронический эффект проявляется как обесцвечивание хлорофилла, приводящее к пожелтению листьев, появлению красной или бурой окраски, которая в нормальных условиях маскируется зеленой. Независимо от формы проявления, результатом является снижение продуктивности и замедление роста. Лишайники особенно чувствительны к SO2 и используются как биоиндикаторы при определении его избыточных количеств в воздухе. Однако диоксид серы не всегда вызывает повреждение: в сульфатдефицитных местностях дополнительные небольшие уровни SO2 могут благотворно влиять на растения, однако происходящее параллельно некоторое подкисление почвы может потребовать дополнительного известкования.
Воздействие диоксида серы в концентрациях выше предельно допустимых может приводить к существенному увеличению различных болезней дыхательных путей, воздействовать на слизистые оболочки, вызывать воспаление носоглотки, бронхиты, кашель, хрипоту и боль в горле. Особенно высокая чувствительность к диоксиду серы наблюдается у людей с хроническими нарушениями органов дыхания, с астмой.
Коксование — это метод переработки жидких и твердых горючих ископаемых путем нагревания их при температуре 900.. .1050 0С без доступа воздуха. Топливо при коксовании разлагается с образованием летучих веществ(до 25%) и твердого остатка. Основными продуктами коксохимии является кокс каменноугольный (76.78%), коксовый газ (14.15%) и различные химические продукты (5.6%), например, бензол, нафталин, антрацен, инден-кумароновое смолы, каменноугольные масла. В состав выбросов коксохимических предприятий входит большое количество экологически опасных веществ: пыль, оксид углерода, оксиды азота, диоксид серы, сероводород, цианистый водород, бензольные углеводороды, фенолы, пиридиновые основания, аммиак, нафталин и бензопирен. Некоторые сочетания этих веществ обладают эффектом суммации негативного действия. По данным расчетов проектных норм ПДВ, удельные выбросы этих веществ находятся в пределах 8.12 кг/т производимого кокса. Анализ объемов выбросов коксохимическим заводом токсичных компонентов в атмосферу выявил, что основными источниками загрязнения являются [2]:
• коксовые печи в момент загрузки угольной шихтой и выгрузки из них раскаленного кокса;
• также дымовые трубы батарей;
• газование дверей и стояков батарей;
• установки тушения кокса;
• градирни открытых циклов водоснабжения конечных газовых холодильников;
• воздушники технологического оборудования и емкостей в химических цехах;
• аспирационные системы.
При этом выбросы коксового блока составляют около 80% общего количества выбросов предприятия. В среднем коксохимический завод ОАО «АрселорМиттал Кривой Рог» выбрасывает 1300 т/год твердых веществ, 1800 т/год оксида азота, 2039,6 диоксида серы и около 3000 оксида углерода. Коксовая пыль, выбрасываемая предприятием, может также содержать соединения марганца, железа, меди, цинка, кадмия и свинца. При выплавке
высоколегированной и сложнолегированной стали в пыль, кроме оксидов железа, попадают и диоксид кремния, соединения серы, фосфора, оксиды ванадия, соединения хрома, никеля, молибдена, селена, теллура и др.
Список литературы
1. Полезная информация: Двуокись серы. [Электронный ресурс]. Режим доступа: http://moreprom.ru — MOREPROM.ru/ (дата обращения: 19.06.2017).
2. Как происходит коксование угля? [Электронный ресурс]. Режим доступа: https://ribalych.ru/ (дата обращения: 19.06.2017).
АНТИОКСИДАНТНАЯ ЭФФЕКТИВНОСТЬ РУТИНА В УСЛОВИЯХ ГОМОГЕННОЙ И ВОДНО-ЭМУЛЬСИОННОЙ КИНЕТИЧЕСКОЙ МОДЕЛЕЙ Музиева М.И.
Музиева Мадина Ильясовна — студент, кафедра аналитической химии, Сургутский государственный университет, г. Сургут
Аннотация: в статье определяется антиоксидантная эффективность рутина в условиях гомогенной и водно-эмульсионной кинетической моделей. Построены кинетические кривые, по которым определили период индукции, начальную и максимальную скорость окислительного процесса и константу скорости обрыва цепей.
Ключевые слова: антиоксидантная и антирадикальная эффективность, рутин, водно-эмульсионная и безводная среда.
Существует множество методов анализа антиоксидантной (АО) и антирадикальной (АР) эффективности флавоноидов. Одним из них является кинетический метод анализа, в основе которого находится зависимость: /(У02) = £. Данный метод осуществляется на автоматических и полуавтоматических установках. В частности, на волюмометре, где скорость окисления зависит от концентрации ингибитора, которую определяют по графику зависимости. Данный метод является перспективным, так как оценка периода индукции определяется по кинетике поглощённого кислорода. Немаловажное значение имеет возможность тестирования водорастворимых антиоксидантов. Это является преимуществом данного метода, так как многие биологически активные соединения растворимы в воде [1].
Реакция окисления в гомогенной среде проводилась при температуре 60,0±0,2°С. Окисляемый субстрат: метиллинолеат в хлорбензоле в соотношении по объёму 1:1 в присутствии инициатора 2,2-азобисизобутиронитрила (АИБН) в концентрации (2,0±0,1)-10_3 моль/л. В качестве субстрата использовался метиллинолеат, так как он обладает оптимальной окисляемостью относительно других высших жирных кислот. Проба насыщалась молекулярным кислородом. При непрерывном перемешивании, измерялся объем поглощенного кислорода с периодичностью в 5 минут. Контрольная проба замеряется аналогичным способом, но уже без добавки ингибитора.
Реакция окисления в водно-эмульсионной среде проводилась при температуре 60,0±0,2°С при непрерывном перемешивании субстрата: метиллинолеат и вода в соотношении 1:3 по объёму. В качестве эмульгатора использовали цетилтриметиламмоний бромид (ЦТМАБ) с конечной концентрацией в пробе 1 ■ 10_3моль/л. В качестве катализатора использовали хлорид меди с конечной концентрацией (1 — 3) ■ 10_3моль/л. Проба насыщалась кислородом и также определялся объём поглощенного кислорода в контрольной пробе и в присутствии ингибитора в интервале концентраций (9,75-10″6 — Ы0″2) моль/л.
По экспериментальным данным построили кинетические кривые (КК), по которым определили период индукции, начальную и максимальную скорость процесса. Скорость инициирования при концентрации инициатора 2-10″3 моль/л и температуре 60,0±0,2°С составила (1,7±0,3) 10″9 моль/л •с. Типичные КК инициированного окисления метиллинолеата в присутствии рутина приведены на рис. 1.

