- Энциклопедия
- Химия
- Кислород
Менделеев создал периодическую систему химических элементов, там он указал все возможные вещества, которые существуют на планете. В этой же таблице можно увидеть информацию о самом важном веществе в жизни всех живых существ – это кислород. Ему присвоен атомный номер 8. Относится к неметаллам и является самым лёгким из всех халькогенов.
В своем естественном проявлении кислород не имеет цвета и запаха относится к газам. Почувствовать его вкус невозможно. Доказано, что одна молекула кислорода состоит из двух атомов. Помимо невидимого газового кислорода существует жидкий и твердый. Жидкий кислород иметь голубой цвет, а твердый представляет собой кристаллы светлого синего цвета.
Люди всегда дышали кислородом, но не всегда подозревали о его существовании. Официальное открытие кислорода произошло 1 августа 1774 году. Сделал это химик из Англии Джозеф Присли. С помощью экспериментов и опытов по направлению солнечных лучей на оксид ртути привел к открытию. Учёный не сразу понял, что совершил открытие нового вещества. В 1775 году французский химик установил, что кислород – это то, из чего состоит воздух, а именно одна из его частей. Далее .вот проведены эксперименты с горением из чего вышла теория о том, что без кислорода огонь не может гореть.
До реформы Ломоносова кислород называли кислотвором. Далее М. В. Ломоносов ввел понятие «кислота» и «кислород». Кислород был найдет даже в земной коре, где его большое количество, но такое количество кислорода на планете было не всегда. Ещё 3.5 миллиона лет назад растений на земле было очень малое количество, а это значит, что фотосинтеза как такого было тоже мало и выделенного кислорода не хватило бы даже одному человеку. Тогда практически весь кислород поглощал океан.
На данный момент планктон из океана наоборот выделяет больше всего кислорода, так же ему помогают леса, где деревья выделяют, но тут же поглощают кислород. Важно отметить, что активность человека никак не влияет на его поглощение кислорода. В любом случае каждый человек одинаково перерабатывает кислород, когда пассивен или активен.
В любом случае кислород влияет на состояние здоровья и обитания живых существ. Если у существа кислородное голодание, то мозг работает не так активно, как при нормальном достатке воздуха. Учёные не предсказывают в ближайшее время уменьшение уровня содержания кислорода в воздухе на планете.
Вариант 2
На нашей планете существует огромное множество различных элементов, которые, так или иначе, находятся в своеобразном симбиозе друг с другом, взаимодействуя, образуя что-то новое, и создавая более новые, комбинированные, и совершенные элементы. Каждый элемент важен, ведь он выполняет какую-то определенную функцию, занимая своё место в нашем мире. Но, однако, самым важным элементом без сомнения является кислород.
Кислород – это один из наиболее распространённых элементов на земле, который поддерживает на ней всю биологическую жизнь, нормализуя, и направляя функционирование всех биологических систем в верное русло. И верно, кислород является одним из самых важных элементов, так как если бы не существовало кислорода, и всего того, что с ним связано, то, соответственно, не существовало бы и жизни на земле. Также кислород входит в состав воды, которая также является одной из важнейших вещей в создании и поддержании жизни.
Такой элемент как кислород появился на земле с приходом первых растений, которые в процессе фотосинтеза перерабатывали углекислый газ, которого в атмосфере на тот момент было в избытке, превращая его в кислород, и отправляя в атмосферу, что делало её более насыщенной и плотной, которая могла лучше защищать планету от возможной радиации, посылаемой в её сторону из космоса. Таким образом кислород поддерживал не только нашу жизнь всё наше существование, но и задолго до нас создал пригодную для жизни атмосферу, благодаря чему мы можем спокойно существовать на данной планете, даже не задумываясь о возможной радиации, которая может быть послана на неё в огромных количествах, так как благодаря кислороду, наша атмосфера достаточно плотная, чтобы не пропускать большую часть данной радиации.
Открытие кислорода произошло довольно таки давно, приблизительно в 19 веке какой-то химик, проведя эксперимент с облучением банки азота получил кислород, назвав его основополагающим элементом.
В обычном своём состоянии кислород это газ без цвета и запаха, который не виден простым человеческим зрением, что делало его возможность открытия весьма сложной, потому и открытие ученого заслуживает уважения.
Кислород
Интересные темы
- Ящерицы — сообщение доклад
Ящерицами называют животных из отряда чешуйчатых. Так же они относятся к роду рептилий. В основном они имеют небольшой размер и две пары конечностей.
- История открытия и изучения «Слова о полку Игореве» доклад сообщение
Слово о полку Игореве считается своеобразным литературным и историческим памятником культуры Древней Руси. Слово могло к нам не дойти, как и не дошли другие великие повести и сказания
- Почему нельзя загрязнять воду? — сообщение доклад
Вода – самый важный источник для человека. Без неё невозможно существование живых существ. К ней обязательно бережное отношение. Так как чистую пресную воду очень сложно заменить
- Какое значение имеет воздух для растений, животных, человека?
В атмосфере находятся множество химических газов – это в большей степени азот и кислород, а в меньшей углекислый газ и аргон. Эти природные смеси нужны каждому дышащему организму и растениям, чтобы развиваться дальше.
- Хронологическая таблица Пушкина (жизнь и творчество)
6 июня 1799 год — Надежда Осиповна Пушкина родила будущего поэта в городе Москва. Александр Сергеевич Пушкин родился в дворянской семье, отца звали Сергей Львович Пушкин.
Обновлено: 11.03.2023
1 августа 1774 года я попытался извлечь воздух из ртутной окалины и нашел, что воздух легко может быть изгнан из нее посредством линзы. Этот воздух не поглощался водой. Каково же было мое изумление, когда я обнаружил, что свеча горит в этом воздухе необычайно ярким пламенем. Тщетно пытался я найти объяснение этому явлению.
Джозеф Пристли
То, что кислород невидим, безвкусен, лишен запаха, газообразен при обычных условиях, надолго задержало его открытие.
Многие ученые прошлого догадывались, что существует вещество со свойствами, которые, как мы теперь знаем, присущи кислороду.
Изобретатель подводной лодки К. Дреббель еще в начале XVII в. выделил кислород, выяснил роль этого газа для дыхания и использовал его в своей подводной лодке. Но работы Дреббеля практически не повлияли на развитие химии. Его изобретение носило военный характер, и все, что было так или иначе связано с ним, постарались своевременно засекретить.
До встречи с Пристли Лавуазье не знал, что в горении и дыхании принимает участие только часть воздуха. Теперь он по-новому поставил начатые двумя годами раньше исследования горения. Для них характерен скрупулезный количественный подход: все, что можно, взвешивалось или как-либо иначе измерялось.
Кислородная теория горения пришла на смену теории флогистона. За два века, прошедших со времени открытия, теория Лавуазье не только не была опровергнута, но еще более укрепилась.
Это не значит, конечно, что об элементе №8 современной науке известно абсолютно все.
Нахождение кислорода в природе
Кислород самый распространенный элемент на нашей планете. Он входит в состав воды (88,9%), а ведь она покрывает 2 /з поверхности земного шара, образуя его водную оболочку гидросферу. Кислород вторая по количеству и первая по значению для жизни составная часть воздушной оболочки Земли атмосферы, где на его долю приходится 21% (по объему) и 23,15% (по массе). Кислород входит в состав многочисленных минералов твердой оболочки земной коры литосферы: из каждых 100 атомов земной коры на долю кислорода приходится 58 атомов.
Как вы уже знаете, обычный кислород существует в форме О2 . Это газ без цвета, запаха и вкуса. В жидком состоянии имеет светло-голубую окраску, в твердом синюю. В воде газообразный кислород растворим лучше, чем азот и водород.
а) В составе простых веществ.
Кислород взаимодействует почти со всеми простыми веществами, кроме галогенов, благородных газов, золота и платиновых металлов. Например, энергично реагирует с металлами: щелочными, образуя оксиды М2 О и пер оксиды М2 О2 ; с железом, образуя железную окалину Ге3 О4 ; с алюминием, образуя оксид А12 О3 .
Реакции неметаллов с кислородом протекают очень часто с выделением большого количества тепла и сопровождаются воспламенением реакции горения. Вспомните горение серы с образованием SО2 , фосфора с образованием Р2 О5 или угля с образованием СО2 .
Почти все реакции с участием кислорода экзотермические. Исключение составляет взаимодействие азота с кислородом: это эндотермическая реакция, которая протекает при температуре выше 1200 °С или при электрическом разряде:
N2 + O2 2NO –Q
в) в составе сложных веществ
Кислород энергично окисляет не только простые, но и сложные вещества, при этом образуется оксиды элементов, из которых они построены.
Метан
Высокая окислительная способность кислорода лежит в основе горения всех видов топлива.
Кислород участвует и в процессах медленного окисления различных веществ при обычной температуре. Эти процессы не менее важны, чем реакции горения. Так, медленное окисление пищи в нашем организме является источником энергии, за счет которой живет организм. Кислород для этой цели доставляется гемоглобином крови, который способен образовывать с ним непрочное соединение уже при комнатной температуре. Окисленный гемоглобин оксигемоглобин доставляет во все ткани и клетки организма кислород, который окисляет белки, жиры и углеводы (составные части пищи), образуя при этом углекислый газ и воду и освобождая энергию, необходимую для деятельности организма.
Исключительно важна роль кислорода в процессе дыхания человека и животных.
Растения также поглощают атмосферный кислород. Но если в темноте идет только процесс поглощения растениями кислорода, то на свету протекает еще один противоположный ему процесс — фотосинтез, в результате которого растения поглощают углекислый газ и выделяют кислород. Так как процесс фотосинтеза идет более интенсивно, то в итоге на свету растения выделяют гораздо больше кислорода, чем поглощают его при дыхании. Таким образом, содержание свободного кислорода Земли сохраняется благодаря жизнедеятельности зеленых растений.
Положение в таблице Д.И. Менделеева, строение.
В центре атома кислорода находится ядро с зарядом +8, ядро состоит из 8 протонов и (16-8)= 8 нейтронов вокруг ядра вращается 12 электронов.
1) 1 S 2
2) 2 S 2 P 4
Для завершения внешнего энергетического уровня кислороду не хватает двух электронов. Энергично принимая их кислород проявляет степень окисления, равную –2. Однако в соединениях кислорода со фтором, общая электронная пара смещена по фтору как к более электроотрицательному элементу, В этом случае степень окисления кислорода равна + 2, а фтора + 2 . в пер оксиде водорода H2 O2 и его производных степеней окисления равна – 1. В соединениях со всеми другими электронами окислительность кислорода отрицательна и равна – 2.
Сравнение окислительно-восстановительных свойств и размера ядра кислорода с элементами стоящими с ним в той же подгруппе, группе и периоде.
В своей группе у кислорода самая маленькая орбита. Принять электроны ему легче всех, отдать труднее. Самая маленькая орбита у него потому, что он стоит во 2 периоде и следовательно у него меньше всех электронных слоев. Принять недостающих электрон легче потому что, у него лучше связь атома с электроном, чем у остальных элементов этой группы. И отдать труднее потому что, тоже связь с электрона с ядром на последнем слое сильней, чем у остальных элементов этой группы.
У кислорода ядро меньше чем у Li, Be, B, C, N, но больше чем у F, потому что число элекроных слоев у них одинаковы, а количество электронов на последнем слое разное. У кислорода электроны больше чем у Li, Be, B, C, N значит связь электронов с ядром больше и радиус меньше. У кислорода восстановительные свойства больше, чем у Li, Be, B, C, N и принять недостающий электрон ему легче, по меньше чем у фтора, которому принять недостающий электрон еще легче, чем кислороду.
Физические свойства аллотропных видоизменений кислорода.
Аллотпропным видоизменениям кислорода является озон. В отличии от бесцветного кислорода, не имеющего запаха, озон – это светло синий газ с сильным запахом. Озон в полтора тяжелее кислорода, лучше его растворяется в воде. Как окислитель озона само воспламеняющее горящие жидкости, например этан. При обычной температуре озон окисляет даже серебро. Поэтому дышать воздухом со значительным содержанием озона нельзя, т.к. он разрушает ткани дыхательных путей.
Большая окислительная активность озона объясняется его термической неустойчивостью. Он при комнатной температуре медленно, но при 100-150 0. С быстро разлагается на кислород и атомарный О 0 , которой является чрезвычайно сильным окислителем по с сравнению с кислородом, он мгновенно вступает в химическую реакцию. В воздушной атмосфере над Землей на высоте около 25 километров находится озоновый слой, который защищает все живое от ультрофиалетовых лучей.
Получение кислорода
a) в лаборатории
Кислород в лаборатории получают путем разложения пероксида водорода (H2 O2 ) в присутствии катализатора- диоксида марганца (MnO2 ) , а также разложением перманганата калия (KMnO4 ) при нагревание.
b) в промышленности
Так как горением в таком газе можно получить очень высокие температуры, полезные во многих. применениях, то быть может, что придет время, когда указанным путем станут на заводах и вообще для промышленности обогащать воздух кислородом.
В Советском Союзе особенно быстрое развитие кислородной промышленности началось в годы Великой Отечественной войны, после изобретения академиком Л.П.Капицей турбодетандера и создания мощных воздухоразделительных установок.
Еще Карл Шееле получал кислород, по меньшей мере, пятью способами: из окиси ртути, сурика, селитры, азотной кислоты и пиролюзита. На подводных лодках и сейчас получают кислород, разлагая богатые этим элементом хлораты и перхлораты. В любой школьной лаборатории демонстрируют опыт – разложение воды на кислород и водород электролизом. Но ни один из этих способов не может удовлетворить потребности промышленности в кислороде.
Энергетически проще всего получить элемент №8 из воздуха, поскольку воздух – не соединение, и разделить воздух не так уж трудно. Температуры кипения азота и кислорода отличаются (при атмосферном давлении) на 12,8°C. Следовательно, жидкий воздух можно разделить на компоненты в ректификационных колоннах так же, как делят, например, нефть. Но чтобы превратить воздух в жидкость, его нужно охладить до минус 196°C. Можно сказать, что проблема получения кислорода – это проблема получения холода.
Чтобы получать холод с помощью обыкновенного воздуха, последний нужно сжать, а затем дать ему расшириться и при этом заставить его производить механическую работу. Тогда в соответствии с законами физики воздух обязан охлаждаться. Машины, в которых это происходит, называют детандерами.
До 1938г. для получения жидкого воздуха пользовались только поршневыми детандерами. По существу, такой детандер – это аналог паровой машины, только работает в нем не пар, а сжатый воздух. Чтобы получить жидкий воздух с помощью таких детандеров, нужны были давления порядка 200 атм., причем по неизбежным техническим причинам на разных стадиях процесса давление было не одинаковым: от 45 до 200 атм. КПД установки был немногим выше, чем у паровой машины. Установка получилась сложной, громоздкой, дорогой.
Современные установки для разделения воздуха, в которых холод получают с помощью турбодетандеров, дают промышленности, прежде всего металлургии и химии, сотни тысяч кубометров газообразного кислорода. Они работают не только у нас, но и во всем мире.
В 1942г. построили подобную, но уже намного более мощную установку, которая производила до 200кг жидкого кислорода в час. В конце 1944г. вводится в строй самая мощная в мире турбо кислородная установка, производящая в 6. 7 раз больше жидкого кислорода, чем установка старого типа, и при этом занимающая в 3. 4 раза меньшую площадь.
Современный блок разделения воздуха БР-2, в конструкции которого также использован турбодетандер, мог бы за сутки работы снабдить тремя литрами газообразного кислорода каждого жителя СССР.
Химические свойства кислорода с позиции О/В реакции, особенности горения органических и не органических веществ, простых и сложных.
Реакции окисления, сопровождающиеся выделениям теплоты и света, называются горением. Расплавленная сера горит в кислороде ярким синим пламенем, при этом образуется газ с резким запахом – диоксид серы, или оксид серы 4 (SO2 ). Запах, его мы ощущаем, когда зажигаем спички.
Внесенный в сосуд, с кислородом горящий красный фосфор горит ослепительным пламенем с образованием твердого белого вещества – оксида фосфора 5 (P2 O5 )
При внесении в сосуд с кислородом раскаленной стальной проволоки вы можете наблюдать горение железа, сопровождаемое треском и разбрызгиванием ярких искр–расплавленных капель железной окалины ( Fe5 O4 )
Это явление можно увидеть при разливе жидкого чугуна и стали на металлургических заводах.
Большое практическое значение имеют процессы горения сложных веществ, как, например: метан, ацетилена. В результате таких реакций получается оксиды элементов, входящих в состав сложного вещества. Например, схему реакции горения ацетилена можно записать так.
2 C2 H2 + 5 O2 4 CO2 2H2 O
Если экзотермическая реакция окисления происходит медленно, то ее горение не называют. Так, медленно окисляются на воздухе многие металлы, покрываясь пленкой оксидов. Сравнительно медленно происходит в живом организме реакция окисления глюкозы – одного из основных источников энергии в организме.
Само горение представляет собой экзотермическую реакцию окисления, происходящею с достаточно небольшой скоростью.
Биологическое значение кислорода.
Высокая окислительная способность кислорода лежит в основе горения всех видов топлива.
Кислород участвует и в процессах медленного окисления различных веществ при обычной температуре. Эти процессы не менее важны, чем реакции горения. Так, медленное окисление пищи в нашем организме является источником энергии, за счет которой живет организм. Кислород для этой цели доставляется гемоглобином крови, который способен образовывать с ним непрочное соединение уже при комнатной температуре. Окисленный гемоглобин оксигемоглобин доставляет во все ткани и клетки организма кислород, который окисляет белки, жиры и углеводы (составные части пищи), образуя при этом углекислый газ и воду и освобождая энергию, необходимую для деятельности организма.
Исключительно важна роль кислорода в процессе дыхания человека и животных. Растения также поглощают атмосферный кислород. Но если в темноте идет только процесс поглощения растениями кислорода, то на свету протекает еще один противоположный ему процесс — фотосинтез, в результате которого растения поглощают углекислый газ и выделяют кислород. Так как процесс фотосинтеза идет более интенсивно, то в итоге на свету растения выделяют гораздо больше кислорода, чем поглощают его при дыхании. Таким образом, содержание свободного кислорода Земли сохраняется благодаря жизнедеятельности зеленых растений.
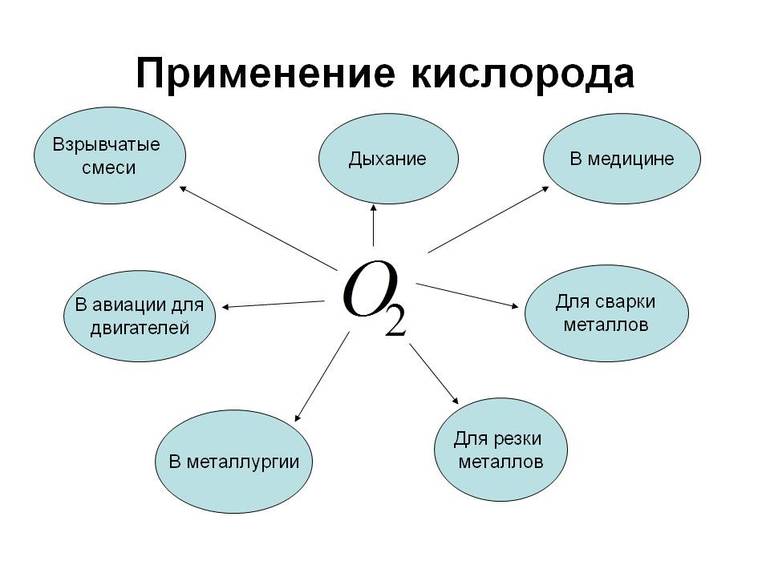
Применение кислорода.
Кислород применяют в металлургической и химической промышленности для ускорения производственных процессов. Так, замена воздушного дутья кислородным в доменном и сталеплавном производстве на много ускоряет выплавку металла. Чистый кислород применяют также для получения высоких температур, на пример, при газовой сварке и резке металлов.
Его используют для жизнеобеспечения на подводных и космических кораблях, при работах водолазов, пожарных.
В медицине кислород применяют в случаях временного затруднения дыхания, связанного с некоторыми заболеваниями.
Научные доклады
Когда и кто открыл кислород?
Химические и физические свойства кислорода
В химии элемент образовывает 2 простых вещества — кислород О2 и О3. Газ О2 не имеет ни запаха, ни цвета. Его молекула притягивается магнитом, так как содержит 2 неспаренных электрона. Атмосферный кислород состоит из двухатомных молекул. В каждой молекуле имеются 2 неспаренных электрона. Молекула инертна и устойчива к высокой энергии активации.
Существуют модификации кислорода: жидкий голубой кислород, твердый кислород. Высокая химическая прочность связи между атомами приводит к тому, что газообразный кислород при комнатной температуре становится малоактивным. В природе он является важным участником процессов превращения и гниения. Интересно, что данный элемент при комнатной температуре реагирует с кровяным гемоглобином. Это обеспечивает транспортабельность кислорода ко всем органам организма.
Со многими веществами может вступать в связь без предварительного нагревания (с щелочноземельными и щелочными металлами, белым фосфором и альдегидами). При этом на поверхности изделий образуется ржавчина. При малейшем нагревании кислород повышает свою химическую активность. С водородом, горючими газами, метаном, простыми и сложными веществами кислород реагирует взрывом.
Изотопный состав элемента изменяется в зависимости от природных условий – он либо обогащается тяжелыми металлами, либо обедняется ими. Очень часто кислород выступает в роли окислителя. В процессе реакции выделяется свет и тепло. Из кислорода в естественных условиях на высоте 10—30 км, при грозовых разрядах, образуется озон (03). Он защищает планету от ультрафиолетового излучения и используется для очищения питьевой воды.
Как мы уже упоминали, кислород – это окислитель. Если окисляемый металл характеризуется высокой летучестью, то процесс происходит как горение с образованием оксида. Эффективность реакции зависит от восстановительной активности. При этом оксиды, выделяемые в процессе, могут быть кислотными, амфотерными и основными. Иногда при горении образуются пероксиды и надпероксиды.
Где применяется кислород?
Кислород используется в черной и цветной металлургии. Он интенсифицирует пирометаллургические и гидрометаллургические процессы. Благодаря элементу научились извлекать из руд золото. Это трудоемкая операция, но благодаря кислороду она протекает значительно быстрее. Также он применяется в химической промышленности, на нужды которой расходуется 30% производящего кислорода. Элемент берет участие в термоокислительном крекинге, когда получается ацетилен – вещество для сварки и резки металлов, для синтезов органических веществ.
Кислород применяется в космосе. Он выступает окислителем в двигателях космических кораблей второй ступени и в ракетах высотных исследований. В составе взрывчатых веществ находится жидкий кислород. Также он применяется в авиации и медицине. Когда затруднительное дыхание, при сердечных и легочных заболеваниях, то больным из кислородных подушек подают кислород.
СОЧИНЕНИЕ НА ТЕМУ «ХУДОЖЕСТВЕННЫЙ ОБРАЗ ВЕЩЕСТВА ИЛИ ПРОЦЕССА (КИСЛОРОД)»!
Я знаком с Кислородом довольно давно.
Он достаточно строг к себе, немного нелюдим — никогда не приглашает к себе более двух знакомых.
Внешне он выглядит достаточно привлекательно, хоть и является альбиносом — телосложение среднее, одежда всегда опрятная, полутёплая улыбка, зачёсанные назад волосы и вечный серый галстук — бабочка только добавляют ему шарма.
Кругу знакомств Кислорода действительно можно позавидовать.
Количество реакций, в которых он принимает участие действительно поражает.
Единственное, что меня напрягает в Кислороде, это его друг.
Его зовут Водород.
Он очень скрытный, и, сказать честно, мне кажется, что Водород его просто использует.
Но это уже совсем другая история.
Выписать простые и сложные вещества : вода, ртуть, кислород, сахар, железо, поваренная соль, углекислый газ?
Выписать простые и сложные вещества : вода, ртуть, кислород, сахар, железо, поваренная соль, углекислый газ.
* * * * * Помогите пожалуйста очень нужно * * * * * * * *.
Напишите формулы биэлементных соединений образующихся при взаимодействии следующих веществ кальций и кислород, алюминний и хлор , водород и фтор, магний и кислород?
Напишите формулы биэлементных соединений образующихся при взаимодействии следующих веществ кальций и кислород, алюминний и хлор , водород и фтор, магний и кислород!
Физическое или химическое явление : а) кислород сжижается при очень низких температурах б) кислород участвует в процессе дыхания и образует углекислый газ в) кислород плохо растворяется в воде г) горе?
Физическое или химическое явление : а) кислород сжижается при очень низких температурах б) кислород участвует в процессе дыхания и образует углекислый газ в) кислород плохо растворяется в воде г) горение ацетилена в кислорода применяется для газов и металлов.
Помогите пожалуйста) очень нужно) как можно доказать что кислород, железо и водород — простые вещества, а вода и сульфид железа — сложные вещества?
Помогите пожалуйста) очень нужно) как можно доказать что кислород, железо и водород — простые вещества, а вода и сульфид железа — сложные вещества?
Каковы условия возникновения и течения реакции образования сульфида железа?
Сочинение на тему «Художественный образ вещества или химического процесса»?
Сочинение на тему «Художественный образ вещества или химического процесса».
При сгорании натрия в кислороде образуется вещество состава?
При сгорании натрия в кислороде образуется вещество состава.
При горении веществ в воздухе и кислороде образуется ?
При горении веществ в воздухе и кислороде образуется ?
Пожалуйста помогите ?
При сгорании магния в кислороде образуется вещество MgO Рассчитайте число молекул кислорода необходимого для реакции с магниим массой 48г.
Сочинение по химии : художественный образ меди?
Сочинение по химии : художественный образ меди.
Помогите пожалуйста с химией?
Помогите пожалуйста с химией!
Напишите мини — сочинение на тему «Художественный образ вещества или процесса».
Очень нужно сочинение про ГАЛОГЕНЫ!
На этой странице сайта вы найдете ответы на вопрос СОЧИНЕНИЕ НА ТЕМУ «ХУДОЖЕСТВЕННЫЙ ОБРАЗ ВЕЩЕСТВА ИЛИ ПРОЦЕССА (КИСЛОРОД)»?, относящийся к категории Химия. Сложность вопроса соответствует базовым знаниям учеников 5 — 9 классов. Для получения дополнительной информации найдите другие вопросы, относящимися к данной тематике, с помощью поисковой системы. Или сформулируйте новый вопрос: нажмите кнопку вверху страницы, и задайте нужный запрос с помощью ключевых слов, отвечающих вашим критериям. Общайтесь с посетителями страницы, обсуждайте тему. Возможно, их ответы помогут найти нужную информацию.
Напишем эту реакцию полагая что формула оксида фосфора P2O5 (а не P4O10), а формула образующейся кислоты H3PO4 (а не HPO3) P2O5 + 3H2O = 2H3PO4 Тогда сумма коэффициентов = 6 (ответ Б).
2HCl + K₂O = 2KCl + H₂O количество вещества хлорида калия n(KCl) = 2n(K₂O) n(KCl) = 2 * 0, 4моль = 0, 8 моль 2HClO₄ + K₂O = 2KClO₄ + H₂O количество вещества перхлората калия n(KClO₄) = 2n(K₂O) n(KClO₄) = 2 * 0, 4моль = 0, 8 моль.
Число частиц — N n = N / Na Na — число Авогадро( = 6, 02 * 10 ^ 23) n = 13 * 10 ^ 23 / 6, 02 * 10 ^ 23 = 2, 16 моль. Ответ : 2, 16 моль.
Способность элемента проявлять различную степень окисления в химических соединениях зависит от количества неспаренных электронов на последнем электронном слое его атома. Размещение электронов атома серы по уровням и подуровням : 1s2 2s2 2p6 3s2 3p4 ..
N(HCOH) = 3моль V₀ = 22, 4л / моль схема полного окисления метаналя HCOH + O₂ = CO₂ + H₂O количество вещества кислорода по уравнению реакции n(O₂) = n(HCOH) объем кислорода V(O₂) = n(O₂)V₀ V(O₂) = n(HCOH)V₀ V(O₂) = 3моль * 22, 4л / моль = 67, 2л.
1, 12 дм3 Мне кажется так *.
1) BaCo3 + 2HCI = BaCl2 + H2Co3 2) Na2Co3 + 2KCI = 2NaCI + K2Co3 3) Fe(OH)2 + H2SO4 = FeSO4 + 2H2O.
5H2SO4 + 8K — > H2S + 4K2SO4 + 4H2OK — 1e = K( + 1) | 1 | 8 — восстановительS( + 6) + 8e = S(2 — ) | 8 | 1 — окислитель.
© 2000-2022. При полном или частичном использовании материалов ссылка обязательна. 16+
Сайт защищён технологией reCAPTCHA, к которой применяются Политика конфиденциальности и Условия использования от Google.
Распространённость и свойства
Прежде всего, элемент необходим для дыхания активных организмов. Он также принимает участие в разложении мёртвых животных и растений. Содержание кислорода в земной коре составляет почти 50%, содержится в различных минералах в виде оксидов и солей. В связанном виде кислород входит в химический состав воды — его процентное соотношение составляет около 89%, а также в клетки всех живых существ — растений и животных.
Компонент характеризуется высочайшей химической насыщенностью и образует гибридные субстанции, состоящие из связанных атомов двух и более компонентов вместе с почти всей периодической таблицей, за исключением только лишь инертных газов (криптон, аргон, неон, гелий и ксенон). В период изменения акцентируется огромное количество тепла, такая реакция является экзотермичной. Он весьма тяжело приготовить в воде.
С повышением температуры водорастворимость убавляется. При снижении температуры вплоть до — 218*с он становится твёрдым.
При соприкосновении сжатого кислородного газа с распылёнными жирными веществами, полученными из веществ растительного, животного или минерального происхождения, происходит их самовозгорание. Это частый источник пожаров. Во избежание несчастных случаев кислородное оборудование должно быть тщательно обезжирено.
Бесцветное вещество обладает способностью образовывать взрывоопасные смеси и легковоспламеняющиеся газы, где поблизости находится источник открытого огня.
Извлечение вещества
Элемент из атмосферы можно приобрести с помощью специализированных установок. В них воздушное пространство фильтруется, избавляется от водорода и азота, малейших сухих элементов, углекислого газа, а также высушивается от влаги. Рециркулированный воздух сокращается компрессионной машиной, а газ перед нажимом переходит в конденсатор для сжижения. Для перевоплощения жидкого воздуха в газ применяются криоцилиндры либо приспособления для откачки с теплообменником. Этот химический компонент можно приобрести как в лаборатории, так и на промышленном предприятии.
Существует несколько способов получения кислорода в лабораторных условиях:
- С помощью реакции разложения хлората калия.
- За счёт разложения пероксида водорода при его нагревании в присутствии оксида марганца, который действует как катализатор.
- Через разложение перманганата калия.
Производство кислорода в промышленности осуществляется различными способами. Современное оборудование обеспечивает приготовление вещества любой степени чистоты.
Применение элемента
Химический элемент используется для жизнеобеспечения людей, страдающих затруднённым дыханием, а также для лечения некоторых недугов. Примечательно, что при нормальном давлении чистый кислород долго не, может быть, вдыхаем. Это небезопасно для здоровья в любой области. Бывает использование компонента в авиации.
Этот химический элемент используется в стекловаренных печах в качестве компонента, улучшающего горение в них. Кроме того, благодаря веществу промышленность сокращает выбросы оксидов азота до уровня, безопасного для жизни. Теплоэлектростанции, работающие на нефти, природном газе или угле, используют кислород для сжигания топлива. Без него все промышленные предприятия просто не работали бы.
Этот химический элемент используется в спиртовании, делигнификации и других процессах, таких как:
- Отбеливание бумаги.
- Очистка сточных вод, что имеет большое значение.
- Подготовка питьевой воды в быту.
- Интенсификация сжигания отходов мусоросжигательных заводов и др.
В природе существует круговорот кислорода: в процессе фотосинтеза растения на свету превращают углекислый газ и воду в органические соединения. Этот процесс можно назвать выделением. Подобно людям и животным, растения ночью потребляют кислород из атмосферы, а потом растения вырабатывают его днём и расходуют ночью. Применение кислорода по химии 9 класса кратко рассматривают, пишут реферат с рисунками и схемами по теме.
Читайте также:
- Сочинение по географии с условными знаками 5 класс школьные знания
- Сочинение я в театре
- Ведьмак итоговое сочинение аргументы
- Сочинение образ поэта и тема вдохновения в лирике а к толстого
- Сочинение анализ эпизода война и мир
Применение кислорода

4.6
Средняя оценка: 4.6
Всего получено оценок: 632.
4.6
Средняя оценка: 4.6
Всего получено оценок: 632.
Кислород – химический элемент VI группы периодической системы Менделеева и самый распространенный элемент в земной коре (47% от ее массы). Кислород является жизненно важным элементом почти всех живых организмов. Более подробно о функциях и применении кислорода в этой статье.
Общие сведения
Кислород представляет собой бесцветный газ без вкуса и запаха, который плохо растворяется в воде. Он входит в состав воды, минералов, горных пород. Свободный кислород образуется благодаря процессам фотосинтеза. Кислород играет наиважнейшую роль в жизни человека. Прежде всего кислород необходим для дыхания живых организмов. Также он принимает участие в процессах разложения погибших животных и растений.
Воздух содержит около 20,95% по объему кислорода. В гидросфере содержится почти 86% по массе кислорода.
Кислород был получен одновременно двумя учеными, но сделали они это независимо друг от друга. Швед К. Шееле получил кислород при прокаливании селитры и других веществ, а англичанин Дж. Пристли – при нагревании оксида ртути.
Применение кислорода в промышленности
Области применения кислорода обширны.
В металлургии он необходим для производства стали, которую получают из металлолома и чугуна. Во многих металлургических агрегатах для лучшего сжигания топлива используют воздух, обогащенный кислородом.
В авиации кислород используется как окислитель топлива в ракетных двигателях. Также он необходим для полетов в космос и в условиях, где нет атмосферы.
В области машиностроения кислород очень важен для резки и сварки металлов. Чтобы расплавить металл нужна специальная горелка, состоящая из металлических труб. Эти две трубы вставляются друг в друга. Свободное пространство между ними заполняют ацетиленом и зажигают. Кислород же в это время пускают по внутренней трубке. И кислород и ацетилен подаются из баллона под давлением. Образуется пламя, температура в котором достигает 2000 градусов. При такой температуре плавится практически любой металл.
Применение кислорода в целлюлозно-бумажной промышленности очень важно. Он используется для отбеливания бумаги, при спиртовании, при вымывании лишних компонентов из целлюлозы (делигнификация).
В химической промышленности кислород используется в качестве реагента.
Для создания взрывчатых веществ необходим жидкий кислород. Жидкий кислород производится путем сжижения воздуха и последующего отделения кислорода от азота.
Применение кислорода в природе и жизни человека
Кислород играет наиважнейшую роль в жизни человека и животных. Свободный кислород существует на нашей планете благодаря фотосинтезу. Фотосинтез – это процесс образования органического вещества на свету с помощью углекислого газа и воды. В результате этого процесса образуется кислород, который необходим для жизнедеятельности животных и человека. Животные и человек потребляют кислород постоянно, растения же расходуют кислород только ночью, а днем производят его.
Применение кислорода в медицине
Кислород находит применение и в медицине. Особенно актуально его использование при затрудненном дыхании во время некоторых заболеваний. Он применяется для обогащения дыхательных путей при туберкулезе легких, а также используется в наркозной аппаратуре. Кислород в медицине используется для лечения бронхиальной астмы, болезней желудочно-кишечного тракта. Для этих целей используют кислородные коктейли.
Также большое значение имеют кислородные подушки – прорезиненная емкость, заполненная кислородом. Она служит для индивидуального применения медицинского кислорода.
Что мы узнали?
В данном сообщении, которое охватывает тему «Кислород» по химии 9 класса кратко даны общие сведения о свойствах и применении этого газа. Кислород крайне важен для машиностроения, медицины, металлургической области и т.д.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Лидия Маслова
10/10
-
Тимофей Кот
10/10
-
Эльшан Асланов
9/10
-
Александр Джураев
9/10
-
Любовь Жовтенко
9/10
-
Андрей Бордюгов
9/10
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 632.
А какая ваша оценка?
Кислород — самый распространенный элемент на нашей планете. Он входит в состав воды (88,9%), а ведь она покрывает 2/3 поверхности земного шара, образуя его водную оболочку — гидросферу. Кислород — вторая по количеству и первая по значению для жизни составная часть воздушной оболочки Земли — атмосферы, где на его долю приходится 21% (по объему) и 23,15% (по массе). Кислород входит в состав многочисленных минералов твердой оболочки земной коры — литосферы: из каждых 100 атомов земной коры на долю кислорода приходится 58 атомов (рис. 21).Как вы уже знаете, обычный кислород существует в форме O2. Это газ без цвета, запаха и вкуса. В жидком состоянии имеет светло-голубую окраску, в твердом — синюю. В воде газообразный кислород растворим лучше, чем азот и водород.Кислород взаимодействует почти со всеми простыми веществами, кроме галогенов, благородных газов, золота и платиновых металлов. Например, энергично реагирует с металлами: щелочными, образуя оксиды и пероксиды; с железом, образуя железную окалину Fе3O4; с алюминием, образуя оксид Аl2O3.Реакции неметаллов с кислородом протекают очень часто с выделением большого количества тепла и сопровождаются воспламенением — реакции горения. Вспомните горение серы с образованием S02, фосфора — с образованием Р2О5 или угля — с образованием С02.Почти все реакции с участием кислорода экзотермические. Исключение составляет взаимодействие азота с кислородом: это эндотермическая реакция, которая протекает при температуре выше 1200 °С или при электрическом разряде:N2 + 02 <-> 2NO — QКислород энергично окисляет не только простые, но и многие сложные вещества, при этом образуютсяоксиды элементов, из которых они построены:СН4 + 202 = 2Н20 + С02
Метан2H2S + 3O2 = 2SO2 + 2Н2OВысокая окислительная способность кислорода лежит в основе горения всех видов топлива.Кислород участвует и в процессах медленного окисления различных веществ при обычной температуре. Эти процессы не менее важны, чем реакции горения. Так, медленное окисление пищи в нашем организме является источником энергии, за счет которой живет организм. Кислород для этой цели доставляется гемоглобином крови, который способен образовывать с ним непрочное соединение уже при комнатной температуре. Окисленный гемоглобин — оксигемоглобин доставляет во все ткани и клетки организма кислород, который окисляет белки, жиры и углеводы (составные части пищи), образуя при этом углекислый газ и воду и освобождая энергию, необходимую для деятельности организма.Исключительно важна роль кислорода в процессе дыхания человека и животных.Растения также поглощают атмосферный кислород. Но если в темноте идет только процесс поглощения растениями кислорода, то на свету протекает еще один противоположный ему процесс — фотосинтез, в результате которого растения поглощают углекислый газ и выделяют кислород. Так как процесс фотосинтеза идет более интенсивно, то в итоге на свету растения выделяют гораздо больше кислорода, чем поглощают его при дыхании. Таким образом, содержание свободного кислорода Земли сохраняется благодаря жизнедеятельности зеленых растений.
Сочинения на тему кислород
Все примеры сочинений по предмету кислород — поделись ими с одноклассниками! Образцы сочинений от команды сайта «Сочинения-Про». Здесь вы найдёте полезные материалы для написания сочинения или эссе самомстоятельно. А если нет — вы всегда можете заказать у нас помощь, по любому виду работ! Воспользуйтесь поиском, чтобы найти нужный вам материал.
Загрязнение воздуха как опасность для человечества
Воздух – это океан, которым мы дышим, воздух снабжает нас кислородом, который необходим нашему телу для жизни. Однако деятельность человека может привести к выбросу частиц в воздух, что может вызвать такие проблемы, как смог, кислотные дожди, парниковый эффект и дыры в озоновом слое. Каждая из этих проблем имеет серьезные проблемы для нашего здоровья и благополучия,
25.10.2020
Биоэнергетические решения
Давление внутри кабины технически называется эквивалентной эффективной высотой кабины или чаще – высотой кабины. Это определяется как эквивалентная высота над средним уровнем моря, имеющая такое же атмосферное давление в соответствии со стандартной атмосферной моделью, такой как Международная стандартная атмосфера. Таким образом, нулевая высота кабины будет равна давлению на среднем уровне моря, которое принимается равным 101,325
20.10.2020
Проведение эксперимента по количеству кислорода, необходимого бактериям в аэробной среде
Название: Потребность в кислороде В этой лаборатории были рассмотрены потребности в кислороде для ряда различных видов бактерий. Протестированные организмы включали два неизвестных вида, культивируемых в анаэробной среде, Pseudomonas auriofaciens (облигатный аэроб), Staphylococcus aureus (факультативный аэроб) и Enterococcus faecalis (аэротолерантный аэроб). Для этого эксперимента ожидается, что рост 3 известных видов бактерий согласуется с их соответствующим метаболическим
16.10.2020
Графеновые нанопластинки (ВНП)
Графен известен как двумерный материал, который получает sp2-гибридизированные атомы углерода, связанные в сотовой структуре. В то время как графеновый лист относится к материалу, выполняемому плоскостью уникальных гексагональных атомов, нанопластины графена, один из материалов на основе графена, определяются как частицы с наноразмерной толщиной от 3 до 100 нм с различными размерами до 50 мкм и имеют
09.10.2020
Роль кислорода в работе органов дыхания и кровообращения
Дыхательная и кровеносная системы работают вместе, доставляя кислород к клеткам организма (легкие посредством воздухообмена, а кровеносная система – путем доставки эритроцитов, содержащих гемоглобин, в капилляры, где кислород выделяется в ткани) и удалению углекислый газ. Кровеносная система доставляет питательные вещества, поглощенные через стенки тонкой кишки, в другие органы (такие как печень, мышцы, мозг, сердце) и доставляет
07.10.2020
Почему езда на велосипеде лучше?
Более широкое использование велосипедов лучше, чем использование автомобилей с двигателями личного сгорания. Двигатели внутреннего сгорания в автомобилях работают с использованием химической реакции сгорания. Горение – это химическая реакция, которая происходит между веществами, эти вещества обычно представляют собой комбинацию кислорода, сопровождаемого пламенем, в котором есть и тепло, и свет. Реагенты объединяются с высокой скоростью из-за характера
28.09.2020
Дыхательная система
Обычно, когда мы думаем о дыхательной системе, мы думаем только о дыхании. Но дыхательная система намного больше. Дыхательная система представляет собой систему органов, функционирующих при дыхании и состоящих, в частности, из носа, носоглотки, гортани, трахеи, бронхов и легких. Цель дыхательных систем – поглощать кислород и вдыхать углекислый газ. Принимая хороший воздух и избавляясь от плохого
12.09.2020
Результаты проекта Oxygen
Выводы Project Oxygen – это, в основном, экспертная смесь, состоящая из подхода функций, подхода Минцберга ролей и подхода навыков. Они пришли к выводу, что для того, чтобы быть лучшим руководителем, необходимо иметь видение будущего, помогающее людям достичь своих долгосрочных рабочих целей, выражая заинтересованность в благополучии сотрудников, технические способности оказывать поддержку своим сотрудникам, эффективные навыки общения
24.08.2020
Сжигание или сжигание топлива, как пример окисления и восстановления
Сгорание или сжигание топлива, возможно, является наиболее распространенным и очевидным примером окисления и восстановления. Горение – это также тот процесс, который преобразует потенциальную энергию топлива в кинетическую энергию (тепло и свет). Большинство видов топлива (бензин, дизельное топливо, пропан и т. Д.) Представляют собой соединения, состоящие в основном из углерода и водорода. Эти углеводороды представляют собой
25.07.2020
Жил-был Кислород. И был он таким сильным, что, с кем ни встретится, сразу окислит. И назвали Кислород окислителем, а вещества, получающиеся в реакции с Кислородом, — оксидами, сам процесс — окислением. Ходит Кислород по таблице Менделеева и со всеми в реакцию вступает. Стал он хвастливым, заносчивым и решил, будто в химическом мире нет никого сильнее его. И все же Кислород ошибся. Как-то раз встретил он в таблице Фтор. Решил Кислород окислить Фтор. Позвал он на помощь Водород и, образовав в соединении с ним воду, пошел в наступление на Фтор. И произошло чудо. Вода, которой тушат пожары, сама загорелась во Фторе. Кислород, считавшийся окислителем, в этой реакции стал восстановителем. Так Фтор превзошел Кислород и оказался самым сильным из окислителей.
Оцени ответ