Йод знают все. Порезав палец, мы тянемся к склянке с йодом, точнее, с его спиртовым раствором. Но не все знают, насколько важно содержание йода в нашем организме. Йод является очень сильным антисептическим препаратом. Однако йод служит не только для смазывания ссадин и царапин. Хотя йода в человеческом организме всего 25 мг, он играет важную роль. Большая часть «человеческого йода» находится в щитовидной железе: он входит в состав вещества, которое регулирует обмен веществ в организме. При недостатке йода задерживается физическое и умственное развитие и возникает болезнь, называющаяся эндемический зоб. Это чаще случается в высокогорных районах, где естественное содержание йода в воздухе, воде и пище очень низкое.
Йод — химический элемент VII группы периодической системы Менделеева. Атомный номер — 53. Относительная атомная масса — 126,9045 ± 0,0001. Галоген. Из имеющихся в природе галогенов — самый тяжёлый, если, конечно, не считать радиоактивный короткоживущий астат. Практически весь природный йод состоит из атомов одного-единственного изотопа с массовым числом 127, его содержание в земной коре — 4х10-5% по массе. Радиоактивный йод-125 образуется в ходе естественных радиоактивных превращений. Из искусственных изотопов йода важнейшие — йод-131 и йод-133, их в основном используют в медицине.
I2 — галоген. Темно-серые кристаллы с металлическим блеском. Летуч. Плохо растворяется в воде, хорошо — в органических растворителях (с фиолетовым или коричневым окрашиванием раствора) или в воде с добавкой солей-йодидов. Слабый окислитель и восстановитель. Реагирует с концентрированными серной и азотной кислотами, металлами, неметаллами, щелочами, сероводородом. Образует соединения с другими галогенами.
Молекула элементного йода, как и прочих галогенов, состоит из двух атомов. Йод — единственный из галогенов — находится в твёрдом состоянии при нормальных условиях. Красивые тёмно-синие кристаллы йода больше всего похожи на графит. Отчётливо выраженное кристаллическое строение, способность проводить электрический ток — все эти «металлические» свойства характерны для чистого йода.
Кальций
Соединения кальция — известняк, мрамор, гипс (а также известь — продукт известняка) — уже в глубокой древности применялись в строительном деле. Вплоть до конца 18 века химики считали известь простым телом. В 1789 А. Лавуазье предположил, что известь, магнезия, барит, глинозём и кремнезём — вещества сложные. В 1808 году Дэви, подвергая электролизу с ртутным катодом смесь влажной гашеной извести с окисью ртути, приготовил амальгаму кальция, а отогнав из неё ртуть, получил металл, названный «кальций» (от лат. Calх, род. падеж calcis — известь).
Кристаллическая решетка
Кристаллические решётки металлов могут быть различных типов, однако для кальция характерна гранецентрированная кубическая решётка.
Размеры, форму и взаимное расположение кристаллов в металлах изучают металлографическими методами. Наиболее полную оценку структуры металла в этом отношении даёт микроскопический анализ его шлифа. Из испытуемого металла вырезают образец, и его плоскость шлифуют, полируют и протравливают специальным раствором (травителем). В результате травления выделяется структура образца, которую рассматривают или фотографируют с помощью металлографического микроскопа.
Кальций — лёгкий металл (d = 1,55), серебристо-белого цвета. Он более твёрд и плавится при более высокой температуре (851 °С) по сравнению с натрием, который расположен рядом с ним в периодической системе. Это объясняется тем, что на один ион кальция в металле приходится два электрона. Поэтому химическая связь между ионами и электронным газом у него более прочная, чем у натрия. При химических реакциях валентные электроны кальция переходят к атомам других элементов. При этом образуются двухзарядные ионы.
Ответ учителя по предмету Химия
Привет, я Йод! Парень веселый и общительный, люблю тусоваться с металлами и неметаллами (легко проявляю степени окисления от -1 до +7). Еще мне нравится органика, особенно двойные связи — как увижу, сразу же к ним присоединяюсь! А еще я полезный — в обмене веществ участвую, и в аптечке всегда я есть! И вообще, меня в капусте (правда, в морской) нашли!
Так-то я парень стабильный, не взрываюсь по пустякам, но если меня с моим корешем Азотом правильно соединить — то веселье и взрывы обеспечены! Но это так, развлекуха по выходным — а работаю я в промышленности, металлы помогаю чистые получать, и полупроводники. Ладно, бывайте! Если буду нужен — всегда найдете меня в Периодической системе по адресу: 5 период, седьмой ряд, 53 номер! Ну или у галогенов спросите — я ж из них буду!
Йод в жизни человека
- Авторы
- Руководители
- Файлы работы
- Наградные документы
Керимова М.М. 1
1МБОУ Одинцовская гимназия № 13
Маланина Е.А. 1
1МБОУ Одинцовская гимназия № 13
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке «Файлы работы» в формате PDF
Введение
Йод ― жизненно необходимый микроэлемент, который в природе встречается крайне редко. Мы все знаем о существовании йода, часто пользуемся им в качестве антисептического препарата. Но мало кто из нас задумывается о более широком значении йода в жизни человека. Ведь йод — это элемент, минимальный по своему количественному содержанию, но очень важный для стабильного функционирования человеческого организма. Его недостаток порождает различного рода заболевания и часто бывает связан с малым употреблением продуктов, содержащих йод. Поэтому моя работа стала посвящена не только изучению столь важного теоретического материала по теме, но и качественному обнаружению йода в пищевых продуктах, чтобы мы точно могли знать, в каких из них йода содержится больше всего.
Цель исследования: Выявить значимость йода для жизни человека и определить качественное содержание йода в поваренной йодированной соли и продуктах питания.
Задачи исследования:
провести обзор научной и научно-популярной литературы, а также ресурсы Интернет по данной теме;
опытным путем определить качественное содержание йода в поваренной йодированной соли и продуктах питания.
Актуальность работы.
Теоретическая значимость данного исследования заключается в обобщении и систематизации материала по теме важности йода. Значимость результатов практической части состоит в полученных знаниях о качественном содержании йода и возможности их применения учителями химии и биологии на факультативных занятиях и элективных курсах.
Гипотеза: Качественное содержание йода можно определить в продуктах питания, используя их отвары.
Основная часть
1.История открытия йода как химического элемента
Существование йода было открыто Бернаром Куртуа ― одним из французских селитроваров. Его наблюдательность позволила ему в 1811 г. заметить, что медный котел при выпаривании щелока (щелок был получен из бурых водорослей) начал быстро подвергаться процессу разрушения. Создавалось впечатление, что котел разъедается какой-то кислотой. Тогда Куртуа, не дав этому новому явлению пройти бесследно, осадил и удалил из раствора соли натрия. Выпарив раствор, он обнаружил в котле наличие сульфида калия и для его разложения к выделившемуся осадку добавил концентрированную серную кислоту. Эта реакция повлекла за собой образование фиолетового дыма — йода. Дальнейшее охлаждение вещества превращало его в темно-серые кристаллы с ярким блеском. Свою работу по открытию йода Куртуа описывал лично: «В маточном растворе щелока, полученного из водорослей, содержится довольно большое количество необычного вещества. Его легко выделить: для этого достаточно прилить серную кислоту к данному раствору и нагреть смесь в реторте. Новое вещество осаждается в приемнике в виде черного порошка, который при нагревании превращается в пары великолепного фиолетового цвета».Чуть позже (в 1813 г.) уже другой французский химик Жозеф-Луи Гей-Люссак стал рассматривать полученное вещество как химический элемент и дал ему название «йод», что в переводе означает «фиолетовый».
2.Нахождение йода в природе
Йод считается одним из редких элементов: его среднее содержание в земной коре составляет 0,00004% по массе. Однако, несмотря на то, что он не входит в число самых распространенных элементов, он очень сильно рассеян в природе, поэтому присутствует практически везде. Больше всего йода (а именно его йодидов) приходится на морскую воду. Его содержание варьируется в пределах 20-30 мг на тонну воды. Он также наблюдается в морских организмах (животного и неживотного происхождения). Так, морская капуста из всех продуктов питания славится наибольшим его содержанием.В природе йод встречается в виде минералов. Распространенность собственных минералов йода очень мала, поэтому нахождение таких минералов, как лаутарита и йодаргирита — очень редкое явление. Йод находится в нефтяных буровых водах. Эти нефтяные месторождения стали главным источником промышленного получения йода в России. В тех странах, где подобные месторождения отсутствуют, для получения йода распространено использование морских водорослей, маточных растворов чилийской (натриевой) селитры, щелока калийных и селитряных производств.
3.Роль йода в человеческой жизни
Йод известен нам всем. У каждого из нас в домашней аптечке хранится спиртовой раствор йода, применяющийся в качестве антисептического средства. Подсушивая ткани, он прекрасно справляется с обработкой царапин, дезинфекцией ран. Еще один случай применения йода человеком — необходимость в стимуляции притока крови к мягким тканям. Такая надобность возникает часто при ушибах и растяжениях, когда на поверхность кожи наносят йодную сетку. Однако кроме этого, йод играет и важную биологическую роль, рассмотреть которую стоит более подробно.
Биологическая роль йода. Йод — важнейший микроэлемент, незаменимый для нашего организма. Суть всей его биологической роли заключается в участии в процессе синтеза гормонов щитовидный железы (тироксина и трийодтиронина). На данный момент йод — единственный из всех микроэлементов, участвующий в подобных процессах. За счет выработки этих гормонов йод посредством них оказывает на организм очень важные эффекты:
обеспечение нормального энергетического обмена благодаря увеличению количества митохондрий;
влияние на образование более 100 ферментов;
стимуляция образования белка;
участие в обмене жиров, углеводов и витаминов;
усиление действия других гормонов (инсулина, адреналина) во многих обменных процессах;
стимуляция нервной системы.
Это лишь малый перечень все тех функций, в которых участвуют гормоны щитовидной железы, а значит и сам йод.
Содержание йода в организме человека.Человеческий организм содержит в себе примерно 20-35 мг йода. Это количество кажется очень маленьким, но значительность его содержания велика. Йод характеризуется своим неравномерным распространением: меньшая его часть содержится в крови и почках, большая — в щитовидной железе (на нее приходится около половины всего йода). Поступление йода в наш организм в основе осуществляется через пищеварительный тракт. Мы потребляем пищу и воду с содержанием соединений йода (йодидов). Желудочно-кишечный тракт осуществляет всасывание этих вещества, интенсивнее всего — тонкий кишечник. Через легкие йод активно может поступать в зоне прибрежных морских районов, а через кожу его поступление осуществляется в совсем малых количествах. Организм человека характеризуется наличием йода преимущественно в органической форме. Йодиды из протекающей через щитовидную железу крови захватываются А-клетками этой железы. Они и образуют таким образом гормоны Т4, Т3, коллоидальный белок тиреоглобулин — органические соединения йода. В человеческом организме присутствуют и неорганические формы йода: проникновение йодид — ионов через клеточные мембраны осуществляется очень легко, в связи, с чем к неорганическим соединениям йода относят как йодиды внеклеточного пространства и эритроцитов, так и йодиды накапливающих йод желез.
4.Потребность йода в организме
Ежедневная потребность в йоде зависит от возраста и физиологического состояния (период полового созревания, беременность и кормление грудью требуют увеличения количества потребляемого йода). В таблице ниже представлены данные Всемирной организации здравоохранения (ВОЗ) о рекомендуемых суточных дозах йода:
|
Физиологическое состояние/возраст |
Суточная норма потребления |
|
Дети грудного возраста (первые 12 месяцев) |
50 мкг |
|
Дети младшего возраста (от 2 до 6 лет) |
90 мкг |
|
Дети школьного возраста (от 7 до 12 лет) |
120 мкг |
|
Подростки (>12 лет) |
150 мкг |
|
Пожилые люди |
100 мкг |
|
Беременные и кормящие женщины |
г |
5.Дисбаланс йода в организме человека
Гармонии можно добиться только сохранением общего баланса. Это касается и нашего с вами организма. Когда в нем нарушается необходимая концентрация йода, начинают появляться проблемы.
Дефицит йода. Йод — это микроэлемент, который не вырабатывается в организме самостоятельно, он попадает туда с пищей. Недостаточное поступление в организм йода порождает патологию щитовидной железы и нарушение синтеза тиреоидных гормонов. Йододефицитные болезни наблюдаются особо распространенными в горных районах и местах, далеких от моря, так как именно в них концентрация йода наименьшая. А в далеких от морской воды областях живет большая часть людей. Именно поэтому согласно данным ВОЗ самые распространенные неинфекционные заболевания в мире — йододефицитные. Области нехватки йода в почвах, воде, пищи относят к эндемичным по дефициту йода. Эти территории занимают 1,5 млрд людей и практически все жители России.
Часто следующие симптомы становятся показателями йодной недостаточности:
понижается аппетит;
человек быстрее утомляется, ощущает вялость;
выпадают волосы, наблюдаются сухость кожи и проблемы с зубами (их разрушение);
проблемы со слухом, памятью;
головная боль;
иммунитет ослабевает, в результате чего организм легко поражается простудными и инфекционными заболеваниями.
Нельзя сказать по этим симптомам, что йодная недостаточность проявляется с особой характеристикой. Такие признаки люди нередко приписывают простой усталости, отсутствию настроения. А проблема ведь кроется гораздо глубже.Избыток йода. Избыток йода в человеческом организме встречается значительно реже, но тоже имеет место. Обычно количество йода, превышающее норму, наблюдается лишь у работников производства или добычи йода при нарушении санитарных норм для нормальной работы. Так, человек чувствует себя нормально при концентрации паров йода, не завышающей 1мг/м³. Концентрация в 1,5-2 мг/м³ затрудняет работу, а 3 мг/м³ делает ее невозможной. Проблема в том, что йод в больших количествах очень токсичен, он просто отравляет организм. Поэтому при необходимости принятия высоких доз йода по медицинским показаниям, то делать это стоит только в соглашении с рекомендациями врача. Отравление йодом может возникнуть по причине:
вдыхания паров вещества;
введения в организм доз йода, превышающих суточную норму;
длительного приема лекарств с содержанием йода;
индивидуальной непереносимости, проявляющейся даже при минимальном контакте с йодом;
сочетания перечисленных факторов.
Отравление йодом (йодизм) подразделяется на два типа: острое и хроническое. Острое отравление происходит при поступлении в организм большой дозы йода за короткий временной отрезок, когда при хроническом отравлении йод поступает регулярно небольшими дозами на протяжении долгого времени. Такой тип поражает организм годами.
6.Содержание йода в различных продуктах питания
Большинство продуктов питания не может характеризоваться большим содержанием йода. Однако среди них есть малое количество тех продуктов, которые смело можно назвать носителями йода. Рассмотрим их поподробнее.
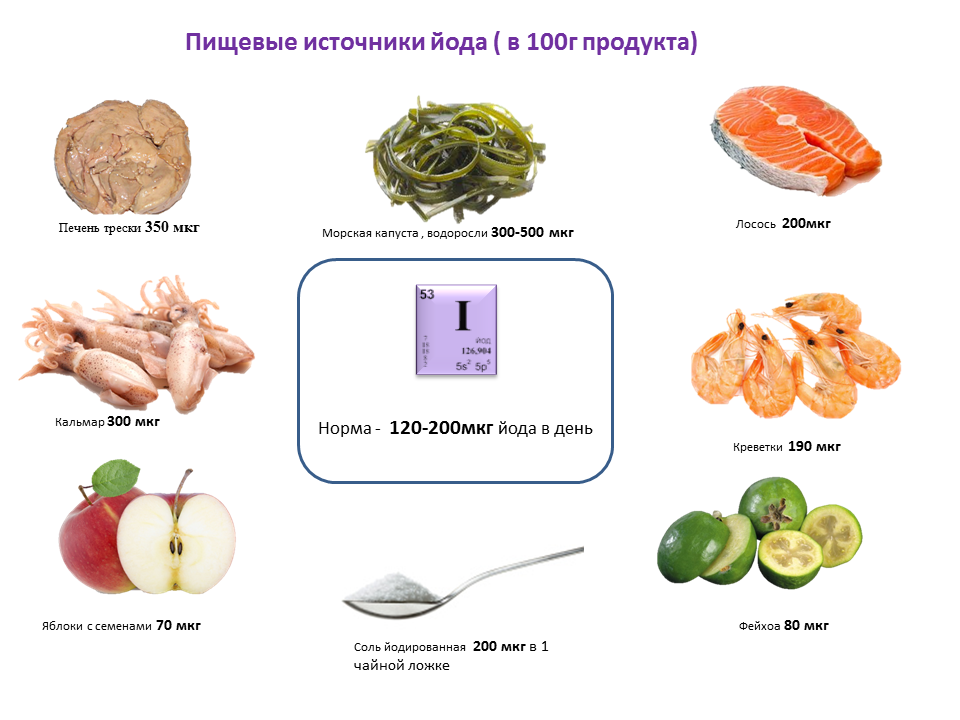
Морепродукты.Морепродукты и растительного, и животного происхождения действительно очень богаты йодом. По количеству его содержания на первом месте стоит морская капуста (ламинария) — бурая водоросль, обитающая в Тихом и Северном Ледовитом океанах. Количество присутствующего в ней йода варьируется в пределах 50-70,000 мкг, что в среднем составляет 0,3% от общей массы. Суточная доза йода набирается при съедании 100-200 г ежедневно. На втором месте после ламинарии стоит морская рыба, в которой содержание йода составляет 70 мкг. Богаты этим элементов и морские гребешки, крабы, мидии, креветки, устрицы. Однако они более доступны для жителей приморских районов.
Йодированные продукты. Сейчас многие продукты йодированы. Поэтому в магазине мы можем встретить йодированную соль, хлебобулочные изделия, молочные продукты, пресноводную рыбу, овощи, выращенные на богатых йодом почвах, с содержанием йода.
Некоторые фрукты и ягода. Содержание йода отмечается в хурме, апельсинах, лимонах, бананах, дыне, винограде, ананасе, клубнике, яблоках.
7.Практическая часть.
7.1.Качественное определение йода в поваренной йодированной соли
Для массовой профилактики йододефицита в России с 1930-х годов была рекомендована йодированная соль.
Мы поставили цели в условиях школьной лаборатории определить качественное содержание иода в образцах пищевой йодированной соли.
Для проведения химических экспериментов я пользовалась материалами и ресурсами школьной лаборатории. Для исследования были приобретены образцы йодированной поваренной соли в магазине расположенном вблизи образовательного учреждения.
Образцы исследования:
образец № 1 (фото 1) – соль натуральная морская пищевая мелкая йодированная «Sea salt» (изготовитель «Salinen Prosol», Словения импортёр ООО «Медитеран», г. Москва), производитель заявляет, что соль содержит иодат калия. Соль упакована в пластиковую банку. Внешний вид – белое крупнокристаллическое вещество.
Фото 1.
образец № 2 (фото 2) – соль пищевая с содержанием натрия+калий, магний, йод (изготовитель ЗАО «Валетек продимпэкт», Московская область, г. Дедовск), производитель заявляет, что соль содержит иодат калия. Соль упакована в металлизированный вакуумный пакет, который помещен в коробку из плотной бумаги. Внешний вид – белое мелкокристаллическое вещество, содержащее дополнительно кристаллы более белого вещества, наблюдается неоднородность.
Фото 2.
образец № 3 (фото 3) – соль йодированная «Зимушка-краса» (изготовитель «Акзо Нобель», Нидерланды, импортёр ООО «Евросоль», г. Санкт-Петербург), производитель заявляет, что соль содержит иодид калия. Соль упакована в пластиковую банку. Внешний вид – белое мелкокристаллическое кристаллическое вещество.
Фото 3.
При приготовлении растворов соли, лучшая растворимость наблюдается у образца № 1
Методика «пятна». Метод основан на определении содержания иода в форме иодата калия. Образование комплексного соединения и окрашивание выделяемого иода с раствором крахмала.
Фото 4. Проведение исследований
Цель исследования: качественное определение содержания иода в исследуемой йодированной соли.
Проведение работы.
Оборудование: колбы, химические стаканы, пробирки, стеклянные палочки.
Реактивы: 1% раствор крахмала, 5% раствор соляной кислоты, 10% раствор иодида калия.
Для проведения эксперимента (фото 4) необходимо приготовили смесь, состоящую из 2 мл раствора крахмала, 25 мл раствора иодида кали и 2 мл раствора соляной кислоты.
Подготовили исследуемые образцы. Используя приготовленную смесь-раствор нанесли на исследуемые образцы. Если йодированная соль содержит соли иодаты, то иодид калия, вступая в окислительно-восстановительную реакцию с иодатом, образует иод – простое вещество, который вступает в реакцию с раствором крахмала и окрашивается в синий цвет. На поверхности образцов солей наблюдается синее окрашивание (фото 5).
Фото 5
Уравнение химической реакции:
KIO3 + 3HCl (разб.) + 5KI → 3I2↓ + 3H2O + 3K2SO4
I2 + раствор крахмала → синее окрашивание
Методика определения иодатов окислением иодида калия.
Метод повторяет определить содержание иода в растворах солей путем окисления иодатов иодидом калия.
Цель исследования: качественное определение содержания иода в исследуемой йодированной соли.
Проведение работы.
Оборудование: колбы, химические стаканы, пробирки, стеклянные палочки.
Реактивы: 10% растворы поваренной соли, 1% раствор крахмала, 5% раствор соляной кислоты, 10% раствор иодида калия.
Для проведения эксперимента приготовили 10% растворы исследуемых образцов. К данным растворам добавили по 5мл раствора иодида калия, по 5 мл раствора соляной кислоты. Колбы с исследуемыми растворами закрыли стеклом и поставили в темное место на 10 минут. По истечении времени добавили по 5 мл раствора крахмала.
Растворы исследуемых образцов приобрели ярко выраженный синий цвет (фото 6), что показывает на содержание иода в форме иодата калия.
Фото 6.
Уравнение химической реакции:
KIO3 + 3HCl (разб.) + 5KI → 3I2↓ + 3H2O + 3K2SO4
I2 + раствор крахмала → синее окрашивание
7.2.Качественное определение йода в отварах продуктах питания
Для качественного определения содержания йода в отварах пищевых продуктов я использовала методику определения йодидов окислительно-восстановительными реакциями (фото 7).
Фото 7. Проведение исследований
Для проведения реакций мне понадобились следующие пищевые продукты: клюква, хурма, морская капуста (сушеная ламинария) и гречка (крупа) – фото 8.
Используя методики определения иодатов, обнаружили, что только морская капуста (ламинария) содержит иодаты (фото 9).
Фото 8. Исследование отваров пищевых продуктов на иодаты: (слева направо) клюква, хурма, ламинария, греча.
Методика определения иодидов окислительно-восстановительными реакциями.
Фото 9. Продукты питания
Цель исследования: качественное определение содержания иода в исследуемых пищевых продуктах, используя их отвары.
Проведение работы. Оборудование: колбы, стеклянные палочки, реактивы: 1% раствор крахмала, 3% раствор пероксида водорода, 5% раствор перманганата калия, 10% раствор серной кислоты.
Приготовили отвары пищевых продуктов (фото 10). Отвары профильтровали (фото 11).
Фото 10. Подготовка отваров.
Фото 11. Отфильтрованные отвары: клюква, хурма, ламинария, греча
Предполагаем, что растворимые соли, перешли в раствор.
Реакция с пероксидом водорода в нейтральной среде.
К 2 мл исследуемого фильтрата прилили 1 мл раствора перекиси водорода, 2-3 капли крахмального клейстера (фото 12).
Уравнение химической реакции
2KI+H2O2→ I2+2KOH
Фото 12.
Реакция с пероксидом водорода в кислой среде.
К 2 мл исследуемого фильтрата прилили 2 капли раствора серной кислоты и раствор перекиси водорода.
Уравнение химической реакции
2KI+H2O2+H2SO4→ I2+K2SO4+2H2O
Признаки: изменение окраски исследуемого раствора, посинение при добавлении раствора крахмала, что свидетельствовало об образовании комплексного соединения йода с крахмалом, что показывает на содержание иода в форме иодидов.
3. Реакция с перманганатом калия в кислой среде:
К 2мл исследуемого раствора прилили подкисленный раствор перманганата калия.
Уравнения химических реакций
10KI+2KMnO4+8H2SO4→ 5I2+2MnSO4+6K2SO4+8H2O
Наблюдали исчезновение окраски, появление желтого оттенка, посинение при добавлении крахмала, что показывает на содержание иода в форме иодидов (фото 13).
Фото 13.
Вывод: Используя отвары пищевых продуктов можно определить содержание иода в форме иодатов и иодидов.
III.Заключение
В своем исследовании мы выяснили, что содержание йода в организме очень важно, но нельзя допускать его недостатка, а также переизбытка, оба случая опасны. Проблема йододефицита существует и является актуальной. Недостаток йода в организме приводит к развитию многих заболеваний, а также существенно снижает умственные способности учащихся. Проблема дефицита йода имеет социальное значение и может влиять на снижение интеллектуального, образовательного и профессионального потенциала нации.
С целью профилактики йододефицитных состояний в питании учащихся в обязательном порядке 1-2 раза в неделю должна включаться рыба, морепродукты, приготовление блюд обязательно с применением йодированной морской соли.
Считаю, что для улучшения ситуации по данной проблеме необходимо вести и просветительскую работу среди населения. Надеюсь, что сведения, представленные мною в данной работе заставят задуматься учащихся гимназии. Следите за содержанием йода в организме и будете здоровы!
IV.Список используемых источников и литературы
Барков С. А. Галогены и подгруппа марганца. Пособие для учащихся. М. »Просвещение», 1976 с112.
Глинка Н. Л. Общая химия: учебное пособие для ВУЗов – 26 – е изд; под ред. В. А. Рабиновича. – Л.: Химия, 1987 с 704.
Кукушкин Ю. Н. Химические элементы в организме человека. Санкт – Петербургский государственный технологический институт. Соросовский Образовательный журнал №5,1998г с 55.
Орлов Д. С. Московский государственный университет им. М.В. Ломоносова. Микроэлементы в почвах и живых организмах. Соросовский образовательный журнал № 1, 1998 г с 61.
Пышнограева И. Химия. Справочник школьника. М. »Слово», 1995 с 147.
Полная энциклопедия народной медицины Т1. »АНС», 1996 г под ред. Непокойчицкого Г. А.
Щеглова А.В. «Йод – ваш домашний доктор»Изд. 2, Рипол Классик, 2010 (Здоровье)
Ресурсы Интернет:
https://science-start.ru/ru/article/view?id=449
https://moydietolog.ru/yod
V.ПриложениеТаблица № 1. Содержание йода в продуктах питания.
|
Продукт |
Содержание йода вмкг на 100 г продукта |
Продукт |
Содержание йода в мкг на 100 г продукта |
|
Печень трески |
370 |
Овес |
20 |
|
Пикша |
245 |
Треска |
130 |
|
Замороженное рыбное филе |
27 |
Сайда |
200 |
|
Хлеб (специальный) |
до 31 |
Шампиньоны |
18 |
|
Морской окунь |
145 |
Свекла |
6,8 |
|
Креветки свежие |
190 |
Капуста |
6,5 |
|
Сельдь свежая |
92 |
Брокколи |
15 |
|
Цельное молоко |
до 19 |
Фасоль |
12,5 |
|
Устрицы сырые |
60 |
Шпинат |
12 |
|
Гречка |
3,5 |
Картофель |
5,8 |
|
Масло сливочное |
9 |
Говядина |
11,5 |
|
Молочные продукты |
до 11 |
Морковь |
6,5 |
|
Пресноводная рыба |
74 |
Рожь |
8,3 |
|
Пшеничная мука |
до 10 |
Лосось |
200 |
|
Яйца (1шт, 50 г) |
до 18 |
Камбала |
190 |
|
Хлеб обычный |
9 |
Свинина |
16,7 |
|
Твердые сыры |
11 |
Горох |
10,5 |
Просмотров работы: 11089
Волошка Дарья 11 класс
Эссе по теме «Неметаллы:Йод»
I.Введение
Иод знают все. Порезав палец, мы тянемся к склянке с иодом, точнее с его спиртовым раствором. Но не все знают насколько важно содержание иода в нашем организме. Иод является очень сильным антисептическим препаратом. Однако иод служит не только для смазывания ссадин и царапин. Хотя иода в человеческом организме всего 25 мг, он играет важную роль. Большая часть «человеческого иода» находится в щитовидной железе: он входит в состав вещества, которое регулирует обмен веществ в организме. При недостатке иода задерживается физическое и умственное развитие и возникает болезнь, называющаяся эндемический зоб. Это случается в высокогорных районах, где естественное содержание иода в воздухе, воде и пище очень низкое.
II.Основная часть
Иод – химический элемент VII группы периодической системы Менделеева. Атомный номер — 53. Относительная атомная масса 126,9045±0,0001. Галоген. Из имеющихся в природе галогенов – самый тяжёлый, если, конечно, не считать радиоактивный короткоживущий астат. Практически весь природный иод состоит из атомов одного – единственного изотопа с массовым числом 127, его содержание в земной коре 4 . 10—5% по массе. Радиоактивный иод – 125 образуется в ходе естественных радиоактивных превращений. Из искусственных изотопов иода важнейшие – иод-131 и иод-133: их в основном используют в медицине.
I2 – галоген. Темно-серые кристаллы с металлическим блеском. Летуч. Плохо растворяется в воде, хорошо – в органических растворителях (с фиолетовым или коричневым окрашиванием раствора) или в воде с добавкой солей – иодидов. Слабый окислитель и восстановитель. Реагирует с концентрированными серной и азотной кислотами, металлами, неметаллами, щелочами, сероводородом. Образует соединения с другими галогенами.
Молекула элементного иода, как и прочих галогенов, состоит из двух атомов. Иод – единственный из галогенов – находится в твёрдом состоянии при нормальных условиях. Красивые тёмно – синие кристаллы иода больше всего похожи на графит. Отчётливо выраженное кристаллическое строение (приложение 3), способность проводить электрический ток – все эти «металлические» свойства характерны для чистого иода
Открытие иода
Конец XVII и начало XVIII века были отмечены в Европе непрекращающимися войнами. Требовалось много пороха и, следовательно, много селитры. Производство селитры приняло невиданные масштабы, наряду с обыкновенным растительным сырьём в дело шли и морские водоросли. В них и обнаружили новый химический элемент.
Одним из французских селитроваров был химик и промышленник Бернар Куртуа (1777–1838), он был весьма наблюдательным человеком. Считается, что именно это помогло ему в 1811 г. стать первооткрывателем нового химического элемента иода. Однажды он заметил, что медный котёл, в котором выпаривался щелок, полученный из фукуса, ламинарий и других бурых водорослей, быстро разрушается, как будто его разъедает какая – то кислота. Куртуа решил выяснить, в чём тут дело. Осадив и удалив из раствора соли натрия, он выпарил раствор, обнаружил в котле сульфид калия и чтобы разложить его, прилил к осадку концентрированной серной кислоты – и тут появился фиолетовый дым. Куртуа повторил опыт, на этот раз в реторте, и в приёмнике реторты осели блестящие чёрные пластинчатые кристаллы.
Иодид натрия из водорослей, взаимодействуя с серной кислотой, выделяет иод I2; одновременно образуется сернистый газ – диоксид серы SO2 и воду:
2NaI + 2H2SO4 = I2 + SO2+ Na2SO4 + 2H2O
При охлаждении пары иода превращались в темно-серые кристаллы с ярким блеском. Куртуа писал: «В маточном растворе щелока, полученного из водорослей, содержится довольно большое количество необычного вещества. Его легко выделить: для этого достаточно прилить серную кислоту к данному раствору и нагреть смесь в реторте… Новое вещество осаждается в приемнике в виде черного порошка, который при нагревании превращается в пары великолепного фиолетового цвета».
Название новому элементу присвоил в 1813 году французский химик Жозеф-Луи Гей-Люссак (1778–1850) за фиолетовый цвет его паров («иодос» по-гречески значит «фиолетовый»). Он же получил многие производные нового элемента – иодоводород HI, иодноватую кислоту HIO3, оксид иода(V) I2O5, хлорид иода ICl и другие. Практически одновременно элементарную природу иода доказал и английский химик Гэмфри Дэви (1778–1829).
Распространение в природе
Среднее содержание иода в земной коре 4*10-5% по массе. В мантии и магмах и в образовавшихся из них породах (гранитах, базальтах) соединения иода рассеяны; глубинные минералы иода неизвестны. История иода в земной коре тесно связана с живым веществом и биогенной миграцией. В биосфере наблюдаются процессы его концентрации, особенно морскими организмами (водорослями, губками). Известны 8 гипергенных минералов иода, образующихся в биосфере, однако они очень редки. Основным резервуаром иода для биосферы служит Мировой океан (в 1 литре в среднем содержится 5*10-5 грамм иода). Из океана соединения иода, растворенные в каплях морской воды, попадают в атмосферу и переносятся ветрами на континенты. Местности, удаленные от океана или отгороженные от морских ветров горами, обеднены иодом. Иод легко адсорбируется1 органическими веществами почв и морских илов. При уплотнении этих илов и образовании осадочных горных пород происходит десорбция, часть соединений иода переходит в подземные воды. Так образуются используемые для добычи иода иодо — бромные воды, особенно характерные для районов нефтяных месторождений (местами 1 литр этих вод содержит свыше 100 мг иода).
Адсорбция – связывание одного вещества на поверхности другого вещества, как правило, твёрдого тела.
Физические и химические свойства
Плотность иода 4,94 г/см3, tпл 113,5 °С, tкип 184,35 °С. Молекула жидкого и газообразного иода состоит из двух атомов (I2). Заметная диссоциация I2 ⇔ 2I наблюдается выше 700 °С, а также при действии света. Уже при обычной температуре иод испаряется, образуя резко пахнущий фиолетовый пар. При слабом нагревании иод возгоняется, оседая в виде блестящих тонких пластинок; этот процесс служит для очистки иода в лабораториях и в промышленности. Иод плохо растворим в воде (0,33 г/л при 25 °С), хорошо — в сероуглероде и органических растворителях (бензоле, спирте), а также в водных растворах иодидов.
Конфигурация внешних электронов атома иода 5s2 5p5. В соответствии с этим проявляет в соединениях переменную валентность (степень окисления): -1 (в HI, KI); +1 (в HIO, KIO); +3 (в IСl3); +5 (в НIO3, КIO3); и +7 (в HIO4, KIO4). Химически иод довольно активен, хотя и в меньшей степени, чем хлор и бром. С металлами иод при легком нагревании энергично взаимодействует, образуя иодиды (Hg + I2 = HgI2). С водородом иод реагирует только при нагревании и не полностью, образуя йодистый водород. Элементный иод — окислитель, менее сильный, чем хлор и бром. Сероводород H2S, тиосульфат натрия Na2S2O3 и другие восстановители восстанавливают его до I- (I2 + H2S = S + 2НI). Хлор и другие сильные окислители в водных растворах переводят его в IO3-. При растворении в воде иода частично реагирует с ней; в горячих водных растворах щелочей образуются иодид и иодат. Адсорбируясь на крахмале, иод окрашивает его в темно-синий цвет; это используется в иодометрии и качественном анализе для обнаружения иода. Пары иода ядовиты и раздражают слизистые оболочки. На кожу иод оказывает прижигающее и обеззараживающее действие. Пятна от иода смывают растворами соды или тиосульфата натрия.
Получение
Сырьем для промышленного получения иода в России служат нефтяные буровые воды (приложение 2); за рубежом – морские водоросли, а также маточные растворы чилийской (натриевой) селитры, содержащие до 0,4% иода в виде иодата натрия. Для извлечения иода из нефтяных вод (содержащих обычно 20 – 40 мг/л иода в виде иодидов) на них сначала действуют хлором или азотистой кислотой. Выделившийся иод либо адсорбируют активным углем, либо выдувают воздухом. На иод, адсорбированный углем, действуют едкой щелочью или сульфитом натрия. Из продуктов реакции свободный иод выделяют действием хлора или серной кислоты и окислителя, например дихромата калия. При выдувании воздухом иод поглощают смесью двуокиси серы с водяным паром и затем вытесняют иод хлором. Сырой кристаллический иод очищают возгонкой.
Иод в организме
Иод – необходимый для животных и человека микроэлемент. В почвах и растениях таёжно-лесной нечерноземной, сухостепной, пустынной и горных биогеохимических зон. Иод содержится в недостаточном количестве или не сбалансирован с некоторыми другими микроэлементами (Са, Mn, Cu); с этим связано распространение в этих зонах эндемического зоба. Среднее содержание иода в почвах около 3*10-4%, в растениях около 2*10-5%. В поверхностных питьевых водах иода мало (от 10-7 до 10-9%). В приморских областях количество иода в 1 м3 воздуха может достигать 50 мкг, в континентальных и горных – составляет 1 или даже 0,2 мкг.
Поглощение иода растениями зависит от содержания в почвах его соединений и от вида растений. Некоторые организмы (так называемые концентраторы иода, например морские водоросли – фукус, ламинария, филлофора, накапливают до 1% иода, некоторые губки – до 8,5% (в скелетном веществе спонгине). Водоросли, концентрирующие иод, используются для его промышленного получения. В животный организм иод поступает с пищей, водой, воздухом. Основной источник иода – растительные продукты и корма. Всасывание иода происходит в передних отделах тонкого кишечника. В организме человека накапливается от 20 до 50 мг иода, в том числе в мышцах около 10 – 25 мг, в щитовидной железе в норме 6 – 15 мг. С помощью радиоактивного иода (I131 и I125) показано, что в щитовидной железе иод накапливается в митохондриях эпителиальных клеток и входит в состав образующихся в них алл — и моноиодтирозинов, которые конденсируются в гормон тетраиодтиронин (тироксин). Выделяется иод из организма преимущественно через почки (до 70 – 80% ), молочные, слюнные и потовые железы, частично с жёлчью.
В различных биогеохимических провинциях содержание иода в суточном рационе колеблется (для человека от 20 до 240 мкг, для овцы от 20 до 400 мкг). Потребность животного в иода зависит от его физиологического состояния, времени года, температуры, адаптации организма к содержанию иода в среде. Суточная потребность в иоде человека и животных – около 3 мкг на 1 кг массы (возрастает при беременности, усиленном росте, охлаждении). Введение в организм иода повышает основной обмен, усиливает окислительные процессы, тонизирует мышцы.
В связи с большим или меньшим недостатком иода в пище и воде применяют иодирование поваренной соли, содержащей обычно 10 – 25 г йодистого калия на 1 тонну соли. Применение удобрений, содержащих иод, может удвоить и утроить его содержание в сельскохозяйственных культурах. Кроме иодирования соли в последние годы стали широко применять иодирование других продуктов. Иод добавляют в некоторые хлебобулочные изделия, молоко, всё большее распространение получают так называемые БАДЫ «биологически активные добавки», содержащие иод, такие как Иод – актив, Иодомарин, Цыгапан, Кламин, и некоторые другие. Одним из самых известных препаратов для восполнения содержания иода в организме считается «Иод – актив». Мы обязаны появлению этого препарата Павлу Флоренскому. Как инженер он был жёстким и расчётливым реалистом. А вот к науке у него с детства была огромная страсть. Павлу Флоренскому было 10 лет, когда он впервые прочёл книгу Фарадея. И Майкл стал его кумиров на всю жизнь. У Флоренского никогда не было сомнений, кто открыл иод конечно Фарадей! Не случайно последним открытием Флоренского, стала формула уникального иодистого препарата, способного оберегать человека от тяжелых болезней. Открытие великого русского учёного имеет планетарное значение. Ведь проблема нехватке иода волнует граждан во всём мире. Дефицитом иода страдают около 1,5 миллиардов человек. В том числе в России от недостатка иода страдает около 70% населения. Беда, точнее катастрофа, бушует на планете. Из – за постоянной нехватки иода люди порой не блещут умом, даже взрослые. Такие люди, отличаются взрывным характером, а потому часто терпят неудачи на работе и в личной жизни. Учёные Всемирной организации здравоохранения уже однозначно пришли к выводу, что коэффициент интеллекта IQ напрямую зависит от содержания иода в организме. В нашем городе применение, таких добавок очень актуально так как, в почве, и соответственно в продуктах очень маленькое содержание иода. Поэтому для сохранения здоровья и интеллектуального потенциала населения, недостаток иода нужно восполнять
История открытия
Йод был открыт в 1811 году французским химиком Бернаром Куртуа (1777—1838). Одна из первых его работ в начале 1800-х годов состояла в том, чтобы помочь своему отцу в изготовлении соединений натрия и калия (нитрат калия, KNO3) из морских водорослей.
Куртуа и его отец собирали водоросли на побережьях Нормандии и Бретани во Франции. Затем они жгли их и смачивали пепел водорослей в воде, чтобы растворить соединения натрия и калия. Однажды в 1811 году Бернар добавил серную кислоту и увидел фиолетовые пары, которые конденсировались, образуя кристаллы с металлическим блеском. Куртуа догадался, что это был новый элемент, который он назвал в честь его цвета (на греческом языке слово «иодес» означает «фиолетовый»).
Куртуа дал небольшое количество этого вещества Шарлю-Бернару Десормесу и Николя Клеману, которые провели систематическое расследование. В ноябре 1813 года они выставили йод в Императорском институте в Париже. То, что это действительно новый элемент, было доказано Джозефом Гей-Люссаком и подтверждено Хамфри Дэви, который отправил отчёт в Королевское учреждение в Лондоне, где ошибочно предположили, что он был первооткрывателем, и это убеждение сохранялось более 50 лет.
Основная информация
Йод является важным элементом, необходимым для жизни. Он наиболее известен своей ролью в выработке гормонов щитовидной железы у людей, а также у всех позвоночных. Дефицит йода может привести к серьёзным проблемам со здоровьем, включая зоб (увеличение щитовидной железы), умственную отсталость и кретинизм.
В качестве чистого элемента он представляет собой блестящий пурпурно-чёрный неметалл, твёрдый при стандартных условиях. Он легко переходит из твёрдого в газообразное состояние, минуя жидкую форму, и выделяет пурпурный пар. Хотя это технически неметалл, он обладает некоторыми металлическими качествами. Основными характеристиками элемента являются:
- Название: Йод.
- Символ: I.
- Атомный номер: 53.
- Атомная масса: 126,90447 а. е. м.
- Температура плавления: 113,5 °C.
- Температура кипения: 184,0 °C.
- Электронная формула йода (Электронная конфигурация): 1s22s22p63s23p63d104s24p64d105s25p5.
- Строение атома: количество протонов — 53, электронов — 53, нейтронов — 74.
- Валентность переменная: -1, +1, (+3), (+4), +5, +7.
- Классификация: галоген.
- Кристаллическая структура: ромбическая.
- Плотность при 20°C: 4,93 г / см3.
- Цвет: чёрно-серый.
Физические свойства
Йод является одним из самых ярких и красивых элементов. Как твёрдое вещество, это тяжёлый, серовато-черный, металлический материал. Среди его основных физических свойств можно выделить:
- При нагревании не плавится. Вместо этого он испаряется. Сублимация — это процесс, при котором твёрдое вещество превращается непосредственно в газ без предварительного плавления. Образующийся пар йода имеет фиолетовый цвет и резкий запах. Если в эти пары помещается холодный объект, йод снова превращается в твёрдое вещество. Образует привлекательные, нежные металлические кристаллы.
- Растворяется в воде лишь незначительно. Но он растворяется во многих других жидкостях, образуя характерные пурпурные растворы.
- При нагревании в надлежащих условиях его можно заставить испаряться при 113,5°C и закипеть при 184 °C. Плотность элемента составляет 4,93 грамма на кубический сантиметр.
- Имеет умеренное давление паров при комнатной температуре, и в открытом сосуде медленно сгущается до глубоких фиолетовых паров, которые раздражают глаза, нос и горло (высококонцентрированный йод является ядовитым и может нанести серьёзный ущерб коже и тканям.) По этой причине йод лучше всего взвешивать в закупоренной бутылке. Для приготовления водного раствора флакон может содержать раствор йодида калия, что значительно снижает давление паров йода.
Химические свойства
Как и другие галогены, йод является активным элементом. Однако он менее активен, чем три галогена, стоящие над ним в периодической таблице. Основные химические свойства йода:
- Его наиболее распространёнными соединениями являются щелочные металлы, натрий и калий. Но он также образует соединения с другими элементами, в том числе с галогенами. Некоторыми примерами являются монобромид йода (IBr), монохлорид йода (ICl) и пентафторид йода (IF 5).
- Молекулярная решётка йода содержит дискретные двухатомные молекулы, которые также присутствуют в расплавленном и газообразном состояниях. Выше 700 °C диссоциация на атомы йода становится заметной.
- Молекула элемента может действовать, как кислота Льюиса в том смысле, что она сочетается с различными основаниями Льюиса. Взаимодействие, однако, слабое, и лишь немногие твёрдые комплексные соединения были выделены. Они легко обнаруживаются в растворе и называются комплексами с переносом заряда. Например, йод слабо растворяется в воде и даёт желтовато-коричневый раствор. Коричневые растворы также образуются со спиртом, эфиром, кетонами и другими соединениями, действующими, как основания Льюиса через атом кислорода.
- Даёт красный раствор в бензоле, который рассматривается, как результат другого типа комплекса с переносом заряда. В инертных растворителях, таких как четырёххлористый углерод или сероуглерод, получаются растворы фиолетового цвета, которые содержат несогласованные молекулы йода.
- Реагирует также с йодид-ионами, поскольку последние могут действовать, как основания Льюиса, и по этой причине растворимость элемента в воде значительно повышается в присутствии йодида. При добавлении йодида цезия кристаллический трийодид цезия может быть выделен из красновато-коричневого водного раствора.
- Образует синий комплекс с крахмалом, и этот цветовой тест используется для обнаружения небольших количеств йода.
- Это более слабый окислитель, чем бром, хлор или фтор.
- Легко соединяется с большинством металлов и некоторыми неметаллами с образованием йодидов. Например, серебро и алюминий легко превращаются в их соответствующие йодиды, а белый фосфор легко объединяется с йодом.
- Водный раствор йодистого водорода (HI), известный как йодистоводородная кислота, является сильной кислотой, которая используется для приготовления йодидов путём реакции с металлами или их оксидами, гидроксидами и карбонатами.
- Проявляет степень окисления +5 в умеренно сильной йодной кислоте (HIO 3), которая может быть легко обезвожена с образованием белого твёрдого пентоксида йода (I 2 O 5).
Наличие в природе
Йода не очень много в земной коре. По оценкам, его количество составляет от 0,3 до 0,5 частей на миллион. Он находится в нижней трети элементов, с точки зрения изобилия. Но, тем не менее, он более распространён, чем кадмий, серебро, ртуть и золото. Его содержание в морской воде ещё меньше — около 0,0003 частей на миллион.
Этот элемент, как правило, концентрируется в земной коре лишь в нескольких местах, когда-то покрытых океанами. За миллионы лет океаны испарились и оставили химические соединения, которые были растворены в них и сегодня существуют под землёй, как соляные копи.
Существует возможность собирать этот элемент из морской воды, солоноватой воды, рассола или морских водорослей. Морская вода имеет разные названия, в зависимости от количества растворенных в ней твёрдых веществ. Водоросли являются популярным источником йода, так как поглощают элементы из морской воды. Со временем они начинают иметь гораздо более высокую концентрацию йода, чем морская вода. Морскую водоросль собирают, сушат и сжигают для сбора вещества. Процесс мало чем отличается от того, который использовал Куртуа в 1811 году.
Изотопы элемента
Известен только один природный изотоп элемента — йод-127. Изотопы — это две или более формы элемента. Они отличаются друг от друга по их массовому числу. Число, написанное справа от названия элемента, является массовым числом. Оно представляет количество протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого одного элемента может варьироваться. Каждая вариация является изотопом.
Примерно 30 радиоактивных изотопов йода были изготовлены искусственно. Это такие изотопы, которые распадаются на части и выделяют некоторую форму радиации. Они образуются, когда очень маленькие частицы обжигают атомы. Эти частицы прилипают к атомам и делают их радиоактивными.
Применение изотопов
Ряд изотопов йода имеет коммерческое использование. В медицинских целях они вводятся в организм пациента через рот, а затем проходят через тело в кровотоке. Когда они путешествуют, то излучают радиацию. Это излучение обнаруживается с помощью рентгеновской плёнки. Медицинский специалист может сказать, насколько хорошо организм функционирует, наблюдая диаграмму направленности. Изотопы йода используются и в следующих целях:
- Йод-123 — в исследованиях мозга, почек и щитовидной железы.
- Йод-125 — для исследования поджелудочной железы, кровотока, печени, поглощения минеральных веществ в костях и потери белков в организме.
- А йод-131 — при исследованиях печени, почек, кровотока, лёгких, мозга, поджелудочной железы.
Наиболее распространённым изотопом является йод-131. При попадании в организм он имеет тенденцию поступать непосредственно в щитовидную железу, а затем используется для выработки гормонов щитовидной железы.
Получение и нахождение
Этот элемент коммерчески производится из йодсодержащих рассолов. Природные рассолы или рассолы, извлечённые из нефтяных скважин, содержащие до 150 мг на литр (0,02 унции на галлон), обнаружены в Яве, Калифорнии и северной Италии. В число ведущих мировых производителей входят Чили, Япония, Китай, Россия и Азербайджан.
Примеси, такие как глина, песок и масло, удаляются фильтрацией, а раствор пропускается через поток диоксида серы, а затем через несколько контейнеров, в которых содержатся пучки медной проволоки. Образующийся йодид меди удаляют фильтрацией, промывают водой, сушат и тонко измельчают. Продукт нагревают с карбонатом калия, получая йодид калия, который затем окисляют до свободного элемента дихроматом и серной кислотой.
Использование и применение
Около 2/3 всего йода и его соединений используется в системах санитарии или в производстве различных антисептиков и лекарств. Вещество также используется для изготовления красителей, фотоплёнки и специального мыла. Он применяется в некоторых отраслях промышленности в качестве катализатора — вещества, используемого для ускорения или замедления химической реакции. Он не претерпевает никаких изменений во время реакции.
Элемент может оказывать как благоприятное, так и неблагоприятное воздействие на живые организмы. Он имеет тенденцию убивать бактерии и другие болезнетворные организмы. Это свойство вещества вызывает его использование в системах санитарии и в качестве антисептика — химического вещества, останавливающего рост микробов.
Настойка йода всегда была одним из самых популярных антисептических препаратов Её наносили на порезы и раны, чтобы предотвратить заражение. Сегодня она часто заменяется другими антисептиками.
Одной из причин того, что сегодня настойка используется реже, является то, что она также может вызвать проблемы. В более высоких дозах йод может раздражать или сжигать кожу. Он также может быть довольно ядовитым, если принимать его внутрь, поэтому важно использовать его согласно инструкции.
Другими важными областями применения йода являются:
- Поскольку он преобразуется в тироксин в щитовидной железе, небольшое его количество имеет важное значение для организма, который содержит в среднем 14 мг (0,00049 унции) элемента. Тироксин — это гормон, необходимый для поддержания нормального обмена веществ во всех клетках организма. Он способен возбудить нервную систему, в особенности кору головного мозга и промежуточный мозг. Во многих местах питьевая вода содержит достаточно йода для этой цели.
- Элемент и его соединения широко используются в аналитической химии. Многие процедуры основаны на выделении или поглощении йода и его последующем титровании с тиосульфатом натрия (йодометрия). Ненасыщенность жиров (то есть количество двойных или тройных связей между атомами углерода) определяется добавлением свободного йода (йодного числа).
- Используется в фотографии, как йодид серебра и йодид калия.
- Йодид серебра также применяется для посадки облаков, чтобы вызвать дождь.
- Используется в производстве красителей.
Биологическая роль
Йод является важным элементом для людей, которым требуется суточное его потребление в количестве около 0,1 мг. Максимальная безопасная для здоровья доза единовременного потребления — 0.5 г (500 мкг). Тело человека содержит до 20 миллиграмм этого элемента, главным образом в щитовидной железе, которая помогает регулировать рост и температуру тела.
Обычно люди получают достаточно йода из пищи, которую они едят. Дефицит же этого микроэлемента может вызвать опухоль щитовидной железы (известный, как зоб). Зоб вызывает большой комок в шее, поскольку щитовидная железа выходит из-под контроля. (Он может вырасти до размера виноградного плода.) Зоб пытается производить гормоны щитовидной железы, но он не получает достаточного количества йода из рациона человека, поэтому продолжает расширяться, пытаясь сделать свою работу.
Недостаток йода может вызвать и другие проблемы. Например, гормоны щитовидной железы необходимы для нормального развития мозга у нерожденного ребёнка и продолжения этого развития после рождения. Люди, которые не включают в свой рацион достаточного количества микроэлемента, не развиваются нормально.
Сегодня эксперты говорят, что низкий уровень йода является основной причиной умственной отсталости, глухоты, мутизма (неспособности говорить) и паралича. К менее серьёзным проблемам относятся сонливость, неуклюжесть и неспособность к обучению.
Количество йода в организме человека очень мало. Для определения его количества вес человека делится на 2 500 000. Полученное число и есть вес элемента в организме. Для нормальных людей эта сумма примерно равна размеру головки булавки, но эта крошечная точка может иметь большое значение для здоровья.
Низкий уровень микроэлемента может быть легко исправлен. Сегодня в большинстве развитых стран компании, производящие поваренную соль, добавляют небольшое количество йодида калия (KI) в соль, которая обозначается «йодированная соль». Люди, которые её используют, получают необходимое количество для нормальной работы щитовидной железы.
Но те, кто живет в развивающихся странах, могут не получать йодированной соли. Всемирная организация здравоохранения (ВОЗ) пытается найти способы обеспечения микроэлементом этих людей. По оценкам ВОЗ, 1,5 млрд человек живут в районах с низким уровнем йода. До 20 млн из этих людей могут иметь психические расстройства из-за его недостатка. ВОЗ начала программу по обеспечению будущего поколения в таких регионах этим микроэлементом, необходимым для нормального развития и функционирования.
Комитет по делам образования города
Челябинска
МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ
ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «ГИМНАЗИЯ № 10 г. ЧЕЛЯБИНСКА»
Проектная
работа
«Йод
в организме человека»
Тип
проекта: исследовательский
Выполнила:
Власова
Вероника
Михайловна
ученица
9 «б» класса
Руководитель
проекта: Шумовская
Людмила
Петровна
Челябинск,
2020г.
Содержание
Введение 3
Основная часть 5
I. Теоретическая часть 5
I.1 Йод и его в жизни
человека 5
I.2 Роль йода в
промышленности 6
I.3 Химические
характеристики 7
I.4 Дефицит
йода 8
I.5 Избыток йода
9
I.6 Получение йода 10
II. Практическая часть 11
II.1 Способы определения
недостатка йода 11
II.2 Проверка способов 13
Заключение 14
Список источников 15
Приложения 16
Введение
Мало кто задумывался, что йод играет огромную роль в нашей жизни. Йод — микроэлемент,
необходимый для нормального роста и развития человека и животных. Попадая в
организм, йод избирательно накапливается в щитовидной железе, где проходит
сложный путь превращений и становится составной частью гормонов: тироксина и
трийодтиронина. Сегодня йододефицит самое распространенное заболевание,
распространяемое неинфекционным путем, что приводит к умственному отставанию
всей нации. Человеческий организм без йода, как без воды существовать не может.
Щитовидная железа – самый йодонасыщенный орган в организме человека. Для
нормальной деятельности железы необходимо определенное количество йода,
нехватка «строительного материала» для гормонов становится причиной тяжелых
болезней и различных патологий. Медицина — главная
область применения устойчивого изотопа йода, где он используется для лечения
зоба, для предупреждения атеросклероза и при лечении ряда болезней внутренних
органов и нервной системы. Это главная, но не единственная область его
применения.
Цель моего проекта:
Изучить
роль йода в жизни человека
Задачи
проекта:
1) Найти продукты с высоким содержанием йода.
2) Узнать, к каким последствиям может привести избыток и
недостаток йода.
3) Проверить способы выявление недостатка или избытка йода в
организме.
Актуальность моего проекта: Выбранная мною тема «Йод в
организме человека» актуальна для всех нас: в настоящее время в нашей стране
остро встали проблемы численности населения и продолжительности жизни. Здоровый
образ жизни, правильное питание, уровень развития медицины, общая грамотность
населения, социальные условия – вот те главные слагаемые, которые всегда, во
все времена будут определяющими в здоровье и жизни человека. Что значит
грамотно относиться к своему организму? Это, прежде всего, знать, что может
спровоцировать те или иные заболевания. Может ли сам человек, хотя бы отчасти,
быть «кузнецом своего здоровья»? Думаю, что да. Чем больше мы знаем, тем меньше
не допускаем того, что может повредить нашему здоровью.
Продукт проекта: памятка
«Продукты, содержание йод»
I. Теоретическая часть
I.1 Йод и его роль в жизни человека
Йод был открыт Куртуа в 1811 году. В медицинскую практику введен с 1820 года.
В природе йод находится обычно в виде органических и неорганических соединений,
однако может находиться и в свободном состоянии в воздухе. Добывается йод из
золы морских водорослей (ламинария) и из чилийской селитры. Йод входит в состав
всех растений. Некоторые морские растения пузырчатая водоросль и морская губка
обладают способностью концентрировать йод.
Йод является природным химическим
элементом, так же, как кислород, водород и железо. Все пронизано йодом: твердая земля, горные породы и даже
самые чистые кристаллы прозрачного горного хрусталя или исландского шпата
содержат в себе довольно много атомов йода», — и поэтому А.Е. Ферсман
назвал йод «элементом со сказочными свойствами». Он естественно
присутствует в некоторых продуктах питания, добавлен в другие продукты питания
и доступен, как пищевая добавка. Йод является питательным веществом и очень
важен для полноценного здоровья на всех этапах жизни. Он необходим для
нормального функционирования щитовидной железы, особенно до и во время
беременности, а также у кормящих матерей, для нормального развития мозга у
плода и у новорожденного. Когда йод поступает в кровь, щитовидная железа
абсорбирует то его количество, которое требуется для выработки её гормонов,
которые, в свою очередь, выделяются в кровь и доставляются в разные участки
тела. Каждой клетке, в каждой ткани и органе требуются гормоны щитовидной
железы, которые помогают телу правильно использовать энергию, а также принимают
участие в сохранении тепла и исправной работе головного мозга, сердца, мышц и
других органов.
Эндемический зоб – это увеличение
щитовидной железы, вызванное дефицитом йода в организме.
I.2 Роль йода в промышленности
Галогены используются в химической
промышленности, для очистки воды и отходов, в производстве пластмасс,
фармацевтических препаратов, целлюлозы и бумаги, тканей, смазочных
материалов. Бром, хлор, фтор и йод служат химическими промежуточными
звеньями, отбеливающими и дезинфицирующими средствами.
В морской воде, а также во всём, что растёт и плавает в
морях и океанах, много йода. Именно поэтому диетологи настоятельно
рекомендуют включать в
рацион что-нибудь, выросшее в солёных водах, хотя бы морскую капусту. Кстати,
долгое время йод в промышленных масштабах получали именно из морских
водорослей. Вдоль берегов строили специальные печи, в которых сжигали дары
морей, а получившуюся золу, в которой было до 5% йода, отправляли на дальнейшую
переработку. Однако в двадцатом веке такой способ уступил место экстракции йода
из подземных солевых вод. В природе же остался ещё один естественный канал
поступления йода на сушу – через атмосферу. Вода, испаряющаяся с поверхности
моря, содержит пусть и небольшой, но разнообразный набор солей и других
химических веществ, в том числе и соединения йода. Подхваченный воздушными
массами такой водяной пар может переноситься на десятки и даже сотни километров
вглубь территории, где конденсируется и выпадает вместе с дождём, избавляя
местных жителей от проблем с йододефицитом.
I.3
Химические характеристики:
- порядковый N
— 53 - атомный вес —
126,932 (приложение А, В)
В настоящее время известно несколько искусственных радиоактивных изотопов йода
с массовыми числами 125, 128, 130, 131, 132, 133 и 135. Наибольшее значение в
практическом отношении имеет радиоактивный изотоп 131, также использоваться и
радиоактивные изотопы 132 и 133. Изотоп йода 131 был выделен в 1938 г.
Ливингудом и Сиборгом из теллура, облученного нейтронами и дейтронами. Затем он
был обнаружен Абельсоном в продуктах деления урана и, наконец, в продуктах
деления тория 232. Изотоп йода является бета- и гамма-излучателем с
периодом полураспада 8дней. Наиболее широкое применение получил изотоп
йода 131 в медицине, где его применяют для определения функции щитовидной
железы, а также для лечения ряда ее заболеваний (гипертиреоза, злокачественных
новообразований и др.). Способность некоторых веществ, содержащих йод,
накапливаться в опухолевых тканях, нашла себе применение в использовании таких
веществ с радиоактивными изотопами йода для точного определения местоположений
опухолей в мозгу.
У йода только один устойчивый
изотоп, которому обязаны все известные соединения, в том числе и гормон.
Попробуйте представить, что произошло бы в случае нарушения устойчивости
некоторых элементов, например йода. Жидкий йод
хорошо растворяет серу, селен, теллур и
йодиды многих металлов, образуя с йодидами комплексные соединения. В воде
частично гидролизован, с другими галогенами образует межгалогенные соединения.
Пары йода токсичны, раздражают
слизистые оболочки.
I.4 Дефицит йода
Зачастую в развитии многих заболеваний щитовидной железы виноват длительный
йодный дефицит. Больше всего от недостатка йода страдают дети и женщины во
время беременности. Поэтому им обязательно нужно принимать препараты,
содержащие йод. Существует несколько симптомов, означающих нехватку йода
(Приложение В)
Наиболее легкий путь насыщения организма йодом предлагает нам
отечественная фармацевтика. Сейчас всюду рекламируют препараты «Йодомарин»,
«Йод — актив», «Йод — баланс». И реклама в этом случае абсолютно
объективна – это действительно полезные йодсодержащие препараты. Сравнительный
анализ показал, что из препаратов самым выгодным является «Йодомарин»,
несмотря на кажущуюся высокую стоимость препарата. К тому же этот
препарат в инструкции по применению содержит сведения о дополнительном
положительном влиянии на организм. .
I.5
Избыток йода в организме
Многие люди самостоятельно «прописывают» себе йодосодержащие таблетки – тем
более что они находятся в свободной продаже. Делать этого нельзя: переизбыток
йода опаснее, чем его недостаток. Передозировка этого микроэлемента может
привести к хроническому воспалению в щитовидной железе и ее гиперфункции (когда
щитовидная железа вырабатывает слишком много гормонов). Избыток йода в организме может наблюдаться при гипертиреозе —
общий уровень йода резко повышается. Щитовидная железа не сильно увеличивается,
но может развиться и базедова болезнь с зобом, экзофтальмом, тахикардией. Кроме
этого наблюдается раздражительность, мышечная слабость, потливость, исхудание,
склонность к диарее.
Элементарный йод очень токсичен. Ранними симптомами отравления являются рвота,
сильные боли в животе и диарея. Смерть наступает вследствие шока от раздражения
большого количества нервных окончаний.
При действии паров йода ( в условиях
производства) наблюдается кашель, слезотечение, конъюнктивит, опухание
околоушных желез, головные боли, шум в ушах, головокружения. Последствиями
хронического отравления являются катар слизистых оболочек и общее расстройство
питания.
I.4
Получение йода
Первоначально йод извлекали из морских водорослей и из
отходов селитренного производства. Впоследствии стали использовать различные
(йонитные, угольные и др.) методы очистки подземных вод, нефтяных и
газовых месторождений. Сырой йод очищают возгонкой.
Получение
йода в лабораториях:
(
действие окислителя на йодиды)
2NaNO2 + 2NaI + 2H2SO4 = I2 + 2NO + 2NaHSO4 + 2H2O.
2NaI + 2H2SO4
= I2 + SO2+ Na2SO4 + 2H2O
Получение йода в промышленности:
Основные источники получения йода – морские водоросли и
нефтяные буровые воды:
2NaI
+ MnO2 + 3H2SO4 = I2 +
2NaHSO4 + MnSO4 + 2H2O.
II.
Практическая часть
II.1
Способы определения недостатка йода
Я составила список найденных мною способов определения
недостатка йода в домашних условиях.
Способ 1
Йодная
сетка
Всего за десять рублей можно провести диагностику в
домашних условиях. Делается это просто — на обычную спичку наматывается ватный
шарик. Окунаем его в раствор йода и рисуем на ноге небольшую сеточку размером в
два-три сантиметра. Теперь важно проследить, когда она исчезнет. Если йодная
сетка впиталась в кожу через час или через несколько часов — вам явно не
хватает этого микроэлемента. Если продержалась больше суток, йода в вашем
организме в избытке.
Способ 2
Посмотрите внимательно на свои ноги. А точнее на
большие пальцы. Мозоль или огрубевшая кожа на внешней части больших пальцев ног
свидетельствует о нарушении обменных процессов в организме, патологии
щитовидной железы и, естественно, йодной недостаточности.
Способ 3
Интересный способ. Люди с дефицитом йода испытывают
потребность к любви к фиолетовому цвету. Психологи
установили, что предпочтение цвету паров йода – фиолетовому – отдают люди,
подверженные усталости.
Способ 4
Самый надежный анализ- это сдача крови в специальной
лаборатории ТТГ и Т4 (щитовидная железа). Анализ крови на содержание
тиреотропного гормона необходимо проходить раз в 2-3 года, чтобы знать, как
функционирует щитовидная железа.
II.2
Определение недостатка йода в домашних условиях и лаборатории
Я захотела проверить способы определения недостатка йода, найденные мною.
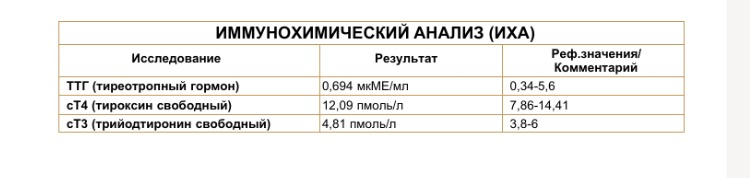
Недавно в лаборатории я сдавала анализ на содержание йода в организме. Самый надежный анализ- это сдача крови в специальной
лаборатории ТТГ и Т4 (щитовидная железа). Анализ крови на содержание
тиреотропного гормона необходимо проходить раз в 2-3 года, чтобы знать, как
функционирует щитовидная железа.
Оказалось, что в моем организме имеется недостаток йода. Мне стало интересно,
смогу ли я выявить недостаток йода с помощью других способов определения. И
так, согласно итогу анализа, йодная сетка должна впитаться за несколько часов.
1 способ – йодная сетка
В домашних условиях данный опыт будет очень
интересен. Йодная сетка исчезла у меня спустя сутки. Содержание йода в
организме в норме. Этот способ знают многие. (приложение Д)
2 и 3 способ
Этот способ неверен. Я не люблю фиолетовый цвет. Я
предпочитаю другие оттенки палитры цветов. И указанной огрубевшей кожи тоже
нет. Следовательно, выявить этими путями недостаток йода нельзя.
4 способ — анализ на ТТГ и Т4
Я сдала анализ на содержание тиреотропного гормона.
Он выявил у меня Эутериоз. Это состояние, при котором уровни тиреоидных (Т3/Т4)
и тиреотропного гормонов не выходят за пределы нормы. То есть, содержание йода
у меня в норме. (приложение Г)
В
заключение своего опыта могу сказать что йодная сетка впиталась в руку спустя
сутки. Это как и в анализе означает, что содержание йода в моем организме в
норме. Эксперимент с проверкой способов удался.
Заключение
Несмотря что йод в организме человека содержится в
необычайно малых количествах(25 мг и в течение жизни
(75 лет) требуется всего 1 чайная ложка), его
роль очень велика. Тяжелая
экологическая ситуация, возрастание стрессовых ситуаций, методы обработки продуктов
питания, «убивающие» биологически активные вещества, — вот далеко не полный
перечень причин повсеместного роста дефицита жизненно важных элементов и
избытка токсичных, наносящих непоправимый вред здоровью. У каждого металла своя
дозировка. Малейшие ее колебания влияют на самочувствие людей. Таким образом
каждый химический элемент вносит свою лепту в состояние нашего организма. И
если этого элемента в организме в избытке или, наоборот, его не хватает, то
человек начинает жаловаться на различного рода недомогания.
В заключение, хочу сказать, что человек должен отслеживать показания элементов
в организме, ведь недостаток или же избыток любого элемента в организме может
привести к плохим последствиям.
Список
использованных источников
1.Л.Ю.
Аликберова. «Занимательная химия», Дрофа, 1999-200с.
2
О.С. Габриелян – ХИМИЯ, 8 класс. Дрофа, 2015- 287с.
3.О.С.
Габриелян – ХИМИЯ, 9 класс. Дрофа, 2015- 290с.
4.Габриелян
О.С. «Настольная книга учителя химии». 9 класс, М.: Блик и К°, 2001
5.В.И.
Добрынина, Е.Я. Свешникова. «Руководство к практическим занятиям по
биологической химии», Медицина, 1977
6.М.Колтун.
«Мир химии» – М.: Детская литература, 1988
7.И. Неумывакин – «Йод. Мифы и реальность», 2017-192с
8.Йод,
наука и жизнь. [Электронный ресурс]. – Режим доступа: https://m.nkj.ru/periodic/l
9.Эндемический
зоб. [Электронный ресурс]. – Режим доступа: https://ru.wikipedia.org/wiki/
10.Йод
свойства и применение. [Электронный ресурс]. – Режим доступа:
http://www.mining-enc.ru/j/jod-/
Приложения
Приложение А «Йод в
таблице Д.И. Менделеева»
Приложение Б (Периодическая
система Д.И. Менделеева)
Приложение В симптомы
нехватки йода
|
I |
· |
Приложение Г ( Анализ на
Т3/Т4)
Приложение Д (Йодная
сетка)
Скачано с www.znanio.ru
Подборка по базе: 2.3.1 Роль языка в жизни общества Сагиев Шерхан РДиГБ 22-1К.docx, Интернет в жизни подростков.docx, Здоровый Образ Жизни.pptx, Эссе по философии Смысл жизни человека.docx, Реферат Кравец В.А. Рациональное питание как критерий здорового , Реферат на тему Роль народных музыкальных инструментов в жизни б, Урок по русскому языку на тему _Еда в жизни человека_ (8 класс)., Х-8 Предмет химии. Роль химии в жизни человека.pptx, Роль культурного человека в жизни.docx, новый Урок КСП 8 класс Вода- источник жизни.docx
Государственное бюджетное общеобразовательное учреждение города Москвы «Школа № 2094»
Реферат на тему:
Йод в нашей жизни
Работу выполнила ученица 9 «Л» класса:
Касимова Александра
Москва
2021
Содержание
-
Введение 3
-
Название и обозначение 4
-
История 4
-
Нахождение в природе 5
-
Физические свойства 6
-
Химические свойства 6
-
Применение в медицине 6
-
Применение в криминалистике 7
-
Применение в технике 8
-
Биологическая роль 9
-
Йод и щитовидная железа 9
-
Токсичность 10
-
Дефицит йода в организме человека 11
-
Избыток йода в организме человека 14
-
-
Способы определения недостатка йода 15
-
Продукты, содержащие йод 15
-
Заключение 17
-
Список литературы 17
- Введение
Цель работы
Выявить влияние микроэлемента йода на здоровье человека.
Задачи:
- Выяснить влияние йода на здоровье человека.
- Определить продукты питания, которые содержат йод.
- Дать рекомендации по использованию продуктов, которые содержат йод.
Актуальность.
В настоящее время йододефицитные заболевания являются наиболее распространенными неинфекционными заболеваниями человека. По данным ВОЗ, около 85% населения России проживают в районах с дефицитом йода. По химическому составу почва большинства территорий России бедна йодом. Кроме того, большую роль в развитии йододефицита за последние годы сыграли значительные изменения в характере питания россиян. Снизилось потребление морской рыбы и морепродуктов, богатых йодом, а также мяса и молочных продуктов, содержание йода в которых относительно высоко.
Рис. Йодное обеспечение населения Земли к началу XXI века (по данным ВОЗ) [IDD NEWSLETTER. 2003; 19 (2): 24–5].
Кроме того, большую роль в увеличении уровня заболеваемости играет неосведомленность населения о простейших способах профилактики заболеваний щитовидной железы. Так, согласно результатам проведенного в девяти регионах России широкомасштабного исследования общественного мнения по проблеме заболеваний от йододефицита, оказалось, что самая большая проблема — слабая информированность населения. Респонденты плохо представляют, какую угрозу для здоровья несет недостаток йода в питании. Две трети опрошенных понятия не имеют, как защитить себя и близких от йодной недостаточности. А между тем йод является важнейшим элементом. От него зависят процессы роста, развития и общего тонуса; полноценное развитие половых желез, формирование различных мозговых функций, отвечающих за интеллект, и многие другие функции нашего организма.
К сожалению, йод относится к микроэлементам, которые организм не способен вырабатывать самостоятельно. Он находится в почве и морской воде в виде йодида. Его содержание в почве, как правило, невелико. В результате все растения имеют недостаточное содержание йода. Это обусловливает тяжелую йодную недостаточность у значительной части населения мира, живущей натуральным хозяйством. Это относится и ко многим регионам России. Таким образом, с пищей мы получаем йод в минимальном количестве, а в питьевой воде его еще меньше.
- Название и обозначение
И
Рис. Элементарный иод
Название элемента предложено Гей-Люссаком и происходит от др.-греч. ἰο-ειδής (букв. «фиалкоподобный»), что связано с цветом пара, который наблюдал французский химик Бернар Куртуа, нагревая маточный рассол золы морских водорослей с концентрированной серной кислотой. В медицине и биологии данный элемент и простое вещество обычно называют йодом, например, «раствор йода», в соответствии со старым вариантом названия, существовавшим в химической номенклатуре до середины XX века.
- История
С

- Нахождение в природе
Й
Сырьём для промышленного получения иода в России служат нефтяные буровые воды, тогда как в зарубежных странах, не обладающих нефтяными месторождениями, используются морские водоросли, а также маточные растворы чилийской (натриевой) селитры, щёлок калийных и селитряных производств, что намного удорожает производство иода из такого сырья.
Типичная концентрация иода в подземных рассолах (где он существует обычно в форме иодида натрия) составляет 30…150 ppm. Оцененные запасы иода в рассолах составляют 5 млн тонн в Японии, 0,25 млн тонн в США, 0,1 млн тонн в Индонезии и 0,36 млн тонн суммарно в Туркменистане, Азербайджане и России. Запасы иода в чилийских залежах каличе (известковых вторичных отложений с примесями нитратов, хлоридов, иодатов и других растворимых солей в пустыне Атакама, где он присутствует в виде иодата кальция Ca(IO3)2) составляют 1,8 млн тонн. Кроме того, отмечается возможность добычи иода из морских водорослей (запасы около 4 тыс. тонн в Японии). Суммарная оценка запасов иода составляет 7,5 млн тонн, не считая морской воды (34,5 млн тонн), прямая добыча иода из которой экономически невыгодна ввиду низкой концентрации — менее 0,05 ppm.
- Физические свойства
Йод при обычных условиях — твердое чёрно-серое вещество с металлическим блеском и специфическим запахом. Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях, например в бензоле — в отличие от бурого раствора в полярном спирте. Йод при комнатной температуре представляет собой темно-фиолетовые кристаллы со слабым блеском. При нагревании при атмосферном давлении он сублимируется (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении пары йода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки йода от нелетучих примесей.
- Химические свойства
Свободный йод проявляет чрезвычайно высокую химическую активность. Он вступает во взаимодействие почти со всеми простыми веществами. Особенно быстро и с выделением большого количества теплоты протекают реакции соединения йода с металлами.
С водородом реагирует только при достаточно сильном нагревании и не полностью, так как начинает идти обратная реакция — разложение иодоводорода:
H2 + I2 = 2HI — 53,1 кДж
Растворяется в растворах иодидов, образуя неустойчивые комплексы. Со щелочами диспропорционирует, образуя иодиды и гипоиодиты. Азотной кислотой окисляется до иодной кислоты.
Если к желтоватому водному раствора йода добавить сероводородной воды (водный раствор H2S), то жидкость обесцвечивается и становится мутной от выделившейся серы:
H2S + I2 = S + 2HI
В соединениях проявляет степени окисления -1, +1, +3, +5, +7.
- П
рименение в медицине
5-процентный спиртовой раствор иода используется для дезинфекции кожи вокруг повреждения (рваной, резаной или иной раны), но не для приёма внутрь при дефиците иода в организме. Продукты присоединения иода к крахмалу (т. н. «Синий йод» — Йодинол, Йокс, Бетадин и др.) являются более мягкими антисептиками.
При большом количестве внутримышечных инъекций на их месте пациенту делается йодная сетка — йодом рисуется сетка на площади, в которую делаются инъекции (например, на ягодицах). Это нужно для того, чтобы быстро рассасывались «шишки», образовавшиеся в местах внутримышечных инъекций.
В рентгенологических и томографических исследованиях широко применяются йодсодержащие контрастные препараты.
Иод-131, как и некоторые радиоактивные изотопы иода (125I, 132I), применяется в медицине для диагностики и лечения заболеваний щитовидной железы[2]. Изотоп широко применяется при лечении диффузно-токсического зоба (болезни Грейвса), некоторых опухолей.
Й
Йодкалиевый растворр Люголя применяют при окраске микроорганизмов по методу Грама, для окрашивания фибрина крови, для выявления некоторых пигментов (каротиноиды), жировых веществ и пр. Гликоген окрашивается йодом в коричневый цвет, амилоид — в различные оттенки бурого и буро-красного цвета.
- Применение в криминалистике
В

- Применение в технике
Й
В галогеновых лампах — в качестве компонента газового наполнителя колбы для осаждения испарившегося вольфрама нити накаливания обратно на неё.
металлогалогеновых дуговых лампах — в качестве газовой среды разряда используются галогениды ряда металлов, использование различных смесей которых позволяет получать лампы с большим разнообразием спектральных характеристик.
Производство аккумуляторов: йод используется в качестве компонента положительного электрода (окислителя) в литиево-ионных аккумуляторах для автомобилей.
Л
- Биологическая роль
Йод — важнейший микроэлемент, незаменимый для нашего организма. Суть всей его биологической роли заключается в участии в процессе синтеза гормонов щитовидный железы (тироксина и трийодтиронина). На данный момент йод — единственный из всех микроэлементов, участвующий в подобных процессах. За счет выработки этих гормонов йод посредством них оказывает на организм очень важные эффекты:
- обеспечение нормального энергетического обмена благодаря увеличению количества митохондрий;
- влияние на образование более 100 ферментов;
- стимуляция образования белка;
- участие в обмене жиров, углеводов и витаминов;
- усиление действия других гормонов (инсулина, адреналина) во многих обменных процессах;
- стимуляция нервной системы.
- Это лишь малый перечень все тех функций, в которых участвуют гормоны щитовидной железы, а значит и сам йод.
-
Йод и щитовидная железа
У животных и человека иод входит в состав так называемых тиреоидных гормонов, вырабатываемых щитовидной железой, — тироксина и трииодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма.
В организме человека (масса тела 70 кг) содержится 12—200 мг иода; содержание иода в организме человека (общее) — порядка 0,0001 %. Суточная потребность человека в иоде определяется возрастом, физиологическим состоянием и массой тела. Для человека среднего возраста нормальной комплекции (нормостеник) суточная доза иода составляет 0,15 мг.
Отсутствие или недостаток иода в рационе (что типично для некоторых местностей) приводит к заболеваниям (эндемический зоб, кретинизм, гипотиреоз). В связи с этим к поваренной соли, поступающей в продажу в местностях с естественным геохимическим дефицитом иода, с профилактической целью добавляют иодид калия, иодид натрия или иодат калия (иодированная соль).
Недостаток иода приводит к заболеваниям щитовидной железы (например, к базедовой болезни, кретинизму). Также при небольшом недостатке иода отмечается усталость, головная боль, подавленное настроение, природная лень, нервозность и раздражительность; слабеет память и интеллект. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Избыток иода в пище обычно легко переносится организмом, однако в отдельных случаях у людей с повышенной чувствительностью этот избыток может также привести к расстройствам щитовидной железы.
-
Токсичность
Йод в виде свободного вещества ядовит. Смертельная доза (LD50) — 3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров иода появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании на слизистую оболочку глаз появляется слезотечение, боль в глазах и покраснение. При попадании внутрь появляется общая слабость, головная боль, повышение температуры, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день появляется кровь в моче. Через 2 дня появляются почечная недостаточность и миокардит. Без лечения наступает летальный исход.
ПДК йода в воде 0,125 мг/дм³, в воздухе 1 мг/м³. Иод относится ко II классу токсичности (высокоопасен) согласно ГОСТ 12.1.007-76[27].
Радиоактивный иод-131 (радиойод), являющийся бета- и гамма-излучателем, особенно опасен для организма человека, так как радиоактивные изотопы биохимически не отличаются от стабильных. Поэтому почти весь радиоактивный иод, как и обычный, концентрируется в щитовидной железе, что приводит к её облучению и дисфункции. Основным источником загрязнения атмосферы радиоактивным иодом являются атомные станции и фармакологическое производство. В то же время это свойство радиоиода позволяет использовать его для борьбы с опухолями щитовидной железы и диагностики её заболеваний.
- Дефицит йода в организме человека
Физиологические потребности в ЙОДЕ согласно Методическим рекомендациям МР 2.3.1.2432-08 о нормах физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации:
Верхний допустимый уровень 600 мкг/сутки.
Физиологическая потребность для взрослых – 150 мкг/сутки.
Физиологическая потребность для детей – от 60 до 150 мкг/сутки.
Таблица 1. Рекомендуемая суточная норма потребления йода в зависимости от возраста (мкг):
| Возраст | Суточная потребность в йоде, (мкг) | |
| Грудные дети | 0 — 3 мес. | 60 |
| 4 — 6 мес. | 60 | |
| 7 — 12 мес. | 60 | |
| Дети
от 1 года до 11 лет |
1 — 3 | 70 |
| 3 — 7 | 100 | |
| 7 — 11 | 120 | |
| Мужчины
(мальчики, юноши) |
11 — 14 | 130 |
| 14 — 18 | 150 | |
| > 18 | 150 | |
| Женщины
(девочки, девушки) |
11 — 14 | 150 |
| 14 — 18 | 150 | |
| > 18 | 150 | |
| Беременные | 220 | |
| Кормящие | 290 |
Таблица 2. Суточная потребность в йоде по данным ВОЗ:
| Возрастные периоды | Потребность в йоде |
| Дети до года | 90 мкг |
| Дети 2-6 лет | 110 – 130 мкг |
| Дети 7-12 лет | 130 – 150 мкг |
| Подростки и взрослые | 150 – 200 мкг |
| Беременные и кормящие женщины | 250 – 300 мкг |
| *Верхний предел безопасного уровня потребления йода — 1000 мкг/сут |
В природе химический элемент ЙОД распространен крайне неравномерно – где-то его вполне достаточно, а где-то ощущается его острая нехватка. Больше всего его присутствует в воде, воздухе и почве морских районов, а вот в гористой местности, на территориях с подзолистыми и сероземными почвами его недостаточно. Существует даже такое понятие, как «районы, эндемичные по дефициту йода».
Наибольшее количество йода – основного компонента гормонов щитовидной железы – поступает в организм с пищей и водой, но усваивается ею лишь около 40% йода, а остальная его часть выводится с мочой. Если его в организме не хватает, щитовидная железа начинает работать в экстремальном режиме, уровень ее гормонов в крови снижается. Т.е. основная причина широкого распространения йододефицитных заболеваний заключается именно в алиментарном факторе, который зачастую зависит от территории проживания.
Йод относится к микроэлементам питания: суточная потребность в нем составляет всего 100-200 мкг (1 мкг — 1 миллионная часть грамма), а за всю жизнь человек потребляет 3-5 граммов йода, что эквивалентно содержимому одной (!) чайной ложки.
Особое биологическое значение йода заключается в том, что он является составной частью молекул гормонов щитовидной железы: тироксина (Т4), содержащего 4 атома йода, и трийодтиронина (ТЗ), в составе которого 3 атома йода:
 |
 |
| Тироксин (Т4)
молекулярная формула: C15H11I4NO4 |
Трийодтиронин (Т3)
молекулярная формула: C15H11I3NO4 |
Часто люди даже и не подозревают о наличии у них дефицита йода в той или иной мере. Они просто недоумевают, почему они так раздражительны, либо наоборот очень подавлены, быстро утомляются, нуждаются в длительном восстановлении сил, имеют нарушения сна, часто подхватывают инфекционные заболевания, имеют нарушения половых функций, тратят массу сил, времени и денег на залечивание локальных проявлений йододефицита и селенодефицита. В отличие от недостаточности основных компонентов питания (белков, жиров и углеводов), дефицит йода не имеет подчас внешне выраженного характера. Поэтому он получил название «скрытый голод».
Рис. Симптомы нехватки йода (йододефицита) в организме
Йододефицитные заболевания (ЙДЗ) — расстройства, связанные с дефицитом йода, которые рассматриваются Всемирной организацией здравоохранения (ВОЗ) как наиболее распространённые во всем мире заболевания неинфекционного характера.
Пациентов с умеренным йододефицитом преследует чувство постоянного недосыпания. Вследствие метаболических нарушений увеличивается вес, причем, ограничивающие диеты в данном случае практически неэффективны. В крови возрастает уровень холестерина, поэтому повышается риск гипертонической болезни, ИБС и атеросклеротических поражений магистральных кровеносных сосудов. У многих больных страдает моторика желчевыводящих путей (появляется дискинезия) и формируются конкременты (камни) в желчном пузыре. У пациенток с дефицитом йода чаще диагностируются дисменорея, мастопатия и миомы матки. Нередки случаи женского бесплодия.
Таблица 3. Симптомы дефицита йода
| Основные симптомы ЙДЗ | Симптомы неврологического кретинизма | Симптомы умеренного дефицита йода |
|
|
|
В России йододефицит и увеличение щитовидной железы наиболее широко представлены: в Верхнем и Нижнем Поволжье, на Севере и в Центральном районе Европейской части, в Сибири и на Дальнем Востоке, на Урале, Алтае и Кавказе. Особенно остро встала эта проблема после аварии на Чернобыльской АЭС. Ведь йод – единственный известный сейчас радиопротектор («защитник» от радиации). Все «чернобыльцы» сразу после аварии получали препараты йода. И сейчас их потребность в йоде в десятки раз выше, чем у обычных людей. Поэтому у проблемы йод-дефицита две стороны: первая – тотальный дефицит йода в питании; вторая – повышенная потребность в йоде из-за высокого радиационного фона и загрязнений окружающей среды радионуклидами после Чернобыля.
-
Избыток йода в организме человека
Избыток йода в человеческом организме встречается значительно реже, но тоже имеет место. Обычно количество йода, превышающее норму, наблюдается лишь у работников производства или добычи йода при нарушении санитарных норм для нормальной работы. Так, человек чувствует себя нормально при концентрации паров йода, не завышающей 1мг/м³. Концентрация в 1,5-2 мг/м³ затрудняет работу, а 3 мг/м³ делает ее невозможной. Проблема в том, что йод в больших количествах очень токсичен, он просто отравляет организм. Поэтому при необходимости принятия высоких доз йода по медицинским показаниям, то делать это стоит только в соглашении с рекомендациями врача. Отравление йодом может возникнуть по причине:
- вдыхания паров вещества;
- введения в организм доз йода, превышающих суточную норму;
- длительного приема лекарств с содержанием йода;
- индивидуальной непереносимости, проявляющейся даже при минимальном контакте с йодом;
- сочетания перечисленных факторов.
Отравление йодом (йодизм) подразделяется на два типа: острое и хроническое. Острое отравление происходит при поступлении в организм большой дозы йода за короткий временной отрезок, когда при хроническом отравлении йод поступает регулярно небольшими дозами на протяжении долгого времени. Такой тип поражает организм годами.
Симптомы избытка йода:
- Раздражение слизистых дыхательных путей, которое проявляется кашлем, першением, наличием слизистого отделяемого из носа.
- Раздражение конъюнктивы: слезотечение, покраснение глаз. В ряде случаев воспалительный процесс может затягиваться. Формируются хронические конъюнктивиты, реже катаракта, повреждения зрительного нерва, со временем снижается зрение.
- Слюнотечение, это следствие раздражения и отека слюнных желез.
- Поражение кожи при избытке йода называется йододерма. Чаще встречается на коже лица, шеи, конечностей. Проявляется в виде угревой сыпи, сопровождающейся зудом или жжением. Угревые элементы склонны к слиянию. После этого образуются мягкие болезненные образования сине-багрового цвета до 3 см в диаметре. Так же поражение кожи может быть в виде крапивницы, по типу рожистого воспаления. При контакте кожи с йодом в виде кристаллов могут возникнуть ожоги или дерматит. Ожоги достаточно глубокие. В ряде случаев образуются трудно заживающие язвенные дефекты.
-
Способы определения недостатка йода
№ 1. Обмакнув ватную палочку в спиртовой раствор йода, нанесите йодную сетку на любой участок кожи, кроме области щитовидной железы. На следующий день внимательно рассмотрите это место. Если вы ничего не обнаружите, то ваш организм нуждается в йоде, если следы йода останутся – у вас нет йододефицита.
№ 2. Перед тем как ложиться спать, нанесите на кожу в области предплечья три линии йодного раствора длиной 10 см: тонкую, чуть толще и самую толстую. Если утром исчезла только первая линия – с йодом у вас все в порядке. Если исчезли первые две – обратите внимание на состояние здоровья. А если не осталось ни одной линии – у вас явный недостаток йода в организме
№3 Посмотрите внимательно на свои ноги. А точнее на большие пальцы. Мозоль или огрубевшая кожа на внешней части больших пальцев ног свидетельствует о нарушении обменных процессов в организме, патологии щитовидной железы и, естественно, йодной недостаточности.
№4 Люди с дефицитом йода испытывают потребность к любви к фиолетовому цвету. Психологи установили, что предпочтение цвету паров йода – фиолетовому – отдают люди, подверженные усталости.
№5 Самый надежный анализ — это сдача крови в специальной лаборатории ТТГ и Т4 (щитовидная железа). Анализ крови на содержание тиреотропного гормона необходимо проходить раз в 2-3 года, чтобы знать, как функционирует щитовидная железа.
-
Продукты, содержащие йод
Низкий уровень микроэлемента может быть легко исправлен. Сегодня в большинстве развитых стран компании, производящие поваренную соль, добавляют небольшое количество йодида калия (KI) в соль, которая обозначается «йодированная соль». Люди, которые её используют, п
Большую часть йода человек получает с пищей, но это составляет около 90%, остальное количество доступно только для жителей прибрежных районов, где воздух богат данным минералом. Для лучшего всасывания йода в организм человека должны поступать в необходимом количестве следующие элементы и минералы: витамины E и A, медь, цинк, железо, белок.
Кладовая йода содержится в морских продуктах питания, около 400 мкг, а также в свежей пресноводной рыбе — 250 мкг. В молочных и растительных продуктах содержится всего от 6 до 11 мкг минерала. В качестве дополнительных источников можно использовать йод-бромистые и йодистые минеральные воды.
Продукты содержащие йод, теряют около половины минерала при тепловой обработке. Для того чтобы уменьшить его потери, следует плотно закрывать крышку при варке и наливать минимальное количество воды. Длительное кипячение разрушает более чем 50% от общего количества йода, содержащегося в продуктах.
Растительные источники йода
- Овощи — салат зелёный, свекла, редис, картофель, помидоры, морковь, баклажан;
- Фрукты — апельсины, виноград, яблоки, груши, абрикос, хурма, слива;
- Бобовые — фасоль, горох;
- Ягоды — вишня, крыжовник, чёрная смородина;
- Злаки — пшеница, гречка, пшено, рис.
Животные источники йода
- Морепродукты — креветки, ламинария;
- Рыба — тунец, треска;
- Молочные продукты — кефир, коровье молоко, сметана, сливки, сыр, творог;
- Куриное яйцо.
-
Заключение
Содержание йода в организме очень важно, но нельзя допускать его недостатка, а также переизбытка, оба случая опасны. Проблема йододефицита существует и является актуальной. Недостаток йода в организме приводит к развитию многих заболеваний, а также существенно снижает умственные способности учащихся. Проблема дефицита йода имеет социальное значение и может влиять на снижение интеллектуального, образовательного и профессионального потенциала нации.
С целью профилактики йододефицитных состояний в питании в обязательном порядке 1-2 раза в неделю должна включаться рыба, морепродукты, приготовление блюд обязательно с применением йодированной морской соли..
-
Список литературы
Ресурсы Интернет:
- https://school-science.ru/5/13/35314
- http://42.rospotrebnadzor.ru/content/777/98760/
- https://studfile.net/preview/6706979/page:3/
- https://бмэ.орг/index.php/ЙОД
- http://polyguanidines.ru/a_hlorgeksidin&yod&6.htm
- https://cyberleninka.ru/article/n/nekotorye-voprosy-ispolzovaniya-parov-yoda-i-ozono-vozdushnoy-smesi-v-operativno-rozysknoy-deyatelnosti-dlya-polucheniya-sledov-paltsev
- https://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/IOD_V_PRIRODE.html
- https://nauka.club/khimiya/yod.html
- https://ru.wikipedia.org/wiki/Иод













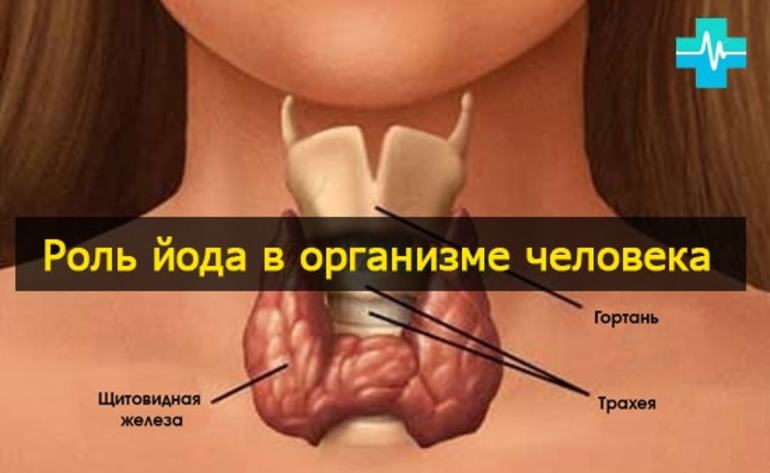



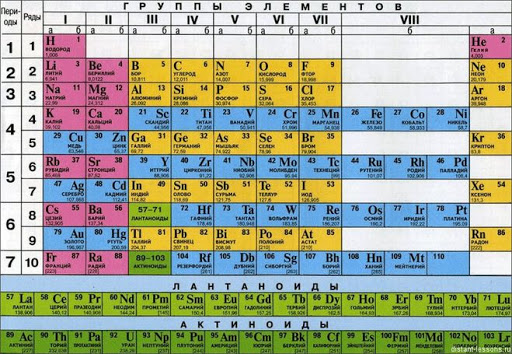
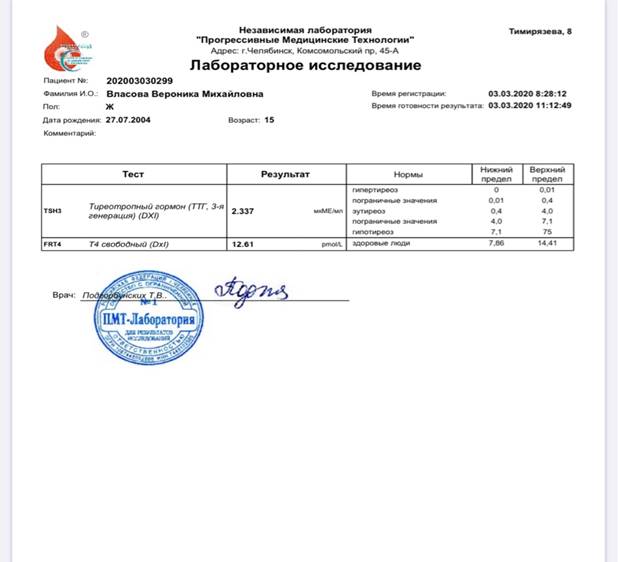

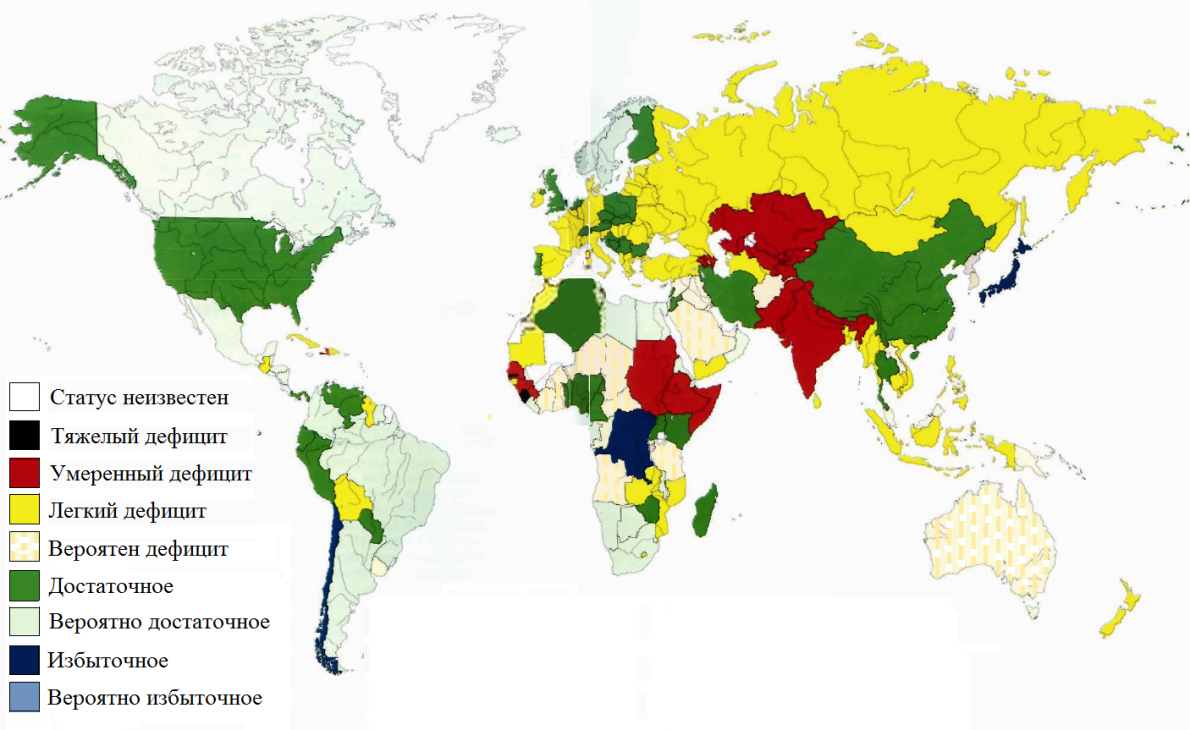

 рименение в медицине
рименение в медицине