Сочинение: Периодическая система элементов Менделеева
ПЛАН
I. Вступление
II. Периодический закон и Периодическая система
химических элементов
1. Открытие Д.И. Менделеевым Периодического закона
2. Структура Периодической системы
а) периоды химических элементов
б) группы химических элементов
III. Периодический закон и строение атома
1. Основные сведения о строении атома
2. Изменения в составе ядер атомов химических элементов. Изотопы
3. Строение электронных оболочек атомов
I . Вступление
Периодический закон и Периодическая система химических элементов Д. И. Менделеева – основа современной химии. Они относятся к таким научным закономерностям, которые отражают явления, реально существующие в природе, и поэтому никогда не потеряют своего значения.
Их открытие было подготовлено всем ходом истории развития химии, однако потребовалась гениальность Д. И. Менделеева, его дар научного предвидения, чтобы эти закономерности были сформулированы и графически представлены в виде таблицы.
II . Периодический закон и Периодическая система химических элементов
1. Открытие Менделеевым Периодического закона
Первый вариант Периодической таблицы элементов был опубликован Д. И. Менделеевым в 1869 году — задолго до того, как было изучено строение атома. В это время Менделеев преподавал химию в Петербургском университете. Готовясь к лекциям, собирая материал для своего учебника «Основы химии», Д. И. Менделеев раздумывал над тем, как систематизировать материал таким образом, чтобы сведения о химических свойствах элементов не выглядели набором разрозненных фактов.
Ориентиром в этой работе Д. И. Менделееву послужили атомные массы (атомные веса) элементов. После Всемирного конгресса химиков в 1860 году, в работе которого участвовал и Д. И. Менделеев, проблема правильного определения атомных весов была постоянно в центре внимания многих ведущих химиков мира, в том числе и Д. И. Менделеева.
Располагая элементы в порядке возрастания их атомных весов, Д. И. Менделеев обнаружил фундаментальный закон природы, который теперь известен как Периодический закон:
Свойства элементов периодически изменяются в соответствии с их атомным весом.
Приведенная формулировка нисколько не противоречит современной, в которой понятие «атомный вес» заменено понятием «заряд ядра». Ядро состоит из протонов и нейтронов. Число протонов и нейтронов в ядрах большинства элементов примерно одинаково, поэтому атомный вес увеличивается примерно так же, как увеличивается число протонов в ядре (заряд ядра Z).
Принципиальная новизна Периодического закона заключалась в следующем:
1. Устанавливалась связь между НЕСХОДНЫМИ по своим свойствам элементами. Эта связь заключается в том, что свойства элементов плавно и примерно одинаково изменяются с возрастанием их атомного веса, а затем эти изменения ПЕРИОДИЧЕСКИ ПОВТОРЯЮТСЯ.
2. В тех случаях, когда создавалось впечатление, что в последовательности изменения свойств элементов не хватает какого-нибудь звена, в Периодической таблице предусматривались ПРОБЕЛЫ, которые надо было заполнить еще не открытыми элементами.
Во всех предыдущих попытках определить взаимосвязь между элементами другие исследователи стремились создать законченную картину, в которой не было места еще не открытым элементам. Наоборот, Д. И. Менделеев считал важнейшей частью своей Периодической таблицы те ее клеточки, которые оставались пока пустыми. Это давало возможность предсказать существование еще неизвестных элементов.
Достойно восхищения, что свое открытие Д. И. Менделеев сделал в то время, когда атомные веса многих элементов были определены весьма приблизительно, а самих элементов было известно всего 63 — то есть чуть больше половины известных нам сегодня.
В свою Периодическую таблицу, опубликованную в марте 1869 года, Д. И. Менделеев поместил элементов больше, чем было открыто к тому времени!
Глубокое знание химических свойств различных элементов позволило Менделееву не только указать на еще не открытые элементы, но и точно предсказать их свойства! Д. И. Менделеев точно предсказал свойства элемента, названного им «эка-силицием». Спустя 16 лет этот элемент действительно был открыт немецким химиком Винклером и назван германием.
Сопоставление свойств, предсказанных Д. И. Менделеевым для еще не открытого элемента «эка-силиция» со свойствами элемента германия (Ge). В современной Периодической таблице германий занимает место «эка-силиция».
| Свойство | Предсказано Д. И. Менделеевым для «эка-силиция» в 1870 году | Определено для германия Ge, открытого в 1886 году |
| Цвет, внешний вид | коричневый | светло-коричневый |
| Атомный вес | 72 | 72,59 |
| Плотность (г/см3 ) | 5,5 | 5,35 |
| Формула оксида | ХО2 | GeO2 |
| Формула хлорида | XCl4 | GeCl4 |
| Плотность хлорида (г/см3 ) | 1,9 | 1,84 |
Точно так же блестяще подтвердились предсказанные Д. И. Менделеевым свойства «эка-алюминия» (элемент галлий Ga, открыт в 1875 году) и «эка-бора» (открытый в 1879 году элемент скандий Sc).
После этого ученым всего мира стало ясно, что Периодическая таблица Д. И. Менделеева не просто систематизирует элементы, а является графическим выражением фундаментального закона природы — Периодического закона.
2. Структура Периодической системы
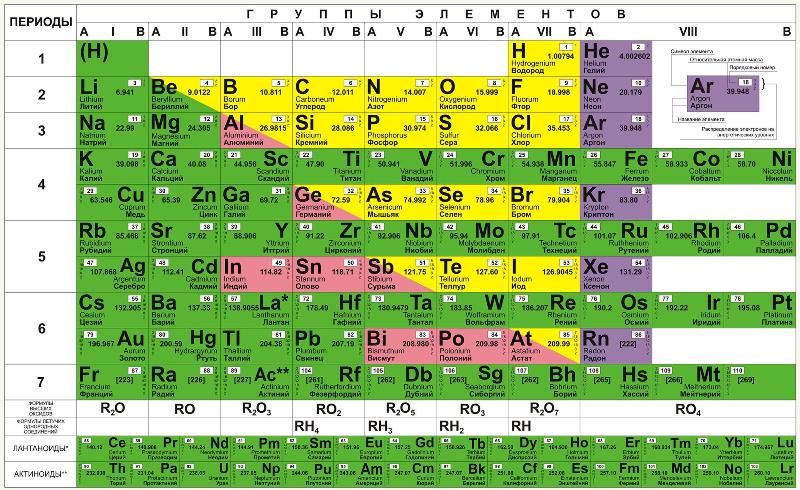
На основе Периодического закона Д.И. Менделеев создал Периодическую систему химических элементов, которая состояла из 7 периодов и 8 групп (короткопериодный вариант таблицы). В настоящее время чаще используется длиннопериодный вариант Периодической системы (7 периодов, 8 групп, отдельно показаны элементы — лантаноиды и актиноиды).
Периоды — это горизонтальные ряды таблицы, они подразделяются на малые и большие. В малых периодах находится 2 элемента (1-й период) или 8 элементов (2-й, 3-й периоды), в больших периодах — 18 элементов (4-й, 5-й периоды) или 32 элемента (6-й, 7-й период). Каждый период начинается с типичного металла, а заканчивается неметаллом (галогеном) и благородным газом .
Группы — это вертикальные последовательности элементов, они нумеруется римской цифрой от I до VIII и русскими буквами А и Б. Короткопериодный вариант Периодической системы включал подгруппы элементов (главную и побочную ).
Подгруппа — это совокупность элементов, являющихся безусловными химическими аналогами; часто элементы подгруппы обладают высшей степенью окисления, отвечающей номеру группы.
В А-группах химические свойства элементов могут меняться в широком диапазоне от неметаллических к металлическим (например, в главной подгруппе V группы азот — неметалл, а висмут — металл).
В Периодической системе типичные металлы расположены в IА группе (Li-Fr), IIА (Mg-Ra) и IIIА (In, Tl). Неметаллы расположены в группах VIIА (F-Al), VIА (O-Te), VА (N-As), IVА (C, Si) и IIIА (B). Некоторые элементы А-групп (бериллий Ве, алюминий Al, германий Ge, сурьма Sb, полоний Po и другие), а также многие элементы Б-групп проявляют и металлические, и неметаллические свойства (явление амфотерности ).
Для некоторых групп применяют групповые названия: IА (Li-Fr) — щелочные металлы, IIА (Ca-Ra) — щелочноземельные металлы, VIА (O-Po) — халькогены, VIIА (F-At) — галогены, VIIIА (He-Rn) — благородные газы. Форма Периодической системы, которую предложил Д.И. Менделеева, называлась короткопериодной или классической. В настоящее время больше используется другая форма Периодической системы — длиннопериодная.
Периодический закон Д.И. Менделеева и Периодическая система химических элементов стали основой современной химии. Относительные атомные массы приведены по Международной таблице 1983 года. Для элементов 104-108 в квадратных скобках приведены массовые числа наиболее долгоживущих изотопов. Названия и символы элементов, приведенные в круглых скобках, не являются общепринятыми.
III . Периодический закон и строение атома
1. Основные сведения строения атомов
В конце XIX — начале XX века физики доказали, что атом является сложной частицей и состоит из более простых (элементарных ) частиц. Были обнаружены:
· катодные лучи (английский физик Дж. Дж.Томсон, 1897 г.), частицы которых получили название электроны e − (несут единичный отрицательный заряд);
· естественная радиоактивность элементов (французские ученые — радиохимики А. Беккерель и М. Склодовская-Кюри, физик Пьер Кюри, 1896 г.) и существование б-частиц (ядер гелия 4 He2+ );
· наличие в центре атома положительно заряженного ядра (английский физик и радиохимик Э. Резерфорд, 1911 г.);
· искусственное превращение одного элемента в другой, например азота в кислород (Э. Резерфорд, 1919 г.). Из ядра атома одного элемента (азота — в опыте Резерфорда) при соударении с б-частицей образовывалось ядро атома другого элемента (кислорода) и новая частица, несущая единичный положительный заряд и названная протоном (p +, ядро 1 H)
· наличие в ядре атома электронейтральных частиц — нейтронов n 0(английский физик Дж. Чедви к, 1932 г.).
В результате проведенных исследований было установлено, что в атоме каждого элемента (кроме 1 H) присутствуют протоны, нейтроны и электроны, причем протоны и нейтроны сосредоточены в ядре атома, а электроны — на его периферии (в электронной оболочке ).
Число протонов в ядре равно числу электронов в оболочке атома и отвечает порядковому номеру этого элемента в Периодической системе.
Электронная оболочка атома представляет собой сложную систему. Она делится на подоболочки с разной энергией (энергетические уровни ); уровни, в свою очередь, подразделяются на подуровни, а подуровни включают атомные орбитали, которые могут различаться формой и размерами (обозначаются буквами s, p, d, f и др.).
Итак, главной характеристикой атома является не атомная масса, а величина положительного заряда ядра. Это более общая и точная характеристика атома, а значит, и элемента. От величины положительного заряда ядра атома зависят все свойства элемента и его положение в периодической системе. Таким образом, порядковый номер химического элемента численно совпадает с зарядом ядра его атома. Периодическая система элементов является графическим изображением периодического закона и отражает строение атомов элементов.
Теория строения атома объясняет периодическое изменение свойств элементов. Возрастание положительного заряда атомных ядер от 1 до 110 приводит к периодическому повторению у атомов элементов строения внешнего энергетического уровня. А поскольку от числа электронов на внешнем уровне в основном зависят свойства элементов, то и они периодически повторяются. В этом физический смысл периодического закона.
Каждый период в периодической системе начинается элементами, атомы которых на внешнем уровне имеют один s-электрон (незавершенные внешние уровни) и потому проявляют сходные свойства — легко отдают валентные электроны, что обуславливает их металлический характер. Это щелочные металлы — Li, Na, К, Rb, Cs.
Заканчивается период элементами, атомы которых на внешнем уровне содержат 2(s2 ) электрона (в первом периоде) или 8 (s2 p6 ) электронов (во всех последующих), то есть имеют завершенный внешний уровень. Это благородные газы Не, Ne, Аr, Кr, Хе, имеющие инертные свойства.
Именно вследствие сходства строения внешнего энергетического уровня похожи их физические и химические свойства. В каждом периоде с возрастанием порядкового номера элементов металлические свойства постепенно ослабевают и возрастают неметаллические, заканчивается период инертным газом.
В свете учения о строении атома становится понятным разделение всех элементов на семь периодов, сделанное Д. И. Менделеевым. Номер периода соответствует числу энергетических уровней атома, то есть положение элементов в Периодической системе обусловлено строением их атомов. В зависимости от того, какой подуровень заполняется электронами, все элементы делят на четыре типа
s-элементы. Заполняется s-подуровень внешнего уровня (s1 — s2 ). Сюда относятся первые два элемента каждого периода.
р-элементы. Заполняется p-подуровень внешнего уровня (p1 — p6 )- Сюда относятся последние шесть элементов каждого периода, начиная со второго.
d-элементы. Заполняется d-подуровень последнего уровня (d1 — d10 ), а на последнем (внешнем) уровне остается 1 или 2 электрона. К ним относятся элементы вставных декад (10) больших периодов, начиная с 4-го, расположенные между s- и p-элементами (их также называют переходными элементами).
f-элементы. Заполняется f-подуровень глубинного (третьего снаружи) уровня (s1 — s2 ), а строение внешнего электронного уровня остается неизменным. Это лантаноиды и актиноиды, находящиеся в шестом и седьмом периодах.
Таким образом, число элементов в периодах (2-8-18-32) соответствует максимально возможному числу электронов на соответствующих энергетических уровнях: на первом — два, на втором — восемь, на третьем — восемнадцать, а на четвертом — тридцать два электрона.
Деление групп на подгруппы (главную и побочную) основано на различии в заполнении электронами энергетических уровней. Главную подгруппу составляют s- и р-элементы, а побочную подгруппу — d и f-элементы. Например в IV группу Периодической системы элементов входят следующие элементы:
| Главная подгруппа (подгруппа углерода) | Побочная подгруппа (подгруппа титана) |
| C…2s2 2p2 | Ti…3d2 4s2 |
| Si…3s2 3p2 | Zr…4d2 5s2 |
| Се…4s2 4р2 | Hf…5d2 6s2 |
| Sn…5s2 5p2 | Ku…6d2 7s2 |
| Pb…6s2 6р2 | |
| р-элементы | d-элементы |
Итак, в каждой группе объединены элементы, атомы которых имеют сходное строение внешнего энергетического уровня. При этом атомы элементов главных подгрупп содержат на внешних (последних) уровнях число электронов, равное номеру группы. Это так называемые валентные электроны.
У элементов побочных подгрупп валентными являются электроны не только внешних, но и предпоследних (вторых снаружи) уровней, в чем и состоит основное различие в свойствах элементов главных и побочных подгрупп.
Отсюда следует, что номер группы, как правило, указывает число электронов, которые могут участвовать в образовании химических связей. В этом физический смысл номера группы.
С позиций теории строения атома легко объясняется возрастание металлических свойств элементов в каждой группе с ростом заряда ядра атома. Сравнивая, например, распределение электронов по уровням в атомах 9 F (1s2 2s2 2р5 ) и 53 J (1s2 2s2 2р6 3s2 3р6 3d10 4s2 4p6 4d10 5s2 5p5 ) можно отметить, что у них по 7 электронов на внешнем уровне, что указывает на сходство свойств. Однако внешние электроны в атоме йода находятся дальше от ядра и поэтому слабее удерживаются. По этой причине атомы йода могут отдавать электроны или, иными словами, проявлять металлические свойства, что нехарактерно для фтора.
Итак, строение атомов обуславливает две закономерности:
а) изменение свойств элементов по горизонтали — в периоде слева направо ослабляются металлические и усиливаются неметаллические свойства;
б) изменение свойств элементов по вертикали — в группе с ростом порядкового номера усиливаются металлические свойства и ослабевают неметаллические.
Таким образом, по мере возрастания заряда ядра атомов химических элементов периодически изменяется строение их электронных оболочек, что является причиной периодического изменения их свойств.
2. Изменение в составе ядер атомов химических элементов. Изотопы
Формулировка закона, данная Д.И. Менделеевым, не могла быть точной и полной с современной точки зрения так как она соответствовала состоянию науки на тот период времени, когда не было известно строение атома. Поэтому новые научные открытия вступили с ней в противоречие. Так были открыты изотопы.
Изотопы – разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд ядра, но разные массовые числа. Сумму чисел протонов и нейтронов в ядре атома называют массовым числом обозначают буквой А. Следовательно, химический элемент – это вид атомов, характеризующихся одинаковым зарядом ядра, то есть содержащих одинаковое число протонов.
3. Строение электронных оболочек атомов
Заполнение атомных орбиталей электронами определяется правилом минимума энергии, принципом Паули и правилом Хунда .
Электроны заполняют атомные орбитали, начиная с подуровня с меньшей энергией. В этом состоит правило минимума энергии. Последовательность в нарастании энергии подуровней акова: 1s < 2s < 2p < 3s < 3p < 4s ≤ 3d < 4p < 5s и так далее …
Согласно расчетам, электрон движется не по какой-то определенной траектории, а может находиться в любой части околоядерного пространства-т.е. можно говорить лишь о вероятности (возможности) его нахождения на определенном расстоянии от ядра.
Электроны в атоме занимают самые энергетически выгодные атомные орбитали (орбитали с минимальной энергией), образуя электронные облака определенной формы.
В случае s -орбитали электронное облако сферическое:
В случае p -орбиталей форма электронного облака гантелеобразная
Внутри атомных орбиталей вероятность нахождения электронов велика; иными словами, имеется высокая электронная плотность. Пространство вне объема орбиталей соответствует малой электронной плотности.
В каждой атомной орбитали может размещаться максимально два электрона (принцип Паули ).
При наличии орбиталей с одинаковой энергией (например, трех р -орбиталей одного подуровня) каждая орбиталь заполняется вначале наполовину (и поэтому на р -подуровне не может быть более трех неспаренных электронов), а затем уже полностью, с образованием электронных пар (правило Хунда ).
Для изображения электронной конфигурации атома нужно распределить его электроны по подуровням так, чтобы каждой атомной орбитали соответствовала одна квантовая ячейка, и в соответствии с тремя указанными правилами заселения
Электронные конфигурации атомов
Электронные конфигурации атомов записываются в виде полных и сокращенных электронных формул:
Из рассмотрения электронных конфигураций атомов видно, что элементы VIIIА-группы (He, Ne, Ar и другие) имеют завершенные s — и p — подуровни (s 2p 6 ). Такие конфигурации обладают повышенной устойчивостью и обеспечивают химическую пассивность благородных газов.
В атомах остальных элементов внешние s — и p — подуровни — незавершенные, например у хлора: 17 Cl = [10 Ne] 3s 2 3p 5. Незавершенные подуровни и электроны на них называются также валентными, поскольку именно они могут участвовать в образовании химических связей между атомами.
f-Элементы. Открытие новых элементов. Ядерные реакции.
Итак, с увеличением атомного номера неизбежно наступает момент, когда у элементов начинают заполняться f-орбитали. Это происходит после заполнения 6s-орбиталей — сразу после элемента 56 Ba с валентной оболочкой …6s2 .
Поскольку при заполнении семи f-орбиталей образуется целых 14 элементов, то как в форме Периодической таблицы f-элементы вынесены отдельными строчками внизу. В нижней части любой таблицы одна строчка из f-элементов “лантаноидов” (по имени элемента лантана La, открывающего ряд f-элементов) и строчка из f-элементов “актиноидов” (по имени элемента актиния Ac). У лантаноидов постепенно заполняются 4f-орбитали, у актиноидов – 5f-орбитали.
Клеточки с f-элементами в Периодической таблице обычно окрашены в зеленый цвет. Для удобства не только в короткой, но даже в длинной форме Периодической таблицы f-элементы вынесены за ее пределы — иначе вся таблица еще сильнее «вытянулась» бы в ширину.
Итак, f-элементами являются 14 лантаноидов и 14 актиноидов.
У лантаноидов заполняются «глубинные» 4f-орбитали третьего снаружи уровня. На внешнем 6s-подуровне все они имеют по 2 электрона (…6s2 ) и обладают очень похожими химическими свойствами. Лантаноиды — активные металлы, все они реагируют с водой с образованием элементарного водорода и гидроксида металла. Их преимущественная степень окисления +3.
Из-за похожести химических свойств многие лантаноиды долго не удавалось выделить в чистом виде. Кроме того, в природных минералах они встречаются редко и в небольших количествах. Отсюда еще одно общее название лантаноидов — редкоземельные элементы.
Актиноиды меньше похожи друг на друга по своим химическим свойствам. Их исследование очень затруднено из-за неустойчивости (радиоактивности) атомов этих элементов. Кстати, у первого члена ряда актиноидов — элемента актиния (89 Ac) наблюдается аналогичный “проскок” 5f1 -электрона на 6d1! Это, как мы уже знаем, связано с требованием минимизации энергии атома данного элемента (хотя, повторим, здесь не все еще понятно), но никак не меняет общих закономерностей Периодической таблицы.
Заполнение 5f-оболочек у актиноидов заканчивается на элементе 103 (Lr, лоуренсий). Здесь в Периодической таблице расположены элементы с уже очень «тяжелыми» и поэтому неустойчивыми ядрами.
Последний из “тяжелых” элементов, еще существующих в природе — это уран (92 U). Уран радиоактивен, то есть постепенно распадается с образованием ядер других элементов. Однако скорость этого распада все же не так велика, чтобы весь уран на Земле успел исчезнуть. Все элементы с более тяжелыми ядрами давно распались и сегодня в минералах их найти невозможно. Такие элементы получают только искусственным путем — синтезом их атомов из ядер более легких элементов с помощью ядерных реакций.
Сначала атомы одного из исходных элементов превращают в ионы — чтобы они приобрели заряд и могли быть разогнаны до высоких скоростей на специальных сложных приборах — ускорителях. Затем разогнанными на ускорителе ядрами бомбардируют мишень из атомов другого элемента. При высоких энергиях ионных пучков на таких ионных ускорителях удается добиться слияния двух ядер в новое ядро с зарядом, равным сумме зарядов двух ядер.
Существуют три признанных во всем мире исследовательских центра по синтезу тяжелых элементов: в Дубне (Россия), в Беркли (США) и в Дармштадте (Германия). Все элементы, начиная с 93-го (нептуний) и до 109-го (майтнерий) были получены именно в этих лабораториях.
Открытие новых элементов сегодня — чрезвычайно сложный и долгий процесс. Атомы искусственных элементов живут очень недолго — порядка секунд для элементов с Z = 101-103, а при дальнейшем “утяжелении” ядер время жизни атомов катастрофически уменьшается. Из миллиардов образующихся ядер нового элемента удается зафиксировать и распознать лишь одно.
В качестве примера рассмотрим сравнительно недавние работы по синтезу 110-го элемента (еще не имеющего названия). Для синтеза ядер этого элемента в лаборатории Дармштадта на мощном ионном ускорителе мишень из свинца-208 (изотопа свинца 82 Pb с массовым числом A = (Z + N) = 208) облучалась ядрами никеля-62 (изотопа никеля 28 Ni с массовым числом 62). Это приводило к образованию ядер 110-го элемента с числом протонов (82 + 28) = 110 и с числом нейтронов — 159. Схематично ядерную реакцию, использованную в Дармштадте, можно записать так:
82 Pb + 28 Ni ®110 Элемент (изотоп с массовым числом 269).
В Дубне для синтеза 110-го элемента использовали мишень из плутония-244, которая облучалась ядрами серы-34. Этот эксперимент проводился на ускорителе в Дубне совместно с Ливерморской лабораторией (США), которая изготовила для эксперимента плутониевую мишень высокого качества. Было зарегистрировано несколько атомов 110-го элемента с числом нейтронов 163. Ядерная реакция в этом случае выглядит так:
94 Pu + 16 S ®110 Элемент (изотоп с массовым числом 273).
Новый элемент не считается открытым до тех пор, пока одна группа исследователей не получит надежных результатов по исследованию его атомов и пока другая (независимая) группа ученых не подтвердит эти результаты. Поэтому дальние клеточки Периодической таблицы заполняются очень медленно.
Есть и другая проблема — как называть вновь открытые элементы? По традиции исследователи, впервые получившие новый элемент, могут предлагать его название. Поэтому каждая группа физиков давала свои названия вновь открытым химическим элементам. По этому поводу было много споров.
Дело в том, что Периодический закон и Периодическая таблица Д. И. Менделеева являются общемировым достоянием и названия новых элементов, остающиеся в них навечно, могут закрепиться лишь при единодушном согласии ученых всего мира. В тех случаях, когда открытие нового элемента еще не подтверждено, либо название не утвердилось окончательно, используются “временные” названия, связанные с атомным номером элемента. Например, элемент 104 был получен советскими физиками в 1964 году и получил название “курчатовий” (Ku) в честь русского физика И. В. Курчатова. В 1969 году этот же элемент воспроизвели в своих опытах американские исследователи и предложили для него название “резерфордий” (Rf) в честь английского физика Э. Резерфорда. До тех пор, пока вопрос о названии 104-го элемента не был решен окончательно, во многих изданиях Периодической таблицы он назывался “унилквандий” и обозначался символом Unq. Здесь “ун” означает 1, “нил” – 0 и “квад” – 4. Точно так же элемент 105 назывался “унилпентий” (Unp), элемент 106 – “унилгексий” (Unh) и так далее.
В 1987 году Международные союзы чистой и прикладной химии (IUPAC) и физики (IUPAP) создали совместную международную комиссию, которая рассмотрела вопрос о приоритете в открытии новых элементов и сделала предложения относительно их наименований. А в январе 1997 г. специальный комитет IUPAC обнародовал решение по названиям элементов № 104–109. Вероятно, эти названия утвердятся уже окончательно:
— элемент 104 названрезерфордием (Rf) — в честь английского физика Эрнста Резерфорда, внесшего огромный вклад в установление строения атома;
— элемент 105 назван дубнием (Db) — в честь города в России, где был открыт этот и многие другие новые элементы.
— элемент 106 назван сиборгием (Sg) — в честь американского физика и радиохимика Гленна Сиборга, участвовавшего в выделении и синтезе многих новых элементов — плутония, нептуния, кюрия, америция, берклия, калифорния, эйнштейния, фермия, менделевия; сделавшего множество других важнейших работ по физике и химии тяжелых элементов;
— элемент 107 назван борием (Bh)- в честь знаменитого датского физика Нильса Бора. Кстати, неправы те, кто думает, что в честь Нильса Бора уже назван элемент бор. Этот элемент был открыт и назван химиками Гей-Люссаком и Тенаром еще в 1808 году;
— элемент 108 назван хассием (Hs) — в честь земли Гессен в Германии, где находится крупнейший научно-исследовательский центр по синтезу и изучению новых элементов;
— элемент 109 назван майтнерием (Mt) — в честь австрийской исследовательницы (физика и радиохимика) Лизе Майтнер, которая вместе с О. Ганом открыла элемент протактиний и сделала много других важнейших работ, способствовавших установлению строения атома.
Элементы 110-112 пока не считаются официально открытыми, хотя ждать этого, видимо, осталось недолго. Уже полным ходом идут работы по синтезу более тяжелых элементов, вплоть до 114-го, который, по некоторым данным, может оказаться гораздо стабильнее, чем его более “легкие” предшественники. Если это необычное свойство 114-го элемента подтвердится в опыте, физики и химики откроют новую страницу в изучении сверхтяжелых элементов.
Эссе на тему: “Значение Периодической системы химических элементов Д. И. Менделеева”
Работу выполнила ученица 9.1 класса
МАОУ “СОШ Аврора”
Костюченко Полина
Руководитель: учитель химии и биологии
Филиппова Алёна Евгеньевна
Значение Периодической системы химических элементов Д. И. Менделеева
Невозможно представить нашу обычную повседневную жизнь без научных открытий. Всё, практически всё, что нас окружает, было открыто когда-то и тщательно изучено (или изучается по сей день) людьми и учёными из разных эпох. Животные и растения были изучены биологами, законы природы — физиками, окружающая нас среда изучается географами. Химия же — наука, изучающая вещества, их свойства и превращения, поэтому я думаю, можно смело сказать, что химия — это наука, которая непосредственно связана со всем не только на планете Земля, но со всеми объектами космического пространства. В истории изучения химии как науки было сделано множество наиважнейших открытий: закон Бойля-Мариотта, теория химического строения А. М. Бутлерова, ну и конечно, всем известный Периодический закон и Периодическая система Дмитрия Ивановича Менделеева.
Дмитрий Иванович Менделеев — величайший химик мира и великий учёный в целом. За свою жизнь этот человек показал всю многогранность своей личности, изучив науки от физики до экономики. Но самым громким и грандиозным научным открытием известным на весь мир, были, без сомнения, Периодический закон и Периодическая система химических элементов. Хоть она и существует уже 150 лет, достоверно никто не может сказать, когда будет до конца понято и открыто всё содержание знаменитой «таблицы Менделеева». По словам самого Д. И. Менделеева, открытию периодического закона способствовало накопление «к концу 60-х годов таких новых сведений о редких элементах, которые открыли бы их разносторонние связи между собой и другими элементами». Многие учёные уже в ту эпоху задумывались о необходимости классификации элементов, но лишь Д.И. Менделееву удалось воплотить эту мечту в жизнь. Идея упорядочивания химических элементов охватила учёного при создании учебника для студентов, отражающего все достижения химии того времени. Итак, мы имеем великого учёного, великую задумку для важнейшей науки, в итоге мы получаем одно из самых значительных и знаменательных открытий в истории не только химии, но и других наук.
Значение Периодической системы химических элементов Д. И. Менделеева, безусловно, огромно. На основе своего открытия Д.И. Менделеев расставил 63 известных элемента по шести периодам и восьми группам. Каждый период начинался металлом и заканчивался неметаллом. Он оставил пробелы в таблице для неоткрытых элементов и сделал перерасчёт относительной атомной массы некоторых элементов (к примеру, бериллия). Открытие, сделанное Менделеевым, неимоверно повлияло на дальнейшее развитие химии. Если раньше новые элементы находились случайно, то с периодической таблицей химики целенаправленно стали искать элементы, ориентируясь на пустые клетки. Так были открыты многие редко встречающиеся элементы (рений). Разве не удивительно, как сам Менделеев предсказывал химические и физические свойства ещё не открытых элементов? Знаменитый “эка-силиций” (германий) обнаружили спустя 16 лет, и истинность предположений Д. И. Менделеева не может не восхищать!
Открытие периодического закона и создание системы химических элементов имело огромное значение не только для химии, но и для философии, для всего нашего миропонимания. Да, к таблице Менделеева человек, не связанный с химией, обращается далеко не каждый день, но согласитесь, без знания химии невозможно полное представление о нашем мире, об окружающей нас природе. Менделеев показал, что химические элементы составляют стройную систему, в основе которой лежит фундаментальный закон природы. В этом нашло выражение и положение о взаимосвязи и взаимовлиянии явлений природы.
В заключение хочется сказать, что в таблице нашли отражение все важнейшие свойства элементов. Классификация элементов по Менделееву обнаруживает, что эти свойства не случайны, а закономерны (атомная масса радиус атома, электроотрицательность, и др.) изменяются закономерно. Место элемента в таблице определяется его свойствами, и, наоборот, каждому месту отвечает определенная совокупность свойств. Это позволяет дать основную характеристику элемента, обращаясь к тому, какое место в периодической системе он занимает.
По моему мнению, это величайшее открытие открывало новые горизонты для изучения не только химии, но и естественных наук в целом (к примеру, атомной физики). Ведь химия — наука, объединяющая всё вокруг нас, не так ли? Ни один ученик не может представить себе уроки химии без Периодического закона и Периодической системы химических элементов. Это настолько важное и необходимое открытие, что его значение не остаётся в рамках науки. Оно преследует нас и в повседневной жизни, напоминая о вкладе русских учёных в мировую науку.
Последующее развитие науки позволило, опираясь на труд Дмитрия Ивановича, гораздо глубже познать строение вещества, чем это было возможно при жизни Менделеева. Таким образом, она не только была первой естественной классификацией химических элементов, показавшей, что они образуют стройную систему и находятся в тесной связи друг с другом, но и явилась могучим орудием для дальнейших исследований. Трудно даже представить мир, без этого глобального, фундаментального, основополагающего открытия, ставшего в своём роде переломным моментом в изучении такой основной науки, как химия.
- Энциклопедия
- Разное
- Таблицы менделеева (история и создания)
Доклад Таблицы менделеева (история и создания) сообщение
Один из обязательных предметов в школе является химия. Большинство знаний, полученных по этой дисциплине, в жизни не применяются. Но знаменитую таблицу Менделеева знает каждый человек. Мало кто догадывается, как она была создана.
Предыстория.
В 1668 году талантливым ученым в области химии и биологии Робертом Бойлером была выпущена статья, в которой он делился своим мнением о надобности открытия свежих химических составляющих. В перечень он внес более10 новых элементов.
Спустя 100 лет ученый Антуан Лавузье из Франции решил увеличить этот список до 35 элементов. Однако основной вклад в развитии химических элементов вложил русский ученый-химик Дмитрий Иванович Менделеев. Он первый высказался о том, что атомная масса элементов имеет связь с их расстановкой в системе.
Так получилось, что в 1869 году русский ученый смог сформулировать самый первый периодический закон, и написать доклад про соотношение свойств с атомным весом элементов.
История создания.
Идея создания периодической таблицы была уже придумана в голове у Менделеева. Но правильно упорядочить ее он долгое время не мог. Более трех суток без сна химик работал над расстановкой химических элементов, перебирая различные методы. В итоге процесс был выполнен, и таблица была создана.
Миф о сне Менделеева.
Почти каждый человек слышал историю о том, что ученому таблица элементов приснилась. Эта легенда придумал помощник ученого А.А. Иностранцев. Это была просто веселая история для студентов. В ней говорилось, что Менделеев во сне смог увидеть свою таблицу, в которой все химические составляющие были уже сформированы в правильном порядке. Но на самом деле химик много работал, не отвлекаясь на еду и сон. Сам Менделеев говорил, что всего лишь шутка. Таблица была создана с помощью тяжелого труда.
Последующая работа.
Ученый продолжал проводить различные эксперименты и вносил поправки в свой труд. Химик изменил значения атомных масс некоторых элементов. Менделеев основывался на результатах своих исследований.
Для новых элементов ученый оставил пустые клетки, однако их свойства он смог заранее просчитать. Менделеев предсказал открытие галлия, скандий и германия.
Организация периодической системы Менделеева.
Д.И. Менделеев расположил все элементы в ряд по массовому росту, а длина рядов была сформирована так, чтобы все элементы имели похожие качества.
В самом начале создания системы она считалась как отображение уже существующего порядка в природе. Никаких пояснений, почему все элементы должны стоять так, не было. Лишь после создания квантовой механики обществу стало хоть немного понятно расположение химических составляющих в таблице. Во время работы над своим проектом Менделеев придерживался 4 этапах: подготовка, инкубация, озарение и проверка. За качественность такого процесса можно судить по окончательным итогам.
Вывод.
Создание периодической таблицы Менделеева стало большим открытием не только для химии как для науки, но и для всего человечества. Главное, что нужно запомнить – это то, в реальной жизни ничего не происходит само по себе. Не нужно ждать, что какое-то открытие или решение в жизни произойдет случайным образом. Для того, чтобы добиться желаемого в жизни нужно иметь некоторые познания и навыки, а также правильно уметь пользоваться своим потенциалом. И совсем не важно, будь это открытие нового химического элемента или же что-то другое…
Таблицы менделеева (история и создания)
Популярные темы сообщений
- Коза
Коза – верный и очень смышлёный друг человека, они узнают своих хозяев и всегда ластятся к ним. Это животное человек одомашнил около 10 тысяч лет назад, то есть ещё раньше, чем наших любимых кошек и собак.
- Роль бактерий в природе
Бактерии – это большая группа микроорганизмов. Мы не видим их невооруженным глазом, но они есть повсюду. Существует мнение, что именно бактерии были первыми живыми организмами, появившимися на нашей планете. Бактерии выполняют разные роли в природе.
- Грибы паразиты
Грибы паразиты появляются преимущественно на растениях, для того чтоб получать с них полезные вещества, при этом само растение заметно слабеет, становится угнетенным. Паразиты являются большой проблемой для сельского хозяйства.
- Сила трения
В природе существует множество явлений, связанных с физикой. Это может быть гром и молнии, электрический ток, сила магнитов, трение и так далее. Последнее мы рассмотрим в сегодняшнем докладе.
- Броуновское движение
Броуновское движение частиц и молекул правильнее было бы называть Брауновским движением по фамилии ученого. Представляет собой хаотичное и постоянное (непрерывное) движение молекул и частиц, газообразных или жидких в вакууме,
Фото: ИТАР-ТАСС
Открытие таблицы периодических химических элементов стало одной из важных вех в истории развития химии как науки. Первооткрывателем таблицы стал российский ученый Дмитрий Менделеев. Неординарный ученый с широчайшим научным кругозором сумел объединить все представления о природе химических элементов в единую стройную концепцию.
Об истории открытия таблицы периодических элементов, интересных фактах, связанных с открытием новых элементов, и народных байках, которые окружали Менделеева и созданную им таблицу химических элементов, М24.RU расскажет в этой статье.
История открытия таблицы
К середине XIX века было открыто 63 химических элемента, и ученые всего мира не раз предпринимали попытки объединить все существовавшие элементы в единую концепцию. Элементы предлагали разместить в порядке возрастания атомной массы и разбить на группы по сходству химических свойств.
В 1863 году свою теорию предложил химик и музыкант Джон Александр Ньюленд, который предложил схему размещения химических элементов, схожую с той, что открыл Менделеев, но работа ученого не была принята всерьез научным сообществом из-за того, что автор увлекся поисками гармонии и связью музыки с химией.
В 1869 году Менделеев опубликовал свою схему периодической таблицы в журнале Русского химического общества и разослал извещение об открытии ведущим ученым мира. В дальнейшем химик не раз дорабатывал и улучшал схему, пока она не приобрела привычный вид.
Суть открытия Менделеева в том, что с ростом атомной массы химические свойства элементов меняются не монотонно, а периодически. После определенного количества разных по свойствам элементов, свойства начинают повторяться. Так, калий похож на натрий, фтор — на хлор, а золото схоже с серебром и медью.
В 1871 году Менделеев окончательно объединил идеи в периодический закон. Ученые предсказал открытие нескольких новых химических элементов и описал их химические свойства. В дальнейшем расчеты химика полностью подтвердились — галлий, скандий и германий полностью соответствовали тем свойствам, которые им приписал Менделеев.
Байки о Менделееве
Гравюра, на которой изображен Менделеев. Фото: ИТАР-ТАСС
Об известном ученом и его открытиях ходило немало баек. Люди в то время слабо представляли себе химию и считали, что занятия химией — это что-то вроде поедания супа из младенцев и воровства в промышленных масштабах. Поэтому деятельность Менделеева быстро обросла массой слухов и легенд.
Одна из легенд гласит, что Менделеев открыл таблицу химических элементов во сне. Случай не единственный, точно также говорил о своем открытии Август Кекуле, которому приснилась формула бензольного кольца. Однако Менделеев только смеялся над критиками. «Я над ней, может быть, двадцать лет думал, а вы говорите: сидел и вдруг … готово!», — как-то сказал ученый о своем открытии.
Другая байка приписывает Менделееву открытие водки. В 1865 году великий ученый защитил диссертацию на тему «Рассуждение о соединении спирта с водою», и это сразу дало повод для новой легенды. Современники химика посмеивались, мол ученый «неплохо творит под действием спирта, соединенного с водой», а следующие поколения уже называли Менделеева первооткрывателем водки.
Посмеивались и над образом жизни ученого, а особенно над тем, что Менделеев оборудовал свою лабораторию в дупле огромного дуба.
Также современники подтрунивали над страстью Менделеева к чемоданам. Ученый в пору своего невольного бездействия в Симферополе вынужден был коротать время за плетением чемоданов. В дальнейшем он самостоятельно мастерил для нужд лаборатории картонные контейнеры. Несмотря на явно «любительский» характер этого увлечения, Менделеева часто называли «чемоданных дел мастером».
Открытие радия
Одна из наиболее трагичных и в то же время известных страниц в истории химии и появления новых элементов в таблице Менделеева связана с открытием радия. Новый химический элемент был открыт супругами Марией и Пьером Кюри, которые обнаружили, что отходы, остающиеся после выделения урана из урановой руды, более радиоактивны, чем чистый уран.
Поскольку о том, что такое радиоактивность, тогда еще никто не знал, то новому элементу молва быстро приписала целебные свойства и способность излечивать чуть ли не от всех известных науке болезней. Радий включили в состав пищевых продуктов, зубной пасты, кремов для лица. Богачи носили часы, циферблат которых был окрашен краской, содержащей радий. Радиоактивный элемент рекомендовали как средство для улучшения потенции и снятия стресса.
Подобное «производство» продолжалось целых двадцать лет — до 30-х годов двадцатого века, когда ученые открыли истинные свойства радиоактивности и выяснили насколько губительно влияние радиации на человеческий организм.
Мария Кюри умерла в 1934 году от лучевой болезни, вызванной долговременным воздействием радия на организм.
Небулий и короний
Фото: ИТАР-ТАСС
Таблица Менделеева не только упорядочила химические элементы в единую стройную систему, но и позволила предсказать многие открытия новых элементов. В то же время некоторые химические «элементы» были признаны несуществующими на основании того, что они не укладывались в концепцию периодического закона. Наиболее известна история с «открытием» новых элементов небулия и корония.
При исследовании солнечной атмосферы астрономы обнаружили спектральные линии, которые им не удалось отождествить ни с одним из известных на земле химических элементов. Ученые предположили, что эти линии принадлежат новому элементу, который получил название короний (потому что линии были обнаружены при исследовании «короны» Солнца — внешнего слоя атмосферы звезды).
Спустя несколько лет астрономы сделали еще одно открытие, изучая спектры газовых туманностей. Обнаруженные линии, которые снова не удалось отождествить ни с чем земным, приписали другому химическому элементу — небулию.
Открытия подверглись критике, поскольку в периодической таблице Менделеева уже не оставалось места для элементов, обладающих свойствами небулия и корония. После проверки обнаружилось, что небулий является обычным земным кислородом, а короний — сильно ионизированное железо.
Отметим, что сегодня в московском Центральном доме ученых РАН торжественно присвоят имена двум химическим элементам, открытым учеными из подмосковной Дубны.
Материал создан на основе информации из открытых источников. Подготовил Василий Макагонов @vmakagonov
Обновлено: 11.03.2023
Эти примеры из текста стали убедительным доказательством того, что знаки препинания – это не только синтаксические единицы, разделяющие текст на смысловые отрезки и выражающие интонационные паузы, но и еще один литературный прием, который поможет передать силу эмоций и степень переживаний героев.
Я считаю, что мысль данного фрагмента текста заключается в том, что не всегда страшные события в жизни оттолкнут от какой-либо деятельности, некоторые находят в себе силы продолжать дело близких людей с честью и отвагой. И ребенок способен проявить лучшие качества, свойственные героям, совершая каждодневный подвиг, несмотря на гибель родного человека.
Действительно, спокойствие мальчика поражает, восхищает его хладнокровие. Не каждый взрослый так бы смог владеть собой в минуту опасности, оберегать других от паники. Так, в предложениях 11-15 юный гребец руководит посадкой. И не подумаешь, что раздает указания ребенок! И это несмотря на сильную усталость!
Ещё более поражает его реакция на падающие рядом с судном осколки! В предложениях 22-24 показано, что мальчик привык к опасности, головы не повернул в сторону снарядов. И это в тот момент, когда взрослые испытывали страх и ужас (предложения 25-27)! Мальчик продолжает дело отца, даже не рассматривает угрожающую жизни ситуацию как нечто пугающее.
Мне удалось проиллюстрировать примерами из текста верность данного мной объяснения фрагмента текста. Мальчик не следует ожидаемой реакции на смерть отца, не трусит, а каждый день совершает подвиг.
Что такое смелость? Кого можно назвать смелым человеком? Каждый ответит на эти вопросы по-своему. Я думаю, что смелость – это способность человека побеждать страх в минуту опасности, решительность в действиях.
Как показывает писатель, мальчик не паникует, не боится даже тогда, когда не выдерживают нервы у взрослых людей. Он каждый день перевозит людей, попадает под осколки снарядов. Мальчик изо дня в день совершает подвиг, продолжая нужное и важное дело своего погибшего отца. Его с уверенностью можно считать смелым.
Таким образом, можно сделать вывод: смелый человек – это тот, кто победил, подчинил себе свои страхи, уверен в себе, силен духом.
Любой, кто ходил в школу, помнит, что одним из обязательных для изучения предметов была химия. Она могла нравиться, а могла и не нравиться – это не важно. И вполне вероятно, что многие знания по этой дисциплине уже забыты и в жизни не применяются. Однако таблицу химических элементов Д. И. Менделеева наверняка помнит каждый. Для многих она так и осталась разноцветной таблицей, где в каждый квадратик вписаны определённые буквы, обозначающие названия химических элементов. Но здесь мы не будем говорить о химии как таковой, и описывать сотни химических реакций и процессов, а расскажем о том, как вообще появилась таблица Менделеева – эта история будет интересна любому творчески мыслящему человеку, да и вообще всем тем, кто охоч до интересной и полезной информации.
Небольшая предыстория
В далёком 1668 году выдающимся ирландским химиком, физиком и богословом Робертом Бойлем была опубликована книга, в которой было развенчано немало мифов об алхимии, и в которой он рассуждал о необходимости поиска неразложимых химических элементов. Учёный также привёл их список, состоящий всего из 15 элементов, но допускал мысль о том, что могут быть ещё элементы. Это стало отправной точкой не только в поиске новых элементов, но и в их систематизации.
Сто лет спустя французским химиком Антуаном Лавуазье был составлен новый перечень, в который входили уже 35 элементов. 23 из них позже были признаны неразложимыми. Но поиск новых элементов продолжался учёными по всему миру. И главную роль в этом процессе сыграл знаменитый русский химик Дмитрий Иванович Менделеев – он впервые выдвинул гипотезу о том, что между атомной массой элементов и их расположением в системе может быть взаимосвязь.
Создание периодической таблицы
Основная идея к 1869 году уже была сформирована Менделеевым, причём за довольно короткое время, но оформить её в какую-либо упорядоченную систему, наглядно отображающую, что к чему, он долго не мог. В одном из разговоров со своим соратником А. А. Иностранцевым он даже сказал, что в голове у него уже всё сложилось, но вот привести всё к таблице он не может. После этого, согласно данным биографов Менделеева, он приступил к кропотливой работе над своей таблицей, которая продолжалась трое суток без перерывов на сон. Перебирались всевозможные способы организации элементов в таблицу, а работа была осложнена ещё и тем, что в тот период наука знала ещё не обо всех химических элементах. Но, несмотря на это, таблица всё же была создана, а элементы систематизированы.
Легенда о сне Менделеева
Дальнейшая работа
В период с 1869 по 1871 годы Менделеев развивал идеи периодичности, к которым склонялось научное сообщество. И одним из важных этапов данного процесса стало понимание того, что любой элемент в системе должно располагать, исходя из совокупности его свойств в сравнении со свойствами остальных элементов. Основываясь на этом, а также опираясь на результаты исследований в изменении стеклообразующих оксидов, химику удалось внести поправки в значения атомных масс некоторых элементов, среди которых были уран, индий, бериллий и другие.
Пустые клетки, остававшиеся в таблице, Менделеев, конечно же, хотел скорее заполнить, и в 1870 году предсказал, что в скором времени будут открыты неизвестные науке химические элементы, атомные массы и свойства которых он сумел вычислить. Первыми из них стали галлий (открыт в 1875 году), скандий (открыт в 1879 году) и германий (открыт в 1885 году). Затем прогнозы продолжили реализовываться, и были открыты ещё восемь новых элементов, среди которых: полоний (1898 год), рений (1925 год), технеций (1937 год), франций (1939 год) и астат (1942-1943 годы). Кстати, в 1900 году Д. И. Менделеев и шотландский химик Уильям Рамзай пришли к мнению, что в таблицу должны быть включены и элементы нулевой группы – до 1962 года они назывались инертными, а после – благородными газами.
Организация периодической системы
Химические элементы в таблице Д. И. Менделеева расположены по рядам, в соответствии с возрастанием их массы, а длина рядов подобрана так, чтобы находящиеся в них элементы имели схожие свойства. Например, благородные газы, такие как радон, ксенон, криптон, аргон, неон и гелий с трудом вступают в реакции с другими элементами, а также имеют низкую химическую активность, из-за чего расположены в крайнем правом столбце. А элементы левого столбца (калий, натрий, литий и т.д.) отлично реагируют с прочими элементами, а сами реакции носят взрывной характер. Говоря проще, внутри каждого столбца элементы имеют подобные свойства, варьирующиеся при переходе от одного столбца к другому. Все элементы, вплоть до №92 встречаются в природе, а с №93 начинаются искусственные элементы, которые могут быть созданы лишь в лабораторных условиях.
В своём первоначальном варианте периодическая система понималась только как отражение существующего в природе порядка, и никаких объяснений, почему всё должно обстоять именно так, не было. И лишь когда появилась квантовая механика, истинный смысл порядка элементов в таблице стал понятен.
Уроки творческого процесса
Говоря о том, какие уроки творческого процесса можно извлечь из всей истории создания периодической таблицы Д. И. Менделеева, можно привести в пример идеи английского исследователя в области творческого мышления Грэма Уоллеса и французского учёного Анри Пуанкаре. Приведём их вкратце.
Согласно исследованиям Пуанкаре (1908 год) и Грэма Уоллеса (1926 год), существует четыре основных стадии творческого мышления:
- Подготовка – этап формулирования основной задачи и первые попытки её решения;
- Инкубация – этап, во время которого происходит временное отвлечение от процесса, но работа над поиском решения задачи ведётся на подсознательном уровне;
- Озарение – этап, на котором находится интуитивное решение. Причём, найтись это решение может в абсолютно не имеющей к задаче ситуации;
- Проверка – этап испытаний и реализации решения, на котором происходит проверка этого решения и его возможное дальнейшее развитие.
Как мы видим, в процессе создания своей таблицы Менделеев интуитивно следовал именно этим четырём этапам. Насколько это эффективно, можно судить по результатам, т.е. по тому, что таблица была создана. А учитывая, что её создание стало огромным шагом вперёд не только для химической науки, но и для всего человечества, приведённые выше четыре этапа могут быть применимы как к реализации небольших проектов, так и к осуществлению глобальных замыслов. Главное помнить, что ни одно открытие, ни одно решение задачи не могут быть найдены сами по себе, как бы ни хотели мы увидеть их во сне и сколько бы ни спали. Чтобы что-то получилось, не важно, создание это таблицы химических элементов или разработка нового маркетинг-плана, нужно обладать определёнными знаниями и навыками, а также умело использовать свои потенциал и упорно работать.
Мы желаем вам успехов в ваших начинаниях и успешной реализации задуманного!
Кто автор мифа о сонной природе открытия Менделеева?
Более же критичные слушатели не спешили принимать вышерассказанный анекдот на веру, так как, во-первых, Иностранцев никогда не был таким уж закадычным другом Менделеева. Во-вторых, химик вообще мало кому открывался, с приятелями он часто шутил, при этом делал это с более чем серьёзным выражением лица, так что окружающие нередко не могли понять — всерьёз брошена та или иная фраза или нет. В-третьих, Менделеев в своих дневниках и письмах рассказывал, что с 1869-го по 1871-й годы он сделал в таблице не одну, а множество правок.
А были такие учёные, которые делали открытия во сне?
В отличие от Менделеева, многие иностранные учёные и изобретатели не только не открещивались, но и наоборот, всячески подчёркивали, что совершить то или иное открытие им помогло некое озарение, снизошедшее на них во сне.
Американский учёный Элиас Хоу в конце XIX века работал над созданием швейной машинки. Первые аппараты Хоу ломались и портили ткань — связано это было с тем, что игольное ушко находилось с тупой стороны иголки. Учёный долгое время не мог понять, как решить эту проблему, пока однажды не задремал прямо над чертежами. Хоу снилось, что правитель какой-то заморской страны под страхом смертной казни приказал ему смастерить швейную машинку. Созданный им аппарат сразу сломался, и монарх пришёл в ярость. Когда Хоу вели на эшафот, он увидел, что копья окружавших его стражников имели отверстия прямо под остриём. Проснувшись, Хоу переместил ушко на противоположный конец иголки, и его швейная машинка начала работать без сбоев.
Датскому учёному Нильсу Бору в 1913 году приснилось, что он очутился на Солнце, а вокруг него на огромной скорости вращаются планеты. Под впечатлением от этого сновидения Бор создал планетарную модель строения атомов, за которую ему позже вручили Нобелевскую премию.
В середине XX века американский учёный Джеймс Уотсон увидел во сне двух переплетающихся змей. Это сновидение помогло ему первым в мире изобразить форму и структуру ДНК.
Первый курс учёбы в институте Санкт-Петербурга молодой Менделеев провалил. Он получил двойки по всем дисциплинам, кроме математики. Никто и предположить не мог, что этот институт он закончит с золотой медалью и станет известным учёным. При этом химии была посвящена всего лишь десятая часть его исследований.
Какие открытия действительно принадлежат Дмитрию Менделееву, а какие являются мифами и домыслами? Фактрум собрал самые интересные факты и байки об исследованиях великого учёного.
Дмитрий Иванович Менделеев в своём кабинете за работой
Легендарная периодическая таблица Менделееву не приснилась. Слухи о знаменательном сне начали ходить ещё при жизни учёного. Менделеев всегда подчёркивал, что размышлял над таблицей почти двадцать лет. История о том, что он просто увидел сложную систему во сне, ему казалась неслыханной.
В 1869 году Дмитрий Менделеев набросал будущую таблицу на неприметном клочке бумаги. Тогда ему пришла идея о связи массы химических элементов с их свойствами. Для работы он изготовил карточки всех известных элементов. И только после этого смог их систематизировать. В результате учёный открыл периодический закон, который использовался им для упорядочивания элементов.
После создания таблицы Дмитрий Менделеев отправил её в ведущие международные научные журналы и лучшим учёным мира. Схема неоднократно дорабатывалась, пока не приобрела привычный для нас вид. В 1870 году Менделееву удалось рассчитать массу и свойства элементов, которые ещё не были открыты. Учёный точно описал галий, скандий и германий, которые обнаружили лишь через несколько лет (германий открыли только в 1886 году).
Миф о водке: легенда таблицы Менделеева — не единственная байка
Периодическая таблица Менделеева — только лишь одно из открытий
Мало кто знает, но Менделеев участвовал в настоящем промышленном шпионаже. При этом учёному не пришлось пользоваться секретной информацией. В 1890 году власти попросили Менделеева раскрыть секрет бездымного пороха. В то время он закупался за границей, что было крайне накладно для российской казны. Дмитрий Менделеев изучил отчёты о немецких, французских и английских железнодорожных поставках. Благодаря этому он рассчитал, в каких количествах в страны ввозились уголь, селитра и другое важное сырье. Именно расчёт пропорций позволил Менделееву изготовить бездымный порох.
Читайте также:
- Почему братья кирсановы не принимают нигилистических идей базарова сочинение
- Проведение корпоративного мероприятия сочинение
- Писали сочинение главное и зависимое слово
- Город моей мечты сочинение 11 класс
- Сочинение на тему мой любимый сказ бажова
Таблица Менделеева
Дмитрий Иванович
Менделеев
В истории развития человеческих знаний немало великих подвигов. Но
только немногие из них можно сопоставить с тем, что было сделано Дмитрием
Ивановичем Менделеевым – одним из величайших гениев мира. Научный подвиг
Менделеева не имеет равных, величие его не только не стирается неуловимым
временем, но и продолжает расти. И никто не может сказать, будут ли
когда-нибудь исчерпано до конца все содержание одного из величайших в науке
обобщений – периодического закона Менделеева.
История науки не знает другого подобного триумфа. Открыт
новый закон природы. Вместо разрозненных, не связанных между собой веществ
перед наукой встала стройная единая система, объединившая в одно целое все
элементы Вселенной. После открытия периодического закона стало ясно, что атомы
всех элементов построены по единому плану.
Открытие периодического закона было очень незаметным и
скромным.
17 февраля 1869г., собираясь в дорогу, профессор
Петербургского университета Дмитрий Иванович Менделеев на обороте письма, в
котором его просили приехать и помочь производству, сделал первый набросок
первой таблицы химических элементов. В этой таблице он расположил все элементы
в порядке возрастания их атомных весов и проследил периодическую повторяемость
их веществ.
В этот день Менделеев отложил свою поездку. Он написал на
отдельных
карточках все
известные тогда элементы с их важнейшими химическими и физическими свойствами.
Располагая эти карточки в различном порядке, сообразуясь с атомными весами и со
свойствами их соединений, Менделеев составил свой первый вариант естественной
системы химических элементов.
Вот как, по его собственным словам, была им открыта
периодическая система: “… Невольно зародилась мысль о том, что между
массой и химическими свойствами необходимо должна быть связь. А так как масса
вещества, хотя и не абсолютная, а лишь относительная, выражается окончательно в
виде весов атомов, то надо искать функциональное соответствие между
индивидуальными свойствами элементов с их атомными весами. Я и
стал подбирать, написав на отдельных карточках элементы с их атомными весами
коренными свойствами, сходные элементы и близкие атомные веса, что быстро и
привило к тому заключению, что свойства элементов стоят в периодической
зависимости от их атомного веса, причем, сомневаясь во многих неясностях, я ни
минуты не сомневался в общности сделанного вывода, т.к. случайность допустить
невозможно”.
Менее двух недель продолжалась поистине титаническая
работа Менделеева над открытием основного закона в современной химии. За этот
короткий период он сумел пройти весь путь от первого проблеска, до его
исчерпывающего доказательства и величайших в науке предсказаний.
Завершив первый этап работы над периодическим законом,
Менделеев вернулся к отложенному делу, связонному с помощью промышленному
производству, и уехал из Петербурга в командировку.
Первое сообщение о
величайшем открытии было сделано 6 марта 1869г. на заседании Русского
химического общества. Менделеева на этом заседании не было. Вместо
отсутствуещего автора его доклад прочел Мешуткин.
Периодический закон был открыт Д. И. Менделеевым 17 февраля 1869 года в результате многолетней работы по отысканию принципов систематизации элементов и изучения самых различных их свойств. Этой работе Д. И. Менделеев посвятил 15 лет непрерывного труда. Открытие было совершено им не случайно, так как в его деятельности органически сочетались теория и практика, знание физической стороны явления, математическая интуиция и философское осмысление. Кроме того, Менделеев умел критически относится к работам своих предшественников и современников. Не пересыщая себя информацией, он как бы пропускал полученные уже данные через призму еще не сформировавшейся до конца концепции и, подобно скульптору, отсек все лишнее, после чего как очевидное представил перед всем научным миром периодический закон.
В отличие от работ предшественников предложенная Д. И. Менделеевым таблица Периодической системы химических элементов имела четкую структуру в виде групп и периодов (с рядами), в которой нашлось место не только для всех известных в то время элементов, но были оставлены пустые места для еще не открытых. Система Д. И. Менделеева позволила не только предсказать существование неизвестных элементов, но и предугадать их свойства, исправить неверно определенные атомные массы уже известных элементов. Д. И. Менделеев обнаружил периодичность в изменении свойств химических элементов, расположенных в порядке возрастания величин их атомных масс, сравнивая между собой все известные ему, в том числе и несходные, элементы.
Д. И. Менделеев в своем открытии опирался на четко сформулированные исходные положения:
Общее неизменное свойство атомов всех химических элементов — их атомная масса; Свойства элементов зависят от их атомных масс; Форма этой зависимости — периодическая.
Можно поражаться гениальности великого русского химика, который на основе величайшей научной интуиции предвидел причины открытых им закономерностей, блестяще угадал порядок расположения элементов и создал таблицу так, что она, будучи довольно простой, тем не менее характеризует строение атомов и не претерпела никаких принципиальных изменений уже в течение 130 лет.
Формулировка Периодического закона:
Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от зарядов их атомных ядер.
Периодическая система — это графическое отображение Периодического закона. Каждое обозначение в Периодической системе отражает какую-либо особенность или закономерность в строении атомов химических элементов.
Менделеев высказывает весьма важную мысль о составе и строении молекулярных соединений: » Молекулярные соединения не представляют всегда соединений только двух частиц, — оно может происходить и между многими, чему пример, мы видим в соединении некоторых солей с несколькими паями воды. При таких соединениях, по-видимому, важную роль положение присоединенных частиц к частице присоединившей».
При образовании растворов — по мнению Менделеева — имеют место как бы два процесса:
1. образование определенного химического соединения в соответствии с законом эквивалентов (NH 4 OH);
2. его распад, т. е. Сам раствор надо рассматривать как химическую систему, в которой есть молекулы гидрата аммиака, молекулы воды (избыток растворителя) и которая находится в равновесии с аммиаком, находящимся в газовой фазе при данной температуре.
Итак, Дмитрий Иванович Менделеев — это величайший ученый своего времени, который внес огромный и незаменимый вклад в развитие мировой науки.