Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Задания Д11 B20 № 2007
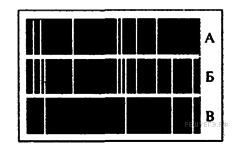
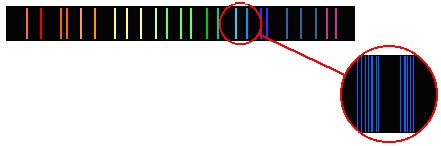
На рисунках А, Б и В приведены спектры излучения атомарных газов А и В и газовой смеси Б.
На основании анализа этих участков спектров можно сказать, что смесь газа содержит
1) только газы А и В
2) газы А, В и другие
3) газ А и другой неизвестный газ
4) газ В и другой неизвестный газ
2
Задания Д11 B20 № 2011
На рисунке изображена схема возможных значений энергии атомов разреженного газа.
В начальный момент времени атомы находятся в состоянии с энергией Возможно испускание газом фотонов с энергией
1) только Дж
2) только и
Дж
3) только
и
Дж
4) любой от до
Дж
3
Задания Д11 B20 № 2027
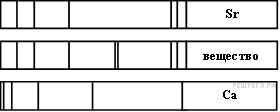
На рисунке приведены спектр поглощения разреженных атомарных паров неизвестного вещества (в середине) и спектры поглощения паров известных элементов (вверху и внизу).
По анализу спектров можно утверждать, что неизвестное вещество содержит
1) только кальций (Са)
2) только стронций (Sr)
3) кальций и еще какое-то неизвестное вещество
4) стронций и еще какое-то неизвестное вещество
4
Задания Д11 B20 № 2115
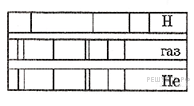
На рисунке приведены фрагмент спектра поглощения неизвестного разреженного атомарного газа (в середине), спектры поглощения атомов водорода (вверху) и гелия (внизу).
В химический состав газа входят атомы
1) только водорода
2) только гелия
3) водорода и гелия
4) водорода, гелия и еще какого-то вещества
5
Задания Д11 B20 № 2122
На рисунках А, Б, В приведены спектры излучения паров стронция, неизвестного образца и кальция.
Можно утверждать, что в образце
1) не содержится ни стронция, ни кальция
2) содержится кальций, но нет стронция
3) содержатся и стронций, и кальций
4) содержится стронций, но нет кальция
Пройти тестирование по этим заданиям
Линейчатые спектры
-
Темы кодификатора ЕГЭ: линейчатые спектры.
-
Спектр испускания
-
Спектр поглощения
-
Спектральный анализ
-
Линейчатые спектры
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: линейчатые спектры.
Если пропустить солнечный свет через стеклянную призму или дифракционную решётку, то возникнет хорошо известный вам непрерывный спектр (рис. 1)(Изображения на рис. 1, 2 и 3 взяты с сайта www.nanospectrum.ru):
Рис. 1. Непрерывный спектр
Спектр называется непрерывным потому, что в нём присутствуют все длины волн видимого диапазона — от красной границы до фиолетовой. Мы наблюдаем непрерывный спектр в виде сплошной полосы, состоящей из разных цветов.
Непрерывным спектром обладает не только солнечный свет, но и, например, свет электрической лампочки. Вообще, оказывается, что любые твёрдые и жидкие тела (а также весьма плотные газы), нагретые до высокой температуры, дают излучение с непрерывным спектром.
Ситуация качественно меняется, когда мы наблюдаем свечение разреженных газов. Спектр перестаёт быть непрерывным: в нём появляются разрывы, увеличивающиеся по мере разрежения газа. В предельном случае чрезвычайно разреженного атомарного газа спектр становится линейчатым — состоящим из отдельных достаточно тонких линий.
Мы рассмотрим два типа линейчатых спектров: спектр испускания и спектр поглощения.
к оглавлению ▴
Спектр испускания
Предположим, что газ состоит из атомов некоторого химического элемента и разрежен настолько, что атомы почти не взаимодействуют друг с другом. Раскладывая в спектр излучение такого газа (нагретого до достаточно высокой температуры), мы увидим примерно следующую картину (рис. 2):
Рис. 2. Линейчатый спектр испускания
Этот линейчатый спектр, образованный тонкими изолированными разноцветными линиями, называется спектром испускания.
Любой атомарный разреженный газ излучает свет с линейчатым спектром. Более того, для каждого химического элемента спектр испускания оказывается уникальным, играя роль «удостоверения личности» этого элемента. По набору линий спектра испускания можно однозначно сказать, с каким химическим элементом мы имеем дело.
Поскольку газ разрежен и атомы мало взаимодействуют друг с другом, мы можем заключить, что свет излучают атомы сами по себе. Таким образом, атом характеризуется дискретным, строго определённым набором длин волн излучаемого света. У каждого химического элемента, как мы уже сказали, этот набор свой.
к оглавлению ▴
Спектр поглощения
Атомы излучают свет, переходя из возбуждённого состояния в основное. Но вещество может не только излучать, но и поглощать свет. Атом, поглощая свет, совершает обратный процесс — переходит из основного состояния в возбуждённое.
Снова рассмотрим разреженный атомарный газ, но на сей раз в холодном состоянии (при достаточно низкой температуре). Свечения газа мы не увидим; не будучи нагретым, газ не излучает — атомов в возбуждённом состоянии оказывается для этого слишком мало.
Если сквозь наш холодный газ пропустить свет с непрерывным спектром, то можно увидеть что-то вроде этого (рис. 3):
Рис. 3. Линейчатый спектр поглощения
На фоне непрерывного спектра падающего света появляются тёмные линии, которые образуют так называемый спектр поглощения. Откуда берутся эти линии?
Под действием падающего света атомы газа переходят в возбуждённое состояние. При этом оказывается, что для возбуждения атомов годятся не любые длины волн, а лишь некоторые, строго определённые для данного сорта газа. Вот именно эти длины волн газ и «забирает себе» из проходящего света.
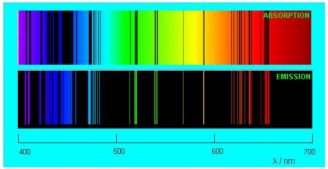
Более того, газ изымает из непрерывного спектра ровно те самые длины волн, которые излучает сам! Тёмные линии в спектре поглощения газа в точности соответствуют ярким линиям его спектра испускания. На рис. 4 сопоставлены спектры испускания и поглощения разреженных паров натрия (изображение с сайта www.nt.ntnu.no):
Рис. 4. Спектры поглощения и испускания для натрия
Впечатляющее совпадение линий, не правда ли?
Глядя на спектры испускания и поглощения, физики XIX века пришли к выводу, что атом не является неделимой частицей и обладает некоторой внутренней структурой. В самом деле, что-то ведь внутри атома должно обеспечивать механизм излучения и поглощения света!
Кроме того, уникальность атомных спектров говорит о том, что этот механизм различен у атомов разных химических элементов; стало быть, атомы разных химических элементов должны отличаться по своему внутреннему устройству.
Строению атома будет посвящён следующий листок.
к оглавлению ▴
Спектральный анализ
Использование линейчатых спектров в качестве уникальных «паспортов» химических элементов лежит в основе спектрального анализа — метода исследования химического состава вещества по его спектру.
Идея спектрального анализа проста: спектр излучения исследуемого вещества сопоставляется с эталонными спектрами химических элементов, после чего делается вывод о присутствии или отсутствии того или иного химического элемента в данном веществе. При определённых условиях методом спектрального анализа можно определить химический состав не только качественно, но и количественно.
В результате наблюдения различных спектров были открыты новые химические элементы.
Первыми из таких элементов были цезий и рубидий; они получили название по цвету линий своего спектра (В спектре цезия наиболее выражены две линии небесно-синего цвета, по-латыни называемого caesius. Рубидий же даёт две характерные линии рубинового цвета).
В 1868 году в спектре Солнца были обнаружены линии, не соответствующие ни одному из известных химических элементов. Новый элемент был назван гелием (от греческого гелиос — солнце). Впоследствии гелий был обнаружен в атмосфере Земли.
Вообще, спектральный анализ излучения Солнца и звёзд показал, что все входящие в их состав входят элементы имеются и на Земле. Таким образом, оказалось, что все объекты Вселенной собраны из одного и того же «набора кирпичиков».
Разберем задачи ЕГЭ по темам: Линейчатые спектры, спектры излучения и поглощения.
к оглавлению ▴
Линейчатые спектры
Задача 1
В 1912 г. английским физиком Альфредом Фаулером при изучении излучения вакуумных трубок, заполненных смесью водорода и гелия, была открыта спектральная серия, которую Фаулер ошибочно приписал водороду. Расчёты показывают, что одна из спектральных линий этой серии соответствует переходу электрона в атоме водорода с энергетического уровня с номером n = 3 на энергетический уровень с номером m =1,5 (хотя энергетического уровня с нецелым номером, конечно же, быть не может). Чему была равна длина волны, соответствовавшая данной спектральной линии? Ответ выразите в нанометрах и округлите до целого числа.
Дано:
n=3
m=1,5
Найти:
Решение.
Уровни энергии в атоме водорода определяются формулой: (эВ), где
и т.д. (1)
При переходе с уровня, соответствующего большему значению энергии (n=3) на уровень с меньшим значением энергии (m=1,5) происходит выделение энергии.
В соответствии с формулой (1), можно рассчитать выделившуюся энергию, которая соответствует указанному переходу
После подстановки численных значений получим:
(эВ).
Чтобы найти длину волны, соответствующую указанному излучению, надо воспользоваться формулой Планка:
С учетом перехода с уровня n на уровень m Отсюда необходимо выразить длину волны
Подстановка численных значений дает значение длины волны, соответствовавшая данной спектральной линии. В расчетах необходимо учесть, что 1эВ Дж.
(м) =
(м) = 273 (нм).
Ответ: 273 нм.
Задача 2
На рисунке показаны спектры поглощения трёх смесей неизвестных газов (1, 2 и 3), а также спектры излучения известных газов A и B. Какая из смесей содержит газ A? В качестве ответа запишите число, обозначающую смесь газов.
Решение.
На рисунке представлены линейчатые спектры смесей газов и отдельных газов. Главное свойство линейчатого спектра состоит в том, линии какого-либо вещества на спектре зависят только от свойств атомов этого вещества, но совершенно не зависят от способа возбуждения свечения атомов. Согласно рисунку, спектральные линии газа А содержатся в смеси газов 3.
Ответ: 3
Задача 3
Какую минимальную скорость должны иметь электроны, чтобы ударом перевести атом водорода из первого энергетического состояния в пятое?
Дано:
n=1
m=5
Найти:
Решение.
Уровни энергии в атоме водорода определяются формулой:
(эВ), где
и т.д.
Для перевода атома водорода из первого энергетического состояния в пятое, ему необходимо сообщить энергию, равную разности этих энергетических состояний.
Рассчитаем значение этой энергии.
(эВ)
В системе «СИ» с учетом того, что 1 эВ Дж.
(Дж).
Электроны, передающие атому водорода эту энергию, должны обладать кинетической энергией не меньшей, чем Дж.
Из последней формулы можно вывести и рассчитать скорость электронов.
масса электрона равна
кг.
(м/с) = 2,14 (Мм/с).
Ответ: 2,14 Мм/с
Спасибо за то, что пользуйтесь нашими статьями.
Информация на странице «Линейчатые спектры» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в ВУЗ или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из разделов нашего сайта.
Публикация обновлена:
09.03.2023
- Взрослым: Skillbox, Хекслет, Eduson, XYZ, GB, Яндекс, Otus, SkillFactory.
- 8-11 класс: Умскул, Лектариум, Годограф, Знанио.
- До 7 класса: Алгоритмика, Кодланд, Реботика.
- Английский: Инглекс, Puzzle, Novakid.
Спектры и спектральный анализ
Спектр – это последовательность спектральных цветов, упорядоченная по возрастанию длины волны. Он появляется при прохождении светового луча через преломляющуюся среду.
Распределение энергии в спектре
Опыты по разложению света в спектр с участием призмы, по интерференции и дифракции показывают различные оптические процессы. Таким образом, они подтверждают, что источники не дают монохроматического света, длина волн которого строго определена.
Свет несёт определённую энергию от источника теплового излучения, которая распределяется неравномерно по волнам или частотам всех длин волн в составе светового пучка. Альтернативно эта энергия распределяется на единичном интервале длин волн.
Интенсивность электромагнитного потока определяется отдельной энергией. Чтобы охарактеризовать распределение излучения по частотам, вводится новая величина – спектральная плотность потока излучения.
Спектральная плотностью потока излучения – это интенсивность излучения, приходящегося на единичный интервал частот.
Плотность потока излучения получается при суммировании выражений, характеризующих интенсивность излучения на небольших спектральных интервалах.
Обычно спектральная плотность излучения на различных частотах находится экспериментально. Используя призму, экспериментаторы получают спектр излучения определённого предмета и измеряют плотность потока излучения на спектральных интервалах маленькой ширины.
Определить распределение энергии с помощью наблюдения невозможно, ведь человеческий глаз избирательно чувствителен к световым волнам: наши зрительные органы концентрируются в жёлто-зелёной области спектра. Лучших вариантом станет использование основного свойства абсолютно чёрного тела: поглощение света всех длин волн.
Падая на поверхность тела, энергия света (излучения) вызывает его нагревание. Это означает, что судить о количестве энергии, излучаемой телом, можно, измерив температуру этого тела.
Закончив опыты, экспериментаторы построили кривую зависимости спектральной плотности интенсивности излучения от частоты.
Такое наглядное представление информации даёт понять о распределении энергии в видимой части спектра тела.
Спектральные аппараты
Спектральные аппараты – это приборы, которые дают чёткий спектр. Под этим подразумевается хорошее разделение различных волн и не допущение перекрывания каких-либо участков спектра. Основная часть спектральных аппаратов – призма или дифракционная решётка.
Чтобы понять принцип устройства и работы, обратим внимание на схему призменного спектрального аппарата:
При проведении исследования излучение попадает в трубку, один конец которой представлен ширмой с узкой щелью, а другой – собирающей линзой L1. Эта часть спектрального аппарата называется коллиматором, её составляющие находятся на фокусном расстоянии от линзы. Этот фактор обеспечивает падение расходящегося светового пучка параллельно на призму Р.
Выходящие из призмы параллельные пучки имеют разные направления, потому что им соответствуют разные частоты и показатели преломления. Все направления в итоге ведут к линзе L2, на фокусном расстоянии от которой располагается экран (матовое стекло или фотопластинка). Таким образом, фокусировка лучей обеспечит получение множества разных изображений, образующих спектр.
Второе название представленного прибора – спектрограф. Замена второй линзы и экрана на зрительную трубу для визуального наблюдения спектров переименует его в спектроскоп.
Виды спектров
Все спектры разделяются на три типа:
- Непрерывные (сплошные);
- Линейчатые;
- Полосатые.
Непрерывные (сплошные) спектры
Непрерывный (сплошной) спектр – это спектр, представляющий волны всех длин волн в данном диапазоне. Ярким примером являются солнечный спектр и спектр дугового фонаря. В них нет разрывов – на экране спектрографа наблюдается сплошная полоса разных цветов.
Появление подобного перехода объясняется кривой зависимости спектральной плотности интенсивности излучения от частоты:
Мы наблюдаем, что распределение энергии по частотам (спектральная плотность интенсивности излучения) различно для разных тел. Возьмём тело с очень тёмной поверхностью (лучше даже абсолютно чёрное тело). Оно излучает электромагнитные волны всех частот, однако свой максимум представленная кривая обретает лишь при определённой частоте. Остальные показатель частоты стремятся либо к нулю, либо – к бесконечности, поэтому энергия излучения очень маленькая. Если же повысить температуру исследуемого тела, то максимум спектральной плотности излучения сместится к коротким волнам.
Говоря об агрегатном состоянии веществ, дающих непрерывные (сплошные) спектры, следует упомянуть твёрдые тела, жидкости и сильно сжатые газы. Высокотемпературная плазма также даёт именно такие спектры.
Итак, непрерывный спектр значительно зависит от взаимодействия атомов друг с другом. Для его получения тело следует нагреть до высоких температур. Полная излучательная способность тела прямо пропорциональна четвёртой степени его абсолютной температуры.
Линейчатые спектры
Поднесём к небольшому пламени газовой горелки кусочек асбеста, предварительно смоченный раствором обыкновенной поваренной соли. Наблюдая пламя в спектроскоп, увидим на экране яркую жёлтую линию. Подобному цвету соответствуют пары натрия, образующиеся при расщеплении молекул поваренной соли (хлорида натрия) в пламени.
Во время этого опыта мы также будем наблюдать спектры водорода и гелия.
Линейчатый спектр – это спектр, который представляет собой цветные линии разной яркости, разделённые широкими тёмными полосами.
Наблюдение линейчатого спектра означает излучение веществом света лишь в определённых очень узких спектральных интервалах. Примерное распределение спектральной плотности интенсивности излучения в линейчатом спектре показано на следующем графике зависимости спектральной плотности интенсивности излучения от частоты:
Каждая изображённая линия спектра обладает конечной шириной.
Любое вещество в газообразном атомарном (не молекулярном) состоянии даст линейчатый спектр. Например, свет излучает атомы, практически не взаимодействующие друг с другом. Изолированные атомы излучают свет строго определённых длин волн. Этот тип спектров фундаментальный и основной.
Часто линейчатые спектры наблюдают при помощи свечения паров вещества в пламени или свечении газового разряда в трубке, наполненной необходимым для исследования газом.
Полосатые спектры
Полосатый спектр — это спектр, который состоит из отдельных полос, разделённых тёмными промежутками.
Качественный спектральный аппарат даёт возможность обнаружить, что каждая полоса на полосатом спектре – это совокупность большого количество тесно расположенных линий.
Линейчатые спектры образуются атомами, а полосатые молекулами, которые не связаны или слабо связаны друг с другом. Однако наблюдаются эти спектры оба при помощи свечение паров вещества в пламени или свечение газового разряда.
Спектры поглощения
Спектр поглощения – это совокупность тёмных линий на фоне непрерывного спектры (линий поглощения).
Световые волны излучает все вещества, атомы которых находятся в возбуждённом состоянии. Энергия этих волн определённым образом распределяется по длинам волн, ведь поглощение волн также зависит от длин волн. Например, через красное стекло проходят волны, соответствующие красному свету по длине волны, а поглощаются все остальные.
Когда белый свет пропускается сквозь холодный, не излучающий газ, на фоне непрерывного спектра источника появляются тёмные линии. Газ интенсивно поглотит длины волн, которые он сам испускает в сильно нагретом состоянии.
Спектральный анализ
Наибольшее значение из всех видов спектров имею линейные, ведь их структура тесно связана со строением атома. Длины волн такого спектра зависят от свойств атомов исследуемого вещества, а не от способа возбуждения свечения атомов. Атомы каждого химического элемента дают свой индивидуальный спектр из определённого набора длин волн, непохожий на спектры других элементов.
Спектральный анализ – это метод определения химического состава вещества по его спектру. Он позволяет обнаружить любой элемент в составе сложного вещества, даже при незначительной массе. Спектральный анализ требует большой точности.
Сейчас у учёных и исследователей уже составлена таблица спектров, в которой представлены спектры всех атомов. Во время её составления были обнаружены многие химические элементы, например рубидий и цезий. Их названия соответствуют цвету основных линий их спектров: рубидий – тёмно-красный, рубиновый, цезий – небесно-голубой.
Этот метод анализа достаточно прост и универсален, поэтому его используют для контроля состава веществ в металлургии, машиностроении и атомной индустрии. Химический состав руд и минералов также определяется с помощью спектрального анализа.
Спектральный анализ проводится не только по спектрам испускания, но и по спектрам поглощения. Именно так спектральный анализ позволил определить химических состав Солнца и других звёзд. Поверхность Солнца светится очень ярко, что даёт на экранах непрерывный спектр. Атмосфера Солнца избирательно поглощает этот свет, следовательно, на фоне непрерывного спектра появляются линии поглощения.
Однако атмосфера излучает и собственный свет. Таким образом, под спектральным анализом астрофизика подразумевает и определение химического состава небесных тел, и нахождение многих физических характеристик (температуры, давления, скорости движения, магнитной индукции).
Задание 19 № 2007. На рисунках А, Б и В приведены спектры излучения атомарных газов А и В и газовой смеси Б.
На основании анализа этих участков спектров можно сказать, что смесь газа содержит
1) только газы А и В
2) газы А, В и другие
3) газ А и другой неизвестный газ
4) газ В и другой неизвестный газ
Решение.
На рисунке представлены линейчатые спектры. Главное свойство линейчатого спектра состоит в том, линии какого-либо вещества на спектре зависят только от свойств атомов этого вещества, но совершенно не зависят от способа возбуждения свечения атомов. Из рисунка видно, что на спектре газовой смеси Б присутствуют те и только те линии, которые есть либо на спектре газа А, либо на спектре газа В. Этот факт говорит в пользу того, что смесь газа Б содержит только газы А и В.
Правильный ответ: 1.
Задание 19 № 2027. На рисунке приведены спектр поглощения разреженных атомарных паров неизвестного вещества (в середине) и спектры поглощения паров известных элементов (вверху и внизу).
По анализу спектров можно утверждать, что неизвестное вещество содержит
1) только кальций (Са)
2) только стронций (Sr)
3) кальций и еще какое-то неизвестное вещество
4) стронций и еще какое-то неизвестное вещество
Решение.
На рисунке представлены линейчатые спектры. Главное свойство линейчатого спектра состоит в том, линии какого-либо вещества на спектре поглощения зависят только от свойств атомов этого вещества. Из рисунка видно, что на спектре поглощения разреженных атомарных паров неизвестного вещества присутствуют все линии, которые есть на спектре стронция, нет линий, свойственных кальцию, но в тоже время есть дополнительные неизвестные линии. Этот факт говорит в пользу того, что в химический состав неизвестного вещества входит стронций и еще какое-то неизвестное вещество.
Правильный ответ: 4.
Задание 19 № 2115. На рисунке приведены фрагмент спектра поглощения неизвестного разреженного атомарного газа (в середине), спектры поглощения атомов водорода (вверху) и гелия (внизу).
В химический состав газа входят атомы
1) только водорода
2) только гелия
3) водорода и гелия
4) водорода, геля и еще какого-то вещества
Решение.
На рисунке представлены линейчатые спектры. Главное свойство линейчатого спектра состоит в том, линии какого-либо вещества на спектре поглощения зависят только от свойств атомов этого вещества. Из рисунка видно, что на спектре поглощения неизвестного разреженного атомарного газа присутствуют те и только те линии, которые есть на спектре гелия. Этот факт говорит в пользу того, что в химический состав неизвестного газа входит только гелий (то есть это и есть гелий).
Правильный ответ: 2.
|
Задание 19 № 2122. На рисунках А, Б, В приведены спектры излучения паров стронция, неизвестного образца и кальция. Можно утверждать, что в образце 1) не содержится ни стронция, ни кальция 2) содержится кальций, но нет стронция 3) содержатся и стронций, и кальций 4) содержится стронций, но нет кальция Решение. На рисунке представлены линейчатые спектры. Главное свойство линейчатого спектра состоит в том, линии какого-либо вещества на спектре pзависят только от свойств атомов этого вещества. Из рисунка видно, что на спектре излучения паров неизвестного образца присутствуют все линии, которые есть на спектре стронция, нет линий, свойственных кальцию, но в тоже время есть дополнительные неизвестные линии. Этот факт говорит в пользу того, что в образце содержится стронций, но нет кальция. Правильный ответ: 4. |
Задание 19 № 2123. Длина волны фотона, излучаемого атомом при переходе из возбужденного состояния с энергией в основное состояние с энергией
, равна (c — скорость света, h — постоянная Планка)
1)
2)
3)
4)
Решение.
Частота фотона, излучаемого атомом при переходе в состояние с более низкой энергией, связана с изменением энергии атома соотношением . Принимая во внимание связь
, получаем, что длина волны фотона равна
.
Правильный ответ: 3.
Задание 19 № 2135. Каков спектр энергетических состояний атомного ядра и какие частицы испускает ядро при переходе из возбужденного состояния в нормальное?
1) cпектр линейчатый, испускает гамма-кванты
2) cпектр сплошной, испускает гамма-кванты
3) cпектр сплошной, испускает бета-частицы
4) cпектр линейчатый, испускает альфа-частицы
Решение.
Атомная система может находиться только в особых стационарных, или квантовых, состояниях, каждому из которых соответствует определенная энергия. Таким образом, спектр энергетических состояний атомного ядра линейчатый. При переходе атома из возбужденного состояния в нормальное испускаются гамма-кванты.
Правильный ответ: 1.
Задание 19 № 3243. 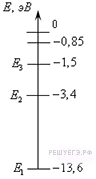
1) получить от атома энергию 3,4 эВ
2) сообщить атому энергию 3,4 эВ
3) получить от атома энергию 13,6 эВ
4) сообщить атому энергию 13,6 эВ
Решение.
Основным состоянием в атоме называется состояние с наименьшей энергии. Для водорода это уровень с энергией
. Началом отсчета энергии
является состояние, при котором ядро водорода и электрон перестают быть связанной системой. При этой энергии происходит ионизация. Таким образом, для того чтобы перевести атом водорода из основного состояния в ионизированное, необходимо сообщить ему энергию
.
|
Задание 19 № 3342. Каков заряд ядра 1) 5 2) 11 3) 16 4) 6 Решение. Числом протонов (заряд ядра в элементарных единицах заряда) записывается внизу перед наименованием элемента. Таким образом, заряд ядра Правильный ответ: 1. |
Задание 19 № 3344. Атом бора содержит
1) 8 протонов, 5 нейтронов и 13 электронов
2) 8 протонов, 13 нейтронов и 8 электронов
3) 5 протонов, 3 нейтрона и 5 электронов
4) 5 протонов, 8 нейтронов и 13 электронов
Решение.
Число электронов в нейтральном атоме совпадает с числом протонов, которое записывается внизу перед наименованием элемента. Число вверху обозначает массовое число, то есть суммарное число протонов и нейтронов. Таким образом, атом бора содержит 5 протонов, 3 нейтронов и 5 электронов.
Правильный ответ: 3.
|
Задание 19 № 3387. На рисунке приведены спектры поглощения атомарных паров неизвестного вещества и трех известных элементов. По виду спектров можно утверждать, что неизвестное вещество содержит в заметном количестве атомы 1) только стронция (Sr) и кальция (Са) 2) только натрия (Na) и стронция (Sr) 3) только стронция (Sr), кальция (Са) и натрия (Na) 4) стронция (Sr), кальция (Са), натрия (Na) и других элементов Решение. На рисунке представлены линейчатые спектры. Главное свойство линейчатого спектра состоит в том, линии какого-либо вещества на спектре поглощения зависят только от свойств атомов этого вещества. Из рисунка видно, что на спектре поглощения неизвестного вещества присутствуют все линии, которые есть на спектрах стронция, кальция и натрия. Помимо этого, на спектре есть линии, которых нет на других трех спектрах. Этот факт говорит в пользу того, что в химический состав неизвестного газа входят и стронций, и кальций, и натрий, а помимо их еще некоторые неизвестные элементы. |
Задание 19 № 3750. Линейчатые спектры поглощения и испускания характерны для
1) любых тел
2) любых нагретых тел
3) для твердых нагретых тел
4) для нагретых атомарных газов
Решение.
Спектры излучения и поглощения связаны с энергетическими переходами в веществе. Чем «сложнее» система, тем запутаннее ее спектры. Для почти свободных атомов и молекул в разрежённых газах спектры поглощения и испускания состоят из отдельных спектральных линий и потому называются линейчатым. Таким образом, линейчатые спектры поглощения и испускания характерны для атомарных газов.
Правильный ответ: 4.
Задание 19 № 3884. На рисунке схематически изображена фотография спектральных линий атомов некоторого химического элемента в ультрафиолетовой части спектра. Из этого рисунка следует, что
1) атом данного химического элемента имеет шесть электронов
2) электроны в атоме этого химического элемента могут находиться только на шести энергетических уровнях
3) электроны в атоме этого химического элемента могут находиться только на четырёх энергетических уровнях
4) только при шести переходах электронов с одного энергетического уровня на другой атом этого химического элемента испускает фотон с длиной волны, лежащей в ультрафиолетовой области спектра
Решение.
Согласно постулатам Бора, энергия излучается или поглощается атомом только при переходе электрона из одного стационарного состояния в другое, при этом частота излучения пропорциональна разности энергий стационарных состояний. Спектр изображает наблюдаемые на эксперименте частоты излучений. Поэтому из приведенного здесь схематического рисунка ультрафиолетовой части спектра можно лишь заключить, что только при шести переходах электронов с одного энергетического уровня на другой атом химического элемента испускает фотон с частотой (длиной волны), лежащей в ультрафиолетовой области спектра.
Правильный ответ: 4.
Задание 19 № 4129. 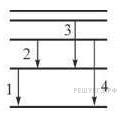
1) 1
2) 2
3) 3
4) 4
Решение.
Квант энергии излучается при переходе на более низкий уровень энергии. При этом расстояние между уровнями пропорционально импульсу излучаемого фотона: . Из диаграммы видно, что среди предложенных вариантов ответа минимальному расстоянию между уровнями, а значит, и минимальному импульсу фотона соответствует переход 2.
Правильный ответ: 2.
|
Задание 19 № 4741. Схема низших энергетических уровней атомов разреженного атомарного газа имеет вид, изображённый на рисунке. В начальный момент времени атомы находятся в состоянии с энергией 1) 0,3 эВ, 0,5эВ и1,5 эВ 2) только 1,5 эВ 3) любой в пределах от 0 до 0,5 эВ 4) только 0,3 эВ Решение. Согласно постулатам Бора, свет излучается при переходе атома на более низкие уровни энергии, при этом фотоны несут энергию, равную разности энергий начального и конечного состояний. Из приведенной здесь схемы видно, что фотон может излучиться только при переходе атома в состояние Правильный ответ: 2 |
|
Задание 19 № 4811. На рисунке указаны три низших значения энергии атома натрия. Атомы находятся в состоянии 1) произойдёт переход атомов в состояние 2) произойдёт переход атомов в состояние 3) произойдёт ионизация атомов 4) атомы не будут поглощать свет Решение. Согласно постулатам Бора, свет поглощается при переходе атома на более высокие уровни энергии, при этом фотоны должны иметь энергию, равную разности энергий конечного и начального состояний. Если атом в состоянии Из приведенной здесь схемы видно, что уровень с данной энергией действительно существует. Следовательно атомарные пары натрия будут поглощать фотоны переходить из состояния Правильный ответ: 2 |
Задание 19 № 4916. На рисунке показана схема низших энергетических уровней атома. В начальный момент времени атом находится в состоянии с энергией . Фотоны какой энергии может излучать атом?
1) только 2 эВ
2) только 2,5 эВ
3) любой, но меньшей 2,5 эВ
4) любой в пределах от 2,5 до 4,5 эВ
Решение.
Согласно постулатам Бора, свет излучается при переходе атома на более низкие уровни энергии, при этом фотоны несут энергию, равную разности энергий начального и конечного состояний. Из приведенной здесь схемы видно, что фотон может излучиться только при переходе атома в состояние , при этом его энергия будет равна .
Правильный ответ: 1
Задание 19 № 4951. На рисунке приведён спектр поглощения неизвестного газа и спектры поглощения атомарных паров известных элементов. По виду спектров можно утверждать, что неизвестный газ содержит атомы
1) азота (N), магния (Mg) и других элементов, но не калия (К)
2) только азота (N) и калия (К)
3) только магния (Mg) и азота (N)
4) магния (Mg), калия (К) и азота (N)
Решение.
На рисунке представлены линейчатые спектры. Главное свойство линейчатого спектра состоит в том, линии какого-либо вещества на спектре поглощения зависят только от свойств атомов этого вещества. Из рисунка видно, что на спектре поглощения паров неизвестного газа присутствуют все линии, которые есть на спектрах магния, калия и азота. Этот факт говорит в пользу того, что в химический состав неизвестного газа входят магний (Mg), калий (К) и азот (N).
Правильный ответ: 4
Задание 19 № 5161. На рисунках А, Б и В приведены спектры излучения паров кальция Са, стронция Sr и неизвестного образца. Можно утверждать, что в неизвестном образце
1) не содержится стронция
2) содержатся кальций и ещё какие-то элементы
3) не содержится кальция
4) содержится только кальций
Решение.
На рисунке представлены линейчатые спектры. Главное свойство линейчатого спектра состоит в том, линии какого-либо вещества на спектре излучения зависят только от свойств атомов этого вещества. Из рисунка видно, что на спектре излучения паров неизвестного газа присутствуют все линии, которые есть на спектре стронция. Этот факт говорит в пользу того, что в химический состав неизвестного газа входит стронций. С другой стороны, линий, характерных для кальция, в неизвестном спектре не наблюдается. Следовательно, неизвестный образец не содержит кальция. Таким образом, верно утверждение 3.
Правильный ответ: 3
Примечание. Можно утверждать, что в неизвестном веществе находится, например, кальций, только в том случае, если все линии кальция содержатся в спектре этого неизвестного вещества.
Задание 19 № 5196. На рисунке приведены спектры поглощения паров натрия, атомарного водорода и атмосферы Солнца.
Об атмосфере Солнца можно утверждать, что в ней
1) не содержится натрия
2) не содержится водорода
3) содержится только натрий и водород
4) содержится и натрий, и водород
Решение.
На рисунке представлены линейчатые спектры. Главное свойство линейчатого спектра состоит в том, линии какого-либо вещества на спектре зависят только от свойств атомов этого вещества. Из рисунка видно, что на спектре атмосферы Солнца присутствуют все линии, которые есть на спектрах натрия водорода. Но помимо этих линий есть еще много других. Этот факт говорит в пользу того, что в химический состав атмосферы Солнца входят натрий, водород и что-то еще. Таким образом, верно утверждение 4.
Правильный ответ: 4
Задание 19 № 5231. На рисунке приведены спектр поглощения разреженных атомарных паров неизвестного вещества и спектры поглощения атомарных паров известных элементов. Проанализировав спектры, можно утверждать, что неизвестное вещество содержит
1) только водород (Н) и гелий (Не)
2) водород (Н), гелий (Не) и натрий (Na)
3) только натрий (Na) и водород (Н)
4) натрий (Na), водород (Н) и другие элементы, но не гелий (Не)
Решение.
На рисунке представлены линейчатые спектры. Главное свойство линейчатого спектра состоит в том, линии какого-либо вещества на спектре зависят только от свойств атомов этого вещества. Из рисунка видно, что на спектре поглощения паров неизвестного газа присутствуют все линии, которые есть на спектре водорода и натрия. Линии, характерные для гелия, отсутствуют. Однако присутствуют линии, соответствующие каким-то другим элементам. Все это говорит в пользу того, что в химический состав неизвестного газа входят натрий (Na), водород (Н) и другие элементы, но не гелий (Не)
Правильный ответ: 4
Задание 19 № 5616.
Схема низших энергетических уровней атома имеет вид, изображённый на рисунке. В начальный момент времени атом находится в состоянии с энергией . Согласно постулатам Бора атом может излучать фотоны с энергией
1) только 0,5 эВ
2) только 1,5 эВ
3) любой, меньшей 0,5 эВ
4) любой в пределах от 0,5 до 2 эВ
Решение.
Согласно постулатам Бора, свет излучается при переходе атома на более низкие уровни энергии, при этом фотоны несут энергию, равную разности энергий начального и конечного состояний. Единственный переход с излучением фотонов возможен на уровень с энергией равной
Правильный ответ указан под номером 2.
Задание 19 № 6090. Бета-частица представляет собой
1) нейтрон
2) электрон
3) ядро гелия
4) ион гелия
Решение.
Бета-частица — это частица с малой массой и зарядом, равным заряду электрона. Такая частица и есть электрон.
Правильный ответ указан под номером: 2.
Задание 19 № 6125. Спектр какого типа наблюдается у излучения атомарного водорода?
1) линейчатый
2) полосатый
3) сплошной
4) ответ зависит от разрешающей силы используемого спектроскопа
Решение.
Атом водорода излучает, когда его электроны переходят с более высоких энергетических уровней на более низкие, в результате чего возникают кванты света с определённой длиной волны, то есть спектр водорода — линейчатый.
Задание 19 № 6160. Спектр какого типа наблюдается у излучения атомарного гелия?
1) линейчатый
2) полосатый
3) сплошной
4) ответ зависит от разрешающей силы используемого спектроскопа
Решение.
Атом гелия излучает, когда его электроны переходят с более высоких энергетических уровней на более низкие, в результате чего возникают кванты света с определённой длиной волны, то есть спектр гелия — линейчатый.
Задание 19 № 6204. В таблице приведены значения энергии для второго и четвёртого энергетических уровней атома водорода.
|
Номер уровня |
Энергия, 10–19 Дж |
|
2 |
–5,45 |
|
4 |
–1,36 |
Какой должна быть энергия фотона, при поглощении которого атом переходит со второго уровня на четвёртый?
1) 4,09·10−19 Дж
2) 1,36·10−19 Дж
3) 5,45·10−19 Дж
4) 6,81·10−19 Дж
Решение.
Для того, чтобы электрон перешёл со второго уровня на четвёртый под действием фотона, энергия фотона должна быть равна разности энергий четвёртого и второго энергетических уровней: −1,36 − (−5,45) = 4,09·10−19 Дж.
Правильный ответ указан под номером: 1.
Задание 19 № 6239. В таблице приведены значения энергии для третьего и четвёртого энергетических уровней атома водорода.
|
Номер уровня |
Энергия, 10–19 Дж |
|
3 |
–2,42 |
|
4 |
–1,36 |
Какой должна быть энергия фотона, при поглощении которого атом переходит с третьего уровня на четвёртый?
1) 2,42·10–19 Дж
2) 1,06·10–19 Дж
3) 1,36·10–19 Дж
4) 3,78·10–19 Дж
Решение.
Для того, чтобы электрон перешёл с третьего уровня на четвёртый под действием фотона, энергия фотона должна быть равна разности энергий четвёртого и третьего энергетических уровней: −1,36 − (−2,42) = 1,06·10−19 Дж.
Правильный ответ указан под номером: 2.
Задание 19 № 6276. На рисунке приведены спектр поглощения неизвестного газа и спектры поглощения атомарных паров известных элементов. По виду спектров можно утверждать, что неизвестный газ содержит атомы
1) только азота ()
2) азота (), магния (
) и другого неизвестного вещества
3) только магния ()
4) только магния () и азота (
)
Решение.
Сравним спектры атомов и спектры неизвестного газа. Из рисунка видно, что все линии, присутствующие в спектре магния есть и в спектре неизвестного газа. Аналогично для азота. Это означает, что газ содержит, как минимум, атомы магния и азота. Кроме линий магния и азота в спектре неизвестного газа содержатся линии, не принадлежащие ни магнию, ни азоту. Следовательно, присутствуют также атомы неизвестного вещества.
Правильный ответ указан под номером: 2.
Задание 19 № 6312. На рисунке приведены спектр поглощения неизвестного газа и спектры поглощения атомарных паров известных металлов. По виду спектров можно утверждать, что неизвестный газ содержит атомы
1) только стронция ()
2) стронция (), кальция (
) и другого вещества
3) только стронция () и кальция (
)
4) только кальция ()
Решение.
Сравним спектры атомов и спектры неизвестного газа. Из рисунка видно, что все линии, присутствующие в спектре стронция есть и в спектре неизвестного газа. Аналогично для кальция. Это означает, что газ содержит, как минимум, стронция и кальция. Кроме линий стронция и кальция в спектре неизвестного газа содержатся линии, не принадлежащие ни стронцию, ни кальцию. Следовательно, присутствуют также атомы неизвестного вещества.
Правильный ответ указан под номером: 2.
Если пропустить солнечный свет через стеклянную призму или дифракционную решётку, то на экране получится хорошо известный нам спектр. Спектр, который вы видите ниже, называется непрерывным спектром. Он представляет собой сплошную полосу, состоящую из разных цветов, плавно переходящих друг в друга.
Непрерывный (сплошной) спектр — разновидность спектра, в которой присутствуют все длины волн видимого диапазона (от красной границы до фиолетовой).
Излучения, обладающие непрерывным спектром:
- свет, излучаемый Солнцем;
- искусственный свет от лампы дневного освещения;
- любые твердые и жидкие тела, плотные газы, нагретые до высокой температуры.
Пример №1. Будет ли излучать свет в непрерывном спектре спираль работающей электроплиты?
В данном случае да, поскольку спирать — твердое тело, нагретое до высокой температуры.
Линейчатый спектр и его виды
Картина резко меняется, когда мы наблюдаем свечение, излучаемое разреженными газами. Спектр перестает быть непрерывным: в нём появляются разрывы, которые увеличиваются по мере разрежения газа. В предельном случае чрезвычайно разреженного атомарного газа спектр становится линейчатым.
Линейчатый спектр — спектр, который состоит из отдельных достаточно тонких линий.
Линейчатый спектр бывает двух видов:
- спектр испускания;
- спектр поглощения.
Спектр испускания
Предположим, что газ состоит из атомов некоторого химического элемента и разрежен настолько, что атомы почти не взаимодействуют друг с другом. Раскладывая в спектр излучение такого газа (нагретого до очень высокой температуры), мы сможем наблюдать такую картину, как на картинке ниже.
Спектр испускания — линейчатый спектр, который состоит из тонких изолированных разноцветных линий, соответствующих тем длинам волн света, который излучается атомами.
Любой атомарный разреженный газ излучает свет с линейчатым спектром. Но наибольшую важность имеет то, что для любого химического элемента спектр испускания является уникальным. Поэтому по нему можно устанавливать, какой химический элемент находится перед нами. Он является своего рода идентификатором.
Поскольку газ разрежен и атомы мало взаимодействуют друг с другом, мы можем сделать следующий вывод:
Свет излучают атомы сами по себе. Следовательно, каждый атом характеризуется дискретным, строго определённым набором длин волн излучаемого света. У каждого химического элемента этот набор свой.
Спектр поглощения
Атомы излучают свет в процессе перехода из возбуждённого состояния в основное. Но вещество может не только излучать, но и поглощать свет. При поглощении света атом совершает обратный процесс — он переходит из основного состояния в возбуждённое.
Снова рассмотрим разреженный атомарный газ, но теперь в охлажденном состоянии (при довольно низкой температуре). Свечения газа в этом случае мы не увидим. В не нагретом состоянии газ не излучает свечение, так как атомов в возбуждённом состоянии оказывается для этого слишком мало.
Если сквозь охлажденный газ пропустить свет с непрерывным спектром, мы увидим следующую картину (см. рисунок ниже).
Спектр поглощения — темные линии на фоне непрерывного спектра, соответствующие тем длинам волн света, которые поглощаются атомами и излучаются впоследствии при сильном нагревании.
Объясним, откуда берутся темные линии. Под действием падающего света газовые атомы переходят в возбуждённое состояние. При этом оказывается, что для возбуждения атомов нужны не любые длины волн, а лишь некоторые, строго определённые для данного вида газа. Именно эти длины волн газ поглощает из падающего на него света.
Внимание! Газ поглощает те длины волн, которые излучает сам. Поэтому, цветные линии на спектре испускания соответствуют темным линиям на спектре поглощения. Если их сложить, можно получить непрерывный спектр.
На рисунке ниже сопоставлены спектры испускания и поглощения разреженных паров натрия.
Глядя на спектры испускания и поглощения, ученые XIX века пришли к выводу, что атом не является неделимой частицей и обладает некоторой внутренней структурой. Ведь что-то внутри атома должно обеспечивать процессы излучения и поглощения света.
Кроме того, уникальность атомных спектров говорит о том, что этот механизм различен у атомов разных химических элементов. Поэтому атомы разных химических элементов должны отличаться по своему внутреннему устройству.
Спектральный анализ
Использование линейчатых спектров в качестве идентификаторов химических элементов лежит в основе спектрального анализа.
Спектральный анализ — метода исследования химического состава вещества по его спектру.
Идея спектрального анализа заключается в следующем. Спектр излучения исследуемого вещества сопоставляется с эталонными спектрами химических элементов. Затем делается вывод о присутствии или отсутствии различных химических элементов в исследуемом образце. При определённых условиях посредством спектрального анализа можно определить химический состав не только качественно, но и количественно.
В результате наблюдения различных спектров были открыты новые химические элементы. Первыми из таких элементов были цезий и рубидий. Названия эти элементы получили по цвету линий своего спектра. Так, в спектре цезия больше всего выражены две линии небесно-синего цвета, который на латинском языке звучит как caesius. Рубидий же даёт две отчетливые линии рубинового цвета.
В 1868 году в спектре солнечного света были обнаружены линии, не соответствующие ни одному из известных химических элементов. Этот элемент был назван гелием (от греческого гелиос — солнце). Впоследствии гелий был найден в атмосфере нашей планеты. Спектральный анализ излучения Солнца и других звезд показал, что все входящие в их состав входят элементы имеются и на Земле. Таким образом, оказалось, что все объекты Вселенной собраны из одного и того же набора элементов.
Пример №2. Какую картинку можно получить, если провести спектральный анализ вещества, состоящего из двух химических элементов?
Спектры испускания и спектры поглощения будут накладываться друг на друга. В итоге можно будет получить спектр испускания, в котором будут присутствовать все длины волн, соответствующие тем, что испускаются первым и вторым химическим элементом. В спектре поглощения эти же длины волн будут отсутствовать.
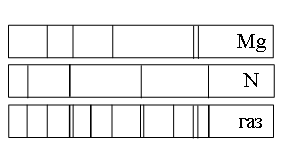
Задание EF18348
Ответ:
а) азота (N), магния (Mg) и другого неизвестного вещества
б) только азота (N)
в) только магния (Mg)
г) только магния (Mg) и азота (N)
Алгоритм решения
- Определить, при каком условии можно считать, что данный химический элемент входит в состав неизвестного газа.
- Сравнить спектр поглощения неизвестного газа и магния. Сделать вывод о том, присутствует ли магний в газе.
- Сравнить спектр поглощения неизвестного газа и азота. Сделать вывод о том, присутствует ли азот в газе.
- Установить, содержит ли неизвестный газ какие-либо еще элементы.
Решение
Если спектр поглощения неизвестного газа содержит все линии, которые есть на спектре известного элемента, то этот газ содержит этот элемент.
Видно, что спектр поглощения неизвестного газа включает в себя все линии, которые есть в спектре поглощения магния. Следовательно, этот газ содержит магний.
Видно, что спектр поглощения неизвестного газа включает в себя все линии, которые есть в спектре поглощения азота. Следовательно, этот газ также содержит азот.
Но кроме линий, соответствующих азоту и магнию, на спектре поглощения газа наблюдаются другие линии. Следовательно, газ содержит как минимум еще один элемент.
Ответ: а
pазбирался: Алиса Никитина | обсудить разбор | оценить
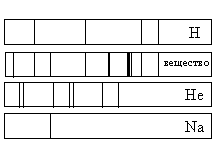
Задание EF18254
Ответ:
а) только натрий (Na) и водород (Н)
б) только водород (Н) и гелий (Не)
в) водород (Н), гелий (Не) и натрий (Na)
г) натрий (Na), водород (H) и другие элементы, но не гелий (He)
Алгоритм решения
- Определить, при каком условии можно считать, что данный химический элемент входит в состав неизвестного газа.
- Сравнить спектр поглощения неизвестного вещества и водорода. Сделать вывод о том, присутствует ли водород в веществе.
- Сравнить спектр поглощения неизвестного вещества и гелия. Сделать вывод о том, присутствует ли гелий в веществе.
- Сравнить спектр поглощения неизвестного вещества и натрия. Сделать вывод о том, присутствует ли натрий в веществе.
- Установить, содержит ли неизвестный газ какие-либо еще элементы.
Решение
Если спектр поглощения неизвестного газа содержит все линии, которые есть на спектре известного элемента, то этот газ содержит данный элемент.
Видно, что спектр поглощения неизвестного вещества включает в себя все линии, которые есть в спектре поглощения водорода и натрия. Но линий, соответствующих спектру поглощения гелия, в нем нет. Следовательно, это вещество содержит водород, натрий, но не содержит гелий.
Кроме линий, соответствующих водороду и натрию, на спектре поглощения вещества наблюдаются другие линии. Следовательно, оно содержит как минимум еще один элемент.
Ответ: г
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF17744

Можно утверждать, что в неизвестном образце
Ответ:
а) не содержится стронция
б) не содержится кальция
в) содержатся кальций и ещё какие-то элементы
г) содержится только кальций
Алгоритм решения
- Определить, при каком условии можно считать, что данный химический элемент входит в состав неизвестного образца.
- Сравнить спектр излучения неизвестного образца и стронция. Сделать вывод о том, присутствует ли стронций в составе образца.
- Сравнить спектр излучения неизвестного образца и кальция. Сделать вывод о том, присутствует ли кальций в составе образца.
- Установить, содержит ли неизвестный газ какие-либо еще элементы.
- Выбрать подходящее утверждение.
Решение
Если спектр излучения неизвестного образца содержит все линии, которые есть на спектре излучения известного элемента, то этот образец содержит данный элемент.
Видно, что спектр излучения неизвестного образца включает в себя все линии, которые есть в спектре излучения стронция. Но линий, соответствующих спектру излучения кальция, в нем нет. Следовательно, этот образец не содержит кальций.
Кроме линий, соответствующих стронцию, на спектре излучения неизвестного образца наблюдаются другие линии. Следовательно, он содержит как минимум еще один элемент.
Из всех перечисленных утверждений верным является только одно — образец не содержит кальция.
Ответ: б
pазбирался: Алиса Никитина | обсудить разбор | оценить
Алиса Никитина | Просмотров: 5.4k
Совокупность монохроматических компонент в излучении называется спектром.
Спектры излучения
Спектральный состав излучения веществ весьма разнообразен. Но, несмотря на это, все спектры, как показывает опыт, можно разделить на три типа.
Непрерывные спектры
Непрерывный спектр представлет собой сплошную разноцветную полосу.
Белый свет имеет непрерывный спектр. Солнечный спектр или спектр дугового фонаря является непрерывным. Это означает, что в спектре представлены волны всех длин. В спектре нет разрывов, и на экране спектрографа можно видеть сплошную разноцветную полосу.
Непрерывные (или сплошные) спектры, как показывает опыт, дают тела, находящиеся в твердом или жидком состоянии, а также сильно сжатые газы. Для получения непрерывного спектра нужно нагреть тело до высокой температуры. Непрерывный спектр дает также высокотемпературная плазма. Электромагнитные волны излучаются плазмой в основном при столкновении электронов с ионами.
Характер непрерывного спектра и сам факт его существования определяются не только свойствами отдельных излучающих атомов, но и в сильной степени зависят от взаимодействия атомов друг с другом.
Излучение источников, в которых свет испускается атомами вещества, имеет дискретный спектр. Они делятся на:
1. линейчатый
2. полосатый
Линейчатые спектры
Линейчатый спектр состоит изотдельных цветных линий различной яркости, разделенных широкими темными полосами.
Внесем в бледное пламя газовой горелки кусочек асбеста, смоченного раствором обыкновенной поваренной соли. При наблюдении пламени в спектроскоп на фоне едва различимого непрерывного спектра пламени вспыхнет яркая желтая линия. Эту желтую линию дают пары натрия, которые образуются при расщеплении молекул поваренной соли в пламени. На рисунке приведены также спектры водорода и гелия. Такие спектры называются линейчатыми. Наличие линейчатого спектра означает, что вещество излучает свет только вполне определенных длин волн (точнее, в определенных очень узких спектральных интервалах).
Линейчатые спектры дают все вещества в газообразном атомарном (но не молекулярном) состоянии. В этом случае свет излучают атомы, которые практически не взаимодействуют друг с другом. Это самый фундаментальный, основной тип спектров.
Изолированные атомы излучают строго определенные длины волн.
Обычно для наблюдения линейчатых спектров используют свечение паров вещества в пламени или свечение газового разряда в трубке, наполненной исследуемым газом.
При увеличении плотности атомарного газа отдельные спектральные линии расширяются, и, наконец, при очень большом сжатии газа, когда взаимодействие атомов становится существенным, эти линии перекрывают друг друга, образуя непрерывный спектр.
Полосатые спектры
Полосатый спектр состоит из отдельных полос, разделенных темными промежутками.
С помощью очень хорошего спектрального аппарата можно обнаружить, что каждая полоса представляет собой совокупность большого числа очень тесно расположенных линий. В отличие от линейчатых спектров полосатые спектры создаются не атомами, а молекулами, не связанными или слабо связанными друг с другом.
Для наблюдения молекулярных спектров так же, как и для наблюдения линейчатых спектров, обычно используют свечение паров в пламени или свечение газового разряда.
Спектры поглощения
Все вещества, атомы которых находятся в возбужденном состоянии, излучают световые волны, энергия которых определенным образом распределена по длинам волн. Поглощение света веществом также зависит от длины волны. Так, красное стекло пропускает волны, соответствующие красному свету, и поглощает все остальные.
Если пропускать белый свет сквозь холодный, неизлучающий газ, то на фоне непрерывного спектра источника появляются темные линии. Это будет спектр поглощения.
Спектр поглощения представляет собой темные линии на фоне непрерывного спектра источника.
Газ поглощает наиболее интенсивно свет как раз тех длин волн, которые он испускает в сильно нагретом состоянии. Темные линии на фоне непрерывного спектра — это линии поглощения, образующие в совокупности спектр поглощения.
Существуют непрерывные, линейчатые и полосатые спектры поглощения.
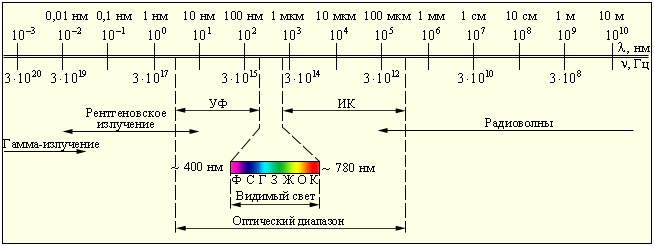
Различные виды электромагнитных излучений, их свойства и практические применения.
Шкала электромагнитных волн. Границы между различными диапазонами условны
Низкочастотные колебения.
Постоянный ток – частота ν = 0 – 10 Гц.
Атмосферные помехи и переменный ток – частота ν = 10 – 104 Гц
Радиоволны.
Частота ν =104 – 1011 Гц
Длина волны λ = 10-3 – 103 м
Получают с помощью колебательных контуров.
Свойства.
Радиоволны различных частот и с различными длинами волн по разному поглощаются и отражаются средами, проявляют свойства дифракции и интерференции.
Применение.
Радиосвязь, телевидение, радиолокация.
Инфракрасное излучение.
Частота ν =3·1011 – 4·1014 Гц
Длина волны λ = 8·10-7 – 2·10-3 м
Излучаются атомами и молекулами вещества.
Инфракрасное излучение дают все тела при любой температуре. Человек излучает электромагнитные волны λ ≈ 9·10-6 м.
Свойства.
- Проходит через некоторые непрозрачные тела, а также сквозь снег, дождь, дымку.
- Производит химическое действие на фотопластинки.
- Поглощаясь веществом, нагревает его.
- Вызывает внутренний фотоэффект у германия.
- Невидимо.
- Способно к явлениям интерференции и дифракции.
- Регистрируют тепловыми методами, фотоэлектрическими и фотографическими.
Применение.
Получают изображения предметов в темноте, приборах ночного видения, в тумане. Используют в криминалистике, в физиотерапии,. в промышленности для сушки окрашенных изделий, стен зданий, древесины, фруктов.
Видимое излучение.
Часть электромагнитного излучения, воспринимаемая глазом (от красного до фиолетового).
Частота ν =4·1014 – 8·1014 Гц
Длина волны λ = 8·10-7 – 4·10-7 м
Свойства.
Отражается, преломляется, воздействует на глаз, способно к явлениям дисперсии, интерференции, дифракции.
Ультрафиолетовое излучение.
Частота ν =8·1014 – 3·1015 Гц
Длина волны λ =·10-8 – 4·10-7 м (но меньше, чем у фиолетового света)
Источники: газоразрядные лампы с трубками из кварца(кварцевые лампы).
Излучается всеми твердыми телами, у которых t > 1000°С, а также светящимися парами ртути.
Свойства.
- Высокая химическая активность (разложение хлорида серебра, свечение кристаллов сульфида цинка).
- Невидимо.
- Большая проникающая способность.
- Убивает микроорганизмы.
- В небольших дозах благотворно влияет на организм человека (загар), но в больших дозах оказывает отрицательное биологическое воздействие: изменение в развитии клеток и обмене веществ, действие на глаза.
Применение.
В медицине, в косметологии (солярий, загар), в промышленности.
Рентгеновские лучи.
Частота ν =3·1015 – 3·1019 Гц
Длина волны λ =·10-11 – 4·10-8 м
Излучаются при резком торможении электронов, движущихся с большим ускорением.
Получают при помощи рентгеновской трубки: электроны в вакуумной трубке ускоряются электрическим полем при высоком напряжении, достигая анода, при соударении резко тормозятся. При торможении электроны движутся с ускорением и излучают электромагнитные волны с малой длиной (от 100 до 0,01 нм).
Свойства.
- Интерференция, дифракция рентгеновских лучей на кристаллической решетке.
- Большая проникающая способность.
- Облучение в больших дозах вызывает лучевую болезнь.
Применение.
В медицине (диагностика заболеваний внутренних органов), в промышленности (контроль внутренней структуры различных изделий, сварных швов).
Гамма – излучение (γ – излучение).
Частота ν =3·1020 Гц и выше
Длина волны λ =3,3·10-11 м
Источники: атомное ядро (ядерные реакции).
Свойства.
- Имеет огромную проникающую способность.
- Оказывает сильное биологическое воздействие.
Применение.
В медицине, в производстве (γ – дефектоскопия).
1. Вспоминай формулы по каждой теме
2. Решай новые задачи каждый день
3. Вдумчиво разбирай решения
Атомные спектры. Энергетические уровни
Электрон в атоме водорода перешёл с энергетического уровня с номером m в основное энергетическое состояние с номером (n = 1). При этом был испущен фотон с импульсом (6,45cdot10^{-27}) кг(cdot)м/с. Чему равен номер (m)?
Найдем энергию испущенного фотона: [E=pc=6,45cdot 10^{-27}text{ кг·м/с}cdot 3cdot 10^{8}text{кг·м/с}=19,5cdot 10^{-19}approx 12,09text{ эВ}]
Энергетические уровни водорода находятся по формуле: [E_n=-dfrac{13,6text{ эВ}}{n^2}]
Второй постулат Бора: [E=E_M-E_n]
Подставим значения: [12,09text{ эВ}=-13,6cdot text{ эВ}left(dfrac{1}{m^2}-dfrac{1}{n^2}right)] [12,09=-13,6cdotleft(dfrac{1}{m^2}-dfrac{1}{4}right)] [12,09=-13,6cdotleft(dfrac{1}{m^2}-dfrac{1}{4}right)]
Таким образом, (m=3).
Ответ: 3
Электрон в атоме водорода переходит с энергетического уровня с номером (n = 2) на энергетический уровень с (n = 1). Чему равен модуль импульса испущенного при этом фотона? Ответ выразите в кг(cdot)м/с, умножив на (10^{-27}).
Энергетические уровни водорода находятся по формуле: [E_n=-dfrac{13,6text{ эВ}}{n^2}]
Второй постулат Бора: [E=E_2-E_1]
Получим: [E=-13,6cdotleft(1-dfrac{1}{4}right)=10,2text{ эВ}]
Импульс энергии фотона: [p=dfrac{E}{c}=dfrac{10,2cdot1,6cdot10^{-19}}{3cdot10^{8}}=5,44cdot10^{27} text{ кг $cdot$ м/с}]
Ответ: 5,44
Атомные ядра с одинаковым массовым числом, но разным количеством протонов и нейтронов, принято называть изобарами. Примером изобар могут служить ядро аргона (_{18}^{40}Ar) и ядро одного из изотопов калия (_{19}K). Сколько нейтронов содержится в указанном ядре калия? ?
Количество нейтронов равно разности атомной массы и зарядового числа, тогда в указанном ядре калия: [40-19=21]
Ответ: 21
Атомные ядра с одинаковым массовым числом, но разным количеством протонов и нейтронов, принято называть изобарами. Примером изобар могут служить ядро кадмия (_{48}^{122}Cd) и ядро одного из изотопов олова (_{50}Sn). Сколько нейтронов содержится в указанном ядре олова? ?
Количество нейтронов равно разности атомной массы и зарядового числа, тогда в указанном ядре олова: [122-50=72]
Ответ: 72
Электрон в атоме водорода находится в основном (самом низком, с номером n = 1) энергетическом состоянии. Атом поглощает фотон с импульсом 6,8(cdot)10(^{-27}) кг(cdot)м/с. Найдите номер энергетического уровня, на который в результате этого перейдёт электрон.
Энергия фотона: [E_text{фот}=hnu=pc=12,75text{ эВ}] Второй постулат Бора: [hnu=E_m-E_n Rightarrow pc = dfrac{-13,6}{n^2}+13,6 Rightarrow n=4]
Ответ: 4
В таблице приведены значения энергии для второго и четвёртого энергетических уровней атома водорода. [begin{array}{|c|c|} hline text{Номер уровня
} & text{Энергия 10$^{-19}$ Дж}\ hline text{2} & text{-
5,45} \ hline text{4} & text{-1,36} \ hline end{array}]
Какой должна быть энергия фотона, при поглощении которого атом переходит со второго уровня на четвёртый? (Ответ дать в 10(^{-19}) Дж.)
Для того, чтобы электрон перешёл со второго уровня на четвёртый под действием фотона, энергия фотона должна быть равна разности энергий четвёртого и второго энергетических уровней: [(-1,36-(-5,45))10^{-19}text{ Дж}=4,09cdot 10^{-19}text{ Дж}]
Ответ: 4,09

Курс Глицин. Любовь, друзья, спорт и подготовка к ЕГЭ
Курс Глицин. Любовь, друзья, спорт и подготовка к ЕГЭ