СПИРТЫ- это соединения, содержащие помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
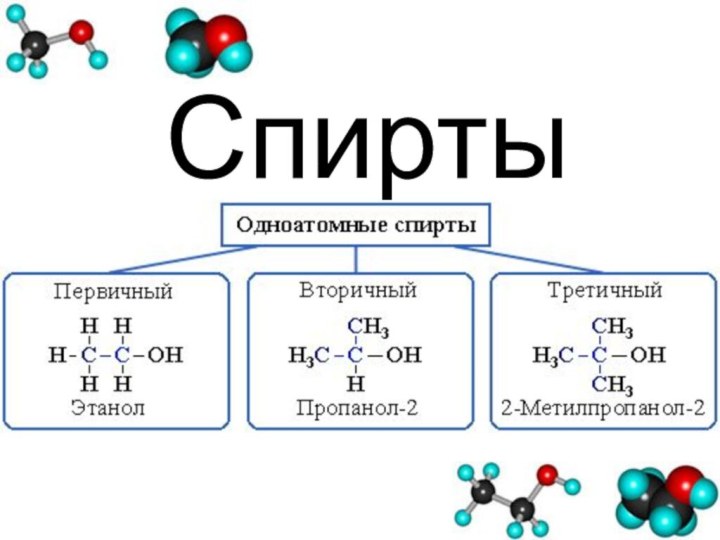
Классификация спиртов.
1.По числу гидроксильных групп:
- одноатомные (одна группа -ОН).
Общая формула CnH2n+1–OH или CnH2n+2O.
- многоатомные (две и более групп -ОН).
Общая формула CnH2n+2Om.
Современное название многоатомных спиртов — полиолы (диолы, триолы и т.д).
Двухатомный спирт – этиленгликоль (этандиол) СH2–CH2
│ │
ОН ОН
Трехатомный спирт – глицерин (пропантриол-1,2,3) СH2–СН–CH2
│ │ │
ОН ОН ОН
2. В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа:
3. По строению радикалов, связанных с атомом кислорода:
- предельные, или алканолы (например, СH3CH2–OH)
- непредельные, или алкенолы (CH2=CH–CH2–OH)
- ароматические (C6H5CH2–OH).
- Фенолы (C6H5–OH).
СТРОЕНИЕ ГИДРОКСИЛЬНОЙ ГРУППЫ.
Связи О–Н и С–О – полярные ковалентные. Это следует из различий в электроотрицательности кислорода (ЭО = 3,5), водорода (ЭО = 2,1) и углерода (ЭО = 2,4).
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Разрыв таких связей происходит преимущественно по ионному механизму.
Атому кислорода в спиртах свойственна sp3-гибридизация. В образовании его связей с атомами C и H участвуют две sp3-гибридные орбитали, валентный угол C–О–H близок к тетраэдрическому.
В фенолах одна из электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца:
ВОДОРОДНЫЕ СВЯЗИ И ФИЗИЧЕСКИЕ СВОЙСТВА СПИРТОВ
Следствием полярности связи О–Н и наличия неподеленных пар электронов на атоме кислорода является способность гидроксисоединений к образованию водородных связей:
Ассоциация молекул ROH
Это объясняет, почему даже низшие спирты — жидкости с относительно высокой температурой кипения (t кип. метанола +64,5оС). При переходе от одноатомных к многоатомным спиртам или фенолам температуры кипения и плавления резко возрастают.
Образование водородных связей с молекулами воды способствует растворимости гидроксисоединений в воде:
Гидратация молекул ROH
Метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин смешиваются с водой в любых соотношениях. Растворимость фенола в воде ограничена. C увеличением молярной массы растворимость спиртов в воде уменьшается.
Предельные одноатомные спирты
Общая формула – СnH2n+1OH или СnH2n+2O n>1
НОМЕНКЛАТУРА
В названии появляется суффикс: -«ОЛ» и номер атома углерода, к которому он присоединен. Нумерация ведется от ближайшего к ОН-группе конца цепи.
Приведенные выше соединения называют: метиловый спирт, этиловый спирт, н—пропило-вый спирт, изопропиловый спирт.
Метиловый спирт (метанол) CH3-OH
Этиловый спирт (этанол) CH3CH2-OH
В названиях многоатомных спиртов (полиолов) положение и число гидроксильных групп указывают соответствующими цифрами и суффиксами -диол (две ОН-группы), -триол (три ОН-группы) и т.д. Например:
ИЗОМЕРИЯ СПИРТОВ.
Для спиртов характерна структурная изомерия:
*изомерия положения ОН-группы (начиная с С3);
*углеродного скелета (начиная с С4);
например, формуле C4H9OH соответствует 4 структурных изомера:
*межклассовая изомерия с простыми эфирами
(например, этиловый спирт СН3CH2–OH и диметиловый эфир CH3–O–CH3).
Получение.
|
1. Щелочной гидролиз галогенпроизводных алканов. |
CH3–Br + NaOH(водн.) 🡪CH3–OH +NaBr |
|
2. Гидратация алкенов: присоединение воды к несимметричным алкенам идет по правилу Марковникова с образованием вторичных и третичных спиртов. |
CH2=CH2 + H2O –(H+)🡪CH3CH2OH CH3–CH=CH2 + H2O–(H+)🡪CH3CHCH3 ОН ОН / CH3–C=CH2 + H2O –(H+)->CH3 –C–СH3 ⎮ ⎮ СН3 СН3 |
|
3.Восстановление карбонильных соединений. |
При гидрировании альдегидов получаются первичные спирты: СН3-С=О + Н2 -(t,kat)🡪 CH3-CH2-OH ⎮ этанол Н При гидрировании кетонов образуются вторичные спирты: СН3-С=О + Н2 -(t,kat)🡪 CH3-CH-OH ⎮ ⎮ СН3 СН3 пропанол-2 |
|
4. Гидролиз сложных эфиров. |
CH3-C=O + H2O –(H2SO4,t)🡪 │ OC2H5 🡪 CH3-COOH + C2H5OH этанол |
|
5. Получение метанола из синтез-газа. |
1. Конверсия природного газа в синтез-газ: СН4 +Н2О = СО + 3Н2 2. Каталитический синтез метанола из монооксида углерода и водорода при температуре 300-400°С и давления 300—500 атм в присутствии катализатора — смеси оксидов цинка, хрома и др. Сырьем для синтеза метанола служит синтез-газ (CO + H2), обогащенный водородом: CO + 2 H2 ⇄ CH3OH Газ на выходе из реактора содержит 3-5% CH3OH, затем газ охлаждают и конденсируют полученный метанол, а оставшийся газ смешивают с исходным газом и направляют снова в реактор. |
|
6. Получение этанола спиртовым брожением. |
Спиртовое брожение глюкозы. С6Н12О6 –(фермент)-> 2С2Н5ОН + 2СО2 |
ХИМИЧЕСКИЕ СВОЙСТВА.
В химических реакциях гидроксисоединений возможно разрушение одной из двух связей:
- С–ОН с замещением или отщеплением ОН-группы
- О–Н с замещением водорода.
|
1.Одноатомные спирты реагируют с активными металлами (Na, K, Mg), образуя соли — алкоголяты (алкоксиды): |
Реакционная способность одноатомных спиртов в реакциях по связи О–Н: CH3OH > первичные > вторичные > третичные. 2R–OH + 2Na 🡪 2 R-ONa + H2 этилат калия (алкоголят) Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла: C2H5OК + H2O 🡪C2H5OH + КOH Со щелочами одноатомные спирты НЕ реагируют. |
|
2.Окисление одноатомных спиртов. |
1) Горение: 2CH3OH + 3O2 🡪2CO2 + 4H2O 2) Окисление первичных спиртов до альдегидов: Реагенты – CuO (to), O2 (Cu, to), а также дегидрирование при нагревании над медной сеткой. СН3-СН2-ОН +СuO –(to)🡪 CH3-C=O + Cu + H2O этанол ⎮ этаналь H 2) Дегидрирование: СН3-СН2-СН2-ОН –(Сu, to)🡪 CH3-CH2-C=O + H2 пропанол ⎮ пропаналь H 3) Окисление подкисленным раствором перманганата калия приводит к образованию карбоновых кислот: СН3-СН2-ОН + KMnO4 + H2SO4 -> CH3-COOH + MnSO4 + K2SO4 +H2O уксусная кислота При окислении метанола образуется углекислый газ!!! 5СН3ОН +6KMnO4 + 9H2SO4 -> 5CО2 + 6MnSO4 + 3K2SO4 +19H2O 4) При окислении вторичных спиртов любым окислителем образуются кетоны. |
|
3. Реакции замещения ОН на галоген: происходит в реакции с галогеноводородами в присутствии сильной кислоты (конц. H2SO4). |
Реакционная способность одноатомных спиртов в реакциях по связи С–О: третичные > вторичные > первичные > CH3OH |
|
4. Образование сложных эфиров. |
Спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры. |
|
5. Реакции дегидратации спиртов. |
|
|
Внутримолекулярная дегидратация: образуются алкены. |
Внутримолекулярная дегидратация спиртов с образованием алкенов идет в присутствии концентрированной серной кислоты при повышенной температуре: Основной продукт – бутен-2. Правило Зайцева – водород отщепляется от менее гидрогенизированного атома углерода. |
|
Межмолекулярная дегидратация: образуются простые эфиры. |
При межмолекулярной дегидратации спиртов также происходит нуклеофильное замещение: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. |
МНОГОАТОМНЫЕ СПИРТЫ.
ПОЛУЧЕНИЕ.
|
1.Окисление алкенов холодным водным раствором KMnO4: |
R-CH=CH2 + KMnO4 + H2O🡪 R- CH-CH2 +MnO2 + KOH алкен │ │ диол OH OH |
|
2. Замещение галогенов на гидроксогруппу: |
СН2— СН — СН2 + 3KOH 🡪 СН2— СН — СН2 + 3KCl │ │ │ (вод.р-р) │ │ │ Cl Сl Cl OH OH OH |
|
3.Восстановление поликарбонильных соединений: |
O=CH – CH =O + H2 –(t,kat)🡪 CH2-CH2 диальдегид │ │ OH OH |
ХИМИЧЕСКИЕ СВОЙСТВА.
|
1.Кислотные свойства. Этиленгликоль, глицерин вследствие взаимного влияния атомов (-I-эффект ОН-групп) являются более сильными кислотами, чем одноатомные спирты. |
Образуют соли не только в реакциях с активными металлами, но и под действием щелочей (частично и обратимо): HO–CH2-CH2–OH + 2Na 🡪 CH2-CH2 +H2 │ │ ONa ONa HO–CH2-CH2–OH +2NaOH ⇄ CH2-CH2 +2H2O │ │ ONa ONa |
|
2.Взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи, образуя комплексные соединения (качественная реакция на многоатомные спирты ): |
— ярко-синий раствор гликолята меди. |
|
3.Образование сложных эфиров азотной кислоты: реакция с азотной кислотой. |
|
|
4. Замещение ОН на галоген: также, как и одноатомные спирты, реагируют с галогеноводородами. |
HO–CH2-CH2–OH + 2HBr 🡪 CH2-CH2 + 2H2O │ │ Br Br Можно заместить 1 или 2 группы ОН. |
|
5. Окисление. Так же, как и одноатомные спирты – оксидом меди или над медной сеткой многоатомные спирты окисляются в карбонильные соединения. |
CH2-CH2 –(t,Сu)🡪 O=CH–CH=O + H2 │ │ диальдегид — глиоксаль OH OH |
ФЕНОЛЫ
Фенолы – гидроксисоединения, в молекулах которых ОН-группы связаны непосредственно с бензольным ядром.
Общая формула – СnH2n-7OH n>6 (для фенолов с одной ОН-группой)
В зависимости от числа ОН-групп различают одноатомные фенолы (например, вышеприведенные фенол и крезолы) и многоатомные. Среди многоатомных фенолов наиболее распространены двухатомные:
Изомерия
1. Фенолам свойственна структурная изомерия (изомерия положения гидроксигруппы).
2. Фенолы изомерны ароматическим спиртам
C6H4(СН3)OН – крезол и C6H5-СН2-OН бензиловый спирт
ПОЛУЧЕНИЕ.
|
1. Из хлорбензола. |
+ Cl2 –(AlCl3)🡪 C6H5Cl + HCl Хлорбензол обрабатывают избытком щелочи, получая водный раствор фенолята натрия: C6H5Cl + 2NaOH –(t,p)🡪C6H5ONa + NaCl хлорбензол фенолят натрия Затем фенол выделяют, пропуская углекислый газ. С6H5ONa + CO2 +H2O 🡪 C6H5OH + Na2CO3 |
|
2. Из кумола. |
1) Алкилирование бензола пропеном: + CH3-CH=CH2 –(H3PO4)🡪 2) Окисление кумола кислородом на катализаторе: |
СВОЙСТВА ФЕНОЛОВ.
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Сходство и отличие фенола и спиртов.
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличие:
-фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
-фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
-фенол не вступает в реакции дегидратации.
|
Кислотные свойства фенолов. |
|
|
1. Как и спирты, реагируют с активными металлами. |
2C6H5OH + 2Na ->2C6H5ONa + H2 Феноляты легко гидролизуются: C6H5ONa + HСl 🡪 C6H5OH + NaCl C6H5ONa +H2О +СО2 🡪 C6H5OH + NaНСО3 |
|
2. Реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты. |
C6H5OH + NaOH 🡪C6H5ONa + H2O |
|
Реакции фенола по бензольному кольцу. |
|
|
3. Галогенирование. Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол №1). |
|
|
4. Нитрование. Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов. При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота). |
|
|
5. Конденсация с альдегидами. С формальдегидом фенол образует фенолоформальдегидные смолы. |
|
|
5. Окисление. Фенолы легко окисляются даже под действием кислорода воздуха. |
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона образуется хинон: |
|
6. Гидрирование (восстановление) |
C6H5OН +3Н2 –(Ni)🡪 C6H11OH циклогексанол |
|
7. Качественная реакция на фенол №2: с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа. |
Слайд 1
Спирты
Слайд 2
Предельные одноатомные спирты (алканолы)
CnH2n+1OH или
R – OH
Номенклатура:
название углеводорода + ол:
этан + ол = этанол
Изомерия:
1) углеродного скелета;
2) положения функциональной
гидроксильной группы;
3) межклассовая изомерия – простые эфиры:
C2H5OH этанол – спирт, а диметиловый эфир
–межклассовый изомер CH3 – O – CH3
Слайд 3
Физ. свойства:
Даже первый спирт – жидкость;
C1-C11 — жидкости,
хорошо растворимы в воде, летучи, имеют запах,
с C12 – твердые, без запаха,
не растворимы в воде,
между молекулами возможно образование
водородных связей.
Слайд 4
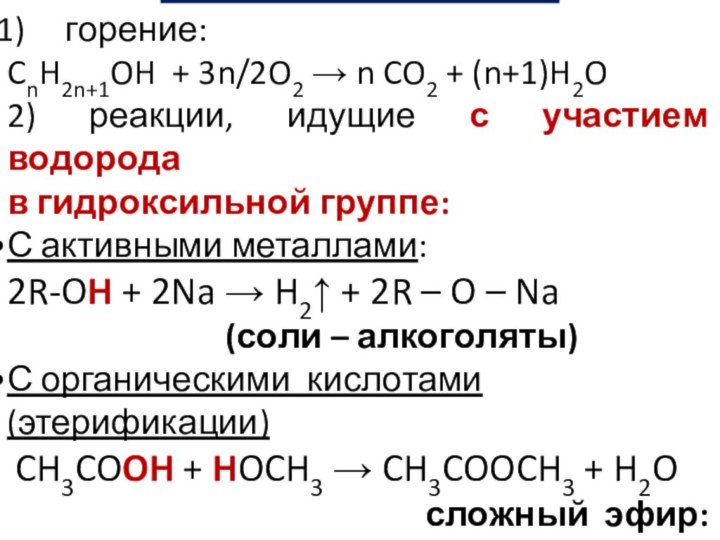
Химические свойства:
горение:
CnH2n+1OH + 3n/2O2 n CO2 + (n+1)H2O
2)
реакции, идущие с участием водорода
в гидроксильной группе:
С активными металлами:
2R-OH + 2Na H2 + 2R – O – Na (соли – алкоголяты)
С органическими кислотами (этерификации)
CH3COOH + HOCH3 CH3COOCH3 + H2O
сложный эфир: метилацетат)
Слайд 5
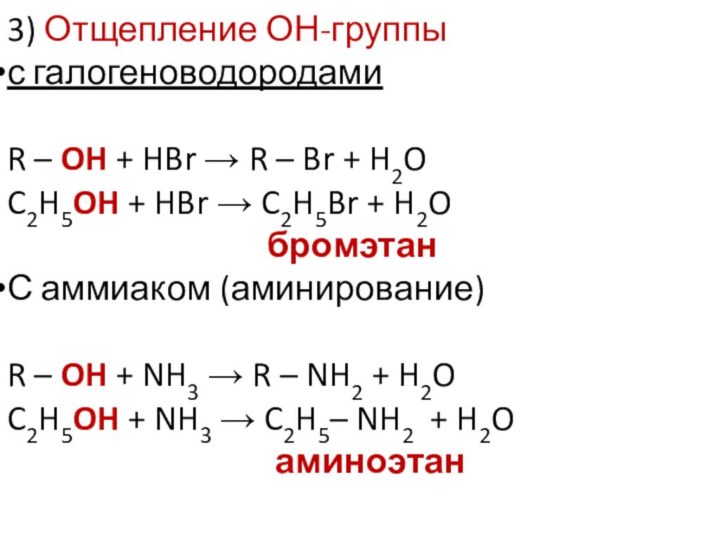
3) Отщепление ОН-группы
с галогеноводородами
R – OH + HBr
R – Br + H2O
C2H5OH + HBr C2H5Br + H2O
бромэтан
С аммиаком (аминирование)
R – OH + NH3 R – NH2 + H2O
C2H5OH + NH3 C2H5– NH2 + H2O
аминоэтан
Слайд 6
4) реакции с участием группы «ОН»
Окисление:
Первичные спирты окисляются в
альдегиды: O
//
C2H5OH + CuO CH3 – C + Cu + H2O
H этаналь
Вторичные спирты окисляются в кетоны
CH3 – CH– CH3 + CuO CH3–C–CH3 + Cu + H2O
| ||
OH O пропанон
Слайд 7
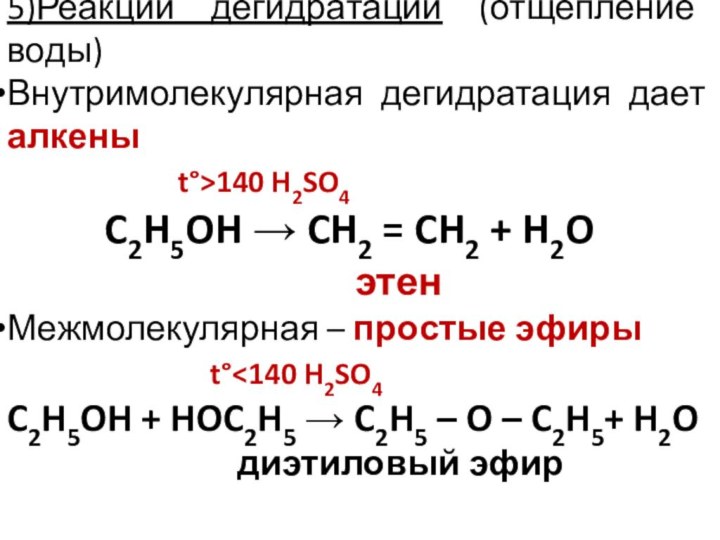
5)Реакции дегидратации (отщепление воды)
Внутримолекулярная дегидратация дает алкены
t°>140 H2SO4
C2H5OH CH2 = CH2 + H2O
этен
Межмолекулярная – простые эфиры
t°140 H2SO4
C2H5OH + HOC2H5 C2H5 – O – C2H5+ H2O
диэтиловый эфир
Слайд 8
Получение спиртов:
Гидратация алкенов:
CH2=CH2 +HOH CH3 –CH2OH
2) щелочной гидролиз
галогеналканов
C2H5Cl + KOH (водный) C2H5OH + KCl
3) восстановление альдегидов:
CH3COH + H2 C2H5OH
4) брожение глюкозы:
C6H12O6 2CO2 + 2C2H5OH
5) Из синтез-газа для метанола:
CO + 2H2 CH3OH
Слайд 9
Бутанол-1 образует сложный эфир при взаимодействии с
1) пропанолом
2) метаналем
3) муравьиной
кислотой
4) соляной кислотой
Слайд 10
При окислении метанола образуется:
метан
метаналь
3) уксусная кислота
4) хлорметан
Слайд 11
Одноатомные предельные спирты
не вступают в реакцию:
1) этерификации
2) гидрирования
3) дегидратации
4)
замещения
Слайд 12
При нагревании метанола с концентрированной серной кислотой образуется
1) диметиловый эфир
2)
метановая кислота
3) формальдегид
4) метан
Слайд 13
Сложный эфир образуется при взаимодействии этанола с
1) CH3COOH
2) CH3OH
3) HBr
4)
KMnO4
Слайд 14
Гидроксильная группа имеется в молекулах:
1) спиртов и карбоновых кислот
2) альдегидов
и простых эфиров
3) аминокислот и сложных эфиров
4) жиров и спиртов
Слайд 15
Многоатомные спирты, в отличие от одноатомных спиртов, могут реагировать с:
1)
гидроксидом меди (II)
2) щелочными металлами
3) карбоновыми кислотами
4) кислородом
Слайд 16
В отличие от пропанола-1, глицерин вступает в реакцию с
1) уксусной
кислотой
2) бромоводородом
3) кальцием
4) гидроксидом меди (II)
Слайд 17
Свежеприготовленный осадок Си(ОН)2
растворится, если к нему добавить:
пропандиол-1,2
2) Пропен
3) пропанол-1
4) пропанол-2
Слайд 18
С каждым из двух веществ: Cu(OH)2 и HCl будет взаимодействовать
1)
этиленгликоль
2) этанол
3) формальдегид
4) метанол
Слайд 19
Верны ли следующие суждения о свойствах спиртов?
А. Многоатомные спирты вступают
в реакции с гидроксидом меди (II).
Б. Среда водного раствора глицерина нейтральная.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Слайд 20
При взаимодействии фенола с натрием образуются:
1) фенолят натрия и вода
2)
фенолят натрия и водород
3) бензол и гидроксид натрия
4) бензоат натрия и водород
Слайд 21
Атом кислорода в молекуле фенола
образует:
одну σ-связь
одну σ- и одну π-связи
две σ-связи
две π-связи
Слайд 22
Верны ли следующие суждения о феноле?
А. В отличие от бензола
фенол взаимодействует с бромной водой.
Б. Для фенола характерны основные свойства.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Слайд 23
При окислении этилена водным раствором KMnO4 образуется
1) этан
2) этанол
3) глицерин
4)
этиленгликоль
Спирты
- Учитель химии высшей квалификационной категории МОУ СОШ №15 г. Балашова Саратовской области Соловова Е.А.
Цель урока
- познакомить с основами номенклатуры, типами изомерии спиртов;
- изучить физические и химические свойства спиртов, показать зависимость свойств вещества от строения молекул;
- рассмотреть общие способы получение спиртов
- закрепить представления о применении веществ, основанном на их свойствах.
Органические вещества в состав молекул которых входят углерод, водород и кислород называются КИСЛОРОДСОДЕРЖАЩИМИ.
- Органические вещества в состав молекул которых входят углерод, водород и кислород называются КИСЛОРОДСОДЕРЖАЩИМИ.
- Кислородсодержащие вещества
- Спирты
- Фенолы
- Альдегиды
- Кетоны
- Карбоновые кислоты
- Эфиры
Спирты – это производные углеводородов, в молекулах которых один или нескольких атомов водорода замещены гидроксильными группами –ОН.
- Спирты – это производные углеводородов, в молекулах которых один или нескольких атомов водорода замещены гидроксильными группами –ОН.
- -ОН
- гидроксильная группа
- R
- углеводородный радикал
Классификация спиртов.
- Классификация спиртов
- по характеру
- углеводородного
- радикала
- по количеству
- гидроксильных
- групп
- по характеру атома
- углерода, с которым
- связана
- гидроксильная группа
- Классификация спиртов
- по характеру углеводородного радикала
- Предельные
- СН3-СН2-СН2-ОН
- Непредельные
- СН2=СН-СН2-ОН
- Ароматические
- СН2-ОН
- Классификация спиртов
- по числу гидроксильных групп
- Одноатомные
- СН3-СН2-СН2-ОН
- Двухатомные
- СН2—СН2
- │ │
- ОН ОН
- Многоатомные
- СН2-СН-СН2
- │ │ │
- ОН ОН ОН
- Классификация спиртов
- по характеру атома углерода,
- с которым связана гидроксильная группа
- Первичные
- СН3-СН2-СН2-ОН
- Вторичные
- СН3-СН-СН3
- │
- ОН
- Третичные
- СН3
- │
- СН3-С-СН3
- │
- ОН
Номенклатура спиртов
- выбираем наиболее длинную углеродную цепь, содержащую гидроксильные группы.
- нумеруем атомы углерода, так чтобы сумма цифр, показывающих позицию функциональных групп была минимальна.
- даем название углеводороду с добавление суффикса –ол.
- указываем количество гидроксильных групп и номера атомов углерода около которых они располагаются.
- углеводородный радикал + ОЛ
- СН2-СН — СН2 –СН2
- │ │ │
- ОН ОН ОН
- 1+2+4=7
- 1+3+4=8
- 1
- 2
- 3
- 4
- Бутантриол -1,2,4
Дайте название веществам
- 1. СН3-СН2-СН2-СН2-ОН
- 2. СН3-СН-СН2-ОН
- │
- СН3
- 3. СН3-СН-СН2-СН3
- │
- ОН
- СН3
- │
- 4. СН3-С – СН3
- │
- ОН
Изомерия спиртов
- Изомерия спиртов
- Изомерия
- углеродного скелета
- Изомерия положения
- функциональной группы
- Межклассовая
- изомерия
- С2Н5ОН
- СН3-О-СН3
Гомологический ряд
предельных одноатомных спиртов
- СН3ОН метанол
- СН3-СН2-ОН этанол
- СН3-СН2-СН2-ОН пропанол -1
- или
- СН3-СН-СН3
- │
- ОН пропанол –2
- СnH2n+1OH
Задание
- 1.Составьте формулы всех изомеров для вещества:
- С5Н12О Дайте названия
- 2.Составьте структурную формулу простейшего представителя непредельных одноатомных спиртов, молекула которого содержит одну двойную связь. Составьте общую формулу этого класса, укажите классы соединений, имеющих такую же общую формулу.
Физические свойства
- Агрегатное состояние:
- С1-С11- жидкости
- С12 –С…- твердые вещества
- Запах
- С1-С3- «спиртовой» запах
- С4-С6- «сивушный» запах
- С11- запаха нет
- Растворимость в воде, легче воды.
- высокая
- Б/цвета
Водородная связь- связь между атомами водорода одной молекулы и атомом сильно электроотрицательных элементов (кислорода, фтора) другой молекулы.
- ▪ ▪ ▪ О-Н ▪ ▪ ▪ О-Н ▪ ▪ ▪ О-Н ▪ ▪ ▪
- │ │ │
- R R R
- Почему возможна водородная связь у спиртов??
Строение спиртов
- Связи О–Н и С–О — полярные ковалентные. Это следует из различий в электроотрицательности кислорода, водорода и углерода. Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Ответьте на вопросы
(работа в парах)
- 1. Чем объясняется разница в растворимости этанола и пропанола в воде?
- 2.Известно, что растворимость спиртов в воде уменьшается с увеличением числа атомов углерода в цепи. Объясните этот факт. Растворимость какогос пирта в воде будет выше: бутанола-1 или бутандиола-1.2
Получение спиртов.
- 1.Гидратацией алкенов.
- СН2=СН2+ Н2О →СН3-СН2-ОН
- 2. Специфические
- а)Метанола – из синтез – газа
- СО+2Н2→СН3ОН
- б) этанола – брожением
- С6Н12О6→2С2Н5ОН + 2 СО2
3. Из галогенпроизводных:
- Способы получения
- 3. Из галогенпроизводных:
- H2O
- R – Cl + NaOH R – OH + NaCl
- 4. Окисление алкенов:
Химические свойства спиртов
- В химических реакциях гидроксисоединений возможно разрушение одной из двух связей:
- С–ОН с отщеплением ОН-группы
- О–Н с отщеплением Н (водорода).
- Это могут быть реакции замещения, в которых происходит замена ОН или Н, или реакция отщепления (элиминирования), когда образуется двойная связь.
как основание
- Химические свойства.
- как основание
- 2 R– OH + HCl R – Cl + H2O
- 2) как кислота
- 2R – OH + 2Na 2R – O – Na + H2
- алкоголят
3) Дегидратация ( -H2O)
- 3) Дегидратация ( -H2O)
- a)Межмолекулярная дегидратация
- до 140’с
- R – CH2 – OH + HO – CH2 – R H2O +
- R – CH2 — O –CH2 – R
- простой эфир
- б) Внутримолекулярная
- H H после 140оС
- R – C – C – O – H R – CH = CH2 + H2O
- H H алкен
Реакция этерификации
- Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).
Окисление
- Окислители — KMnO4, K2Cr2O7+H2SO4, O2+катализатор. Легкость окисления спиртов уменьшается в ряду:
- первичные > вторичные > третичные.
Применение этилового спирта
Спирт — ксенобиотик
- Ксенобиотики – это вещества, которые не содержатся в человеческом организме, но влияют на его жизнедеятельность:
- питательные вещества, которые обеспечивают организм энергией;
- лекарственные вещества, влияющие на самочувствие, воздействуя на биохимические процессы в организме;
- яды-вещества, нарушающие естественные биологические процессы, вызывая нарушения в работе организме или смерть.
Тестирование
- http://www.chemistry.ssu.samara.ru/test/ROH.htm
Источники
- 1. http://cnit.ssau.ru/organics/index.htm
- Органическая химия: Электронный учебник для средней школы
- Под редакцией Г.И. Дерябиной, А.В. Соловова
- 2.Презентация «Спирты» Полуэктова И.А.
- 3.http://www.chemistry.ssu.samara.ru/test/ROH.htm
Вы можете бесплатно и без регистрации скачать любую из 8695 презентаций на тему спирт
План изучения класса: «Спирты» 1. С С пппп ииии …
… ееее рррр ииии нннн Спирты Спиртами (алканолами) называются органические вещества … метанол э этанол метиловый спирт тиловый спирт Двухатомные спирты (гликоли) HO – … Окисление вторичных спиртов Дегидрирование спиртов При пропускании паров спирта при 200 …
Многоатомные спирты они же: полиспирты и полиолы.
… , как сосудорасширяющее средство. Получение многоатомных спиртов Спирты синтезируют путем восстановления моносахаридов, конденсации … СПИРТЫ К высшим спиртам (техническое название высшие жирные спирты — ВЖС) относят такие алифатические спирты …
Спирти — похідні вуглеводнів, у …
… і їх також називають багатоатомними спиртами. Етиловий спирт, вірніше рослинний хм … ідроксильних груп, називають багатоатомними. Якщо спирт походить від насиченого вуглеводню … ік, включені ізопропіловий спирт, н- бутиловий спирт, синтетичний етанол, пропіленгл …