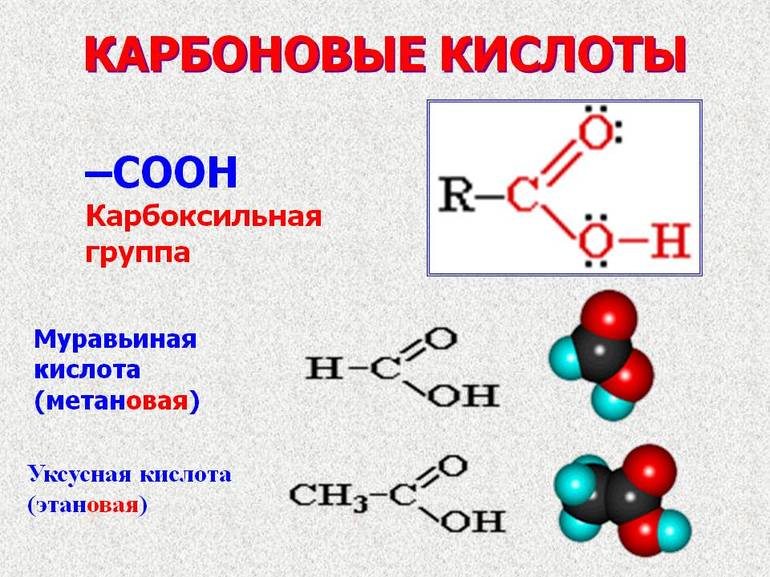
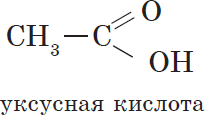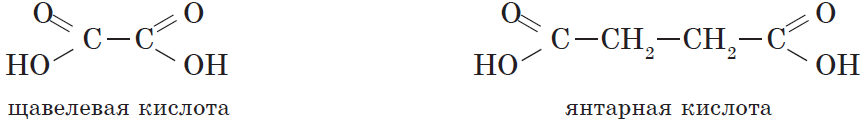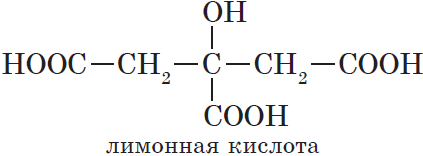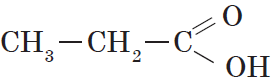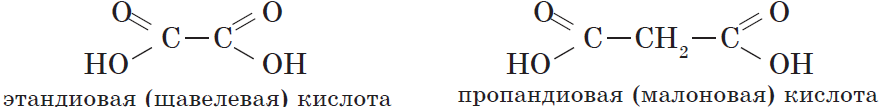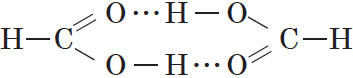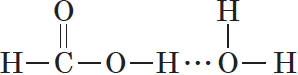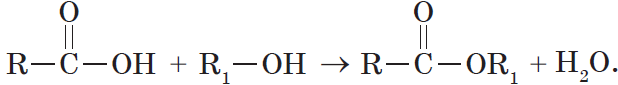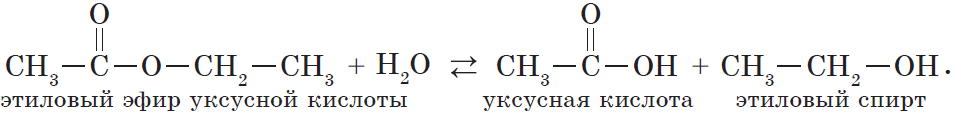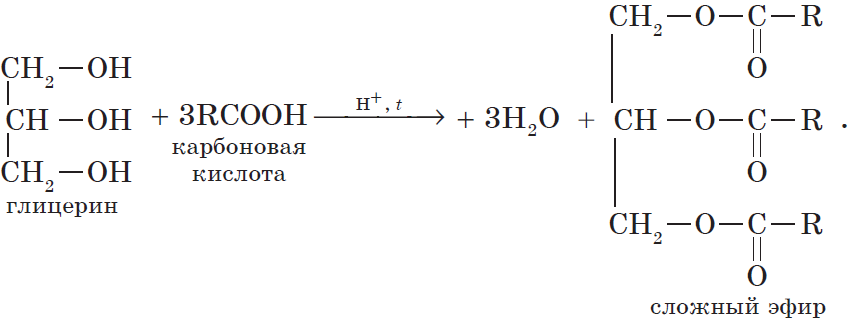Вещества, содержащие в молекуле одну или несколько карбоксильных групп, называются карбоновыми кислотами.
Группа атомов 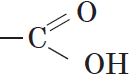
Органические кислоты, содержащие в молекуле одну карбоксильную группу, являются одноосновными.
Общая формула этих кислот $RCOOH$, например:
Карбоновые кислоты, содержащие две карбоксильные группы, называются двухосновными. К ним относятся, например, щавелевая и янтарная кислоты:
Существуют и многоосновные карбоновые кислоты, содержащие более двух карбоксильных групп. К ним относится, например, трехосновная лимонная кислота:
В зависимости от природы углеводородного радикала карбоновые кислоты делятся на предельные, непредельные, ароматические.
Предельными, или насыщенными, карбоновыми кислотами являются, например, пропановая (пропионовая) кислота:
или уже знакомая нам янтарная кислота.
Очевидно, что предельные карбоновые кислоты не содержат $π$-связей в углеводородном радикале. В молекулах непредельных карбоновых кислот карбоксильная группа связана с ненасыщенным, непредельным углеводородным радикалом, например, в молекулах акриловой (пропеновой) $СН_2=СН—СООН$ или олеиновой $СН_3—(СН_2)7—СН=СН—(СН_2)7—СООН$ и других кислот.
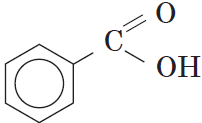
Как видно из формулы бензойной кислоты, она является ароматической, так как содержит в молекуле ароматическое (бензольное) кольцо:
Номенклатура и изомерия
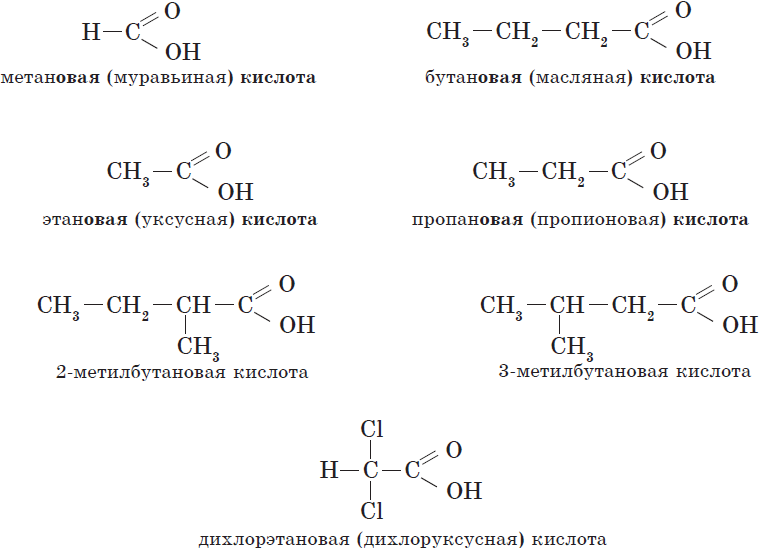
Общие принципы образования названий карбоновых кислот, как и других органических соединений, уже рассматривались. Остановимся подробнее на номенклатуре одно- и двухосновных карбоновых кислот. Название карбоновой кислоты образуется от названия соответствующего алкана (алкана с тем же числом атомов углерода в молекуле) с добавлением суффикса -ов-, окончания -ая и слова кислота. Нумерация атомов углерода начинается с карбоксильной группы. Например:
Количество карбоксильных групп указывается в названии префиксами ди-, три-, тетра-:
Многие кислоты имеют и исторически сложившиеся, или тривиальные, названия.
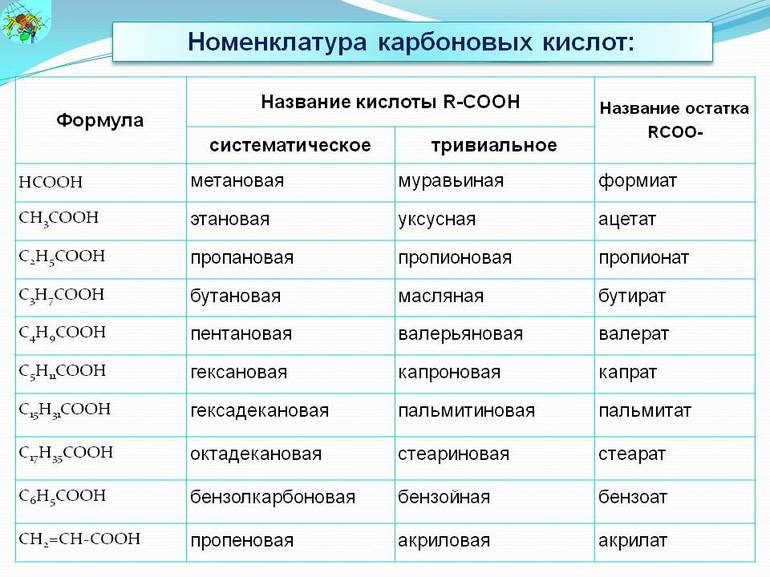
Названия карбоновых кислот.
| Химическая формула | Систематическое название кислоты | Тривиальное название кислоты |
| $Н—СООН$ | Метановая | Муравьиная |
| $СН_3—СООН$ | Этановая | Уксусная |
| $СН_3—СН_2—СООН$ | Пропановая | Пропионовая |
| $СН_3—СН_2—СН_2—СООН$ | Бутановая | Масляная |
| $СН_3—СН_2—СН_2—СН_2—СООН$ | Пентановая | Валериановая |
| $СН_3—(СН_2)4—СООН$ | Гексановая | Капроновая |
| $СН_3—(СН_2)5—СООН$ | Гептановая | Энантовая |
| $НООС—СООН$ | Этандиовая | Щавелевая |
| $НООС—СН_2—СООН$ | Пропандиовая | Малоновая |
| $НООС—СН_2—СН_2—СООН$ | Бутандиовая | Янтарная |
После знакомства с многообразным и интересным миром органических кислот рассмотрим более подробно предельные одноосновные карбоновые кислоты.
Понятно, что состав этих кислот выражается общей формулой $С_nН{2n}О_2$, или $С_nН{2n+1}СООН$, или $RCOOH$.
Физические и химические свойства
Физические свойства.
Низшие кислоты, т.е. кислоты с относительно небольшой молекулярной массой, содержащие в молекуле до четырех атомов углерода, — жидкости с характерным резким запахом (вспомните запах уксусной кислоты). Кислоты, содержащие от $4$ до $9$ атомов углерода, — вязкие маслянистые жидкости с неприятным запахом; содержащие более $9$ атомов углерода в молекуле — твердые вещества, не растворяющиеся в воде. Температуры кипения предельных одноосновных карбоновых кислот увеличиваются с ростом числа атомов углерода в молекуле и, следовательно, с ростом относительной молекулярной массы. Так, например, температура кипения муравьиной кислоты равна $100,8°С$, уксусной — $118°С$, пропионовой — $141°С$.
Простейшая карбоновая кислота — муравьиная $НСООН$, имея небольшую относительную молекулярную массу $(M_r(HCOOH)=46)$, при обычных условиях является жидкостью с температурой кипения $100,8°С$. В то же время бутан $(M_r(C_4H{10})=58)$ в тех же условиях газообразен и имеет температуру кипения $–0,5°С$. Это несоответствие температур кипения и относительных молекулярных масс объясняется образованием димеров карбоновых кислот, в которых две молекулы кислоты связаны двумя водородными связями:
Возникновение водородных связей становится понятным при рассмотрении строения молекул карбоновых кислот.
Молекулы предельных одноосновных карбоновых кислот содержат полярную группу атомов — карбоксил 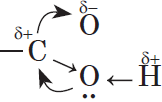
Муравьиная и уксусная кислоты растворимы в воде неограниченно. Очевидно, что с увеличением числа атомов в углеводородном радикале растворимость карбоновых кислот снижается.
Химические свойства.
Общие свойства, характерные для класса кислот (как органических, так и неорганических), обусловлены наличием в молекулах гидроксильной группы, содержащей сильную полярную связь между атомами водорода и кислорода. Рассмотрим эти свойства на примере растворимых в воде органических кислот.
1. Диссоциация с образованием катионов водорода и анионов кислотного остатка:
$CH_3-COOH⇄CH_3-COO^{-}+H^+$
Более точно этот процесс описывает уравнение, учитывающее участие в нем молекул воды:
$CH_3-COOH+H_2O⇄CH_3COO^{-}+H_3O^+$
Равновесие диссоциации карбоновых кислот смещено влево; подавляющее большинство их — слабые электролиты. Тем не менее, кислый вкус, например, уксусной и муравьиной кислот объясняется диссоциацией на катионы водорода и анионы кислотных остатков.
Очевидно, что присутствием в молекулах карбоновых кислот «кислого» водорода, т.е. водорода карбоксильной группы, обусловлены и другие характерные свойства.
2. Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений до водорода: $nR-COOH+M→(RCOO){n}M+{n}/{2}H_2↑$
Так, железо восстанавливает водород из уксусной кислоты:
$2CH_3-COOH+Fe→(CH_3COO){2}Fe+H_2↑$
3. Взаимодействие с основными оксидами с образованием соли и воды:
$2R-COOH+CaO→(R-COO){2}Ca+H_2O$
4. Взаимодействие с гидроксидами металлов с образованием соли и воды (реакция нейтрализации):
$R—COOH+NaOH→R—COONa+H_2O$,
$2R—COOH+Ca(OH)2→(R—COO){2}Ca+2H_2O$.
5. Взаимодействие с солями более слабых кислот с образованием последних. Так, уксусная кислота вытесняет стеариновую из стеарата натрия и угольную из карбоната калия:
$CH_3COOH+C_{17}H_{35}COONa→CH_3COONa+C_{17}H_{35}COOH↓$,
$2CH_3COOH+K_2CO_3→2CH_3COOK+H_2O+CO_2↑$.
6. Взаимодействие карбоновых кислот со спиртами с образованием сложных эфиров — реакция этерификации (одна из наиболее важных реакций, характерных для карбоновых кислот):
Взаимодействие карбоновых кислот со спиртами катализируется катионами водорода.
Реакция этерификации обратима. Равновесие смещается в сторону образования сложного эфира в присутствии водоотнимающих средств и при удалении эфира из реакционной смеси.
В реакции, обратной этерификации, которая называется гидролизом сложного эфира (взаимодействие сложного эфира с водой), образуются кислота и спирт:
Очевидно, что реагировать с карбоновыми кислотами, т.е. вступать в реакцию этерификации, могут и многоатомные спирты, например глицерин:
Все карбоновые кислоты (кроме муравьиной) наряду с карбоксильной группой содержат в молекулах углеводородный остаток. Безусловно, это не может не сказаться на свойствах кислот, которые определяются характером углеводородного остатка.
7. Реакции присоединения по кратной связи — в них вступают непредельные карбоновые кислоты. Например, реакция присоединения водорода — гидрирование. Для кислоты, содержащей в радикале одну $π$-связь, можно записать уравнение в общем виде:
$C_{n}H_{2n-1}COOH+H_2{→}↖{катализатор}C_{n}H_{2n+1}COOH.$
Так, при гидрировании олеиновой кислоты образуется предельная стеариновая кислота:
${C_{17}H_{33}COOH+H_2}↙{text»олеиновая кислота»}{→}↖{катализатор}{C_{17}H_{35}COOH}↙{text»стеариновая кислота»}$
Непредельные карбоновые кислоты, как и другие ненасыщенные соединения, присоединяют галогены по двойной связи. Так, например, акриловая кислота обесцвечивает бромную воду:
${CH_2=CH—COOH+Br_2}↙{text»акриловая(пропеновая)кислота»}→{CH_2Br—CHBr—COOH}↙{text»2,3-дибромпропановая кислота»}.$
8. Реакции замещения (с галогенами) — в них способны вступать предельные карбоновые кислоты. Например, при взаимодействии уксусной кислоты с хлором могут быть получены различные хлорпроизводные кислоты:
$CH_3COOH+Cl_2{→}↖{Р(красный)}{CH_2Cl-COOH+HCl}↙{text»хлоруксусная кислота»}$,
$CH_2Cl-COOH+Cl_2{→}↖{Р(красный)}{CHCl_2-COOH+HCl}↙{text»дихлоруксусная кислота»}$,
$CHCl_2-COOH+Cl_2{→}↖{Р(красный)}{CCl_3-COOH+HCl}↙{text»трихлоруксусная кислота»}$
Отдельные представители карбоновых кислот и их значение
Муравьиная (метановая) кислота ХЦООХ — жидкость с резким запахом и температурой кипения $100.8°С$, хорошо растворима в воде. Муравьиная кислота ядовита, при попадании на кожу вызывает ожоги! Жалящая жидкость, выделяемая муравьями, содержит эту кислоту. Муравьиная кислота обладает дезинфицирующим свойством и поэтому находит свое применение в пищевой, кожевенной и фармацевтической промышленности, медицине. Она используется при крашении тканей и бумаги.
Уксусная (этановая) кислота $CH_3COOH$ — бесцветная жидкость с характерным резким запахом, смешивается с водой в любых cоотношениях. Водные растворы уксусной кислоты поступают в продажу под названием уксуса ($3–5%$-ный раствор) и уксусной эссенции ($70–80%$-ный раствор) и широко используются в пищевой промышленности. Уксусная кислота — хороший растворитель многих органических веществ и поэтому используется при крашении, в кожевенном производстве, в лакокрасочной промышленности. Кроме этого, уксусная кислота является сырьем для получения многих важных в техническом отношении органических соединений: например, на ее основе получают вещества, используемые для борьбы с сорняками, — гербициды.
Уксусная кислота является основным компонентом винного уксуса, характерный запах которого обусловлен именно ею. Она — продукт окисления этанола и образуется из него при хранении вина на воздухе.
Важнейшими представителями высших предельных одноосновных кислот являются пальмитиновая $C_{15}H_{31}COOH$ и стеариновая $C_{17}H_{35}COOH$ кислоты. В отличие от низших кислот, эти вещества твердые, плохо растворимы в воде.
Однако их соли — стеараты и пальмитаты — хорошо растворимы и обладают моющим действием, поэтому их еще называют мылами. Понятно, что эти вещества производят в больших масштабах. Из непредельных высших карбоновых кислот наибольшее значение имеет олеиновая кислота $C_{17}H_{33}COOH$, или $CH_3 — (CH_2)_7 — CH=CH —(CH_2)_7COOH$. Это маслоподобная жидкость без вкуса и запаха. Широкое применение в технике находят ее соли.
Простейшим представителем двухосновных карбоновых кислот является щавелевая (этандиовая) кислота $HOOC—COOH$, соли которой встречаются во многих растениях, например в щавеле и кислице. Щавелевая кислота — это бесцветное кристаллическое вещество, хорошо растворяется в воде. Она применяется при полировке металлов, в деревообрабатывающей и кожевенной промышленности.
Понятие кислота
В 1877 году химик из Швеции Сванте Аррениус предложил разделять ряд веществ на основания и кислоты. Согласно его теории, если при растворении в воде элемент высвобождает протон водорода Н+, его нужно относить к кислоте, а если гидроксид-иона (ОН-), то к основанию. Это правило позволило объяснить нейтрализацию веществ при взаимодействии друг с другом. Позже учёный дал уточнение, что сталкивание гидроксид-иона с ионом водорода образовывает воду H2O.
В начале двадцатого века британец Томас Лаури и датчанин Йоханнсен Брёнстед расширили определение. Они предложили относить к кислотам любую молекулу (ион), способную отдавать протон. Это позволило описать реакции, проходящие c водой, например, хлорид аммония.
В 1923 году американец Льюис на основании двух определений сформулировал своё правило. Его формулировка и стала использоваться повсеместно. По нему, кислота — это химическое соединение, принимающее электронную пару и образовывающее ковалентную связь. Основание же, напротив — соединение, способное избавляться от электронной пары.
Все кислоты в химии принято разделять на 2 типа:
- Кислородосодержащие;
- Бескислородные.
Кроме этого, соединения могут быть одноосновными, двухосновными или трёхосновными. Все кислоты, за исключением кремниевой, отлично растворяются в воде. При взаимодействии с основаниями образуют соль, воду и кислотный остаток. Протекание реакции при соприкосновении с металлами происходит не всегда. Взаимодействие возможно лишь элементов, которые располагаются левее водорода. При этом кислотное соединение должно быть не только сильным, но и способным отдавать частицы водорода, которые выделяются во время взаимодействия.
Кислотные растворы могут изменять цвет. Так, лакмус становится красным. Соединение при взаимодействии имеет кислый вкус, появляется электрическая проводимость.
Если же в кислотный раствор добавить спирт, образуется сложный эфир. Все приведенные свойства характерны как для органических соединений, так и неорганических.
Особенности органического класса
Органическая химия изучает синтезирование углеводородов и их производство. Производные соединения углерода и водорода в молекулах относятся к карбоксильной группе (- COOH). Название веществ состоит из двух элементов: карбонита и гидроксила. Свойства же группы определяется смещением электронной плотности к карбонильному кислороду и образованной поляризацией связи O-H.
Другое название карбонатных кислот — органические. Их свойства определяются строением. Особенности группы из-за диссоциации с образованием частиц водорода в том, что её свойства совпадают с минеральными кислотами. Некоторые соединения, например, уксусная кислота (СН3СОOН) в своей молекуле имеют углеводородный радикал, поэтому возможны реакции, сопровождающиеся выбиванием водорода галогеном. Этот процесс приводит к повышению степени диссоциации, и кислота становится сильнее.
Из свойств органических соединений можно выделить:
- При реагировании с металлами образуется соль и водород — CH3-CH2-COOH + K → CH3-CH2-COO-K + H2.
- Реакция с галогенами описывается формулой: CH3 — CH2 — C = O (-OH) + Cl2 → CH3 — CH (-Cl) — C = O (-OH) + HCl, то есть протекает с появлением галогеносодержащих кислот.
- Взаимодействие со спиртом приводит к возникновению эфира: CH3 — CH2 — COOH + CH3 — OH → CH3 — COOH — CH3.
- При реагировании с металлами образуется соль и вода: CH3-CH2-COOH + MgO →Mg (CH3-CH2-COO)2 + H2O.
- Соединение с солью приводит к слабой кислотности с образованием иной соли: CH3CH2-COO-Na + H2O + CO2.
Так как карбоновые кислоты распадаются на ионы, степень растворимости и достаточно большая температура кипения определяют межмолекулярные водородные связи. При этом с возрастанием молекулярной массы растворимость соединения уменьшается.
Карбоновые кислоты принято разделять и по природе углеводородного радикала: они бывают алифатическими, ароматическими и алициклическими. Если же в первом типе содержится более шести атомов углерода, соединение называют жирной кислотой. Это происходит из-за того, что в виде сложных эфиров они являются частью природных жиров и масел.
Ароматическая представляет собой бензойную и дикарбоновую кислоту, а алициклическая – циклопропан-карбоновую и циклогексанкарбоновую кислоты. Из структуры соединений выделяют радикалы (ацилы). Подписывают их используя суффикс – ил., например, бутрил, формил.
Таблица соединений
Существует две системы обозначений для карбоновых соединений. Их классификация допускает использование тривиального названия и по ИЮПАК. В то же время применение систематической номенклатуры считается более предпочтительной. Всё дело в том, что тривиальные имена не содержат сведений о составе и строении соединений, а некоторые сложные эфиры и соли вовсе не имеют сокращённых наименований.
В мире насчитывается более сотни различных видов органических кислот. Они входят в компоненты природных вод и связаны с жизнедеятельностью человека, животных и растений. Общую формулу для всей группы можно изобразить как R—COOH. Из наиболее популярных соединений можно выделить:
| Тривиальное имя | Название по ИЮПАК | Содержащиеся соли и эфиры | Номер регистрации по CAS |
| Адипиновая | Гександиовая | Адипинаты | 124-04-9 |
| Акриловая | Пропеновая | Акрилаты | 79-10-7 |
| Аспарагин | 4-амид-2-аминобутандиовая | 70-47-3 | |
| Бензиловая | Гидроксидифенилуксусная | 76-93-7 | |
| Валериановая | Пентановая | Валераты | 109-52-4 |
| Ванилиновая | 4-гидрокси-3-метоксибензойная | 121-34-6 | |
| Винная | 2,3-дигидроксибутандиовая | Тартраты | 133-37-9 |
| Виноградная | DL-винная | 526-83-0 | |
| Гистидин | 2-амино-3-(4-имидазолил)пропановая | 351-50-8 | |
| Глицин | Аминоуксусная | 56-40-6 | |
| Изоянтарная | Метилмалоновая | 516-05-2 | |
| Камфорная | цис-1,2,2-триметилциклопентан-1,3-дикарбоновая кислота | 560-09-8 | |
| Кофейная | 3-(3,4-дигидроксифенил)пропеновая | 331-39-5 | |
| Лимонная | 2-гидрокси-1,2,3-пропантрикарбоновая | Цитраты | 77-92-9 |
| Лимонно-яблочная | 2-гидрокси-2-метилбутандиовая | 597-44-4 | |
| Мелиссовая | Триаконтановая | Мелиссаты | 506-50-3 |
| Молочная | 2-гидроксипропановая | Лактаты | 50-21-5 |
| Никотиновая | Пиридин-3-карбоновая | Никотинаты | 59-67-6 |
| Оксаминовая | Моноамид щавелевая | 471-47-6 | |
| Пенициллиновая | (2Z)-3-метокси-5-метил-4-оксо-2,5-гексадиеновая | 90-65-3 | |
| Пробковая | Октандиовая | Субераты | 505-48-6 |
| Салициловая | 2-гидроксибензойная | Салицилаты | 69-72-7 |
| Травматиновая | 2-додецендиовая | 64-02-36-4 | |
| Уксусная | Этановая | Ацетаты | 64-19-7 |
| Фенантровая | 1-фенантренкарбоновая | 27875-89-4 | |
| Фолиевая | 59-30-3 | ||
| Яблочная | Малаты | 6915-15-7 |
Отдельно нужно выделить муравьиную кислоту (HCOOH). Это одноосновное соединение. В природе она вырабатывается у пчёл, муравьёв, содержится в крапиве и хвое. Проявляет восстановительные свойства. Эта кислота очень востребована как антибактериальное средство.
Происхождение и получение
Получение HOOC-соединений связано с окислением спиртов. Протекающую реакцию окисления этилового спирта можно записать как CH3 – CH2 – OH → CH3 – C = O (-OH) + H2O. Окисление же уксусного альдегида выглядит следующим образом: CH3 – C = O (H) → CH3 – C =O (-OH). Образование возможно и гидролизом нитрилов. Побочным продуктом является аммиак: CH3 – C = N + H2O → CH3 – C = O (-OH) + NH3.
Карбоновую кислоту можно создать гидролизом сложного эфира. В результате реакции получается спирт. Что интересно, если в реакции использовать щёлочь, продуктом станет соль. Но если её поместить в минеральную кислоту, получится органическая. Реакция имеет вид: СH3 – C = O (-CH3) + H2O → CH3 – C = O (-OH) – CH3OH. Этот способ применяется для получения высших соединений: пальмитинового ( C 16 H 32 O 2), стеаринового ( c17h35cooh), олеинового ( c17h33cooh). При этом в воде они не растворяются.
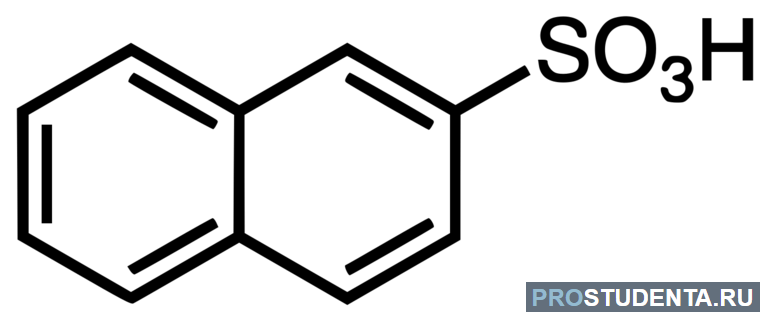
Сульфокислоты, описываемые формулой RSO3H с органическим радикалом, по функциям сходны с сульфогруппой -SO3H. Получают их путём сульфирования ароматических углеводов. Например, нуклеофильным обменом иона галогена на сульфогруппу, сульфоокислением алканов, тиолов и органических дисульфидов.
Всего же можно выделить следующие способы:
- окисление;
- гидролиз;
- разложение цианидов;
- использование раствора Гриньяра.
В промышленности предельные монокарбоновые кислоты получают из жиров, восков, масел. Довольно распространённый способ образования соединений — путём окисления алканов и алкенов. Например, муравьиная кислота образовывается из метана 2CH4 + + 3O2 → 2HCOOH + 2H2O, а уксусная из н-бутана 2CH3-CH2-CH2-CH3 + 5O2 → 4CH3COOH + 2H2O. Кроме этого, выполняют окисление алканов, гомологов бензола. Производство возможно и в лабораторных условиях. Так в них выполняют гидролиз сложных эфиров и галогенпроизводных, растворяют ангидриды. Какой способ предпочтителен, зависит от имеющихся реактивов и необходимой концентрации полученного раствора.
Некоторые кислоты можно выделить из живых организмов. Например, муравьиную, уксусную. Если первую выделяют из красных муравьёв, вторая содержится в выделениях животных, образуется в результате брожения или скисания. Бензойная кислота находится в ладане, эфирных маслах, бальзамах. Нельзя не упомянуть и самую известную кислоту — лимонную. Способ её чистого получения был открыт в 1860 году и стал называться биосинтезом.
Карбоновые кислоты и их соли
Карбоновые кислоты и их соли |
|
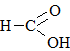 |
Метановая кислотаМуравьиная кислота |
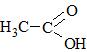 |
Этановая кислотаУксусная кислота |
| CH3-CH2-COOH | Пропановая кислотаПропионовая кислота |
| C3H7-COOH | Бутановая кислотаМасляная кислота |
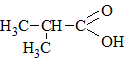 |
2-Метилпропановая кислотаИзомасляная кислота |
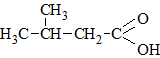 |
3-Метилбутановая кислотаИзовалериановая кислота |
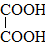 |
Этандиовая кислотаЩавелевая кислота |
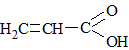 |
Пропеновая кислотаАкриловая кислота |
| C15H31-COOH | Пальмитиновая кислота |
| C17H35-COOH | Стеариновая кислота |
| C17H33-COOH | Олеиновая кислота |
| C17H31-COOH | Линолевая кислота |
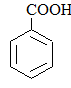 |
Бензойная кислотаБензолкарбоновая кислота |
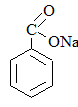 |
Бензоат натрия |
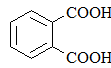 |
Фталевая кислотаБензол-1,2-дикарбоновая кислота |
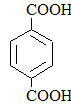 |
Терефталевая кислотаБензол-1,4-дикарбоновая кислота |
| HCOONa | Формиат натрия |
| CH3COONa | Ацетат натрия |
| (CH3CH2COO)2Ca | Пропионат кальция |
| (C17H35COO)2Ca | Стеарат кальция |
Карбоновые кислоты – это вещества, в молекулах которых содержится одна или несколько карбоксильных групп СООН.
Общая формула предельных одноосновных карбоновых кислот: СnH2nO2
Строение, изомерия и гомологический ряд карбоновых кислот
Химические свойства карбоновых кислот
Способы получения карбоновых кислот
Классификация карбоновых кислот
По числу карбоксильных групп:
- одноосновные карбоновые кислоты — содержат одну карбоксильную группу -СООН. Общая формула CnH2n+1COOH или CnH2nO2.
Например, уксусная кислота
- многоосновные карбоновые кислоты — содержат две и более карбоксильные группы СООН. Например, общая формула двухосновных карбоновых кислот CnH2n(СОOH)2 или CnH2n-2O4.
Например, щавелевая кислота
Классификация по строению углеводородного радикала
- Предельные карбоновые кислоты – карбоксильная группа СООН соединена с предельным радикалом. Например, этановая кислота СН3–СООН.
- Непредельные карбоновые кислоты – карбоксильная группа СООН соединена с непредельным радикалом. Например, акриловая кислота: СН2=СН–СООН.
- Ароматические кислоты — карбоксильная группа СООН соединена с непредельным радикалом. Например, бензойная кислота: С6Н5СООН.
- Циклические кислоты — карбоксильная группа СООН соединена с углеводородным циклом. Например, циклопропанкарбоновая кислота: С3Н5СООН.
Строение карбоновых кислот
Карбоксильная группа сочетает в себе две функциональные группы – карбонил и гидроксил, взаимно влияющие друг на друга.
Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4).
Электронная плотность смещена к более электроотрицательному атому кислорода.
Атом углерода карбоксильной группы находится в состоянии sp2-гибридизации, образует три σ-связи и одну π-связь.
Водородные связи и физические свойства карбоновых кислот
В жидком состоянии и в растворах молекулы карбоновых кислот образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул карбоновых кислот.
Молекулы карбоновых кислот с помощью водородных связей соединены в димеры.
Это приводит к увеличению растворимости в воде и высоким температурам кипения низших карбоновых кислот.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Номенклатура карбоновых кислот
Предельные одноосновные карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Муравьиная | Метановая | Формиат (метаноат) | HCOOH |
| Уксусная | Этановая | Ацетат (этаноат) | CH3COOH |
| Пропионовая | Пропановая | Пропионат (пропаноат) | CH3CH2COOH |
| Масляная | Бутановая | Бутират (бутаноат) | CH3(CH2)2COOH |
| Валериановая | Пентановая | Пентаноат | CH3(CH2)3COOH |
| Капроновая | Гексановая | Гексаноат | CH3(CH2)4COOH |
| Пальмитиновая | Гексадекановая | Пальмитат | С15Н31СООН |
| Стеариновая | Октадекановая | Стеарат | С17Н35СООН |
Таблица. Непредельные одноосновные карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Акриловая | Пропеновая | Акрилат | CH2=CH–COOH |
| Метакриловая | 2-Метилпропеновая | Метакрилат | CH2=C(СH3)–COOH |
| Кротоновая | транс-2-Бутеновая | Кротонат | СН3 -CH=CH–COOH |
| Олеиновая | 9- цис-Октадеценовая | Олеат | СН3(СН2)7СН=СН(СН2)7СООН |
| Линолевая | 9,12-цис-Октадекадиеновая | Линолеат | СН3(СН2)4(СН=СНСН2)2(СН2)6СООН |
| Линоленовая | 9,12,15-цис-Октадекатриеновая | Линоленоат | СН3СН2(СН=СНСН2)3(СН2)6СООН |
Таблица. Двухосновные карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Щавелевая | Этандиовая | Оксалат | НООС – COOH |
| Малоновая | Пропандиовая | Малонат | НООС-СН2-СООН |
| Янтарная | Бутандиовая | Сукцинат | НООС-(СН2)2-СООН |
| Глутаровая | Пентандиовая | Глутарат | НООС-(СН2)3-СООН |
| Адипиновая | Гександиовая | Адипинат | НООС-(СН2)4-СООН |
| Малеиновая | цис-Бутендиовая | Малеинат | цис-НООССН=СНСООН |
| Фумаровая | транс-Бутендиовая | Фумарат | транс-НООССН=СНСООН |
Таблица. Ароматические карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Бензойная | Фенилкарбоновая | Бензоат |  |
| Фталевая | Бензол-1,2-дикарбоновая кислота | Фталат |  |
| Изофталевая | Бензол-1,3-дикарбоновая кислота | Изофталат |  |
| Терефталевая | Бензол-1,4-дикарбоновая кислота | Терефталат |  |
Изомерия предельных карбоновых кислот
Структурная изомерия
Для предельных карбоновых кислот характерна структурная изомерия – изомерия углеродного скелета и межклассовая изомерия.
Структурные изомеры – это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета характерна для карбоновых кислот, которые содержат не менее четырех атомов углерода.
Например. Формуле С4Н8О2 соответствуют бутановая и 2-метилпропановая кислота
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Карбоновые кислоты изомерны сложным эфирам. Общая формула и предельных одноосновных карбоновых кислот, и сложных эфиров — CnH2nО2.
Например. Межклассовые изомеры с общей формулой С2Н4О2: уксусная кислота СН3–CОOH и метилформиат H–COOCH3
| Уксусная кислота | Метиловый эфир муравьиной кислоты |
| СН3–CОOH | HCOOCH3 |
Общую формулу СnH2nO2 могут также иметь многие другие полифункциональные соединения, например: альдегидоспирты, непредельные диолы, циклические простые диэфиры и т.п.
Химические свойства карбоновых кислот
.
- кислотные свойства, замещение водорода на металл;
- замещение группы ОН
- замещение атома водорода в алкильном радикале
- образование сложных эфиров — этерификация
1. Кислотные свойства
Кислотные свойства карбоновых кислот возникают из-за смещения электронной плотности к карбонильному атому кислорода и вызванной этим дополнительной (по сравнению со спиртами и фенолами) поляризацией связи О–Н.
В водном растворе карбоновые кислоты частично диссоциируют на ионы:
R–COOH ⇆ R-COO– + H+
1.1. Взаимодействие с основаниями
Карбоновые кислоты реагируют с большинством оснований. При взаимодействии карбоновых кислот с основаниями образуются соли карбоновых кислот и вода.
CH3COOH + NaOH = CH3COONa + H2O
Карбоновые кислоты реагируют с щелочами, амфотерными гидроксидами, водным раствором аммиака и нерастворимыми основаниями.
Например, уксусная кислота растворяет осадок гидроксида меди (II)
Видеоопыт взаимодействия уксусной кислоты с гидроксидом натрия можно посмотреть здесь.
Например, уксусная кислота реагирует с водным раствором аммиака с образованием ацетата аммония
CH3COOH + NH3 = CH3COONH4
1.2. Взаимодействие с металлами
Карбоновые кислоты реагируют с активными металлами. При взаимодействии карбоновых кислот с металлами образуются соли карбоновых кислот и водород.
Например, уксусная кислота взаимодействует с кальцием с образованием ацетата кальция и водорода.
Видеоопыт взаимодействия уксусной кислоты с магнием и цинком можно посмотреть здесь.
1.3. Взаимодействие с основными оксидами
Карбоновые кислоты реагируют с основными оксидами с образованием солей карбоновых кислот и воды.
Например, уксусная кислота взаимодействует с оксидом бария с образованием ацетата бария и воды.
Например, уксусная кислота реагирует с оксидом меди (II)
2СН3СООН + CuO = H2О + ( CH3COO)2 Cu
Видеоопыт взаимодействия уксусной кислоты с оксидом меди (II) можно посмотреть здесь.
1.4. Взаимодействие с с солями более слабых и летучих (или нерастворимых) кислот
Карбоновые кислоты реагируют с солями более слабых, нерастворимых и летучих кислот.
Например, уксусная кислота растворяет карбонат кальция
Качественная реакция на карбоновые кислоты: взаимодействие с содой (гидрокарбонатом натрия) или другими гидрокарбонатами. В результате наблюдается выделение углекислого газа
2. Реакции замещения группы ОН
Для карбоновых кислот характерны реакции нуклеофильного замещения группы ОН с образованием функциональных производных карбоновых кислот: сложных эфиров, амидов, ангидридов и галогенангидридов.
2.1. Образование галогенангидридов
Под действием галогенагидридов минеральных кислот-гидроксидов (пента- или трихлорид фосфора) происходит замещение группы ОН на галоген.
Например, уксусная кислота реагирует с пентахлоридом фосфора с образованием хлорангидрида уксусной кислоты
2.2. Взаимодействие с аммиаком
При взаимодействии аммиака с карбоновыми кислотами образуются соли аммония:
При нагревании карбоновые соли аммония разлагаются на амид и воду:
2.3. Этерификация (образование сложных эфиров)
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.
Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты):
При этом фенол не вступает в реакцию этерификации с карбоновыми кислотами. Сложные эфиры фенола получают косвенными способами.
2.4. Получение ангидридов
С помощью оксида фосфора (V) можно дегидратировать (то есть отщепить воду) карбоновую кислоту – в результате образуется ангидрид карбоновой кислоты.
Например, при дегидратации уксусной кислоты под действием оксида фосфора образуется ангидрид уксусной кислоты
3. Замещение атома водорода при атоме углерода, ближайшем к карбоксильной группе
Карбоксильная группа вызывает дополнительную поляризацию связи С–Н у соседнего с карбоксильной группой атома углерода (α-положение). Поэтому атом водорода в α-положении легче вступает в реакции замещения по углеводородному радикалу.
В присутствии красного фосфора карбоновые кислоты реагируют с галогенами.
Например, уксусная кислота реагирует с бромом в присутствии красного фосфора
4. Свойства муравьиной кислоты
Особенности свойств муравьиной кислоты обусловлены ее строением, она содержит не только карбоксильную, но и альдегидную группу и проявляет все свойства альдегидов.
4.1. Окисление аммиачным раствором оксида серебра (I) и гидроксидом меди (II)
Как и альдегиды, муравьиная кислота окисляется аммиачным раствором оксида серебра. При этом образуется осадок из металлического серебра.
При окислении муравьиной кислоты гидроксидом меди (II) образуется осадок оксида меди (I):
4.2. Окисление хлором, бромом и азотной кислотой
Муравьиная кислота окисляется хлором до углекислого газа.
4.3. Окисление перманганатом калия
Муравьиная кислота окисляется перманганатом калия до углекислого газа:
5HCOOH + 2KMnO4 + 3H2SO4 → 5CO2 + 2MnSO4 + K2SO4 + 8H2O
Видеоопыт взаимодействия муравьиной кислоты с перманганатом калия можно посмотреть здесь.
4.4. Разложение при нагревании
При нагревании под действием серной кислоты муравьиная кислота разлагается с образованием угарного газа:
Видеоопыт разложения муравьиной кислоты можно посмотреть здесь
5. Особенности бензойной кислоты
5.1. Разложение при нагревании
При нагревании бензойная кислота разлагается на бензол и углекислый газ:
5.2. Реакции замещения в бензольном кольце
Карбоксильная группа является электроноакцепторной группой, она уменьшает электронную плотность бензольного кольца и является мета-ориентантом.
6. Особенности щавелевой кислоты
6.1. Разложение при нагревании
При нагревании щавелевая кислота разлагается на угарный газ и углекислый газ:
6.2. Окисление перманганатом калия
Щавелевая кислота окисляется перманганатом калия до углекислого газа:
7. Особенности непредельных кислот (акриловой и олеиновой)
7.1. Реакции присоединения
Присоединение воды и бромоводорода к акриловой кислоте происходит против правила Марковникова, т.к. карбоксильная группа является электроноакцепторной:
К непредельным кислотам можно присоединять галогены и водород. Например, олеиновая кислота присоединяет водород:
7.2. Окисление непредельных карбоновых кислот
Непредельные кислоты обесцвечивают водный раствор перманганатов. При этом окисляется π-связь и у атомов углерода при двойной связи образуются две гидроксогруппы:
Получение карбоновых кислот
1. Окисление спиртов, алкенов и алкинов
При окислении спиртов, алкенов, алкинов и некоторых других соединений подкисленным раствором перманганата калия образуются карбоновые кислоты.
Например, при окислении этанола в жестких условиях образуется уксусная кислота
2. Окисление альдегидов
Альдегиды реагируют с раствором перманганата или дихромата калия в кислой среде при нагревании, а также с гидроксидом меди при нагревании.
Например, при окислении уксусного альдегида перманганатом калия в серной кислоте образуется уксусная кислота.
Например, при окислении альдегидов гидроксидом меди (II) также образуются карбоновые кислоты
3. Щелочной гидролиз тригалогенидов
Тригалогеналканы, в которых три атома галогена расположены у одного атома углерода, с избытком щелочи образуется соль кислоты. При этом сначала происходит замещение галогенов на группы ОН.
Образуется неустойчивое вещество, которое распадается с отщеплением воды:
Так как щелочь в избытке, то образуется не сама кислота, а её соль:
4. Получение карбоновых кислот из солей
Карбоновые кислоты можно получить из солей действием минеральной кислоты на раствор соли:
Например, муравьиную кислоту можно получить, подействовав на формиат натрия раствором серной кислоты:
5. Гидролиз сложных эфиров
Сложные эфиры подвергаются гидролизу в кислой среде при нагревании:
Например, метилацетат гидролизуется в кислой среде:
6. Кислотный гидролиз жиров
Под действием кислот жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира.
Например, при гидролизе тристеарата глицерина в кислой среде образуется стеариновая кислота и глицерин
7. Получение муравьиной кислоты из угарного газа
Соль муравьиной кислоты получают нагреванием оксида углерода (II) с твёрдым гидроксидом натрия под давлением:
8. Каталитическое окисление бутана
Уксусную кислоту в промышленности получают каталитическим окислением бутана:
9. Получение бензойной кислоты
Бензойную кислоту получают окислением гомологов бензола раствором перманганата калия в кислой среде.
Например, при окислении толуола образуется бензойная кислота:
10. Взаимодействие реактива Гриньяра с углекислым газом
При взаимодействии реактивов Гриньяра (алкилгалогенидов магния) с углекислым газом и последующем гидролизе образовавшегося промежуточного продукта образуется карбоновая кислота.
В окружающем мире большое значение имеет такой класс химических соединений, как органические кислоты. Список этих веществ включает в себя карбоновые и сульфоновые соединения. Первые характеризуются наличием в составе карбоксила, а вторые включают в себя сульфогруппу. Общей для них является способность к проявлению кислотных свойств, благодаря которым они взаимодействуют с оксидами, гидроксидами, солями, спиртами и некоторыми металлами.
Оглавление:
- Вещества с одной функциональной группой
- Многоосновные соединения
- Другие классы
Карбоновые кислоты
Соединение называется карбоновым, если в нём содержится карбоксильная группа -COOH, образованная из карбонильной -COH (также её называют альдегидной) и гидроксильной -OH (или спиртовой). Внутри этого типа веществ существует своя классификация в зависимости от количества функциональных групп:
- если она одна — кислота считается одноосновной;
- если две и более — многоосновной.
Вещества с одной функциональной группой
Итак, одноосновные кислоты содержат только одну функциональную группу COOH. Название вещества составляется по систематической номенклатуре, но не менее широко используются тривиальные наименования, не отражающие информацию о его составе и строении, но закрепившиеся исторически.
Например, одно из самых известных органических веществ записывается формулой CH3COOH. По номенклатуре ИЮПАК это этановая кислота, но чаще её называют уксусной. Бесцветную жидкость с резким запахом и кислым вкусом с давних времён получали как продукт брожения вина́. Её способность к взаимодействию с металлами использовали для получения краски из свинца и меди.
В середине XIX века химики научились синтезировать вещество из неорганических материалов, а спустя полвека производили его путём перегонки древесины. В настоящее время основным промышленным способом его получения является каталитическое карбонилирование метанола, а основное применение соединение нашло в пищевой и фармацевтической отраслях.
К другим известным одноосновным органическим кислотам относятся:
- Метановая кислота (HCOOH) имеет тривиальное название муравьиная, поскольку впервые была получена из едких выделений рыжих лесных муравьёв. В природе она также обнаружена у пчёл и медуз. Кроме того, вещество содержится в хвое, крапиве и фруктах. Основным промышленным методом его получения является пропускание угарного газа через нагретую каустическую соду. В результате этого процесса получается соль, из которой металл вытесняется серной кислотой, а итоговый продукт перегоняется в вакууме.
- Бензойная кислота (C6H5СООН) одно из немногих веществ, имеющих лишь одно название. Это ароматическое соединение впервые было получено сублимацией смолы стираксового дерева и нашло применение в консервировании фруктов. В качестве пищевой добавки её белые кристаллы применяют и сейчас, но получают дешёвый и легкодоступный продукт окислением толуола.
- Олеиновая или цис-9-октадеценовая кислота (C17H33COOH) относится к жирным и выглядит как маслянистая жидкость. В природе она содержится в целом ряде растительных масел (в частности, оливковом и подсолнечном), а также в животных жирах (свиней, коров и быков, трески). Соединение выделяют из этих материалов в виде сложных эфиров и применяют в лакокрасочной отрасли, мыловарении, косметической промышленности.
- Стеариновая или октадекановая (C17H35COOH) — ещё одна жирная кислота, получаемая гидрированием олеиновой. В природе она встречается в основном в бараньем жире и пальмовом масле. Также синтезируется в организме человека. В промышленных масштабах вещество получают путём гидролиза жиров и используют в составе косметических средств, свечей, пластичных смазок.
Многоосновные соединения
Если число карбоксильных групп равно двум, вещество называется двухосновным. К таким относится этандиовая или щавелевая кислота (HOOC-COOH) — одна из немногих, являющихся сильными среди органических. Это предельное соединение содержится в некоторых растениях, а в промышленных масштабах производится путём окисления некоторых производных углеводородов неорганическими кислотами в присутствии катализатора. Применяют вещество в лабораторном синтезе, текстильном и кожевенном хозяйстве. Его токсичность делает невозможным его применение в какой-либо пищевой промышленности.
А вот лимонная кислота ((HOOCCH2)2C(OH)COOH) имеет длинное систематическое название 2-гидроксипропан-1,2,3-трикарбоновой, из которого можно сделать вывод, что она трёхосновная. Это белое кристаллическое вещество без запаха действительно содержит в себе три карбоксильные группы и одну гидроксильную, тем не менее по свойствам является слабым. В природе оно содержится в различных фруктах, поэтому и было выделено впервые в виде кальциевой соли из лимонного сока. Сейчас используется биосинтез из кукурузы, маниока, сладкого картофеля, сахара или мелассы.
Другие классы
Если в веществе помимо карбоксильной содержатся и другие группы, его выделяют в отдельный тип соединений. Наиболее известные из них приведены в таблице.
| Название | Характерная группа | Пример |
| Оксикислоты | -OH | Молочная или альфа-оксипропионовая кислота (CH3CH(OH)COOH), образующаяся при брожении. Впервые она была выделена из прокисшего молока, сейчас её получают ферментативным или синтетическим способом. Первый подразумевает использование бактериальных или грибных культур, второй — взаимодействие уксусного альдегида с цианистым водородом и гидролиз продукта реакции. Полученное вещество применяют в пищевой и полимерной промышленности. |
| Кетокислоты | =CO | Пировиноградная или 2-оксопропановая кислота (CH3(CO)COOH). Происхождение традиционного названия связано с моментом её открытия, которое осуществилось при перегонке виноградной и винной кислот. В настоящее время способ её получения остался практически тем же, был лишь улучшен выход продукта путём включения в реакцию серно-калиевой соли. |
| Аминокислоты | -NH2 | Таких соединений известно около пятисот наименований, одним из первых был открыт глицин или аминоуксусная кислота (NH2—CH2—COOH). Вещество было выделено из желатина, сейчас его получают хлорированием карбоновых кислот, с последующим взаимодействием продукта реакции с аммиаком. Глицин широко применяется в медицине, а также пищевой промышленности. |
Сульфоновые представители
Сульфокислоты — вещества, содержащие в своём составе углеводородный радикал и группу -SO3H. Они обладают высокой способностью к образованию солей в реакциях с основаниями, сложных эфиров при взаимодействии со спиртами, а также ангидридов и амидов.
В чистом виде соединения получают с помощью введения сульфогруппы в ароматические углеводороды, алканы, тиолы, а затем используют в синтезе красителей, медикаментов, поверхностно-активных веществ.
Наиболее известными природными представителями сульфокислот являются:
- Таурин или 2-аминоэтансульфоновая кислота (H2NC2H4SO3H) — вещество, присутствующее в животных тканях и желчи и способствующее эмульгированию жиров в кишечнике. Синтезированное из этаноламина, оно используется в медицине (например, в виде глазных капель, применяемых при поражениях сетчатки и роговицы, или препаратов для приёма внутрь при сердечно-сосудистой недостаточности) и пищевой промышленности (в энергетических напитках, соках, спортивном питании).
- Цистеин или альфа-амино-бета-тиопропионовая кислота (C3H7NO2S) — соединение, входящее в состав белков ногтей, кожи, волос и пищеварительных ферментов. В организме оно выполняет функцию формирования тканей кожи, участия в пищеварительном процессе, защиты от радиации. В промышленности цистеин получают из птичьих перьев, щетины и человеческих волос путём их обработки соляной кислотой, а затем используют при приготовлении лекарственных препаратов.
Химии известно ещё множество органических кислот, все из них перечислить просто невозможно.
Новые открытия делаются постоянно, благодаря чему находятся новые компоненты пищевых добавок, лекарств от ранее неизлечимых болезней и соединений, двигающих прогресс.
12 сентября 2022
В закладки
Обсудить
Жалоба
Памятка по органической химии
Таблица.
pm-h.doc
pm-h.pdf
Класс | Химические свойства | Способы получения
Алканы
Алкены
Алкины
Алкадиены
Арены
Предельные одноатомные спирты
Многоатомные спирты
Альдегиды
Предельные одноосновные карбоновые кислоты
Моносахариды
Дисахариды
Полисахариды
Амины
Аминокислоты
Белки
Автор: Столярова В.А.
Обратите внимание на то, что по мере понижения степени окисления суффиксы меняются в следующем порядке:
|
Формула |
Название кислоты |
Название соли |
|
HAlO2 |
Метаалюминиевая |
Метаалюминат |
|
HBO2 |
Метаборная |
Метаборат |
|
H3BO3 |
Ортоборная |
Ортоборат |
|
HBr |
Бромоводородная |
Бромид |
|
HCOOH |
Муравьиная |
Формиат |
|
HCN |
Циановодородная |
Цианид |
|
H2CO3 |
Угольная |
Карбонат |
|
H2C2O4 |
Щавелевая |
Оксолат |
|
H4C2O2 (CH3COOH) |
Уксусная |
Ацетат |
|
HCl |
Хлороводородная |
Хлорид |
|
HClO |
Хлорноватистая |
Гипохлорит |
|
HClO2 |
Хлористая |
Хлорит |
|
HClO3 |
Хлорноватая |
Хлорат |
|
HClO4 |
Хлорная |
Перхлорат |
|
HCrO2 |
Метахромистая |
Метахромит |
|
HCrO4 |
Хромовая |
Хромат |
|
HCr2O7 |
Двухромовая |
Дихромат |
|
HI |
Иодоводородная |
Иодид |
|
HMnO4 |
Марганцевая |
Перманганат |
|
H2MnO4 |
Марганцовистая |
Манганат |
|
H2MoO4 |
Молибденовая |
Молибдат |
|
HNO2 |
Азотистая |
Нитрит |
|
HNO3 |
Азотная |
Нитрат |
|
HPO3 |
Метафосфорная |
Метафосфат |
|
H3 PO4 |
Ортофосфорная |
Ортофосфат (фосфат) |
|
H4P2O7 |
Двуфосфорная(Пирофосфорная) |
Дифосфат(Пирофосфат) |
|
H3PO3 |
Фосфористая |
Фосфит |
|
H3PO2 |
Фосфорноватистая |
Гипофосфит |
|
H2S |
Сероводородная |
Сульфид |
|
H2SO3 |
Сернистая |
Сульфит |
|
H2SO4 |
Серная |
Сульфат |
|
H2S2O3 |
Тиосерная |
Тиосульфат |
|
H2Se |
Селеноводородная |
Селенид |
|
H2SiO3 |
Кремниевая |
Силикат |
|
HVO3 |
Ванадиевая |
Ванадат |
|
H2WO4 |
Вольфрамовая |
Вольфрамат |
-оватая, — истая, -оватистая.