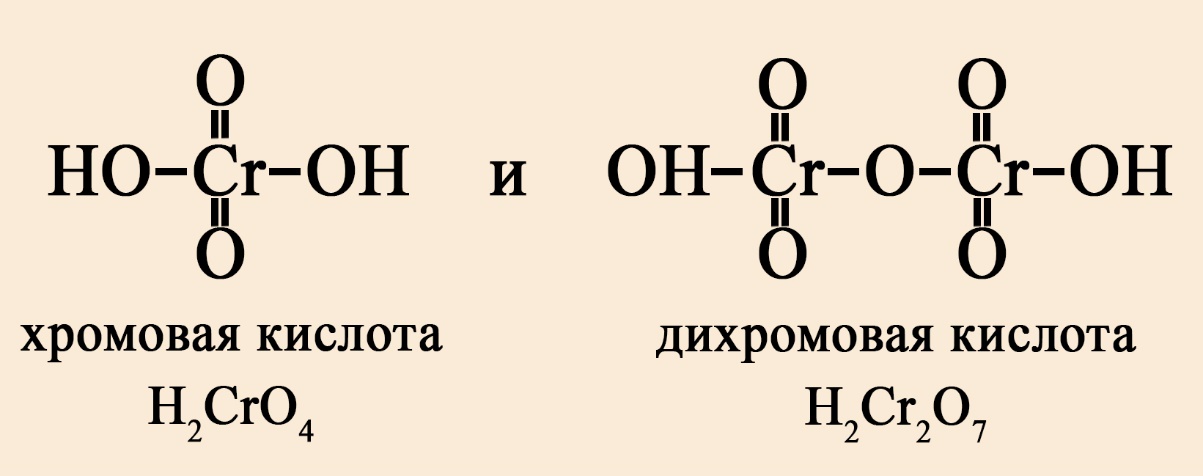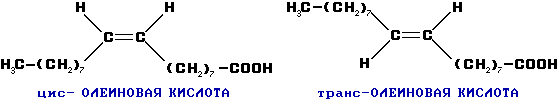Классификация кислот
Материал по химии
- Определение кислот
- Классификация кислот по составу
- Классификация кислот по основности
- Сильные и слабые кислоты
- Тривиальные названия некоторых кислот
- «Протон» или «катион»?
- Кислоты и индикаторы
Определение кислот
Кислоты ‒ это вещества, способные в растворах отдавать катион (протон) водорода.
Примеры диссоциации кислот:
HCl ↔ H+ + Cl‒
H2SO4 ↔ 2H+ + SO42‒
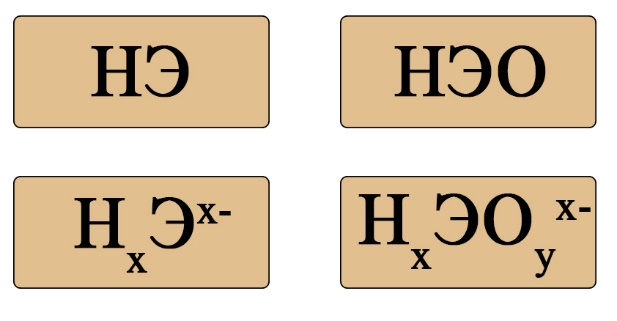
Если пока понятие диссоциации неизвестно, легче ориентироваться по общим формулам кислот:
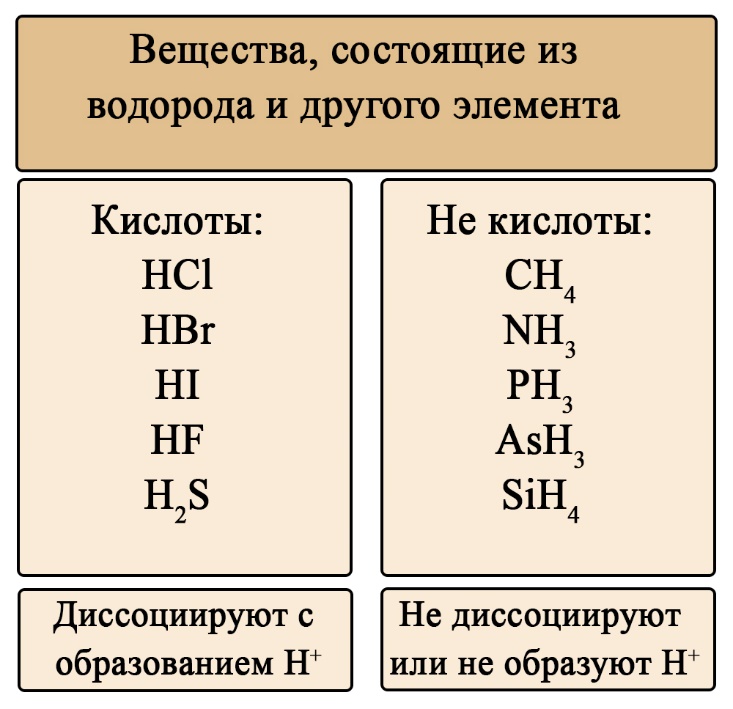
Важен не только состав, но и последовательность. На первом месте должен стоять водород, за ним – элемент, если в составе есть кислород, то он должен стоять последним. Например, HCl – кислота (соответствует формуле HЭ), H2S – тоже кислота (на первом месте водород, на втором — сера), а вот NH3 несмотря на то, что состоит из водорода и элемента, не является кислотой, это легко определить по последовательности: в этой формуле сначала стоит элемент, а за ним – водород (иногда, чтобы запутать сдающего, составитель может написать не NH3, а H3N, Вы должны помнить, что NH3 (аммиак), PH3(фосфин), AsH3 (арсин), CH4 (метан) – не являются кислотами, так как в воде либо не диссоциируют, либо диссоциируют без образования протона водорода. H2SO4 – является кислотой, так как формула имеет порядок элементов «водород → элемент → кислород», а NaOH, тоже состоящая из элемента, кислорода и водорода – кислотой не является, так как тут последовательность будет такова: «элемент → кислород → водород».
Классификация кислот по составу
Кислоты можно разделить на кислородсодержащие и бескислородные. Не трудно догадаться, что бескислородные не содержат атомов кислорода, а кислородсодержащие — содержат. Кислородсодержащие кислоты образованы соответствующими оксидами, а бескислородные образованы прямым взаимодействием простых веществ.
Таб. Примеры бескислородных и кислородсодержащих кислот, образованных одним и тем же неметаллом
|
Бескислородные |
Кислородсодержащие |
|
HCl |
HClO4 |
|
H2S |
H2SO3 |
|
HBr |
HBrO |
|
HI |
HIO2 |
Классификация кислот по основности
Кислоты могут отдать столько водорода, сколько имеется в их составе (в большинстве случаев, есть исключения). Если может отдать максимум один водород – то кислота относится к одноосновным, если может отдать максимум два протона водорода – то двухосновная и так далее.
Например:
HCl ↔ H+ + Cl‒ (одноосновная)
H2SO4 ↔ 2H+ + SO42‒ (двухосновная)
H3PO4 ↔ 3H+ + PO43- (трехосновная/многоосновная)
Таб. Примеры кислот с разной основностью
|
Одноосновные (один водород) |
Двухосновные (два водорода) |
Многоосновные (три и более протона водорода) |
|
HNO3 |
H2S |
H3PO4 |
|
HF |
H2SiO3 |
H3BO3 |
|
HBrO |
H2CO3 |
H4P2O7 |
Сильные и слабые кислоты
От чего зависит сила кислот? В первую очередь от скорости отдачи протона водорода при диссоциации (чем быстрее кислота отдает протон водорода, тем она считается сильнее). Как определить скорость «на глаз», не имея под рукой никаких справочных материалов, кроме таблицы Менделеева?
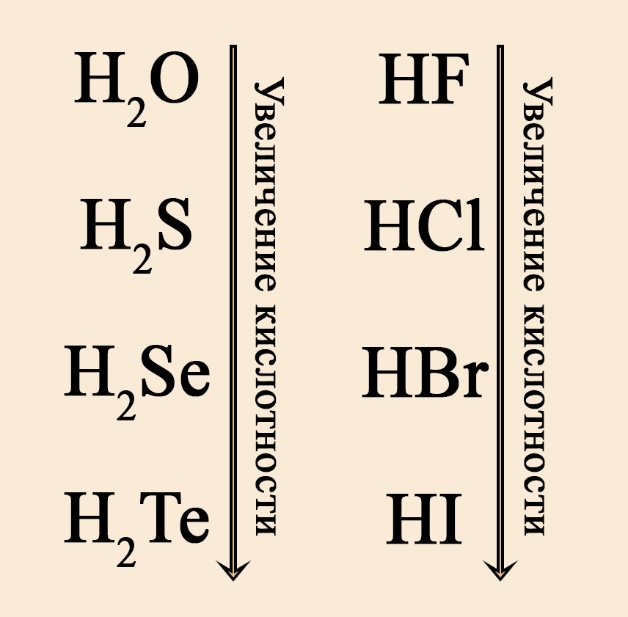
- Если кислота бескислородная, то скорость диссоциации можно определить по радиусу атома, образующего эту кислоту элемента. Напомним, что радиус увеличивается в ПС (периодической системе) сверху-вниз и справа-налево. Так, в ряду кислот HF → HCl → HBr → HI радиус увеличивается от фтора к йоду, так как йод стоит в ПС значительно ниже, чем фтор. Радиус фтора небольшой, поэтому протон водорода прочно связан со фтором, скорость диссоциации будет низкой, значит, кислота слабая. У йода пять электронных оболочек, между йодом и водородом большее расстояние, чем между фтором и водородом, поэтому молекула йодоводорода будет диссоциировать значительно быстрее, значит, кислота сильная. Аналогичную закономерность можно наблюдать в ряду кислот, образованных халькогенами (неметаллами VIА-группы): чем ниже халькоген, тем сильнее образуемая им кислота, поэтому H2S слабее H2Se, а H2Se слабее, чем H2Te.
- Если кислота кислородсодержащая, то её сила зависит от количества кислорода, не входящего в гидроксо-группы. Чем больше кислорода вне -OH группы, тем сильнее кислота. Так, дихромовая кислота сильнее хромовой, потому как дихромовая кислота имеет четыре кислорода вне гидроксо-группы, а хромовая – два кислорода вне гидроксогруппы.
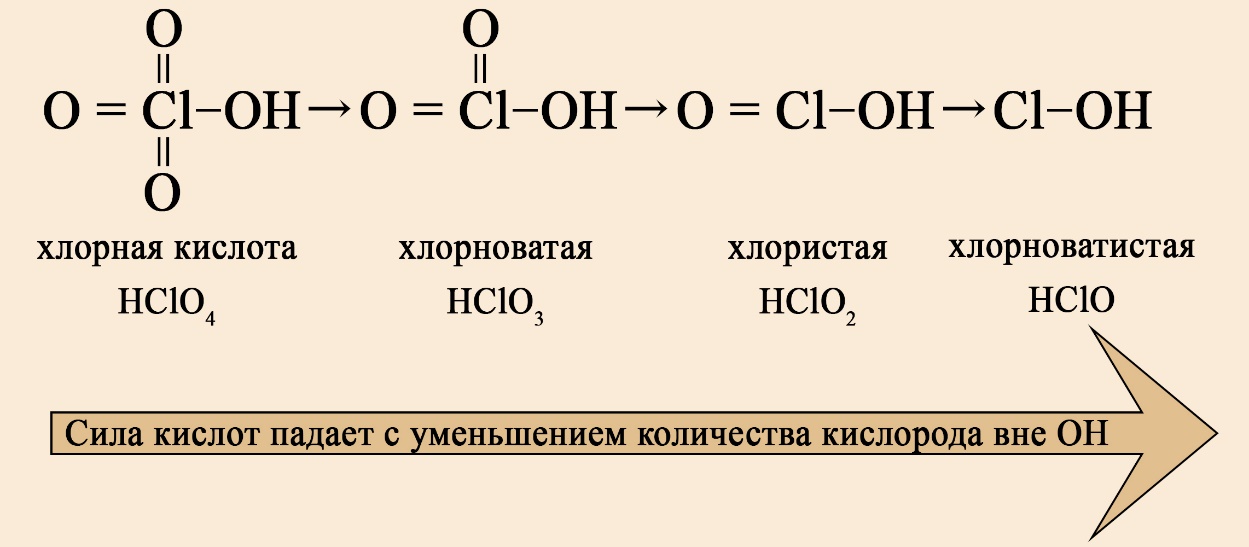
В ряду хлорсодержащих кислот наблюдается такая же закономерность:
Список сильных кислот: HI, HCl, HBr, HNO3, HClO4, HClO3, HBrO3, H2SO4, HMnO4, H2Cr2O7.
Список слабых кислот: H2S, HF, HNO2, H2SO3, H2CO3, HClO, карбоновые кислоты.
В действительности классификация кислот по их силе несколько богаче, и те кислоты, которые в школе записывают в слабые (например, ортофосфорную и фтороводородную) на самом деле относят к кислотам средней силы. Помимо классификации важно знать и названия кислот, а также их остатки. Остатками кислот называют отрицательно-заряженные ионы (анионы), которые образуются при диссоциации кислоты в воде. То есть остаток кислоты – это частица, которая остаётся, если отнять у кислоты весь водород. Вот несколько таблиц, в которых кислоты сгруппированы по силе, с указанием соответствующих кислотных остатков и примерами солей:
Таб. Самые сильные кислоты и их остатки
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
HI |
йодоводородная |
I‒ |
NaI -йодид натрия |
|
HBr |
Бромоводородная |
Br‒ |
KBr – бромид калия |
|
HCl |
Хлороводородная, соляная |
Cl‒ |
CaCl2 – хлорид кальция |
|
HClO4 |
Хлорная |
ClO4‒ |
NaClO4 – перхлорат натрия |
|
H2SO4 |
Серная |
SO42‒ |
K2SO4 – сульфат калия |
|
HMnO4 |
Марганцовая |
MnO4‒ |
NaMnO4 – перманганат натрия |
Таб. Сильные кислоты и их остатки
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
HClO3 |
Хлорноватая |
ClO3‒ |
KClO3 – хлорат калия |
|
HBrO3 |
Бромноватая |
BrO3‒ |
Ba(BrO3)2 – бромат бария |
|
H2Cr2O7 |
Дихромовая |
Cr2O72‒ |
(NH4)2Cr2O7 – дихромат аммония |
Таб. Кислоты средней силы и их остатки (в ОГЭ и ЕГЭ считаем слабыми)
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
HNO2 |
Азотистая |
NO2‒ |
NaNO2 – нитрит натрия |
|
H3PO4 |
Фосфорная (ортофосфорная) |
PO43‒ |
(NH4)3PO4 – фосфат аммония |
|
HF |
Фтороводородная (плавиковая) |
F‒ |
CaF2 – фторид кальция |
|
HClO2 |
Хлористая |
ClO2‒ |
KClO2 – хлорит калия |
Таб. Слабые кислоты и их остатки
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
H2S |
Сероводородная |
S2‒ |
MgS – сульфид магния |
|
HCN |
Циановодородная |
CN‒ |
KCN – цианид калия |
|
H2CO3 |
Угольная |
CO32‒ |
CaCO3 – карбонат кальция |
|
H2SO3 |
Сернистая |
SO32‒ |
BaSO3 – сульфит бария |
|
HClO |
Хлорноватистая |
ClO‒ |
NaClO – гипохлорит натрия |
|
H2SiO3 |
Кремниевая |
SiO32‒ |
K2SiO3 – силикат калия |
|
CH3COOH |
Уксусная |
CH3COO‒* |
CH3COONa – ацетат натрия |
*В органических кислотах водород пишется не в начале молекулы, а в конце, например:
CH3COOH – уксусная кислота, диссоциирует следующим образом:
CH3COOH ↔ CH3COO‒ + H+
C2H5COOH – пропионовая кислота
CH3CH2COOH ↔ CH3CH2COO‒ + H+
C3H7COOH – масляная кислота.
C3H7COOH ↔ C3H7COO‒ + H+
Задание в формате ЕГЭ с ответом:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- H2SO2
- HCl
- HNO3
- кислородсодержащая сильная
- кислородсодержащая слабая
- бескислородная сильная
- бескислородная слабая
Пример задания из КИМ ЕГЭ:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- HNO2
- HBr
- H3PO4
- одноосновная сильная
- одноосновная слабая
- многоосновная сильная
- многоосновная слабая
Задание по образцу ФИПИ:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- HF
- H2CO3
- H2SiO3
- кислородсодержащая сильная
- кислородсодержащая слабая
- бескислородная сильная
- бескислородна слабая
Тривиальные названия некоторых кислот
Многие кислоты имеют альтернативное историческое название, например, хлороводородную кислоту еще называют соляной кислотой, потому что она образует самую популярную соль – NaCl (поваренная соль, используемая в быту). Фтороводородную кислоту называют плавиковой, так как она плавит стекло (поэтому данную кислоту не хранят в стеклянной таре). Муравьиную и щавелевую кислоты назвали так по источнику получения.
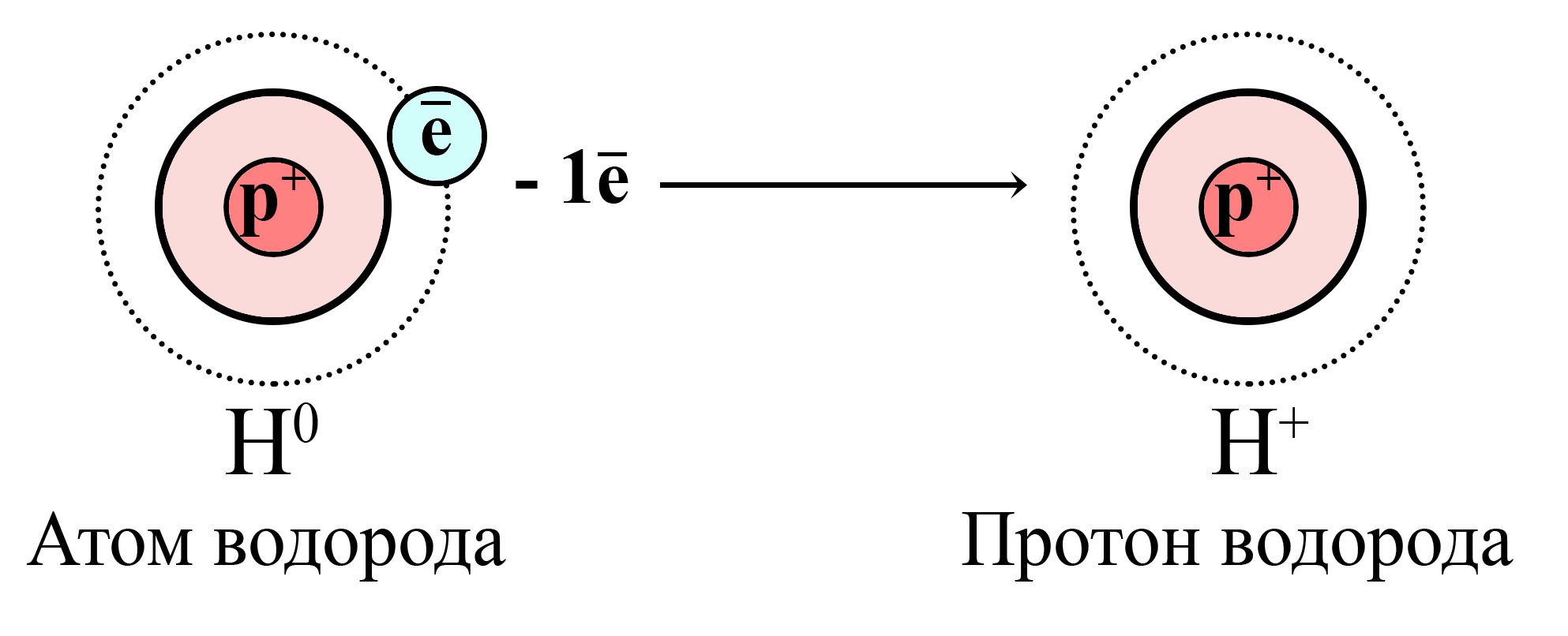
«Протон» или «катион»?
Для всех положительно заряженных частиц характерен термин «катион», однако, по отношению к водороду принято говорить «протон». А дело всё в том, что другие элементы при потере внешних электронов, все равно обладают электронами внутренних слоёв, тогда как водород, содержащий всего один электрон, потеряв его, становится протоном (нейтронов в ядре тоже нет).
Поэтому принято говорить, что кислота отдает не катион водорода, а протон водорода.
Кислоты и индикаторы
Для определения кислот в растворах можно использовать стандартные индикаторы (вещества, меняющие цвет в определенной среде): лакмус и метиловый оранжевый, фенолфталеин кислотами не окрашивается. Лакмус в кислых растворах (рН < 7) становится красным, а метиловый оранжевый – красным или розовым.
Химические свойства кислот
1. Сила кислот уменьшается в ряду:
HI → HClO4 → HBr → HCl → H2SO4 → H2SeO4 → HNO3 → HClO3 → HIO3 →
H2SO3 → HClO2 → H3PO4 → HF → HNO2 → CH3COOH → H2CO3 → H2S → H2SiO3.
Некоторые реакции, подтверждающие ряд кислот:
2HCl + Na2CO3 → 2NaCl + CO2 + H2O т.е. H2CO3 слабее, чем HCl
K2CO3 + SO2 → K2SO3 + CO2 т.е. H2CO3 слабее, чем H2SO3
CH3COOH + NaHCO3 → CH3COONa + CO2 + H2O т.е. H2CO3 слабее, чем CH3COOH
Na2SiO3 + CO2 + H2O → H2SiO3 + Na2CO3 т.е. H2SiO3 слабее, чем H2CO3
3H2SO4 + 2K3PO4 → 3K2SO4 + 2H3PO4 т.е. H3PO4 слабее, чем H2SO4
Во всех этих реакциях образуются либо осадок, либо (более) слабая кислота.
Если осадка не образуется и обе кислоты сильные (т.е. кислота, которая вступила в реакцию, и кислота, которая образовалась в результате реакции), то в растворе такие реакции не идут. Подобные реакции возможны только в случае образования сильных летучих кислот (HNO3 и HCl) в реакциях с твердыми солями, а не растворами:
NaCl(тв.) + H2SO4(к) → NHSO4 + HCl
NaNO3(тв.) + H2SO4(к) → NaHSO4 + HNO3
Аналогичным образом можно получить и слабую плавиковую кислоту:
KF(тв.) + H2SO4(к) → KHSO4 + HF
HBr и HI (они также являются летучими) таким образом получать не удается, так как они окисляются концентрированной серной кислотой:
8KI + 5H2SO4(конц.) → 4I2 + H2S + 4K2SO4 + 4H2O
2KBr + 2H2SO4(конц.) → Br2 + SO2 + K2SO4 + 2H2O
2. Летучесть кислот
Следующие кислоты являются летучими: HNO3, HF, HCl, HBr, HI, H2S, H2Se.
Остальные кислоты являются нелетучими.
3. Сила кислот (способность к диссоциации)
Сильные: HNO3, H2SO4, HCl, HBr, HI, HClO4, HClO3.
Слабые (все остальные): HF, H2CO3, H2SO3, HNO2, H3PO4, H2S, H2SiO3, все органические кислоты и другие.
4. Растворимость кислот в воде
Нерастворимыми кислотами являются: H2SiO3 и все высшие жирные кислоты, т.е. кислоты, содержащие 10 атомов углерода и больше. Например, C17H35COOH (стеариновая кислота).
5. Термическое разложение кислот
При нагревании разлагаются следующие кислоты:
H2CO3 → CO2 + H2O
H2SO3 → SO2 + H2O
4HNO3 → 4NO2 + O2 + 2H2O
H2SiO3 → SiO2 + H2O
Неустойчивыми являются H2CO3 и H2SO3.
6. Взаимодействие с основаниями (реакция нейтрализации)
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
2HCl + Mg(OH)2 → MgCl2 + 2H2O
Эти реакции идут, только если образующаяся соль существует в водном растворе, т.е. в таблице растворимости не должен стоять прочерк:
H2S + Al(OH)3 → реакция не идет, т.к. Al2S3 в водной среде разлагается (по сути, идет обратная реакция)
H2S + Cr(OH)3 → реакция не идет по той же причине.
Особенность кремниевой кислоты: из оснований она реагирует только с щелочами:
H2SiO3 + 2NaOH → Na2SiO3 + 2H2O
H2SiO3 + Cu(OH)2 → реакция не идет
H2SiO3 + Al(OH)3 → реакция не идет.
7. Взаимодействие с солями
Реакции с солями идут, если выделяется газ, выпадает осадок или образуется более слабая кислота:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
AgNO3 + HCl → AgCl + HNO3
K3PO4 + HCl → NaCl + H3PO4 (слабая кислота)
8. Взаимодействие кислот-неокислителей с металлами
Металлы, стоящие в ряду активности металлов до водорода, взаимодействуют с кислотами-неокислителями с выделением водорода:
H2SO4(р) + Zn → ZnSO4 + H2
6HCl + 2Fe → 2FeCl3 + 3H2
Cu + HCl → реакция не идет.
9. Взаимодействие кислот-окислителей (H2SO4(к), HNO3(к) и HNO3(р)) с простыми и сложными веществами
9.1) Серная кислота
9.2) Азотная кислота
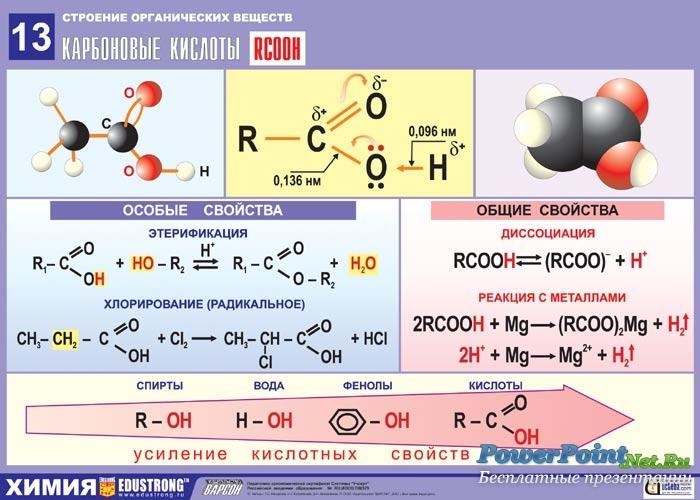
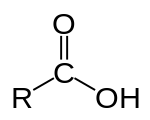
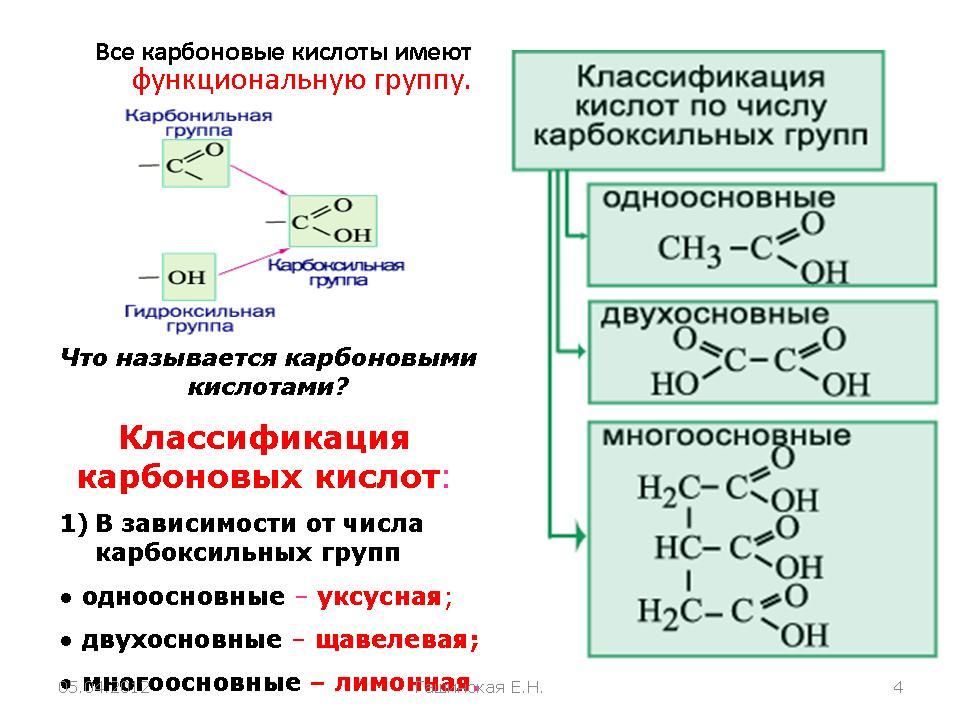
Карбоновые кислоты — класс органических соединений, молекулы которых содержат одну или несколько карбоксильных групп
COOH.
Имеют разнообразное промышленное применение и большое биологическое значение.
Общая формула одноосновных карбоновых кислот CnH2nO2 .

Классификация карбоновых кислот
По количеству карбоксильных групп в молекуле карбоновые кислоты подразделяются на:
- Одноосновные — 1 карбоксильная группа
- Двухосновные — 2 карбоксильных группы
- Трехосновные — 3 карбоксильных группы

Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав
которых они входят.
Номенклатура и изомерия карбоновых кислот
Названия карбоновых кислот формируются путем добавления суффикса «овая» к названию алкана с соответствующим числом атомов углерода
и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Многие карбоновые кислоты имеют тривиальные названия. Наиболее известные:
- Метановая — HCOOH — муравьиная кислота
- Этановая — CH3-COOH — уксусная кислота
- Пропановая — C2H5-COOH — пропионовая кислота
- Бутановая — C3H7-COOH — масляная кислота
- Пентановая — C4H9-COOH — валериановая кислота

Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными
эфирами.

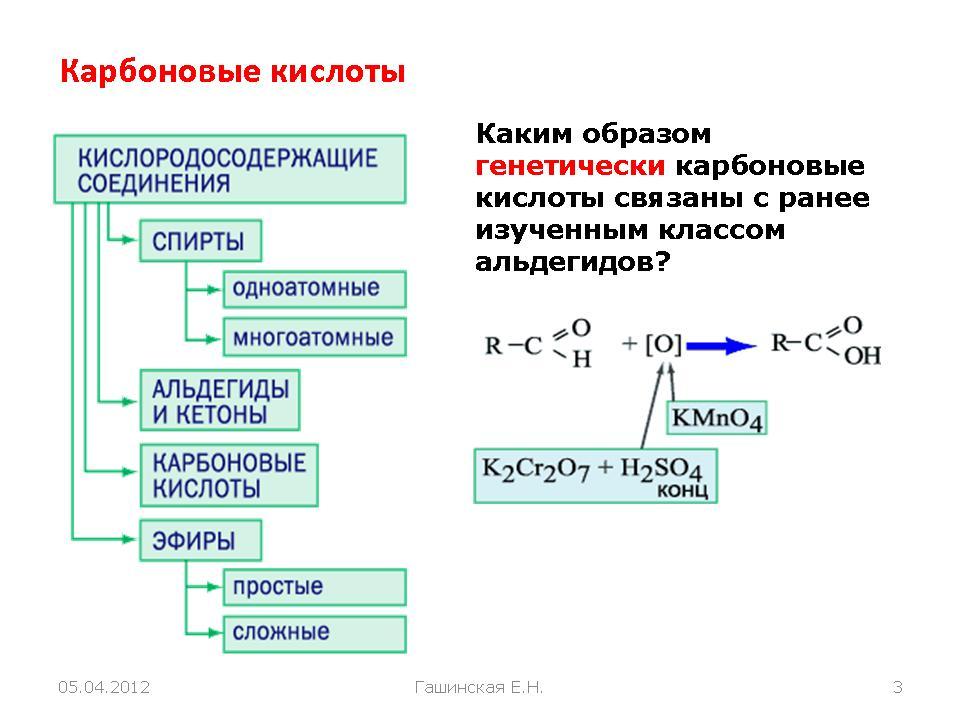
Получение карбоновых кислот
- Окисление алканов
- Окисление спиртов
- Окисление альдегидов
- Синтез муравьиной кислоты
- Синтез уксусной кислоты
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого
образуются кислоты.

При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются
до соответствующих кислот.

При окислении альдегиды образуют соответствующие карбоновые кислоты. Окисление можно проводить качественной реакцией
на альдегиды — реакцией серебряного зеркала.

Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.

Окисление альдегидов также может быть успешно осуществлено другим реагентом — свежеосажденным гидроксидом меди II.
В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I.

Существует специфический способ получения муравьиной кислоты, который заключается в реакции твердого гидроксида щелочного металла с угарным газом под давлением и температуре 200°С — образуется формиат (соль муравьиной кислоты).
При дальнейшей обработке формиата серной кислотой образуется муравьиная кислота.

Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид.
Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.

Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем
спирты.
- Кислотные свойства
- Галогенирование
- Особые свойства муравьиной кислоты
- Разложение муравьиной кислоты
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений
металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.

Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко
замещается водород у третичного, чуть сложнее — у вторичного, и значительно сложнее — у первичного атома углерода.

Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе.
Поэтому самая слабая из трех кислот — уксусная, чуть сильнее — хлоруксусная, за ней — дихлоруксусная и самая сильная —
трихлоруксусная.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это
перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.

Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот,
способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.

При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
HCOOH → (t, H2SO4) CO↑ + H2O
Сложные эфиры
Получение сложных эфиров происходит в реакции этерификации (лат. aether — эфир), заключающейся во взаимодействии карбоновой кислоты
и спирта.
Названия сложных эфиров формируются в зависимости от того, какой кислотой и каким спиртом эфир образован. Примеры:
- Метановая кислота + метанол = метиловый эфир метановой кислоты (метилформиат)
- Этановая кислота + этанол = этиловый эфир уксусной кислоты (этилацетат)
- Метановая кислота + этанол = этиловый эфир метановой кислоты (этилформиат)
- Пропановая кислота + бутанол = бутиловый эфир пропионовой кислоты (бутилпропионат)

Для сложных эфиров характерной реакцией является гидролиз — их разложение. Возможен щелочной гидролиз, при котором образуется соль
кислоты и спирт, и кислотный гидролиз, при котором образуются исходные спирт и кислота.
Кислотный гидролиз протекает обратимо, щелочной — необратимо.
Реакция щелочного гидролиза по-другому называется реакция омыления, и напомнит о себе, когда мы дойдем до темы жиров.

Ангидриды
Ангидриды — химические соединения, производные неорганических и органических кислот, образующиеся при их дегидратации.

Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.

Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания.
Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.

Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит
в непредельной акриловой кислоте.

© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Содержание
-
Номенклатура
-
Название одноосновных карбоновых кислот
-
Название двухосновных карбоновых кислот
-
Карбоновые кислотные остатки
-
Классификация
-
Применение
-
Получение
-
Физические свойства
-
Характерные химические реакции
-
Литература
Приложения
-
Практические задачи по теме: «Карбоновые кислоты»
-
Видео по теме: «Карбоновые кислоты»
Карбо́новые кисло́ты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH. Кислые свойства объясняются тем, что данная группа может сравнительно легко отщеплять протон. За редкими исключениями карбоновые кислоты являются слабыми. Например, у уксусной кислоты CH3COOH константа кислотности равна 1,75·10−5. Ди- и трикарбоновые кислоты более сильные, чем монокарбоновые.
Номенклатура
По международной номенклатуре ИЮПАК, карбоновые кислот называют, выбирая за основу наиболее длинную углеродную цепочку, содержащую группу —СООН, и добавляя к названию соответствующего углеводорода окончание «овая» и слово «кислота«. При этом атому углерода, входящему в состав карбоксильной группы, присваивается первый номер. Например СН3-СН2-СООН — пропановая кислота, СН3-С(СН3)2-СООН — 2,2-диметилпропановая кислота.
По рациональной номенклатуре к названию углеводорода добавляют окончание «карбоновая» и слово «кислота«, не включая при этом в нумерацию цепи атом углерода карбоксильной группы. Например, С5Н9СООН — циклопентанкарбоновая кислота, СН3-С(СН3)2-СООН — трет-бутилкарбоновая кислота.
Многие из карбоновых кислот имеют тривиальные названия (некоторые из них приведены в таблице).
Названия одноосновных карбоновых кислот
|
Тривиальное название |
Название по ИЮПАК |
Формула |
Название солей |
|
Муравьиная кислота |
Метановая кислота |
HCOOH |
формиаты |
|
Уксусная кислота |
Этановая кислота |
CH3COOH |
ацетаты |
|
Пропионовая кислота |
Пропановая кислота |
C2H5COOH |
пропионаты |
|
Масляная кислота |
Бутановая кислота |
C3H7COOH |
бутираты |
|
Валериановая кислота |
Пентановая кислота |
C4H9COOH |
валераты |
|
Капроновая кислота |
Гексановая кислота |
C5H11COOH |
капраты |
|
Энантовая кислота |
Гептановая кислота |
C6H13COOH |
энантоаты |
|
Каприловая кислота |
Октановая кислота |
C7H15COOH |
каприлаты |
Названия двухосновных карбоновых кислот
|
Тривиальное название |
Название по ИЮПАК |
Формула |
Название солей |
|
Щавелевая кислота |
Этандиовая кислота |
HOOCCOOH |
оксалаты |
Классификация
В зависимости от радикала, связанного с карбоксилом, различают следующие группы карбоновых кислот:
ароматические
алифатические (в том числе предельные и непредельные)
алициклические
гетероциклические.
По числу карбоксильных групп кислоты могут быть одно-, двух- и многоосновными. При введении в молекулы кислоты других функциональных групп (например, -ОН, =CO, -NH2 и др.) образуются окси-, кето-, аминокислоты и другие классы соединений.
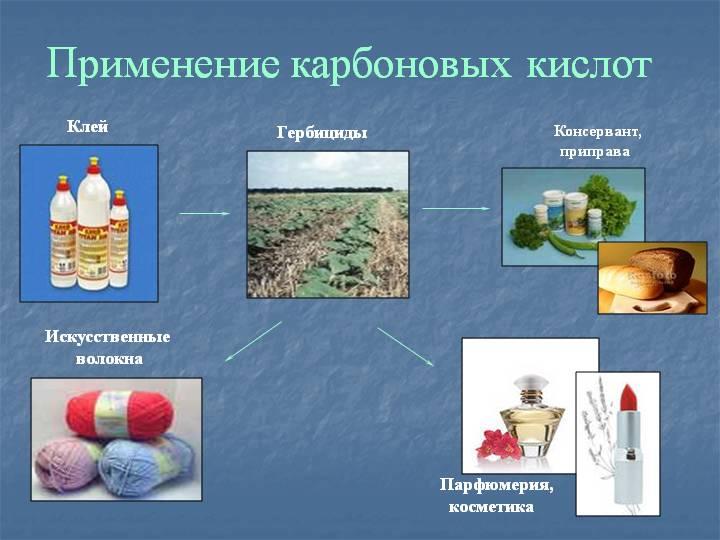
Применение
Муравьиная кислота – в медицине — муравьиный спирт (1,25% спиртовой раствор муравьиной кислоты), в пчеловодстве, в органическом синтезе, при получении растворителей и консервантов; в качестве сильного восстановителя.
Уксусная кислота – в пищевой и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров). В домашнем хозяйстве как вкусовое и консервирующее вещество.
Масляная кислота – для получения ароматизирующих добавок, пластификаторов и флотореагентов.
Щавелевая кислота – в металлургической промышленности (удаление окалины).
Стеариновая (C17H35COOH) и пальмитиновая (C15H31COOH) кислоты _ – в качестве поверхностно-активных веществ, смазочных материалов в металлообработке.
Олеиновая кислота (C17H33COOH) – фотореагент и собиратель при обогащении руд цветных металлов.
Карбоновые кислоты — исходные соединения для получения промежуточных продуктов органического синтеза, в частности кетенов, галогенангидридов, виниловых эфиров, галогенкислот. Соли карбоновых кислот и щелочных металлов применяют как мыла, эмульгаторы, смазочные масла; соли тяжелых металлов — сиккативы, инсектициды и фунгициды, катализаторы. Эфиры кислот — пищевые добавки, растворители; моно- и диэфиры гликолей и полигликолей пластификаторы, компоненты лаков и алкидных смол; эфиры целлюлозы — компоненты лаков и пластмассы. Амиды кислот эмульгаторы и флотоагенты.
Получение
-
Окисление спиртов
-
Окисление альдегидов
-
Гидролиз тригалогеналканов
-
Карбоксилирование металлорганических соединений
-
Гидролиз сложных эфиров
-
Гидролиз нитрилов
Катализируется кислотой или основанием; первоначально образуется амид, который гидролизуется до кислоты; лишь в редких случаях амид устойчив к гидролизу; удобный лабораторный метод (если нитрил доступен)
-
Реакция Арндта-Эйстерта
Используется для получения высших гомологов кислот из низших.
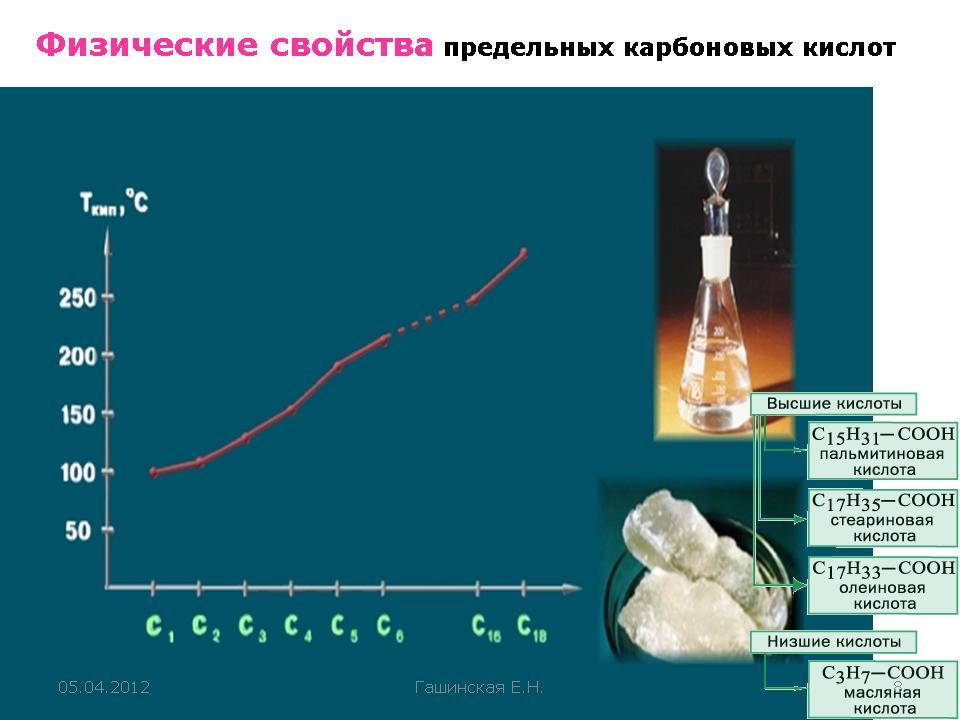
Физические свойства
Низшие карбоновые кислоты — жидкости с острым запахом, хорошо растворимые в воде. С повышением относительной молекулярной массы растворимость кислот в воде и их плотность уменьшаются, а температура кипения повышается. Высшие кислоты, начиная с пеларгоновой (н-нонановой) СН3-(СН2)7-СООН, — твердые вещества, без запаха, нерастворимые в воде. Низшие карбоновые кислоты в безводном виде и в виде концентрированных растворов раздражают кожу и вызывают ожоги, особенно муравьиная кислота и уксусная кислота.
На физических свойствах карбоновых кислот сказывается значительная степень ассоциации вследствие образования водородных связей. Кислоты в отличие от спиртов, образуют более прочные водородные связи, вследствие того что связи в них в большей степени поляризованы по типу
Кроме того, у карбоновых кислот имеется возможность образования водородных связей с кислородом карбонильного диполя, обладающим значительной электроотрицательностью, а не только с кислородом другой гидроксильной группы. Действительно, в твердом и жидком состояниях карбоновые кислоты существуют в основном в виде циклических димеров.
Характерные химические реакции
Наиболее важные химические свойства, характерные для большинства карбоновых кислот:
1. Карбоновые кислоты при реакции с металлами, их оксидами или их осно́вными гидроксидами дают соли соответствующих металлов:
2. Карбоновые кислоты могут вытеснять более слабую кислоту из её соли, например:
3. Карбоновые кислоты в присутствии кислого катализатора реагируют со спиртами, образуя сложные эфиры (реакция этерификации):
4. При нагревании аммонийных солей карбоновых кислот образуются их амиды:
5. Под действием карбоновые кислоты превращаются в соответствующие хлорангидриды:
Изомерия карбоновых кислот
-
Cтруктурная изомерия:
изомерия скелета в углеводородном радикале (начиная с C4).
межклассовая изомерия, начиная с C2.
Например, формуле C2H4O2 соответствуют 3 изомера, относящиеся к различным классам органических соединений. -
Пространственная изомерия:
Возможна цис-транс изомерия в случае непредельных карбоновых кислот. Например:
Список литературы
-
Общая органическая химия т. 4 под ред. Д. Бартона и Д. Оллиса. М.: Химия. 1983
-
Сайкс П. Механизмы реакций в органической химии. М.: Химия. 1991
-
Адамс М. Карбоновые кислоты в органике. М.: Химия. 1990
-
Дж. Роберт, М.Касерио «Основы органической химии» т. 1 Издание 2-е, дополненное. 1978
Кислоты
— электролиты, диссоциирующие с образованием катионов водорода и анионов кислотного остатка
Общая формула кислот H
n
Ac, где n – число атомов водорода, равное заряду иона кислотного остатка, Ac — кислотный остаток.
Сила кислот убывает в ряду:
HI > HClO
4
> HBr > HCl > H
2
SO
4
> HNO
3
> H
2
SO
3
> H
3
PO
4
> HF > HNO
2
>H
2
CO
3
> H
2
S > H
2
SiO
3
Кислородосодержащие кислоты и соответствующие кислотные оксиды
Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны также твёрдые кислоты: ортофосфорная, метафосфорная HPO
3
, борная H
3
BO
3
. Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H
2
SiO
3
.
1) Взаимодействие простых веществ
(получают бескислородные кислоты)
H
2
+ Cl
2
= 2HCl,
H
2
+ S = H
2
S.
2) Взаимодействие кислотных оксидов с водой
(получают кислородсодержащие кислоты)
SO
3
+ H
2
O = H
2
SO
4
,
3) Взаимодействие солей с растворами сильных кислот
(получают слабые кислоты)
Na
2
SiO
3
+ 2HCl = H
2
SiO
3
+ 2NaCl,
SiO
3
2-
+ 2H
+
= H
2
SiO
3
.
4) Электролиз водных растворов солей
2CuSO
4
+ 2H
2
O = 2Cu + O
2
+ 2H
2
SO
4
.
1) Растворы кислот кислые на вкус,
изменяют окраску индикаторов
:
лакмуса в красный цвет, метилового оранжевого – в розовый, цвет фенолфталеина не изменяется.
В водном растворе растворимые кислоты диссоциируют, образуя ион водорода, и кислотный остаток:
HCl = H
+
+ Cl
—
.
Многоосновные кислоты диссоциируют ступенчато:
H
2
SO
4
= H
+
+ HSO
4
—
,
HSO
4
—
= H
+
+ SO
4
2-
.
Суммарное уравнение:
H
2
SO
4
= 2H
+
+ SO
4
2-
2) Взаимодействие с металлами
Ca + 2HCl = CaCl
2
+ H
2
Водород из кислот-неокислителей могут вытеснять только металлы, стоящие в
электрохимическом ряду напряжений
металлов до водорода.
Кислоты-окислители — азотная и серная конц., реагируют с металлами по-другому, потому что в качестве окислителя выступает элемент кислотного остатка, а не водород!
Cu + 4HNO
3
= Cu(NO
3
)
2
+ 2NO
2
↑+2H
2
O
Cu +2H
2
SO
4 конц
= CuSO
4
+SO
2
↑ + 2H
2
O
3) Взаимодействие с основными оксидами
CaO + 2HCl = CaCl
2
+ H
2
O
(если образуется растворимая соль)
4) Взаимодействие с основаниями (реакция нейтрализации)
H
2
SO
4
+ 2KOH = K
2
SO
4
+ 2H
2
O,
2H
+
+ 2OH
—
= 2H
2
O
2HCl + Cu(OH)
2
= CuCl
2
+ 2H
2
O,
Cu(OH)
2
+ 2H
+
= Cu
2+
+ 2H
2
O.
Многоосновные кислоты образуют кислые и средние соли:
H
2
SO
4
+ NaOH = NaHSO
4
+ H
2
O,
H
2
SO
4
+ 2NaOH = Na
2
SO
4
+ 2H
2
O.
5) Взаимодействие с солями
Реакции с солями происходят только в том случае, если в результате химического превращения образуется малодиссоциирующее вещество, выделяется газ или выпадает осадок.
Na
2
CO
3
+ 2HCl = 2NaCl + CO
2
↑ + H
2
O,
CO
3
2-
+ 2H
+
= CO
2
+ H
2
O.
В этом случае выделяется углекислый газ и образуется малодиссоциирующее вещество – вода.
Na
2
SiO
3
+ H
2
SO
4
= H
2
SiO
3
↓ + Na
2
SO
4
,
SiO
3
2-
+ 2H
+
= H
2
SiO
3
.
Реакция происходит, так как образуется осадок.
6) Специфические свойства кислот
Связаны с окислительно-восстановительными реакциями, бескислородные кислоты в растворе могут только окисляться (проявлять восстановительные свойства):
2KMn
+7
O
4
+ 16HCl
—
= Cl
2
0
+ 2KCl + 2Mn
+2
Cl
2
+ 8H
2
O,
H
2
S
-2
+ Br
2
0
= S
0
+ 2HBr
—
.
Кислородсодержащие кислоты могут окисляться (проявлять восстановительные свойства), только когда центральный атом в них находится в промежуточной степени окисления, как, например, в сернистой кислоте:
H
2
S
+4
O
3
+ Cl
2
0
+ H
2
O = H
2
S
+6
O
4
+ 2HCl
—
.
Если центральный атом находится в максимальной степени окисления, то кислоты проявляют окислительные свойства, например, взаимодействие с металлами и неметаллами:
C
0
+ 2H
2
S
+6
O
4
= C
+4
O
2
+ 2S
+4
O
2
+ 2H
2
O,
3P
0
+ 5HN
+5
O
3
+ 2H
2
O = 3H
3
P
+5
O
4
+ 5N
+2
O.
Химические свойства кислот
- Многие кислоты растворяются в воде, придавая ей кисловатый вкус. Чтобы узнать присутствие кислоты в растворе применяются индикаторы: лакмус и метиловый оранжевый окрашиваются в красный цвет.
- Со щелочами взаимодействуют сильные кислоты. Происходит реакция нейтрализации, из — за того, что кислая среда кислоты, а так же щелочная среда щелочи в сумме образуют нейтральную среду воды. Сокращенное ионное уравнение реакции нейтрализации имеет общий вид: Н+ + ОН— → Н2О
- Взаимодействуют с основными и амфотерными основаниями и оксидами, образуя соли и воду. Данные реакции из-за образования электролита всегда проходят до конца. В них растворяются многие оксиды и нерастворимые основания.
- Возможно взаимодействие кислот с солями, при условии образования малорастворимых или газообразных веществ.
Взаимодействие кислот с металлами:
Классификаций кислот:
По составу кислотного остатка кислоты делятся на:
- кислородсодержащие — это гидроксиды. Они относятся к этой группе, так как содержат в своем составе ОН — группу. К ним относятся кислоты:
- серная — H2SO4;
- сернистая — H2SO3;
- азотная — HNO3;
- фосфорная — H3PO4;
- угольная — H2CO3;
- кремниевая — H2SiO3.
- бескислородные — кислорода в своем составе не имеют. К ним относятся кислоты:
- фтороводородная HF;
- хлороводородная или соляная HCl;
- бромоводородная HBr;
- иодоводородная HI;
- сероводородная H2S.
По количеству атомов водорода в составе:
- одноосновные (HNO3, HF и др.),
- двухосновные (H2SO4, H2CO3 и др.),
- трехосновные (H3PO4).
| Сильные кислоты |
|
| Слабые кислоты |
|
Изучай химические свойства:
- оксидов,
- металлов и неметаллов,
- солей,
- оснований и амфотерных гидроксидов.
Решай с ответами:
- задание 7 по химии
- задание 8 по химии
- задание 9 по химии
- задание 10 по химии
- задание 23 по химии
2.6. Характерные химические свойства кислот.
Классификация кислот
Кислоты можно классифицировать исходя из разных критериев:
1) Наличие атомов кислорода в кислоте
| Кислородсодержащие | Бескислородные |
| H3PO4,HNO3,HNO2,H2SO4,H3PO4,H2CO3,H2CO3, HClO4 все органические кислоты (HCOOH, CH3COOH и т.д.) | HF, HCl, HBr, HI, H2S |
2) Основность кислоты
Основностью кислоты называют число «подвижных» атомов водорода в ее молекуле, способных при диссоциации отщепляться от молекулы кислоты в виде катионов водорода H+, а также замещаться на атомы металла:
| одноосновные |
двухосновные |
трехосновные |
| HBr, HCl, HNO3, HNO2, HCOOH, CH3COOH |
H2SO4, H2SO3, H2CO3, H2SiO3 |
H3PO4 |
3) Летучесть
Кислоты обладают различной способностью улетучиваться из водных растворов.
| Летучие | Нелетучие |
|
H2S, HCl, CH3COOH, HCOOH |
H3PO4, H2SO4, высшие карбоновые кислоты |
4) Растворимость
| Растворимые | Нерастворимые |
| HF, HCl, HBr, HI, H2S, H2SO3, H2SO4, HNO3, HNO2, H3PO4, H2CO3, CH3COOH, HCOOH | H2SiO3, высшие карбоновые кислоты |
5) Устойчивость
| Устойчивые | Неустойчивые |
| H2SO4, H3PO4, HCl, HBr, HF | H2CO3, H2SO3 |
6) Способность к диссоциации
|
хорошо диссоциирующие (сильные) |
малодиссоциирующие (слабые) |
|
H2SO4, HCl, HBr, HI, HNO3, HClO4 |
H2CO3, H2SO3, H2SiO3 |
7) Окисляющие свойства
|
слабые окислители (проявляют окислительные свойства за счет катионов водорода H+) |
сильные окислители (проявляют окислительные свойства за счет кислотообразующего элемента) |
|
практически все кислоты кроме HNO3 и H2SO4 (конц.) |
HNO3 любой концентрации, H2SO4 (обязательно концентрированная) |
Химические свойства кислот
1. Способность к диссоциации
Кислоты диссоциируют в водных растворах на катионы водорода и кислотные остатки. Как уже было сказано, кислоты делятся на хорошо диссоциирующие (сильные) и малодиссоциирующие (слабые). При записи уравнения диссоциации сильных одноосновных кислот используется либо одна направленная вправо стрелка (), либо знак равенства (=), что показывает фактически необратимость такой диссоциации. Например, уравнение диссоциации сильной соляной кислоты может быть записано двояко:
либо в таком виде: HCl = H+ + Cl—
либо в таком: HCl → H+ + Cl—
По сути направление стрелки говорит нам о том, что обратный процесс объединения катионов водорода с кислотными остатками (ассоциация) у сильных кислот практически не протекает.
В случае, если мы захотим написать уравнение диссоциации слабой одноосновной кислоты, мы должны использовать в уравнении вместо знака две стрелки
. Такой знак отражает обратимость диссоциации слабых кислот — в их случае сильно выражен обратный процесс объединения катионов водорода с кислотными остатками:
CH3COOH CH3COO— + H+
Многоосновные кислоты диссоциируют ступенчато, т.е. катионы водорода от их молекул отрываются не одновременно, а по очереди. По этой причине диссоциация таких кислот выражается не одним, а несколькими уравнениями, количество которых равно основности кислоты. Например, диссоциация трехосновной фосфорной кислоты протекает в три ступени с поочередным отрывом катионов H+ :
H3PO4 H+ + H2PO4—
H2PO4— H+ + HPO42-
HPO42- H+ + PO43-
Следует отметить, что каждая следующая ступень диссоциации протекает в меньшей степени, чем предыдущая. То есть, молекулы H3PO4 диссоциируют лучше (в большей степени), чем ионы H2PO4— , которые, в свою очередь, диссоциируют лучше, чем ионы HPO42-. Связано такое явление с увеличением заряда кислотных остатков, вследствие чего возрастает прочность связи между ними и положительными ионами H+.
Из многоосновных кислот исключением является серная кислота. Поскольку данная кислота хорошо диссоциирует по обоим ступеням, допустимо записывать уравнение ее диссоциации в одну стадию:
H2SO4 2H+ + SO42-
2. Взаимодействие кислот с металлами
Седьмым пунктом в классификации кислот мы указали их окислительные свойства. Было указано, что кислоты бывают слабыми окислителями и сильными окислителями. Подавляющее большинство кислот (практически все кроме H2SO4(конц.) и HNO3) являются слабыми окислителями, так как могут проявлять свою окисляющую способность только за счет катионов водорода. Такие кислоты могут окислить из металлов только те, которые находятся в ряду активности левее водорода, при этом в качестве продуктов образуется соль соответствующего металла и водород. Например:
H2SO4(разб.) + Zn ZnSO4 + H2
2HCl + Fe FeCl2 + H2
Что касается кислот-сильных окислителей, т.е. H2SO4 (конц.) и HNO3, то список металлов, на которые они действуют, намного шире, и в него входят как все металлы до водорода в ряду активности, так и практически все после. То есть концентрированная серная кислота и азотная кислота любой концентрации, например, будут окислять даже такие малоактивные металлы, как медь, ртуть, серебро. Более подробно взаимодействие азотной кислоты и серной концентрированной с металлами, а также некоторыми другими веществами из-за их специфичности будет рассмотрено отдельно в конце данной главы.
3. Взаимодействие кислот с основными и амфотерными оксидами
Кислоты реагируют с основными и амфотерными оксидами. Кремниевая кислота, поскольку является нерастворимой, в реакцию с малоактивными основными оксидами и амфотерными оксидами не вступает:
H2SO4 + ZnO ZnSO4 + H2O
6HNO3 + Fe2O3 2Fe(NO3)3 + 3H2O
H2SiO3 + FeO ≠
4. Взаимодействие кислот с основаниями и амфотерными гидроксидами
HCl + NaOH H2O + NaCl
3H2SO4 + 2Al(OH)3 Al2(SO4)3 + 6H2O
5. Взаимодействие кислот с солями
Данная реакция протекает в случае, если образуется осадок, газ либо существенно более слабая кислота, чем та, которая вступает в реакцию. Например:
H2SO4 + Ba(NO3)2 BaSO4↓ + 2HNO3
CH3COOH + Na2SO3 CH3COONa + SO2↑ + H2O
HCOONa + HCl HCOOH + NaCl
6. Специфические окислительные свойства азотной и концентрированной серной кислот
Как уже было сказано выше, азотная кислота в любой концентрации, а также серная кислота исключительно в концентрированном состоянии являются очень сильными окислителями. В частности, в отличие от остальных кислот они окисляют не только металлы, которые находятся до водорода в ряду активности, но и практически все металлы после него (кроме платины и золота).
Так, например, они способны окислить медь, серебро и ртуть. Следует однако твердо усвоить тот факт, что ряд металлов (Fe, Cr, Al) несмотря на то, что являются довольно активными (находятся до водорода), тем не менее, не реагируют с концентрированной HNO3 и концентрированной H2SO4 без нагревания по причине явления пассивации — на поверхности таких металлов образуется защитная пленка из твердых продуктов окисления, которая не позволяет молекулами концентрированной серной и концентрированной азотной кислот проникать вглубь металла для протекания реакции. Однако, при сильном нагревании реакция все таки протекает.
В случае взаимодействия с металлами обязательными продуктами всегда являются соль соответствующего метала и используемой кислоты, а также вода. Также всегда выделяется третий продукт, формула которого зависит от многих факторов, в частности, таких, как активность металлов, а также концентрация кислот и температура проведения реакций.
Высокая окислительная способность концентрированной серной и концентрированной азотной кислот позволяет им реагировать не только практическим со всеми металлами ряда активности, но даже со многими твердыми неметаллами, в частности, с фосфором, серой, углеродом. Ниже в таблице наглядно представлены продукты взаимодействия серной и азотной кислот с металлами и неметаллами в зависимости от концентрации:
7. Восстановительные свойства бескислородных кислот
Все бескислородные кислоты (кроме HF) могут проявлять восстановительные свойства за счет химического элемента, входящего в состав аниона, при действии различных окислителей. Так, например, все галогеноводородные кислоты (кроме HF) окисляются диоксидом марганца, перманганатом калия, дихроматом калия. При этом галогенид-ионы окисляются до свободных галогенов:
4HCl + MnO2 MnCl2 + Cl2↑ + 2H2O
16HBr + 2KMnO4 2KBr + 2MnBr2 + 8H2O + 5Br2
14НI + K2Cr2O7 3I2↓ + 2Crl3 + 2KI + 7H2O
Среди всех галогеноводородных кислот наибольшей восстановительной активностью обладает иодоводородная кислота. В отличие от других галогеноводородных кислот ее могут окислить даже оксид и соли трехвалентного железа.
6HI + Fe2O3 2FeI2 + I2↓ + 3H2O
2HI + 2FeCl3 2FeCl2 + I2↓ + 2HCl
Высокой восстановительной активностью обладает также и сероводородная кислота H2S. Ее может окислить даже такой окислитель, как диоксид серы:
2H2S + SO2 3S↓+ 2H2O
На сильные и слабые эти субстанции подразделяются в зависимости от возможности отдавать ионы водорода во время взаимодействия с металлами.
Общие свойства
Все кислоты содержат атомы водорода, которые способны вступать в реакцию. Таким образом, кислота представляет собой сложное вещество, молекулы которого состоят из разного количества атомов водорода и кислотного остатка. Эти соединения обладают кислым и зачастую слегка металлическим вкусом. При контакте с ними индикаторы приобретают другой оттенок вплоть до кардинальной смены цвета.
Химические свойства, являющиеся общими для всех кислот:
- Все вещества, содержащие кислород, в процессе разложения образуют воду и кислотный оксид.
- Бескислородные соединения распадаются на простые элементы.
- Окислители вступают в реакцию со всеми расположенными слева от H металлами из ряда активности.
- Кислоты взаимодействуют с солями, образованными более слабым соединением.
Физические свойства веществ могут кардинально отличаться. Например, одни из них имеют запах, у других он отсутствует совершенно.
Кислоты могут быть жидкими, газообразными и твёрдыми. К твёрдым соединениям относятся, например, C2H204 и H3BO3.
Концентрация вещества
Зачастую химикам приходится решать задачи на определение количества чистой кислоты, находящейся в растворе, в процентах. В таких случаях искомым значением является концентрация.
Это величина, позволяющая определять количественный состав жидкого химического вещества. К примеру, для того, чтобы узнать, сколько чистой серной кислоты находится в разбавленном растворе, необходимо небольшое количество смеси налить в мерный стакан, взвесить и определить искомое значение по таблице плотности. Указанная таблица используется при вычислениях, так как плотность неразрывно связана с концентрацией.
Основная классификация
Чаще всего кислые вещества разделяют на кислородосодержащие и бескислородные. Состав последних соединений отличается тем, что в них нет кислорода, но есть водород. В связи с этим их названия всегда дополнены словом «водородная». Например, хлороводородная, сероводородная.
Кроме того, кислоты имеют классификацию по количеству атомов водорода.
Так, они подразделяются на следующие типы:
- одноосновные;
- двухосновные;
- трехосновные.
Но также существуют органические кислоты, то есть органические вещества, которые проявляют свойства, присущие кислотным соединениям. Из них наиболее известны уксусная, щавелевая, муравьиная, лимонная, молочная и яблочная.
Все кислые вещества и основания подразделяются на сильные и слабые. Но необходимо понять, что эти понятия никак не связаны с концентрацией соединений. Сила кислоты определяется её способностью вступать в химическую реакцию, отдавая водородные ионы.
Так, вещество считается сильным, если этот процесс проходит легко.
Сильные и слабые реагенты
Если реагент в водном растворе полностью распадается на ионы, то есть диссоциирует, то оно является сильным, поскольку слабые химические соединения никогда не растворяются до конца.
Кроме того, отличить слабую кислоту можно посредством измерения её проводимости. Сильные соединения являются хорошими электролитами. Сильные основания при попадании в воду также распадаются. Следует отметить, что основания также называют гидроксидами или гидроокисями.
Существует специальные перечни слабых и сильных кислот и оснований. Таблица, приведённая ниже, также может использоваться для классификации реагентов.
| Сильная кислота | Слабая кислота | Сильное основание | Слабое основание |
|---|---|---|---|
| HCI соляная или хлороводородная | HF фтороводородная | NaOH гидроокись натрия | Mg(OH)2 гидроокись магния |
| HBr бромоводородная | CH3COOH уксусная | KOH гидроокись калия | Fe(OH)2 гидроокись железа (II) |
| HI йодоводородная | H2SO3 сернистая | Ca(OH)2 гидроокись кальция | Zn(OH)2 гидроокись цинка |
| HNO3 азотная | H2S сероводородная | Ba(OH)2 гидроокись бария | NH4OH гидроокись аммония |
| HClO4 хлорная | HNO2 азотистая | LiOH гидроокись лития | Fe(OH)3 гидроокись железа (III) |
| H2SO4 серная | H2SiO3 кремниевая |
А также следует отметить, что кислородсодержащая угольная (H2CO3) и ортофосфорная (H3PO4) или фосфорная кислоты — слабые. К сильным же необходимо добавить хромовую, которая является средней по силе.
Кроме того, нужно учитывать, что современная химия позволяет учёным создавать новые соединения. В связи с этим список кислот, как сильных, так и слабых, постоянно пополняется.
Химические реакции
При соединении сильной кислоты с таким же основанием получится нейтральный раствор. Произошедшая в этом случае химическая реакция называется нейтрализацией. Если же заменить основание на слабое, то полностью диссоциирует только кислое вещество.
Второй компонент не распадается на ионы полностью.
Слабое основание лишь незначительно вступает в реакцию со слабой кислотой.
Когда кислотное соединение реагирует с сильным основанием, то первый реагент проходит частичную диссоциацию, второй же полностью диссоциирует.
Полученный в результате раствор обладает слабыми свойствами основания.
Водородный показатель
При проведении диссоциирующих реакций важно правильно определить уровень кислотности воды. Для его количественного выражения применяется величина pH, называющаяся силой, весом или потенциалом водорода. Она позволяет измерить активность ионов водорода. Если уровень pH превышает 7, то у вещества присутствуют кислотные свойства, если же этот показатель меньше 7, то свойства являются основными.
Способы определения
Результаты химических реакций, в которых участвует любое вещество, напрямую зависят от уровня его кислотности. А потому химики всегда измеряют этот показатель.
Существует несколько методов определения pH:
- Инструментальный способ. В этом случае применяется pH-метр. Этот прибор трансформирует концентрацию протонов в какой-либо жидкости в электрический сигнал.
- Индикаторы. Это вещества, изменяющие оттенок цвет в зависимости от показателя pH. Использование различных индикаторов позволяет получить довольно точные данные об уровне кислотности.
- Соль. Соль представляет собой соединение ионов, которое полностью диссоциирует в слабом водном растворе. Для определения кислотно-щелочных свойств соляного раствора, прежде всего, нужно установить и изучить свойства ионов, находящиеся в растворе.
Буферный раствор
Буферным раствором называется вещество, отличающееся наличием постоянной концентрации ионов водорода.
При добавлении сильной кислоты или такого же основания в небольших дозах эти растворы сохраняют изначальный уровень кислотности.
Для приготовления такой смеси нужно смешать слабое кислое вещество или основание с соответствующей солью.
При изготовлении буферного раствора необходимо учитывать следующие факторы:
- Интервал уровня кислотности, в котором вещество станет эффективным.
- Ёмкость раствора, то есть какой объём сильного кислотного соединения или основания можно добавить в смесь, не изменив её pH.
- При соединении веществ не должно быть реакций, способных повлиять на состав раствора.
Самые опасные кислотные соединения
На сегодняшний день самой сильной кислотой в мире считается пентафторид сурьмы фтористоводородной кислоты. Её химическая формула — HFSbF5. Не существует точных данных об активности этого соединения, но установлено, что его 55-процентный раствор почти в миллион раз сильнее концентрированной серной кислоты.
Следующим по силе является карборановое кислотное соединение. Это вещество разрешается хранить только в специальной ёмкости. Она также во много раз опаснее серной и растворяет даже стекло.
Ещё одной суперкислотой является плавиковая. Она не имеет цвета и, подобно предыдущему веществу, способна разъедать стекло. Для перевозки этого едкого соединения применяют полиэтилен. Вещество прекрасно вступает в реакцию с большинством металлов, но не взаимодействует с парафином. Соединение токсично, даже его пары опасны для здоровья. Кислота обладает эффектом наркотика.
Самое известное сильное вещество — серная кислота. Из-за больших производственных объёмов некоторые химики считают именно её самой опасной в мире. По мере того как увеличивается концентрация реагента, растёт и его опасность для здоровья человека, хотя даже растворы серного кислотного соединения могут нанести серьёзный вред. Это вещество окисляет металлы и является крайне едким, даже пары реагента очень опасны. При контакте происходит поражение кожи и слизистых оболочек, органов дыхания, а также внутренних органов человека.
Часто используемая в быту муравьиная кислота тоже относится к ядовитым химикатам. Эта ситуация объясняется тем, что опасность возникает только при высокой концентрации вещества. В обычных условиях оно бесцветно, легко образует водные растворы, а также успешно растворяется в ацетоне.
При концентрации меньше 10% реагент вызывает только раздражение. Если же этот показатель повышен, то соединение может разъесть ткани и множество других веществ. Его пары повреждают глаза, слизистые оболочки и дыхательные пути. При попадании внутрь организма наступает серьёзное отравление. Но в минимальных концентрациях реагент успешно перерабатывается и выводится из организма. В небольших дозах оно присутствует во фруктах, выделениях насекомых, крапиве.
Мощным ядом является азотная кислота. В разных пропорциях она прекрасно смешивается с водой. Реагент крайне опасен для человека. Его пары наносят серьёзный вред органам дыхания и слизистым оболочкам. Кожный покров при попадании кислоты становится жёлтым, на нём остаются язвы. Пострадавшие места требуют длительного восстановительного процесса.
При воздействии высокой температуры или света азотная кислота распадается, превращаясь в довольно токсичный газ. У вещества не возникает химической реакции со стеклом, а потому этот материал применяют для хранения реагента. Создателем ядовитого соединения является алхимик Джабир.
Кривые титрования
Кривые титрования представляют собой график зависимости параметра вещества, который связан с концентрацией реагента, подвергающегося титрованию, титранта или продукта химической реакции, от степени протекания процесса. Если проходит кислотно-основная реакция, то показателем концентрации каждого её участка является уровень рН.
Существуют теоретические и экспериментальные кривые. Теоретические используются для того, чтобы обосновать выбор индикатора. Их расчёт осуществляется по уравнению реакции и данным об исходной концентрации соединений, вступающих в реакцию. Экспериментальные кривые позволяют определить точки эквивалентности. Их получают путём измерения одного из свойств системы в процессе титрования.
Протекание и результат химических реакций, в которые вступает любая кислота, напрямую зависят от того, является это вещество сильным или слабым. В специальных химических таблицах приведены наименования самых распространённых соединений, что позволяет безошибочно определить силу реагента.
Перед изучением этого раздела рекомендую прочитать следующую статью:
Классификация неорганических веществ
Кислоты – сложные вещества, которые при взаимодействии с водой образуют в качестве катионов только ионы Н+ (или Н3О+).
По растворимости в воде кислоты можно поделить на растворимые и нерастворимые. Некоторые кислоты самопроизвольно разлагаются и в водном растворе практически не существуют (неустойчивые). Подробно про классификацию кислот можно прочитать здесь.
Получение кислот
1. Взаимодействие кислотных оксидов с водой. При этом с водой реагируют при обычных условиях только те оксиды, которым соответствует кислородсодержащая растворимая кислота.
кислотный оксид + вода = кислота
Например, оксид серы (VI) реагирует с водой с образованием серной кислоты:
SO3 + H2O → H2SO4
При этом оксид кремния (IV) с водой не реагирует:
SiO2 + H2O ≠
2. Взаимодействие неметаллов с водородом. Таким образом получают только бескислородные кислоты.
Неметалл + водород = бескислородная кислота
Например, хлор реагирует с водородом:
H20 + Cl20 → 2H+Cl—
3. Электролиз растворов солей. Как правило, для получения кислот электролизу подвергают растворы солей, образованных кислотным остатком кислородсодержащих кислот. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например, электролиз раствора сульфата меди (II):
2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2
4. Кислоты образуются при взаимодействии других кислот с солями. При этом более сильная кислота вытесняет менее сильную.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
CaCO3 + H2SO4 → CaSO4 + H2O + CO2
5. Кислоты можно получить окислением оксидов, других кислот и неметаллов в водном растворе кислородом или другими окислителями.
Например, концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
P + 5HNO3 → H3PO4 + 5NO2 + H2O
Химические свойства кислот
1. В водных растворах кислоты диссоциируют на катионы водорода Н+ и анионы кислотных остатков. При этом сильные кислоты диссоциируют почти полностью, а слабые кислоты диссоциируют частично.
Например, соляная кислота диссоциирует почти полностью:
HCl → H+ + Cl–
Если говорить точнее, происходит протолиз воды, и в растворе образуются ионы гидроксония:
HCl + H2O → H3O+ + Cl–
Многоосновные кислоты диссоциируют cтупенчато.
Например, сернистая кислота диссоциирует в две ступени:
H2SO3 ↔ H+ + HSO3–
HSO3– ↔ H+ + SO32–
2. Кислоты изменяют окраску индикатора. Водный раствор кислот окрашивает лакмус в красный цвет, метилоранж в красный цвет. Фенолфталеин не изменяет окраску в присутствии кислот.
3. Кислоты реагируют с основаниями и основными оксидами.
С нерастворимыми основаниями и соответствующими им оксидами взаимодействуют только растворимые кислоты.
нерастворимое основание + растворимая кислота = соль + вода
основный оксид + растворимая кислота = соль + вода
Например, гидроксид меди (II) взаимодействует с растворимой бромоводородной кислотой:
Cu(OH)2 + 2HBr → CuBr2 + 2H2O
При этом гидроксид меди (II) не взаимодействует с нерастворимой кремниевой кислотой.
Cu(OH)2 + H2SiO3 ≠
С сильными основаниями (щелочами) и соответствующими им оксидами реагируют любые кислотами.
Щёлочи взаимодействуют с любыми кислотами — и сильными, и слабыми. При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации. Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
Например, гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
NaOH + H3PO4 → NaH2PO4 + H2O
При мольном соотношении количества щелочи и кислоты 1:2 образуются гидрофосфаты:
2NaOH + H3PO4 → Na2HPO4 + 2H2O
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
3NaOH + H3PO4 → Na3PO4 + 3H2O
4. Растворимые кислоты взаимодействуют с амфотерными оксидами и гидроксидами.
Растворимая кислота + амфотерный оксид = соль + вода
Растворимая кислота + амфотерный гидроксид = соль + вода
Например, уксусная кислота взаимодействует с гидроксидом алюминия:
3CH3COOH + Al(OH)3 → (CH3COO)3Al + 3H2O
5. Некоторые кислоты являются сильными восстановителями. Восстановителями являются кислоты, образованные неметаллами в минимальной или промежуточной степени окисления, которые могут повысить свою степень окисления (йодоводород HI, сернистая кислота H2SO3 и др.).
Например, йодоводород можно окислить хлоридом меди (II):
4HI— + 2Cu+2 Cl2 → 4HCl + 2Cu+I + I20
6. Кислоты взаимодействуют с солями.
Кислоты реагируют с растворимыми солями только при условии, что в продуктах реакции присутствует газ, вода, осадок или другой слабый электролит. Такие реакции протекают по механизму ионного обмена.
Кислота1 + растворимая соль1 = соль2 + кислота2/оксид + вода
Например, соляная кислота взаимодействует с нитратом серебра в растворе:
Ag+NO3— + H+Cl— → Ag+Cl—↓ + H+NO3—
Кислоты реагируют и с нерастворимыми солями. При этом более сильные кислоты вытесняют менее сильные кислоты из солей.
Например, карбонат кальция (соль угольной кислоты), реагирует с соляной кислотой (более сильной, чем угольная):
CaCO3 + 2HCl → CaCl2 + H2O + CO2
7. Кислоты взаимодействуют с кислыми и основными солями. При этом более сильные кислоты вытесняют менее сильные из кислых солей. Либо кислые соли реагируют с кислотами с образованием более кислых солей.
кислая соль1 + кислота1 = средняя соль2 + кислота2/оксид + вода
Например, гидрокарбонат калия реагирует с соляной кислотой с образованием хлорида калия, углекислого газа и воды:
KHCO3 + HCl → KCl + CO2 + H2O
Ещё пример: гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия:
H3PO4 + K2HPO4 → 2KH2PO4
При взаимодействии основных солей с кислотами образуются средние соли. Более сильные кислоты также вытесняют менее сильные из солей.
Например, гидроксокарбонат меди (II) растворяется в серной кислоте:
2H2SO4 + (CuOH)2CO3 → 2CuSO4 + 3H2O + CO2
Основные соли могут взаимодействовать с собственными кислотами. При этом вытеснения кислоты из соли не происходит, а просто образуются более средние соли.
Например, гидроксохлорид алюминия взаимодействует с соляной кислотой:
Al(OH)Cl2 + HCl → AlCl3 + H2O
8. Кислоты взаимодействуют с металлами.
При этом протекает окислительно-восстановительная реакция. Однако минеральные кислоты и кислоты-окислители взаимодействуют по-разному.
К минеральным кислотам относятся соляная кислота HCl, разбавленная серная кислота H2SO4, фосфорная кислота H3PO4, плавиковая кислота HF, бромоводородная HBr и йодоводородная кислоты HI и др.
Такие кислоты взаимодействуют только с металлами, расположенными в ряду активности до водорода:
При взаимодействии минеральных кислот с металлами образуются соль и водород:
минеральная кислота + металл = соль + H2↑
Например, железо взаимодействует с соляной кислотой с образованием хлорида железа (II):
Fe + 2H+Cl → Fe+2Cl2 + H20
Кислоты-окислители (азотная кислота HNO3 любой концентрации и серная концентрированная кислота H2SO4(конц)) при взаимодействии с металлами водород не образуют, т.к. окислителем выступает не водород, а азот или сера. Продукты восстановления азотной или серной кислот бывают различными. Определять их лучше по специальным правилам. Эти правила подробно разобраны в статье Окислительно-восстановительные реакции. Я настоятельно рекомендую выучить их наизусть.
9. Некоторые кислоты разлагаются при нагревании.
Угольная H2CO3, сернистая H2SO3 и азотистая HNO2 кислоты разлагаются самопроизвольно, без нагревания:
H2CO3 → H2O + CO2
H2SO3 → H2O + SO2
2HNO2 → NO + H2O + NO2
Кремниевая H2SiO3, йодоводородная HI кислоты разлагаются при нагревании:
H2SiO3 → H2O + SiO2
2HI → H2 + I2
Азотная кислота HNO3 разлагается при нагревании или на свету:
4HNO3 → O2 + 2H2O + 4NO2
Кислоты и основания
После прочтения статьи Вы сможете разделять вещества на соли, кислоты и основания. В статье описано, что такое
pH раствора, какими общими свойствами обладают кислоты и основания.
Простым языком, кислота — это всё что с H, а основание — c OH. НО! Не всегда. Что бы отличать кислоту от основания
необходимо… запомнить их! Сожалею. Что бы хоть как то облегчить жизнь, три наших друга, Аррениус и Бренстед с
Лоури, придумали две теории, которые зовутся их именем.
Как металлы и неметаллы, кислоты и основания — это разделение веществ по схожим свойствам. Первая теория кислот
и оснований принадлежала швецкому учёному Аррениусу. Кислота по Аррениусу — это класс веществ, которые
в реакции с водой диссоциируют (распадаются), образовывая катион водорода H+. Основания Аррениуса в водном растворе образуют
анионы OH—. Следующая теория в 1923 году была предложена учёными Бренстедом и Лоури. Теория Бренстеда-Лоури
определяет кислотами вещества, способные в реакции отдавать протон (протоном в реакциях называют катион водорода). Основания,
соответственно, — это вещества, способные принять протон в реакции. Актуальная на данный момент теория — теория Льюиса.
Теория Льюиса определяет кислоты как молекулы или ионы, способные принимать электронные пары, тем самым формируя
аддукты Льюиса (аддукт — это соединение, образующееся соединением двух реагентов без образования побочных продуктов).
В неорганической химии, как правило, под кислотой имеют ввиду кислоту Бренстеда-Лоури, то есть вещества, способные отдать
протон. Если имеют ввиду определение кислоты по Льюису, то в тексте такую кислоту называют кислотой Льюиса. Данные правила
справедливы для кислот и оснований.
Диссоциация
Диссоциация – это процесс распада вещества на ионы в растворах или расплавах. Например, диссоциация соляной кислоты — это распад
HCl на H+ и Cl—.
Свойства кислот и оснований
Кислоты, содержащие водород, в водном растворе выделяют катионы водорода. Основания, содержащие гидроксид-ион,
в водном растворе выделяют анион OH—.
Основания, как правило, мыльные на ощупь, кислоты, в большинстве своём, имеют кислый вкус.
При реакции основания со многими катионами формируется осадок. При реакции кислоты с анионами, как правило, выделяется
газ.
Часто используемые кислоты:
H2O, H3O+, CH3CO2H, H2SO4,
HSO4−, HCl, CH3OH, NH3
Часто используемые основания:
OH−, H2O, CH3CO2−,
HSO4−, SO42−, Cl−
Сильные и слабые кислоты и основания
Сильные кислоты
Такие кислоты, которые полностью диссоциируют в воде, производя катионы водорода H+ и анионы.
Пример сильной кислоты — соляная кислота HCl:
HCl(р-р) + H2O(ж) → H3O+(р-р) + Cl—(р-р)
Примеры сильных кислот: HCl, HBr, HF, HNO3, H2SO4, HClO4
Список сильных кислот
- HCl — соляная кислота
- HBr — бромоводород
- HI — йодоводород
- HNO3 — азотная кислота
- HClO4 — хлорная кислота
- H2SO4 — серная кислота
Слабые кислоты
Растворяются в воде только частично, например, HF:
HF(р-р) + H2O(ж) → H3O+(р-р) + F—(р-р) —
в такой реакции более 90% кислоты не диссоциирует:
[H3O+]=[F—] < 0,01M для вещества 0,1М
Сильную и слабую кислоту можно различить измеряя проводимость растворов: проводимость зависит от количества ионов,
чем сильнее кислота тем она более диссоциирована, поэтому чем сильнее кислота тем выше проводимость.
Список слабых кислот
- HF фтороводородная
- H3PO4 фосфорная
- H2SO3 сернистая
- H2S сероводородная
- H2CO3 угольная
- H2SiO3 кремниевая
Сильные основания
Сильные основания полностью диссоциируют в воде:
NaOH(р-р) + H2O ↔ NH4
К сильным основаниям относятся гидроксиды металлов первой (алкалины, щелочные металы) и второй (алкалинотеррены,
щёлочноземельные металлы) группы.
Список сильных оснований
- NaOH гидроксид натрия (едкий натр)
- KOH гидроксид калия (едкое кали)
- LiOH гидроксид лития
- Ba(OH)2 гидроксид бария
- Ca(OH)2 гидроксид кальция (гашеная известь)
Слабые основания
В обратимой реакции в присутствии воды образует ионы OH—:
NH3 (р-р) + H2O ↔ NH+4 (р-р) + OH—(р-р)
Большинство слабых оснований — это анионы:
F—(р-р) + H2O ↔ HF(р-р) + OH—(р-р)
Список слабых оснований
- Mg(OH)2 гидроксид магния
- Fe(OH)2 гидроксид железа (II)
- Zn(OH)2 гидроксид цинка
- NH4OH гидроксид аммония
- Fe(OH)3 гидроксид железа (III)
Реакции кислот и оснований
Сильная кислота и сильное основание
Такая реакция называется нейтрализацией: при количестве реагентов достаточном для полной диссоциации кислоты и
основания, результирующий раствор будет нейтральным.
Пример:
H3O+ + OH— ↔ 2H2O
Слабое основание и слабая кислота
Общий вид реакции:
Слабое основание(р-р) + H2O ↔ Слабая кислота(р-р) + OH—(р-р)
Сильное основание и слабая кислота
Основание полностью диссоциирует, кислота диссоциирует частично, результирующий раствор имеет слабые свойства
основания:
HX(р-р) + OH—(р-р) ↔ H2O + X—(р-р)
Сильная кислота и слабое основание
Кислота полностью диссоциирует, основание диссоциирует не полностью:
NH3 (р-р) + H+ ↔ NH4
Диссоциация воды
Диссоциация — это распад вещества на составляющие молекулы. Свойства кислоты или основания зависят от
равновесия, которое присутствует в воде:
H2O + H2O ↔ H3O+(р-р) + OH—(р-р)
Kc = [H3O+][OH—]/[H2O]2
Константа равновесия воды при t=25°: Kc = 1.83⋅10-6, также имеет место следующее
равенство: [H3O+][OH—] = 10-14, что называется константой
диссоциации воды. Для чистой воды [H3O+] = [OH—] = 10-7,
откуда -lg[H3O] = 7.0.
Данная величина (-lg[h3O]) называется pH — потенциал водорода. Если pH < 7, то вещество
имеет кислотные свойства, если pH > 7, то вещество имеет основные свойства.
Способы определения pH
Инструментальный метод
Специальный прибор pH-метр — устройство, трансформирующее концентрацию протонов в растворе в электрический
сигнал.
Индикаторы
Вещество, которое изменяет цвет в некотором интервале значений pH в зависимости от кислотности раствора,
используя несколько индикаторов можно добиться достаточно точного результата.
Соль
Соль — это ионное соединение образованное катионом отличным от H+ и анионом отличным от O2-.
В слабом водном растворе соли полностью диссоциируют.
Что бы определить кислотно-щелочные свойства раствора соли, необходимо определить, какие ионы присутствуют
в растворе и рассмотреть их свойства: нейтральные ионы, образованные из сильных кислот и оснований не влияют на pH:
не отдают ионы ни H+, ни OH— в воде. Например, Cl—, NO—3,
SO2-4, Li+, Na+, K+.
Анионы, образованные из слабых кислот, проявляют щелочные свойства (F—, CH3COO—,
CO2-3), катионов с щелочными свойствами не существует.
Все катионы кроме металлов первой и второй группы имеют кислотные свойства.
Буфферный раствор
Растворы, которые сохраняют уровень pH при добавлении небольшого количества сильной кислоты или сильного
основания, в основном состоят из:
- Смесь слабой кислоты, соответствующей соли и слабого основания
- Слабое основание, соответствующая соль и сильная кислота
Для подготовки буфферного раствора определённой кислотности необходимо смешать слабую кислоту или основание
с соответствующей солью, при этом необходимо учесть:
- Интервал pH в котором буфферный раствор будет эффективен
-
Ёмкость раствора — количество сильной кислоты или сильного основания, которые можно добавить не повлияв
на pH раствора - Не должно происходить нежелаемых реакций, которые могут изменить состав раствор