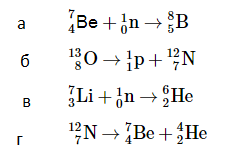Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Задания Д10 B19 № 2005
Какие утверждения соответствуют планетарной модели атома?
1) ядро — в центре атома, заряд ядра положителен, электроны на орбитах вокруг ядра
2) ядро — в центре атома, заряд отрицателен, электроны на орбитах вокруг ядра
3) электроны — в центре атома, ядро обращается вокруг электронов, заряд ядра положителен
4) электроны — в центре атома, ядро обращается вокруг электронов, заряд ядра отрицателен
2
Задания Д10 B19 № 2006
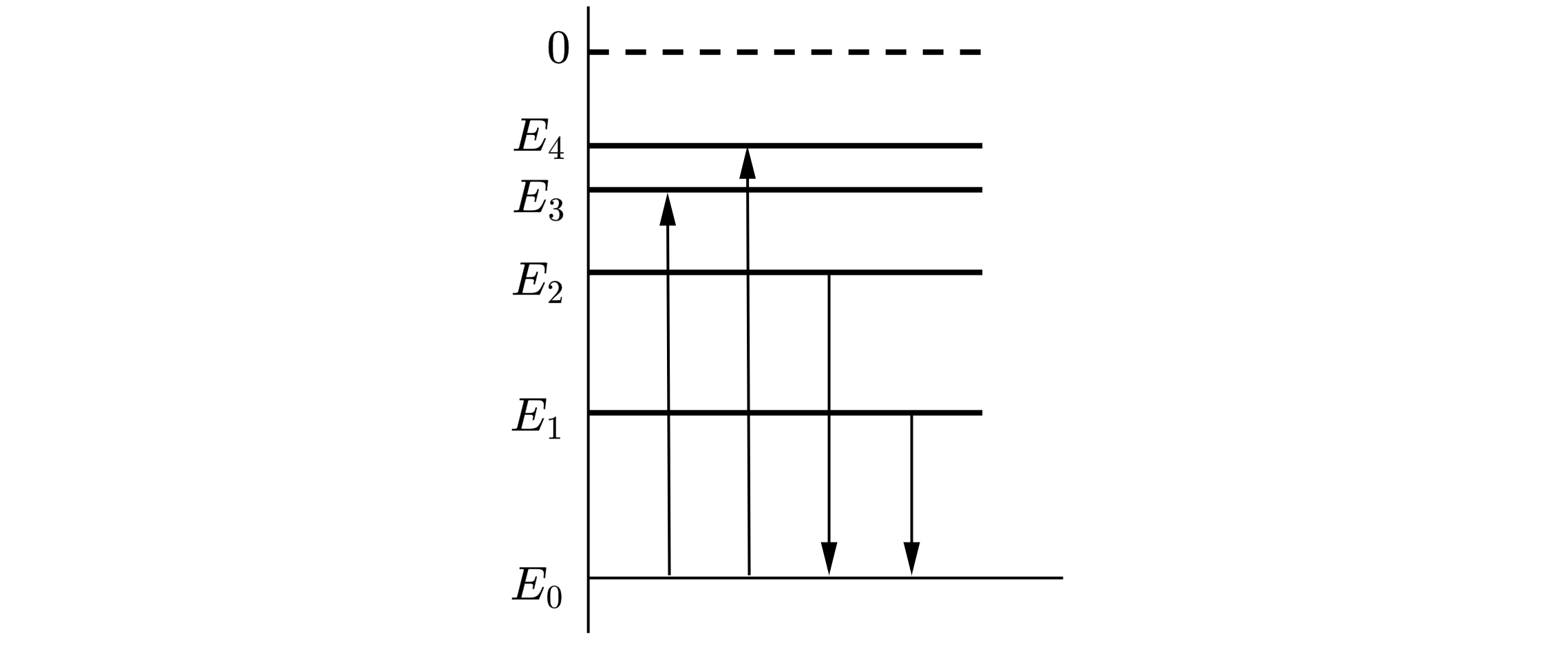
На рисунке представлена диаграмма энергетических уровней атома.
Какой из отмеченных стрелками переходов между энергетическими уровнями сопровождается поглощением кванта минимальной частоты?
1) с уровня 1 на уровень 5
2) с уровня 1 на уровень 2
3) с уровня 5 на уровень 1
4) с уровня 2 на уровень 1
3
Задания Д10 B19 № 2013
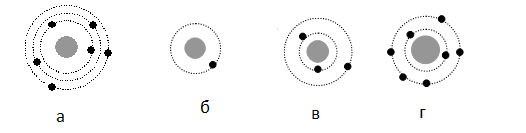
На рисунке изображены модели атома Резерфорда для четырех атомов.
Черными точками обозначены электроны. Атому соответствует схема
1) 1
2) 2
3) 3
4) 4
4
Задания Д10 B19 № 2018
На рисунке изображены схемы четырех атомов.
Электроны обозначены черными точками. Атому соответствует схема
1) 1
2) 2
3) 3
4) 4
5
Задания Д10 B19 № 2019
На рисунке изображены схемы четырех атомов.
Электроны обозначены черными точками. Атому соответствует схема
1) 1
2) 2
3) 3
4) 4
Пройти тестирование по этим заданиям
в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 119 1–20 | 21–40 | 41–60 | 61–80 | 81–100 …
Добавить в вариант
Задания Д32 C3 № 3046
Предположим, что схема нижних энергетических уровней атомов некоего элемента имеет вид, показанный на рисунке, и атомы находятся в состоянии с энергией
Электрон, столкнувшись с одним из таких атомов, в результате столкновения получил некоторую дополнительную энергию. Кинетическая энергия электрона до столкновения равнялась
Определите импульс электрона после столкновения с атомом. Возможностью испускания света атомом при столкновении с электроном пренебречь, до столкновения атом считать неподвижными.
Задания Д11 B20 № 3344
Атом бора содержит
1) 8 протонов, 5 нейтронов и 13 электронов
2) 8 протонов, 13 нейтронов и 8 электронов
3) 5 протонов, 3 нейтрона и 5 электронов
4) 5 протонов, 8 нейтронов и 13 электронов
Задания Д10 B19 № 3389
Атом титана содержит
1) 48 протонов, 22 нейтрона и 26 электронов
2) 26 протонов, 22 нейтрона и 48 электронов
3) 22 протонов, 26 нейтрона и 22 электронов
4) 22 протонов, 48 нейтрона и 48 электронов
Задания Д10 B19 № 3390
Атом меди содержит
1) 29 протонов, 34 нейтрона и 29 электронов
2) 34 протона, 29 нейтронов и 34 электрона
3) 29 протонов, 34 нейтрона и 34 электрона
4) 34 протона, 29 нейтронов и 29 электронов
В сосуде находится разреженный атомарный водород. Атом водорода в основном состоянии ( эВ) поглощает фотон и ионизуется. Электрон, вылетевший из атома в результате ионизации, движется вдали от ядра со скоростью
км/с. Какова частота поглощённого фотона? Энергией теплового движения атомов водорода пренебречь. В ответе приведите значение частоты в герцах, умноженное на 10−15, с точностью до десятых.
Источник: ЕГЭ по физике 06.06.2013. Основная волна. Урал. Вариант 1., ЕГЭ по физике 06.06.2013. Основная волна. Урал. Вариант 5.
В сосуде находится разреженный атомарный водород. Атом водорода в основном состоянии () поглощает фотон и ионизуется. Электрон, вылетевший из атома в результате ионизации, движется вдали от ядра со скоростью
Какова длина волны поглощённого фотона? Энергией теплового движения атомов водорода пренебречь. Ответ приведите в нанометрах и округлите до целого числа.
Источник: ЕГЭ по физике 06.06.2013. Основная волна. Урал. Вариант 2.
В сосуде находится разреженный атомарный водород. Атом водорода в основном состоянии () поглощает фотон и ионизуется. Электрон, вылетевший из атома в результате ионизации, движется вдали от ядра с импульсом
Какова энергия поглощенного фотона? Энергией теплового движения атомов водорода пренебречь. Ответ приведите в электрон-вольтах, округлите до десятых.
Источник: ЕГЭ по физике 06.06.2013. Основная волна. Урал. Вариант 3.
В сосуде находится разреженный атомарный водород. Атом водорода в основном состоянии () поглощает фотон и ионизуется. Электрон, вылетевший из атома в результате ионизации, движется вдали от ядра со скоростью υ = 1000 км/с. Какова энергия поглощённого фотона? Энергией теплового движения атомов водорода пренебречь. Ответ приведите в электрон-вольтах ответ округлите до первого знака после запятой.
Источник: ЕГЭ по физике 06.06.2013. Основная волна. Урал. Вариант 4., ЕГЭ по физике 06.06.2013. Основная волна. Урал. Вариант 6.
Задания Д10 B19 № 5764
Согласно одному из квантовых постулатов Н. Бора
1) излучение или поглощение энергии атомом происходит непрерывно
2) атом излучает или поглощает энергию только тогда, когда электроны находятся в стационарных состояниях
3) при переходе электрона с орбиты на орбиту излучается или поглощается квант энергии, равный энергии электрона в данном стационарном состоянии
4) при переходе электрона с орбиты на орбиту излучается или поглощается квант энергии, равный разности энергий электрона в стационарных состояниях
Задания Д10 B19 № 6900
На рисунке изображены модели четырёх нейтральных атомов. Чёрными кружочками обозначены электроны. Атому соответствует модель
Источник: ЕГЭ — 2015. Досрочная волна.
Уровни энергии электрона в атоме водорода задаются формулой En = −13,6/n2 эВ, где n = 1, 2, 3, …. При переходе атома из состояния Е2 в состояние Е1 атом испускает фотон. Попав на поверхность фотокатода, фотон выбивает фотоэлектрон. Длина волны света, соответствующая красной границе фотоэффекта для материала поверхности фотокатода, λкр = 300 нм. Чему равен максимально возможный импульс фотоэлектрона? (Ответ дать в 10–24 кг·м/с, округлив до десятых.) Постоянную Планка принять равной 6,6·10−34 Дж·с, а скорость света — 3·108 м/с.
Уровни энергии электрона в атоме водорода задаются формулой En = −13,6/n2 эВ, где n = 1, 2, 3, …. При переходе атома из состояния Е2 в состояние Е1 атом испускает фотон. Попав на поверхность фотокатода, этот фотон выбивает фотоэлектрон. Частота света, соответствующая красной границе фотоэффекта для материала поверхности фотокатода,
νкр = 6·1014 Гц. Чему равен максимально возможный импульс фотоэлектрона? (Ответ дать в 10−24 кг·м/с, округлив до десятых.) Постоянную Планка принять равной 6,6·10−34 Дж·с.
Задания Д10 B19 № 7150
На рисунке изображены схемы четырёх атомов. Чёрными точками обозначены электроны. Нейтральному атому соответствует схема
Электрон в атоме водорода находится в основном (самом низком, с номером n = 1) энергетическом состоянии. Атом поглощает фотон с импульсом 6,8 · 10–27 кг·м/с. Найдите номер энергетического уровня, на который в результате этого перейдёт электрон.
Электрон в атоме водорода находится в основном (самом низком, с номером n = 1) энергетическом состоянии. Атом поглощает фотон с импульсом 6,45 · 10–27 кг·м/с. Найдите номер энергетического уровня, на который в результате этого перейдёт электрон.
Каким образом возникает газовый разряд и свечение в стеклянных трубках с достаточно разреженными газами при подаче на электроды в трубках высокого напряжения? Какие частицы (ионы или электроны) играют основную роль в обеспечении ионизации газа? Оцените, во сколько раз отличаются кинетические энергии электронов и ионов гелия после их ускорения в электрическом поле (считайте, что при ионизации атом гелия теряет один электрон). Ответ поясните на основании известных законов механики и электродинамики.
Выберите все верные утверждения о физических явлениях, величинах и закономерностях.
Запишите в ответ их номера.
1) Вектор скорости материальной точки всегда направлен по касательной к её траектории.
2) В процессе кристаллизации постоянной массы вещества его внутренняя энергия увеличивается.
3) Разноимённые точечные электрические заряды отталкиваются друг от друга.
4) Явления интерференции и дифракции могут наблюдаться в любом диапазоне электромагнитных волн.
5) При переходе атома из одного стационарного состояния в другое стационарное состояние атом испускает или поглощает фотон.
Установите соответствие между названиями постулатов и их формулировками. К каждой позиции первого столбца подберите нужную позицию второго и запишите в таблицу выбранные цифры под соответствующими буквами.
ИХ ФОРМУЛИРОВКИ
1) переходя из одного состояния в другое, атом излучает (поглощает) половину раз-ности энергий в начальном и конечном состояниях
2) переходя из одного состояния в другое, атом излучает (поглощает) квант энергии, равный разности энергий в начальном и конечном состояниях
3) атом может находиться только в одном из двух возможных состояний
4) атом может находиться только в одном из состояний с определенным значением энергии
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Задания Д10 B19 № 2110
Ядро атома содержит 10 нейтронов и 9 протонов, вокруг него обращаются 8 электронов. Эта система частиц
1) ион фтора
2) ион неона
3) атом фтора
4) атом неона
На рисунке изображена схема низших энергетических уровней атома. В начальный момент времени атом находится в состоянии с энергией
Согласно постулатам Бора с какой энергией данный атом может излучать фотоны? (Ответ дать в 10−19 Дж.)
Источник: ЕГЭ по физике 06.06.2013. Основная волна. Дальний Восток. Вариант 1.
Всего: 119 1–20 | 21–40 | 41–60 | 61–80 | 81–100 …
Темы кодификатора ЕГЭ: Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояние атомов.
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
Одну из первых моделей строения атома — «пудинговую модель» — разработал Д.Д. Томсон в 1904 году. Томсон открыл существование электронов, за что и получил Нобелевскую премию. Однако наука на тот момент не могла объяснить существование этих самых электронов в пространстве. Томсон предположил, что атом состоит из отрицательных электронов, помещенных в равномерно заряженный положительно «суп», который компенсирует заряд электронов (еще одна аналогия — изюм в пудинге). Модель, конечно, оригинальная, но неверная. Зато модель Томсона стала отличным стартом для дальнейших работ в этой области.
И дальнейшая работа оказалась эффективной. Ученик Томсона, Эрнест Резерфорд, на основании опытов по рассеянию альфа-частиц на золотой фольге предложил новую, планетарную модель строения атома.
Согласно модели Резерфорда, атом состоит из массивного, положительно заряженного ядра и частиц с небольшой массой — электронов, которые, как планеты вокруг Солнца, летают вокруг ядра, и на него не падают.
Модель Резерфорда оказалась следующим шагом в изучении строения атома. Однако современная наука использует более совершенную модель, предложенную Нильсом Бором в 1913 году. На ней мы и остановимся подробнее.
Атом — это мельчайшая, электронейтральная, химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
При этом электроны двигаются не по определенной орбите, как предполагал Резерфорд, а довольно хаотично. Совокупность электронов, которые двигаются вокруг ядра, называется электронной оболочкой.
Атомное ядро, как доказал Резерфорд — массивное и положительно заряженное, расположено в центральной части атома. Структура ядра довольно сложна, и изучается в ядерной физике. Основные частицы, из которых оно состоит — протоны и нейтроны. Они связаны ядерными силами (сильное взаимодействие).
Рассмотрим основные характеристики протонов, нейтронов и электронов:
| Протон | Нейтрон | Электрон | |
| Масса | 1,00728 а.е.м. | 1,00867 а.е.м. | 1/1960 а.е.м. |
| Заряд | + 1 элементарный заряд | 0 | — 1 элементарный заряд |
1 а.е.м. (атомная единица массы) = 1,66054·10-27 кг
1 элементарный заряд = 1,60219·10-19 Кл
И — самое главное. Периодическая система химических элементов, структурированная Дмитрием Ивановичем Менделеевым, подчиняется простой и понятной логике: номер атома — это число протонов в ядре этого атома. Причем ни о каких протонах Дмитрий Иванович в XIX веке не слышал. Тем гениальнее его открытие и способности, и научное чутье, которое позволило перешагнуть на полтора столетия вперёд в науке.
Следовательно, заряд ядра Z равен числу протонов, т.е. номеру атома в Периодической системе химических элементов.
Атом — это электронейтральная частица, следовательно, число протонов равно числу электронов: Ne = Np = Z.
Масса атома (массовое число A) примерно равна суммарной массе крупных частиц, которые входят в состав атома — протонов и нейтронов. Поскольку масса протона и нейтрона примерно равна 1 атомной единице массы, можно использовать формулу:
M = Np + Nn
Массовое число указано в Периодической системе химических элементов в ячейке каждого элемента.
Обратите внимание! При решении задач ЕГЭ массовое число всех атомов, кроме хлора, округляется до целого по правилам математики. Массовое число атома хлора в ЕГЭ принято считать равным 35,5.
Таким образом, рассчитать число нейтронов в атоме можно, вычтя из массового числа номер атома: Nn = M – Z.
В Периодической системе собраны химические элементы — атомы с одинаковым зарядом ядра. Однако, может ли меняться у этих атомов число остальных частиц? Вполне. Например, атомы с разным числом нейтронов называют изотопами данного химического элемента. У одного и того же элемента может быть несколько изотопов.
Попробуйте ответить на вопросы. Ответы на них — в конце статьи:
- У изотопов одного элемента массовое число одинаковое или разное?
- У изотопов одно элемента число протонов одинаковое или разное?
Химические свойства атомов определяются строением электронной оболочки и зарядом ядра. Таким образом, химические свойства изотопов одного элемента практически не отличаются.
Поскольку атомы одного элемента могут существовать в форме разных изотопов, в названии часто указывается массовое число, например, хлор-35, и принята такая форма записи атомов:
Еще немного вопросов:
3. Определите количество нейтронов, протонов и электронов в изотопе брома-81.
4. Определите число нейтронов в изотопе хлора-37.
Строение электронной оболочки
Согласно квантовой модели строение атома Нильса Бора, электроны в атоме могут двигаться только по определенным (стационарным) орбитам, удаленным от ядра на определенное расстояние и характеризующиеся определенной энергией. Другое название стационарны орбит — электронные слои или энергетические уровни.
Электронные уровни можно обозначать цифрами — 1, 2, 3, …, n. Номер слоя увеличивается мере удаления его от ядра. Номер уровня соответствует главному квантовому числу n.
В одном слое электроны могут двигаться по разным траекториям. Траекторию орбиты характеризует электронный подуровень. Тип подуровня характеризует орбитальное квантовое число l = 0,1, 2, 3 …, либо соответствующие буквы — s, p, d, g и др.
В рамках одного подуровня (электронных орбиталей одного типа) возможны варианты расположения орбиталей в пространстве. Чем сложнее геометрия орбиталей данного подуровня, тем больше вариантов их расположения в пространстве. Общее число орбиталей подуровня данного типа l можно определить по формуле: 2l+1. На каждой орбитали может находиться не более двух электронов.
| Тип орбитали | s | p | d | f | g |
| Значение орбитального квантового числа l | 0 | 1 | 2 | 3 | 4 |
| Число атомных орбиталей данного типа 2l+1 | 1 | 3 | 5 | 7 | 9 |
| Максимальное количество электронов на орбиталях данного типа | 2 | 6 | 10 | 14 | 18 |
Получаем сводную таблицу:
|
Номер уровня, n |
Подуровень | Число
АО |
Максимальное количество электронов |
| 1 | 1s | 1 | |
| 2 | 2s | 1 | |
| 2p | 3 | ||
|
3 |
3s | 1 | |
| 3p | 3 | ||
| 3d | 5 | ||
|
4 |
4s | 1 | |
| 4p | 3 | ||
| 4d | 5 | ||
| 4f | 7 |
|
Заполнение электронами энергетических орбиталей происходит согласно некоторым основным правилам. Давайте остановимся на них подробно.
Принцип Паули (запрет Паули): на одной атомной орбитали могут находиться не более двух электронов с противоположными спинами (спин — это квантовомеханическая характеристика движения электрона).
Правило Хунда. На атомных орбиталях с одинаковой энергией электроны располагаются по одному с параллельными спинами. Т.е. орбитали одного подуровня заполняются так: сначала на каждую орбиталь распределяется по одному электрону. Только когда во всех орбиталях данного подуровня распределено по одному электрону, занимаем орбитали вторыми электронами, с противоположными спинами.
Таким образом, сумма спиновых квантовых чисел таких электронов на одном энергетическом подуровне (оболочке) будет максимальной.
Например, заполнение 2р-орбитали тремя электронами будет происходить так: , а не так:
Принцип минимума энергии. Электроны заполняют сначала орбитали с наименьшей энергией. Энергия атомной орбитали эквивалентна сумме главного и орбитального квантовых чисел: n + l. Если сумма одинаковая, то заполняется первой та орбиталь, у которой меньше главное квантовое число n.
| АО | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 5g |
| n | 1 | 2 | 2 | 3 | 3 | 3 | 4 | 4 | 4 | 4 | 5 | 5 | 5 | 5 | 5 |
| l | 0 | 0 | 1 | 0 | 1 | 2 | 0 | 1 | 2 | 3 | 0 | 1 | 2 | 3 | 4 |
| n + l | 1 | 2 | 3 | 3 | 4 | 5 | 4 | 5 | 6 | 7 | 5 | 6 | 7 | 8 | 9 |
Таким образом, энергетический ряд орбиталей выглядит так:
1s < 2s < 2 p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f~5d < 6p < 7s <5f~6d …
Электронную структуру атома можно представлять в разных формах — энергетическая диаграмма, электронная формула и др. Разберем основные.
Энергетическая диаграмма атома — это схематическое изображение орбиталей с учетом их энергии. Диаграмма показывает расположение электронов на энергетических уровнях и подуровнях. Заполнение орбиталей происходит согласно квантовым принципам.
Например, энергетическая диаграмма для атома углерода:
Электронная формула — это запись распределения электронов по орбиталям атома или иона. Сначала указывается номер уровня, затем тип орбитали. Верхний индекс справа от буквы показывает число электронов на орбитали. Орбитали указываются в порядке заполнения. Запись 1s2 означает, что на 1 уровне s-подуровне расположено 2 электрона.
Например, электронная формула углерода выглядит так: 1s22s22p2.
Для краткости записи, вместо энергетических орбиталей, полностью заполненных электронами, иногда используют символ ближайшего благородного газа (элемента VIIIА группы), имеющего соответствующую электронную конфигурацию.
Например, электронную формулу азота можно записать так: 1s22s22p3 или так: [He]2s22p3.
1s2 = [He]
1s22s22p6 = [Ne]
1s22s22p63s23p6 = [Ar] и так далее.
Электронные формулы элементов первых четырех периодов
Рассмотрим заполнение электронами оболочки элементов первых четырех периодов. У водорода заполняется самый первый энергетический уровень, s-подуровень, на нем расположен 1 электрон:
+1H 1s1 1s
У гелия 1s-орбиталь полностью заполнена:
+2He 1s2 1s
Поскольку первый энергетический уровень вмещает максимально 2 электрона, у лития начинается заполнение второго энергетического уровня, начиная с орбитали с минимальной энергией — 2s. При этом сначала заполняется первый энергетический уровень:
+3Li 1s22s1 1s 2s
У бериллия 2s-подуровень заполнен:
+4Be 1s22s2 1s 2s
Далее, у бора заполняется p-подуровень второго уровня:
+5B 1s22s22p1 1s 2s
2p
У следующего элемента, углерода, очередной электрон, согласно правилу Хунда, заполняет вакантную орбиталь, а не заполняет частично занятую:
+6C 1s22s22p2 1s 2s
2p
Попробуйте составить электронную и электронно-графическую формулы для следующих элементов, а затем можете проверить себя по ответам конце статьи:
5. Азот
6. Кислород
7. Фтор
У неона завершено заполнение второго энергетического уровня:
+10Ne 1s22s22p6 1s 2s
2p
У натрия начинается заполнение третьего энергетического уровня:
+11Na 1s22s22p63s1 1s 2s
2p
3s
От натрия до аргона заполнение 3-го уровня происходит в том же порядке, что и заполнение 2-го энергетического уровня. Предлагаю составить электронные формулы элементов от магния до аргона самостоятельно, проверить по ответам.
8. Магний
9. Алюминий
10. Кремний
11. Фосфор
12. Сера
13. Хлор
14. Аргон
А вот начиная с 19-го элемента, калия, иногда начинается путаница — заполняется не 3d-орбиталь, а 4s. Ранее мы упоминали в этой статье, что заполнение энергетических уровней и подуровней электронами происходит по энергетическому ряду орбиталей, а не по порядку. Рекомендую повторить его еще раз. Таким образом, формула калия:
+19K 1s22s22p63s23p64s11s 2s
2p
3s
3p
4s
Для записи дальнейших электронных формул в статье будем использовать сокращенную форму:
+19K [Ar]4s1 [Ar] 4s
У кальция 4s-подуровень заполнен:
+20Ca [Ar]4s2 [Ar] 4s
У элемента 21, скандия, согласно энергетическому ряду орбиталей, начинается заполнение 3d-подуровня:
+21Sc [Ar]3d14s2 [Ar] 4s 3d
Дальнейшее заполнение 3d-подуровня происходит согласно квантовым правилам, от титана до ванадия:
+22Ti [Ar]3d24s2 [Ar] 4s 3d
+23V [Ar]3d34s2 [Ar] 4s 3d
Однако, у следующего элемента порядок заполнения орбиталей нарушается. Электронная конфигурация хрома такая:
+24Cr [Ar]3d54s1 [Ar] 4s 3d
В чём же дело? А дело в том, что при «традиционном» порядке заполнения орбиталей (соответственно, неверном в данном случае — 3d44s2) ровно одна ячейка в d-подуровне оставалась бы незаполненной. Оказалось, что такое заполнение энергетически менее выгодно. А более выгодно, когда d-орбиталь заполнена полностью, хотя бы единичными электронами. Этот лишний электрон переходит с 4s-подуровня. И небольшие затраты энергии на перескок электрона с 4s-подуровня с лихвой покрывает энергетический эффект от заполнения всех 3d-орбиталей. Этот эффект так и называется — «провал» или «проскок» электрона. И наблюдается он, когда d-орбиталь недозаполнена на 1 электрон (по одному электрону в ячейке или по два).
У следующих элементов «традиционный» порядок заполнения орбиталей снова возвращается. Конфигурация марганца:
+25Mn [Ar]3d54s2
Аналогично у кобальта и никеля. А вот у меди мы снова наблюдаем провал (проскок) электрона — электрон опять проскакивает с 4s-подуровня на 3d-подуровень:
+29Cu [Ar]3d104s1
На цинке завершается заполнение 3d-подуровня:
+30Zn [Ar]3d104s2
У следующих элементов, от галлия до криптона, происходит заполнение 4p-подуровня по квантовым правилам. Например, электронная формула галлия:
+31Ga [Ar]3d104s24p1
Формулы остальных элементов мы приводить не будем, можете составить их самостоятельно.
Некоторые важные понятия:
Внешний энергетический уровень — это энергетический уровень в атоме с максимальным номером, на котором есть электроны.
Например, у меди ([Ar]3d104s1) внешний энергетический уровень — четвёртый.
Валентные электроны — электроны в атоме, которые могут участвовать в образовании химической связи. Например, у хрома (+24Cr [Ar]3d54s1) валентными являются не только электроны внешнего энергетического уровня (4s1), но и неспаренные электроны на 3d-подуровне, т.к. они могут образовывать химические связи.
Основное и возбужденное состояние атома
Электронные формулы, которые мы составляли до этого, соответствуют основному энергетическому состоянию атома. Это наиболее выгодное энергетически состояние атома.
Однако, чтобы образовывать химические связи, атому в большинстве ситуаций необходимо наличие неспаренных (одиночных) электронов. А химические связи энергетически очень для атома выгодны. Следовательно, чем больше в атоме неспаренных электронов — тем больше связей он может образовать, и, как следствие, перейдёт в более выгодное энергетическое состояние.
Поэтому при наличии свободных энергетических орбиталей на данном уровне спаренные пары электронов могут распариваться, и один из электронов спаренной пары может переходить на вакантную орбиталь. Таким образом число неспаренных электронов увеличивается, и атом может образовать больше химических связей, что очень выгодно с точки зрения энергии. Такое состояние атома называют возбуждённым и обозначают звёздочкой.
Например, в основном состоянии бор имеет следующую конфигурацию энергетического уровня:
+5B 1s22s22p1 1s 2s
2p
На втором уровне (внешнем) одна спаренная электронная пара, один одиночный электрон и пара свободных (вакантных) орбиталей. Следовательно, есть возможность для перехода электрона из пары на вакантную орбиталь, получаем возбуждённое состояние атома бора (обозначается звёздочкой):
+5B* 1s22s12p2 1s 2s
2p
Попробуйте самостоятельно составить электронную формулу, соответствующую возбуждённому состоянию атомов. Не забываем проверять себя по ответам!
15. Углерода
16. Бериллия
17. Кислорода
Электронные формулы ионов
Атомы могут отдавать и принимать электроны. Отдавая или принимая электроны, они превращаются в ионы.
Ионы — это заряженные частицы. Избыточный заряд обозначается индексом в правом верхнем углу.
Если атом отдаёт электроны, то общий заряд образовавшейся частицы будет положительный (вспомним, что число протонов в атоме равно числу электронов, а при отдаче электронов число протонов будет больше числа электронов). Положительно заряженные ионы — это катионы. Например: катион натрия образуется так:
+11Na 1s22s22p63s1 -1е = +11Na+ 1s22s22p63s0
Если атом принимает электроны, то приобретает отрицательный заряд. Отрицательно заряженные частицы — это анионы. Например, анион хлора образуется так:
+17Cl 1s22s22p63s23p5 +1e = +17Cl— 1s22s22p63s23p6
Таким образом, электронные формулы ионов можно получить добавив или отняв электроны у атома. Обратите внимание, при образовании катионов электроны уходят с внешнего энергетического уровня. При образовании анионов электроны приходят на внешний энергетический уровень.
Попробуйте составить самостоятельно электронный формулы ионов. Не забывайте проверять себя по ключам!
18. Ион Са2+
19. Ион S2-
20. Ион Ni2+
В некоторых случаях совершенно разные атомы образуют ионы с одинаковой электронной конфигурацией. Частицы с одинаковой электронной конфигурацией и одинаковым числом электронов называют изоэлектронными частицами.
Например, ионы Na+ и F—.
Электронная формула катиона натрия: Na+ 1s22s22p6, всего 10 электронов.
Электронная формула аниона фтора: F— 1s22s22p6, всего 10 электронов.
Таким образом, ионы Na+ и F— — изоэлектронные. Также они изоэлектронны атому неона.
Тренажер по теме «Строение атома» — 10 вопросов, при каждом прохождении новые.
288
Создан на
03 января, 2022 От Admin
Тренировочный тест «Строение атома»
Тренировочный тест по теме «Строение атома»
1 / 10
1) V 2) B 3) Li 4) C 5) He
Определите элементы, атомы которых в основном состоянии имеют электронную формулу внешнего энергетического уровня ns2.
2 / 10
1) Fe 2) B 3) Li 4) C 5) He
Определите элементы, атомы которых в основном состоянии имеют электронную формулу внешнего энергетического уровня ns2.
3 / 10
1) Ca 2) S 3) Na 4) F 5) Mn
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют одинаковое число электронов во внешнем слое.
4 / 10
1) Zn 2) S 3) Si 4) Fe 5) Mg
Определите элементы, атомы которых в основном состоянии не содержат неспаренных электронов.
5 / 10
1) He 2) Ba 3) Si 4) S 5) F
Определите элементы, атомы которых в основном состоянии не содержат неспаренных электронов.
6 / 10
1) Ti 2) P 3) N 4) Al 5) O
Определите элементы, атомы которых в основном состоянии содержат два неспаренных электрона.
7 / 10
1) O 2) P 3) Si 4) Cr 5) S
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют электронную конфигурацию внешнего энергетического уровня ns2np4.
8 / 10
1) S 2) Ca 3) Mn 4) Al 5) Cl
Определите, атомы каких из указанных в ряду элементов имеют на внешнем энергетическом уровне одинаковое число электронов.
9 / 10
1) Ba 2) Sn 3) Ti 4) S 5) Ca
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют на внешнем энергетическом уровне два неспаренных электрона.
10 / 10
1) C 2) H 3) O 4) Mg 5) N
Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое число неспаренных электронов.
Ваша оценка
The average score is 33%
Ответы на вопросы:
1. У изотопов одного химического элемента массовое число всегда разное, т.к. массовое число складывается из числа протонов и нейтронов. А у изотопов различается число нейтронов.
2. У изотопов одного элемента число протонов всегда одинаковое, т.к. число протонов характеризует химический элемент.
3. Массовое число изотопа брома-81 равно 81. Атомный номер = заряд ядра брома = число протонов в ядре = 35. Вычитаем из массового числа число протонов, получаем 81-35=46 нейтронов.
4. Массовое число изотопа хлора равно 37. Атомный номер, заряд ядра и число протонов в ядре равно 17. Получаем число нейтронов = 37-17 =20.
5. Электронная формула азота:
+7N 1s22s22p3 1s 2s
2p
6. Электронная формула кислорода:
+8О 1s22s22p4 1s 2s
2p
7. Электронная формула фтора:
8. Электронная формула магния:
+12Mg 1s22s22p63s2 1s 2s
2p
3s
9. Электронная формула алюминия:
+13Al 1s22s22p63s23p1 1s 2s
2p
3s
3p
10. Электронная формула кремния:
+14Si 1s22s22p63s23p2 1s 2s
2p
3s
3p
11. Электронная формула фосфора:
+15P 1s22s22p63s23p3 1s 2s
2p
3s
3p
12. Электронная формула серы:
+16S 1s22s22p63s23p4 1s 2s
2p
3s
3p
13. Электронная формула хлора:
14. Электронная формула аргона:
+18Ar 1s22s22p63s23p6 1s 2s
2p
3s
3p
15. Электронная формула углерода в возбуждённом состоянии:
+6C* 1s22s12p3 1s 2s
2p
16. Электронная формула бериллия в возбуждённом состоянии:
+4Be 1s22s12p1 1s 2s
2p
17. Электронная формула кислорода в возбуждённом энергетическом состоянии соответствует формуле кислорода в основном энергетическом состоянии, т.к. нет условий для перехода электрона — отсутствуют вакантные энергетические орбитали.
18. Электронная формула иона кальция Са2+: +20Ca2+ 1s22s22p63s23p6
19. Электронная формула аниона серы S2-: +16S2- 1s22s22p63s23p6
20. Электронная формула катиона никеля Ni2+: +28Ni2+ 1s22s22p63s23p63d84s0. Обратите внимание! Атомы отдают электроны всегда сначала с внешнего энергетического уровня. Поэтому никель отдаёт электроны сначала с внешнего 4s-подуровня.
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
Ядерная физика. Планетарная модель атома. Нуклонная модель ядра. Ядерные реакции.
В. З. Шапиро
Задание 19 ЕГЭ по физике посвящено темам: «Физика атома», «Физика атомного ядра». Задание относится к базовому уровню. Чтобы его решить, нужно уметь работать с Периодической системой элементов Д. И. Менделеева, определять количество протонов, нейтронов, записывать уравнения ядерных реакций.
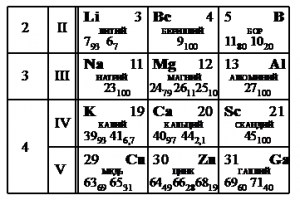
- На рисунке представлен фрагмент Периодической системы элементов Д. И. Менделеева. Под названием каждого элемента приведены массовые числа его основных стабильных изотопов. При этом нижний индекс около массового числа указывает (в процентах) распространённость изотопа
в природе.
Укажите число протонов и число нейтронов в ядре самого распространённого стабильного изотопа калия.
| Число протонов | Число нейтронов |
Необходимая теория:
Строение атома
Используя периодическую систему Д. И. Менделеева, можно определить атомную массу калия. Из двух предложенных изотопов надо выбрать самый распространенный – это калий с атомной массой 39. Так как порядковый номер определяет количество протонов (19), то для нахождения числа нейтронов надо вычесть из атомной массы количество протонов.
Nнейтр. = 39 — 19 = 20
| Число протонов | Число нейтронов |
| 19 | 20 |
Секрет решения. Задачи по данной теме являются одними из самых простых. Но и здесь можно допустить ошибку, если невнимательно прочитать условие. Например, можно неправильно выбрать самый распространенный (или менее распространенный) стабильный изотоп химического элемента.
2. Ядро бериллия может захватить гамма-квант, в результате чего происходит ядерная реакция с образованием ядра химического элемента
Каковы заряд образовавшегося ядра Z (в единицах элементарного заряда) и его массовое число A?
| Заряд числа Z | Массовое число ядра A |
Необходимая теория:
Ядерные реакции
При написании ядерных реакций сумма верхних индексов в левой части уравнения должна быть равна сумме верхних индексов в правой части уравнения. То же самое относится и к нижним индексам. Это правило основано на выполнении законов сохранения заряда и массы. Проведем расчет.
Z = 4 – 0 = 4; A = 9 – 1 = 8.
| Заряд ядра Z | Массовое число ядра A |
| 4 | 8 |
Секрет решения. При написании ядерных реакций, кроме закономерностей, описанных в решении, надо знать массовые и зарядовые числа некоторых частиц:
нейтрон
протон или
(ядро атома водорода);
α-частица (ядро атома гелия)
электрон
Указанные значения масс и зарядов частиц надо знать наизусть. Только это вызывает трудности при написании ядерных реакций.
3. Сколько протонов и сколько нейтронов содержится в ядре
| Число протонов | Число нейтронов |
Необходимая теория:
Строение атома
Нижний индекс химического элемента определяет порядковый номер, заряд ядра и количество протонов. Для ядра количество протонов равно 17. Количество нейтронов определяется разницей массового и зарядового чисел.
Nнейтр. = 35 – 17 = 18
| Число протонов | Число нейтронов |
| 17 | 18 |
Секрет решения. Важно знать, что суммарное количество протонов и нейтронов определяют массу атома. Электроны, безусловно, влияют на массу, но незначительно. Массу электронов необходимо вычитать из общей массы атома при расчетах энергии связи атомного ядра.
Спасибо за то, что пользуйтесь нашими статьями.
Информация на странице «Задание 19 ЕГЭ по физике» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать нужные и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из разделов нашего сайта.
Публикация обновлена:
08.03.2023
Для решения заданий № 19 требуется понимание структуры атома по Резерфорду, а также сущности процессов, происходящих при ядерных реакциях, например, при α-распаде.
Задание EF17569
Опыты Э. Резерфорда по рассеянию α-частиц показали, что
А. почти вся масса атома сосредоточена в ядре.
Б. ядро имеет положительный заряд.
Какое(-ие) из утверждений правильно(-ы)?
Ответ:
- только А
- только Б
- и А, и Б
- ни А, ни Б
Алгоритм решения
- Кратко описать суть и результаты опыта, проведенного Резерфордом.
- Установить, какие выводы позволил сделать этот опыт.
Решение
Резерфорд направил пучок радиоактивного излучения на золотую фольгу. Альфа-частицы, проходя сквозь нее, попадали на экран и оставляли след. Если без фольги след представлял собой более менее четко ограниченный круг, то в случае с фольгой, четких границ круга не было. Когда Резерфорд окружил установку фольгой, он обнаружил, что часть альфа-частиц изменила траекторию движения после столкновения с фольгой в обратном направлении. Но это было бы невозможно, если бы заряд был распределен в атомах равномерно по всему объему. Наблюдать такую картинку возможно только при условии, что заряд атома концентрируется в небольшом пространстве — ядре. Причем этот заряд положительный, поскольку он не притягивает, а отталкивает альфа-частицы. Поэтому оба утверждения являются верными.
Ответ: 3
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF18183
На рисунке изображены схемы четырёх атомов, соответствующие модели атома Резерфорда. Чёрными точками обозначены электроны. Атому 63Li соответствует схема:
Алгоритм решения
- Описать планетарную модель атома.
- Установить, какой рисунок подходит для данного химического элемента.
Решение
Планетарная модель атома подразумевает наличие положительно заряженного ядра, вокруг которого вращаются по орбитам электроны. Причем количество протонов равно количеству электронов. Зарядовое число у лития равно 3. Следовательно, на орбитах вокруг ядра должно вращаться 3 электрона — как на рисунке «в».
Ответ: в
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF18691
Ядро атома содержит 3 нейтрона и 4 протона, вокруг ядра обращаются 2 электрона. Эта система частиц является
Ответ:
а) нейтральным атомом углерода96C
б) ионом бериллия 74Be
в) ионом лития 93Li
г) нейтральным атомом бериллия 74B
Алгоритм решения
- Установить, будет ли атом нейтральным.
- Выбрать подходящий ответ.
Решение
Согласно условию, содержится 4 протона и всего 2 электрона. Это значит, что речь будет идти о положительно заряженном ионе. Массовое число будет равно 7 (4 протона + 3 нейтрона), а зарядовое число — 4 (4 протона). Этому соответствует ион бериллия.
Ответ: б
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF17709
Какая из строчек таблицы правильно отражает структуру ядра 49115 In?
Алгоритм решения
- Установить, чем определяются количество протонов и нейтронов.
- Определить, сколько содержится в атоме протонов.
- Определить, сколько содержится в атоме нейтронов.
Решение
Протоны и нейтроны — нуклоны. Общее их количество является массовым числом A, которое указывается слева от обозначения химического элемента в верхнем индексе. В данном случае A = 115.
Зарядовое число — порядковый номер химического элемента в периодической системе Менделеева. Оно обозначается Z и равно количеству протонов в ядре. В нашем случае Z = 49. Значит, протонов 49.
Чтобы посчитать количество нейтронов, нужно из массового числа вычесть зарядовое число: 115 – 49 = 66. Значит, нейтронов 66. Строка 1 подходит.
Ответ: 1
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF17974
Связанная система элементарных частиц содержит 14 нейтронов, 13 протонов и 10 электронов. Эта система частиц является
Ответ:
а) ионом алюминия 1327Al
б) нейтральным атомом кремния 1427Si
в) ионом кремния 1427Si
г) нейтральным атомом алюминия 1327Al
Алгоритм решения
- Определить, перед нами ион или нейтральный атом.
- Установить зарядовое число.
- Установить массовое число.
- Выбрать подходящий ответ.
Решение
Согласно условию задачи, в связанной системе элементарных частиц содержится 14 нейтронов, 13 протонов и 10 электронов. В нейтральном атоме количество электронов равно количеству протонов. В нашем случае электронов на 3 меньше. Значит, перед нами ион.
Зарядовое число соответствует количеству протонов. Их 13.
Массовое число равно сумме количества протонов и электронов: 14 + 13 = 27.
Выходит, перед нами ион алюминия.
Ответ: а
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF18942
На рисунке представлен фрагмент Периодической системы элементов Д.И. Менделеева. Под названием каждого элемента приведены массовые числа его основных стабильных изотопов. При этом нижний индекс около массового числа указывает (в процентах) распространённость изотопа в природе.
Укажите число протонов и число нейтронов в ядре наименее распространённого из указанных стабильных изотопов меди.
Алгоритм решения
- Найти наименее распространенный изотоп меди.
- Выписать для него массовые и зарядовые числа.
- Найти число протонов и нейтронов.
Решения
Наименее распространен изотоп меди Cu-65, поскольку возле его массового числа стоит меньший индекс — 31.
Массовое число этого изотопа — 65. Зарядовое число соответствует порядковому номеру — 29.
Количество протонов соответствует зарядовому числу. Их 29.
Количество нейтронов есть разность массового и зарядовых чисел: 65 – 29 = 36.
Эти числа запишем последовательно: 2936.
Ответ: 2936
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF17710
Каково массовое число ядра Х в реакции 95241 Am + 24 He→ X + 2 01 n?
Алгоритм решения
- Записать правило сохранения нуклонов до и после реакции.
- Составить уравнение и вычислить искомое массовое число.
Решение
Количество нуклонов до и после реакции постоянно. Поэтому сумма массовых чисел до реакции и после нее не изменится. Составим уравнение, используя только массовые числа ядер и частиц:
241 + 4 = A + 2
A = 243
Ответ: 243
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF18442
Определите массовое и зарядовое число частицы, которая вызывает ядерную реакцию37 Li + … → 48 Вe + 01 n?
Алгоритм решения
- Записать правило сохранения нуклонов до и после реакции.
- Составить уравнение и вычислить искомое массовое число.
- Составить уравнение и вычислить искомое зарядовое число.
Решение
Количество нуклонов до и после реакции постоянно. Поэтому сумма массовых чисел до реакции и после нее не изменится. Составим уравнение, используя только массовые числа ядер и частиц:
7 + А = 8 + 1
A = 2
Составим уравнение, используя только массовые числа ядер и частиц:
3 + Z = 4 + 0
Z = 1
Ответ: 21
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF18660
Закону сохранения электрического заряда не противоречит реакция:
Алгоритм решения
- Записать правило сохранения нуклонов до и после реакции.
- Проверить, где выполняется это правило.
Решение
Количество нуклонов до и после реакции постоянно. Поэтому сумма массовых и зарядовых чисел до реакции и после нее не изменится. Проверим правильность реакций.
Реакция «а»:
7 + 1 = 8
4 + 0 < 5
Реакция «б»:
13 = 1 + 12
8 = 1 + 7
Реакция «в»:
7 + 1 > 6
3 + 0 > 2
Реакция «г»:
12 > 7 + 4
7 > 4 + 2
Подходит только реакция «б».
Ответ: б
pазбирался: Алиса Никитина | обсудить разбор | оценить
Тема 19.
Основы СТО. Квантовая физика (изменение физических величин в процессах, установление соответствия)
19
.
04
Энергетические уровни
Вспоминай формулы по каждой теме
Решай новые задачи каждый день
Вдумчиво разбирай решения
ШКОЛКОВО.
Готовиться с нами — ЛЕГКО!
Подтемы раздела
основы сто. квантовая физика (изменение физических величин в процессах, установление соответствия)
19.01Фотоэффект
19.02Модель атома и атомного ядра.
19.03Радиоактивный распад
19.04Энергетические уровни
19.05Фотоны
19.06СТО
Решаем задачи
На рисунке изображена упрощённая диаграмма нижних энергетических уровней атома. Нумерованными стрелками отмечены
некоторые возможные переходы атома между этими уровнями.
Стрелками отмечены некоторые возможные переходы атома между этими уровнями. Установите соответствие между процессами
поглощения света наименьшей длины волны и излучения света наименьшей частоты и энергией соответствующего
фотона.
К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные
цифры под соответствующими буквами.
Установите соответствие между физическими величинами и формулами, при помощи которых можно их рассчитать.
К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные
цифры под соответствующими буквами.
Показать ответ и решение
Энергия электрона определяется формулой 3, а энергия, которую нужно сообщить электрону в атоме
водорода для того, чтобы он перешел с n-го энергетического уровня на m-й энергетический уровень –
формулой 1.
При переходе электрона в атоме с (n + 1)-го энергетического уровня на n-й энергетический уровень испускается фотон. Как
изменятся следующие физические величины при уменьшении n на единицу: энергия испускаемого фотона, длина волны
испускаемого фотона.
Для каждой величины определите соответствующий характер изменения:
1) увеличилась;
2) уменьшилась;
3) не изменилась.
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Показать ответ и решение
Энергия испускаемого фотона – это разница энергий между высшим и низшим уровнем
Расстояние между соседними уровнями увеличивается с уменьшением n. И, значит, с уменьшением n энергия испускаемого
фотона будет увеличиваться.
Энергия фотона обратно пропорциональна длине волны. Отсюда следует вывод, что увеличение энергии фотона (с уменьшением
n) приведет к уменьшению длины волны.
На рисунке изображена упрощённая диаграмма нижних энергетических уровней атома. Нумерованными стрелками отмечены
некоторые возможные переходы атома между этими уровнями. Какие из этих переходов связаны с поглощением кванта света
наибольшей длины волны и излучением кванта света с наименьшей энергией? Установите соответствие между процессами
поглощения и испускания света и стрелками, обозначающими энергетические переходы атома. К каждой позиции первого столбца
подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
Демоверсия 2021
Показать ответ и решение
По второму постулату Бора энергия перехода равна:
где – энергия на начальном уровне,
– энергия на конечном уровне.
Энергия перехода можно также найти по формуле:
где – частота,
– длина волны.
А) Поглощение – переход с более низкого уровня на более высокие, при этом так как длина волны максимальна,
то
энергия поглощенного фотона минимальна, значит, уровни находятся ближе друг к другу.
Б) Излучение с наименьшей энергией от более высокого, к более низкому, при этом расстояние между уровнями
минимально
На рисунке изображена упрощённая диаграмма нижних энергетических уровней атома. Нумерованными стрелками отмечены
некоторые возможные переходы атома между этими уровнями. Какой из этих четырёх переходов связан с поглощением света
наименьшей частоты, а какой – с излучением света наибольшей частоты?
Установите соответствие между процессами поглощения и испускания света и стрелками, указывающими энергетические
переходы атома. К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу
выбранные цифры под соответствующими буквами
Демоверсия 2019
Показать ответ и решение
По второму постулату Бора энергия перехода равна:
где – энергия на начальном уровне,
– энергия на конечном уровне.
Энергия перехода можно также найти по формуле:
где – частота,
– длина волны.
А) Поглощение – переход с более низкого уровня на более высокие, при этом так как частота минимальна, то
энергия поглощенного фотона минимальна, значит, уровни находятся ближе друг к другу (3).
Б) Излучение с наименьшей энергией от более высокого, к более низкому, при этом так как частота максимальна,
то
энергия излученного фотона максимальна, значит, уровни находятся дальше друг от друга (2)
Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
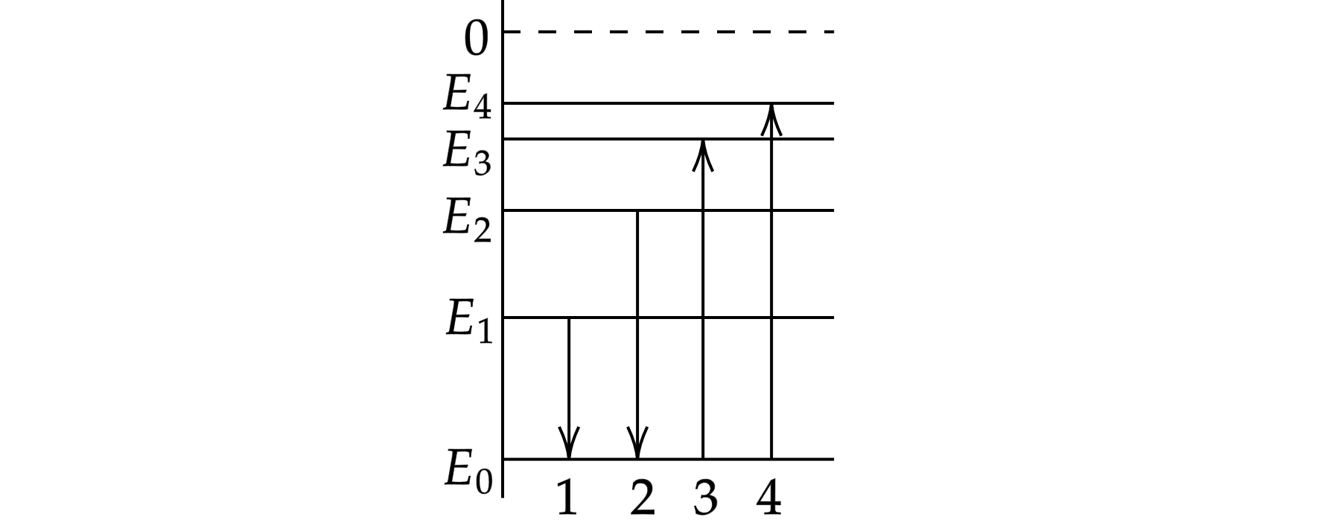
1
На диаграмме показаны переходы атома водорода между различными энергетическими состояниями, сопровождающиеся либо излучением, либо поглощением фотонов. Поглощение фотона с наибольшей длиной волны
происходит при переходе, обозначенном цифрой:
Источник: Централизованное тестирование по физике, 2015
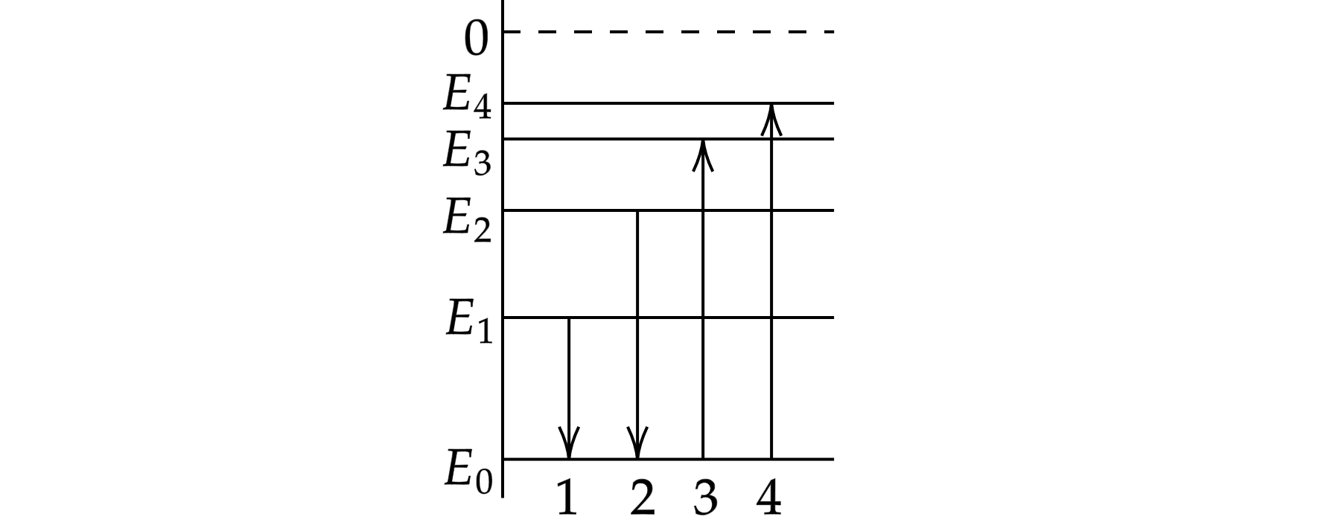
2
На диаграмме показаны переходы атома водорода между различными энергетическими состояниями, сопровождающиеся либо излучением, либо поглощением фотонов. Поглощение фотона с наименьшим импульсом pmin происходит при переходе, обозначенном цифрой:
Источник: Централизованное тестирование по физике, 2015
3
На диаграмме показаны переходы атома водорода между различными энергетическими состояниями, сопровождающиеся либо излучением, либо поглощением фотонов. Поглощение фотона с наибольшей длиной волны
происходит при переходе, обозначенном цифрой:
Источник: Централизованное тестирование по физике, 2015
4
На диаграмме показаны переходы атома водорода между различными энергетическими состояниями, сопровождающиеся либо излучением, либо поглощением фотонов. Поглощение фотона с наибольшей частотой
происходит при переходе, обозначенном цифрой:
Источник: Централизованное тестирование по физике, 2015
5
На диаграмме показаны переходы атома водорода между различными энергетическими состояниями, сопровождающиеся либо излучением, либо поглощением фотонов. Поглощение фотона с наименьшей частотой
происходит при переходе, обозначенном цифрой:
Источник: Централизованное тестирование по физике, 2015
Пройти тестирование по этим заданиям