Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими
соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением
периодического закона.

В периодической таблице элементы расположены в порядке увеличения атомного заряда, группируются в «строки и столбцы» — периоды и группы.
Период — ряд горизонтально расположенных химических элементов. 1, 2 и 3 периоды называются малыми, они состоят из одного ряда элементов.
4, 5, 6 — называются большими периодами, они состоят из двух рядов химических элементов.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в
высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете
предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.

Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая
говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы
увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.

В группе радиус атома увеличивается с увеличением заряда атомных ядер — сверху вниз «↓». Чем больше период, тем больше электронных орбиталей вокруг атома,
соответственно, и больше его радиус.
С уменьшением заряда атома в группе радиус атома уменьшается — снизу вверх «↑». Это связано с уменьшением количества электронных орбиталей вокруг
атома. Для примера возьмем атомы бора и алюминия, элементов, расположенных в одной группе.

Период, группа и электронная конфигурация
Обратите внимание еще раз на важную деталь: элементы, находящиеся в одной группе (главной подгруппе!), имеют сходную конфигурацию внешнего уровня.
Так у бора на внешнем уровне расположены 3 электрона, у алюминия — тоже 3. Оба они в III группе.
Такая закономерность иногда может сильно облегчить жизнь, однако у элементов побочных подгрупп она отсутствует — там нужно считать электроны
«вручную», располагая их на электронных орбиталях.
Раз уж мы повели речь об электронных конфигурациях, давайте запишем их для бора и алюминия, чтобы лучше представлять их внешний уровень и увидеть
то самое «сходство»:
- B5 — 1s22s22p1
- Al13 — 1s22s22p63s23p1
Общую электронную конфигурацию для элементов III группы главной подгруппы можно записать ns2np1. Это будет работать для
бора, внешний уровень которого 2s22p1, алюминия — 3s23p1, галия — 4s24p1,
индия — 5s25p1 и таллия — 6s26p1. За «n» мы принимаем номер периода.
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы,
то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Вам остается только распределить известное число электронов по s и p ячейкам, а затем подставить номер периода — и вот быстро получена
конфигурация внешнего уровня. Предлагаю посмотреть на примере ниже 

Очень надеюсь, что теперь вы знаете: только глядя на положение элемента в периодической таблице, на группу и период, в которых он расположен,
вы уже можете составить конфигурацию его внешнего уровня. Безусловно, это для элементов главных подгрупп. Повторюсь: у побочных — только «вручную».
Длина связи
Длина связи — расстояние между атомами химически связанных элементов. Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую.
Чем больше радиус атома, тем больше длина связи.
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.

Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех
веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
В периоде с увеличением заряда атома металлические свойства ослабевают, неметаллические — усиливаются (слева направо «→»). В группе с увеличением
заряда атома металлические свойства усиливаются, а неметаллические — ослабевают (сверху вниз «↓»).

Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают
S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Таким образом, самые сильные металлические свойства проявляет рубидий, но с другой стороны — у него самые слабые неметаллические свойства. Сера
обладает самыми слабыми металлическими свойствами, но, если посмотреть по-другому, сера — самый сильный неметалл.
Распределение металлов и неметаллов в периодической таблице также является наглядным отображением этого правила. Если провести условную
линию, проходящую от бора до астата, то справа окажутся неметаллы, а слева — металлы.

Основные и кислотные свойства
Основные свойства в периоде с увеличением заряда атома уменьшаются, кислотные — возрастают. В группе с увеличением заряда атома основные
свойства усиливаются, а кислотные — ослабевают.
Кислотные и основные свойства противопоставлены друг другу, как противопоставлены металлические и неметаллические. Где первые усиливаются,
вторые — убывают. Все аналогично, поэтому смело ассоциируйте одни с другими, так будет гораздо легче запомнить.

Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных
кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Это можно объяснить в темах диссоциации и химических связей. Когда мы дойдем до соответствующей темы, я напомню про HF и водородные связи между
молекулами, которые делают эту кислоту самой слабой. Сейчас воспринимайте это как исключение: HF — самая слабая из этих кислот, а
HI — самая сильная.

Восстановительные и окислительные свойства
Восстановительные свойства в периоде с увеличением заряда атома ослабевают, окислительные — усиливаются. В группе с увеличением заряда
атома восстановительные свойства усиливаются, а окислительные — ослабевают.
Ассоциируйте восстановительные свойства с металлическими и основными, а окислительные — с неметаллическими и кислотными. Так гораздо проще
запомнить 

Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Электроотрицательность — способность атома, связанного с другими, приобретать отрицательный заряд (притягивать к себе электроны).
Мы уже касались ее в статье, посвященной степени окисления. Это важное свойство, ведь более ЭО-ый атом притягивает
к себе электроны и уходит в отрицательную степень окисления со знаком минус «-«.
Все перечисленные в подзаголовке свойства вместе с ЭО усиливаются в периоде с увеличением заряда атома, в группе с увеличением заряда атома
они ослабевают. Таким образом, самый электроотрицательный элемент расположен справа вверху таблицы Д.И. Менделеева — это фтор.

Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий
расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе
выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на
себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Понятию ЭО-ости «синонимичны» также понятия сродства к электрону — энергии, выделяющейся при присоединении электрона к атому, и энергии ионизации —
количеству энергии, которое необходимо для отщепления электрона от атома. И то, и другое возрастают с увеличением электроотрицательности.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.

Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды,
ниже строка с летучими водородными соединениями.

Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру,
для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
В таблице видно, что для VIa группы формула высшего оксида RO3, а, к примеру, для IIIa группы — R2O3. Напишем
высшие оксиды для веществ из VIa : SO3, SeO3, TeO3 и IIIa группы: B2O3, Al2O3,
Ga2O3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим,
что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.

С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене.
Я расскажу вам, как легко их запомнить.
ЛВС характерны для IV, V, VI и VII группы. Элементы этих групп более электроотрицательны, чем водород, поэтому ходят в «-» отрицательную СО.
Минимальная степень окисления для элементов главных подгрупп, начиная с IV группы, может быть рассчитана так: номер группы — 8.
Например, для углерода минимальная СО = 4-8 = -4; для азота 5-8 = -3; для кислорода 6-8 = -2; для фтора 7-8 = -1. Для того, чтобы запомнить
ЛВС, вы должны ассоциировать IV, V, VI и VII группы с хорошо известными вам веществами: метаном, аммиаком, водой и фтороводородом.

Так как общее строение ЛВС в пределах одной группы сходно, то, вспомнив например H2O для кислорода в VI группе, вы легко
найдете формулы других ЛВС VI группы: серы — H2S, H2Se, H2Te, H2Po.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Темы кодификатора ЕГЭ: Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояние атомов.
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
Одну из первых моделей строения атома — «пудинговую модель» — разработал Д.Д. Томсон в 1904 году. Томсон открыл существование электронов, за что и получил Нобелевскую премию. Однако наука на тот момент не могла объяснить существование этих самых электронов в пространстве. Томсон предположил, что атом состоит из отрицательных электронов, помещенных в равномерно заряженный положительно «суп», который компенсирует заряд электронов (еще одна аналогия — изюм в пудинге). Модель, конечно, оригинальная, но неверная. Зато модель Томсона стала отличным стартом для дальнейших работ в этой области.
И дальнейшая работа оказалась эффективной. Ученик Томсона, Эрнест Резерфорд, на основании опытов по рассеянию альфа-частиц на золотой фольге предложил новую, планетарную модель строения атома.
Согласно модели Резерфорда, атом состоит из массивного, положительно заряженного ядра и частиц с небольшой массой — электронов, которые, как планеты вокруг Солнца, летают вокруг ядра, и на него не падают.
Модель Резерфорда оказалась следующим шагом в изучении строения атома. Однако современная наука использует более совершенную модель, предложенную Нильсом Бором в 1913 году. На ней мы и остановимся подробнее.
Атом — это мельчайшая, электронейтральная, химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
При этом электроны двигаются не по определенной орбите, как предполагал Резерфорд, а довольно хаотично. Совокупность электронов, которые двигаются вокруг ядра, называется электронной оболочкой.
Атомное ядро, как доказал Резерфорд — массивное и положительно заряженное, расположено в центральной части атома. Структура ядра довольно сложна, и изучается в ядерной физике. Основные частицы, из которых оно состоит — протоны и нейтроны. Они связаны ядерными силами (сильное взаимодействие).
Рассмотрим основные характеристики протонов, нейтронов и электронов:
| Протон | Нейтрон | Электрон | |
| Масса | 1,00728 а.е.м. | 1,00867 а.е.м. | 1/1960 а.е.м. |
| Заряд | + 1 элементарный заряд | 0 | — 1 элементарный заряд |
1 а.е.м. (атомная единица массы) = 1,66054·10-27 кг
1 элементарный заряд = 1,60219·10-19 Кл
И — самое главное. Периодическая система химических элементов, структурированная Дмитрием Ивановичем Менделеевым, подчиняется простой и понятной логике: номер атома — это число протонов в ядре этого атома. Причем ни о каких протонах Дмитрий Иванович в XIX веке не слышал. Тем гениальнее его открытие и способности, и научное чутье, которое позволило перешагнуть на полтора столетия вперёд в науке.
Следовательно, заряд ядра Z равен числу протонов, т.е. номеру атома в Периодической системе химических элементов.
Атом — это электронейтральная частица, следовательно, число протонов равно числу электронов: Ne = Np = Z.
Масса атома (массовое число A) примерно равна суммарной массе крупных частиц, которые входят в состав атома — протонов и нейтронов. Поскольку масса протона и нейтрона примерно равна 1 атомной единице массы, можно использовать формулу:
M = Np + Nn
Массовое число указано в Периодической системе химических элементов в ячейке каждого элемента.
Обратите внимание! При решении задач ЕГЭ массовое число всех атомов, кроме хлора, округляется до целого по правилам математики. Массовое число атома хлора в ЕГЭ принято считать равным 35,5.
Таким образом, рассчитать число нейтронов в атоме можно, вычтя из массового числа номер атома: Nn = M – Z.
В Периодической системе собраны химические элементы — атомы с одинаковым зарядом ядра. Однако, может ли меняться у этих атомов число остальных частиц? Вполне. Например, атомы с разным числом нейтронов называют изотопами данного химического элемента. У одного и того же элемента может быть несколько изотопов.
Попробуйте ответить на вопросы. Ответы на них — в конце статьи:
- У изотопов одного элемента массовое число одинаковое или разное?
- У изотопов одно элемента число протонов одинаковое или разное?
Химические свойства атомов определяются строением электронной оболочки и зарядом ядра. Таким образом, химические свойства изотопов одного элемента практически не отличаются.
Поскольку атомы одного элемента могут существовать в форме разных изотопов, в названии часто указывается массовое число, например, хлор-35, и принята такая форма записи атомов:
Еще немного вопросов:
3. Определите количество нейтронов, протонов и электронов в изотопе брома-81.
4. Определите число нейтронов в изотопе хлора-37.
Строение электронной оболочки
Согласно квантовой модели строение атома Нильса Бора, электроны в атоме могут двигаться только по определенным (стационарным) орбитам, удаленным от ядра на определенное расстояние и характеризующиеся определенной энергией. Другое название стационарны орбит — электронные слои или энергетические уровни.
Электронные уровни можно обозначать цифрами — 1, 2, 3, …, n. Номер слоя увеличивается мере удаления его от ядра. Номер уровня соответствует главному квантовому числу n.
В одном слое электроны могут двигаться по разным траекториям. Траекторию орбиты характеризует электронный подуровень. Тип подуровня характеризует орбитальное квантовое число l = 0,1, 2, 3 …, либо соответствующие буквы — s, p, d, g и др.
В рамках одного подуровня (электронных орбиталей одного типа) возможны варианты расположения орбиталей в пространстве. Чем сложнее геометрия орбиталей данного подуровня, тем больше вариантов их расположения в пространстве. Общее число орбиталей подуровня данного типа l можно определить по формуле: 2l+1. На каждой орбитали может находиться не более двух электронов.
| Тип орбитали | s | p | d | f | g |
| Значение орбитального квантового числа l | 0 | 1 | 2 | 3 | 4 |
| Число атомных орбиталей данного типа 2l+1 | 1 | 3 | 5 | 7 | 9 |
| Максимальное количество электронов на орбиталях данного типа | 2 | 6 | 10 | 14 | 18 |
Получаем сводную таблицу:
|
Номер уровня, n |
Подуровень | Число
АО |
Максимальное количество электронов |
| 1 | 1s | 1 | |
| 2 | 2s | 1 | |
| 2p | 3 | ||
|
3 |
3s | 1 | |
| 3p | 3 | ||
| 3d | 5 | ||
|
4 |
4s | 1 | |
| 4p | 3 | ||
| 4d | 5 | ||
| 4f | 7 |
|
Заполнение электронами энергетических орбиталей происходит согласно некоторым основным правилам. Давайте остановимся на них подробно.
Принцип Паули (запрет Паули): на одной атомной орбитали могут находиться не более двух электронов с противоположными спинами (спин — это квантовомеханическая характеристика движения электрона).
Правило Хунда. На атомных орбиталях с одинаковой энергией электроны располагаются по одному с параллельными спинами. Т.е. орбитали одного подуровня заполняются так: сначала на каждую орбиталь распределяется по одному электрону. Только когда во всех орбиталях данного подуровня распределено по одному электрону, занимаем орбитали вторыми электронами, с противоположными спинами.
Таким образом, сумма спиновых квантовых чисел таких электронов на одном энергетическом подуровне (оболочке) будет максимальной.
Например, заполнение 2р-орбитали тремя электронами будет происходить так: , а не так:
Принцип минимума энергии. Электроны заполняют сначала орбитали с наименьшей энергией. Энергия атомной орбитали эквивалентна сумме главного и орбитального квантовых чисел: n + l. Если сумма одинаковая, то заполняется первой та орбиталь, у которой меньше главное квантовое число n.
| АО | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 5g |
| n | 1 | 2 | 2 | 3 | 3 | 3 | 4 | 4 | 4 | 4 | 5 | 5 | 5 | 5 | 5 |
| l | 0 | 0 | 1 | 0 | 1 | 2 | 0 | 1 | 2 | 3 | 0 | 1 | 2 | 3 | 4 |
| n + l | 1 | 2 | 3 | 3 | 4 | 5 | 4 | 5 | 6 | 7 | 5 | 6 | 7 | 8 | 9 |
Таким образом, энергетический ряд орбиталей выглядит так:
1s < 2s < 2 p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f~5d < 6p < 7s <5f~6d …
Электронную структуру атома можно представлять в разных формах — энергетическая диаграмма, электронная формула и др. Разберем основные.
Энергетическая диаграмма атома — это схематическое изображение орбиталей с учетом их энергии. Диаграмма показывает расположение электронов на энергетических уровнях и подуровнях. Заполнение орбиталей происходит согласно квантовым принципам.
Например, энергетическая диаграмма для атома углерода:
Электронная формула — это запись распределения электронов по орбиталям атома или иона. Сначала указывается номер уровня, затем тип орбитали. Верхний индекс справа от буквы показывает число электронов на орбитали. Орбитали указываются в порядке заполнения. Запись 1s2 означает, что на 1 уровне s-подуровне расположено 2 электрона.
Например, электронная формула углерода выглядит так: 1s22s22p2.
Для краткости записи, вместо энергетических орбиталей, полностью заполненных электронами, иногда используют символ ближайшего благородного газа (элемента VIIIА группы), имеющего соответствующую электронную конфигурацию.
Например, электронную формулу азота можно записать так: 1s22s22p3 или так: [He]2s22p3.
1s2 = [He]
1s22s22p6 = [Ne]
1s22s22p63s23p6 = [Ar] и так далее.
Электронные формулы элементов первых четырех периодов
Рассмотрим заполнение электронами оболочки элементов первых четырех периодов. У водорода заполняется самый первый энергетический уровень, s-подуровень, на нем расположен 1 электрон:
+1H 1s1 1s
У гелия 1s-орбиталь полностью заполнена:
+2He 1s2 1s
Поскольку первый энергетический уровень вмещает максимально 2 электрона, у лития начинается заполнение второго энергетического уровня, начиная с орбитали с минимальной энергией — 2s. При этом сначала заполняется первый энергетический уровень:
+3Li 1s22s1 1s 2s
У бериллия 2s-подуровень заполнен:
+4Be 1s22s2 1s 2s
Далее, у бора заполняется p-подуровень второго уровня:
+5B 1s22s22p1 1s 2s
2p
У следующего элемента, углерода, очередной электрон, согласно правилу Хунда, заполняет вакантную орбиталь, а не заполняет частично занятую:
+6C 1s22s22p2 1s 2s
2p
Попробуйте составить электронную и электронно-графическую формулы для следующих элементов, а затем можете проверить себя по ответам конце статьи:
5. Азот
6. Кислород
7. Фтор
У неона завершено заполнение второго энергетического уровня:
+10Ne 1s22s22p6 1s 2s
2p
У натрия начинается заполнение третьего энергетического уровня:
+11Na 1s22s22p63s1 1s 2s
2p
3s
От натрия до аргона заполнение 3-го уровня происходит в том же порядке, что и заполнение 2-го энергетического уровня. Предлагаю составить электронные формулы элементов от магния до аргона самостоятельно, проверить по ответам.
8. Магний
9. Алюминий
10. Кремний
11. Фосфор
12. Сера
13. Хлор
14. Аргон
А вот начиная с 19-го элемента, калия, иногда начинается путаница — заполняется не 3d-орбиталь, а 4s. Ранее мы упоминали в этой статье, что заполнение энергетических уровней и подуровней электронами происходит по энергетическому ряду орбиталей, а не по порядку. Рекомендую повторить его еще раз. Таким образом, формула калия:
+19K 1s22s22p63s23p64s11s 2s
2p
3s
3p
4s
Для записи дальнейших электронных формул в статье будем использовать сокращенную форму:
+19K [Ar]4s1 [Ar] 4s
У кальция 4s-подуровень заполнен:
+20Ca [Ar]4s2 [Ar] 4s
У элемента 21, скандия, согласно энергетическому ряду орбиталей, начинается заполнение 3d-подуровня:
+21Sc [Ar]3d14s2 [Ar] 4s 3d
Дальнейшее заполнение 3d-подуровня происходит согласно квантовым правилам, от титана до ванадия:
+22Ti [Ar]3d24s2 [Ar] 4s 3d
+23V [Ar]3d34s2 [Ar] 4s 3d
Однако, у следующего элемента порядок заполнения орбиталей нарушается. Электронная конфигурация хрома такая:
+24Cr [Ar]3d54s1 [Ar] 4s 3d
В чём же дело? А дело в том, что при «традиционном» порядке заполнения орбиталей (соответственно, неверном в данном случае — 3d44s2) ровно одна ячейка в d-подуровне оставалась бы незаполненной. Оказалось, что такое заполнение энергетически менее выгодно. А более выгодно, когда d-орбиталь заполнена полностью, хотя бы единичными электронами. Этот лишний электрон переходит с 4s-подуровня. И небольшие затраты энергии на перескок электрона с 4s-подуровня с лихвой покрывает энергетический эффект от заполнения всех 3d-орбиталей. Этот эффект так и называется — «провал» или «проскок» электрона. И наблюдается он, когда d-орбиталь недозаполнена на 1 электрон (по одному электрону в ячейке или по два).
У следующих элементов «традиционный» порядок заполнения орбиталей снова возвращается. Конфигурация марганца:
+25Mn [Ar]3d54s2
Аналогично у кобальта и никеля. А вот у меди мы снова наблюдаем провал (проскок) электрона — электрон опять проскакивает с 4s-подуровня на 3d-подуровень:
+29Cu [Ar]3d104s1
На цинке завершается заполнение 3d-подуровня:
+30Zn [Ar]3d104s2
У следующих элементов, от галлия до криптона, происходит заполнение 4p-подуровня по квантовым правилам. Например, электронная формула галлия:
+31Ga [Ar]3d104s24p1
Формулы остальных элементов мы приводить не будем, можете составить их самостоятельно.
Некоторые важные понятия:
Внешний энергетический уровень — это энергетический уровень в атоме с максимальным номером, на котором есть электроны.
Например, у меди ([Ar]3d104s1) внешний энергетический уровень — четвёртый.
Валентные электроны — электроны в атоме, которые могут участвовать в образовании химической связи. Например, у хрома (+24Cr [Ar]3d54s1) валентными являются не только электроны внешнего энергетического уровня (4s1), но и неспаренные электроны на 3d-подуровне, т.к. они могут образовывать химические связи.
Основное и возбужденное состояние атома
Электронные формулы, которые мы составляли до этого, соответствуют основному энергетическому состоянию атома. Это наиболее выгодное энергетически состояние атома.
Однако, чтобы образовывать химические связи, атому в большинстве ситуаций необходимо наличие неспаренных (одиночных) электронов. А химические связи энергетически очень для атома выгодны. Следовательно, чем больше в атоме неспаренных электронов — тем больше связей он может образовать, и, как следствие, перейдёт в более выгодное энергетическое состояние.
Поэтому при наличии свободных энергетических орбиталей на данном уровне спаренные пары электронов могут распариваться, и один из электронов спаренной пары может переходить на вакантную орбиталь. Таким образом число неспаренных электронов увеличивается, и атом может образовать больше химических связей, что очень выгодно с точки зрения энергии. Такое состояние атома называют возбуждённым и обозначают звёздочкой.
Например, в основном состоянии бор имеет следующую конфигурацию энергетического уровня:
+5B 1s22s22p1 1s 2s
2p
На втором уровне (внешнем) одна спаренная электронная пара, один одиночный электрон и пара свободных (вакантных) орбиталей. Следовательно, есть возможность для перехода электрона из пары на вакантную орбиталь, получаем возбуждённое состояние атома бора (обозначается звёздочкой):
+5B* 1s22s12p2 1s 2s
2p
Попробуйте самостоятельно составить электронную формулу, соответствующую возбуждённому состоянию атомов. Не забываем проверять себя по ответам!
15. Углерода
16. Бериллия
17. Кислорода
Электронные формулы ионов
Атомы могут отдавать и принимать электроны. Отдавая или принимая электроны, они превращаются в ионы.
Ионы — это заряженные частицы. Избыточный заряд обозначается индексом в правом верхнем углу.
Если атом отдаёт электроны, то общий заряд образовавшейся частицы будет положительный (вспомним, что число протонов в атоме равно числу электронов, а при отдаче электронов число протонов будет больше числа электронов). Положительно заряженные ионы — это катионы. Например: катион натрия образуется так:
+11Na 1s22s22p63s1 -1е = +11Na+ 1s22s22p63s0
Если атом принимает электроны, то приобретает отрицательный заряд. Отрицательно заряженные частицы — это анионы. Например, анион хлора образуется так:
+17Cl 1s22s22p63s23p5 +1e = +17Cl— 1s22s22p63s23p6
Таким образом, электронные формулы ионов можно получить добавив или отняв электроны у атома. Обратите внимание, при образовании катионов электроны уходят с внешнего энергетического уровня. При образовании анионов электроны приходят на внешний энергетический уровень.
Попробуйте составить самостоятельно электронный формулы ионов. Не забывайте проверять себя по ключам!
18. Ион Са2+
19. Ион S2-
20. Ион Ni2+
В некоторых случаях совершенно разные атомы образуют ионы с одинаковой электронной конфигурацией. Частицы с одинаковой электронной конфигурацией и одинаковым числом электронов называют изоэлектронными частицами.
Например, ионы Na+ и F—.
Электронная формула катиона натрия: Na+ 1s22s22p6, всего 10 электронов.
Электронная формула аниона фтора: F— 1s22s22p6, всего 10 электронов.
Таким образом, ионы Na+ и F— — изоэлектронные. Также они изоэлектронны атому неона.
Тренажер по теме «Строение атома» — 10 вопросов, при каждом прохождении новые.
288
Создан на
03 января, 2022 От Admin
Тренировочный тест «Строение атома»
Тренировочный тест по теме «Строение атома»
1 / 10
1) V 2) B 3) Li 4) C 5) He
Определите элементы, атомы которых в основном состоянии имеют электронную формулу внешнего энергетического уровня ns2.
2 / 10
1) Fe 2) B 3) Li 4) C 5) He
Определите элементы, атомы которых в основном состоянии имеют электронную формулу внешнего энергетического уровня ns2.
3 / 10
1) Ca 2) S 3) Na 4) F 5) Mn
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют одинаковое число электронов во внешнем слое.
4 / 10
1) Zn 2) S 3) Si 4) Fe 5) Mg
Определите элементы, атомы которых в основном состоянии не содержат неспаренных электронов.
5 / 10
1) He 2) Ba 3) Si 4) S 5) F
Определите элементы, атомы которых в основном состоянии не содержат неспаренных электронов.
6 / 10
1) Ti 2) P 3) N 4) Al 5) O
Определите элементы, атомы которых в основном состоянии содержат два неспаренных электрона.
7 / 10
1) O 2) P 3) Si 4) Cr 5) S
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют электронную конфигурацию внешнего энергетического уровня ns2np4.
8 / 10
1) S 2) Ca 3) Mn 4) Al 5) Cl
Определите, атомы каких из указанных в ряду элементов имеют на внешнем энергетическом уровне одинаковое число электронов.
9 / 10
1) Ba 2) Sn 3) Ti 4) S 5) Ca
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют на внешнем энергетическом уровне два неспаренных электрона.
10 / 10
1) C 2) H 3) O 4) Mg 5) N
Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое число неспаренных электронов.
Ваша оценка
The average score is 33%
Ответы на вопросы:
1. У изотопов одного химического элемента массовое число всегда разное, т.к. массовое число складывается из числа протонов и нейтронов. А у изотопов различается число нейтронов.
2. У изотопов одного элемента число протонов всегда одинаковое, т.к. число протонов характеризует химический элемент.
3. Массовое число изотопа брома-81 равно 81. Атомный номер = заряд ядра брома = число протонов в ядре = 35. Вычитаем из массового числа число протонов, получаем 81-35=46 нейтронов.
4. Массовое число изотопа хлора равно 37. Атомный номер, заряд ядра и число протонов в ядре равно 17. Получаем число нейтронов = 37-17 =20.
5. Электронная формула азота:
+7N 1s22s22p3 1s 2s
2p
6. Электронная формула кислорода:
+8О 1s22s22p4 1s 2s
2p
7. Электронная формула фтора:
8. Электронная формула магния:
+12Mg 1s22s22p63s2 1s 2s
2p
3s
9. Электронная формула алюминия:
+13Al 1s22s22p63s23p1 1s 2s
2p
3s
3p
10. Электронная формула кремния:
+14Si 1s22s22p63s23p2 1s 2s
2p
3s
3p
11. Электронная формула фосфора:
+15P 1s22s22p63s23p3 1s 2s
2p
3s
3p
12. Электронная формула серы:
+16S 1s22s22p63s23p4 1s 2s
2p
3s
3p
13. Электронная формула хлора:
14. Электронная формула аргона:
+18Ar 1s22s22p63s23p6 1s 2s
2p
3s
3p
15. Электронная формула углерода в возбуждённом состоянии:
+6C* 1s22s12p3 1s 2s
2p
16. Электронная формула бериллия в возбуждённом состоянии:
+4Be 1s22s12p1 1s 2s
2p
17. Электронная формула кислорода в возбуждённом энергетическом состоянии соответствует формуле кислорода в основном энергетическом состоянии, т.к. нет условий для перехода электрона — отсутствуют вакантные энергетические орбитали.
18. Электронная формула иона кальция Са2+: +20Ca2+ 1s22s22p63s23p6
19. Электронная формула аниона серы S2-: +16S2- 1s22s22p63s23p6
20. Электронная формула катиона никеля Ni2+: +28Ni2+ 1s22s22p63s23p63d84s0. Обратите внимание! Атомы отдают электроны всегда сначала с внешнего энергетического уровня. Поэтому никель отдаёт электроны сначала с внешнего 4s-подуровня.
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
Строение атома
Автор статьи — профессиональный репетитор И. Давыдова (Юдина).
Атом — в переводе с древнегреческого – неделимый — это наименьшая частица химического элемента, являющаяся носителем его свойств. Современные представления о строении атома требуют для понимания знаний основ квантовой механики, поэтому мы ограничимся упрощенной моделью.
Атом состоит из ядра (в составе которого протоны и нейтроны) и электронов. Несмотря на то, что ядро составляет большую часть массы атома, оно очень мало.
| Заряд z | Масса m | |
| Протон p+ | +1 | 1 |
| Нейтрон n0 | 0 | 1 |
| Электрон e— | -1 | 0 |
Количество протонов равно количеству электронов и равно номеру атома в периодической таблице. Число нейтронов равно разности атомной массы и номера элемента.
Бор – пятый элемент периодической таблицы, в его атоме 5 протонов и 5 электронов. Атомная масса ≈ 11, количество нейтронов равно 11 – 5 = 6.
Элементы, имеющие одинаковое количество протонов в ядре, но различающиеся числом нейтронов, называются изотопами.
Например, 35Cl и 37Cl – изотопы, различающиеся атомной массой и количеством нейтронов.
| Число протонов | Число нейтронов | Число электронов | |
| 35Cl | 17 | 18 | 17 |
| 37Cl | 17 | 20 | 17 |
Вокруг ядра по различным траекториям — орбиталям движутся электроны. Каждой орбитали соответствует определенный уровень энергии, чем ближе орбиталь к ядру, тем меньшей энергией должен обладать электрон, чтобы находиться на ней.
Порядок заполнения орбиталей:
Электроны располагаются на орбиталях в соответствии со следующими правилами:
- Принцип наименьшей энергии: в первую очередь электроны заполняют наиболее низкие по энергии уровни (ближайшие к ядру).
Энергия орбиталей на уровнях и подуровнях изменяется следующим образом: 1s < 2s < 2р < Зs < Зр < 4s < 3d < 4р < 5s <4d < 5р < 6s < 4f ≈ 5d < 6p < 7s < 5f ≈6d < 7p . (●)
| Тип орбитали | Число орбиталей на энергетическом уровне | Максимальное количество электронов на этих орбиталях |
| s | 1 | 2 |
| p | 3 | 6 |
| d | 5 | 10 |
| f | 7 | 14 |
Перед оставшимися двумя принципами введем понятие спина электрона. Спин – характеристика самого электрона, представить его (это упрощенная модель, а ненастоящий физический смысл понятия спин!) можно как направление движения электрона вокруг своей оси: по или против часовой стрелки. Возможных значений всего два: +1/2 (обозначаем стрелкой вверх) и -1/2 (обозначаем стрелкой вниз).
- Принцип Паули: на каждой орбитали может быть не более двух электронов, причем их спины должны быть различными.
- Правило Хунда: суммарный спин системы должен быть максимально возможным.
С правилом Паули всё достаточно ясно: спины двух электронов на одной орбитали различны, а значит у одного электрона +1/2 (стрелочка вверх), у другого – -1/2 (стрелочка вниз). Но каков смысл правила Хунда? В данном случае обратимся всё к тем же значениям спина электрона. При заполнении электронного уровня всегда сначала заполняется один подуровень, только затем электроны помещаются на следующий. Рассмотрим p-подуровень. На нём имеются 3 орбитали (см. таблицу выше). В целом, есть разные варианты развития событий. Допустим, у нас есть 4 электрона, которые надо расположить на подуровне. Мы можем поместить два в первую ячейку, два во вторую. Посчитаем суммарный спин. У двух элетронов спин 1/2, у других -1/2. Тогда при сложении мы получаем ноль. Теперь расположим три первых электрона по одному, оставшийся поместим на первую орбитал (в пару). Теперь суммарный спин 1. Значит, подходит второй случай. Для того чтобы каждый раз не высчитывать суммарный спин, можно запомнить, что вначале следует расположить все имеющиеся электроны по одному, и если на подуровне уже не останется свободных ячеек, начинать составлять пары.
Рассмотрим заполнение орбиталей электронами на нескольких примерах. У каждого следующего элемента таблицы Менделеева на один протон и один электрон больше, чем у предыдущего. У элементов главных подгрупп всегда заполняется внешний электронный уровень, у элементов побочных – один из предыдущих.
— магний – двенадцатый элемент, имеет по 12 протонов и электронов, находится в главной подгруппе. Распределим эти электроны в соответствии с рассмотренными выше правилами, не забывая, что на каждом подуровне может быть не более двух электронов.
Магний – элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены — 1s22s22p6.Магний находится во второй группе, значит, на третьем уровне у него два электрона — 3s2. Итого получаем1s22s22p63s2.
В атоме магния в основном состоянии нет неспаренных электронов.
Если атому сообщили дополнительную энергию (например, нагрели), то электронная пара может распарится и один из электронов переходит на свободную орбиталь того же энергетического уровня. В возбужденном состоянии атом магния имеет два неспаренных электрона и может образовать две связи (валентность II).
— фосфор – пятнадцатый элемент, находится в главной подгруппе. Распределяем 15 электронов: Фосфор — элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены — 1s22s22p6.Фосфор находится в пятой группе, значит, на третьем уровне у него пять электронов — 3s23p3. Итого получаем1s22s22p63s23p3.
В атоме фосфора в основном состоянии 3 неспаренных электрона. В возбужденном состоянии атом фосфора имеет пять неспаренных электронов и может образовать пять связей (валентность V).
— цирконий – сороковой элемент, распределяем 40 электронов. Цирконий – элемент побочной подгруппы! Поэтому у него заполняется предыдущий электронный уровень (4d-подуровень). Цирконий – второй d – элемент в пятом периоде, значит, он содержит 2 электрона на 4d – подуровне. Итого получаем: 1s22s22p63s23p64s23d104p65s24d2.
В атоме циркония в основном состоянии 2 неспаренных электрона.
В возбужденном состоянии цирконий имеет четыре неспаренных электрона.
Важно отметить, что в обычном состоянии цирконий не может образовывать связей, так как для этого необходимы неспаренные электроны на внешнем электронном уровне. Соответственно, во всех соединениях цирконий находится в возбуждённом состоянии.
Исключениями из общего порядка заполнения электронных подуровней являются хром, марганец, медь, серебро и золото – у них наблюдается «провал» электрона с внешного s – подуровня на предвнешний d. (Атому более комфортно иметь на d-подуровне 5 или 10 электронов, чем 4 или 9). Например, электронные конфигурации хрома и меди вместо 4s23d4 и 4s23d9 имеют вид 4s13d5 и 4s13d10.
Задания для тренировки:
- Сколько протонов и электронов содержит ион NO2—
1) 46p, 46e
2) 23p, 24e
3) 23р, 23e
4) 46p, 47e - Чем отличаются изотопы одного и того же химического элемента?
1) Числом протонов
2) Числом электронов
3) Зарядом ядра
4) Массовым числом - Укажите атом, в котором больше всего электронов:
1) 2Н
2) 40Аr
3) 41Ar
4) 39К - Изобразить электронно-графическую схему атома хлора в основном и всех возможных возбужденных состояниях. Какие валентности способен проявлять хлор?
- Объяснить, почему сера проявляет валентность VI, а кислород – не проявляет, хотя оба эти элемента содержат по 6 электронов на внешнем слое.
Благодарим за то, что пользуйтесь нашими статьями.
Информация на странице «Строение атома» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать необходимые и поступить в высшее учебное заведение или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
08.03.2023
Занятие 1. Строение атома. Закономерности изменения химических свойств элементов в ПСХЭ
1. Строение атома
|
Основные элементы содержания: |
|
атом, атомное ядро, протон, нейтрон, электрон, атомная орбиталь, энергетический уровень, энергетический подуровень, электронная конфигурация атома, внешние и валентные электроны, основное и возбужденное состояние атома. |
1.1. Современное представление об атоме
Химический элемент – это вид атомов с одинаковым _____________________________ .
Электронейтральная частица, состоящая из положительно ядра и отрицательно заряженной электронной оболочки ___________________________________________________ .
Ядро атома состоит из _______________________________________________________.
Основные характеристики протонов, нейтронов и электронов
|
Частица |
Обозначение |
Заряд, условный |
Массовое число |
Масса, а.е.м. |
|
Электрон |
|
-1 |
0 |
5,5·10-4 |
|
Протон |
p |
+1 |
1 |
1,0073 |
|
Нейтрон |
n |
0 |
1 |
1,0087 |
Как установлено Г Мозли, заряд ядра численно равен порядковому номеру элемента ПСХЭ Д.И. Менделеева (физический смысл порядкового номера):
Порядковый Заряд Число Число
номер ядра протонов электронов
элемента атома в ядре в атоме
Атомы химического элемента обозначают, используя запись – , в которой:
Э – _________________ химического элемента; А – это массовое число равное ______________________________________________ , Z – это ___________________________ .
|
Разные атомы, у которых |
число протонов Z одинаково, число нейтронов N различно |
называется |
|
|
число нейтронов N одинаково, число протонов Z различно |
называется |
||
|
массовое число А одинаково, число протонов Z различно, |
называется |
1.2. Строение электронной оболочки атома
Область пространства в атоме, в которой наиболее вероятно находится электрон называют _________________________________________________________________________.
Каждая атомная орбиталь имеет определенную форму (рисунок).
Атомные орбитали образуют энергетические уровни и подуровни.
Энергетические уровни обозначаются ____________, номер энергетического уровня равен номеру ____________.
Каждый энергетический уровень состоит из подуровней. Число подуровней равно номеру ___________.
Подуровни объединяют орбитали одного вида.
Первый подуровень состоит из __________________.
Второй подуровень состоит из __________________.
Третий подуровень состоит из __________________.
ЗАПОМНИТЬ!!!!
Любой s-подуровень состоит из одной _______________________, p-подуровень состоит из трех _____________________, d-подуровень состоит из пяти ____________________.
Рис. Энергетические уровни и подуровни в атоме
Принцип Паули______________________________________________________________.
Максимальное число электронов на энергетических уровнях
|
Уровень |
Подуровни |
Максимальное число электронов на подуровне |
Максимальное число электронов на уровне |
|
К (первый) |
1s |
2 |
2 |
|
L (второй) |
2s 2р |
2 6 |
8 |
|
М (третий) |
3s 3р 3d |
2 6 10 |
18 |
|
N (четвертый) |
4s 4р 4d 4f |
2 6 10 14 |
32 |
Принцип минимума энергии ___________________________________________________
___________________________________________
Электроны, находящиеся на последнем энергетическом уровне, называются ___________.
Электроны, которые могут принимать участие в образовании химических связей, называются ________________________________.
Для элементов главных подгрупп валентными являются внешние ________________.
17Cl 1s22s22p6 3s23p6 — валентные электроны.
Для элементов побочных подгрупп валентными являются внешние ___________ и предвнешние _________________.
24 Cr 1s22s22p6 3s23p6 4s13d5 — валентные электроны
В зависимости от характера заполнения электронами, орбитали делятся на ____________ (без электронов), _______________ (один электрон) и ___________________________ (два электрона).
Два электрона, которые находятся на одной орбитали и имеют противоположные спины, называются ______________________________________________________________________.
Правило Хунда _______________________________________________________________
___________________________________________________________________________________________________________________________________________________________________
Приобретая энергию, атом может из своего основного, самого устойчивого состояния перейти в возбужденное состояние.
Основное и возбужденное состояние
С С*
Правило Хунда справедливо ТОЛЬКО ДЛЯ ОСНОВНОГО СОСТОЯНИЯ!!!
1.3. Способы изображения электронной конфигурации
Схемы электронного строения показывают ______________________________________
Электронные формулы показывают _____________________________________________
Электронно-графические формулы показывают __________________________________
____________________________________________________________________________
1.4. Провал электрона
«Провал» электрона приводит к повышению устойчивости подуровней
2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
|
Основные элементы содержания: |
|
Периодический закон, Периодическая система химических элементов, периодические изменения в системе химических элементов, атомный радиус, электроотрицательность, |
2.1. Структура Периодической системы химических элементов
Периодическая система Д.И. Менделеева
|
I |
II |
III |
IV |
V |
VI |
VII |
VIII |
|||
|
1 |
H |
He |
||||||||
|
2 |
Li |
Be |
B |
C |
N |
O |
F |
Ne |
||
|
3 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
||
|
4 |
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
|
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
|||
|
5 |
Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Rd |
|
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
Xe |
|||
|
6 |
Cs |
Ba |
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
|
Au |
Hg |
Tl |
Pb |
Bi |
Po |
At |
Rn |
|||
|
7 |
Fr |
Ra |
Ac |
Db |
Jl |
Rf |
Bh |
Hn |
Mt |
|
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
|
Th |
Pa |
U |
Np |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr |
Элементы располагаются в порядке возрастания __________________________________
Порядковый номер элемента равен ______________________________________________
Горизонтальные строки — ______________________________________________________
Вертикальные колонки — _______________________________________________________
Периода – последовательность химических элементов, выстроенных в порядке ________________ заряда ядра, атомы которых имеют в электронной оболочке одинаковое число _________________________________. В ПСХЭ _____________ периодов, из них 1, – 3 — ___________________ периоды; 4 – 6 ___________________ периоды; 7 – незавершенный.
Номер периода равен _________________________________________________________.
Каждая строка большого периода называется — ___________________________________.
Группа – последовательность химических элементов, выстроенных в порядке ___________________ заряда ядра, атомы которых имеют в электронной оболочке одинаковое число ____________________________________________________________________________.
Номер группы равен _________________________________________________________.
2.2. Периодическое изменение свойств элементов:
2.2.1. Радиус атома
В группе сверху вниз число электронных уровней _____________________________________,
следовательно, радиус атом _________________________________________________________.
В периоде слева направо число электронных уровней ___________________________________,
при этом заряд ядра ___________________, следовательно, радиус атома _________________.
2.2.2. Прочность связи внешних электронов с ядром
В группе сверху вниз радиус атома __________________________________________________,
следовательно, прочность связи внешних электронов с ядром ____________________________.
В периоде слева направо радиус ____________________, при этом заряд ядра ______________,
следовательно, прочность связи внешних электронов с ядром __________________________
2.2.3. Металлические свойства — способность отдавать электроны
В группе сверху вниз прочность связи внешних электронов с ядром _______________________, следовательно, металлические свойства______________________________________________.
В периоде слева направо прочность связи внешних электронов с ядром ____________________, следовательно, металлические свойства _____________________________________________.
2.2.4. Неметаллические свойства — способность принимать электроны
В группе сверху вниз радиус атома___________________________________________________,
следовательно, неметаллические свойства ____________________________________________.
В периоде слева направо радиус атома _____________, при этом заряд ядра _____________, следовательно, неметаллические свойства ___________________________________________.
2.2.5. Энергия ионизации. Сродство к электрону
Наименьшая энергия, необходимая для отрыва электрона от атома, называется __________________________________________________________________________________.
Так как энергия ионизации характеризует способность атомов отдавать электроны, она является количественной характеристикой металлических свойств элементов. Энергия ионизации зависит в основном от заряда ядра и радиуса атома.
В группе сверху вниз радиус атома __________________________________________________,
прочность связи внешних электронов с ядром ________________________________________,
следовательно, энергия ионизации ____________________________________________________.
В периоде слева направо радиус атома _______________________________________________,
при этом заряд ядра ______________________________________________________________,
прочность связи внешних электронов с ядром _________________________________________,
следовательно, энергия ионизации __________________________________________________
Зависимость свойств атомов элементов от их положения в ПС
|
Название свойства |
Характер изменения: |
|
|
в периоде слева направо → |
в подгруппе сверху вниз ↓ |
|
|
Число внешних электронов |
||
|
Заряд ядра (число электронов в атоме) |
||
|
Число электронных уровней |
||
|
Число валентных электронов |
||
|
Радиус атома |
||
|
Прочность связи внешних электронов с ядром |
||
|
Металлические свойства |
||
|
Неметаллические свойства |
||
|
Электроотрицательность |
||
|
Энергия ионизации |
||
|
Окислительный свойства |
||
|
Восстановительные свойства |
3. Задания для закрепления
1. Химический элемент, имеющий электронную конфигурацию 1s22s22p63s23p64s2, в периодической системе находится в
1) 3-м периоде, VIIIВ группе 2) 4-м периоде, IIА группе
3) 4-м периоде, IIВ группе 3) 3-м периоде, VIIIA группе
2. Атом хрома имеет электронную конфигурацию
1) 1s22s22p4 3) 1s22s22p63s23p63d54s1
2) 1s22s22p63s23p6 4) 1s22s22p63s23p4
3. Сходную конфигурацию внешнего энергетического уровня имеют элементы хлор и
1) марганец 2) сера 3) аргон 4) бром
4. Число электронов на 3р-орбиталях атома фосфора в основном состоянии равно:
1) пяти 2) двум 3) трем 4) четырем
5. У атома кремния в основном состоянии число неспаренных электронов равно
1) 1 2) 2 3) 3 4) 0
6. Атом серы в максимально возбужденном состоянии имеет электронную конфигурацию валентных электронов
1) 3s23p43d0 3) 3s13p23d3
2) 3s23p33d1 4) 3s13p33d2
7. Не может находиться в возбужденном состоянии атом
1) углерода 2) азота 3) фосфора 4) серы
8.Электронная конфигурация иона хлора Cl—:
1) 1s22s22p63s23p3 3) 1s22s22p63s23p5
2) 1s22s22p63s23p4 4) 1s22s22p63s23p6
9. Одинаковую электронную конфигурацию имеют атомы неона и частица:
1) Mg2+ 2) S2- 3) Cl+ 4) К+
10. Частицей, имеющей такое же строение электронной оболочки, как у атома аргона, является
1) С1+3 2) Cl+ 3) Cl0 4) Сl—
11. Число электронов в ионе Al3+ равно:
1) 13 2) 18 3) 5 4) 10
12. Легче всего присоединяют электроны атомы:
1) хлора 2) серы 3) селена 4) брома
13. Одинаковую электронную конфигурацию имеют ионы
1) Al3+ и K+ 2) Na+ и O2– 3) Mg2+ и Ca2+ 4) Na+ и Cl–
14. На 3s-энергетическом подуровне в основном состоянии расположены все валентные электроны атома
1) магния 2) алюминия 3) азота 4) бора
15. На 2s-энергетическом подуровне расположены все валентные электроны атома
1) магния 2) бериллия 3) кремния 4) натрия
16. Электронная конфигурация 1s22s22p6 соответствует
1) атому С 2) иону O2– 3) иону Cl— 4) иону Ca2+
17. Атому аргона в основном состоянии соответствует электронная конфигурация частицы
1) S2- 2) Zn2+ 3) Si4+ 4) Se0
18. Атом химического элемента, водородное соединение которого имеет формулу RH3, имеет конфигурацию внешнего уровня:
1) ns2np2 2) ns2np4 3) ns2 4) ns2np3
19. Атому аргона в основном состоянии соответствует электронная конфигурация частицы
1) Ca0 2) K+ 3) Cl+ 4) Zn2+
20. Электронную конфигурацию, отличную от инертного газа, имеет ион
1) K+ 2) O2- 3) Cu2+ 4) Ca2+
21. Какие два атома имеют одинаковое число s-электронов в основном состоянии?
1) Na и K 2) Cl и Na 3) Cl и Fe 4) P и Cl
22. Среди элементов 2-го периода наибольшее число неспаренных электронов имеет в основном состоянии атом
1) лития 2) углерода 3) азота 4) фтора
23. Два неспаренных электрона на внешнем уровне в основном состоянии имеет атом
1) магния 2) углерода 3) хлора 4) бериллия
24. Электронную конфигурацию ls22s22p6 имеет ион
1) Mg2+ 2) К+ 3) Fe2+ 4) С −
25. Сходную конфигурацию внешнего энергетического уровня имеют атомы магния и
1) кальция 2) хрома 3) кремния 4) алюминия
26. Электронная конфигурация 1s22s22p63s23p6 соответствует частице
1) N3- 2) Ca2+ 3) F— 4) Al3+
27. Элемент, электронная конфигурация атома которого 1s22s22p63s23p2, образует водородное соединение
1) CH4 2) SiH4 3) H2O 4) H2S
28. Одинаковую электронную конфигурацию имеют ионы
1) Cl— и Br— 2) Al3+ и F— 3) O2- и Ca2+ 4) Mg2+ и S2-
29. Одинаковую электронную конфигурацию имеют
1) Mg2+ и O2- 2) Na+ и K+ 3) F— и Ar 4) O и S
30. Среди элементов 3-го периода наибольшее число неспаренных электронов имеет в основном состоянии атом
1) натрия 2) кремния 3) фосфора 4) хлора
31. Ион элемента имеет заряд -2 и электронную конфигурацию 1s22s22p63s23p6. Порядковый номер элемента равен
1) 8 2) 16 3) 18 4) 20
32. Какое соединение содержит оба элемента с электронной конфигурацией 1s22s22p6
1) Na2S 2) KF 3) Na2O 4) KBr
33. Восьмиэлектронную внешнюю оболочку имеет каждая из двух частиц:
1) P3+ и Cl5+ 2) S2- и Cl7+ 3) H+ и Ca2+ 4) Cl5+ и Li+
34. Электронная конфигурация внешнего уровня элемента — 4s23d3. В периодической системе элемент находится в
1) 3 периоде, V группе 2) 3 периоде, VII группе
3) 4 периоде, V группе 4) 4 периоде, VII группе
35. Элемент, электронная конфигурация атома которого 1s22s22p63s23p3, образует водородное соединение
1) NH3 2) PH3 3) HCl 4) H2S
36. Какая электронная конфигурация соответствует распределению валентных электронов в атоме хрома?
1) 3d44s2 2) 3s23p4 3) 3d54s1 4) 4s24p6
37. Высший оксид элемента с электронной конфигурацией 1s22s22p63s23p5:
1) Э2О5 2) ЭО3 3) Э2О7 4) ЭО4
38. Электронная конфигурация внешнего уровня элемента — 4s23d3. В периодической системе элемент находится в
1) 3 периоде, III группе 2) 3 периоде, V группе
3) 4 периоде, III группе 4) 4 периоде, V группе
39. Электронная конфигурация 1s22s22p63s23p6 соответствует частице
1) S4+ 2) P3- 3) Al3+ 4) O2-
40. Элемент имеет на внешнем энергетическом уровне 5 электронов. Каков может быть порядковый номер этого элемента?
1) 5 2) 7 3) 11 4) 25
41. Элемент находится в 3-м периоде, IVA группе. Конфигурация его валентных электронов —
1) 3s23p2 2) 3s23d2 3) 3p4 4) 4s23d1
42. Электронная конфигурация атома ванадия:
1) 1s22s22p63s23p63d5 2) 1s22s22p63s23p63d34s2
3) 1s22s22p63s23p63d44s1 4) 1s22s22p63s23p64s24p3
43. Электронная конфигурация внешнего электронного слоя …4s24p3 соответствует атому:
1) мышьяка; 2) ванадия; 3) фосфора; 4) сурьмы
44. Электронная конфигурация ns2np6 соответствует каждому из двух атомов:
1) аргон и криптон; 3) фтор и хлор;
2) неон и гелий; 4) сера и кислород
45. Электронная конфигурация ls22s22p63s23p63d104s24p6 не соответствует частице:
1) Kr0; 2) Rb0; 3) Вr—; 4) Se2-
46. Электронная конфигурация ls22s22p63s23p63d10 не соответствует иону:
1) Сu+; 2) Zn2+; 3) Cu2+; 4)Ga3+
47. Электронную конфигурацию инертного газа не имеет ион:
1) Ca2+; 2) С1—; 3) К+; 4)Сr3+
48. Элементу, электронная формула атома которого ls22s22p5, соответствует водородное соединение, формула которого:
1) HF; 2) НС1; 3) СН4; 4) NH3
49. Элементу, электронная формула внешнего электронного слоя атома которого …3s23p2, соответствует водородное соединение, формула которого:
1) РН3; 2) СН4; 3) SiH4; 4) HI
50. Элементу, электронная формула атома которого 1s22s22p63s23p63d54s2, соответствует высший оксид, формула которого:
1) Br2O7; 2) МnO2; 3) МnO; 4) Мn2O7
51. Атомы элементов 4-го периода имеют одинаковое число:
1) электронов на внешнем энергетическом уровне
2) нейтронов
3) энергетических уровней
4)протонов
52. Атомы элементов IIА группы сходны по:
1) числу электронов в атоме
2) числу электронов на внешнем электронном слое
3) числу энергетических уровней в электронной оболочке
4) радиусу атомов
53. Какая из характеристик атомов одинакова для всех элементов 3-го периода периодической системы?
1) число энергетических уровней
2) радиусы атомов
3) число электронов на внешнем энергетическом уровне
4) число протонов в ядре атома
54. В группах с ростом порядкового номера атомов элементов увеличивается:
1) число валентных электронов
2) атомный радиус
3) электроотрицательность
4) кислотные свойства высших гидроксидов
55. Наименьший радиус имеет атом
1) фтора 2) бериллия 3)бария 4) кремния
56. Атому с наибольшим радиусом соответствует электронная конфигурация
1) 1 s22s22p63s23p1 3) 1s22s22p63s23p5
2) 1s22s22p4 4) 1s22s22p2
57. Наибольший радиус имеет ион
1) Rb+ 2) Sr2+ 3) Те2- 4) I—
58. Наименьший радиус имеет ион
1) Сl— 2) Mg2+ 3) S2- 4) Са2+
59. Наибольшее значение электроотрицательности имеет атом, электронная конфигурация которого
1) 1s22s22p1 3) 1s22s22p5
2) 1s22s22p4 4) 1s22s22p63s23p5
60. Химическому элементу, электронная формула которого 1s22s22p63s23p2, соответствует водородное соединение
1) хлороводород 2) сероводород 3) фосфин 4) силан
61. В каком ряду химические элементы расположены в порядке уменьшения их атомного радиуса?
1) Se → S → O 2) Cl → Br → I 3) S → P → Si 4) Al → Mg → Na
62. В порядке ослабления основных свойств оксиды расположены в ряду:
1) B2O3 → BeO → Li2O 2) Al2O3 → MgO → Na2O
3) CaO → MgO → BeO 4) Li2O → K2O → Rb2O
63. В каком ряду химические элементы расположены в порядке возрастания их электроотрицательности?
1) B → C → N 2) S → Se → Te
3) Be → Mg → Ca 4) B → Al → Ga
64. Во втором периоде периодической системы с ростом порядкового номера уменьшается
1) электроотрицательность атома 2) радиус атома
3) энергия ионизации 4) высшая степень окисления
65. В ряду элементов O → S → Se → Te увеличивается
1) электроотрицательность
2) низшая степень окисления
3) кислотный характер водородного соединения
4) валентность элемента в водородном соединении
67. В каком ряду химические элементы расположены в порядке возрастания их электроотрицательности?
1) B, C, N 2) Be, Mg, Ca 3) Cl, Br, I 4) S, P, Si
68. Сила кислот увеличивается в ряду
1) HF ─ HCl ─ HBr 2) H2SO4 ─ H2SO3 ─ H2S
3) H2SO4 ─ H3PO4 ─ H2SiO3 3) H2Se ─ H2S ─ H2O
69. Наиболее ярко выраженные неметаллические свойства проявляет
1) хлор 2) бор 3) фосфор 4) бром
70. Кислотные свойства высших оксидов усиливаются в ряду:
1) GeO2 ─ SiO2 ─ CO2 2) Cl2O7 ─ SO3 ─ P2O5
3) N2O5 ─ CO2 ─ B2O3 4) Cl2O7 ─ Br2O7 ─ I2O7
71. Среди элементов VIA группы максимальный радиус атома имеет
1) кислород 2) сера 3) теллур 4) полоний
72. Верны ли следующие суждения о магнии и его соединениях?
А. Высшая степень окисления магния в соединениях равна +3.
Б. Гидроксид магния проявляет основные свойства.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
73. Верны ли следующие суждения об элементах IIA группы?
А. Барий более активный металл, чем стронций.
Б. Основный характер оксидов в ряду BaO → CaO → MgO ослабевает.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
74. Верны ли следующие суждения о металлах и их соединениях?
А. Магний проявляет более выраженные металлические свойства, чем алюминий.
Б. Основный характер оксидов в ряду Li2O → BeO → B2O3 усиливается.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
75. В ряду элементов Na → Mg → Al → Si
1) уменьшаются радиусы атомов
2) уменьшается число протонов в ядрах атомов
3) увеличивается число электронных слоёв в атомах
4) уменьшается высшая степень окисления атомов
76. Соединения состава NaHЭО3 и NaHЭО4 характерны для
1) азота 2) фосфора 3) хлора 4) серы
77. В ряду элементов Cl → S → P → Si
1) уменьшается число электронных слоев в атомах
2) уменьшаются радиусы атомов
3) ослабевают неметаллические свойства
4) увеличивается число внешних электронов в атомах
78. В ряду химических элементов хлор → сера → фосфор:
1) ослабевают неметаллические свойства;
2) уменьшается радиус атома;
3) увеличивается радиус атома;
4) усиливаются неметаллические свойства;
5) уменьшается электроотрицательность.
79. В ряду химических элементов углерод → кремний → германий:
1) ослабевают неметаллические свойства;
2) уменьшается радиус атома;
3) увеличивается радиус атома;
4) усиливаются неметаллические свойства;
5) уменьшается электроотрицательность.
80. Ряды химических элементов, в которых радиус атома увеличивается:
1) натрий → магний → алюминий;
2) фтор → кислород → азот;
3) селен → сера → кислород;
4) углерод → кремний → германий;
5) фтор → хлор → бром.
81. Ряды химических элементов, в которых радиус атома уменьшается:
1) алюминий → магний → натрий;
2) селен → сера → кислород;
3) кремний → фосфор → хлор;
4) барий → кальций → магний;
5) бор → бериллий → литий.
82. Ряды химических элементов, в которых неметаллические свойства усиливаются:
1) йод → бром → хлор;
2) фтор → бром → йод;
3) кремний → фосфор → хлор;
4) кислород → сера → селен;
5) бор → углерод → азот.
83. Ряды химических элементов, в которых металлические свойства ослабевают:
1) литий → бериллий → бор;
2) барий → кальций → магний;
3) углерод → кремний → германий;
4) натрий → магний → алюминий;
5) алюминий → магний → натрий.
84. Ряды формул высших оксидов, в которых кислотные свойства ослабевают:
1) Р2О5 → SiО2 → А12О3;
2) СО2 → В2О3 → ВеО;
3) Р2О5 → SО3 → С12О7;
4) As2О5 → P2О5 → N2О5;
5) СО2 → SiО2 → GeО2.
85. В ряду элементов Si → P → S уменьшается
1) число электронов в атоме 2) радиус атома
3) электроотрицательность 4) высшая степень окисления
86. Верны ли следующие суждения о строении атомов и свойствах щелочных металлов?
А. Атомы щелочных металлов в основном состоянии имеют электронную конфигурацию внешнего энергетического уровня ns1.
Б. Все щелочные металлы способны взаимодействовать с водой при обычной температуре.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
87. В подгруппе кислорода с ростом порядкового номера элемента уменьшается
1) низшая степень окисления 2) радиус атома
3) энергия ионизации атома 4) относительная атомная масса
88. В ряду элементов C → Si → Ge увеличивается
1) электроотрицательность атома
2) радиус атома
3) высшая степень окисления
4) валентность элемента в летучем водородном соединении
89. Верны ли следующие суждения о металлах и их соединениях?
А. Восстановительные свойства у калия выражены сильнее, чем у магния.
Б. Высшие оксиды металлов IA группы имеют состав R2O.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
90. Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент
1) хлор 2) германий 3) мышьяк 4) селен
91. Электроотрицательность увеличивается в ряду элементов
1) F − Сl – Вr 2) Р − S − Сl
3) Na − К – Rb 4) C − Si − Ge
92. В каком ряду химические элементы расположены в порядке возрастания их электроотрицательности?
1) Cl → Br → I 2) S → Se → Te 3) N → P → As 4) Li → Be → B
93. Верны ли следующие суждения о металлах и их соединениях?
А. Высшая степень окисления атома хрома равна номеру группы периодической
системы химических элементов.
Б. Высший гидроксид алюминия проявляет амфотерные свойства.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
94. Наиболее ярко выраженные неметаллические свойства проявляет
1) фтор 2) иод 3) сера 4) кремний
95. В порядке возрастания неметаллических свойств элементы расположены в ряду:
1) B, C, O, F 2) C, Si, Ge, Sn 3) Cl, S, P, Si 4) O, N, C, B
96. Неметаллические свойства элементов усиливаются в ряду:
1) Cl ─ S ─ P ─ Si 2) N ─ P ─ As ─ Se
3) B ─ C ─ N ─ O 4) C ─ Si ─ P ─ N
97. В ряду элементов Na → Mg → Al → Si
1) уменьшаются радиусы атомов
2) уменьшается число протонов в ядрах атомов
3) увеличивается число электронных слоёв в атомах
4) уменьшается высшая степень окисления атомов
98. Верны ли следующие утверждения о цинке и его соединениях?
А. Оксид и гидроксид цинка проявляют амфотерные свойства.
Б. Соединения цинка в высшей степени окисления являются сильными окислителями.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
99. В подгруппе галогенов с ростом порядкового номера увеличивается
1) электроотрицательность
2) высшая степень окисления
3) окислительная способность простых веществ
4) число заполненных энергетических уровней в атоме
100. В порядке усиления неметаллических свойств простых веществ образующие их элементы расположены в ряду
l) C, Si, Ge 2) Se, S, О 3) F, О, N 4) Se, As, Ge
4. Задания для самостоятельной работы
1. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне два электрона.
1) P 2) Bi 3) Be 4) At 5) Ba
Запишите в поле ответа номера выбранных элементов.
2. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне семь электронов.
1) Cl 2) S 3) Li 4) At 5) Al
Запишите в поле ответа номера выбранных элементов.
3. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне один электрон.
1) Cs 2) H 3) Sr 4) Sb 5) Te
Запишите в поле ответа номера выбранных элементов.
4. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне два электрона.
1) Ge 2) Al 3) Ca 4) Br 5) Ba
Запишите в поле ответа номера выбранных элементов.
5. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне семь электронов.
1) Cl 2) Rb 3) Te 4) F 5) Sn
Запишите в поле ответа номера выбранных элементов.
6. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне два электрона.
1) Ba 2) At 3) Bi 4) Mg 5) Cs
Запишите в поле ответа номера выбранных элементов.
7. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне семь электронов.
1) I 2) S 3) Al 4) Na 5) At
Запишите в поле ответа номера выбранных элементов.
8. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне два электрона.
1) C 2) Ca 3) As 4) Be 5) Ga
Запишите в поле ответа номера выбранных элементов.
9. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне четыре электрона.
1) Ba 2) In 3) Pb 4) Si 5) Cs
Запишите в поле ответа номера выбранных элементов.
10. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне четыре электрона.
1) Pb 2) Ge 3) Cs 4) Po 5) At
Запишите в поле ответа номера выбранных элементов.
11. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне один электрон.
1) H 2) I 3) Se 4) Rb 5) Sb
Запишите в поле ответа номера выбранных элементов.
12. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне шесть электронов.
1) K 2) Se 3) Ge 4) O 5) P
Запишите в поле ответа номера выбранных элементов.
13. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне четыре электрона.
1) Cl 2) Pb 3) Ca 4) Si 5) Mg
Запишите в поле ответа номера выбранных элементов.
14. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне один электрон.
1) Na 2) F 3) H 4) Mg 5) Si
Запишите в поле ответа номера выбранных элементов.
15. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне пять электронов.
1) Sr 2) N 3) Li 4) Bi 5) F
Запишите в поле ответа номера выбранных элементов.
16. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне два электрона.
1) Ca 2) C 3) Ba 4) F 5) O
Запишите в поле ответа номера выбранных элементов.
17. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне три электрона.
1) Be 2) O 3) B 4) Al 5) H
Запишите в поле ответа номера выбранных элементов.
18. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне семь электронов.
1) Br 2) Ca 3) F 4) Al 5) K
Запишите в поле ответа номера выбранных элементов.
19. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне один электрон.
1) Cs 2) Cl 3) Tl 4) Li 5) Ba
Запишите в поле ответа номера выбранных элементов.
20. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне два электрона.
1) C 2) Ca 3) Br 4) As 5) Mg
Запишите в поле ответа номера выбранных элементов.
21. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их неметаллических свойств.
1) P 2) Bi 3) Be 4) At 5) Ba
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
22. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их неметаллических свойств.
1) Cl 2) S 3) Li 4) At 5) Al
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
23. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Cs 2) H 3) Sr 4) Sb 5) Te
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
24. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Ge 2) Al 3) Ca 4) Br 5) Ba
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
25. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их неметаллических свойств.
1) Cl 2) Rb 3) Te 4) F 5) Sn
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
26. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Br 2) At 3) Bi 4) Mg 5) Cs
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
27. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их неметаллических свойств.
1) I 2) S 3) Al 4) Na 5) At
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
28. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) C 2) Ca 3) As 4) Be 5) Ga
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
29. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Ba 2) In 3) Pb 4) Si 5) Cs
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
30. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Rb 2) Ge 3) Cs 4) Po 5) At
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
31. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) H 2) I 3) Se 4) Rb 5) Sb
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
32. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их неметаллических свойств.
1) K 2) Se 3) Ge 4) O 5) P
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
33. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Cl 2) Pb 3) Ca 4) Si 5) Mg
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
34. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Na 2) F 3) H 4) Mg 5) Si
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
35. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Sr 2) N 3) Li 4) Bi 5) F
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
36. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Ca 2) C 3) Ba 4) F 5) O
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
37. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Be 2) O 3) B 4) Al 5) H
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
38. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их неметаллических свойств.
1)Br 2) Ca 3) F 4) Al 5) K
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
39. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Cs 2) Cl 3) Tl 4) Li 5) Ba
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
40. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) C 2) Ca 3) Br 4) As 5) Mg
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
5. Задания для проверки
1. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне шесть электронов.
1) Po 2) Cl 3) Na 4) O 5) P
Запишите в поле ответа номера выбранных элементов.
2. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне один электрон.
1) Li 2) C 3) B 4) H 5) Al
Запишите в поле ответа номера выбранных элементов.
3. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне два электрона.
1) Ba 2) Po 3) Bi 4) Sr 5) I
Запишите в поле ответа номера выбранных элементов.
4. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне четыре электрона.
1) Na 2) C 3) F 4) Sn 5) O
Запишите в поле ответа номера выбранных элементов.
5. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне один электрон.
1) Cs 2) P 3) Al 4) Li 5) S
Запишите в поле ответа номера выбранных элементов.
6. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне пять электронов.
1) As 2) Sr 3) P 4) Al 5) Mg
Запишите в поле ответа номера выбранных элементов.
7. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне три электрона.
1) Tl 2) At 3) Li 4) Al 5) Ba
Запишите в поле ответа номера выбранных элементов.
8. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне три электрона.
1) Ga 2) Ca 3) Kr 4) In 5) H
Запишите в поле ответа номера выбранных элементов.
9. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне семь электронов.
1) Cl 2) Sn 3) Sb 4) I 5) Ba
Запишите в поле ответа номера выбранных элементов.
10. Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне один электрон.
1) H 2) O 3) B 4) Li 5) Se
Запишите в поле ответа номера выбранных элементов.
11. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их неметаллических свойств.
1) Po 2) Cl 3) Na 4) O 5) P
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
12. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Li 2) C 3) B 4) H 5) Al
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
13. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Ba 2) Po 3) Bi 4) Sr 5) I
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
14. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Na 2) C 3) F 4) Sn 5) O
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
15. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Cs 2) P 3) Al 4) Li 5) S
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
16. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) As 2) Sr 3) P 4) Al 5) Mg
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
17. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Tl 2) At 3) Li 4) Al 5) Ba
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
18. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) Ga 2) Ca 3) Kr 4) In 5) H
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
19. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их неметаллических свойств.
1) Cl 2) Sn 3) Sb 4) I 5) Ba
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
20. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания их металлических свойств.
1) H 2) O 3) B 4) Li 5) Se
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Вспомните:
- что такое атом;
- из чего состоит атом;
- изменяется ли атом в химических реакциях?
АТОМ — это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Число электронов в ходе химических процессов может изменяться, но заряд ядра всегда остается неизменным. Зная распределение электронов в атоме (строение атома), можно предсказать многие свойства данного химического элемента, а также простых и сложных веществ, в состав которых этот элемент входит.
Содержание
- Структура Периодической системы Менделеева
- Ядро атома. Изотопы
- Распределение электронов в поле ядра атома
- Строение атома и свойства элементов
- Выводы
Структура Периодической системы Менделеева
Строение атома, т. е. состав ядра, распределение электронов вокруг ядра, несложно определить по положению элемента в Периодической системе. В Периодической системе Менделеева химические элементы располагаются в определённой последовательности. Эта последовательность тесно связана со строением атома этих элементов. Каждому химическому элементу в системе присвоен порядковый номер, кроме того, для него можно указать:
- номер периода;
- номер группы;
- вид подгруппы.
Зная точный «адрес» химического элемента, т. е. его группу, подгруппу и номер периода, можно однозначно определить строение его атома.
Период — это горизонтальный ряд химических элементов. В современной Периодической системе семь периодов. Первые три — малые, так как они содержат 2 или 8 элементов:
- 1-й период — Н, Не — 2 элемента;
- 2-й период — Li…Nе — 8 элементов;
- 3-й период — Na…Аr — 8 элементов.
Остальные периоды — большие. Каждый из них содержит 2–3 ряда элементов:
- 4-й период (2 ряда) — К…Кr — 18 элементов;
- 6-й период (3 ряда) — Сs…Rn — 32 элемента. В этот период входит ряд лантаноидов.
Группа — вертикальный ряд химических элементов. Всего групп восемь. Каждая группа состоит из двух подгрупп: главной подгруппы и побочной подгруппы (см. рис. 5).
Главную подгруппу (подгруппу А) образуют химические элементы малых периодов и больших периодов. На рисунке 5 показано, что главную подгруппу пятой группы составляют элементы малых периодов (N, P) и больших периодов (As, Sb, Bi).
Побочную подгруппу (подгруппу Б) образуют химические элементы только больших периодов. В нашем случае это V, Nb, Ta.
Визуально эти подгруппы различить легко: главная подгруппа «высокая», начинается с первого или второго периода. Побочная подгруппа — «низкая», начинается с 4-го периода.
Итак, каждый химический элемент Периодической системы имеет свой адрес:
- период;
- группу;
- подгруппу;
- порядковый номер.
Например, ванадий (V) — это химический элемент 4-го периода, V группы, побочной подгруппы, порядковый номер 23.
Задание 3.1. Укажите период, группу и подгруппу для химических элементов с порядковыми номерами 8, 26, 31, 35, 54.
Задание 3.2. Укажите порядковый номер и название химического элемента, если известно, что он находится:
- в 4-м периоде, VI группе, побочной подгруппе;
- в 5-м периоде, IV группе, главной подгруппе.
Каким образом можно связать эти сведения об элементе со строением его атома?
Ядро атома. Изотопы
Атом состоит из ядра, которое имеет положительный заряд, и электронов, которые имеют отрицательный заряд. В целом атом электронейтрален.
Положительный заряд ядра атома равен порядковому номеру химического элемента.
Ядро атома — сложная частица. В ней сосредоточена почти вся масса атома. Поскольку химический элемент — совокупность атомов с одинаковым зарядом ядра, то около символа элемента указывают (рис. 6).
По этим данным можно определить состав ядра. Ядро состоит из протонов и нейтронов.
- Протон (р) имеет массу, равную 1 (1,0073 а. е. м.) и заряд, равный +1.
- Нейтрон (n) заряда не имеет (нейтрален), а масса его приблизительно равна массе протона (1,0087 а. е. м.).
Какие частицы определяют заряд ядра? Протоны! Причём число протонов равно (по величине) заряду ядра атома, т. е. порядковому номеру:
Число нейтронов определяют по разности между величинами: «масса ядра» и «порядковый номер».
Задание 3.3. Определите состав ядер атомов, если химический элемент находится в:
- 3-м периоде, VII группе, главной подгруппе;
- 4-м периоде, IV группе, побочной подгруппе;
- 5-м периоде, I группе, главной подгруппе.
Обратите внимание, что при определении массового числа ядра атома приходится округлять атомную массу, указанную в Периодической системе! Почему? Ведь массы протона и нейтрона практически целочисленны, а массой электронов можно пренебречь.
Для того,чтобы ответить на этот вопрос, нужно понять:
- Что происходит с атомом в ходе химических процессов;
- Что такое «химический элемент».
В химических процессах обязательно изменяется распределение электронов вокруг ядра или даже изменяется их число. В последнем случае атом отдаёт или принимает электроны и превращается в заряженную частицу — ион. Но в химических реакциях никогда не меняется состав ядра атома, его заряд. Поэтому заряд ядра атома является своеобразным «паспортом» химического элемента.
Химический элемент — совокупность атомов или ионов с одинаковым зарядом ядра.
Для того чтобы разобраться, попробуйте определить, какие из ядер, состав которых указан ниже, принадлежат одному и тому же химическому элементу:
Атомам одного химического элемента принадлежат ядра А и В, так как они содержат одинаковое число протонов, т. е. заряд этих ядер одинаковый. Но ведь у них разная масса! Исследования показывают, что масса атома не оказывает существенного влияния на его химические свойства. Поэтому атомы одного и того же химического элемента (одинаковое число протонов), но с разной массой (разное число нейтронов) являются ИЗОТОПАМИ* этого элемента.
* Слово «изотоп» означает по смыслу «одно место», т. е. все изотопы данного химического элемента находятся в одной клетке ПСХЭ.
В таблице Менделеева указана средняя атомная масса всех природных изотопов данного элемента (Аr). Изотопы и их химические соединения отличаются друг от друга по физическим свойствам, но химические свойства у изотопов одного химического элемента одинаковы. Так, изотоп углерода-14 (14С) имеет такие же химические свойства, как и углерод-12 (12С), который входит в ткани любого живого организма, отличаясь от него только радиоактивностью. Поэтому изотопы применяют для диагностики и лечения различных заболеваний, для научных исследований.
Элемент «водород» встречается в природе в виде трёх изотопов:
Химический элемент «кислород» также представлен тремя природными изотопами:
Задание 3.4. Укажите состав ядер этих изотопов водорода и кислорода.
Если разные вещества содержат атомы одного и того же химического элемента, это не означает, что эти вещества имеют одни те же свойства. Например, химический элемент «хлор» в виде атомарного хлора Cl• разрушает метан, а также атмосферный озон. Тот же элемент в виде молекулярного хлора Cl2 ядовит, активно реагирует с водой, многими металлами, а ионы хлора (химический элемент — тот же!) в составе NaCl химически инертен, а с биологической точки зрения не только безвреден, но и полезен для нас. Эти ионы являются макроэлементами нашей пищи, которые входят в состав крови, желудочного сока. Суточная потребность — до 6 граммов.
Но вернемся к описанию строения атома.
Распределение электронов в поле ядра атома
Как известно, ядро атома в химических процессах не меняется. А что меняется? Общее число электронов и распределение электронов. Общее число электронов определить несложно: оно равно порядковому номеру, т. е. заряду ядра атома:
Электроны имеют отрицательный заряд –1, а масса их ничтожна: 1/1840 от массы протона.
Отрицательно заряженные электроны отталкиваются и поэтому находятся на разных расстояниях от ядра. При этом электроны, имеющие приблизительно равный запас энергии, образуют энергетический уровень.
Число энергетических уровней в атоме равно номеру периода, в котором находится химический элемент. Энергетические уровни условно обозначают так (рис. 7).
Задание 3.5. Определите число энергетических уровней в атомах кислорода, магния, кальция, свинца.
На каждом энергетическом уровне может находиться ограниченное число электронов:
- на первом энергетическом уровне не более 2 электронов;
- на втором энергетическом уровне не более 8 электронов;
- на третьем энергетическом уровне не более 18 электронов.
ЗАПОМНИТЕ ЭТИ ЧИСЛА!
Они показывают, что, например, на втором энергетическом уровне может находиться 2 или 5 или 7 электронов, но не может быть 9 или 12 электронов.
Важно знать, что, независимо от номера энергетического уровня, на внешнем (последнем) уровне не может быть больше восьми электронов. Внешний восьмиэлектронный энергетический уровень является наиболее устойчивым и называется завершённым. Такие энергетические уровни имеются у самых неактивных элементов — благородных газов.
Как определить число электронов на внешнем уровне остальных атомов? Для этого существует простое правило – число внешних электронов равно:
- для элементов главных подгрупп — номеру группы;
- для элементов побочных подгрупп — оно не может быть больше двух (рис. 8).
Например:
Задание 3.6. Укажите число внешних электронов для химических элементов с порядковыми номерами 15, 25, 30, 53.
Задание 3.7. Найдите в Периодической системе химические элементы, в атомах которых имеется завершённый внешний уровень.
Очень важно правильно определять число внешних электронов, так как именно с ними связаны важнейшие свойства атома. Так, в химических реакциях атомы стремятся «приобрести» устойчивый, завершённый внешний уровень (8ē). Для этого атомы, на внешнем уровне которых мало электронов, «предпочитают» их отдать.
Химические элементы, атомы которых способны только отдавать электроны, относятся к МЕТАЛЛАМ. Очевидно, что на внешнем уровне атома металла должно быть мало электронов: 1, 2, 3.
Если на внешнем энергетическом уровне атома много электронов, то такие атомы стремятся принять электроны до завершения внешнего энергетического уровня, т. е. до восьми электронов. Такие элементы относятся к НЕМЕТАЛЛАМ.
Вопрос. К каким элементам (металлам или неметаллам) относятся химические элементы побочных подгрупп? Почему?
Металлы и неметаллы главных подгрупп в таблице Менделеева отделяет линия, которую можно провести от бора к астату. Выше этой линии (и на линии) располагаются неметаллы, ниже — металлы.
Задание 3.8. Определить, к металлам или неметаллам относятся: фосфор, ванадий, кобальт, селен, висмут. Вывод сделайте, определив положение элемента в Периодической системе химических элементов и число электронов на внешнем уровне.
Для того чтобы составить распределение электрона по остальным уровням и подуровням, следует воспользоваться следующим АЛГОРИТМОМ:
- Определить общее число электронов в атоме (по порядковому номеру).
- Определить число энергетических уровней (по номеру периода).
- Определить число внешних электронов (по виду подгруппы и номеру группы).
- Указать число электронов на всех уровнях, кроме предпоследнего.
- Рассчитать число электронов на предпоследнем уровне.
Например, согласно пунктам 1…4 для атома марганца определено:
Получили распределение электронов в атоме марганца (рис. 9):
Задание 3.9. Отработайте алгоритм, составив схемы строения атомов для элементов № 16, 26, 33, 37. Укажите: металлы это или неметаллы? Ответ поясните.
Составляя вышеприведенные схемы строения атома, мы не учитывали, что электроны в атоме занимают не только определённые уровни, но и определённые подуровни каждого уровня. Вид подуровня обозначается латинской буквой: s, p, d.
Число возможных подуровней равно номеру уровня, т. е.
- первый уровень состоит из одного s-подуровня;
- второй уровень состоит из двух подуровней: s и р и т. д.
На каждом подуровне может находиться строго ограниченное число электронов:
- на s-подуровне — не больше 2ē;
- на р-подуровне — не больше 6ē;
- на d-подуровне — не больше 10ē.
Подуровни одного уровня заполняются в строго определённом порядке:
Таким образом, р-подуровнь не может начать заполняться, если не заполнен s-подуровень данного энергетического уровня и т. д. Исходя из этого правила, несложно составить электронную конфигурацию атома марганца (рис. 10).
В целом электронная конфигурация атома марганца выглядит так:
Здесь и далее приняты обозначения (рис. 11).
Задание 3.10. Составьте электронные конфигурации атомов для химических элементов № 16, 26, 33, 37.
Для чего необходимо составлять электронные конфигурации атомов? Для того чтобы определять свойства этих химических элементов!
Для этого следует помнить: в химических процессах участвуют только валентные электроны.
Валентные электроны находятся на внешнем энергетическом уровне и незавершённом d-подуровне предвнешнего уровня.
Определим число валентных электронов для марганца:
или сокращённо:
Строение атома и свойства элементов
Мы получили краткую электронную формулу атома марганца, которая отражает распределение его валентных электронов. Что можно определить по этой формуле?
1. Какие свойства — металла или неметалла — преобладают у этого элемента? Ответ: марганец — металл, так как на внешнем (четвёртом) уровне 2 электрона.
2. Какой процесс характерен для металла? Ответ: всегда только отдача электронов.
3. Какие электроны и сколько их будет отдавать атом марганца? Ответы:
- два внешних электрона (они дальше всех от ядра и слабее притягиваются им);
- семь (2+5) валентных электронов (так как в этом случае на третьем уровне атома останется восемь электронов, т. е. образуется завершённый уже внешний уровень).
Все эти рассуждения и заключения можно отразить при помощи схемы (рис. 12).
Полученные условные заряды атома называются степенью окисления.
Рассматривая строение атомов кислорода и водорода и рассуждая аналогично, можно показать, что типичными степенями окисления для кислорода является –2, а для водорода +1.
Вопрос. С каким из этих химических элементов может образовывать соединения марганец, если учесть полученные выше степени окисления его?
Только с кислородом, так как его атом имеет противоположную по заряду (знаку) степень окисления. В этом случае несложно составить формулы соответствующих оксидов марганца (здесь степени окисления соответствуют валентностям этих химических элементов):
Строение атома марганца подсказывает, что большей степени окисления, чем +7, у марганца быть не может, так как в этом случае пришлось бы затрагивать устойчивый, теперь уже завершённый предвнешний уровень. Поэтому степень окисления +7 является высшей, а соответствующий оксид Мn2О7 — высшим оксидом марганца.
Для закрепления всех этих понятий рассмотрим строение атома теллура и некоторые его свойства (см. рис. 13). Этот рисунок показывает, что теллур относится к неметаллам, так как, во-первых, у него на внешнем уровне шесть электронов и, во-вторых, его символ находится в главной подгруппе выше линии В — At. Поэтому его атом может и принимать (до завершения внешнего уровня, и отдавать электроны. В результате, в отличие от металлов, неметалл теллур может проявлять низшую степень окисления (–2) и образовывать летучие водородные соединения с водородом (Н2Те). Высшая степень окисления атома теллура (+6), как и у металлов соответствует номеру группы и, находясь в этой степени окисления, теллур образует высший оксид ТеО3.
Задание 3.11. Изобразить электронные конфигурации атомов Nа, Rb, Сl, I, Si, Sn. Определить свойства этих химических элементов, формулы их простейших соединений (с кислородом и с водородом).
Сделаем выводы.
- В химических реакциях участвуют только валентные электроны, которые могут находиться только на последних двух уровнях.
- Атомы металлов могут только отдавать эти электроны (все или несколько), принимая положительные степени окисления.
- Атомы неметаллов могут принимать (недостающие до восьми) электроны, получая при этом отрицательные степени окисления, и отдавать валентные электроны (все или несколько), принимая при этом положительные степени окисления.
Возникает вопрос: как составить краткую электронную формулу (распределение валентных электронов), сразу, не составляя длинных электронных конфигураций? Для этого нужно помнить несколько простых правил.
1. Номер периода соответствует числу энергетических уровней у атомов химических элементов этого периода.
2. Номер группы, как правило, совпадает с числом валентных электронов, (исключение составляют только подгруппы меди и железа).
3. Подгруппа (главная или побочная) включает химические элементы, у которых имеется одинаковое распределение валентных электронов, причём в атомах элементов главной и побочной подгруппы электроны распределяются по-разному.
3.1. У элементов главных подгрупп все валентные электроны находятся на внешнем уровне, например:
V группа, главная → 5 валентных электронов
Поэтому для всех химических элементов главной подгруппы пятой группы (пять валентных электронов) распределение этих электронов следующее:
3.2. У элементов побочных подгрупп число внешних электронов не превышает двух, например:
5 валентных электронов ← V группа, побочная → 2 электрона на внешнем уровне*.
* За счёт «провала электрона» число внешних электронов может быть меньше. Но число валентных электронов при этом не меняется, поэтому свойства элемента будут такими же. Эти случаи рассмотрены в Самоучителе второго уровня, часть 1.
Для большинства химических элементов побочных подгрупп, у которых на внешнем энергетическом уровне два электрона, остальные (N – 2) валентные электроны будут находиться на d-подуровне предвнешнего уровня (N – номер группы), например:
Вопрос. Для элементов какой группы составлена такая запись?
Задание 3.12. Составьте краткие электронные формулы для атомов химических элементов № 35 и 42, а затем составьте распределение электронов в этих атомах по алгоритму. Убедитесь, что ваше «предсказание» сбылось.
Сравним теперь свойства химических элементов одной подгруппы, например:
Что общего в строении атомов этих элементов? На внешнем уровне каждого атома по одному электрону — это активные металлы. Металлическая активность связана со способностью отдавать электроны: чем легче отдает электроны атом, тем сильнее выражены его металлические свойства.
Что удерживает электроны в атоме? Притяжение их к ядру. Чем ближе электроны к ядру, тем сильнее они притягиваются ядром атома, тем труднее их «оторвать».
Исходя из этого, сделаем вывод: какой элемент — Nа или Rb — легче отдает внешний электрон? Какой из них является более активным металлом? Очевидно, рубидий, так как его валентные электроны находятся дальше от ядра (и слабее удерживаются ядром).
Вывод. В главных подгруппах сверху вниз металлические свойства усиливаются, так как возрастает радиус атома и валентные электроны слабее притягиваются к ядру.
Сравним свойства:
Оба химических элемента — неметаллы, так как до завершения внешнего уровня не хватает одного электрона, и эти атомы будут активно притягивать недостающий электрон. При этом, чем сильнее притягивает атом неметалла недостающий электрон, тем сильнее проявляются его неметаллические свойства (способность принимать электроны).
За счёт чего происходит притяжение электрона? За счёт положительного заряда ядра атома. Но в таком случае чем ближе электрон к ядру, тем сильнее их взаимное притяжение, тем активнее неметалл.
Сделаем вывод, у какого элемента сильнее выражены неметаллические свойства: у хлора или у йода? Очевидно, у хлора, так как его валентные электроны ближе к ядру.
Вывод. Активность неметаллов в подгруппах сверху вниз убывает, так как возрастает радиус атома и все труднее притянуть недостающие электроны.
Сравним свойства кремния и олова:
На внешнем уровне обоих атомов по четыре электрона. Тем не менее эти элементы в Периодической системе находятся по разные стороны от линии, соединяющей бор и астат (см. правило в уроке 2.1.). Поэтому:
- у кремния, символ которого находится выше линии В–At, сильнее проявляются неметаллические свойства;
- у олова, символ которого находится ниже линии В–At, сильнее проявляются металлические свойства;
Почему? Потому что в атоме олова четыре валентных электрона находятся так далеко от ядра, что присоединение недостающих четырех электронов затруднено, в то время как отдача электронов с пятого энергетического уровня происходит достаточно легко. Для кремния возможны оба процесса, причём первый (приём электронов) — преобладает.
Выводы:
- чем меньше электронов в атоме и чем дальше они от ядра, тем сильнее проявляются металлические свойства;
- чем больше внешних электронов в атоме, чем ближе они к ядру, тем сильнее проявляются неметаллические свойства.
Сравним строение атомов и свойства химических элементов одного периода:
Вопрос. О каком периоде и каких элементах идёт речь?
Видно, что металлические свойства убывают, так как увеличивается число внешних электронов, а неметаллические свойства — возрастают. Если речь идёт о большом периоде, где большинство элементов имеет 2 электрона на внешнем уровне (элементы побочных подгрупп), то в этом случае главной причиной убывания металлических свойств в периоде является уменьшение радиуса атома. Дело в том, что за счёт увеличения заряда ядра в периоде увеличивается сила притяжения электронов к нему и уменьшается радиус атома:
Сравните: r (Ca) = 0,197 нм и r (Zn) = 0,139 нм
Вопрос. Какой из металлов более активен?
Основываясь на этих и других выводах, сформулированных в этой главе, можно для любого химического элемента Периодической системы составить алгоритм описания свойств химического элемента по его положению в Периодической системе.
1. Составить схему строения атома, т. е. определить состав ядра, распределение электронов по энергетическим уровням и подуровням:
- определить общее число электронов в атоме (по порядковому номеру);
- определить число энергетических уровней (по номеру периода);
- определить число внешних электронов (по виду подгруппы и номеру группы);
- указать число электронов на всех энергетических уровнях, кроме предпоследнего;
- рассчитать число электронов на предпоследнем уровне.
2. Определить число валентных электронов и число внешних электронов.
3. Определить, какие свойства — металла или неметалла — сильнее проявляются у данного химического элемента (по положению в ПСХЭ).
4. Определить число отдаваемых (принимаемых) электронов.
5. Определить высшую и низшую степени окисления химического элемента.
6. Составить для этих степеней окисления химические формулы простейших соединений с кислородом и водородом.
7. Определить характер оксида (см. урок 2.1.) и составить уравнения его реакции с водой.
8. Для указанных (пункт 6) веществ составить уравнения характерных реакций (см. урок 2).
Задание 3.13. Составить по данной схеме описания атомов серы, селена, кальция и стронция и свойства этих химических элементов. Какие общие свойства имеют их оксиды? Гидроксиды?
Если вы выполнили упражнения 3.11 и 3.12, то легко заметить, что не только атомы элементов одной подгруппы, но и их соединения имеют общие свойства и похожий состав. Это отражено в Периодическом законе Менделеева: Свойства химических элементов, а также свойства простых и сложных веществ, образованных ими, находятся в периодической зависимости от ЗАРЯДА ЯДЕР ИХ АТОМОВ.
Физический смысл Периодического закона ясен: свойства химических элементов периодически повторяются потому, что периодически повторяются конфигурации валентных электронов (распределение электронов внешнего и предпоследнего уровней).
Так, у химических элементов одной и той же подгруппы одинаковое распределение валентных электронов и, значит, похожие свойства.
Выводы
Строение атома связано с положением элемента в Периодической системе. Зная строение атома, можно предсказать свойства элемента и его соединений. Эти свойства находятся в периодической зависимости от заряда ядер атомов элементов, в соответствии с Периодическим законом Менделеева.
Понятие атом возникло еще в античном мире для обо значения частиц вещества. В переводе с греческого атом означает «неделимый».
Электроны
Ирландский физик Стони на основании опытов пришел к выводу, что электричество переносится мельчайшими частицами, существующими в атомах всех химических элементов. В $1891$ г. Стони предложил эти частицы назвать электронами, что по-гречески означает «янтарь».
Через несколько лет после того, как электрон получил свое название, английский физик Джозеф Томсон и французский физик Жан Перрен доказали, что электроны несут на себе отрицательный заряд. Это наименьший отрицательный заряд, который в химии принят за единицу $(–1)$. Томсон даже сумел определить скорость движения электрона (она равна скорости света — $300 000$ км/с) и массу электрона (она в $1836$ раз меньше массы атома водорода).
Томсон и Перрен соединяли полюса источника тока с двумя металлическими пластинами — катодом и анодом, впаянными в стеклянную трубку, из которой был откачан воздух. При подаче на пластины-электроды напряжения около 10 тысяч вольт в трубке вспыхивал светящийся разряд, а от катода (отрицательного полюса) к аноду (положительному полюсу) летели частицы, которые ученые сначала назвали катодными лучами, а затем выяснили, что это был поток электронов. Электроны, ударяясь об особые вещества, нанесенные, например, на экран телевизора, вызывают свечение.
Был сделан вывод: электроны вырываются из атомов материала, из которого сделан катод.
Свободные электроны или поток их можно получить и другими способами, например, при накаливании металлической проволоки или при падении света на металлы, образованные элементами главной подгруппы I группы таблицы Менделеева (например, цезий).
Состояние электронов в атоме
Под состоянием электрона в атоме понимают совокупность информации об энергии определенного электрона в пространстве, в котором он находится. Мы уже знаем, что электрон в атоме не имеет траектории движения, т.е. можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра. Он может находиться в любой части этого пространства, окружающего ядро, и совокупность различных положений его рассматривают как электронное облако с определенной плотностью отрицательного заряда. Образно это можно представить себе так: если бы удалось через сотые или миллионные доли секунды сфотографировать положение электрона в атоме, как при фотофинише, то электрон на таких фотографиях был бы представлен в виде точки. При наложении бесчисленного множества таких фотографий получилась бы картина электронного облака с наибольшей плотностью там, где этих точек больше всего.
На рисунке показан «разрез» такой электронной плотности в атоме водорода, проходящей через ядро, а штриховой линией ограничена сфера, внутри которой вероятность обнаружения электрона составляет $90%$. Ближайший к ядру контур охватывает область пространства, в которой вероятность обнаружения электрона — $10%$, вероятность обнаружения электрона внутри второго от ядра контура составляет $20%$, внутри третьего — $≈30%$ и т.д. В состоянии электрона есть некая неопределенность. Чтобы охарактеризовать это особое состояние, немецкий физик В. Гейзенберг ввел понятие о принципе неопределенности, т.е. показал, что невозможно определить одновременно и точно энергию и местоположение электрона. Чем точнее определена энергия электрона, тем неопределеннее его положение, и наоборот, определив положение, нельзя определить энергию электрона. Область вероятности обнаружения электрона не имеет четких границ. Однако можно выделить пространство, где вероятность нахождения электрона максимальна.
Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью.
В нем заключено приблизительно $90%$ электронного облака, и это означает, что около $90%$ времени электрон находится в этой части пространства. По форме различают $4$ известных ныне типа орбиталей, которые обозначаются латинскими буквами $s, p, d$ и $f$. Графическое изображение некоторых форм электронных орбиталей представлено на рисунке.
Важнейшей характеристикой движения электрона на определенной орбитали является энергия его связи с ядром. Электроны, обладающие близкими значениями энергии, образуют единый электронный слой, или энергетический уровень. Энергетические уровни нумеруют, начиная от ядра: $1, 2, 3, 4, 5, 6$ и $7$.
Целое число $n$, обозначающее номер энергетического уровня, называют главным квантовым числом.
Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня электроны последующих уровней характеризуются большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внеш него уровня.
Число энергетических уровней (электронных слоев) в атоме равно номеру периода в системе Д. И. Менделеева, к которому принадлежит химический элемент: у атомов элементов первого периода один энергетический уровень; второго периода — два; седьмого периода — семь.
Наибольшее число электронов на энергетическом уровне определяется по формуле:
$N=2n^2,$
где $N$ — максимальное число электронов; $n$ — номер уровня, или главное квантовое число. Следовательно: на первом, ближайшем к ядру энергетическом уровне может находиться не более двух электронов; на втором — не более $8$; на третьем — не более $18$; на четвертом — не более $32$. А как, в свою очередь, устроены энергетические уровни (электронные слои)?
Начиная со второго энергетического уровня $(n = 2)$, каждый из уровней подразделяется на подуровни (подслои), несколько отличающиеся друг от друга энергией связи с ядром.
Число подуровней равно значению главного квантового числа: первый энергетический уровень имеет один под уровень; второй — два; третий — три; четвертый — четыре. Подуровни, в свою очередь, образованы орбиталями.
Каждому значению $n$ соответствует число орбиталей, равное $n^2$. По данным, представленным в таблице, можно проследить связь главного квантового числа $n$ с числом подуровней, типом и числом орбиталей и максимальным числом электронов на подуровне и уровне.
Главное квантовое число, типы и число орбиталей, максимальное число электронов на подуровнях и уровнях.
| Энергетический уровень $(n)$ | Число подуровней, равное $n$ | Тип орбитали | Число орбиталей | Максимальное число электронов | ||
| в подуровне | в уровне, равное $n^2$ | в подуровне | на уровне, равное $n^2$ | |||
| $K(n=1)$ | $1$ | $1s$ | $1$ | $1$ | $2$ | $2$ |
| $L(n=2)$ | $2$ | $2s$ | $1$ | $4$ | $2$ | $8$ |
| $2p$ | $3$ | $6$ | ||||
| $M(n=3)$ | $3$ | $3s$ | $1$ | $9$ | $2$ | $18$ |
| $3p$ | $3$ | $6$ | ||||
| $3d$ | $5$ | $10$ | ||||
| $N(n=4)$ | $4$ | $4s$ | $1$ | $16$ | $2$ | $32$ |
| $4p$ | $3$ | $6$ | ||||
| $4d$ | $5$ | $10$ | ||||
| $4f$ | $7$ | $14$ |
Подуровни принято обозначать латинскими буквами, равно как и форму орбиталей, из которых они состоят: $s, p, d, f$. Так:
- $s$-подуровень — первый, ближайший к ядру атома подуровень каждого энергетического уровня, состоит из одной $s$-орбитали;
- $р$-подуровень — второй подуровень каждого, кроме первого, энергетического уровня, состоит из трех $р$-орбиталей;
- $d$-подуровень — третий подуровень каждого, начиная с третьего, энергетического уровня, состоит из пяти $d$-орбиталей;
- $f$-подуровень каждого, начиная с четвертого, энергетического уровня, состоит из семи $f$-орбиталей.
Ядро атома
Но не только электроны входят в состав атомов. Физик Анри Беккерель обнаружил, что природный минерал, содержащий соль урана, тоже испускает неведомое излучение, засвечивая фотопленки, закрытые от света. Это явление было названо радиоактивностью.
Различают три вида радиоактивных лучей:
- $α$-лучи, которые состоят из $α$-частиц, имеющих заряд в $2$ раза больше заряда электрона, но с положительным знаком, и массу в $4$ раза больше массы атома водорода;
- $β$-лучи представляют собой поток электронов;
- $γ$-лучи — электромагнитные волны с ничтожно малой массой, не несущие электрического заряда.
Следовательно, атом имеет сложное строение — состоит из положительно заряженного ядра и электронов.
Как же устроен атом?
В 1910 г. в Кембридже, близ Лондона, Эрнест Резерфорд со своими учениками и коллегами изучал рассеяние $α$-частиц, проходящих через тоненькую золотую фольгу и падаюших на экран. Альфа-частицы обычно отклонялись от первоначального направления всего на один градус, подтверждая, казалось бы, равномерность и однородность свойств атомов золота. И вдруг исследователи заметили, что некоторые $α$-частицы резко меняли направление своего пути, будто наталкиваясь на какую-то преграду.
Разместив экран перед фольгой, Резерфорд сумел обнаружить даже те редчайшие случаи, когда $α$-частицы, отразившись от атомов золота, летели в противоположном направлении.
Расчеты показали, что наблюдаемые явления могли произойти, если бы вся масса атома и весь его положительный заряд были сосредоточены в крохотном центральном ядре. Радиус ядра, как выяснилось, в 100 000 раз меньше радиуса всего атома, той его области, в которой находятся электроны, имеющие отрицательный заряд. Если применить образное сравнение, то весь объем атома можно уподобить стадиону в Лужниках, а ядро — футбольному мячу, расположенному в центре поля.
Атом любого химического элемента сравним с крохотной Солнечной системой. Поэтому такую модель атома, предложенную Резерфордом, называют планетарной.
Протоны и нейтроны
Оказывается, и крошечное атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов — протонов и нейтронов.
Протоны имеют заряд, равный заряду электронов, но противоположный по знаку $(+1)$, и массу, равную массе атома водорода (она принята в химии за единицу). Обо значаются протоны знаком $↙{1}↖{1}p$ (или $р+$). Нейтроны не несут заряда, они нейтральны и имеют массу, равную массе протона, т.е. $1$. Обозначают нейтроны знаком $↙{0}↖{1}n$ (или $n^0$).
Протоны и нейтроны вместе называют нуклонами (от лат. nucleus — ядро).
Сумма числа протонов и нейтронов в атоме называется массовым числом. Например, массовое число атома алюминия:
Так как массой электрона, ничтожно малой, можно пренебречь, то очевидно, что в ядре сосредоточена вся масса атома. Электроны обозначают так: $e↖{-}$.
Поскольку атом электронейтрален, также очевидно, что число протонов и электронов в атоме одинаково. Оно равно порядковому номеру химического элемента, присвоенному ему в Периодической системе. Например, в ядре атома железа содержится $26$ протонов, а вокруг ядра вращается $26$ электронов. А как определить число ней тронов?
Как известно, масса атома складывается из массы протонов и нейтронов. Зная порядковый номер элемента $(Z)$, т.е. число протонов, и массовое число $(А)$, равное сумме чисел протонов и нейтронов, можно найти число нейтронов $(N)$ по формуле:
$N=A-Z$
Например, число нейтронов в атоме железа равно:
$56 – 26 = 30$.
В таблице представлены основные характеристики элементарных частиц.
Основные характеристики элементарных частиц.
| Частица и ее обозначение | Масса | Заряд | Примечание |
| Протон — $p^+$ | $1$ | $+1$ | Число протонов равно порядковому номеру элемента |
| Нейтрон — $n^0$ | $1$ | $0$ | Число нейтронов находят по формуле: $N=A-Z$ |
| Электрон — $e↖{-}$ | ${1}/{1837}$ | $-1$ | Число электронов равно порядковому номеру элемента |
Изотопы
Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами.
Слово изотоп состоит из двух греческих слов: isos — одинаковый и topos — место, обозначает «занимающий одно место» (клетку) в Периодической системе элементов.
Химические элементы, встречающиеся в природе, являются смесью изотопов. Так, углерод имеет три изотопа с массой $12, 13, 14$; кислород — три изотопа с массой $16, 17, 18$ и т. д.
Обычно приводимая в Периодической системе относительная атомная масса химического элемента является средним значением атомных масс природной смеси изотопов данного элемента с учетом их относительного содержания в природе, поэтому значения атомных масс довольно часто являются дробными. Например, атомы природного хлора представляют собой смесь двух изотопов — $35$ (их в природе $75%$) и $37$ (их $25%$); следовательно, относительная атомная масса хлора равна $35.5$. Изотопы хлора записываются так:
$↖{35}↙{17}{Cl}$ и $↖{37}↙{17}{Cl}$
Химические свойства изотопов хлора совершенно одинаковы, как и изотопов большинства химических элементов, например калия, аргона:
$↖{39}↙{19}{K}$ и $↖{40}↙{19}{K}$, $↖{39}↙{18}{Ar}$ и $↖{40}↙{18}{Ar}$
Однако изотопы водорода сильно различаются по свойствам из-за резкого кратного увеличения их относительной атомной массы; им даже присвоены индивидуальные названия и химические знаки: протий — $↖{1}↙{1}{H}$; дейтерий — $↖{2}↙{1}{H}$, или $↖{2}↙{1}{D}$; тритий — $↖{3}↙{1}{H}$, или $↖{3}↙{1}{T}$.
Теперь можно дать современное, более строгое и научное определение химическому элементу.
Химический элемент — это совокупность атомов с одинаковым зарядом ядра.
Строение электронных оболочек атомов элементов первых четырех периодов
Рассмотрим отображение электронных конфигураций атомов элементов по периодам системы Д. И. Менделеева.
Элементы первого периода.
Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).
Электронные формулы атомов показывают распределение электронов по энергетическим уровням и под уровням.
Графические электронные формулы атомов показывают распределение электронов не только по уровням и под уровням, но и по орбиталям.
В атоме гелия первый электронный слой завершен — в нем $2$ электрона.
Водород и гелий — $s$-элементы, у этих атомов заполняется электронами $s$-орбиталь.
Элементы второго периода.
У всех элементов второго периода первый электронный слой заполнен, и электроны заполняют $s-$ и $р$-орбитали второго электронного слоя в соответствии с принципом наименьшей энергии (сначала $s$, а затем $р$) и правилами Паули и Хунда.
В атоме неона второй электронный слой завершен — в нем $8$ электронов.
Элементы третьего периода.
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать 3s-, 3р- и 3d-под уровни.
Строение электронных оболочек атомов элементов третьего периода.
У атома магния достраивается $3,5$-электронная орбиталь. $Na$ и $Mg$ — $s$-элементы.
У алюминия и последующих элементов заполняется электронами $3d$-подуровень.
В атоме аргона на внешнем слое (третьем электронном слое) $8$ электронов. Как внешний слой завершен, но всего в третьем электронном слое, как вы уже знаете, может быть 18 электронов, а это значит, что у элементов третьего периода остаются незаполненными $3d$-орбитали.
Все элементы от $Al$ до $Ar$ — $р$-элементы.
$s-$ и $р$-элементы образуют главные подгруппы в Периодической системе.
Элементы четвертого периода.
У атомов калия и кальция появляется четвертый электронный слой, заполняется $4s$-подуровень, т.к. он имеет меньшую энергию, чем $3d$-подуровень. Для упрощения графических электронных формул атомов элементов четвертого периода:
- обозначим условно графическую электронную формулу аргона так: $Ar$;
- не будем изображать подуровни, которые у этих атомов не заполняются.
$К, Са$ — $s$-элементы, входящие в главные подгруппы. У атомов от $Sc$ до $Zn$ заполняется электронами 3d-подуровень. Это $3d$-элементы. Они входят в побочные подгруппы, у них заполняется предвнешний электронный слой, их относят к переходным элементам.
Обратите внимание на строение электронных оболочек атомов хрома и меди. В них происходит «провал» одного электрона с $4s-$ на $3d$-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций $3d^5$ и $3d^{10}$:
$↙{24}{Cr}$ $1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{4} 4s^{2}…$
$↙{29}{Cu}$ $1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{9}4s^{2}…$
| Символ элемента, порядковый номер, название | Схема электронного строения | Электронная формула | Графическая электронная формула |
| $↙{19}{K}$ Калий | 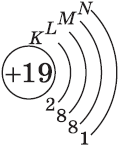 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^1$ | 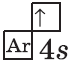 |
| $↙{20}{C}$ Кальций | 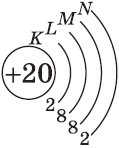 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2$ | 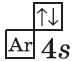 |
| $↙{21}{Sc}$ Скандий | 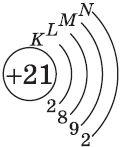 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^1{3}d^1$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^1{4}s^1$ | 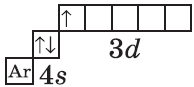 |
| $↙{22}{Ti}$ Титан | 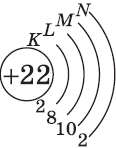 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^2$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^2{4}s^2$ | 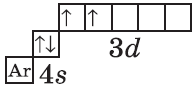 |
| $↙{23}{V}$ Ванадий | 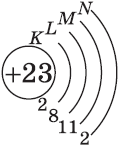 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^3$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^3{4}s^2$ | 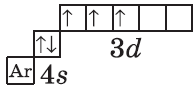 |
| $↙{24}{Сr}$ Хром | 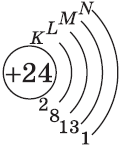 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^1{3}d^5$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^5{4}s^1$ | 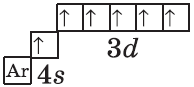 |
| $↙{29}{Сu}$ Хром | 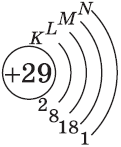 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^1{3}d^{10}$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^{10}{4}s^1$ | 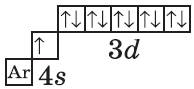 |
| $↙{30}{Zn}$ Цинк | 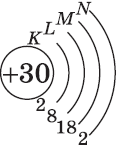 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^{10}$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^{10}{4}s^2$ | 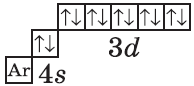 |
| $↙{31}{Ga}$ Галлий | 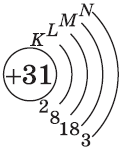 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^{10}4p^{1}$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^{10}{4}s^{2}4p^{1}$ | 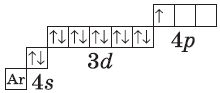 |
| $↙{36}{Kr}$ Криптон | 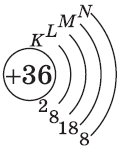 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^{10}4p^6$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^{10}{4}s^{2}4p^6$ | 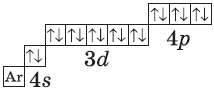 |
В атоме цинка третий электронный слой завершен — в нем заполнены все подуровни $3s, 3р$ и $3d$, всего на них $18$ электронов.
У следующих за цинком элементов продолжает заполняться четвертый электронный слой, $4р$-подуровень. Элементы от $Ga$ до $Кr$ — $р$-элементы.
У атома криптона внешний (четвертый) слой завершен, имеет $8$ электронов. Но всего в четвертом электронном слое, как вы знаете, может быть $32$ электрона; у атома криптона пока остаются незаполненными $4d-$ и $4f$-подуровни.
У элементов пятого периода идет заполнение подуровней в следующем порядке: $5s → 4d → 5р$. И также встречаются исключения, связанные с «провалом» электронов, у $↙{41}Nb$, $↙{42}Мо$, $↙{44}Ru$, $↙{45}Rh$, $↙{46}Pd$, $↙{47}Ag$. В шестом и седьмом периодах появляются $f$-элементы, т.е. элементы, у которых идет заполнение соответственно $4f-$ и $5f$-подуровней третьего снаружи электронного слоя.
$4f$-элементы называют лантаноидами.
$5f$-элементы называют актиноидами.
Порядок заполнения электронных подуровней в атомах элементов шестого периода: $↙{55}Cs$ и $↙{56}Ва$ — $6s$-элементы; $↙{57}La … 6s^{2}5d^{1}$ — $5d$-элемент; $↙{58}Се$ – $↙{71}Lu — 4f$-элементы; $↙{72}Hf$ – $↙{80}Hg — 5d$-элементы; $↙{81}Т1$ – $↙{86}Rn — 6d$-элементы. Но и здесь встречаются элементы, у которых нарушается порядок заполнения электронных орбиталей, что, например, связано с большей энергетической устойчивостью наполовину и полностью заполненных $f$-подуровней, т.е. $nf^7$ и $nf^{14}$.
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы, как вы уже поняли, делят на четыре электронных семейства, или блока:
- $s$-элементы; электронами заполняется $s$-подуровень внешнего уровня атома; к $s$-элементам относятся водород, гелий и элементы главных подгрупп I и II групп;
- $р$-элементы; электронами заполняется $р$-подуровень внешнего уровня атома; к $р$-элементам относятся элементы главных подгрупп III–VIII групп;
- $d$-элементы; электронами заполняется $d$-подуровень предвнешнего уровня атома; к $d$-элементам относятся элементы побочных подгрупп I–VIII групп, т.е. элементы вставных декад больших периодов, расположенных между $s-$ и $р-$элементами. Их также называют переходными элементами;
- $f$-элементы; электронами заполняется $f-$подуровень третьего снаружи уровня атома; к ним относятся лантаноиды и актиноиды.
Электронная конфигурация атома. Основное и возбужденное состояние атомов
Швейцарский физик В. Паули в $1925$ г. установил, что в атоме на одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины (в переводе с английского — веретено), т.е. обладающих такими свойствами, которые условно можно представить себе как вращение электрона вокруг своей воображаемый оси по часовой стрелке или против. Этот принцип носит название принципа Паули.
Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, т.е. электроны с противоположными спинами.
На рисунке показана схема деления энергетических уровней на подуровни.
$s-$Орбиталь, как вы уже знаете, имеет сферическую форму. Электрон атома водорода $(n = 1)$ располагается на этой орбитали и неспарен. По этому его электронная формула, или электронная конфигурация, записывается так: $1s^1$. В электронных формулах номер энергетического уровня обозначается цифрой, стоящей перед буквой $(1…)$, латинской буквой обозначают подуровень (тип орбитали), а цифра, которая записывается справа сверху от буквы (как показатель степени), показывает число электронов на подуровне.
Для атома гелия Не, имеющего два спаренных электрона на одной $s-$орбитали, эта формула: $1s^2$. Электронная оболочка атома гелия завершена и очень устойчива. Гелий — это благородный газ. На втором энергетическом уровне $(n = 2)$ имеются четыре орбитали, одна $s$ и три $р$. Электроны $s$-орбитали второго уровня ($2s$-орбитали) обладают более высокой энергией, т.к. находятся на большем расстоянии от ядра, чем электроны $1s$-орбитали $(n = 2)$. Вообще для каждого значения $n$ существует одна $s-$орбиталь, но с соответствующим запасом энергии электронов на нем и, следовательно, с соответствующим диаметром, растущим по мере увеличения значения $n$.$s-$Орбиталь, как вы уже знаете, имеет сферическую форму. Электрон атома водорода $(n = 1)$ располагается на этой орбитали и неспарен. По этому его электронная формула, или электронная конфигурация, записывается так: $1s^1$. В электронных формулах номер энергетического уровня обозначается цифрой, стоящей перед буквой $(1…)$, латинской буквой обозначают подуровень (тип орбитали), а цифра, которая записывается справа сверху от буквы (как показатель степени), показывает число электронов на подуровне.
Для атома гелия $Не$, имеющего два спаренных электрона на одной $s-$орбитали, эта формула: $1s^2$. Электронная оболочка атома гелия завершена и очень устойчива. Гелий — это благородный газ. На втором энергетическом уровне $(n = 2)$ имеются четыре орбитали, одна $s$ и три $р$. Электроны $s-$орбитали второго уровня ($2s$-орбитали) обладают более высокой энергией, т.к. находятся на большем расстоянии от ядра, чем электроны $1s$-орбитали $(n = 2)$. Вообще для каждого значения $n$ существует одна $s-$орбиталь, но с соответствующим запасом энергии электронов на нем и, следовательно, с соответствующим диаметром, растущим по мере увеличения значения $n$.
$р-$Орбиталь имеет форму гантели, или объемной восьмерки. Все три $р$-орбитали расположены в атоме взаимно перпендикулярно вдоль пространственных координат, проведенных через ядро атома. Следует подчеркнуть еще раз, что каждый энергетический уровень (электронный слой), начиная с $n= 2$, имеет три $р$-орбитали. С увеличением значения $n$ электроны занимают $р$-орбитали, расположенные на больших расстояниях от ядра и направленные по осям $x, y, z$.
У элементов второго периода $(n = 2)$ заполняется сначала одна $s$-орбиталь, а затем три $р$-орбитали; электронная формула $Li: 1s^{2}2s^{1}$. Электрон $2s^1$ слабее связан с ядром атома, поэтому атом лития может легко отдавать его (как вы, очевидно, помните, этот процесс называется окислением), превращаясь в ион лития $Li^+$.
В атоме бериллия Be четвертый электрон также размещается на $2s$-орбитали: $1s^{2}2s^{2}$. Два внешних электрона атома бериллия легко отрываются — $В^0$ при этом окисляется в катион $Ве^{2+}$.
У атома бора пятый электрон занимает $2р$-орбиталь: $1s^{2}2s^{2}2p^{1}$. Далее у атомов $C, N, O, F$ идет заполнение $2р$-орбиталей, которое заканчивается у благородного газа неона: $1s^{2}2s^{2}2p^{6}$.
У элементов третьего периода заполняются соответственно $3s-$ и $3р$-орбитали. Пять $d$-орбиталей третьего уровня при этом остаются свободными:
$↙{11}Na 1s^{2}2s^{2}2p^{6}3s^{1}$,
$↙{17}Cl 1s^{2}2s^{2}2p^{6}3s^{2}3p^{5}$,
$↙{18}Ar 1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}$.
Иногда в схемах, изображающих распределение электронов в атомах, указывают только число электронов на каждом энергетическом уровне, т.е. записывают сокращенные электронные формулы атомов химических элементов, в отличие от приведенных выше полных электронных формул, например:
$↙{11}Na 2, 8, 1;$ $↙{17}Cl 2, 8, 7;$ $↙{18}Ar 2, 8, 8$.
У элементов больших периодов (четвертого и пятого) первые два электрона занимают соответственно $4s-$ и $5s$-орбитали: $↙{19}K 2, 8, 8, 1;$ $↙{38}Sr 2, 8, 18, 8, 2$. Начиная с третьего элемента каждого большого периода, последующие десять электронов поступят на предыдущие $3d-$ и $4d-$орбитали соответственно (у элементов побочных подгрупп): $↙{23}V 2, 8, 11, 2;$ $↙{26}Fr 2, 8, 14, 2;$ $↙{40}Zr 2, 8, 18, 10, 2;$ $↙{43}Tc 2, 8, 18, 13, 2$. Как правило, когда будет заполнен предыдущий $d$-подуровень, начнет заполняться внешний (соответственно $4р-$ и $5р-$) $р-$подуровень: $↙{33}As 2, 8, 18, 5;$ $↙{52}Te 2, 8, 18, 18, 6$.
У элементов больших периодов — шестого и незавершенного седьмого — электронные уровни и подуровни заполняются электронами, как правило, так: первые два электрона поступают на внешний $s-$подуровень: $↙{56}Ba 2, 8, 18, 18, 8, 2;$ $↙{87}Fr 2, 8, 18, 32, 18, 8, 1$; следующий один электрон (у $La$ и $Са$) на предыдущий $d$-подуровень: $↙{57}La 2, 8, 18, 18, 9, 2$ и $↙{89}Ac 2, 8, 18, 32, 18, 9, 2$.
Затем последующие $14$ электронов поступят на третий снаружи энергетический уровень, на $4f$ и $5f$-орбитали соответственно лантоноидов и актиноидов: $↙{64}Gd 2, 8, 18, 25, 9, 2;$ $↙{92}U 2, 8, 18, 32, 21, 9, 2$.
Затем снова начнет застраиваться второй снаружи энергетический уровень ($d$-подуровень) у элементов побочных подгрупп: $↙{73}Ta 2, 8, 18, 32, 11, 2;$ $↙{104}Rf 2, 8, 18, 32, 32, 10, 2$. И, наконец, только после полного заполнения десятью электронами $d$-подуровня будет снова заполняться $р$-под уровень: $↙{86}Rn 2, 8, 18, 32, 18, 8$.
Очень часто строение электронных оболочек атомов изображают с помощью энергетических, или квантовых ячеек — записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули, согласно которому в ячейке (орбитали) может быть не более двух электронов, но с антипараллельными спинами, и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки сначала по одному и имеют при этом одинаковое значение спина, и лишь затем спариваются, но спины при этом, по принципу Паули, будут уже противоположно направленными.
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
Атом (греч: atomos – неделимый) – химически неделимая нейтральная частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
Атомное ядро – состоит из нуклонов (лат. nucleus ядро ): протонов (греч. protos – первый) и нейтронов (греч. neitrum – ни то, ни другое).
Электронная оболочка – совокупность движущихся вокруг ядра отрицательно заряженных электронов.
Протон (p⁺) — частица в составе ядра, имеет положительный заряд, относительную массу 1, 0073.
Число протонов равно порядковому номеру и обозначается Z – заряд ядра.
Нейтрон (n⁰) – частица в составе ядра. Не имеет заряда. Относительная масса 1,0087.
Число нейтронов обозначается буквой N. Может меняться в атомах одного и того же элемента.
Электрон (е) – частица в составе электронной оболочки. Имеет отрицательный заряд, равный по величине, но противоположный по знаку заряду протона. Масса электрона примерно в 2000 раз меньше массы протона и практически не влияет на массу атома.
Так как атом — электронейтральная частица, то число протонов равно числу электронов
(число р⁺ = числу е):
N(e) = N(p⁺) = Z
Массовое число А (относительная атомная масса) складывается из числа протонов и нейтронов в ядре данного атома.
Число нейтронов равно разности массового числа и заряда ядра.
А = N(p⁺) + N(nº)
N(nº) = A – Z
Строение атома
Планетарная модель атома
Химический элемент – вид атомов с определѐнным зарядом ядра (количеством протонов).
Количество протонов неизменно, количество нейтронов может меняться.
Атомы с одинаковым зарядом ядра (количеством протонов), но разным числом нейтронов в ядре, т.е. разной массой, называются изотопами (нуклидами).
Один и тот же элемент может существовать в виде двух или нескольких изотопов. Все изотопы одного и того же элемента химически неотличимы.
Электронное строение атома
Электрон — уникальная элементарная частица: обладая свойствами, отличающими его от всех других частиц, он одновременно является и частицей, и волной, т.е. имеет двойственную природу.
С одной стороны, обладая малой массой, электрон проявляет свойства частицы. С другой стороны, электрон движется с такой высокой скоростью, что фактически «размазан» по атому, он находится не в одной конкретной точке, а образует «электронное облако».
Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона называется электронной орбиталью.
КВАНТОВЫЕ ЧИСЛА
Состояние электрона в атоме описывается 4 квантовыми числами:
- Главное квантовое число n;
- Побочное (орбитальное) квантовое число l;
- Магнитное квантовое число ml;
- Спиновое квантовое число ms.
- ГЛАВНОЕ КВАНТОВОЕ ЧИСЛО — n.
Главное квантовое число — n — определяет энергетический уровень электрона (равно номеру периода).
Главное квантовое число принимает любые целочисленные значения, начиная с n=1 (n=1,2,3,…) и соответствует номеру периода.
- ОРБИТАЛЬНОЕ КВАНТОВОЕ ЧИСЛО l
Определяет геометрическую форму атомной орбитали. Принимает любые целочисленные значения с l = 0 (l = n -1)
- МАГНИТНОЕ КВАНТОВОЕ ЧИСЛО
определяет ориентацию орбитали в пространстве (ml). Принимает любые целочисленные значения от -1 до +1, включая 0.
( ml = 2l +1)
Для s-орбитали:
l=0, ml= 1(0) — одна равноценная ориентация в пространстве (одна орбиталь).
Для p-орбитали:
l=1, ml= 3 (-1,0,+1) — три равноценные ориентации в пространстве (три орбитали).
Для d-орбитали:
l=2, ml= 5 (-2,-1,0,1,2) — пять равноценных ориентаций в пространстве (пять орбиталей).
Для f-орбитали:
l=3, ml= 7 (-3,-2,-1,0,1,2,3) — семь равноценных ориентаций в пространстве (семь орбиталей).
- СПИНОВОЕ КВАНТОВОЕ ЧИСЛО – ms
На каждой орбитали могут максимально размещаться два электрона, обладающие равной энергией, но отличающиеся особым свойством, спином.
Графически орбиталь принято изображать в виде квадрата, а электроны — в виде стрелок, направленных вверх или вниз.
Стрелки, направленные в противоположные стороны, означают электроны с двумя противоположными спинами.
Следовательно, электроны в электронной оболочке занимают определенные
уровни (дом),
подуровни (этаж),
орбитали (квартира).
Подуровни состоят из одной или нескольких одинаковых по энергии орбиталей.
На каждой орбитали может быть не больше двух электронов.
На
s-подуровне (одна орбиталь) могут находиться два электрона,
p-подуровне (три орбитали) — шесть электронов ,
d-подуровне (пять орбиталей) — десять электронов.
Элементы, у которых последним заполняется s-подуровень, называются s –элементами, p-подуровень — p –элементами, d-подуровень — d –элементами.
ПРИНЦИПЫ ПОСТРОЕНИЯ ЭЛЕКТРОННОЙ КОНФИГУРАЦИИ ЭЛЕМЕНТА
Количество электронов в атоме элемента равно его порядковому номеру.
Количество энергетических уровней атома равно номеру периода, в котором расположен элемент.
Количество электронов на внешнем (валентном) уровне равно номеру группы, в которой расположен элемент.
При более подробном описании электронной конфигурации рассматривают не только количество электронов на данном энергетическом уровне, но и их распределение по подуровням. Каждая незаполненная орбиталь обозначается пустым квадратиком.
При заполнении орбиталей электронами используют следующие правила.
1. ПРИНЦИП МИНИМУМА ЭНЕРГИИ
Орбитали заполняются в порядке увеличения энергии, снизу вверх. Каждый электрон располагается так, чтобы его энергия была минимальной, т. е. среди свободных орбиталей он выбирает орбиталь с самой низкой энергией.
Порядок заполнения энергетических подуровней (см. рис.) можно запомнить в виде ряда:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d » 4f < 6p < 7s….
2. ПРИНЦИП ПАУЛИ
На каждой орбитали может находиться не более двух электронов. Если два электрона находятся на одной орбитали, то они обладают противоположными спинами (стрелки направлены в разные стороны). Такие электроны называют спаренными. Если на орбитали находится только один электрон, то его называют неспаренным.
3. ПРАВИЛО ХУНДА (ГУНДА)
Атом в основном состоянии должен иметь максимально возможное число неспаренных электронов в пределах определенного подуровня.
4s-орбиталь обладает меньшей энергией, чем 3d-орбиталь, поэтому в первую очередь электроны заполнят 4s-подуровень и лишь затем 3d-подуровень.
Для удобства запоминания порядка заполнения энергетических подуровней лучше воспользоваться следующей схемой: в каждой отдельной строке написать возможные типы орбиталей для каждого уровня, провести стрелки под углом 450 и «расселять» электроны по подуровням, ориентируясь по стрелкам сверху вниз.
ЗАПИСЬ ЭЛЕКТРОННОЙ КОНФИГУРАЦИИ АТОМА
Подробные электронные конфигурации атомов изображают двумя способами:
- графически, с помощью квадратиков со стрелками (часто называют энергетическими диаграммами);
- в строчку, когда перечисляются все занятые энергетические подуровни с указанием общего числа электронов на каждом из них.
Последовательность заполнения орбиталей и максимальное число электронов на каждом подуровне:
ПРОСКОК» ИЛИ «ПРОВАЛ» ЭЛЕКТРОНА
У атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место «провал» электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома.
ВОЗБУЖДЕННОЕ СОСТОЯНИЕ АТОМА
Все электронные конфигурации, о которых мы говорили выше, являются конфигурациями с наименьшей энергией и соответствуют основному состоянию атома.
Получив энергию извне (облучение или нагревание системы), один либо несколько электронов могут переходить на более высокий энергетический подуровень.
Состояние атома, при котором электрон из электронной пары с предыдущего подуровня «распаривается» и переходит на следующий подуровень, называется возбужденным состоянием атома.
ВАЛЕНТНЫЕ ВОЗМОЖНОСТИ
Валентность атома определяется числом неспаренных электронов.
При наличии свободных орбиталей электроны атома могут распариваться, перескакивать на на другой подуровень, т.е. атом переходит в возбужденное состояние, поэтому валентность может быть постоянной и переменной. При этом число неспаренных электронов, а, следовательно, число связей, образуемых атомом, увеличивается.
Высшая валентность всегда равна номеру группы.
Для определения низшей переменной валентности (количества свободных электронов) , которой чаще всего обладают неметаллы, необходимо из 8 вычесть номер группы.
Валентность зависит:
1. От количества электронов на внешнем уровне
2. От количества свободных неспаренных электронов
3. От наличия свободных орбиталей
Электронные формулы ионов
Ионы – заряженные частицы, они получаются из атомов путем отдачи электронов (тогда образуются катионы) или принятия электронов (образуются анионы).
Примеры:
S2- (16+2=18е)
P3+ (15-3=12е)
Na+ (11-1=10е)
Электронная формула иона получается путем добавления или вычитания электронов из электронной формулы атома ( до инертной оболочки – 8е).
1(Б) Тесты ЕГЭ ФИПИ 2015 к теме «Строение атома»



















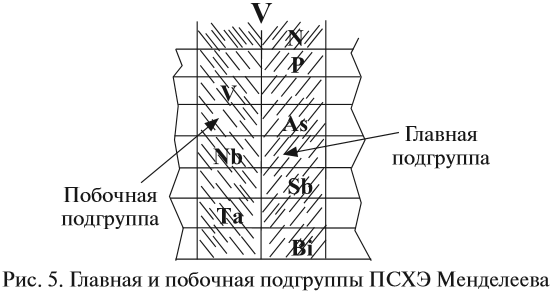
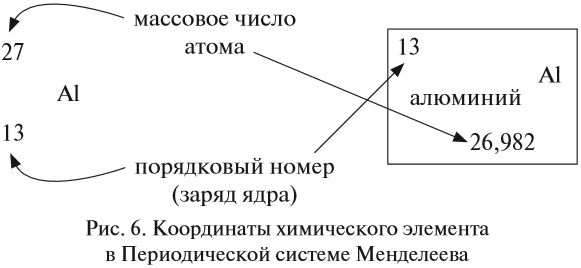
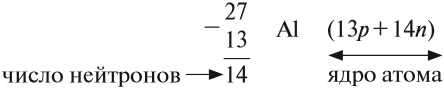
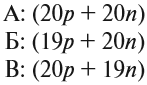
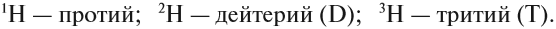
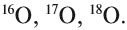

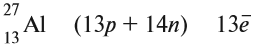
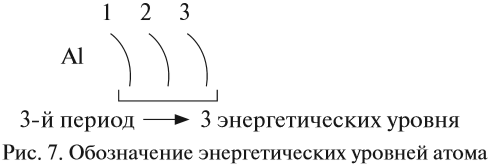
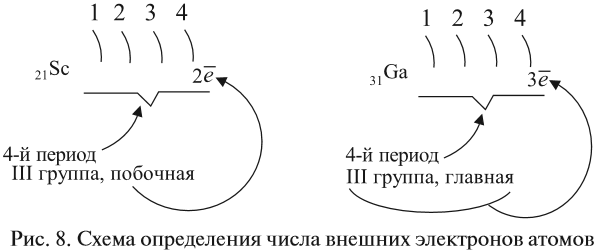

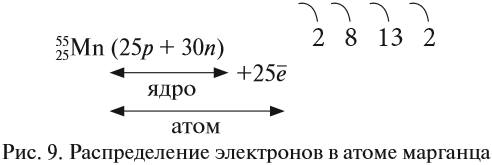
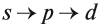
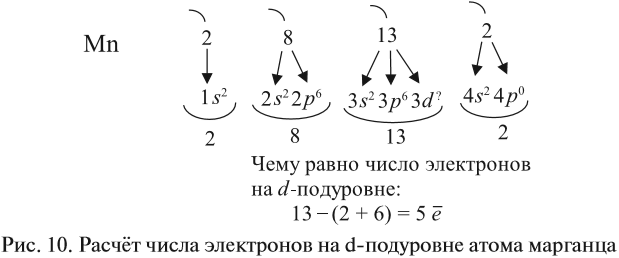
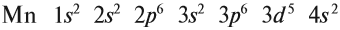
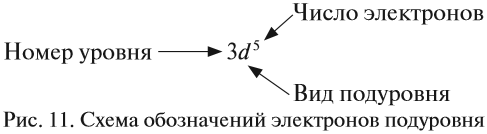

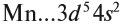

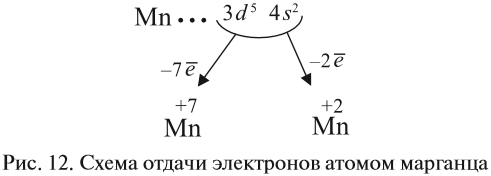
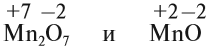

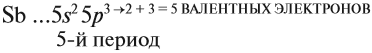
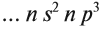
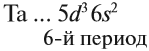
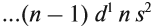
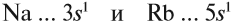
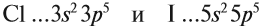

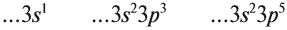

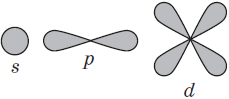
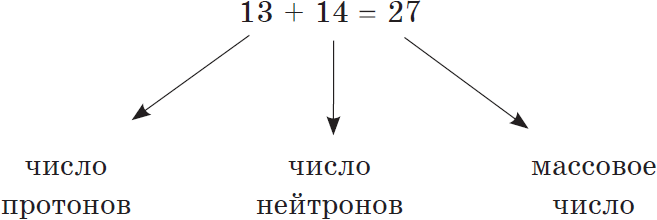
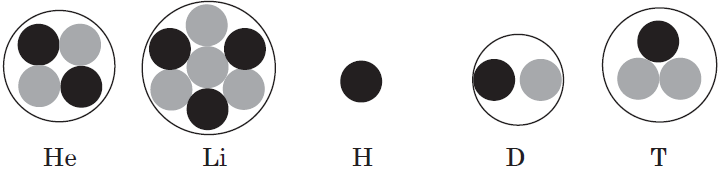
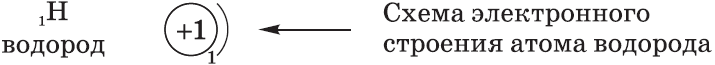
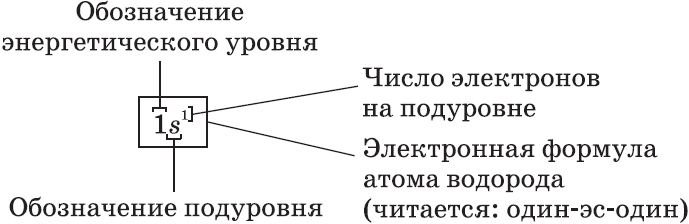
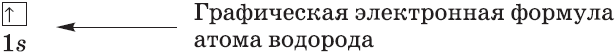

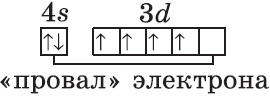
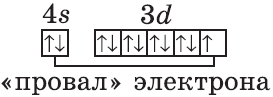
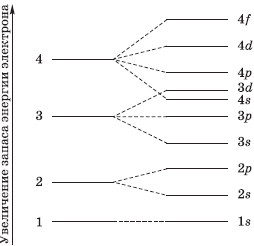
![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)


































