Атомно-молекулярное учение
Мы приступаем к изучению химии — мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными
формулами элементов.
Атом (греч. а — отриц. частица + tomos — отдел, греч. atomos — неделимый) — электронейтральная частица вещества микроскопических
размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом

Протон (греч. protos — первый) — положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов
элементов. Нейтрон (лат. neuter — ни тот, ни другой) — нейтральная (0) элементарная частица, присутствующая в ядрах всех
химических элементов, кроме водорода.
Электрон (греч. elektron — янтарь) — стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома —
порядковый номер в таблице Менделеева — равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20)
в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.

Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило:
порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим
электроны занимают различные энергетические уровни.
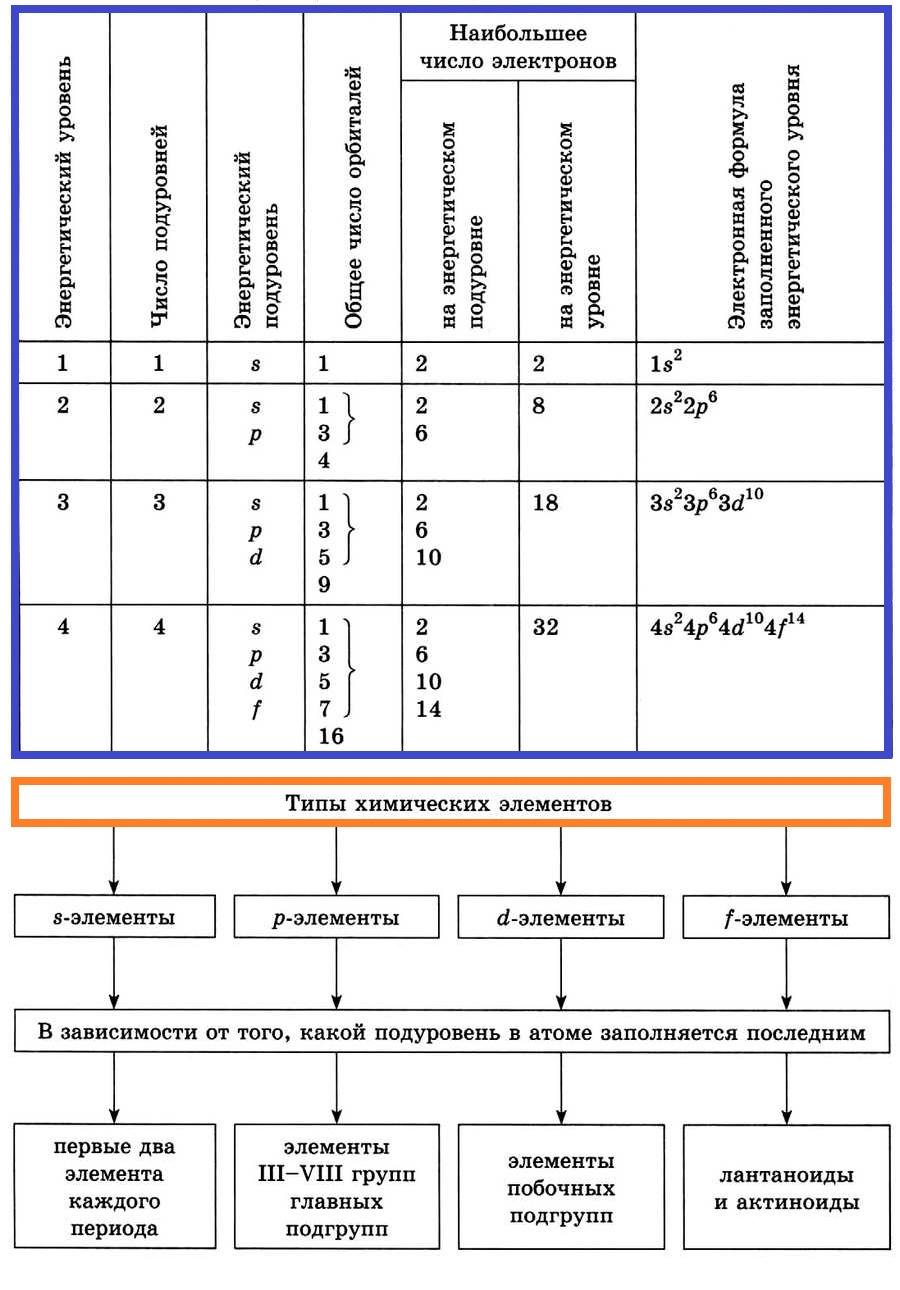
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
- Второй уровень
- Третий уровень
- Четвертый уровень
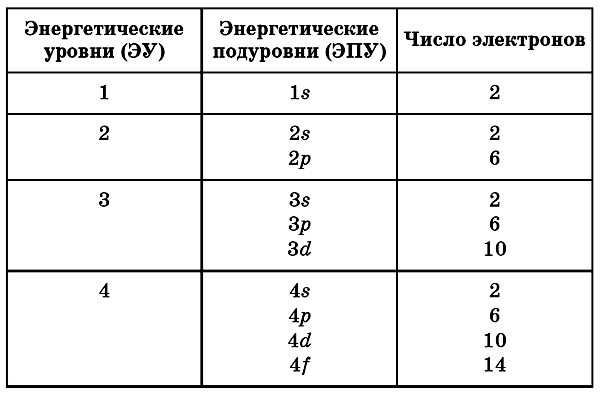
Состоит из s-подуровня: одной «1s» ячейки, в которой помещаются 2 электрона (заполненный электронами — 1s2)
Состоит из s-подуровня: одной «s» ячейки (2s2) и p-подуровня: трех «p» ячеек (2p6), на которых
помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s2), p-подуровня: трех «p» ячеек (3p6) и d-подуровня:
пяти «d» ячеек (3d10), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s2), p-подуровня: трех «p» ячеек (4p6), d-подуровня:
пяти «d» ячеек (4d10) и f-подуровня: семи «f» ячеек (4f14), на которых помещается 14
электронов

Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число
электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а
также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или
атомным орбиталям, движутся электроны, создавая определенный «рисунок».
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь — клеверный лист.

Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной «ячейке») не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются
еще одним электроном с противоположным направлением - Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было
бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и
серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода — 6, у серы — 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.

Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил.
А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся
одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод — 1s22s22p2
- Серы — 1s22s22p63s23p4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне — это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда
для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод — 2s22p2 (4 валентных электрона)
- Сера -3s23p4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью — способностью атомов образовывать определенное число химических связей.

- Углерод — 2s22p2 (2 неспаренных валентных электрона)
- Сера -3s23p4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных
электронов. Ниже будет дано наглядное объяснение этой задаче.

Запишем получившиеся электронные конфигурации магния и скандия:
- Магний — 1s22s22p63s2
- Скандий — 1s22s22p63s23p64s23d1
В целом несложная и интересная тема электронных конфигураций отягощена небольшим исключением — провалом электрона, которое только подтверждает общее
правило: любая система стремится занять наименее энергозатратное состояние.
Провал электрона
Провалом электрона называют переход электрона с внешнего, более высокого энергетического уровня, на предвнешний, энергетически более
низкий. Это связано с большей энергетической устойчивостью получающихся при этом электронных конфигураций.
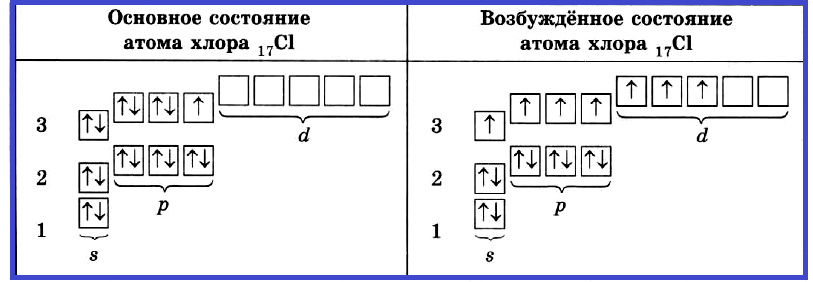
Подобное явление характерно лишь для некоторых элементов: медь, хром, серебро, золото, молибден. Для примера выберем хром, и рассмотрим
две электронных конфигурации: первую «неправильную» (сделаем вид, будто мы не знаем про провал электрона) и вторую правильную, написанную
с учетом провала электрона.
Теперь вы понимаете, что кроется под явлением провала электрона. Запишите электронные конфигурации хрома и меди самостоятельно еще раз и
сверьте с представленными ниже.

Основное и возбужденное состояние атома
Основное и возбужденное состояние атома отражаются на электронных конфигурациях. Возбужденное состояние связано с движением электронов
относительно атомных ядер. Говоря проще: при возбуждении пары электронов распариваются и занимают новые ячейки.
Возбужденное состояние является для атома нестабильным, поэтому долгое время в нем он пребывать не может. У некоторых атомов: азота,
кислорода , фтора — возбужденное состояние невозможно, так как отсутствуют свободные орбитали («ячейки») — электронам некуда перескакивать, к тому
же d-орбиталь у них отсутствует (они во втором периоде).
У серы возможно возбужденное состояние, так как она имеет свободную d-орбиталь, куда могут перескочить электроны. Четвертый энергетический
уровень отсутствует, поэтому, минуя 4s-подуровень, заполняем распаренными электронами 3d-подуровень.
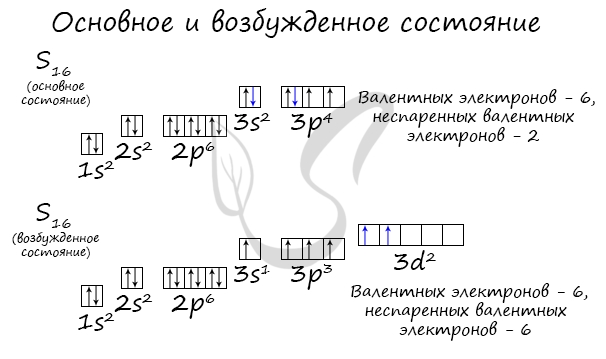
По мере изучения основ общей химии мы еще не раз вернемся к этой теме, однако хорошо, если вы уже сейчас запомните, что возбужденное состояние
связано с распаривание электронных пар.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Темы кодификатора ЕГЭ: Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояние атомов.
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
Одну из первых моделей строения атома — «пудинговую модель» — разработал Д.Д. Томсон в 1904 году. Томсон открыл существование электронов, за что и получил Нобелевскую премию. Однако наука на тот момент не могла объяснить существование этих самых электронов в пространстве. Томсон предположил, что атом состоит из отрицательных электронов, помещенных в равномерно заряженный положительно «суп», который компенсирует заряд электронов (еще одна аналогия — изюм в пудинге). Модель, конечно, оригинальная, но неверная. Зато модель Томсона стала отличным стартом для дальнейших работ в этой области.
И дальнейшая работа оказалась эффективной. Ученик Томсона, Эрнест Резерфорд, на основании опытов по рассеянию альфа-частиц на золотой фольге предложил новую, планетарную модель строения атома.
Согласно модели Резерфорда, атом состоит из массивного, положительно заряженного ядра и частиц с небольшой массой — электронов, которые, как планеты вокруг Солнца, летают вокруг ядра, и на него не падают.
Модель Резерфорда оказалась следующим шагом в изучении строения атома. Однако современная наука использует более совершенную модель, предложенную Нильсом Бором в 1913 году. На ней мы и остановимся подробнее.
Атом — это мельчайшая, электронейтральная, химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
При этом электроны двигаются не по определенной орбите, как предполагал Резерфорд, а довольно хаотично. Совокупность электронов, которые двигаются вокруг ядра, называется электронной оболочкой.
Атомное ядро, как доказал Резерфорд — массивное и положительно заряженное, расположено в центральной части атома. Структура ядра довольно сложна, и изучается в ядерной физике. Основные частицы, из которых оно состоит — протоны и нейтроны. Они связаны ядерными силами (сильное взаимодействие).
Рассмотрим основные характеристики протонов, нейтронов и электронов:
| Протон | Нейтрон | Электрон | |
| Масса | 1,00728 а.е.м. | 1,00867 а.е.м. | 1/1960 а.е.м. |
| Заряд | + 1 элементарный заряд | 0 | — 1 элементарный заряд |
1 а.е.м. (атомная единица массы) = 1,66054·10-27 кг
1 элементарный заряд = 1,60219·10-19 Кл
И — самое главное. Периодическая система химических элементов, структурированная Дмитрием Ивановичем Менделеевым, подчиняется простой и понятной логике: номер атома — это число протонов в ядре этого атома. Причем ни о каких протонах Дмитрий Иванович в XIX веке не слышал. Тем гениальнее его открытие и способности, и научное чутье, которое позволило перешагнуть на полтора столетия вперёд в науке.
Следовательно, заряд ядра Z равен числу протонов, т.е. номеру атома в Периодической системе химических элементов.
Атом — это электронейтральная частица, следовательно, число протонов равно числу электронов: Ne = Np = Z.
Масса атома (массовое число A) примерно равна суммарной массе крупных частиц, которые входят в состав атома — протонов и нейтронов. Поскольку масса протона и нейтрона примерно равна 1 атомной единице массы, можно использовать формулу:
M = Np + Nn
Массовое число указано в Периодической системе химических элементов в ячейке каждого элемента.
Обратите внимание! При решении задач ЕГЭ массовое число всех атомов, кроме хлора, округляется до целого по правилам математики. Массовое число атома хлора в ЕГЭ принято считать равным 35,5.
Таким образом, рассчитать число нейтронов в атоме можно, вычтя из массового числа номер атома: Nn = M – Z.
В Периодической системе собраны химические элементы — атомы с одинаковым зарядом ядра. Однако, может ли меняться у этих атомов число остальных частиц? Вполне. Например, атомы с разным числом нейтронов называют изотопами данного химического элемента. У одного и того же элемента может быть несколько изотопов.
Попробуйте ответить на вопросы. Ответы на них — в конце статьи:
- У изотопов одного элемента массовое число одинаковое или разное?
- У изотопов одно элемента число протонов одинаковое или разное?
Химические свойства атомов определяются строением электронной оболочки и зарядом ядра. Таким образом, химические свойства изотопов одного элемента практически не отличаются.
Поскольку атомы одного элемента могут существовать в форме разных изотопов, в названии часто указывается массовое число, например, хлор-35, и принята такая форма записи атомов:
Еще немного вопросов:
3. Определите количество нейтронов, протонов и электронов в изотопе брома-81.
4. Определите число нейтронов в изотопе хлора-37.
Строение электронной оболочки
Согласно квантовой модели строение атома Нильса Бора, электроны в атоме могут двигаться только по определенным (стационарным) орбитам, удаленным от ядра на определенное расстояние и характеризующиеся определенной энергией. Другое название стационарны орбит — электронные слои или энергетические уровни.
Электронные уровни можно обозначать цифрами — 1, 2, 3, …, n. Номер слоя увеличивается мере удаления его от ядра. Номер уровня соответствует главному квантовому числу n.
В одном слое электроны могут двигаться по разным траекториям. Траекторию орбиты характеризует электронный подуровень. Тип подуровня характеризует орбитальное квантовое число l = 0,1, 2, 3 …, либо соответствующие буквы — s, p, d, g и др.
В рамках одного подуровня (электронных орбиталей одного типа) возможны варианты расположения орбиталей в пространстве. Чем сложнее геометрия орбиталей данного подуровня, тем больше вариантов их расположения в пространстве. Общее число орбиталей подуровня данного типа l можно определить по формуле: 2l+1. На каждой орбитали может находиться не более двух электронов.
| Тип орбитали | s | p | d | f | g |
| Значение орбитального квантового числа l | 0 | 1 | 2 | 3 | 4 |
| Число атомных орбиталей данного типа 2l+1 | 1 | 3 | 5 | 7 | 9 |
| Максимальное количество электронов на орбиталях данного типа | 2 | 6 | 10 | 14 | 18 |
Получаем сводную таблицу:
|
Номер уровня, n |
Подуровень | Число
АО |
Максимальное количество электронов |
| 1 | 1s | 1 | |
| 2 | 2s | 1 | |
| 2p | 3 | ||
|
3 |
3s | 1 | |
| 3p | 3 | ||
| 3d | 5 | ||
|
4 |
4s | 1 | |
| 4p | 3 | ||
| 4d | 5 | ||
| 4f | 7 |
|
Заполнение электронами энергетических орбиталей происходит согласно некоторым основным правилам. Давайте остановимся на них подробно.
Принцип Паули (запрет Паули): на одной атомной орбитали могут находиться не более двух электронов с противоположными спинами (спин — это квантовомеханическая характеристика движения электрона).
Правило Хунда. На атомных орбиталях с одинаковой энергией электроны располагаются по одному с параллельными спинами. Т.е. орбитали одного подуровня заполняются так: сначала на каждую орбиталь распределяется по одному электрону. Только когда во всех орбиталях данного подуровня распределено по одному электрону, занимаем орбитали вторыми электронами, с противоположными спинами.
Таким образом, сумма спиновых квантовых чисел таких электронов на одном энергетическом подуровне (оболочке) будет максимальной.
Например, заполнение 2р-орбитали тремя электронами будет происходить так: , а не так:
Принцип минимума энергии. Электроны заполняют сначала орбитали с наименьшей энергией. Энергия атомной орбитали эквивалентна сумме главного и орбитального квантовых чисел: n + l. Если сумма одинаковая, то заполняется первой та орбиталь, у которой меньше главное квантовое число n.
| АО | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 5g |
| n | 1 | 2 | 2 | 3 | 3 | 3 | 4 | 4 | 4 | 4 | 5 | 5 | 5 | 5 | 5 |
| l | 0 | 0 | 1 | 0 | 1 | 2 | 0 | 1 | 2 | 3 | 0 | 1 | 2 | 3 | 4 |
| n + l | 1 | 2 | 3 | 3 | 4 | 5 | 4 | 5 | 6 | 7 | 5 | 6 | 7 | 8 | 9 |
Таким образом, энергетический ряд орбиталей выглядит так:
1s < 2s < 2 p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f~5d < 6p < 7s <5f~6d …
Электронную структуру атома можно представлять в разных формах — энергетическая диаграмма, электронная формула и др. Разберем основные.
Энергетическая диаграмма атома — это схематическое изображение орбиталей с учетом их энергии. Диаграмма показывает расположение электронов на энергетических уровнях и подуровнях. Заполнение орбиталей происходит согласно квантовым принципам.
Например, энергетическая диаграмма для атома углерода:
Электронная формула — это запись распределения электронов по орбиталям атома или иона. Сначала указывается номер уровня, затем тип орбитали. Верхний индекс справа от буквы показывает число электронов на орбитали. Орбитали указываются в порядке заполнения. Запись 1s2 означает, что на 1 уровне s-подуровне расположено 2 электрона.
Например, электронная формула углерода выглядит так: 1s22s22p2.
Для краткости записи, вместо энергетических орбиталей, полностью заполненных электронами, иногда используют символ ближайшего благородного газа (элемента VIIIА группы), имеющего соответствующую электронную конфигурацию.
Например, электронную формулу азота можно записать так: 1s22s22p3 или так: [He]2s22p3.
1s2 = [He]
1s22s22p6 = [Ne]
1s22s22p63s23p6 = [Ar] и так далее.
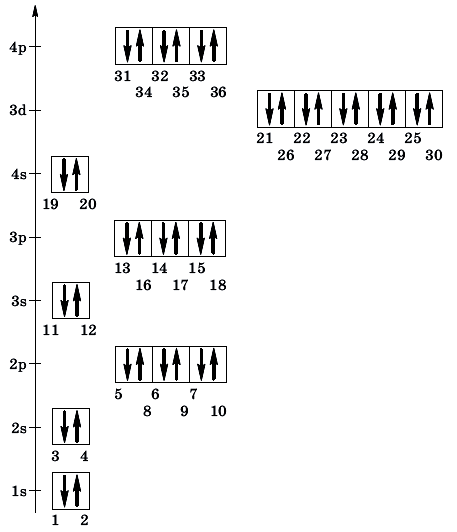
Электронные формулы элементов первых четырех периодов
Рассмотрим заполнение электронами оболочки элементов первых четырех периодов. У водорода заполняется самый первый энергетический уровень, s-подуровень, на нем расположен 1 электрон:
+1H 1s1 1s
У гелия 1s-орбиталь полностью заполнена:
+2He 1s2 1s
Поскольку первый энергетический уровень вмещает максимально 2 электрона, у лития начинается заполнение второго энергетического уровня, начиная с орбитали с минимальной энергией — 2s. При этом сначала заполняется первый энергетический уровень:
+3Li 1s22s1 1s 2s
У бериллия 2s-подуровень заполнен:
+4Be 1s22s2 1s 2s
Далее, у бора заполняется p-подуровень второго уровня:
+5B 1s22s22p1 1s 2s
2p
У следующего элемента, углерода, очередной электрон, согласно правилу Хунда, заполняет вакантную орбиталь, а не заполняет частично занятую:
+6C 1s22s22p2 1s 2s
2p
Попробуйте составить электронную и электронно-графическую формулы для следующих элементов, а затем можете проверить себя по ответам конце статьи:
5. Азот
6. Кислород
7. Фтор
У неона завершено заполнение второго энергетического уровня:
+10Ne 1s22s22p6 1s 2s
2p
У натрия начинается заполнение третьего энергетического уровня:
+11Na 1s22s22p63s1 1s 2s
2p
3s
От натрия до аргона заполнение 3-го уровня происходит в том же порядке, что и заполнение 2-го энергетического уровня. Предлагаю составить электронные формулы элементов от магния до аргона самостоятельно, проверить по ответам.
8. Магний
9. Алюминий
10. Кремний
11. Фосфор
12. Сера
13. Хлор
14. Аргон
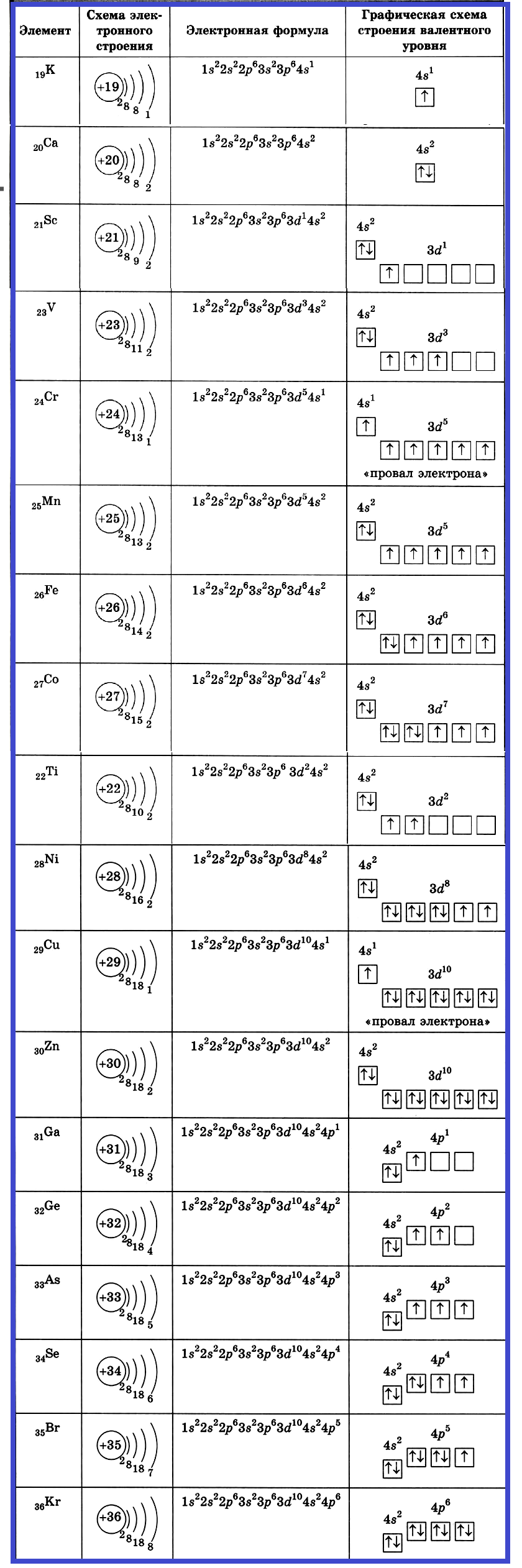
А вот начиная с 19-го элемента, калия, иногда начинается путаница — заполняется не 3d-орбиталь, а 4s. Ранее мы упоминали в этой статье, что заполнение энергетических уровней и подуровней электронами происходит по энергетическому ряду орбиталей, а не по порядку. Рекомендую повторить его еще раз. Таким образом, формула калия:
+19K 1s22s22p63s23p64s11s 2s
2p
3s
3p
4s
Для записи дальнейших электронных формул в статье будем использовать сокращенную форму:
+19K [Ar]4s1 [Ar] 4s
У кальция 4s-подуровень заполнен:
+20Ca [Ar]4s2 [Ar] 4s
У элемента 21, скандия, согласно энергетическому ряду орбиталей, начинается заполнение 3d-подуровня:
+21Sc [Ar]3d14s2 [Ar] 4s 3d
Дальнейшее заполнение 3d-подуровня происходит согласно квантовым правилам, от титана до ванадия:
+22Ti [Ar]3d24s2 [Ar] 4s 3d
+23V [Ar]3d34s2 [Ar] 4s 3d
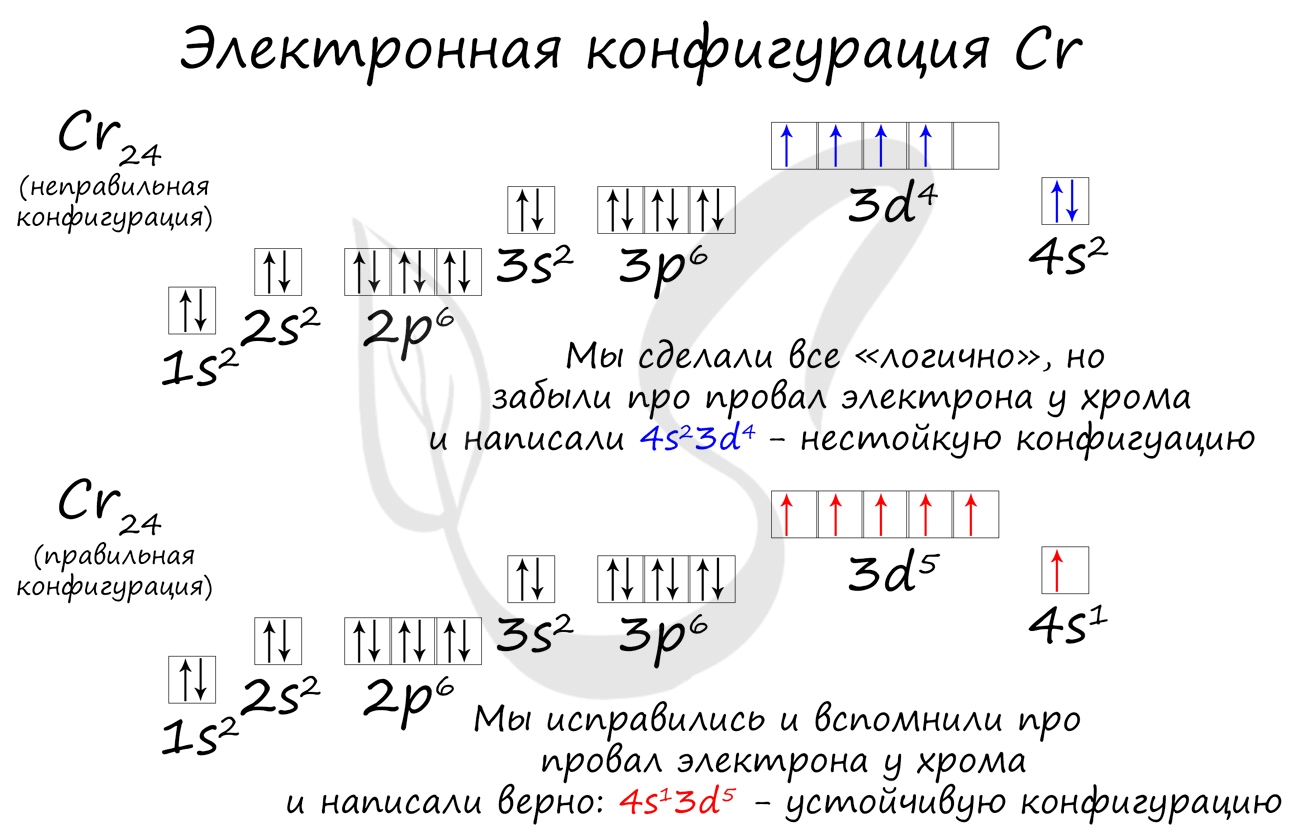
Однако, у следующего элемента порядок заполнения орбиталей нарушается. Электронная конфигурация хрома такая:
+24Cr [Ar]3d54s1 [Ar] 4s 3d
В чём же дело? А дело в том, что при «традиционном» порядке заполнения орбиталей (соответственно, неверном в данном случае — 3d44s2) ровно одна ячейка в d-подуровне оставалась бы незаполненной. Оказалось, что такое заполнение энергетически менее выгодно. А более выгодно, когда d-орбиталь заполнена полностью, хотя бы единичными электронами. Этот лишний электрон переходит с 4s-подуровня. И небольшие затраты энергии на перескок электрона с 4s-подуровня с лихвой покрывает энергетический эффект от заполнения всех 3d-орбиталей. Этот эффект так и называется — «провал» или «проскок» электрона. И наблюдается он, когда d-орбиталь недозаполнена на 1 электрон (по одному электрону в ячейке или по два).
У следующих элементов «традиционный» порядок заполнения орбиталей снова возвращается. Конфигурация марганца:
+25Mn [Ar]3d54s2
Аналогично у кобальта и никеля. А вот у меди мы снова наблюдаем провал (проскок) электрона — электрон опять проскакивает с 4s-подуровня на 3d-подуровень:
+29Cu [Ar]3d104s1
На цинке завершается заполнение 3d-подуровня:
+30Zn [Ar]3d104s2
У следующих элементов, от галлия до криптона, происходит заполнение 4p-подуровня по квантовым правилам. Например, электронная формула галлия:
+31Ga [Ar]3d104s24p1
Формулы остальных элементов мы приводить не будем, можете составить их самостоятельно.
Некоторые важные понятия:
Внешний энергетический уровень — это энергетический уровень в атоме с максимальным номером, на котором есть электроны.
Например, у меди ([Ar]3d104s1) внешний энергетический уровень — четвёртый.
Валентные электроны — электроны в атоме, которые могут участвовать в образовании химической связи. Например, у хрома (+24Cr [Ar]3d54s1) валентными являются не только электроны внешнего энергетического уровня (4s1), но и неспаренные электроны на 3d-подуровне, т.к. они могут образовывать химические связи.
Основное и возбужденное состояние атома
Электронные формулы, которые мы составляли до этого, соответствуют основному энергетическому состоянию атома. Это наиболее выгодное энергетически состояние атома.
Однако, чтобы образовывать химические связи, атому в большинстве ситуаций необходимо наличие неспаренных (одиночных) электронов. А химические связи энергетически очень для атома выгодны. Следовательно, чем больше в атоме неспаренных электронов — тем больше связей он может образовать, и, как следствие, перейдёт в более выгодное энергетическое состояние.
Поэтому при наличии свободных энергетических орбиталей на данном уровне спаренные пары электронов могут распариваться, и один из электронов спаренной пары может переходить на вакантную орбиталь. Таким образом число неспаренных электронов увеличивается, и атом может образовать больше химических связей, что очень выгодно с точки зрения энергии. Такое состояние атома называют возбуждённым и обозначают звёздочкой.
Например, в основном состоянии бор имеет следующую конфигурацию энергетического уровня:
+5B 1s22s22p1 1s 2s
2p
На втором уровне (внешнем) одна спаренная электронная пара, один одиночный электрон и пара свободных (вакантных) орбиталей. Следовательно, есть возможность для перехода электрона из пары на вакантную орбиталь, получаем возбуждённое состояние атома бора (обозначается звёздочкой):
+5B* 1s22s12p2 1s 2s
2p
Попробуйте самостоятельно составить электронную формулу, соответствующую возбуждённому состоянию атомов. Не забываем проверять себя по ответам!
15. Углерода
16. Бериллия
17. Кислорода
Электронные формулы ионов
Атомы могут отдавать и принимать электроны. Отдавая или принимая электроны, они превращаются в ионы.
Ионы — это заряженные частицы. Избыточный заряд обозначается индексом в правом верхнем углу.
Если атом отдаёт электроны, то общий заряд образовавшейся частицы будет положительный (вспомним, что число протонов в атоме равно числу электронов, а при отдаче электронов число протонов будет больше числа электронов). Положительно заряженные ионы — это катионы. Например: катион натрия образуется так:
+11Na 1s22s22p63s1 -1е = +11Na+ 1s22s22p63s0
Если атом принимает электроны, то приобретает отрицательный заряд. Отрицательно заряженные частицы — это анионы. Например, анион хлора образуется так:
+17Cl 1s22s22p63s23p5 +1e = +17Cl— 1s22s22p63s23p6
Таким образом, электронные формулы ионов можно получить добавив или отняв электроны у атома. Обратите внимание, при образовании катионов электроны уходят с внешнего энергетического уровня. При образовании анионов электроны приходят на внешний энергетический уровень.
Попробуйте составить самостоятельно электронный формулы ионов. Не забывайте проверять себя по ключам!
18. Ион Са2+
19. Ион S2-
20. Ион Ni2+
В некоторых случаях совершенно разные атомы образуют ионы с одинаковой электронной конфигурацией. Частицы с одинаковой электронной конфигурацией и одинаковым числом электронов называют изоэлектронными частицами.
Например, ионы Na+ и F—.
Электронная формула катиона натрия: Na+ 1s22s22p6, всего 10 электронов.
Электронная формула аниона фтора: F— 1s22s22p6, всего 10 электронов.
Таким образом, ионы Na+ и F— — изоэлектронные. Также они изоэлектронны атому неона.
Тренажер по теме «Строение атома» — 10 вопросов, при каждом прохождении новые.
288
Создан на
03 января, 2022 От Admin
Тренировочный тест «Строение атома»
Тренировочный тест по теме «Строение атома»
1 / 10
1) V 2) B 3) Li 4) C 5) He
Определите элементы, атомы которых в основном состоянии имеют электронную формулу внешнего энергетического уровня ns2.
2 / 10
1) Fe 2) B 3) Li 4) C 5) He
Определите элементы, атомы которых в основном состоянии имеют электронную формулу внешнего энергетического уровня ns2.
3 / 10
1) Ca 2) S 3) Na 4) F 5) Mn
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют одинаковое число электронов во внешнем слое.
4 / 10
1) Zn 2) S 3) Si 4) Fe 5) Mg
Определите элементы, атомы которых в основном состоянии не содержат неспаренных электронов.
5 / 10
1) He 2) Ba 3) Si 4) S 5) F
Определите элементы, атомы которых в основном состоянии не содержат неспаренных электронов.
6 / 10
1) Ti 2) P 3) N 4) Al 5) O
Определите элементы, атомы которых в основном состоянии содержат два неспаренных электрона.
7 / 10
1) O 2) P 3) Si 4) Cr 5) S
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют электронную конфигурацию внешнего энергетического уровня ns2np4.
8 / 10
1) S 2) Ca 3) Mn 4) Al 5) Cl
Определите, атомы каких из указанных в ряду элементов имеют на внешнем энергетическом уровне одинаковое число электронов.
9 / 10
1) Ba 2) Sn 3) Ti 4) S 5) Ca
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют на внешнем энергетическом уровне два неспаренных электрона.
10 / 10
1) C 2) H 3) O 4) Mg 5) N
Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое число неспаренных электронов.
Ваша оценка
The average score is 33%
Ответы на вопросы:
1. У изотопов одного химического элемента массовое число всегда разное, т.к. массовое число складывается из числа протонов и нейтронов. А у изотопов различается число нейтронов.
2. У изотопов одного элемента число протонов всегда одинаковое, т.к. число протонов характеризует химический элемент.
3. Массовое число изотопа брома-81 равно 81. Атомный номер = заряд ядра брома = число протонов в ядре = 35. Вычитаем из массового числа число протонов, получаем 81-35=46 нейтронов.
4. Массовое число изотопа хлора равно 37. Атомный номер, заряд ядра и число протонов в ядре равно 17. Получаем число нейтронов = 37-17 =20.
5. Электронная формула азота:
+7N 1s22s22p3 1s 2s
2p
6. Электронная формула кислорода:
+8О 1s22s22p4 1s 2s
2p
7. Электронная формула фтора:
8. Электронная формула магния:
+12Mg 1s22s22p63s2 1s 2s
2p
3s
9. Электронная формула алюминия:
+13Al 1s22s22p63s23p1 1s 2s
2p
3s
3p
10. Электронная формула кремния:
+14Si 1s22s22p63s23p2 1s 2s
2p
3s
3p
11. Электронная формула фосфора:
+15P 1s22s22p63s23p3 1s 2s
2p
3s
3p
12. Электронная формула серы:
+16S 1s22s22p63s23p4 1s 2s
2p
3s
3p
13. Электронная формула хлора:
14. Электронная формула аргона:
+18Ar 1s22s22p63s23p6 1s 2s
2p
3s
3p
15. Электронная формула углерода в возбуждённом состоянии:
+6C* 1s22s12p3 1s 2s
2p
16. Электронная формула бериллия в возбуждённом состоянии:
+4Be 1s22s12p1 1s 2s
2p
17. Электронная формула кислорода в возбуждённом энергетическом состоянии соответствует формуле кислорода в основном энергетическом состоянии, т.к. нет условий для перехода электрона — отсутствуют вакантные энергетические орбитали.
18. Электронная формула иона кальция Са2+: +20Ca2+ 1s22s22p63s23p6
19. Электронная формула аниона серы S2-: +16S2- 1s22s22p63s23p6
20. Электронная формула катиона никеля Ni2+: +28Ni2+ 1s22s22p63s23p63d84s0. Обратите внимание! Атомы отдают электроны всегда сначала с внешнего энергетического уровня. Поэтому никель отдаёт электроны сначала с внешнего 4s-подуровня.
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
Строение атома
Автор статьи — профессиональный репетитор И. Давыдова (Юдина).
Атом — в переводе с древнегреческого – неделимый — это наименьшая частица химического элемента, являющаяся носителем его свойств. Современные представления о строении атома требуют для понимания знаний основ квантовой механики, поэтому мы ограничимся упрощенной моделью.
Атом состоит из ядра (в составе которого протоны и нейтроны) и электронов. Несмотря на то, что ядро составляет большую часть массы атома, оно очень мало.
| Заряд z | Масса m | |
| Протон p+ | +1 | 1 |
| Нейтрон n0 | 0 | 1 |
| Электрон e— | -1 | 0 |
Количество протонов равно количеству электронов и равно номеру атома в периодической таблице. Число нейтронов равно разности атомной массы и номера элемента.
Бор – пятый элемент периодической таблицы, в его атоме 5 протонов и 5 электронов. Атомная масса ≈ 11, количество нейтронов равно 11 – 5 = 6.
Элементы, имеющие одинаковое количество протонов в ядре, но различающиеся числом нейтронов, называются изотопами.
Например, 35Cl и 37Cl – изотопы, различающиеся атомной массой и количеством нейтронов.
| Число протонов | Число нейтронов | Число электронов | |
| 35Cl | 17 | 18 | 17 |
| 37Cl | 17 | 20 | 17 |
Вокруг ядра по различным траекториям — орбиталям движутся электроны. Каждой орбитали соответствует определенный уровень энергии, чем ближе орбиталь к ядру, тем меньшей энергией должен обладать электрон, чтобы находиться на ней.
Порядок заполнения орбиталей:
Электроны располагаются на орбиталях в соответствии со следующими правилами:
- Принцип наименьшей энергии: в первую очередь электроны заполняют наиболее низкие по энергии уровни (ближайшие к ядру).
Энергия орбиталей на уровнях и подуровнях изменяется следующим образом: 1s < 2s < 2р < Зs < Зр < 4s < 3d < 4р < 5s <4d < 5р < 6s < 4f ≈ 5d < 6p < 7s < 5f ≈6d < 7p . (●)
| Тип орбитали | Число орбиталей на энергетическом уровне | Максимальное количество электронов на этих орбиталях |
| s | 1 | 2 |
| p | 3 | 6 |
| d | 5 | 10 |
| f | 7 | 14 |
Перед оставшимися двумя принципами введем понятие спина электрона. Спин – характеристика самого электрона, представить его (это упрощенная модель, а ненастоящий физический смысл понятия спин!) можно как направление движения электрона вокруг своей оси: по или против часовой стрелки. Возможных значений всего два: +1/2 (обозначаем стрелкой вверх) и -1/2 (обозначаем стрелкой вниз).
- Принцип Паули: на каждой орбитали может быть не более двух электронов, причем их спины должны быть различными.
- Правило Хунда: суммарный спин системы должен быть максимально возможным.
С правилом Паули всё достаточно ясно: спины двух электронов на одной орбитали различны, а значит у одного электрона +1/2 (стрелочка вверх), у другого – -1/2 (стрелочка вниз). Но каков смысл правила Хунда? В данном случае обратимся всё к тем же значениям спина электрона. При заполнении электронного уровня всегда сначала заполняется один подуровень, только затем электроны помещаются на следующий. Рассмотрим p-подуровень. На нём имеются 3 орбитали (см. таблицу выше). В целом, есть разные варианты развития событий. Допустим, у нас есть 4 электрона, которые надо расположить на подуровне. Мы можем поместить два в первую ячейку, два во вторую. Посчитаем суммарный спин. У двух элетронов спин 1/2, у других -1/2. Тогда при сложении мы получаем ноль. Теперь расположим три первых электрона по одному, оставшийся поместим на первую орбитал (в пару). Теперь суммарный спин 1. Значит, подходит второй случай. Для того чтобы каждый раз не высчитывать суммарный спин, можно запомнить, что вначале следует расположить все имеющиеся электроны по одному, и если на подуровне уже не останется свободных ячеек, начинать составлять пары.
Рассмотрим заполнение орбиталей электронами на нескольких примерах. У каждого следующего элемента таблицы Менделеева на один протон и один электрон больше, чем у предыдущего. У элементов главных подгрупп всегда заполняется внешний электронный уровень, у элементов побочных – один из предыдущих.
— магний – двенадцатый элемент, имеет по 12 протонов и электронов, находится в главной подгруппе. Распределим эти электроны в соответствии с рассмотренными выше правилами, не забывая, что на каждом подуровне может быть не более двух электронов.
Магний – элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены — 1s22s22p6.Магний находится во второй группе, значит, на третьем уровне у него два электрона — 3s2. Итого получаем1s22s22p63s2.
В атоме магния в основном состоянии нет неспаренных электронов.
Если атому сообщили дополнительную энергию (например, нагрели), то электронная пара может распарится и один из электронов переходит на свободную орбиталь того же энергетического уровня. В возбужденном состоянии атом магния имеет два неспаренных электрона и может образовать две связи (валентность II).
— фосфор – пятнадцатый элемент, находится в главной подгруппе. Распределяем 15 электронов: Фосфор — элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены — 1s22s22p6.Фосфор находится в пятой группе, значит, на третьем уровне у него пять электронов — 3s23p3. Итого получаем1s22s22p63s23p3.
В атоме фосфора в основном состоянии 3 неспаренных электрона. В возбужденном состоянии атом фосфора имеет пять неспаренных электронов и может образовать пять связей (валентность V).
— цирконий – сороковой элемент, распределяем 40 электронов. Цирконий – элемент побочной подгруппы! Поэтому у него заполняется предыдущий электронный уровень (4d-подуровень). Цирконий – второй d – элемент в пятом периоде, значит, он содержит 2 электрона на 4d – подуровне. Итого получаем: 1s22s22p63s23p64s23d104p65s24d2.
В атоме циркония в основном состоянии 2 неспаренных электрона.
В возбужденном состоянии цирконий имеет четыре неспаренных электрона.
Важно отметить, что в обычном состоянии цирконий не может образовывать связей, так как для этого необходимы неспаренные электроны на внешнем электронном уровне. Соответственно, во всех соединениях цирконий находится в возбуждённом состоянии.
Исключениями из общего порядка заполнения электронных подуровней являются хром, марганец, медь, серебро и золото – у них наблюдается «провал» электрона с внешного s – подуровня на предвнешний d. (Атому более комфортно иметь на d-подуровне 5 или 10 электронов, чем 4 или 9). Например, электронные конфигурации хрома и меди вместо 4s23d4 и 4s23d9 имеют вид 4s13d5 и 4s13d10.
Задания для тренировки:
- Сколько протонов и электронов содержит ион NO2—
1) 46p, 46e
2) 23p, 24e
3) 23р, 23e
4) 46p, 47e - Чем отличаются изотопы одного и того же химического элемента?
1) Числом протонов
2) Числом электронов
3) Зарядом ядра
4) Массовым числом - Укажите атом, в котором больше всего электронов:
1) 2Н
2) 40Аr
3) 41Ar
4) 39К - Изобразить электронно-графическую схему атома хлора в основном и всех возможных возбужденных состояниях. Какие валентности способен проявлять хлор?
- Объяснить, почему сера проявляет валентность VI, а кислород – не проявляет, хотя оба эти элемента содержат по 6 электронов на внешнем слое.
Благодарим за то, что пользуйтесь нашими статьями.
Информация на странице «Строение атома» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать необходимые и поступить в высшее учебное заведение или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
08.03.2023
Понятие атом возникло еще в античном мире для обо значения частиц вещества. В переводе с греческого атом означает «неделимый».
Электроны
Ирландский физик Стони на основании опытов пришел к выводу, что электричество переносится мельчайшими частицами, существующими в атомах всех химических элементов. В $1891$ г. Стони предложил эти частицы назвать электронами, что по-гречески означает «янтарь».
Через несколько лет после того, как электрон получил свое название, английский физик Джозеф Томсон и французский физик Жан Перрен доказали, что электроны несут на себе отрицательный заряд. Это наименьший отрицательный заряд, который в химии принят за единицу $(–1)$. Томсон даже сумел определить скорость движения электрона (она равна скорости света — $300 000$ км/с) и массу электрона (она в $1836$ раз меньше массы атома водорода).
Томсон и Перрен соединяли полюса источника тока с двумя металлическими пластинами — катодом и анодом, впаянными в стеклянную трубку, из которой был откачан воздух. При подаче на пластины-электроды напряжения около 10 тысяч вольт в трубке вспыхивал светящийся разряд, а от катода (отрицательного полюса) к аноду (положительному полюсу) летели частицы, которые ученые сначала назвали катодными лучами, а затем выяснили, что это был поток электронов. Электроны, ударяясь об особые вещества, нанесенные, например, на экран телевизора, вызывают свечение.
Был сделан вывод: электроны вырываются из атомов материала, из которого сделан катод.
Свободные электроны или поток их можно получить и другими способами, например, при накаливании металлической проволоки или при падении света на металлы, образованные элементами главной подгруппы I группы таблицы Менделеева (например, цезий).
Состояние электронов в атоме
Под состоянием электрона в атоме понимают совокупность информации об энергии определенного электрона в пространстве, в котором он находится. Мы уже знаем, что электрон в атоме не имеет траектории движения, т.е. можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра. Он может находиться в любой части этого пространства, окружающего ядро, и совокупность различных положений его рассматривают как электронное облако с определенной плотностью отрицательного заряда. Образно это можно представить себе так: если бы удалось через сотые или миллионные доли секунды сфотографировать положение электрона в атоме, как при фотофинише, то электрон на таких фотографиях был бы представлен в виде точки. При наложении бесчисленного множества таких фотографий получилась бы картина электронного облака с наибольшей плотностью там, где этих точек больше всего.
На рисунке показан «разрез» такой электронной плотности в атоме водорода, проходящей через ядро, а штриховой линией ограничена сфера, внутри которой вероятность обнаружения электрона составляет $90%$. Ближайший к ядру контур охватывает область пространства, в которой вероятность обнаружения электрона — $10%$, вероятность обнаружения электрона внутри второго от ядра контура составляет $20%$, внутри третьего — $≈30%$ и т.д. В состоянии электрона есть некая неопределенность. Чтобы охарактеризовать это особое состояние, немецкий физик В. Гейзенберг ввел понятие о принципе неопределенности, т.е. показал, что невозможно определить одновременно и точно энергию и местоположение электрона. Чем точнее определена энергия электрона, тем неопределеннее его положение, и наоборот, определив положение, нельзя определить энергию электрона. Область вероятности обнаружения электрона не имеет четких границ. Однако можно выделить пространство, где вероятность нахождения электрона максимальна.
Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью.
В нем заключено приблизительно $90%$ электронного облака, и это означает, что около $90%$ времени электрон находится в этой части пространства. По форме различают $4$ известных ныне типа орбиталей, которые обозначаются латинскими буквами $s, p, d$ и $f$. Графическое изображение некоторых форм электронных орбиталей представлено на рисунке.
Важнейшей характеристикой движения электрона на определенной орбитали является энергия его связи с ядром. Электроны, обладающие близкими значениями энергии, образуют единый электронный слой, или энергетический уровень. Энергетические уровни нумеруют, начиная от ядра: $1, 2, 3, 4, 5, 6$ и $7$.
Целое число $n$, обозначающее номер энергетического уровня, называют главным квантовым числом.
Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня электроны последующих уровней характеризуются большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внеш него уровня.
Число энергетических уровней (электронных слоев) в атоме равно номеру периода в системе Д. И. Менделеева, к которому принадлежит химический элемент: у атомов элементов первого периода один энергетический уровень; второго периода — два; седьмого периода — семь.
Наибольшее число электронов на энергетическом уровне определяется по формуле:
$N=2n^2,$
где $N$ — максимальное число электронов; $n$ — номер уровня, или главное квантовое число. Следовательно: на первом, ближайшем к ядру энергетическом уровне может находиться не более двух электронов; на втором — не более $8$; на третьем — не более $18$; на четвертом — не более $32$. А как, в свою очередь, устроены энергетические уровни (электронные слои)?
Начиная со второго энергетического уровня $(n = 2)$, каждый из уровней подразделяется на подуровни (подслои), несколько отличающиеся друг от друга энергией связи с ядром.
Число подуровней равно значению главного квантового числа: первый энергетический уровень имеет один под уровень; второй — два; третий — три; четвертый — четыре. Подуровни, в свою очередь, образованы орбиталями.
Каждому значению $n$ соответствует число орбиталей, равное $n^2$. По данным, представленным в таблице, можно проследить связь главного квантового числа $n$ с числом подуровней, типом и числом орбиталей и максимальным числом электронов на подуровне и уровне.
Главное квантовое число, типы и число орбиталей, максимальное число электронов на подуровнях и уровнях.
| Энергетический уровень $(n)$ | Число подуровней, равное $n$ | Тип орбитали | Число орбиталей | Максимальное число электронов | ||
| в подуровне | в уровне, равное $n^2$ | в подуровне | на уровне, равное $n^2$ | |||
| $K(n=1)$ | $1$ | $1s$ | $1$ | $1$ | $2$ | $2$ |
| $L(n=2)$ | $2$ | $2s$ | $1$ | $4$ | $2$ | $8$ |
| $2p$ | $3$ | $6$ | ||||
| $M(n=3)$ | $3$ | $3s$ | $1$ | $9$ | $2$ | $18$ |
| $3p$ | $3$ | $6$ | ||||
| $3d$ | $5$ | $10$ | ||||
| $N(n=4)$ | $4$ | $4s$ | $1$ | $16$ | $2$ | $32$ |
| $4p$ | $3$ | $6$ | ||||
| $4d$ | $5$ | $10$ | ||||
| $4f$ | $7$ | $14$ |
Подуровни принято обозначать латинскими буквами, равно как и форму орбиталей, из которых они состоят: $s, p, d, f$. Так:
- $s$-подуровень — первый, ближайший к ядру атома подуровень каждого энергетического уровня, состоит из одной $s$-орбитали;
- $р$-подуровень — второй подуровень каждого, кроме первого, энергетического уровня, состоит из трех $р$-орбиталей;
- $d$-подуровень — третий подуровень каждого, начиная с третьего, энергетического уровня, состоит из пяти $d$-орбиталей;
- $f$-подуровень каждого, начиная с четвертого, энергетического уровня, состоит из семи $f$-орбиталей.
Ядро атома
Но не только электроны входят в состав атомов. Физик Анри Беккерель обнаружил, что природный минерал, содержащий соль урана, тоже испускает неведомое излучение, засвечивая фотопленки, закрытые от света. Это явление было названо радиоактивностью.
Различают три вида радиоактивных лучей:
- $α$-лучи, которые состоят из $α$-частиц, имеющих заряд в $2$ раза больше заряда электрона, но с положительным знаком, и массу в $4$ раза больше массы атома водорода;
- $β$-лучи представляют собой поток электронов;
- $γ$-лучи — электромагнитные волны с ничтожно малой массой, не несущие электрического заряда.
Следовательно, атом имеет сложное строение — состоит из положительно заряженного ядра и электронов.
Как же устроен атом?
В 1910 г. в Кембридже, близ Лондона, Эрнест Резерфорд со своими учениками и коллегами изучал рассеяние $α$-частиц, проходящих через тоненькую золотую фольгу и падаюших на экран. Альфа-частицы обычно отклонялись от первоначального направления всего на один градус, подтверждая, казалось бы, равномерность и однородность свойств атомов золота. И вдруг исследователи заметили, что некоторые $α$-частицы резко меняли направление своего пути, будто наталкиваясь на какую-то преграду.
Разместив экран перед фольгой, Резерфорд сумел обнаружить даже те редчайшие случаи, когда $α$-частицы, отразившись от атомов золота, летели в противоположном направлении.
Расчеты показали, что наблюдаемые явления могли произойти, если бы вся масса атома и весь его положительный заряд были сосредоточены в крохотном центральном ядре. Радиус ядра, как выяснилось, в 100 000 раз меньше радиуса всего атома, той его области, в которой находятся электроны, имеющие отрицательный заряд. Если применить образное сравнение, то весь объем атома можно уподобить стадиону в Лужниках, а ядро — футбольному мячу, расположенному в центре поля.
Атом любого химического элемента сравним с крохотной Солнечной системой. Поэтому такую модель атома, предложенную Резерфордом, называют планетарной.
Протоны и нейтроны
Оказывается, и крошечное атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов — протонов и нейтронов.
Протоны имеют заряд, равный заряду электронов, но противоположный по знаку $(+1)$, и массу, равную массе атома водорода (она принята в химии за единицу). Обо значаются протоны знаком $↙{1}↖{1}p$ (или $р+$). Нейтроны не несут заряда, они нейтральны и имеют массу, равную массе протона, т.е. $1$. Обозначают нейтроны знаком $↙{0}↖{1}n$ (или $n^0$).
Протоны и нейтроны вместе называют нуклонами (от лат. nucleus — ядро).
Сумма числа протонов и нейтронов в атоме называется массовым числом. Например, массовое число атома алюминия:
Так как массой электрона, ничтожно малой, можно пренебречь, то очевидно, что в ядре сосредоточена вся масса атома. Электроны обозначают так: $e↖{-}$.
Поскольку атом электронейтрален, также очевидно, что число протонов и электронов в атоме одинаково. Оно равно порядковому номеру химического элемента, присвоенному ему в Периодической системе. Например, в ядре атома железа содержится $26$ протонов, а вокруг ядра вращается $26$ электронов. А как определить число ней тронов?
Как известно, масса атома складывается из массы протонов и нейтронов. Зная порядковый номер элемента $(Z)$, т.е. число протонов, и массовое число $(А)$, равное сумме чисел протонов и нейтронов, можно найти число нейтронов $(N)$ по формуле:
$N=A-Z$
Например, число нейтронов в атоме железа равно:
$56 – 26 = 30$.
В таблице представлены основные характеристики элементарных частиц.
Основные характеристики элементарных частиц.
| Частица и ее обозначение | Масса | Заряд | Примечание |
| Протон — $p^+$ | $1$ | $+1$ | Число протонов равно порядковому номеру элемента |
| Нейтрон — $n^0$ | $1$ | $0$ | Число нейтронов находят по формуле: $N=A-Z$ |
| Электрон — $e↖{-}$ | ${1}/{1837}$ | $-1$ | Число электронов равно порядковому номеру элемента |
Изотопы
Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами.
Слово изотоп состоит из двух греческих слов: isos — одинаковый и topos — место, обозначает «занимающий одно место» (клетку) в Периодической системе элементов.
Химические элементы, встречающиеся в природе, являются смесью изотопов. Так, углерод имеет три изотопа с массой $12, 13, 14$; кислород — три изотопа с массой $16, 17, 18$ и т. д.
Обычно приводимая в Периодической системе относительная атомная масса химического элемента является средним значением атомных масс природной смеси изотопов данного элемента с учетом их относительного содержания в природе, поэтому значения атомных масс довольно часто являются дробными. Например, атомы природного хлора представляют собой смесь двух изотопов — $35$ (их в природе $75%$) и $37$ (их $25%$); следовательно, относительная атомная масса хлора равна $35.5$. Изотопы хлора записываются так:
$↖{35}↙{17}{Cl}$ и $↖{37}↙{17}{Cl}$
Химические свойства изотопов хлора совершенно одинаковы, как и изотопов большинства химических элементов, например калия, аргона:
$↖{39}↙{19}{K}$ и $↖{40}↙{19}{K}$, $↖{39}↙{18}{Ar}$ и $↖{40}↙{18}{Ar}$
Однако изотопы водорода сильно различаются по свойствам из-за резкого кратного увеличения их относительной атомной массы; им даже присвоены индивидуальные названия и химические знаки: протий — $↖{1}↙{1}{H}$; дейтерий — $↖{2}↙{1}{H}$, или $↖{2}↙{1}{D}$; тритий — $↖{3}↙{1}{H}$, или $↖{3}↙{1}{T}$.
Теперь можно дать современное, более строгое и научное определение химическому элементу.
Химический элемент — это совокупность атомов с одинаковым зарядом ядра.
Строение электронных оболочек атомов элементов первых четырех периодов
Рассмотрим отображение электронных конфигураций атомов элементов по периодам системы Д. И. Менделеева.
Элементы первого периода.
Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).
Электронные формулы атомов показывают распределение электронов по энергетическим уровням и под уровням.
Графические электронные формулы атомов показывают распределение электронов не только по уровням и под уровням, но и по орбиталям.
В атоме гелия первый электронный слой завершен — в нем $2$ электрона.
Водород и гелий — $s$-элементы, у этих атомов заполняется электронами $s$-орбиталь.
Элементы второго периода.
У всех элементов второго периода первый электронный слой заполнен, и электроны заполняют $s-$ и $р$-орбитали второго электронного слоя в соответствии с принципом наименьшей энергии (сначала $s$, а затем $р$) и правилами Паули и Хунда.
В атоме неона второй электронный слой завершен — в нем $8$ электронов.
Элементы третьего периода.
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать 3s-, 3р- и 3d-под уровни.
Строение электронных оболочек атомов элементов третьего периода.
У атома магния достраивается $3,5$-электронная орбиталь. $Na$ и $Mg$ — $s$-элементы.
У алюминия и последующих элементов заполняется электронами $3d$-подуровень.
В атоме аргона на внешнем слое (третьем электронном слое) $8$ электронов. Как внешний слой завершен, но всего в третьем электронном слое, как вы уже знаете, может быть 18 электронов, а это значит, что у элементов третьего периода остаются незаполненными $3d$-орбитали.
Все элементы от $Al$ до $Ar$ — $р$-элементы.
$s-$ и $р$-элементы образуют главные подгруппы в Периодической системе.
Элементы четвертого периода.
У атомов калия и кальция появляется четвертый электронный слой, заполняется $4s$-подуровень, т.к. он имеет меньшую энергию, чем $3d$-подуровень. Для упрощения графических электронных формул атомов элементов четвертого периода:
- обозначим условно графическую электронную формулу аргона так: $Ar$;
- не будем изображать подуровни, которые у этих атомов не заполняются.
$К, Са$ — $s$-элементы, входящие в главные подгруппы. У атомов от $Sc$ до $Zn$ заполняется электронами 3d-подуровень. Это $3d$-элементы. Они входят в побочные подгруппы, у них заполняется предвнешний электронный слой, их относят к переходным элементам.
Обратите внимание на строение электронных оболочек атомов хрома и меди. В них происходит «провал» одного электрона с $4s-$ на $3d$-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций $3d^5$ и $3d^{10}$:
$↙{24}{Cr}$ $1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{4} 4s^{2}…$
$↙{29}{Cu}$ $1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{9}4s^{2}…$
| Символ элемента, порядковый номер, название | Схема электронного строения | Электронная формула | Графическая электронная формула |
| $↙{19}{K}$ Калий |  |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^1$ | 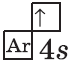 |
| $↙{20}{C}$ Кальций | 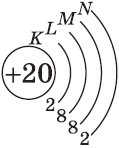 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2$ | 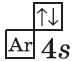 |
| $↙{21}{Sc}$ Скандий | 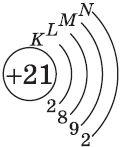 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^1{3}d^1$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^1{4}s^1$ | 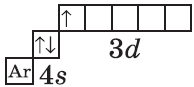 |
| $↙{22}{Ti}$ Титан | 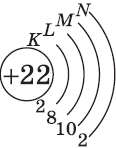 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^2$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^2{4}s^2$ | 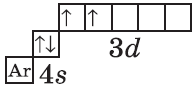 |
| $↙{23}{V}$ Ванадий | 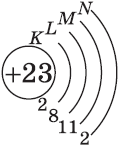 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^3$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^3{4}s^2$ | 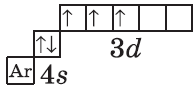 |
| $↙{24}{Сr}$ Хром | 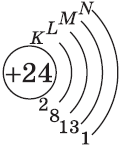 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^1{3}d^5$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^5{4}s^1$ | 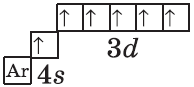 |
| $↙{29}{Сu}$ Хром | 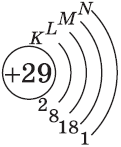 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^1{3}d^{10}$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^{10}{4}s^1$ | 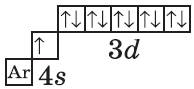 |
| $↙{30}{Zn}$ Цинк | 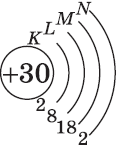 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^{10}$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^{10}{4}s^2$ | 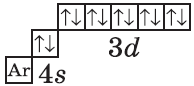 |
| $↙{31}{Ga}$ Галлий | 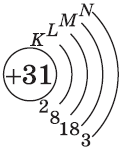 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^{10}4p^{1}$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^{10}{4}s^{2}4p^{1}$ | 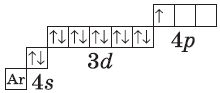 |
| $↙{36}{Kr}$ Криптон |  |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^{10}4p^6$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^{10}{4}s^{2}4p^6$ | 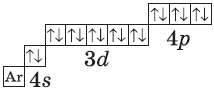 |
В атоме цинка третий электронный слой завершен — в нем заполнены все подуровни $3s, 3р$ и $3d$, всего на них $18$ электронов.
У следующих за цинком элементов продолжает заполняться четвертый электронный слой, $4р$-подуровень. Элементы от $Ga$ до $Кr$ — $р$-элементы.
У атома криптона внешний (четвертый) слой завершен, имеет $8$ электронов. Но всего в четвертом электронном слое, как вы знаете, может быть $32$ электрона; у атома криптона пока остаются незаполненными $4d-$ и $4f$-подуровни.
У элементов пятого периода идет заполнение подуровней в следующем порядке: $5s → 4d → 5р$. И также встречаются исключения, связанные с «провалом» электронов, у $↙{41}Nb$, $↙{42}Мо$, $↙{44}Ru$, $↙{45}Rh$, $↙{46}Pd$, $↙{47}Ag$. В шестом и седьмом периодах появляются $f$-элементы, т.е. элементы, у которых идет заполнение соответственно $4f-$ и $5f$-подуровней третьего снаружи электронного слоя.
$4f$-элементы называют лантаноидами.
$5f$-элементы называют актиноидами.
Порядок заполнения электронных подуровней в атомах элементов шестого периода: $↙{55}Cs$ и $↙{56}Ва$ — $6s$-элементы; $↙{57}La … 6s^{2}5d^{1}$ — $5d$-элемент; $↙{58}Се$ – $↙{71}Lu — 4f$-элементы; $↙{72}Hf$ – $↙{80}Hg — 5d$-элементы; $↙{81}Т1$ – $↙{86}Rn — 6d$-элементы. Но и здесь встречаются элементы, у которых нарушается порядок заполнения электронных орбиталей, что, например, связано с большей энергетической устойчивостью наполовину и полностью заполненных $f$-подуровней, т.е. $nf^7$ и $nf^{14}$.
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы, как вы уже поняли, делят на четыре электронных семейства, или блока:
- $s$-элементы; электронами заполняется $s$-подуровень внешнего уровня атома; к $s$-элементам относятся водород, гелий и элементы главных подгрупп I и II групп;
- $р$-элементы; электронами заполняется $р$-подуровень внешнего уровня атома; к $р$-элементам относятся элементы главных подгрупп III–VIII групп;
- $d$-элементы; электронами заполняется $d$-подуровень предвнешнего уровня атома; к $d$-элементам относятся элементы побочных подгрупп I–VIII групп, т.е. элементы вставных декад больших периодов, расположенных между $s-$ и $р-$элементами. Их также называют переходными элементами;
- $f$-элементы; электронами заполняется $f-$подуровень третьего снаружи уровня атома; к ним относятся лантаноиды и актиноиды.
Электронная конфигурация атома. Основное и возбужденное состояние атомов
Швейцарский физик В. Паули в $1925$ г. установил, что в атоме на одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины (в переводе с английского — веретено), т.е. обладающих такими свойствами, которые условно можно представить себе как вращение электрона вокруг своей воображаемый оси по часовой стрелке или против. Этот принцип носит название принципа Паули.
Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, т.е. электроны с противоположными спинами.
На рисунке показана схема деления энергетических уровней на подуровни.
$s-$Орбиталь, как вы уже знаете, имеет сферическую форму. Электрон атома водорода $(n = 1)$ располагается на этой орбитали и неспарен. По этому его электронная формула, или электронная конфигурация, записывается так: $1s^1$. В электронных формулах номер энергетического уровня обозначается цифрой, стоящей перед буквой $(1…)$, латинской буквой обозначают подуровень (тип орбитали), а цифра, которая записывается справа сверху от буквы (как показатель степени), показывает число электронов на подуровне.
Для атома гелия Не, имеющего два спаренных электрона на одной $s-$орбитали, эта формула: $1s^2$. Электронная оболочка атома гелия завершена и очень устойчива. Гелий — это благородный газ. На втором энергетическом уровне $(n = 2)$ имеются четыре орбитали, одна $s$ и три $р$. Электроны $s$-орбитали второго уровня ($2s$-орбитали) обладают более высокой энергией, т.к. находятся на большем расстоянии от ядра, чем электроны $1s$-орбитали $(n = 2)$. Вообще для каждого значения $n$ существует одна $s-$орбиталь, но с соответствующим запасом энергии электронов на нем и, следовательно, с соответствующим диаметром, растущим по мере увеличения значения $n$.$s-$Орбиталь, как вы уже знаете, имеет сферическую форму. Электрон атома водорода $(n = 1)$ располагается на этой орбитали и неспарен. По этому его электронная формула, или электронная конфигурация, записывается так: $1s^1$. В электронных формулах номер энергетического уровня обозначается цифрой, стоящей перед буквой $(1…)$, латинской буквой обозначают подуровень (тип орбитали), а цифра, которая записывается справа сверху от буквы (как показатель степени), показывает число электронов на подуровне.
Для атома гелия $Не$, имеющего два спаренных электрона на одной $s-$орбитали, эта формула: $1s^2$. Электронная оболочка атома гелия завершена и очень устойчива. Гелий — это благородный газ. На втором энергетическом уровне $(n = 2)$ имеются четыре орбитали, одна $s$ и три $р$. Электроны $s-$орбитали второго уровня ($2s$-орбитали) обладают более высокой энергией, т.к. находятся на большем расстоянии от ядра, чем электроны $1s$-орбитали $(n = 2)$. Вообще для каждого значения $n$ существует одна $s-$орбиталь, но с соответствующим запасом энергии электронов на нем и, следовательно, с соответствующим диаметром, растущим по мере увеличения значения $n$.
$р-$Орбиталь имеет форму гантели, или объемной восьмерки. Все три $р$-орбитали расположены в атоме взаимно перпендикулярно вдоль пространственных координат, проведенных через ядро атома. Следует подчеркнуть еще раз, что каждый энергетический уровень (электронный слой), начиная с $n= 2$, имеет три $р$-орбитали. С увеличением значения $n$ электроны занимают $р$-орбитали, расположенные на больших расстояниях от ядра и направленные по осям $x, y, z$.
У элементов второго периода $(n = 2)$ заполняется сначала одна $s$-орбиталь, а затем три $р$-орбитали; электронная формула $Li: 1s^{2}2s^{1}$. Электрон $2s^1$ слабее связан с ядром атома, поэтому атом лития может легко отдавать его (как вы, очевидно, помните, этот процесс называется окислением), превращаясь в ион лития $Li^+$.
В атоме бериллия Be четвертый электрон также размещается на $2s$-орбитали: $1s^{2}2s^{2}$. Два внешних электрона атома бериллия легко отрываются — $В^0$ при этом окисляется в катион $Ве^{2+}$.
У атома бора пятый электрон занимает $2р$-орбиталь: $1s^{2}2s^{2}2p^{1}$. Далее у атомов $C, N, O, F$ идет заполнение $2р$-орбиталей, которое заканчивается у благородного газа неона: $1s^{2}2s^{2}2p^{6}$.
У элементов третьего периода заполняются соответственно $3s-$ и $3р$-орбитали. Пять $d$-орбиталей третьего уровня при этом остаются свободными:
$↙{11}Na 1s^{2}2s^{2}2p^{6}3s^{1}$,
$↙{17}Cl 1s^{2}2s^{2}2p^{6}3s^{2}3p^{5}$,
$↙{18}Ar 1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}$.
Иногда в схемах, изображающих распределение электронов в атомах, указывают только число электронов на каждом энергетическом уровне, т.е. записывают сокращенные электронные формулы атомов химических элементов, в отличие от приведенных выше полных электронных формул, например:
$↙{11}Na 2, 8, 1;$ $↙{17}Cl 2, 8, 7;$ $↙{18}Ar 2, 8, 8$.
У элементов больших периодов (четвертого и пятого) первые два электрона занимают соответственно $4s-$ и $5s$-орбитали: $↙{19}K 2, 8, 8, 1;$ $↙{38}Sr 2, 8, 18, 8, 2$. Начиная с третьего элемента каждого большого периода, последующие десять электронов поступят на предыдущие $3d-$ и $4d-$орбитали соответственно (у элементов побочных подгрупп): $↙{23}V 2, 8, 11, 2;$ $↙{26}Fr 2, 8, 14, 2;$ $↙{40}Zr 2, 8, 18, 10, 2;$ $↙{43}Tc 2, 8, 18, 13, 2$. Как правило, когда будет заполнен предыдущий $d$-подуровень, начнет заполняться внешний (соответственно $4р-$ и $5р-$) $р-$подуровень: $↙{33}As 2, 8, 18, 5;$ $↙{52}Te 2, 8, 18, 18, 6$.
У элементов больших периодов — шестого и незавершенного седьмого — электронные уровни и подуровни заполняются электронами, как правило, так: первые два электрона поступают на внешний $s-$подуровень: $↙{56}Ba 2, 8, 18, 18, 8, 2;$ $↙{87}Fr 2, 8, 18, 32, 18, 8, 1$; следующий один электрон (у $La$ и $Са$) на предыдущий $d$-подуровень: $↙{57}La 2, 8, 18, 18, 9, 2$ и $↙{89}Ac 2, 8, 18, 32, 18, 9, 2$.
Затем последующие $14$ электронов поступят на третий снаружи энергетический уровень, на $4f$ и $5f$-орбитали соответственно лантоноидов и актиноидов: $↙{64}Gd 2, 8, 18, 25, 9, 2;$ $↙{92}U 2, 8, 18, 32, 21, 9, 2$.
Затем снова начнет застраиваться второй снаружи энергетический уровень ($d$-подуровень) у элементов побочных подгрупп: $↙{73}Ta 2, 8, 18, 32, 11, 2;$ $↙{104}Rf 2, 8, 18, 32, 32, 10, 2$. И, наконец, только после полного заполнения десятью электронами $d$-подуровня будет снова заполняться $р$-под уровень: $↙{86}Rn 2, 8, 18, 32, 18, 8$.
Очень часто строение электронных оболочек атомов изображают с помощью энергетических, или квантовых ячеек — записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули, согласно которому в ячейке (орбитали) может быть не более двух электронов, но с антипараллельными спинами, и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки сначала по одному и имеют при этом одинаковое значение спина, и лишь затем спариваются, но спины при этом, по принципу Паули, будут уже противоположно направленными.
МКОУ
«Кужникская СОШ»
ТРЕНАЖЕР
ЕГЭ ПО ХИМИИ
ЗАДАНИЕ
№1 «СТРОЕНИЕ АТОМА»
Автор:
Махмудов А. М.,
учитель
химии и биологии
2021
г.
Периодическая система химических элементов Д. И.
Менделеева
|
ПЕРИОДЫ |
Г Р У П П |
|||||||||
|
I |
II |
III |
IV |
V |
VI |
VII |
VIII |
|||
|
I |
1 H водород 1,0079 |
2 He гелий 4,0026 |
||||||||
|
II |
3 Li литий 6,941 |
4 Be бериллий 9,01218 |
5 B бор 10,811 |
6 C углерод 12,011 |
7 N азот 14,0067 |
8 O кислород 15,9994 |
9 F фтор 18,9984 |
10 Ne неон 20,179 |
||
|
III |
11 Na натрий 22,98977 |
12 Mg магний 24,305 |
13 Al алюминий 26,98154 |
14 Si кремний 28,0855 |
15 P фосфор 30,97376 |
16 S сера 32,066 |
17 Cl хлор 35,453 |
18 Ar аргон 39,948 |
||
|
IV |
19 K калий 39,0983 |
20 Ca кальций 40,078 |
21 Sc скандий 44,95591 |
22 Ti титан 47,88 |
23 V ванадий 50,9415 |
24 Cr хром 51,9961 |
25 Mn марганец 54,9380 |
26 Fe железо 55,847 |
27 Co кобальт 58,9332 |
28 Ni никель 58,69 |
|
29 Cu медь 63,546 |
30 Zn цинк 65,39 |
31 Ga галлий 69,723 |
32 Ge германий 72,59 |
33 As мышьяк 74,9216 |
34 Se селен 78,96 |
35 Br бром 79,904 |
36 Kr криптон 83,80 |
|||
|
V |
37 Rb рубидий 85,4678 |
38 Sr стронций 87,62 |
39 Y иттрий 88,9059 |
40 Zr цирконий 91,224 |
41 Nb ниобий 92,9064 |
42 Mo молибден 95,94 |
43 Tc технеций 98,9062 |
44 Ru рутений 101,07 |
45 Rh родий 102,9055 |
46 Pd палладий 106,42 |
|
47 Ag серебро 107,8682 |
48 Cd кадмий 112,41 |
49 In индий 114,82 |
50 Sn олово 118,710 |
51 Sb сурьма 121,75 |
52 Te теллур 127,60 |
53 I иод 126,9045 |
54 Xe ксенон 131,29 |
|||
|
VI |
55 Cs цезий 132,9054 |
56 Ba барий 137,33 |
57* La лантан 138,9055 |
72 Hf гафний 178,49 |
73 Ta тантал 180,9479 |
74 W вольфрам 183,85 |
75 Re рений 186,207 |
76 Os осмий 190,2 |
77 Ir иридий 192,22 |
78 Pt платина 195,08 |
|
79 Au золото 196,9665 |
80 Hg ртуть 200,59 |
81 Tl таллий 204,383 |
82 Pb свинец 207,2 |
83 Bi висмут 208,9804 |
84 Po полоний 208,9824 |
85 At астат 210,9871 |
86 Rn радон 222,0176 |
|||
|
VII |
87 Fr франций 223,0197 |
88 Ra радий 226,0254 |
89** Ac актиний 227,0278 |
104 Rf резерфордий [261] |
105 Db дубний [262] |
106 Sg сиборгий [263] |
107 Bh борий [264] |
108 Hs хассий [265] |
109 Mt мейтнерий [268] |
110 Ds дармштадтий [271] |
|
* |
58 Ce церий 140,12 |
59 Pr празеодим 140,9077 |
60 Nd неодим 144,24 |
61 Pm прометий 144,9128 |
62 Sm самарий 150,36 |
63 Eu европий 151,96 |
64 Gd гадолиний 157,25 |
65 Tb тербий 158,9254 |
66 Dy диспрозий 162,50 |
67 Ho гольмий 164,9304 |
68 Er эрбий 167,26 |
69 Tm тулий 168,9342 |
70 Yb иттербий 173,04 |
71 Lu лютеций 174,967 |
|
** |
90 Th торий 232,0381 |
91 Pa протактиний 231,0359 |
92 U уран 238,0289 |
93 Np нептуний 237,0482 |
94 Pu плутоний 244,0642 |
95 Am америций 243,0614 |
96 Cm кюрий 247,0703 |
97 Bk берклий 247,0703 |
98 Cf калифорний 251,0796 |
99 Es эйнштейний 252,0828 |
100 Fm фермий 257,0951 |
101 Md менделевий 258,0986 |
102 No нобелий 259,1009 |
103 Lr лоуренсий 260,1054 |
1.1.
Состав ядер атомов.
|
Название частицы |
обозначение |
масса |
заряд |
|
протон |
р+ |
1 |
+1 |
|
нейтрон |
n0 |
1 |
0 |
|
электрон |
е— |
~0 |
-1 |
— число протонов (Z) = заряд ядра = порядковый номер элемента;
— массовое число: А = Z + N;
— число нейтронов: N = A – Z.
1.
Определите
состав ядра наиболее распространенного изотопа углерода.
Решение: Наиболее
распространенным является изотоп углерода
с относительной атомной
массой 12 (по усредненной
относительной атомной массе элемента).
Z = 6
N = A – Z = 12 – 6 = 6
2.
Определите
состав ядра наиболее распространенных изотопов натрия, азота, фосфора.
3.
Чем
отличаются по составу ядра изотопов 35Cl и 37Сl?
4.
В чем
сходство и отличие состава ядер атомов наиболее распространенных изотопов калия
и кальция?
5.
У каких
двух элементов из данного ряда, в атомах наиболее распространенных изотопов,
имеют число протонов равное числу нейтронов?
1)
Li; 2)
F; 3) Se; 4) Si; 5) Ne.
1.2. Распределение
электронов по энергетическим уровням.
Максимально возможное число
е— (N) на уровне определяется по формуле:
N = 2n2, где n – номер энергетического уровня.
• ) ) )
)
2е— 8е—
18е— 32е—
— число Е-уровней = №
периода;
— число е— на последнем
уровне (у элементов главных подгрупп) = № группы.
6.
Запишите
распределение электронов по энергетическим уровням в атоме кремния.
Решение:
+14Si
2е—, 8е—, 4е—
7.
Запишите
распределение электронов по уровням в атомах азота и фосфора.
8.
Какие два
элемента из данного ряда имеют одинаковое число электронов на внешнем уровне?
1)Li; 2) Br; 3) S; 4) Pb; 5) Rb.
9.
Какие два
элемента из данного ряда имеют по семь электронов в наружном слое?
1)Sn; 2) Na; 3) I; 4) Сl; 5) Xe.
10.
Атомам,
каких двух элементов из данного перечня не хватает два электрона до завершения
внешнего уровня?
1)
Mo; 2) O; 3) B; 4) S; 5) Sr.
1.3. Распределение
электронов по орбиталям в атомах элементов (электронные конфигурации атомов
элементов).
ü Состояние
электронов в атомах определяется квантовыми числами:
— главное квантовое число n – определяет
номер энергетического уровня;
— орбитальное или побочное
квантовое число l – определяет форму орбитали;
— магнитное квантовое число m l — ориентацию орбиталей в
пространстве;
— спиновое квантовое число m s – магнитный момент (+1/2
и -1/2).
В атоме не может быть двух электронов со
всеми четырьмя одинаковыми квантовыми числами (Принцип Паули), т. е. каждый
электрон в атоме имеет свой уровень, форму орбитали, ориентацию в пространстве
и магнитный момент.
|
|
s-орбиталь имеет форму шара, имеет одно направление в s |
|
|
р-орбиталь имеет форму гантели, имеет p |
|
|
d-орбиталь d |
|
f-орбиталь f |
ü Порядок расположения
орбиталей:
1s │ 2s,2p │ 3s,3p,3d │ 4s,4p,4d,4f │ 5s,5p,5d,5f и т. д.
1 ур. 2 ур. 3 ур.
4 ур. 5 ур.
Число энергетических уровней в атоме =
номеру периода.
• По тому, какие орбитали
заполняются в атомах, различают s-, p-,
d-, f-элементы:
|
ПЕРИОДЫ |
Г Р У П П |
|||||||||
|
I |
II |
III |
IV |
V |
VI |
VII |
VIII |
|||
|
I |
1 H водород 1,0079 |
2 He гелий 4,0026 |
—s-элементы —p-элементы —d-элементы —f-элементы |
|||||||
|
II |
3 Li литий 6,941 |
4 Be бериллий 9,01218 |
5 B бор 10,811 |
6 C углерод 12,011 |
7 N азот 14,0067 |
8 O кислород 15,9994 |
9 F фтор 18,9984 |
10 Ne неон 20,179 |
||
|
III |
11 Na натрий 22,98977 |
12 Mg магний 24,305 |
13 Al алюминий 26,98154 |
14 Si кремний 28,0855 |
15 P фосфор 30,97376 |
16 S сера 32,066 |
17 Cl хлор 35,453 |
18 Ar аргон 39,948 |
||
|
IV |
19 K калий 39,0983 |
20 Ca кальций 40,078 |
21 Sc скандий 44,95591 |
22 Ti титан 47,88 |
23 V ванадий 50,9415 |
24 Cr хром 51,9961 |
25 Mn марганец 54,9380 |
26 Fe железо 55,847 |
27 Co кобальт 58,9332 |
28 Ni никель 58,69 |
|
29 Cu медь 63,546 |
30 Zn цинк 65,39 |
31 Ga галлий 69,723 |
32 Ge германий 72,59 |
33 As мышьяк 74,9216 |
34 Se селен 78,96 |
35 Br бром 79,904 |
36 Kr криптон 83,80 |
|||
|
V |
37 Rb рубидий 85,4678 |
38 Sr стронций 87,62 |
39 Y иттрий 88,9059 |
40 Zr цирконий 91,224 |
41 Nb ниобий 92,9064 |
42 Mo молибден 95,94 |
43 Tc технеций 98,9062 |
44 Ru рутений 101,07 |
45 Rh родий 102,9055 |
46 Pd палладий 106,42 |
|
47 Ag серебро 107,8682 |
48 Cd кадмий 112,41 |
49 In индий 114,82 |
50 Sn олово 118,710 |
51 Sb сурьма 121,75 |
52 Te теллур 127,60 |
53 I иод 126,9045 |
54 Xe ксенон 131,29 |
|||
|
VI |
55 Cs цезий 132,9054 |
56 Ba барий 137,33 |
57* La лантан 138,9055 |
72 Hf гафний 178,49 |
73 Ta тантал 180,9479 |
74 W вольфрам 183,85 |
75 Re рений 186,207 |
76 Os осмий 190,2 |
77 Ir иридий 192,22 |
78 Pt платина 195,08 |
|
79 Au золото 196,9665 |
80 Hg ртуть 200,59 |
81 Tl таллий 204,383 |
82 Pb свинец 207,2 |
83 Bi висмут 208,9804 |
84 Po полоний 208,9824 |
85 At астат 210,9871 |
86 Rn радон 222,0176 |
|||
|
VII |
87 Fr франций 223,0197 |
88 Ra радий 226,0254 |
89** Ac актиний 227,0278 |
104 Rf резерфордий [261] |
105 Db дубний [262] |
106 Sg сиборгий [263] |
107 Bh борий [264] |
108 Hs хассий [265] |
109 Mt мейтнерий [268] |
110 Ds дармштадтий [271] |
|
* |
58 Ce церий 140,12 |
59 Pr празеодим 140,9077 |
60 Nd неодим 144,24 |
61 Pm прометий 144,9128 |
62 Sm самарий 150,36 |
63 Eu европий 151,96 |
64 Gd гадолиний 157,25 |
65 Tb тербий 158,9254 |
66 Dy диспрозий 162,50 |
67 Ho гольмий 164,9304 |
68 Er эрбий 167,26 |
69 Tm тулий 168,9342 |
70 Yb иттербий 173,04 |
71 Lu лютеций 174,967 |
|
** |
90 Th торий 232,0381 |
91 Pa протактиний 231,0359 |
92 U уран 238,0289 |
93 Np нептуний 237,0482 |
94 Pu плутоний 244,0642 |
95 Am америций 243,0614 |
96 Cm кюрий 247,0703 |
97 Bk берклий 247,0703 |
98 Cf калифорний 251,0796 |
99 Es эйнштейний 252,0828 |
100 Fm фермий 257,0951 |
101 Md менделевий 258,0986 |
102 No нобелий 259,1009 |
103 Lr лоуренсий 260,1054 |
ü Порядок заполнения орбиталей:
|
№ |
Заполнение |
элементы |
|
|
I |
1s
|
H и He |
|
|
II |
2s 2p |
Li, Be, B, C, N, O, F, Ne |
|
|
III |
3s 3p |
Na, Mg, Al, |
|
|
IV |
3d 4s ↗ ↘
|
d-элементы от ↗ ↘ K, Ca от Ga до Kr |
|
|
V |
4d 5s ↗ ↘
|
d-элементы от ↗ ↘ Rb, Sr от In до Xe |
|
|
VI |
↗ ↙ 5d 6s ↗ ↘
|
Лантаноиды ↗ ↙ La от Hf до Hg ↗ ↘ Cs, Ba от Tl до Rn |
|
|
VII |
↗ ↙ 6d 7s ↗ ↘ 7p
|
||
•
Заполнение
орбиталей у элементов малых периодов:
Первый период.
|
I |
H 1s1 |
He 1s2 |
На каждой орбитали может находиться не более двух электронов.
Если два электрона находятся на одной орбитали, то они обладают противоположными
спинами (стрелки направлены в разные стороны):
Второй период.
|
II |
Li 2s1 |
Be 2 s2 |
B 2 s22p1 |
C 2 s22p2 |
N 2 s22p3 |
O 2 s22p4 |
F 2 s22p5 |
Ne 2 s22p6 |
1s2 2s1 2p0
+3Li
Для удобства рисуем орбитали
только внешнего уровня:
2s1 2p0
+3Li …
Заполнение энергетических
уровней происходит таким образом, чтобы суммарный спин был максимальным (Правило Хунда). Например, три р-электрона
на орбиталях р-подуровня располагаются по одному на орбиталях: , а затем спариваются:
,
,
. Заполняем сначала s-орбиталь, а затем р-орбиталь.
2s2 2p2
+6C …
— основное состояние
↗ ↖
спаренные электроны неспаренные электроны
В атоме углерода в основном
состоянии 2 спаренных и 2 неспаренных электрона во внешнем слое.
Кроме основного, есть еще и
возбужденное состояние атома, обусловленное распариванием электронов
внешнего слоя с последующим занятием пустой орбитали (обозначается значком*):
2s1
2p3
+6C*
…
В этом случае у углерода четыре
неспаренных электрона на внешнем слое.
У атомов N, O, F такого состояния
нет, за отсутствием свободных орбиталей.
2s2 2p3
+7N …
— основное
состояние
Валентные электроны — электроны, которые
находятся на внешнем электронном слое атома. В атоме углерода их 4.
В катионах и анионах,
электронов может быть меньше или больше, соответственно. Катион С4+
теряет 4 электрона внешнего слоя и приобретает электронную конфигурацию гелия,
а анион С4- приобретает дополнительно недостающие электроны, и
приобретает конфигурацию неона.
Задание: потренируйтесь в составлении электронных формул
атомов II периода.
Элементы третьего периода. Например, атом хлора. Подсчет
электронов ведем по клеткам с начала периода, до самого элемента включительно.
|
III |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
⸠→
3s2 ⸠→ 3p5
На третьем уровне дополнительно появляется d-орбиталь, которая используется при
переходе атома в возбужденное состояние.
|
Основное состояние |
Возбужденное состояние* |
|
3s2 3p5 3d0 +17Сl … |
3s2 3p4 3d1 +17 Сl * … 3s1 +17 Сl ** … 3s1 +17 Сl *** … |
Задание: потренируйтесь в составлении электронных формул
атомов III периода.
• Заполнение орбиталей у элементов
больших периодов:
В больших периодах, после заполнения s-орбитали, начинается заполнение d-орбитали предвнешнего уровня, а после него – р-орбиталь:
|
IV |
K 4s1 |
Ca 4s2 |
Sc 3d14s2 |
Ti 3d24s2 |
V 3d34s2 |
Cr 3d54s1 |
Mn 3d54s2 |
Fe 3d64s2 |
Co 3d74s2 |
Ni 3d84s2 |
|
Cu 3d104s1 |
Zn 3d104s2 |
Ga 4s24p1 |
Ge 4s24p2 |
As 4s24p3 |
Se 4s24p4 |
Br 4s24p5 |
Kr 4s24p6 |
Запишем электронную конфигурацию атомов титана и
ванадия. Подсчет электронов ведем по клеткам данного периода. Первые две клетки
(K и Ca), это 4s2. Далее, 10 клеток (элементы побочной
подгруппы), это электроны 3d-орбитали.
Подсчитываем клетки включительно самого элемента:
⸠→ 4s2, ⸠→ 3d2
|
IV |
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
|
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
|
3d2 4s2 +22Ti … |
3d3 4s2 +23V … |
У некоторых элементов
происходит так называемый «провал электрона».
Провал электрона —
переход электрона с внешнего, более высокого
энергетического уровня, на предвнешний, энергетически более
низкий. Это связано с большей устойчивостью получающихся при этом
электронных конфигураций (необходимо запомнить Cr, Mo и Cu, Ag, Au).
⸠→ 4s2
⸠→ 3d4
|
IV |
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
|
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
Например, для хрома и меди следовало
бы записать так:
|
3d4 4s2 +24Cr … |
3d9 4s2 +29Сu … |
А на самом деле
происходит провал электрона:
|
3d5 4s1 +24Cr … |
3d10 4s1 +29Сu … |
После цинка идут р-элементы (Ga – Kr), у которых заполняется р-орбиталь:
Запишем электронную конфигурацию атома брома в
основном и возбужденном состояниях:
⸠→ 4s2, эти клетки не считаем, т. к.
здесь заполняется 3d-орбиталь
|
IV |
19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
|
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
⸠→ 4р5
|
4s2 4p5 4d0 4f0 +35Br … |
4s2 +35Br* … 4s2 +35Br** … 4s1 4p3 4d3 4f0 +35Br***… |
Задание: потренируйтесь в составлении электронных формул
атомов IV периода.
11.
Запишите
распределение электронов по орбиталям в атомах кислорода, серы, калия, кальция
и германия в основном и возбужденном состоянии.
Ответьте на следующие вопросы, используя данные элементы:
1)
атомы,
каких элементов имеют конфигурацию внешнего слоя ns2np4 в основном состоянии?
2)
атомам,
какого элемента характерна конфигурация внешнего электронного слоя ns1np3 в возбужденном состоянии?
3)
у атомов,
каких из этих элементов отсутствует возбужденное состояние?
4)
укажите
элемент, имеющий два валентных электрона;
5)
какой из
этих элементов не имеет неспаренных электронов в основном состоянии?
6)
выберите
три элемента, атомы которых имеют одинаковое количество неспаренных электронов
в основном состоянии;
7)
выберите
элементы, имеющие одинаковое количество валентных электронов;

катионы,
каких элементов в солях имеют электронную конфигурацию аргона?
9)
анион,
какого из этих элементов имеет электронную конфигурацию аргона?
10)
какой из этих
элементов способен иметь шесть неспаренных электронов в возбужденном состоянии?
11)
выберите
элементы, имеющие одинаковое число s-электронов во внешнем слое атома в основном состоянии;
12)
выберите
элементы, имеющие одинаковое число s-электронов в атоме в основном состоянии.
Решение: составляем
электронные конфигурации атомов в основном и возбужденном состоянии:
|
Основное состояние |
Возбужденное состояние* |
|
2s2 2p4 +8O … |
У кислорода возбужденного состояния нет, т. |
|
3s2 3p4 3d0 +16S … |
3s2 +16S* … 3s1 3p3 +16S** … |
|
4s1 4p0 4d0 4f0 +19К … |
нет |
|
4s2 4p0 4d0 4f0 +20Ca … |
4s1 4p1 +20Ca* … |
|
4s2 4p2 4d0 4f0 +32Ge … |
4s1 4p3 4d0 4f0 +32Ge* … |
Ответы на вопросы даем исходя из составленных схем:
1)O,
S; 2)Ge; 3)O, K; 4)Ca; 5)Ca; 6)O, S, Ge; 7)O, S; 8)K, Ca;
9)S;
10)S; 11)O, S, Ca, Ge; 12)Ca, Ge.
12.
Запишите
распределение электронов по орбиталям в атомах азота, магния, алюминия и
фосфора в основном и возбужденном состоянии.
Ответьте на следующие вопросы, используя эти четыре элемента:
1) у атома какого из этих элементов отсутствует возбужденное
состояние?
2) в атомах каких элементов имеется одинаковое число
электронных слоев?
3) какой элемент не имеет неспаренных электронов в основном
состоянии?
4) укажите элемент имеющий три валентных электрона;
5) у какого элемента в возбужденном состоянии 5 неспаренных
электронов?
6) атомам какого элемента в возбужденном состоянии характерна
конфигурация внешнего электронного слоя ns1np1?
7) у атомов каких элементов имеется одинаковое число
неспаренных электронов в основном состоянии?

электронов в возбужденном состоянии?
9) у какого элемента электронная
конфигурация аниона соответствует атому аргона?
10) катионы каких элементов имеют
электронную конфигурацию неона?
11) атомы каких элементов имеют
конфигурацию внешнего слоя ns2np3 в основном состоянии?
12) выберите элементы, имеющие
одинаковое число s— электронов в атоме в
основном состоянии.
13.
Запишите
распределение электронов по орбиталям в атомах титана, хрома, меди и ртути.
Ответьте на следующие вопросы, используя эти четыре элемента:
1)
у какого
из этих элементов больше всего валентных электронов?
2)
сколько
электронов может содержаться во внешнем электронном слое атомов этих элементов?
3)
кроме электронов
внешнего слоя, какие электроны еще участвуют в образовании химических связей у
данных элементов?
Решение:
3d2 4s2
+22Ti
…
…
3d5 4s1
+24Сr …
…
Провал
электрона
У хрома, молибдена, меди, серебра и золота
(и некоторых других элементов) происходит «провал электрона».
3d10 4s1
+29Сu …
…
Провал
электрона
Для ртути:
⸠→ 6s2, ⸠→ .
|
VI |
55 Cs цезий 132,9054 |
56 Ba барий 137,33 |
57* La лантан 138,9055 |
72 Hf гафний 178,49 |
73 Ta тантал 180,9479 |
74 W вольфрам 183,85 |
75 Re рений 186,207 |
76 Os осмий 190,2 |
77 Ir иридий 192,22 |
78 Pt платина 195,08 |
|
79 Au золото 196,9665 |
80 Hg ртуть 200,59 |
81 Tl таллий 204,383 |
82 Pb свинец 207,2 |
83 Bi висмут 208,9804 |
84 Po полоний 208,9824 |
85 At астат 210,9871 |
86 Rn радон 222,0176 |
. 5d10
5d10
6s2
+80Hg … ….
…
Ответы на
вопросы:
1)Cr; 2) 1 или 2; 3)электроны d-подуровня предвнешнего
слоя.
14.
Составьте
схемы распределения электронов по орбиталям в атомах скандия, марганца, цинка и
серебра.
15.
Выберите
два элемента, имеющие конфигурацию внешнего электронного слоя ns2np5 в основном состоянии.
1)As; 2) Sn; 3) I; 4) Te; 5) Br.
16.
Выберите
два элемента, имеющие одинаковое количество электронов во внешнем слое.
1)Cu; 2) Zn; 3) Cl; 4) Pb; 5) K.
17. Какие два, из
перечисленных элементов, имеют в возбужденном состоянии конфигурацию внешнего
электронного слоя ns1np3nd1?
1)Zn; 2) N; 3) P; 4) As; 5) Cr.
18.
Укажите
два элемента, которым не хватает два электрона до завершения наружного
энергетического уровня.
1)S; 2) O; 3) C; 4) Ge; 5) Ca.
19. У каких двух, из перечисленных
элементов, в атоме во внешнем слое один электрон?
1) Fe; 2) Ag; 3) Al; 4) He;
5) Rb.
20. Выберите два элемента,
имеющие конфигурацию внешнего электронного слоя ns2np2 в основном состоянии.
1)As; 2) Sn; 3) Pb; 4) Te;
5) Br.
21. Среди приведенных
элементов выберите два, атомы которых имеют по три неспаренных электрона в
наружном слое в возбужденном состоянии.
1)Al; 2) O; 3)B; 4) S; 5) Sr.
22. Какие два, из
перечисленных элементов, имеют в возбужденном состоянии конфигурацию внешнего
электронного слоя ns1np3?
1)Li; 2) С; 3) N; 4) Mn; 5) Si.
23. Назовите два элемента,
атомы которых имеют три неспаренных электрона в атоме.
1)Rb; 2) Si; 3) Sc; 4) P; 5) Ti.
24. Определите два элемента в
ряду, атомы которых содержат одинаковое количество валентных электронов.
1)Na; 2) Sn; 3) Cl; 4) P; 5) V.
25. Катионы, каких двух
элементов в ряду, имеют электронную конфигурацию атома аргона?
1)Zn; 2) Ca; 3) K; 4) Be; 5) Ne.
26. Выберите два элемента,
анионы которых имеют электронную конфигурацию атома неона.
1)Si; 2) N; 3) I; 4) F; 5) Te.
27. Какие два из элементов
имеют валентные электроны, как на внешнем, так и на предыдущем уровне?
1)S; 2) O; 3)Cu ; 4) Br; 5) Ti.
28. Выберите два элемента, катионы
которых имеют электронную конфигурацию 1s2.
1)H; 2) Be; 3) Li; 4) He; 5) Na.
29. Выберите два элемента, имеющие конфигурацию
внешнего электронного слоя ns2np1 в основном состоянии.
1)Ba; 2) Al; 3) I; 4) Ga; 5) Br.
30. Укажите два элемента,
которым не хватает шесть электронов до завершения наружного энергетического
уровня.
1)S; 2) O; 3) Cs; 4) Sr; 5) Ca.
31. Назовите два элемента,
атомы которых имеют четыре неспаренных электрона в атоме в возбужденном
состоянии.
1)Al; 2) Ge; 3) Ga; 4) F; 5) C.
32. Какие два, из
перечисленных элементов, имеют в возбужденном состоянии конфигурацию внешнего
электронного слоя ns1np1?
1)He; 2) Ca; 3)Be ; 4) Br;
5) Cl.
33. Выберите два элемента,
анионы которых имеют электронную конфигурацию атома 4s24p6.
1)Se; 2) N; 3) I; 4) F; 5) Br.
34. Катионы, каких двух
элементов в ряду, имеют электронную конфигурацию внешнего слоя атома 3s23p6?
1)K; 2) Mg; 3) Ga; 4) Be; 5) Al.
35. Определите два элемента в
ряду, атомы которых содержат одинаковое количество p-электронов во внешнем слое в
возбужденном состоянии.
1)In; 2) С; 3) P; 4) Ga; 5) K.
36. Выберите два элемента в
ряду, атомы которых содержат одинаковое количество s-электронов во внешнем слое в
возбужденном состоянии.
1)P; 2) N; 3) Pb; 4) O; 5) Kr.
37. У каких двух, из перечисленных
элементов, в атоме во внешнем слое два электрона?
1) Au; 2) Xe; 3) Cr; 4) Ni;
5) Cd.
ОТВЕТЫ:
2._, Z = 11, N = 12;
, Z = 7, N = 7;
, Z = 15, N = 16.
3._Количеством
нейтронов.
4._Они
отличаются количеством протонов, сходны количеством нейтронов.
5._45.
7._+7N 2e—5e—; +15P 2e—8e—5e—.
8._15.
9. _34. 10. _24.
12. Решение:
|
+7N |
или |
2s2 2p3 +7N … |
Ответы
на вопросы:
1)N; 2) Mg, Al, P; 3) Mg; 4) Al;
5) P; 6)
Mg; 7) N, P; 
9) P; 10)
Mg, Al, P; 11) N, P;
12) Mg, Al, P.
14.
|
3d1 4s2 +21Sc … |
3d5 4s2 +25Mn … |
|
3d10 4s2 +30Zn … |
4d10 5s1 +47Ag … |
15._35;
16._15; 17._34; 18._12; 19._25;
20._23; 21._13; 22._25;
23._34;
24._45; 25._23; 26._24;
27._35; 28._23; 29._24; 30._45;
31._25;
32._23; 33._15; 34._13; 35._23;
36._13; 37._45.
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
Атом (греч: atomos – неделимый) – химически неделимая нейтральная частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
Атомное ядро – состоит из нуклонов (лат. nucleus ядро ): протонов (греч. protos – первый) и нейтронов (греч. neitrum – ни то, ни другое).
Электронная оболочка – совокупность движущихся вокруг ядра отрицательно заряженных электронов.
Протон (p⁺) — частица в составе ядра, имеет положительный заряд, относительную массу 1, 0073.
Число протонов равно порядковому номеру и обозначается Z – заряд ядра.
Нейтрон (n⁰) – частица в составе ядра. Не имеет заряда. Относительная масса 1,0087.
Число нейтронов обозначается буквой N. Может меняться в атомах одного и того же элемента.
Электрон (е) – частица в составе электронной оболочки. Имеет отрицательный заряд, равный по величине, но противоположный по знаку заряду протона. Масса электрона примерно в 2000 раз меньше массы протона и практически не влияет на массу атома.
Так как атом — электронейтральная частица, то число протонов равно числу электронов
(число р⁺ = числу е):
N(e) = N(p⁺) = Z
Массовое число А (относительная атомная масса) складывается из числа протонов и нейтронов в ядре данного атома.
Число нейтронов равно разности массового числа и заряда ядра.
А = N(p⁺) + N(nº)
N(nº) = A – Z
Строение атома
Планетарная модель атома
Химический элемент – вид атомов с определѐнным зарядом ядра (количеством протонов).
Количество протонов неизменно, количество нейтронов может меняться.
Атомы с одинаковым зарядом ядра (количеством протонов), но разным числом нейтронов в ядре, т.е. разной массой, называются изотопами (нуклидами).
Один и тот же элемент может существовать в виде двух или нескольких изотопов. Все изотопы одного и того же элемента химически неотличимы.
Электронное строение атома
Электрон — уникальная элементарная частица: обладая свойствами, отличающими его от всех других частиц, он одновременно является и частицей, и волной, т.е. имеет двойственную природу.
С одной стороны, обладая малой массой, электрон проявляет свойства частицы. С другой стороны, электрон движется с такой высокой скоростью, что фактически «размазан» по атому, он находится не в одной конкретной точке, а образует «электронное облако».
Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона называется электронной орбиталью.
КВАНТОВЫЕ ЧИСЛА
Состояние электрона в атоме описывается 4 квантовыми числами:
- Главное квантовое число n;
- Побочное (орбитальное) квантовое число l;
- Магнитное квантовое число ml;
- Спиновое квантовое число ms.
- ГЛАВНОЕ КВАНТОВОЕ ЧИСЛО — n.
Главное квантовое число — n — определяет энергетический уровень электрона (равно номеру периода).
Главное квантовое число принимает любые целочисленные значения, начиная с n=1 (n=1,2,3,…) и соответствует номеру периода.
- ОРБИТАЛЬНОЕ КВАНТОВОЕ ЧИСЛО l
Определяет геометрическую форму атомной орбитали. Принимает любые целочисленные значения с l = 0 (l = n -1)
- МАГНИТНОЕ КВАНТОВОЕ ЧИСЛО
определяет ориентацию орбитали в пространстве (ml). Принимает любые целочисленные значения от -1 до +1, включая 0.
( ml = 2l +1)
Для s-орбитали:
l=0, ml= 1(0) — одна равноценная ориентация в пространстве (одна орбиталь).
Для p-орбитали:
l=1, ml= 3 (-1,0,+1) — три равноценные ориентации в пространстве (три орбитали).
Для d-орбитали:
l=2, ml= 5 (-2,-1,0,1,2) — пять равноценных ориентаций в пространстве (пять орбиталей).
Для f-орбитали:
l=3, ml= 7 (-3,-2,-1,0,1,2,3) — семь равноценных ориентаций в пространстве (семь орбиталей).
- СПИНОВОЕ КВАНТОВОЕ ЧИСЛО – ms
На каждой орбитали могут максимально размещаться два электрона, обладающие равной энергией, но отличающиеся особым свойством, спином.
Графически орбиталь принято изображать в виде квадрата, а электроны — в виде стрелок, направленных вверх или вниз.
Стрелки, направленные в противоположные стороны, означают электроны с двумя противоположными спинами.
Следовательно, электроны в электронной оболочке занимают определенные
уровни (дом),
подуровни (этаж),
орбитали (квартира).
Подуровни состоят из одной или нескольких одинаковых по энергии орбиталей.
На каждой орбитали может быть не больше двух электронов.
На
s-подуровне (одна орбиталь) могут находиться два электрона,
p-подуровне (три орбитали) — шесть электронов ,
d-подуровне (пять орбиталей) — десять электронов.
Элементы, у которых последним заполняется s-подуровень, называются s –элементами, p-подуровень — p –элементами, d-подуровень — d –элементами.
ПРИНЦИПЫ ПОСТРОЕНИЯ ЭЛЕКТРОННОЙ КОНФИГУРАЦИИ ЭЛЕМЕНТА
Количество электронов в атоме элемента равно его порядковому номеру.
Количество энергетических уровней атома равно номеру периода, в котором расположен элемент.
Количество электронов на внешнем (валентном) уровне равно номеру группы, в которой расположен элемент.
При более подробном описании электронной конфигурации рассматривают не только количество электронов на данном энергетическом уровне, но и их распределение по подуровням. Каждая незаполненная орбиталь обозначается пустым квадратиком.
При заполнении орбиталей электронами используют следующие правила.
1. ПРИНЦИП МИНИМУМА ЭНЕРГИИ
Орбитали заполняются в порядке увеличения энергии, снизу вверх. Каждый электрон располагается так, чтобы его энергия была минимальной, т. е. среди свободных орбиталей он выбирает орбиталь с самой низкой энергией.
Порядок заполнения энергетических подуровней (см. рис.) можно запомнить в виде ряда:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d » 4f < 6p < 7s….
2. ПРИНЦИП ПАУЛИ
На каждой орбитали может находиться не более двух электронов. Если два электрона находятся на одной орбитали, то они обладают противоположными спинами (стрелки направлены в разные стороны). Такие электроны называют спаренными. Если на орбитали находится только один электрон, то его называют неспаренным.
3. ПРАВИЛО ХУНДА (ГУНДА)
Атом в основном состоянии должен иметь максимально возможное число неспаренных электронов в пределах определенного подуровня.
4s-орбиталь обладает меньшей энергией, чем 3d-орбиталь, поэтому в первую очередь электроны заполнят 4s-подуровень и лишь затем 3d-подуровень.
Для удобства запоминания порядка заполнения энергетических подуровней лучше воспользоваться следующей схемой: в каждой отдельной строке написать возможные типы орбиталей для каждого уровня, провести стрелки под углом 450 и «расселять» электроны по подуровням, ориентируясь по стрелкам сверху вниз.
ЗАПИСЬ ЭЛЕКТРОННОЙ КОНФИГУРАЦИИ АТОМА
Подробные электронные конфигурации атомов изображают двумя способами:
- графически, с помощью квадратиков со стрелками (часто называют энергетическими диаграммами);
- в строчку, когда перечисляются все занятые энергетические подуровни с указанием общего числа электронов на каждом из них.
Последовательность заполнения орбиталей и максимальное число электронов на каждом подуровне:
ПРОСКОК» ИЛИ «ПРОВАЛ» ЭЛЕКТРОНА
У атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место «провал» электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома.
ВОЗБУЖДЕННОЕ СОСТОЯНИЕ АТОМА
Все электронные конфигурации, о которых мы говорили выше, являются конфигурациями с наименьшей энергией и соответствуют основному состоянию атома.
Получив энергию извне (облучение или нагревание системы), один либо несколько электронов могут переходить на более высокий энергетический подуровень.
Состояние атома, при котором электрон из электронной пары с предыдущего подуровня «распаривается» и переходит на следующий подуровень, называется возбужденным состоянием атома.
ВАЛЕНТНЫЕ ВОЗМОЖНОСТИ
Валентность атома определяется числом неспаренных электронов.
При наличии свободных орбиталей электроны атома могут распариваться, перескакивать на на другой подуровень, т.е. атом переходит в возбужденное состояние, поэтому валентность может быть постоянной и переменной. При этом число неспаренных электронов, а, следовательно, число связей, образуемых атомом, увеличивается.
Высшая валентность всегда равна номеру группы.
Для определения низшей переменной валентности (количества свободных электронов) , которой чаще всего обладают неметаллы, необходимо из 8 вычесть номер группы.
Валентность зависит:
1. От количества электронов на внешнем уровне
2. От количества свободных неспаренных электронов
3. От наличия свободных орбиталей
Электронные формулы ионов
Ионы – заряженные частицы, они получаются из атомов путем отдачи электронов (тогда образуются катионы) или принятия электронов (образуются анионы).
Примеры:
S2- (16+2=18е)
P3+ (15-3=12е)
Na+ (11-1=10е)
Электронная формула иона получается путем добавления или вычитания электронов из электронной формулы атома ( до инертной оболочки – 8е).
1(Б) Тесты ЕГЭ ФИПИ 2015 к теме «Строение атома»
Современные представления о строении атома
Элемент ЕГЭ: 1.1 Современные представления о строении атома. 1.1.1 Строение электронных оболочек атомов элементов первых четырех периодов: s-, р- и d-элементы. Электронная конфигурация атома. Основное и возбуждённое состояние атомов.
Современные представления о строении атома
Атом – химически неделимая электронейтральная частица, которая состоит из положительно заряженного ядра и движущихся вокруг него отрицательно заряженных электронов.
Атомы не имеют заряда (нейтральны). Если атом присоединяет один или несколько электронов, он приобретает отрицательный заряд и превращается в анион. Если атом теряет один или несколько электронов, он приобретает положительный заряд и превращается в катион. Заряд иона указывают арабской цифрой и знаком после символа атома.
Состав ядра: А = Z + N, где А — массовое число; Z — протонное число (число протонов); N — число нейтронов.
Элементарные частицы
| Название | Обозначение | Масса | Заряд |
| Электрон |
ē |
≈ 0 | -1 |
| Протон |
р |
1 | +1 |
| Нейтрон |
n |
1 | 0 |
Порядковый номер элемента в периодической системе:
- Заряд ядра атома
- Число протонов в ядре атома
- Число электронов в атоме
Нуклиды – разновидности атомов с фиксированным массовым числом А, числом протонов Z и нейтронов N в ядре.
Основные положения квантовой теории строения атома:
- Дискретность энергии электрона
- Двойственная (корпускулярно-волновая) природа электрона
- Невозможность определения траектории электрона (принцип неопределенности)
Относительная атомная масса элемента (Ar)
Физическая величина, показывающая, во сколько раз средняя масса атомов данного элемента больше 1/12 части массы изотопа углерода 12С.
Атомные орбитали
Орбиталь — пространство вокруг ядра, в котором нахождение электрона наиболее вероятно (вероятность более 90%)
Порядок заполнения орбиталей в основном состоянии
1) Принцип наименьшей энергии. Электроны занимают в первую очередь орбитали, имеющие наименьшую энергию.
2) Принцип Паули. На каждой орбитали могут находиться не более двух электронов, причём спины их противоположны.
3) Правило Хунда. Орбитали заполняются электронами так, чтобы их суммарный спин был максимальным.
Спин электрона — свойство электрона, характеризующее его способность взаимодействовать с магнитным полем. Может принимать два значения (положительное и отрицательное).
Последовательность заполнения орбиталей электронами в основном состоянии:
Энергетические уровни и подуровни
Элементы, у которых идет заполнение s-подуровня, называют s-элементами.
Элементы, у которых заполняется р-подуровень, называют р-элементами.
Элементы, у которых заполняется d-подуровень, называют d-элементами.
Элементы, у которых заполняется f-подуровень, называют f-элементами.
Распределение электронов в атоме по энергетическим уровням (электронным слоям) и подуровням
Электроны, относящиеся к последнему энергетическому уровню, называют внешними (валентными) электронами.
Строение электронных оболочек атомов первых четырёх периодов
Распределение электронов по орбиталям атома называют электронной конфигурацией атома, или электронной формулой.
Строение элементов первого периода
Строение элементов второго периода
Строение элементов третьего периода
Строение элементов четвёртого периода
Электронные конфигурации d5 и d10 обладают повышенной устойчивостью, поэтому в атомах хрома и меди наблюдается «перескок» электрона с 4s-подуровня на 3d-подуровень («провал электрона»).
Основное и возбуждённое состояние атомов
Наиболее устойчивое состояние атома, в котором энергия его электронной оболочки минимальна, называется основным состоянием атома. Любые другие состояния атома называют возбужденными состояниями.
Для возможности перехода атома в возбуждённое состояние необходимо выполнение одновременно двух условий:
- наличие спаренных электронов;
- наличие вакантных орбиталей.
Таблица «Современные представления о строении атома. Кратко»
(с) В учебных целях использованы цитаты из пособий: «Химия / Н. Э. Варавва, О. В. Мешкова. — Москва, Эксмо (ЕГЭ. Экспресс-подготовка)» и «Химия : Новый полный справочник для подготовки к ЕГЭ / Е.В. Савинкина. — Москва, Издательство АСТ».
Вы смотрели Справочник по химии «Современные представления о строении атома». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
- Конспект урока в 11 классе «Основные сведения о строении атома»


















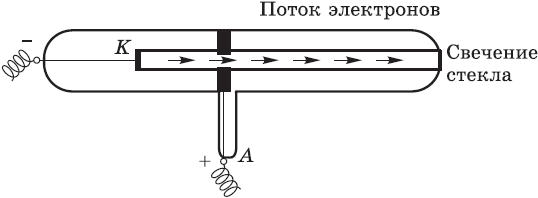
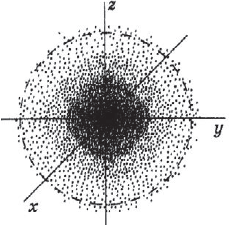
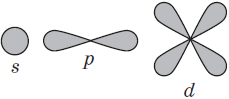
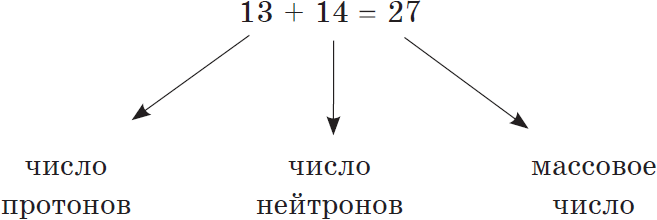
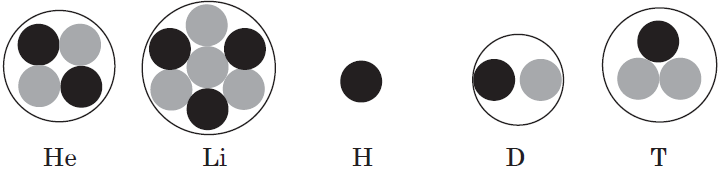
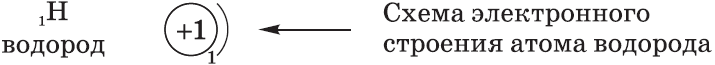
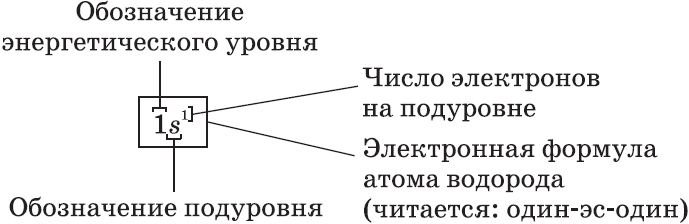
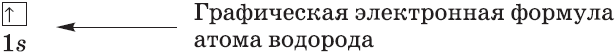

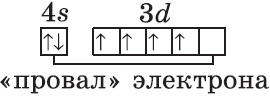
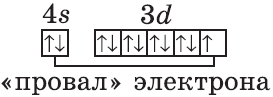
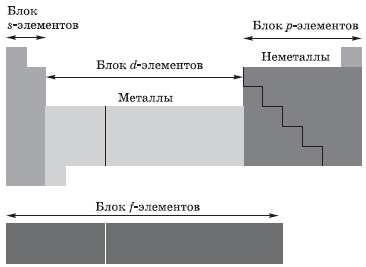
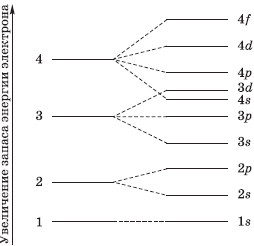
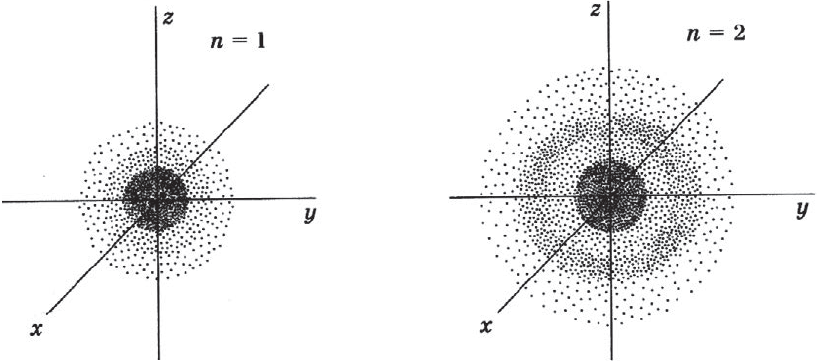





![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)