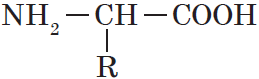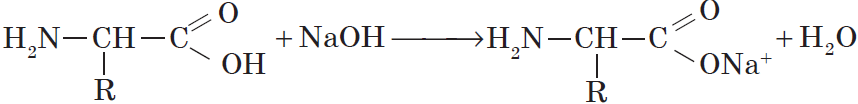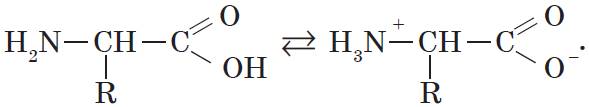8 мая 2022
В закладки
Обсудить
Жалоба
Формулы аминокислот
20 формул.
Аминокислоты — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Основные химические элементы аминокислот — это углерод (C), водород (H), кислород (O) и азот (N), хотя другие элементы также встречаются в радикале определенных аминокислот. Известны около 500 встречающихся в природе аминокислот (хотя только 20 используются в генетическом коде). Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы.
aminokisloti.docx
Белки – наиболее важные органические соединения клетки. Их содержание колеблется от 50% до 80% в разных клетках организма.
Строение белков
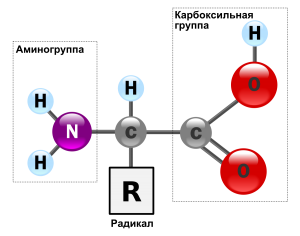
В состав белков, кроме 4 основных химических элементов (углерод, кислорода, водород, азот), могут входит фосфор, сера, железо. Белки – сложные высокомолекулярные соединения, которые составлены из аминокислотных последовательностей. Аминокислоты состоят из двух частей: аминогруппы -NH2 и карбоксильной группы -COOH. Первая несет в себе основные свойства, а вторая – кислотные, что обуславливает активности и амфотерность этих соединений (Амфотерность – проявление кислотных или основных свойств в зависимости от реакции). Аминокислоты отличаются радикалами.
Строение аминокислоты
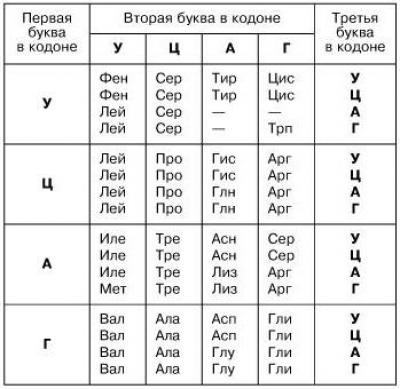
Аминокислоты ассоциируются с генетическим кодом, так как последовательности нуклеотидов кодируют триплеты нуклеотидов. Такие задачи изучаются в школе и встречаются в ЕГЭ. Всем, кто сталкивался с генетикой, хорошо знакома таблица аминокислот:
Таблица аминокислот
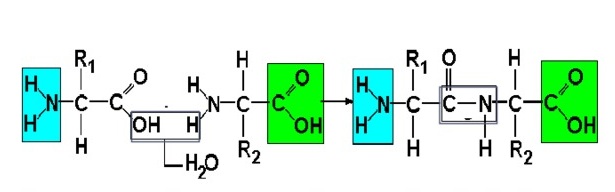
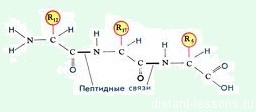
В один белок может входить много аминокислот. Они соединяются в цепь посредством образования пептидных связей: азот одной аминокислоты связывается с углеродом другой аминокислоты:
Строение белка. Зеленым цветом обозначена карбоксильная группа аминокислоты, голубым цветом – аминогруппа аминокислоты
В состав белка может входить даже несколько аминокислотных цепей. Всего аминокислот насчитывается около 170, однако основное разнообразие задают 20 аминокислот, что связано с тем, что одна аминокислота может кодироваться различными последовательностями кодонов, или другими словами, аминокислота может кодироваться разными триплетами нуклеотидов. Это одно из свойств генетического кода (свойство избыточности).
Некоторые аминокислоты животный организм синтезирует самостоятельно, но, как можно догадаться, не все. Такие аминокислоты называются незаменимыми аминокислотами, их следует употреблять с пищей. Например, лейцин используется не просто как биологическая добавка, что достаточно распространено среди фармакологических компаний, но и применяется при лечении заболеваний печени, а также анемии, она же малокровие.
Классификация белков
Протеины – белки, в состав которых входят только белковые молекулы.
Протеиды – белки, в состав которых, кроме белковых молекул, входят небелковые молекулы.
- Гликопротеиды (белок + углевод)
- Липопротеиды (белок + липид)
- Нуклеопротеиды (белок + нуклеиновые кислоты)
Для того чтобы не путаться в понятиях, нужно вспомнить, что принимают спортсмены для того, чтобы скорее нарастить мышечную массу, то есть протеиновые коктейли, батончики и т.д. Именно протеиновые, это слово на слуху, пусть теперь оно ассоциируется с этой классификацией.
Уровни организации белковой молекулы
Структура белка именуется просто по счету, в зависимости от сложности укладки.
Первичная структура белка представляет собой прямую цепь из аминокислот. Она является главной и определяющей свойства, форму и функции белка.
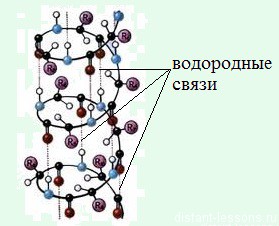
Вторичная структура белка – уже две цепи. Однако эти цепи не идут параллельно друг другу. Они скручены в спираль и связаны водородными связями, которые их удерживают за счет того, что их много. ДНК была обнаружена именно в форме двойной спирали. В этом виде она наиболее известна.
Третичная структура белка – глобула. Глобула означает шар, что и является описанием структуры белка. В этом случае прочность обусловлена тремя видами связей: водородными, ионными и дисульфидными.
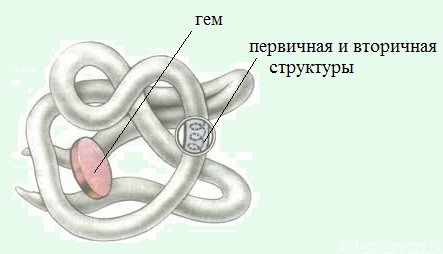
Четвертичная структура белка – это как бы глобула из глобул. Она встречается не у всех белков. Белок крови гемоглобин состоит из 4х субъединиц четвертичной структуры.
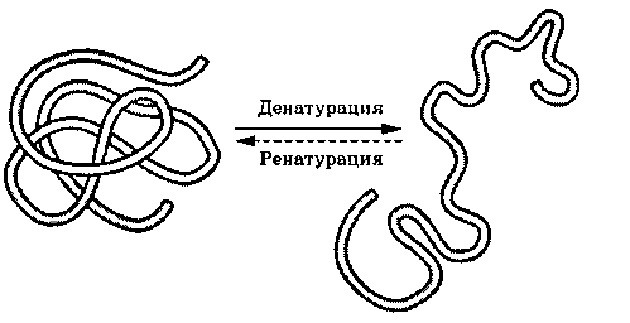
Денатурация – утрата белковой молекулой своей природной структуры. Это обратимый процесс, похожий на сохранение в игре. Если белок денатурировал, но его природная структура не нарушена, то он восстановится. Причин разрушения белка может быть много: высокая температура, химические повреждения, радиация, обезвоживание и т.д. Так что когда мы варим яйца или мясо, то происходит денатурация белка. Как мы видим, к исходному состояния он уже не возвращается (не ренатурирует). Денатурацию и ренатурацию просто запомнить по похожим словам: денатурация – деградация – разрушение; ренатурация – регенерация – восстановление.
Денатурация и ренатурация
Функции белков
1.Структурная функция
Белки входят в состав всего в клетке: мембраны и органоиды. Кроме того, есть белки, которые очень важно знать:
- Коллаген – входит в состав соединительной ткани. Коллаген можно запомнить по кремам, которые обещают продлить молодость и расправить морщины.
- Кератин – известен всем, кто когда-либо смотрел рекламу шампуня для волос. Кератин входит в структуру волос и прочих производных нашего и животного тела: шерсть, перья, ногти, когти, копыта, рога.
- Эластин – как понятно из названия, отвечает за эластичность. Она важна а) в связках, так как они должны растягиваться для совершения движений и возвращаться в исходное состояние. Кстати, в том числе и голосовые связки; б) в сосудах, по которым течет кровь порой под большим давлением, с высоким давлением и скоростью.
2.Ферментативная функция
Ферменты – катализаторы (= ускорители химических реакций) белковой природы. С ферментами происходит тесное знакомство в разделе «пищеварение». Есть одно важное правило, которое нужно обязательно запомнить: все ферменты – белки, но не все белки – ферменты.
3.Транспортная функция
Белки-транспортеры осуществляют перенос веществ через мембрану клетки. Очень наглядным примером транспорта белками является белок-переносчик гемоглобин, благодаря которому мы дышим. В мышцах существует аналог этого белка – миоглобин (приставка мио- означает «сокращение», тем самым называя месторасположение белка).
4.Защитная функция
Изучая иммунитет, ученики и студенты знакомятся с антителами – специфическими белками крови, которые вырабатываются иммунными клетками лимфоцитами для борьбы с чужеродными организмами или вредными соединениями. Так антитела сражаются за нас, когда мы хватаем где-то микробов, так же эти белки воюют, когда человеку переливают кровь неподходящей группы или пересаживают орган, который его организм отторгает. Переливание крови неподходящей группы может привести к летальному исходу, так как произойдет агглютинация – склеивание эритроцитов.
Некоторые растения и животные вырабатывают яды или токсины для того, чтобы защитить себя от нападения и поедания. Поэтому не следует есть незнакомые ягоды, грибы и ловить где-нибудь в тропиках лягушек. Это может закончиться плачевно.
Кроме оборонительной и атакующей функции во благо защиты организма, есть и латающая. При порезе и кровопотере молекулы белка тромбина объединяются для того, чтобы закрыть поврежденный сосуд, а тем временем, тонкие нити белка фибрина переплетаются на поверхности раны, образуя тоненькую пленочку. Если порез был несерьезным, то кровотечение успешно остановлено.
5.Регуляторная функция
Некоторые белки являются гормонами. Они отвечают за регуляцию физиологических процессов организма. Наиболее известным примером белкового гормона является инсулин.
6.Энергетическая функция
Как и углеводы с жирами, белки тоже могут быть расщеплены для получения энергии. Однако, чаще всего, аминокислоты, полученные в результате распада белка, снова используются организмом для построения других белков. Это делает для экономии энергии и биологического материала, ведь в случае повторного использования, не нужно тратиться на синтез новых соединений. При расщеплении 1 г белка высвобождается 17,6 кДж энергии.
Задание EB11693
Установите соответствие между классами органических веществ и выполняемыми ими функциями в клетке.
| ОСОБЕННОСТИ СТРОЕНИЯ И СВОЙСТВ ВЕЩЕСТВА | ВЕЩЕСТВА |
|
A) запасание энергии Б) сигнальная B) хранение генетической информации Г) перенос энергии Д) входит в состав клеточных стенок и мембран Е) реализация генетической информации (синтез белка) |
1) углеводы 2) нуклеиновые кислоты (ДНК, РНК) |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
| А | Б | В | Г | Д | Е |
Для начала вспомним какие вообще есть классы органических веществ в клетке.
Это белки, жиры, углеводы и нуклеиновые кислоты. Белки, жиры и углеводы являются источниками энергии, но у них есть и более локальные функции:
| Белки | Жиры | Углеводы | Нуклеиновые кислоты | |
| Структурная | + | + | ||
| Энергетическая | + | + | + | |
| Защитная | + | + | ||
| Ферментативная | + | |||
| Двигательная | + | |||
| Транспортная | + | |||
| Регуляторная | + | |||
| Рецепторная | + | |||
| Хранение и передача ген.информации | + | |||
| Биосинтез белка | + |
Выберем вначале то,что относится к нуклеиновым кислотам: биосинтез белка и хранение генетической информации.
Остальное — углеводы.
PS: сигнальная и рецепторная функция — одно и то же.
Ответ: 112112
pазбирался: Ксения Алексеевна | обсудить разбор | оценить
Задание EB21891
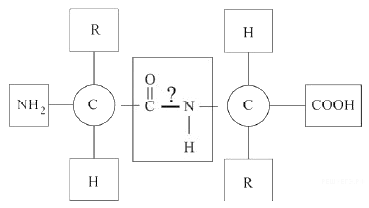
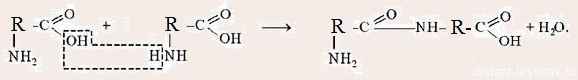
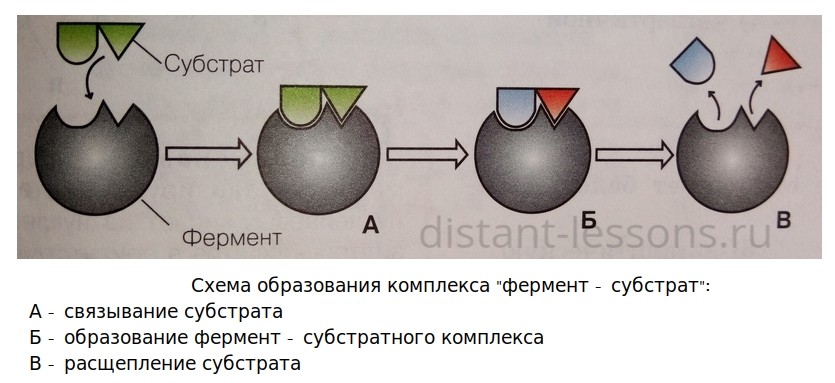
Рассмотрите предложенную схему реакции между аминокислотами. Запишите в ответ понятие, обозначающее название химической связи, отмеченной на схеме знаком вопроса.
На данной схеме изображена реакция между двумя аминокислотами, что известно из вопроса. Между ними действуют пептидные связи.
Пептидная связь — это химическая связь, возникающая между двумя молекулами в результате реакции конденсации между карбоксильной группой (-СООН) одной молекулы и аминогруппой (-NH2) другой молекулы, при выделении одной молекулы воды (H2O).
Ответ: пептидная
pазбирался: Ксения Алексеевна | обсудить разбор | оценить
Ксения Алексеевна | Просмотров: 5.5k
Аминокислоты. Белки
Ключевые слова конспекта: Аминокислоты. Глицин. Пептидная связь. Белки. Качественные реакции на белки. Денатурация белка. ДНК. Ген.
Строение аминокислот
Если проанализировать термин «аминокислоты», то можно прийти к выводу, что так должны называться соединения, содержащие в молекулах две функциональные группы: карбоксильную группу —СООН, определяющую кислотные свойства, и основную аминогруппу —NH2. Вывести общую формулу аминокислот нетрудно:
Органические вещества, содержащие в молекуле карбоксильную группу —СООН и аминогруппу —NH2, называют аминокислотами.
Аминокислоты представляют собой твёрдые кристаллические вещества, многие из них хорошо растворимы в воде, некоторые имеют сладкий вкус.
(с) Цитата из справочного издания «ХИМИЯ. Справочник в таблицах / М.: Издательство АЙРИС-пресс»
Способы получения и химические свойства аминокислот
В промышленности аминокислоты получают биотехнологическим путём как продукты жизнедеятельности микроорганизмов. Кроме того, разработано несколько лабораторных способов получения аминокислот. Один из них может быть представлен следующей схемой:
Простейшую аминокислоту называют аминоуксусной кислотой или глицином, её формула H2N—СН2—СООН.
Какие же свойства проявляют аминокислоты — кислотные или основные? Оказывается, подобно амфотерным неорганическим соединениям, в зависимости от природы реагента аминокислоты могут проявлять свойства как кислоты, так и основания. Например, глицин реагирует со щелочами с образованием солей, проявляя свойства кислоты:
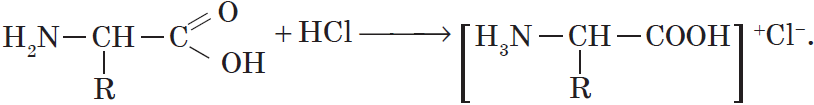
В реакциях с кислотами глицин проявляет свойства органических оснований — аминов:
Понятие о пептидах и белках
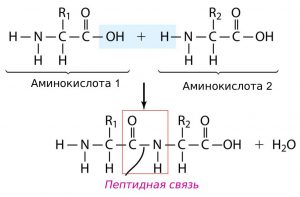
Важное химическое свойство аминокислот — способность взаимодействовать друг с другом с отщеплением молекулы воды, образуя пептиды:
Между двумя остатками аминокислот образуется пептидная связь:
Связь, возникающую между карбоксильной группой —СООН одной молекулы аминокислоты и аминогруппой —NH2 другой молекулы аминокислоты, называют пептидной связью.
Получившийся в результате реакции дипептид может вступать в реакции с другими молекулами аминокислот, образуя полимеры — белки. Поскольку в результате этой реакции, помимо высокомолекулярного вещества, образуется второй продукт — вода, такой процесс относят к реакциям поликонденсации.
О важности белков для живых организмов свидетельствует тот факт, что в большинстве иностранных языков соединения такого типа называют протеинами (от греч. protos — первый). На Земле не существует ни одного живого организма, включая простейшие одноклеточные и бактерии, который не состоял бы из белковых молекул.
Белки — это природные полимеры, образованные остатками аминокислот, связанными между собой пептидными связями.
Структура и функции белков
В состав природных белков входит около 20 аминокислот, а разновидностей белков великое множество. Каким же образом эти 20 аминокислот создают такое многообразие белков? Дело в том, что аминокислотные остатки в белковой молекуле повторяются, а их последовательность, называемая первичной структурой белка, уникальна. Подобным образом из 33 букв русского алфавита состоят десятки тысяч различных слов, различающихся порядком чередования букв («первичная структура» слова) и, как следствие, значением.
Молекулы белков имеют также вторичную и третичную структуру. Характеристика этих структур белковых молекул приведена в таблице.
В зависимости от того, какую функцию выполняет белок в организме, различно его отношение к воде. Большинство белков в воде не растворяется, например кератины, которые составляют основу волос, ногтей, перьев, рогов и т. д. Для некоторых белков выполнение их функций невозможно без растворения. Так, в воде растворяются многие белки, выполняющие функции природных катализаторов, — ферменты.
Химические свойства белков
Для обнаружения белка проводят качественные реакции на белки. Белки дают фиолетовое окрашивание в щелочной среде под действием свежеприготовленного осадка гидроксида меди(II). Эту пробу называют биуретовой реакцией.
Вторую качественную реакцию на белки называют ксантопротеиновой. При действии на раствор белка концентрированной азотной кислоты образуется белый осадок, который быстро приобретает жёлтую окраску, а при добавлении водного раствора аммиака становится оранжевым.
Для обнаружения в белках соединений серы используют следующий тест. При горении серосодержащих белков появляется характерный запах жжёного рога.
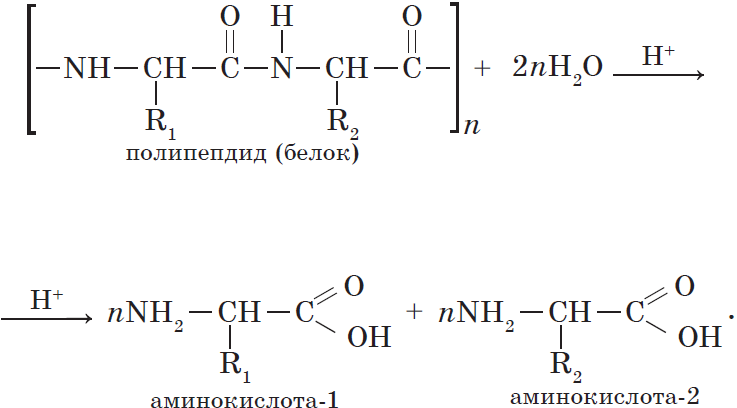
Одно из важнейших химических свойств белков — реакции гидролиза. В присутствии природных катализаторов (ферментов) или сильных кислот молекулы воды расщепляют полимерную белковую молекулу до аминокислот:
Именно такой процесс протекает при переваривании белковой пищи. Образующиеся аминокислоты попадают в кровь, затем транспортируются в каждую клетку организма, где из них синтезируются белковые молекулы, характерные именно для этого вида живых организмов. Теперь вы понимаете, почему белки, наряду с жирами и углеводами, — основной компонент пищи. Недостаток белка в питании человека может вызвать тяжёлые заболевания. При несбалансированном питании у людей отмечается плохое самочувствие, быстрая утомляемость, снижение иммунитета. Многие юноши и девушки вашего возраста изнуряют себя разными диетами с целью похудеть, а то и вовсе отказываются от еды. Такая «коррекция фигуры» может привести к непоправимым проблемам со здоровьем.
При относительно небольшом нагревании или действии химических реагентов нарушается структура белка, т. е. происходит его денатурация (от лат. denaturatus; de- — приставка, означающая «отделение, удаление», +nature — природа). Для живых организмов денатурация белка — это гибель. Однако в пищевой промышленности тепловая денатурация белков — один из обычных технологических процессов. Варка и обжаривание продуктов, выпечка хлеба, производство макаронных изделий, приготовление творога — все эти операции связаны с денатурацией белков.
Белки играют ключевую роль почти во всех структурах живых организмов и происходящих в них процессах.
В каждой клетке организма синтезируется множество белков. Информация о структуре всех белков организма зашифрована в ещё одних природных биополимерах — молекулах дезоксирибонуклеиновых кислот (ДНК). Мономеры ДНК — нуклеотиды. Молекулы ДНК человека содержат примерно 3,1 млрд пар нуклеотидов. Участок молекулы ДНК, отвечающий за синтез одного белка, называют геном.
Справочная таблица «Аминокислоты»
Конспект урока по химии «Аминокислоты. Белки». В учебных целях использованы цитаты из пособия «Химия. 10 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
У человека имеются четыре фенотипа по группам крови: I(0), II(А), III(В), IV(АВ). Ген, определяющий группу крови, имеет три аллеля: IA, IB, i-0, причем аллель i-0 является рецессивной по отношению к аллелям IA и IB. Ген дальтонизма d сцеплен с Х-хромосомой. В брак вступили женщина со II группой крови (гетерозигота) и мужчина с III (гомозигота) группой крови. Известно, что отец женщины страдал дальтонизмом, мать была здорова. У родственников мужчины этой болезни никогда не было. Определите генотипы родителей. Укажите возможные генотипы и фенотипы (номер группы крови) детей. Составьте схему решения задачи. Определите вероятность рождения детей-дальтоников и детей со II группой крови.
1. Установите соответствие между классами органических веществ и выполняемыми ими функциями в клетке.
|
ОСОБЕННОСТИ СТРОЕНИЯ И СВОЙСТВ ВЕЩЕСТВА |
ВЕЩЕСТВА |
|
|
A) запасание энергии Б) сигнальная B) хранение генетической информации Г) перенос энергии Д) входит в состав клеточных стенок и мембран Е) реализация генетической информации (синтез белка) |
1) углеводы 2) нуклеиновые кислоты (ДНК, РНК) |
2. Установите соответствие между признаками и видами нуклеиновых кислот.
|
ПРИЗНАКИ НУКЛЕИНОВЫХ КИСЛОТ |
ВИДЫ НУКЛЕИНОВЫХ КИСЛОТ |
|
|
A) хранит наследственную информацию Б) копирует наследственную информацию и передаёт её к месту синтеза белка B) является матрицей для синтеза белка Г) состоит из двух цепей Д) переносит аминокислоты к месту синтеза белка Е) специфична по отношению к аминокислоте |
1) ДНК 2) и-РНК 3) т-РНК |
3. Установите соответствие между особенностями нуклеиновой кислоты и её видом.
|
ОСОБЕННОСТИ НК |
ВИД НК |
|
|
A) хранит и передаёт наследственную информацию Б) включает нуклеотиды АТГЦ B) триплет молекулы называется кодоном Г) молекула состоит из двух цепей Д) передаёт информацию на рибосомы Е) триплет молекулы называется антикодоном |
1) ДНК 2) и-РНК 3) т-РНК |
4. Установите соответствие между характеристиками органических веществ и их видами.
|
ХАРАКТЕРИСТИКИ |
ВИДЫ |
|
|
А) имеет первичную, вторичную, третичную и четвертичную структуры Б) мономеры — аминокислоты В) в состав молекулы обязательно входят атомы фосфора Г) выполняет структурные функции, являясь частью клеточных мембран Д) синтезируется на ДНК Е) образован(-а) полинуклеотидной нитью |
1) белок 2) РНК |
5. Установите соответствие
|
ХАРАКТЕРИСТИКА |
ВИД МОЛЕКУЛЫ |
|
|
А) состоит из нуклеотидов Б) обладают способностью образовывать пептидную связь В) способны действовать как буферные системы Г) обеспечивает матричный синтез рибо- нуклеиновых кислот Д) способны к репликации Е) содержат карбоксильную и аминогруппы в молекуле |
1) аминокислоты 2) ДНК |
6. Установите соответствие между характеристиками и оргноидами: к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца.
|
ХАРАКТЕРИСТИКА |
ОРГАНОИД |
|
|
А) образует лизосомы Б) может присоединять рибосомы В) формирует секреторные пузырьки Г) отвечает за досборку белков после синтеза Д) обеспечивает синтез полипептидных цепей Е) представлен стопкой плоских цистерн |
1) аппарат Гольджи 2) эндоплазматическая сеть |
7. Установите соответствие между характеристиками и видами органических веществ: к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца.
|
ХАРАКТЕРИСТИКА |
ОРГАНИЧЕСКОЕ ВЕЩЕСТВО |
|
|
А) служит источником информации о структуре белка Б) транспортирует энергию В) содержит три остатка фосфорной кислоты Г) образует рибосомы Д) транспортирует аминокислоты Е) состоит из одной полинуклеотидной цепи |
1) РНК 2) АТФ |
Задание 4
1. Выберите признаки РНК.
1) содержится в рибосомах и ядрышке
2) способна к репликации
3) состоит из одной цепи
4) содержится в хромосомах
5) набор нуклеотидов АТГЦ
6) набор нуклеотидов АГЦУ
2. Белки, в отличие от нуклеиновых кислот,
1) участвуют в образовании плазматической мембраны
2) входят в состав хромосом3) участвуют в гуморальной регуляции
4) осуществляют транспортную функцию
5) выполняют защитную функцию
6) переносят наследственную информацию из ядра к рибосоме
3 Выберите ТРИ функции ДНК в клетке
1) посредник в передаче наследственной информации
2) хранение наследственной информации
3) кодирование аминокислот
4) матрица для синтеза иРНК
5) регуляторная
6) структурирование хромосом
4. Молекула ДНК
1) полимер, мономером которого является нуклеотид
2) полимер, мономером которого является аминокислота
3) двуцепочный полимер
4) одноцепочный полимер
5) содержит наследственную информацию
6) выполняет энергетическую функцию в клетке
5. Какие признаки характерны для молекулы ДНК?
1) состоит из одной полипептидной нити
2) состоит из двух полинуклеотидных нитей, закрученных в спираль
3) имеет нуклеотид, содержащий урацил
4) имеет нуклеотид, содержащий тимин
5) сохраняет наследственную информацию
6) переносит информацию о строении белка из ядра к рибосоме
6. Чем молекула иРНК отличается от ДНК?
1) переносит наследственную информацию из ядра к рибосоме
2) в состав нуклеотидов входят остатки азотистых оснований, углевода и фосфорной кислоты
3) состоит из одной полинуклеотидной нити
4) состоит из связанных между собой двух полинуклеотидных нитей
5) в ее состав входит углевод рибоза и азотистое основание урацил
6) в ее состав входит углевод дезоксирибоза и азотистое основание тимин
7.Все перечисленные ниже признаки, кроме двух, можно использовать для описания молекулы ДНК. Определите два признака, «выпадающих» из общего списка, и запишите в таблицу цифры, под которыми они указаны.
1) состоит из двух полинуклеотидных цепей, закрученных в спираль
2) переносит информацию к месту синтеза белка
3) в комплексе с белками строит тело рибосомы
4) способна самоудваиваться
5) в комплексе с белками образует хромосомы
8. Все приведённые ниже признаки, кроме двух, можно использовать для описания функций нуклеиновых кислот в клетке. Определите два признака, «выпадающих» из общего списка, и запишите в ответ цифры, под которыми они указаны.
1) осуществляют гомеостаз
2) переносят наследственную информацию из ядра к рибосоме
3) участвуют в биосинтезе белка
4) входят в состав клеточной мембраны
5) транспортируют аминокислоты
9. Все перечисленные ниже признаки, кроме двух, можно использовать для описания молекулы ДНК. Определите два признака, «выпадающие» из общего списка, и запишите в таблицу цифры, под которыми они указаны.
1) состоит из двух цепей, образующих спираль
2) содержит нуклеотиды АТГЦ
3) в состав входит сахар рибоза
4) самоудваивается
5) участвует в процессе трансляции
10. Все приведённые ниже признаки, кроме двух, можно использовать для описания функций нуклеиновых кислот в клетке. Определите два признака, «выпадающих» из общего списка, и запишите в ответ цифры, под которыми они указаны.
1) осуществляют гомеостаз
2) переносят наследственную информацию из ядра к рибосоме
3) участвуют в биосинтезе белка
4) входят в состав клеточной мембраны
5) транспортируют аминокислоты
11. Все перечисленные ниже признаки, кроме двух, можно использовать для описания молекулы ДНК. Определите два признака, «выпадающие» из общего списка, и запишите в таблицу цифры, под которыми они указаны.
1) состоит из двух цепей, образующих спираль
2) содержит нуклеотиды АТГЦ
3) в состав входит сахар рибоза
4) самоудваивается
5) участвует в процессе трансляции
1) у эукариот синтезируется в ядре
2) содержит урацил и рибозу
3) содержит остатки фосфорной кислоты
4) содержит информацию о структуре белков
5) бывает информационной
Задание3
1. Сколько нуклеотидов во фрагменте матричной цепи ДНК кодируют 55 аминокислот во фрагменте полипептида? В ответе запишите только соответствующее число.
2. В молекуле ДНК количество нуклеотидов с гуанином составляет 20% от общего числа. Сколько нуклеотидов в % с тимином в этой молекуле. В ответ запишите только соответствующее число.
3. В молекуле ДНК количество нуклеотидов с тимином составляет 40% от общего числа. Сколько нуклеотидов в % с гуанином в этой молекуле. В ответ запишите только соответствующее число.
4. Какой процент нуклеотидов с цитозином содержит ДНК, если доля её адениновых нуклеотидов составляет 10% от общего числа. В ответ запишите только соответствующее число.
5. Сколько нуклеотидов в гене кодируют последовательность 60 аминокислот в молекуле белка. В ответ запишите только соответствующее число.
Белки – это биологические гетерополимеры; синтезируются в живых организмах и выполняют в них важнейшие функции. В состав белков входят атомы углерода, кислорода, водорода, азота и иногда серы.

Аминокислоты обладают свойствами и кислоты и основания (они амфотерны), поэтому могут соединяться друг с другом. Чередование разных аминокислот в разной последовательности позволяет получать огромное количество различных по структуре и функциям белков.
В белках встречается 20 видов различных аминокислот, некоторые из которых животные синтезировать не могут (отсюда – заменимые и незаменимые аминокислоты). Они получают их от растений, которые могут синтезировать все аминокислоты. Именно до аминокислот расщепляются белки в пищеварительных трактах животных. Из этих аминокислот, поступающих в клетки организма, строятся его новые белки.
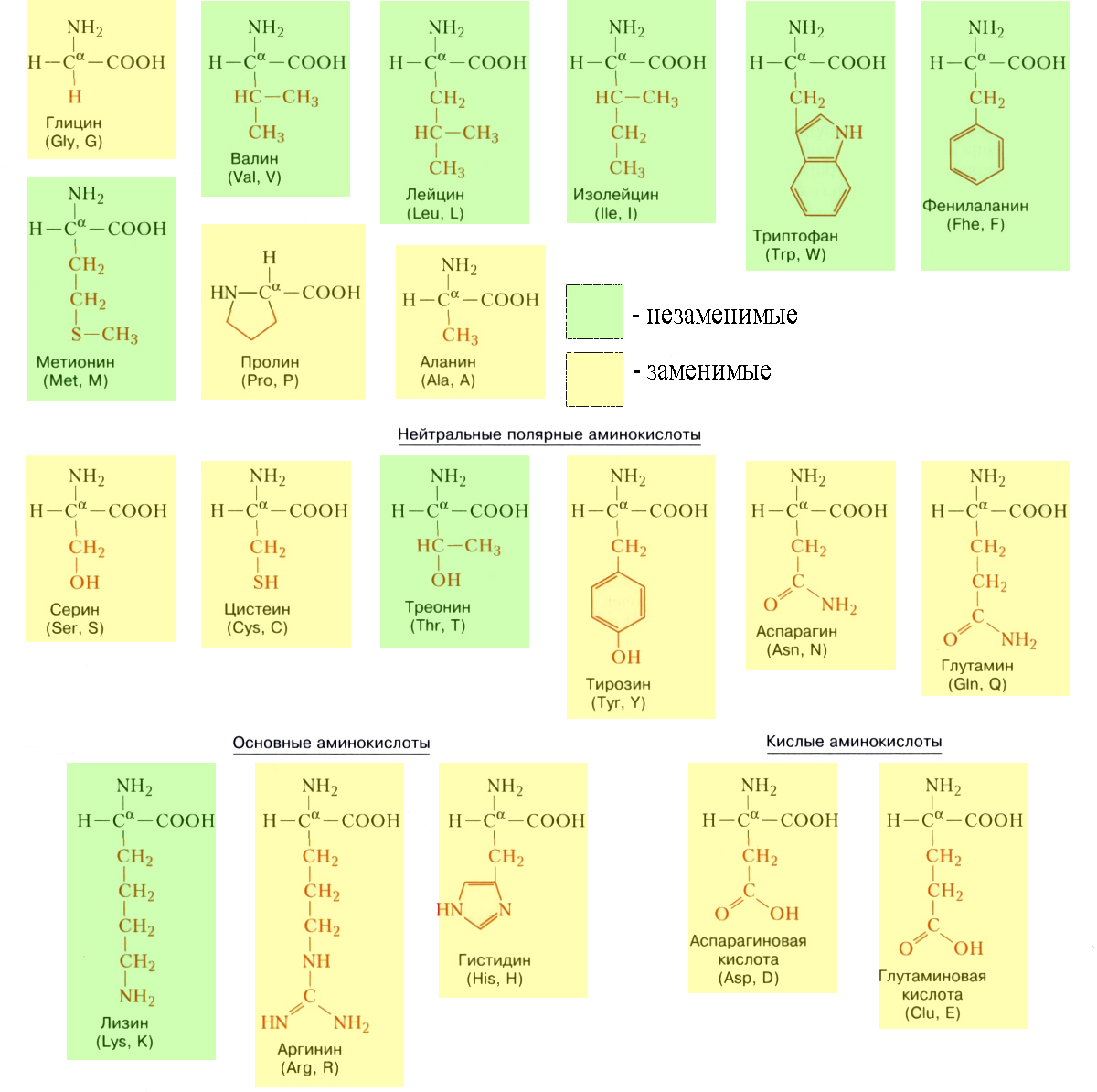
Незаменимых аминокислот восемь: валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин. Если они не поступают в организм, происходит значительное нарушение его функций. Запомнить незаменимые аминокислоты можно так:
Таблица аминокислот
Структура белковой молекулы – это ее аминокислотный состав, последовательность мономеров (аминокислот) и степень скрученности молекулы.
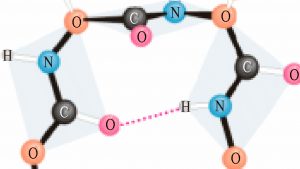
3. Далее молекула белка сложной конфигурации в виде глобулы (шарика), приобретает третичную структуру. Прочность этой структуры обеспечивается гидрофобными, водородными, ионными и дисульфидными S-S связями, обеспечивающими сцепку между отдельными участками спирали.
Нарушение четвертичной, третичной и вторичной структур ↔обратимо↔.
Разрушение первичной структуры необратимо.
Белки имеют видовую специфичность: каждый вид организмов обладает белками, не встречающимися у других видов.
Аминокислоты — гетерофункциональные соединения, которые обязательно содержат две функциональные группы: аминогруппу $—NH_2$ и карбоксильную группу $—СООН$, связанные с углеводородным радикалом.
Общую формулу простейших аминокислот можно записать так:
Так как аминокислоты содержат две различные функциональные группы, которые оказывают влияние друг на друга, характерные реакции отличаются от характерных реакций карбоновых кислот и аминов.
Свойства аминокислот
Аминогруппа $—NH_2$ определяет основные свойства аминокислот, т.к. способна присоединять к себе катион водорода по донорно-акцепторному механизму за счет наличия свободной электронной пары у атома азота.
Группа $—СООН$ (карбоксильная группа) определяет кислотные свойства этих соединений. Следовательно, аминокислоты — это амфотерные органические соединения.
Со щелочами они реагируют как кислоты:
С сильными кислотами — как основания-амины:
Кроме того, аминогруппа в аминокислоте вступает во взаимодействие с входящей в ее состав карбоксильной группой, образуя внутреннюю соль:
Так как аминокислоты в водных растворах ведут себя как типичные амфотерные соединения, то в живых организмах они играют роль буферных веществ, поддерживающих определенную концентрацию ионов водорода.
Аминокислоты представляют собой бесцветные кристаллические вещества, плавящиеся с разложением при температуре выше $200°С$. Они растворимы в воде и нерастворимы в эфире. В зависимости от радикала $R—$ они могут быть сладкими, горькими или безвкусными.
Аминокислоты подразделяют на природные (обнаруженные в живых организмах) и синтетические. Среди природных аминокислот (около $150$) выделяют протеиногенные аминокислоты (около $20$), которые входят в состав белков. Они представляют собой L-формы. Примерно половина из этих аминокислот относятся к незаменимым, т.к. они не синтезируются в организме человека. Незаменимыми являются такие кислоты, как валин, лейцин, изолейцин, фенилаланин, лизин, треонин, цистеин, метионин, гистидин, триптофан. В организм человека данные вещества поступают с пищей. Если их количество в пище будет недостаточным, нормальное развитие и функционирование организма человека нарушаются. При отдельных заболеваниях организм не в состоянии синтезировать и некоторые другие аминокислоты. Так, при фенилкетонурии не синтезируется тирозин.
Важнейшим свойством аминокислот является способность вступать в молекулярную конденсацию с выделением воды и образованием амидной группировки $—NH—CO—$, например:
${nNH_2—(CH_2)_5—COOH}↙{text»аминокапроновая кислота»}→{(…—NH—(CH_2)_5—COO—…)_n}↙{text»капрон»}+(n+1)H_2O$.
Получаемые в результате такой реакции высокомолекулярные соединения содержат большое число амидных фрагментов и поэтому получили название полиамидов.
Для получения синтетических волокон пригодны аминокислоты с расположением аминои карбоксильной групп на концах молекул.
Полиамиды $α$-аминокислот называются пептидами. В зависимости от числа остатков аминокислот различают дипептиды, пептиды, полипептиды. В таких соединениях группы $—NH—CO—$ называют пептидными.
Некоторые аминокислоты, входящие в состав белков.
| Название аминокислоты | Формула |
| Глицин (аминоуксусная) | $NH_2-CH_2-COOH$ |
| Аланин ($α$-аминопропионовая) | 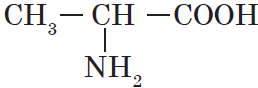 |
| Цистеин ($α$-амино-$β$меркаптопропионовая) | 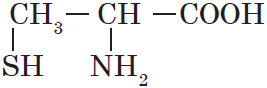 |
| Лизин ($α$, $ε$-диаминокапроновая) | 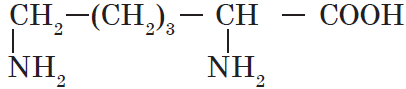 |
| Фенилаланин ($α$-амино-$β$фенилпропионовая) | 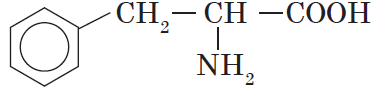 |
Белки
Белками, или белковыми веществами, называют высокомолекулярные (молекулярная масса варьируется от $5–10$ тыс. до $1$ млн и более) природные полимеры, молекулы которых построены из остатков аминокислот, соединенных амидной (пептидной) связью.
Белки также называют протеинами (от греч. protos — первый, важный). Число остатков аминокислот в молекуле белка очень сильно колеблется и иногда достигает нескольких тысяч. Каждый белок обладает своей, присущей ему, по следовательностью расположения аминокислотных остатков.
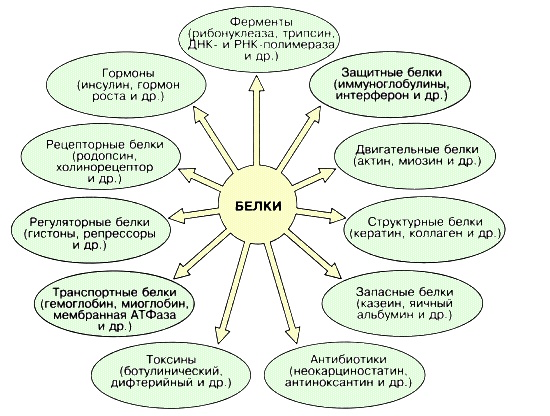
Белки выполняют разнообразные биологические функции: каталитические (ферменты), регуляторные (гормоны), структурные (коллаген, фиброин), двигательные (миозин), транспортные (гемоглобин, миоглобин), защитные (иммуноглобулины, интерферон), запасные (казеин, альбумин, глиадин) и другие.
Белки — основа биомембран, важнейшей составной части клетки и клеточных компонентов. Они играют ключевую роль в жизни клетки, составляя как бы материальную основу ее химической деятельности.
Исключительное свойство белка — самоорганизация структуры, т.е. его способность самопроизвольно создавать определенную, свойственную только данному белку пространственную структуру. По существу, вся деятельность организма (развитие, движение, выполнение им различных функций и многое другое) связана с белковыми веществами. Без белков невозможно представить себе жизнь.
Белки — важнейшая составная часть пищи человека и животных, поставщик необходимых аминокислот.
Строение белков
Все белки образованы двадцатью разными $α$-аминокислотами, общую формулу которых можно представить в виде
$R-CHNH_2-COOH$
где радикал R может иметь самое разнообразное строение.
Белки представляют собой полимерные цепи, состоящие из десятков тысяч, миллионов и более остатков $α$-аминокислот, связанных между собой пептидными связями. Последовательность аминокислотных остатков в молекуле белка называют его первичной структурой.
Для белковых тел характерны огромные молекулярные массы (до миллиарда) и почти макроразмеры молекул. Такая длинная молекула не может быть строго линейной, поэтому ее участки изгибаются и сворачиваются, что приводит к образованию водородных связей с участием атомов азота и кислорода. Образуется регулярная спиралевидная структура, которую называют вторичной структурой.
В белковой молекуле могут возникать ионные взаимодействия между карбоксильными и аминогруппами различных аминокислотных остатков и образование дисульфидных мостиков. Эти взаимодействия приводят к появлению третичной структуры.
Белки с $M_r > 50000$ состоят, как правило, из нескольких полипептидных цепей, каждая из которых уже имеет первичную, вторичную и третичную структуры. Говорят, что такие белки обладают четвертичной структурой.
Свойства белков
Белки — амфотерные электролиты. При определенном значении $рН$ среды (оно называется изоэлектрической точкой) число положительных и отрицательных зарядов в молекуле белка одинаково.
Это одно из основных свойств белка. Белки в этой точке электронейтральны, а их растворимость в воде наименьшая. Способность белков снижать растворимость при достижении электронейтральности их молекул используется для выделения из растворов, например, в технологии получения белковых продуктов.
Гидратация. Процесс гидратации означает связывание белками воды, при этом они проявляют гидрофильные свойства: набухают, их масса и объем увеличиваются. Набухание отдельных белков зависит от их строения. Имеющиеся в составе и расположенные на поверхности белковой макромолекулы гидрофильные амидные ($—СО—NH—$, пептидная связь), аминные ($—NH_2$) и карбоксильные ($—СООН$) группы притягивают к себе молекулы воды, строго ориентируя их на поверхности молекулы. Окружающая белковые глобулы гидратная (водная) оболочка препятствует агрегации и осаждению, а следовательно, способствует устойчивости растворов белка. В изоэлектрической точке белки обладают наименьшей способностью связывать воду, происходит разрушение гидратной оболочки вокруг белковых молекул, поэтому они соединяются, образуя крупные агрегаты. Агрегация белковых молекул происходит и при их обезвоживании с помощью некоторых органических растворителей, например этилового спирта. Это приводит к выпадению белков в осадок. При изменении $рН$ среды макромолекула белка становится заряженной, и его гидратационная способность меняется.
При ограниченном набухании концентрированные белковые растворы образуют сложные системы, называемые студнями. Студни не текучи, упруги, обладают пластичностью, определенной механической прочностью, способны сохранять свою форму.
Различная гидрофильность клейковинных белков — один из признаков, характеризующих качество зерна пшеницы и получаемой из него муки (так называемые сильные и слабые пшеницы). Гидрофильность белков зерна и муки играет важную роль при хранении и переработке зерна, в хлебопечении. Тесто, которое получают в хлебопекарном производстве, представляет собой набухший в воде белок, концентрированный студень, содержащий зерна крахмала.
Денатурация белков. При денатурации под влиянием внешних факторов (температуры, механического воздействия, действия химических агентов и ряда других факторов) происходит изменение вторичной, третичной и четвертичной структур белковой макромолекулы, т.е. ее нативной пространственной структуры. Первичная структура, а следовательно, и химический состав белка не меняются. Изменяются физические свойства: снижается растворимость, способность к гидратации, теряется биологическая активность. Меняется форма белковой макромолекулы, происходит агрегирование. В то же время увеличивается активность некоторых химических групп, облегчается воздействие на белки протеолитических ферментов, а следовательно, он легче гидролизуется.
В пищевой технологии особое практическое значение имеет тепловая денатурация белков, степень которой зависит от температуры, продолжительности нагрева и влажности. Это необходимо помнить при разработке режимов термообработки пищевого сырья, полуфабрикатов, а иногда и готовых продуктов. Особую роль процессы тепловой денатурации играют при бланшировании растительного сырья, сушке зерна, выпечке хлеба, получении макаронных изделий. Денатурация белков может вызываться и механическим воздействием (давлением, растиранием, встряхиванием, ультразвуком). Наконец, к денатурации белков приводит действие химических реагентов (кислот, щелочей, спирта, ацетона). Все эти приемы широко используются в пищевой и биотехнологии.
Пенообразование. Под процессом пенообразования понимают способность белков образовывать высококонцентрированные системы «жидкость — газ», называемые пенами. Устойчивость пены, в которой белок является пенообразователем, зависит не только от его природы и от концентрации, но и от температуры. Белки в качестве пенообразователей широко используются в кондитерской промышленности (пастила, зефир, суфле). Структуру пены имеет хлеб, а это влияет на его вкусовые качества.
Молекулы белков под влиянием ряда факторов могут разрушаться или вступать во взаимодействие с другими веществами с образованием новых продуктов. Для пищевой промышленности можно выделить два важных процесса: 1) гидролиз белков под действием ферментов; 2) взаимодействие аминогрупп белков или аминокислот с карбонильными группами восстанавливающих сахаров. Под влиянием протеаз-ферментов, катализирующих гидролитическое расщепление белков, последние распадаются на более простые продукты (поли- и дипептиды) и в итоге на аминокислоты. Скорость гидролиза белка зависит от его состава, молекулярной структуры, активности фермента и условий.
Гидролиз белков. Реакцию гидролиза с образованием аминокислот в общем виде можно записать так:
Горение. Белки горят с образованием азота, углекислого газа и воды, а также некоторых других веществ. Горение сопровождается характерным запахом жженых перьев.
Цветные реакции. Используют следующие реакции:
— ксантопротеиновую, при которой происходит взаимодействие ароматических и гетероатомных циклов в молекуле белка с концентрированной азотной кислотой, сопровождающееся появлением желтой окраски;
— биуретовую, при которой происходит взаимодействие слабощелочных растворов белков с раствором сульфата меди (II) с образованием комплексных соединений между ионами $Cu^{2+}$ и полипептидами. Реакция сопровождается появлением фиолетово-синей окраски.
Аминокислоты и белки
17-Июл-2013 | Нет комментариев | Лолита Окольнова
Аминокислоты
— основа белковой жизни на Земле
А вы знаете, что многие ученые называют жизнь на земле «белковой»? Основу белка составляют аминокислоты. А как они появились на Земле?
Белки — это макромолекулы, имеющие большую молекулярную ( до 1,5 млн у.е.) массу. Все белки являются полимерами нерегулярного строения, состоящими из отдельных мономеров — аминокислот, определяющихся генетическим кодом.
Есть такая гипотеза, что в самом начале на Земле не было всех тех органических соединений, которые мы наблюдаем теперь. И в то далекое-предалекое время наша планета постоянно подвергалась бомбардировке метеоритами и кометами. И эти самые метеориты содержали в себе органические соединения, в том числе и аминокислоты. Получается, что жизнь на Землю принесли извне…
У любой теории есть много как сторонников, так и противников. В научном мире жаркие споры по этой теме до сих пор не угасают, наша задача — разобраться что такое аминокислоты и белки какую роль они играют в нашем мире.
Аминокислота — вещество, имеющее двойственную природу:
Из-за наличия аминогруппы и карбоксильной группы аминокислоты амфотерны — проявляют и основные и кислотные свойства и могут соединяться между собой. Такая связь называется пептидной.
Белков на Земле огромное количество. Это обязательная часть химического состава клетки. Как получилось, что природа имеет столько вариантов?
- Аминокислот в белке много. Вплоть до нескольких тысяч!
- Аминокислоты в белке могут находиться в разной последовательности. Именно разные сочетания аминокислот в белковой цепи дает такую вариативность.
В природе известно 20 видов аминокислот.
Откуда они берутся в природе? Обычно они получаются при гидролизе белков и затем, в ходе обмена веществ, опять образуют белки.
Аминокислоты принято делить на заменимые и незаменимые
>/center>
Заменимые аминокислоты наш организм может синтезировать сам, но при этом обеспечивается только минимум потребностей организма.
Незаменимые аминокислоты — те, которые организм потребляет извне — с белковой пищей или образуются из других аминокислот.
Интересно то, что растения могут синтезировать ВСЕ аминокислоты! Что бы мы без них делали? И кислород они нам для дыхания поставляют, и аминокислотами у них запастись можно… одним словом, Продуценты!
Для формата ЕГЭ не нужно знать наизусть все 20 аминокислот и их формулы, но надо понимать их строение и функции в организме, ведь аминокислоты — «кирпичики» белков, а жизнь у нас именно белковая! 🙂
Белки
они же полипептиды, они же протеины
Ф.Энгельс биологом не был, но дал такое определение жизни:
Жизнь есть способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их внешней природой, причем с прекращением этого обмена веществ прекращается и жизнь, что приводит к разложению белка
Конечно, это определение не научное и не затрагивает очень многие признаки живых систем, но определяет один самый важный момент —
жизнь на земле белковая
Строение и функции белков
Белки — полимеры, мономерами которых являются аминокислоты. В составе белков всего 20 аминокислот, а вот комбинаций этих аминокислот может быть очень много! За счет этого достигается разнообразие. Поэтому белков в природе огромное количество!
Белковый состав так и записывается — последовательностью аминокислот, которые обозначаются тремя буквами:
То, что показано на рисунке — последовательность аминокислот — это целая длинная большая молекула (то, что приведено здесь — это очень маленький белок, обычно такие молекулы на порядок длиннее).
В теме про аминокислоты мы уже рассмотрели механизм образования такого полимера — полипептида.
Белки делят на:
- простые — состоят только из аминокислот;
- сложные — кроме аминокислот содержат вещества небелковой природы.
Первичная структура (конформация) белка
— это именно эта последовательность — то, какие аминокислоты и в какой последовательности они соединены ковалентными связями.
Вторичная структура белка
Это спираль, которая образуется уже за счет межмолекулярных — водородных связей.
Третичная структура белка
Эта структура образована свернутыми спиралями — такое образование называется глобула.
Четвертичная структура белка
это совместное объединение нескольких схожих по строению третичных белковых структур (глобул или субъединиц) в единую молекулу с приобретением ею природных свойств.
Сами глобулы в этой структуре называют протомерами, а само четвертичное образование — мультимером.
Белки довольно легко подвергаются разрушению. Сначала «ломается» четвертичная, потом третичная, потом уже вторичная структура. Разрушить первичную структуру сложнее. Это уже, скорее, химическое взаимодействие.

Самые известные денатуранты -температура (нагревание), спирт, кислоты и щелочи.
Простой и повседневный пример денатурации — яичница! 🙂
Ренатурация — обратный процесс — восстановление разрушенной структуры белка.
Функции белков
- структурная — белок является обязательным компонентом любой мембраны, любого хряща…
- почти все ферменты имеют белковую природу. Ферменты=биокатализаторы. На каждую реакцию есть свой фермент.
- Гормоны имеют белковую природу.
- Транспорт — белки переносят вещества через мембрану клетки, гемоглобин — кислород в крови…
Функций у белков очень много… то, что перечислено выше — только самые основные.
Каждый вид растений и животных имеет особый, только ему присущий набор белков, т. е. белки являются основой видовой специфичности.
- у разных видов есть одинаковые белки, выполняющие определенные функции (например, у собаки и человека за регуляцию сахара в крови отвечает гормон инсулин)
- у представителей одного вида белки могут отличаться по строению (например, белки групп крови)
Белки — основа жизни на Земле, и найти какие-либо процессы, проходящие в живом организме без их участия, практически невозможно…
Редко, но все же встречаются в вопросах ЕГЭ такие термины:
- дистальные белки — белки мембраны клетки

Обсуждение: «Аминокислоты и белки»
(Правила комментирования)