Таблицы на ЕГЭ и ОГЭ по химии
На сдаче ЕГЭ и ОГЭ по химии можно использовать три таблицы:
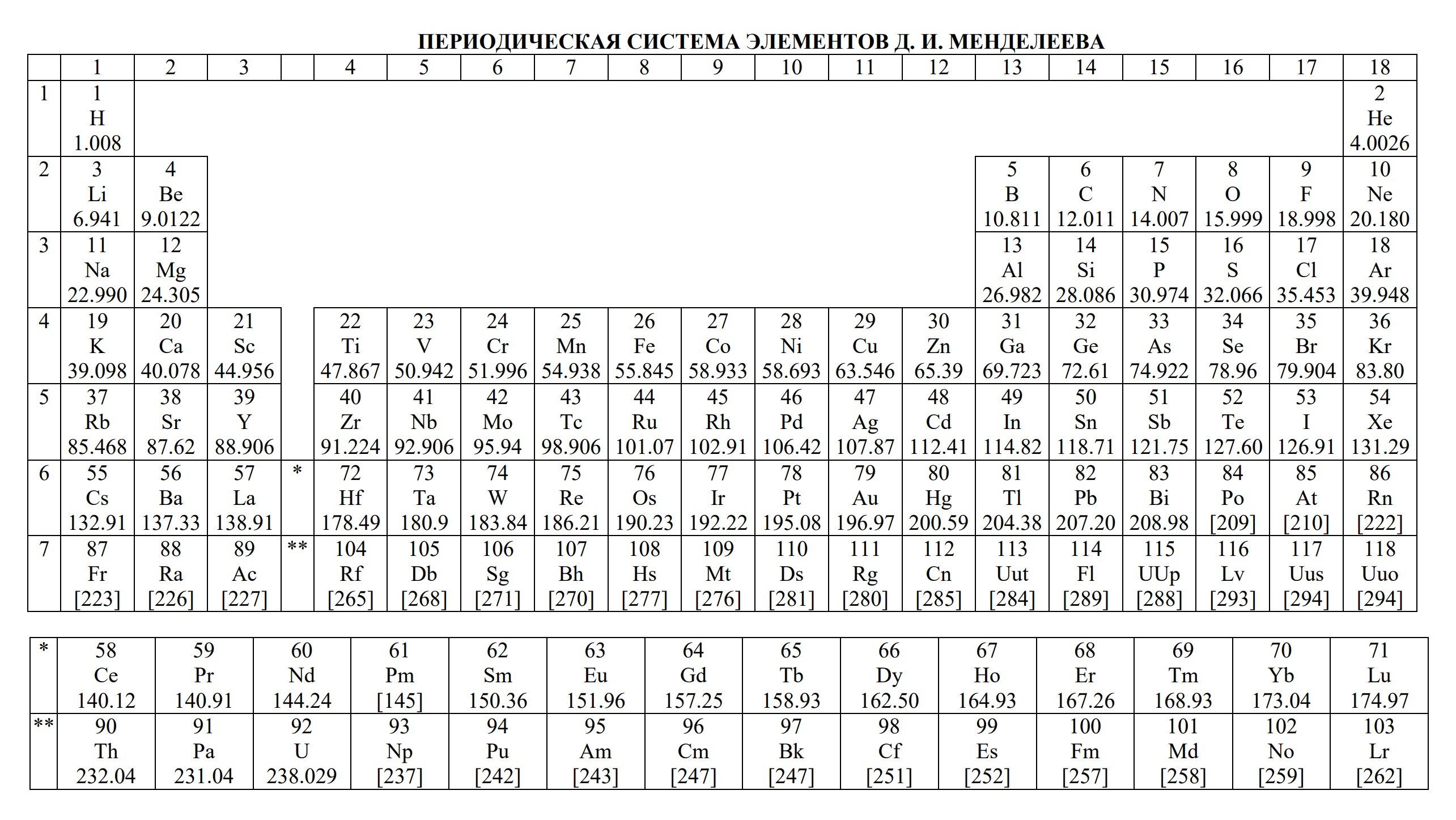
- периодическая система химических элементов Д.И. Менделеева
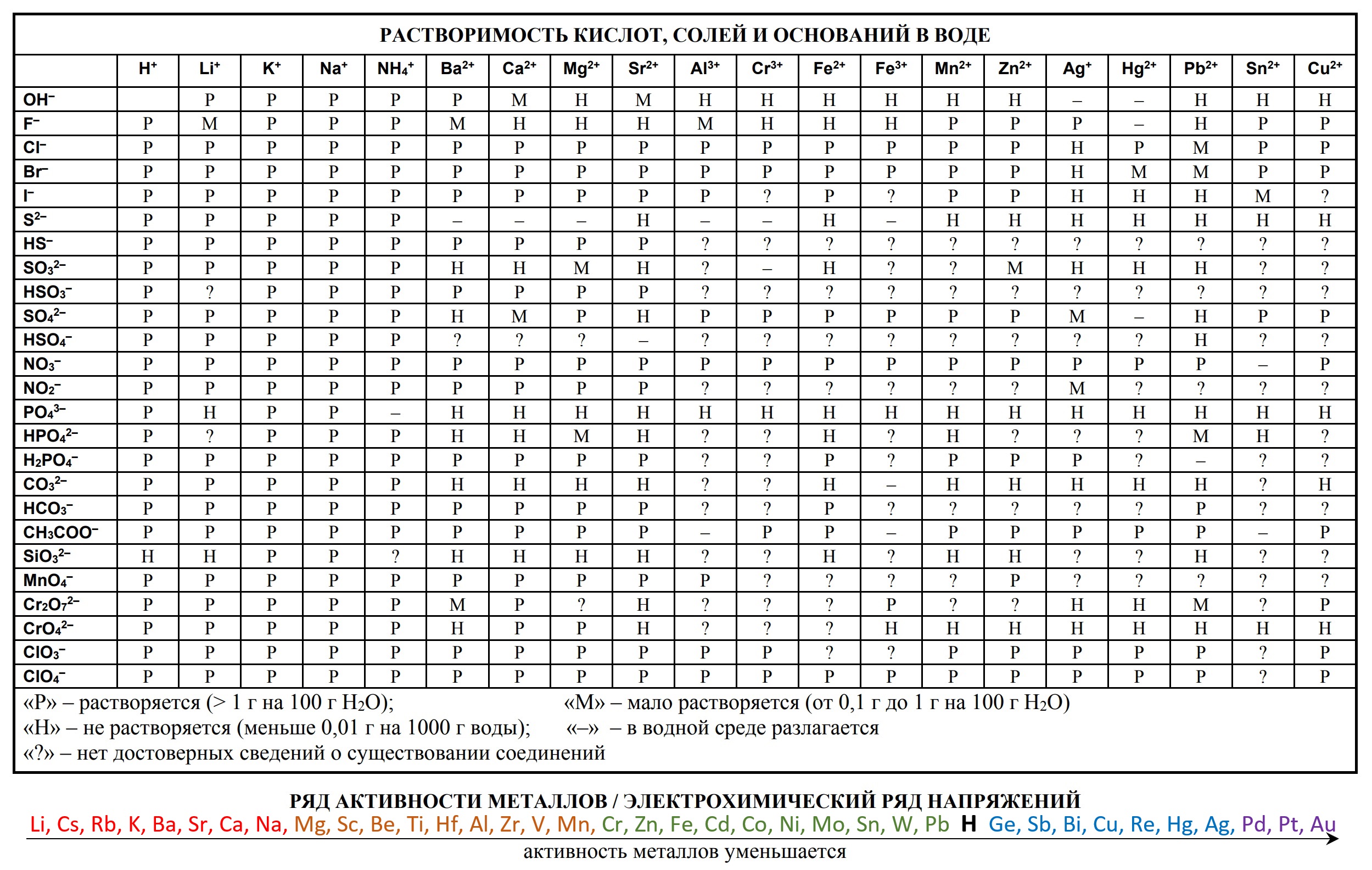
- таблица растворимости
- ряд активности металлов.
Они содержат в себе 80% информации, необходимой для решения большинства заданий.
Однако таблицы на форзацах разных учебников, продаваемые в книжных магазинах, располагающиеся на просторах интернета отличаются не только оформлением, но и содержанием. Что бы они оказались надёжно шпаргалкой, а не приятной неожиданностью, лучше с самого начала начинать работать с тем форматом, который официально разрешен на ЕГЭ твоего года.
Скачать эти таблицы можно ниже. А как сделать эти безликие таблицы наиболее информационными для тебя я расскажу на уроке.
- Таблица Д.И. Менделеева для ОГЭ и ЕГЭ
- Таблица растворимости и ряд активности для ОГЭ и ЕГЭ
- Таблица растворимости с расширенным рядом активности
- Таблица Д.И. Менделеева длиннопериодная для олимпиады
Новости
Таблицы для ЕГЭ по химии
Различные таблицы и справочные материалы занимают важную роль при подготовке к ЕГЭ по химии. В них собрана вся самая важная и нужная информация в сжатом формате, что помогает быстро найти ответ, не заучивая целые параграфы из учебников.
Таблицы, необходимые на ЕГЭ по химии 2019
На сдаче ЕГЭ по химии разрешено использование трёх таблиц: периодической системы химических элементов Д.И. Менделеева, таблицы растворимости и ряда активности металлов. Они содержат в себе 80% информации, необходимой для решения большинства заданий.
1. Периодическая система химических элементов Д.И. Менделеева верный друг каждого химика. В ней содержатся основные сведения обо всех известных химических элементах.
Но нужно понимать, что эта таблица поможет только тому, кто разбирается в основных свойствах элементов и знает, что в ней искать. Для этого нужно быть знакомым с такими понятиями, как электроотрицательность, валентность, степень окисления, строение атома.
2. Таблица растворимости солей, кислот и оснований в воде. Одно из условий протекания реакции – выпадение осадка. Именно таблица растворимости даёт возможность узнать образует то или иное вещество осадок, а, следовательно, протекает реакция или нет. Для того, чтобы установить факт растворимости вещества в воде по таблице, необходимо выбрать необходимые катион и анион, а затем прочитать символ, находящийся в месте их пересечения.
3. Электрохимический ряд напряжений металлов – последовательность, которая представляет сравнительную активность металлов в окислительно-восстановительных реакциях в водной среде. Активность металла характеризует его реакционную способность: чем легче атом отдаёт электроны, тем активнее его восстановительная способность. Элементы, находящиеся в таблице до водорода, являются активными, после водорода – неактивными. Измерение электрохимического потенциала металлов на практике производится с помощью стандартного водородного электрода, поэтому водород присутствует в ряду напряжений.
Эта таблица используется для сравнительной оценки химической активности металлов в реакциях с водными растворами солей и кислот, а также для оценки катодно-анодных процессов при электролизе и оценки возможности протекания ОВР с участием металлов.
Справочные материалы для ЕГЭ по химии в таблицах
Для качественной и продуктивной подготовки к экзамену по химии школьники используют различные справочные материалы. Самый удобный способ запоминания важных аспектов – использование справочных материалов в формате таблиц. Они содержат в себе максимальное количество полезной, заранее структурированной информации.
Формулы и названия наиболее распространённых кислот и солей
Тривиальные названия неорганических веществ
Еще по этой теме:
Серная кислота
Основные сведения о серной кислоте: свойства, получение, применение.
Теперь «ХиШник» стал полностью бесплатным
Как развивалось приложение все эти годы, и почему мы им так гордимся.
Азотная кислота
Статья содержит основную информацию об азотной кислоте: её свойства, получение и применение.
Диены
Основные сведения о диеновых углеводородах: номенклатура и изомерия, классификация, химические свойства, получение.
Правило Марковникова
Правило Марковникова: формулировка, механизм протекания реакций, исключения из правила.
Внеклассное мероприятие по химии
Идеи интересных внеклассных мероприятий по химии.
Формулы для решения задач по химии
Перечень основных формул, которые используются при решении школьных задач по химии.
Химические профессии
Обзор необычных профессий, связанных с химией.
ЕГЭ по химии 2019
Основная информация о ЕГЭ по химии 2019: структура экзамена, баллы, даты проведения.
Критерии оценивания ОГЭ по химии, баллы 2019
Подробно расскажем о баллах ОГЭ по химии 2019, методах и критериях оценивания заданий и переводе первичных баллов в школьную оценку.
Изменения ОГЭ по химии в 2019 году
Расскажем об изменениях, которые ждут школьников при сдаче ОГЭ по химии в 2019 году.
Подготовка к ОГЭ по химии
Несколько советов и рекомендаций, следуя которым подготовка к ОГЭ по химии будет проходить результативно.
Онлайн тесты по химии
Немного информации о проверке знаний с помощью тестов по химии в режиме онлайн.
Все об ОГЭ по химии в 2019
Основные сведения об ОГЭ по химии 2019: даты, время, баллы, материалы для подготовки.
Тест по химии 11 класс
Рассказываем о тестах по химии, используемых для проверки знаний в 11 классе.
Тест по химии 10 класс
Общие сведения о тестах по химии в 10 классе.
Тест по химии 9 класс
Рассказываем о тестах по химии, используемых для проверки знаний в 9 классе.
Тест по химии 8 класс
Рассказываем в общих чертах о тестах по химии в 8 классе
Ионная связь
Статья, содержащая в себе базовые понятие об ионном виде химической связи.
Водородная связь
Статья о водородном типе химической связи и его особенностях.
Подготовка к ЕГЭ по химии с нуля
В статье дано несколько действенных советов по подготовке к ЕГЭ по химии «с нуля».
Металлическая связь
Продолжаем серию статей про виды химической связи.
Ковалентная связь
Начинаем серию статей про виды химической связи.
Шкала перевода баллов ЕГЭ по химии 2018
Отвечаем на вопросы о системе оценивания и переводе первичных баллов в тестовые.
Учимся на летних каникулах
Размышляем о том, как полезно провести время во время летнего отдыха на каникулах. (в статье есть подарок внимательным читателям)
«ХиШник» приехал на Сахалин!
Этим летом открывается очередная летняя сессия областной профильной школы для одаренных детей «Эврика».
Мой сын увлёкся химией, что делать?
Собрали ТОП-5 полезных материалов для старшеклассника.
Двенадцать сервисов для изучения химии, с которыми ты точно сдашь
Великолепная подборка полезных сайтов для самостоятельного изучения химии.
О правах и обязанностях в школе: почему необходимо сотрудничество учеников и учителей
Что такое право само по себе и откуда оно берется. Как не заработать славу скандалистов, «вечно качающих права», и при этом не переносить безропотно нарушение своих личных границ…
Современный задачник по химии
материал о том, какие виды задачников по химии существуют и как среди них ориентироваться.
Выбираем репетитора по химии: инструкция
Научиться решать задачи по химии легко: следуем инструкции
Учимся решать задачи по химии к ОГЭ, ЕГЭ, инструкция от ХиШника
Изменения в ЕГЭ по химии 2018 года, новая демоверсия, спецификация, кодификаторы ЕГЭ
ФИПИ снова решил усложнить нам жизнь новыми требованиями к ЕГЭ. О том, почему изменения не всегда плохи, и как встретить их с достоинством.
Обновление в демонстрационной версии «ХиШника»
Мы расширили приветственное окно, чтобы при входе в приложение всем новым пользователям были понятны основные принципы работы «ХиШника».
Активация лицензионного ключа и первые шаги в «ХиШнике».
Что такое лицензионный ключ и как происходит его активация в приложении
Современный урок химии по ФГОС
Для чего нужны стандарты, по которым происходит обучение химии в российских школах, и как приложение “ХиШник” поможет соответствовать этим стандартам?
ХиШник в школе: ИКТ на уроках химии
Как наше приложение поможет внедрить ИКТ в уроки
Ура! Новые планы ХиШника и подарочки
Подводим итоги 2017, планируем 2018 и, конечно же, дарим подарки!
Родина приложения «ХиШник» – Новосибирский Академгородок
Почему же родиной «ХиШника» стал Новосибирский Академгородок?
Совпадение не случайное.
Можно ли просматривать историю решения задач учениками в онлайн-режиме?
Итак, «ХиШник» это приложение, в котором могут работать и ученики, и преподаватели. После того, как преподаватель создает в приложении учебную группу
Можно ли заниматься в «ХиШнике» со смартфона/планшета?
Сегодня у нас вопрос, которого мы давно ждали: можно ли заниматься в «ХиШнике» со смартфона/планшета?
Семинар от «ХиШника» на КПК для учителей химии
На прошлой неделе мы провели семинар в рамках масштабных ежегодных курсов повышения квалификации на базе СУНЦ НГУ (Новосибирск, Академгородок).
Команда «ХиШника» провела мастер-класс для преподавателей химии и методистов
Вчера команда «ХиШника» провела мастер-класс для преподавателей химии и методистов программ повышения квалификации из разных регионов России.
Как купить полный доступ к приложению?
Сегодня новый вопрос: что делать, если решать задачи в демо-версии приложения понравилось, как получить полный доступ? Отвечаем!
«ХиШник» представляет два кейса на ярмарке кейсов «Школа реальных дел»
Ярмарка кейсов «Школы реальных дел» – уже в эту пятницу! В этом году «ХиШник» представляет два кейса.
Служба поддержки:
support@hishnik-school.ru
Спасибо!
Настоящее пользовательское (лицензионное) соглашение (далее – «Соглашение») заключается между Обществом с ограниченной ответственностью «АЛЕКТА» (далее – «Лицензиар»), и Пользователем (физическим лицом, выступающем в роли конечного потребителя Продукта) совместно именуемые «Стороны».
Пожалуйста, внимательно ознакомьтесь с текстом настоящего Соглашения. Оно представляет собой публичную оферту и, после его принятия Вами, образует соглашение между Вами (Пользователем) и Лицензиаром о предмете и на условиях, изложенных в тексте Соглашения.
Принимая настоящее Соглашение, Вы соглашаетесь с положениями, принципами, а также соответствующими условиями лицензионного соглашения, изложенными ниже.
Источник
Ряд напряжений (ряд активности или электрохимический ряд напряжения ЭХРН) металлов используется на практике для относительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе.

ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ МЕТАЛЛОВ
Восстановительная активность металлов (свойство отдавать электроны) уменьшается, а окислительная способность их катионов (свойство присоединять электроны) увеличивается в указанном ряду слева направо.
-
Металлы, стоящие левее, являются более сильными восстановителями, чем металлы, расположенные правее: они вытесняют последние из растворов солей. Например, взаимодействие Zn + Cu
2+
→ Zn
2+
+ Cu возможно только в прямом направлении. Цинк вытесняет медь из водного раствора её соли. При этом цинковая пластинка растворяется, а металлическая медь выделяется из раствора. - Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот-неокислителей; наиболее активные металлы (до алюминия включительно) — и при взаимодействии с водой.
- Металлы, стоящие в ряду правее водорода, с водными растворами кислот-неокислителей при обычных условиях не взаимодействуют.
-
При электролизе металлы, стоящие правее водорода, выделяются на катоде; восстановление металлов умеренной активности сопровождается выделением водорода; наиболее активные металлы (до алюминия) невозможно при обычных условиях выделить из водных растворов солей.
Катодный процесс
Электрохимический ряд напряжения металлов (Таблица)
Электрохимический ряд напряжения металлов
|
Металл |
Eu |
Sm |
Li |
Cs |
Rb |
K |
Ra |
Ba |
Sr |
Ca |
Na |
Ac |
La |
Ce |
Pr |
… |
|
Ион металла |
Eu2+ |
Sm2+ |
Li+ |
Cs+ |
Rb+ |
K+ |
Ra2+ |
Ba2+ |
Sr2+ |
Ca2+ |
Na+ |
Ac3+ |
La3+ |
Ce3+ |
Pr3+ |
… |
|
Стандартный электродный потенциал, φ°Меn+/Ме |
-3,3 95 |
-3,1 21 |
-3,0 45 |
-3,02 |
-2,9 25 |
-2,9 24 |
-2,92 |
-2,9 05 |
-2,8 88 |
-2,8 66 |
-2,7 14 |
-2,6 |
-2,5 22 |
-2,48 |
-2,4 62 |
… |
|
Реакционная способность |
Реагируют с водой |
Реагируют с разбавленными кислотами |
||||||||||||||
|
Электролиз (на катоде) |
При электролизе на катоде выделяется водород |
|
… |
Nd |
Pm |
Gd |
Tb |
Mg |
Y |
Dy |
Am |
Ho |
Er |
Tm |
Lu |
Sc |
Pu |
Th |
Np |
U |
… |
|
… |
Nd3+ |
Pm3+ |
Gd3+ |
Tb3+ |
Mg2+ |
Y3+ |
Dy3+ |
Am3+ |
Ho3+ |
Er3+ |
Tm3+ |
Lu3+ |
Sc3+ |
Pu3+ |
Th4+ |
Np3+ |
U3+ |
… |
|
… |
-2,4 31 |
-2,4 23 |
-2,3 97 |
-2,3 91 |
-2,3 75 |
-2,3 72 |
-2,3 53 |
-2,32 |
-2,3 19 |
-2,2 96 |
-2,2 78 |
-2,2 55 |
-2,0 77 |
-2,0 31 |
-1,8 99 |
-1,8 56 |
-1,7 98 |
… |
|
Реагируют с разбавленными кислотами |
||||||||||||||||||
|
При электролизе на катоде выделяется водород |
|
… |
Hf |
Be |
Al |
Ti |
Zr |
Ti |
Yb |
Ti |
Mn |
V |
Nb |
Pa |
Cr |
V |
Zn |
Cr |
Ga |
Ga |
… |
|
… |
Hf4+ |
Be2+ |
Al3+ |
Ti2+ |
Zr4+ |
Ti3+ |
Yb3+ |
Ti4+ |
Mn2+ |
V2+ |
Nb3+ |
Pa5+ |
Cr2+ |
V3+ |
Zn2+ |
Cr3+ |
Ga3+ |
Ga2+ |
… |
|
… |
-1,7 |
-1,69 |
-1,6 63 |
-1,63 |
-1,5 39 |
-1,2 08 |
-1,2 05 |
-1,63 |
-1,1 79 |
-1,1 75 |
-1,1 |
-1 |
-0,9 13 |
-0,87 |
-0,7 63 |
-0,7 44 |
-0,7 44 |
-0,45 |
… |
|
Реагируют с разбавленными кислотами |
|||||||||||||||||||
|
Выделяется водород |
При электролизе на катоде одновременно идут две конкурирующие реакции – выделение водорода и осаждение металла в чистом виде |
|
… |
Fe |
Cd |
In |
Tl |
Co |
Ni |
Te |
Mo |
In |
Sn |
Pb |
H2 |
W |
Sb |
Bi |
Ge |
Re |
Co |
Cu |
Тс |
… |
|
… |
Fe2+ |
Cd2+ |
In3+ |
Tl+ |
Co2+ |
Ni2+ |
Te2+ |
Mo3+ |
In+ |
Sn2+ |
Pb2+ |
2H+ |
W3+ |
Sb3+ |
Bi3+ |
Ge2+ |
Re3+ |
Co3+ |
Cu2+ |
Тс2+ |
… |
|
… |
-0,4 41 |
-0,4 03 |
-0,34 |
-0,3 36 |
-0,2 77 |
-0,25 |
-0,24 |
-0,2 |
-0,1 39 |
-0,1 36 |
-0,1 26 |
0,0 00 |
0,11 |
0,2 |
0,215 |
0,23 |
0,3 |
0,33 |
0,346 |
0,4 |
… |
|
Реагируют с разбавленными кислотами |
С разбавленными кислотами НЕ взаимодействуют |
||||||||||||||||||||
|
Выделение водорода и осаждение металла в чистом виде |
При электролизе на катоде выделяется металл в чистом виде |
|
… |
Ru |
Mn |
Cu |
Po |
Te |
Rh |
Po |
W |
Rh |
Tl |
2Hg |
Ag |
Pb |
Pd |
Os |
Hg |
Ir |
Pt |
Au |
Au |
|
… |
Ru2+ |
Mn3+ |
Cu+ |
Po3+ |
Te4+ |
Rh2+ |
Po2+ |
W6+ |
Rh3+ |
Tl3+ |
Hg22+ |
Ag+ |
Pb4+ |
Pd2+ |
Os2+ |
Hg2+ |
Ir3+ |
Pt2+ |
Au3+ |
Au+ |
|
… |
+0,45 |
+0,47 |
+0,522 |
+0,56 |
+0,568 |
+0,6 |
+0,65 |
+0,68 |
+0,7 |
+0,71 |
+0,788 |
+0,7 99 |
+0,8 |
+0,83 |
+0,85 |
+0,854 |
+1,15 |
+1,1 88 |
+1,4 92 |
+1,6 92 |
|
С разбавленными кислотами НЕ взаимодействуют |
||||||||||||||||||||
|
При электролизе на катоде выделяется металл в чистом виде |
По
химическим свойствам металлы подразделяют на:
1)Активные
(щелочные и щелчноземельные металлы, Mg, Al, Zn и др.)
2)
Металлы средней активности (Fe, Cr, Mn и др.) ;
3)Малоактивные
(Cu, Ag)
4)
Благородные металлы – Au, Pt, Pd и др.
В
реакциях — только восстановители. Атомы металлов легко отдают электроны
внешнего (а некоторые – и предвнешнего) электронного слоя, превращаясь в
положительные ионы. Возможные степени окисления Ме Низшая 0,+1,+2,+3 Высшая +4,+5,+6,+7,+8
1.ВЗАИМОДЕЙСТВИЕ С НЕМЕТАЛЛАМИ
1.
С ВОДОРОДОМ
Реагируют
при нагревании металлы IA и IIA группы, кроме бериллия. Образуются твёрдые
нестойкие вещества гидриды, остальные металлы не реагируют.
2K
+ H₂ = 2KH (гидрид калия)
Ca
+ H₂ = CaH₂
2.С
КИСЛОРОДОМ
Реагируют
все металлы, кроме золота, платины. Реакция с серебром происходит при высоких
температурах, но оксид серебра(II) практически не образуется, так как он
термически неустойчив. Щелочные металлы при нормальных условиях образуют
оксиды, пероксиды, надпероксиды (литий – оксид, натрий – пероксид, калий,
цезий, рубидий – надпероксид
4Li
+ O2 = 2Li2O (оксид)
2Na
+ O2 = Na2O2 (пероксид)
K+O2=KO2
(надпероксид)
Остальные
металлы главных подрупп при нормальных условиях образуют оксиды со степенью окисления,
равной номеру группы 2Сa+O2=2СaO
2Сa+O2=2СaO
Металлы
побочных подрупп образуют оксиды при нормальных условиях и при нагревании
оксиды разной степени окисления, а железо железную окалину Fe3O4
(Fe⁺²O∙Fe2⁺³O3)
3Fe
+ 2O2 = Fe3O4
4Cu
+ O₂ = 2Cu₂⁺¹O (красный) 2Cu + O₂ = 2Cu⁺²O (чѐрный );
2Zn
+ O₂ = ZnO 4Cr + 3О2 = 2Cr2О3
3.
С ГАЛОГЕНАМИ
галогениды
(фториды, хлориды, бромиды, иодиды). Щелочные при нормальных условиях с F,
Cl , Br воспламеняются:
2Na
+ Cl2 = 2NaCl (хлорид)
Щелочноземельные
и алюминий реагируют при нормальных условиях:
Сa+Cl2=СaCl2
2Al+3Cl2
= 2AlCl3
Металлы
побочных подгрупп при повышенных температурах
Cu
+ Cl₂ = Cu⁺²Cl₂
Zn + Cl₂ = ZnCl₂
2Fe
+ ЗС12 = 2Fe⁺³Cl3 хлорид железа (+3) 2Cr + 3Br2 = 2Cr⁺³Br3
2Cu + I₂ = 2Cu⁺¹I (не бывает йодида меди (+2)!)
4.
ВЗАИМОДЕЙСТВИЕ С СЕРОЙ
при
нагревании даже у щелочных металлов, с ртутью при нормальных условиях.
Реагируют все металлы, кроме золота и платины
с серой – сульфиды: 2K + S =
K2S 2Li+S = Li2S (сульфид)
Сa+S=СaS(сульфид) 2Al+3S =
Al2S3 Cu + S = Cu⁺²S (чѐрный)
Zn
+ S = ZnS 2Cr + 3S = Cr2⁺³S3 Fe + S = Fe⁺²S
5.
ВЗАИМОДЕЙСТВИЕ С ФОСФОРОМ И АЗОТОМ
протекает
при нагревании (исключение: литий с азотом при нормальных условиях) :
с
фосфором – фосфиды: 3Ca + 2P =Са3P2,
С
азотом – нитриды 6Li + N2 = 3Li2N (нитрид лития)
(н.у.) 3Mg + N2 = Mg3N2
(нитрид магния) 2Al + N2 =
2A1N 2Cr + N2 =
2CrN 3Fe + N2 = Fe₃⁺²N₂¯³
6.
ВЗАИМОДЕЙСТВИЕ С УГЛЕРОДОМ И КРЕМНИЕМ
протекает
при нагревании:
С
углеродом образуются карбиды С углеродом реагируют только наиболее активные
металлы. Из щелочных металлов карбиды образуют литий и натрий, калий, рубидий,
цезий не взаимодействуют с углеродом :
2Li + 2C = Li2C2, Са +
2С = СаС2
Металлы
– d-элементы образуют с углеродом соединения нестехиометрического состава
типа твердых растворов: WC, ZnC, TiC – используются для получения
сверхтвёрдых сталей.
с
кремнием – силициды: 4Cs + Si = Cs4Si,
7.
ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ВОДОЙ:
С
водой реагируют металлы, стоящие до водорода в электрохимическом ряду
напряжений Щелочные и щелочноземельные металлы реагируют с
водой без нагревания , образуя растворимые гидроксиды( щелочи ) и водород,
алюминий (после разрушения оксидной пленки — амальгирование), магний при
нагревании, образуют нерастворимые основания и водород.
2Na
+ 2HOH = 2NaOH + H2↑
Сa + 2HOH =
Ca(OH)2 + H2↑
2Аl
+ 6Н2O = 2Аl(ОН)3 + ЗН2↑
Остальные
металлы реагируют с водой только в раскаленном состоянии , образуя оксиды
(железо – железную окалину)
Zn
+ Н2O = ZnO + H2 ↑ 3Fe + 4HOH = Fe3O4 + 4H2↑
2Cr + 3H₂O = Cr₂O₃ + 3H₂↑
8
С КИСЛОРОДОМ И ВОДОЙ
На
воздухе железо и хром легко окисляется в присутствии влаги (ржавление)
4Fe
+ 3O2 + 6H2O = 4Fe(OH)3
4Cr
+ 3O2 + 6H2O = 4Cr(OH)3
9.
ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ОКСИДАМИ
Металлы
(Al, Mg,Са ), восстанавливают при высокой температуре неметаллы или менее
активные металлы из их оксидов → неметалл или малоактивный металл и оксид
(кальцийтермия, магнийтермия, алюминотермия)
2Al
+ Cr2O3 = 2Cr + Al2O3 ЗСа + Cr₂O₃ = ЗСаО + 2Cr (800 °C)
8Al+3Fe3O4 = 4Al2O3+9Fe (термит) 2Mg + CО2 = 2MgO + С
Mg + N2O = MgO + N2↑ Zn + CО2 = ZnO+ CO 2Cu
+ 2NO = 2CuO + N2 3Zn + SО2 = ZnS + 2ZnO
10.
С ОКСИДАМИ
Металлы
железо и хром реагируют со оксидами, уменьшая степень окисления
Cr
+ Cr2⁺³O3 = 3Cr⁺²O Fe+ Fe2⁺³O3 = 3Fe⁺²O
11.
ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ СО ЩЕЛОЧАМИ
Со
щелочами взаимодействуют только те металлы, оксиды и гидроксиды которых
обладают амфотерными свойствами ((Zn, Al, Cr(III), Fe(III) и др. РАСПЛАВ →
соль металла + водород.
2NaOH
+ Zn → Na2ZnO2 + H2↑ (цинкат натрия)
2Al
+ 2(NaOH · H2O) = 2NaAlO2 + 3H2
РАСТВОР → комплексная соль металла + водород.
2NaOH
+ Zn0 + 2H2O = Na2[Zn+2(OH)4] + H2↑ (тетрагидроксоцинкат натрия) 2Al+2NaOH +
6H2O = 2Na[Al(OH)4]+3H2↑
12.
ВЗАИМОДЕЙСТВИЕ С КИСЛОТАМИ (КРОМЕ HNO3 и Н2SО4 (конц.)
Металлы,
стоящие в электрохимическом ряду напряжений металлов левее водорода,
вытесняют его из разбавленных кислот → соль и водород
Запомни!
Азотная кислота никогда не выделяет водород при взаимодействии с металлами.
Мg
+ 2НС1 = МgСl2 + Н2↑
Al + 2НС1 = Al⁺³Сl₃ + Н2↑
13.
РЕАКЦИИ С СОЛЯМИ
Активные
металлы вытесняют из солей менее активные. Восстановление из растворов:
CuSO4
+ Zn = Zn SO4 + Cu
FeSO4
+ Cu = РЕАКЦИИ НЕТ
Mg
+ CuCl2(pp) = MgCl2 + Сu
Восстановление
металлов из расплавов их солей
3Na+
AlCl₃ = 3NaCl + Al
TiCl2
+ 2Mg = MgCl2 +Ti
Металлы
групп В реагируют с солями, понижая степень окислениЯ
2Fe⁺³Cl3
+ Fe = 3Fe⁺²Cl2
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
-
оксид образует только литий
4Li + O2 = 2Li2O
-
натрий образует пероксид
2Na + O2 = Na2O2
-
калий, рубидий и цезий — надпероксид
K + O2 = KO2
Остальные металлы с кислородом образуют оксиды:
2Mg + O2 = 2MgO
2Al + O2 = Al2O3
2Zn + O2 = 2ZnO (при нагревании)
4Cr + 3O2 = 2Cr2O3
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
4Fe + 3O2 (воздух) + 6H2O(влага) = 4Fe(OH)3
С галогенами металлы образуют галогениды:
2Na + Cl2 = 2NaCl
Mg + Cl2 = MgCl2
2Al + 3Br2 = 2AlBr3
Zn + Cl2 =ZnCl2
2Cr + 3Cl2 = 2CrCl3
Медный порошок реагирует с хлором и бромом (в эфире):
Cu + Cl2 = CuCl2
Cu + Br2 = CuBr2
При взаимодействии с водородом образуются гидриды:
2Na + H2 = 2NaH
Ca + H2 +СaH2
Zn + H2 =ZnH2
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
2K + S = K2S
Сa + S = CaS
2Al + 3S = Al2S3
2Cr + 3S = Cr2S3
Cu +S = CuS
Реакции с фосфором протекают до образования фосфидов (при нагревании):
3K + P = K3P
3Mg + 2P = Mg3P2
3Zn + 2P = Zn3P2
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
2Li + 2C = Li2C2
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
Ca + 2C = CaC2
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
6Li + N2 = 2Li3N
3Mg + N2 = Mg3N2
2Al + N2 = 2AlN
2Cr + N2 = 2CrN
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
2Li + 2H2O = 2LiOH + H2
Ca + 2H2O = Ca(OH)2 + H2
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Cr + H2O = Cr2O3 + H2
Zn + H2O = ZnO + H2
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Металлы IА группы:
2K + H2SO4 (раствор) = K2SO4 + H2
8K + 5H2SO4 (конц) = 4K2SO4 + H2S + 4H2O
8Na + 10HNO3 (раствор) = 8NaNO3 + NH4NO3 + 3H2O
3Na + 4HNO3 (конц) = 3NaNO3 + NO + 2H2О
Металлы IIА группы
Mg + H2SO4 (раствор) = MgSO4 + H2
4Mg + 5H2SO4 (конц) = 4MgSO4 + H2S + 4H2O
Mg+ 4HNO3 (конц) = Mg(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 (раствор) = 4Mg(NO3)2 + 2N2O + 5H2O
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
2Li + 2NH3 = 2LiNH2 + H2
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2
2K + 2C6H5OH = 2C6H5OK + H2
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
8Al + 3Fe3O4 = 4Al2O3 + 9Fe (алюмотермия)
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Вопросы для самоконтроля
-
С чем реагируют неактивные металлы?
-
С чем связаны восстановительные свойства металлов?
-
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
-
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
-
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
По теме: методические разработки, презентации и конспекты
Конспект урока по теме:»Металлы, их положение в Периодической системе, строение атомов металлов. Общие физические свойства металлов.»
План — конспект урока разработан для учащихся 9 класса на основе Примерной программы по химии для основной школы и на основе программы авторского курса химии для 8-11 классов О.С. Габриеляна (в …
Урок по химии в 9 классе. Тема: «Общие химические свойства металлов. Взаимодействие металлов со сложными веществами. Электрохимический ряд напряжений металлов».
Урок по химии в 9 классе. Тема: «Общие химические свойства металлов. Взаимодействие металлов со сложными веществами. Электрохимический ряд напряжений металлов».
Цели урока учебные, воспитательные и р…
Влияние тяжелых металлов на активность фермента каталазы
Презентация, позволит разнообразить урок…
Влияние тяжелых металлов на активность фермента каталазы
Экологический проект…
План урока химии по теме «Положение металлов в Периодической системе химических элементов Д.И. Менделеева, строение их атомов. Строение металлов – простых веществ. Физические свойства металлов».
План урока № 62 (9кл). Положение металлов в Периодической системе химических элементов Д.И. Менделеева, строение их атомов. Строение металлов – простых веществ. Физические свойства металлов….
«Общие химические свойства металлов. Ряд активности». разработка урока
Тип урока: урок изучения нового материалаВид урока: мультимедийныйЦель урока: систематизировать сведения о химических свойствах металлов, рассмотренных при изучении материала курса химии 8,9 классов, …
Электрохимический ряд активности металлов
Помощь в подготовке к выпускным и переводным экзаменам….