Таблицы на ЕГЭ и ОГЭ по химии
На сдаче ЕГЭ и ОГЭ по химии можно использовать три таблицы:
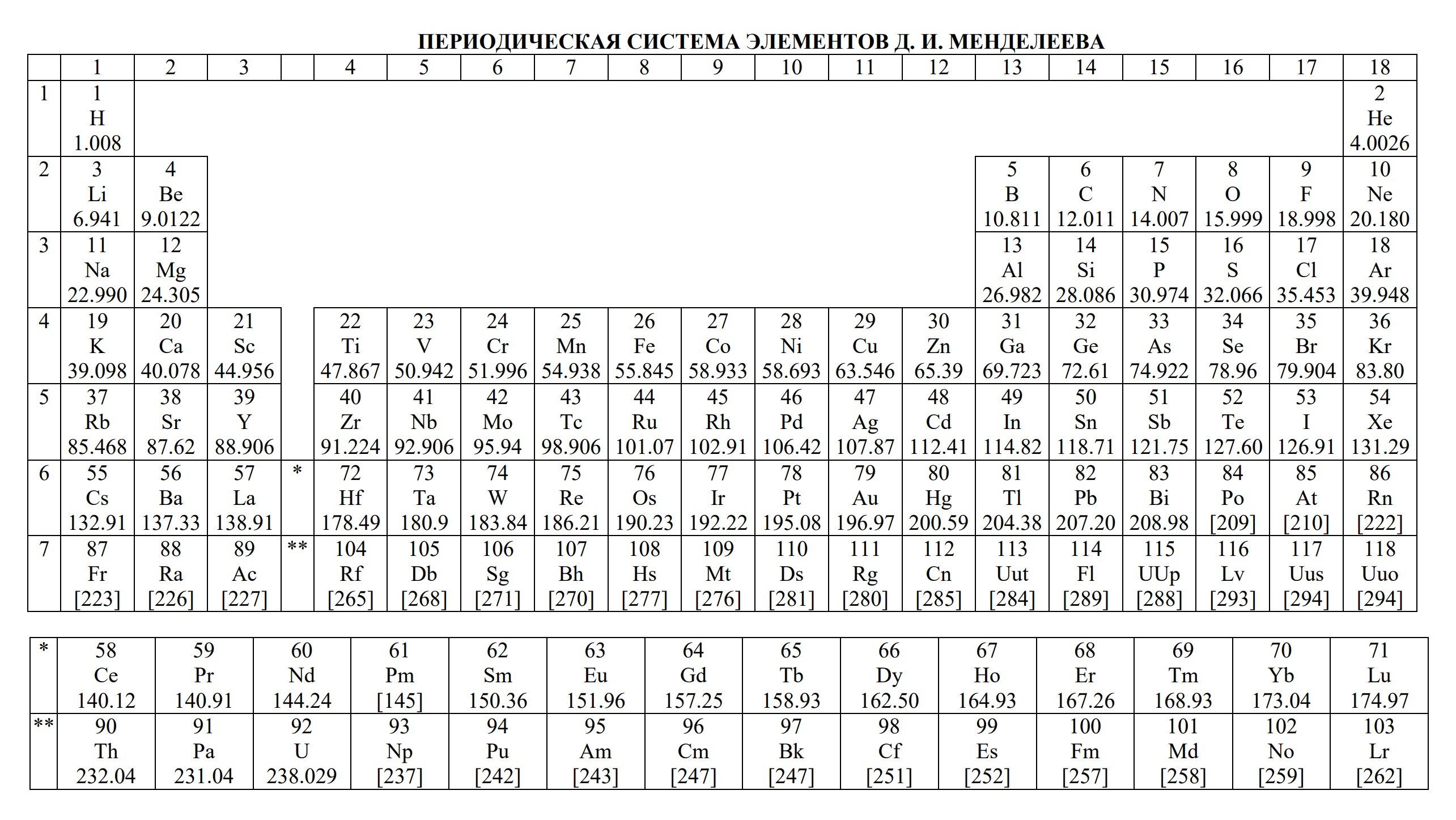
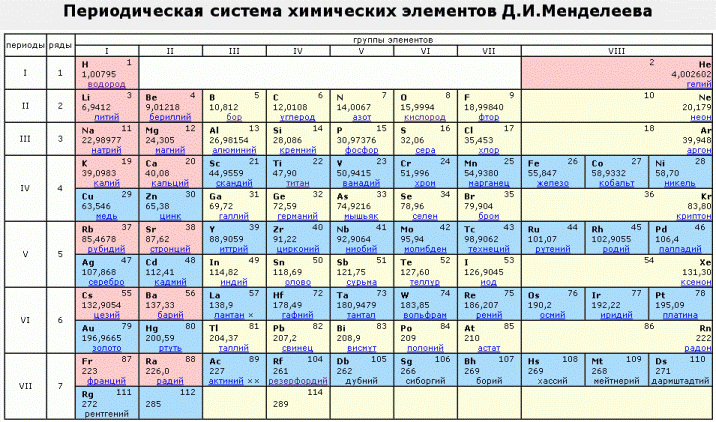
- периодическая система химических элементов Д.И. Менделеева
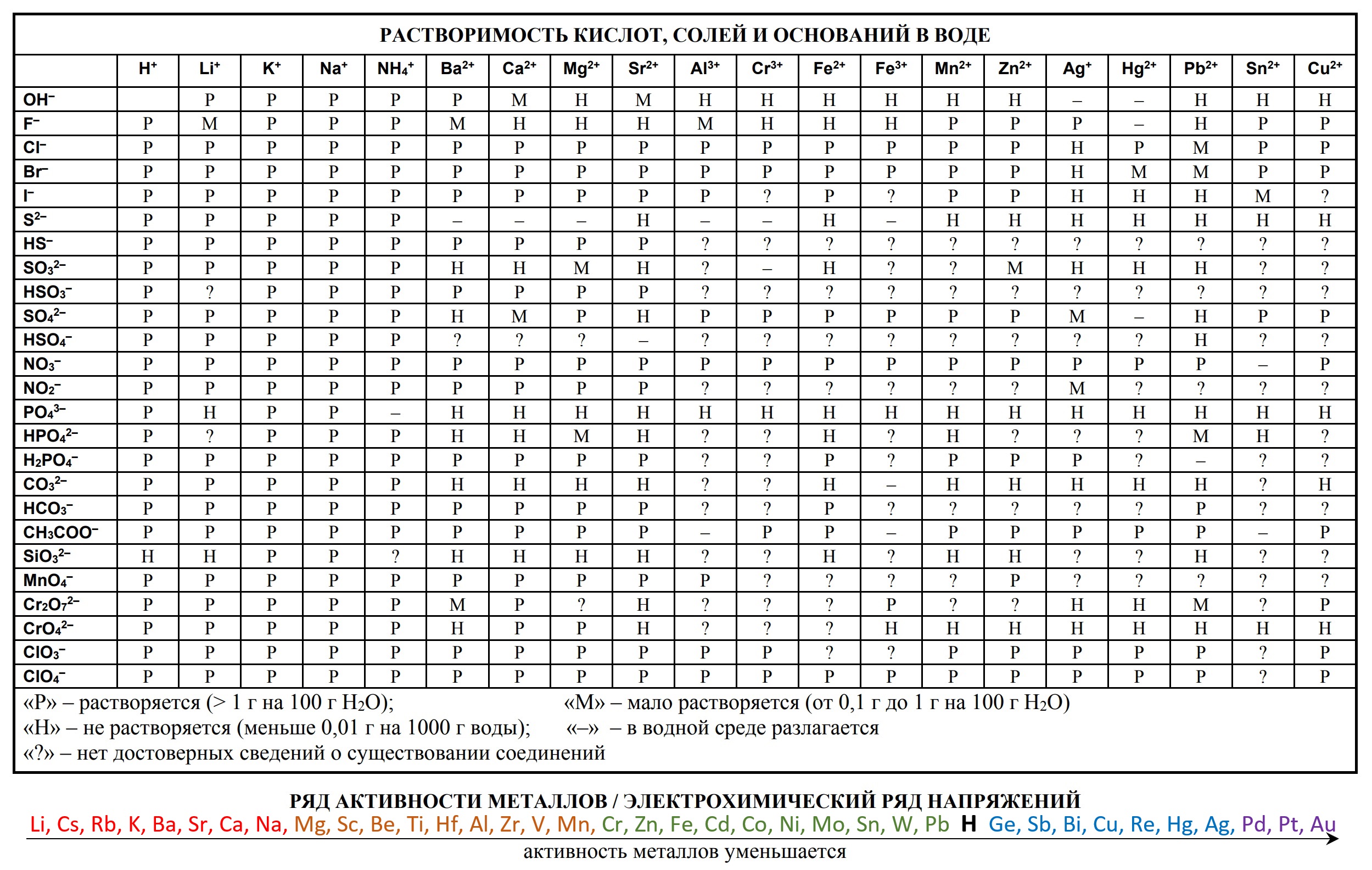
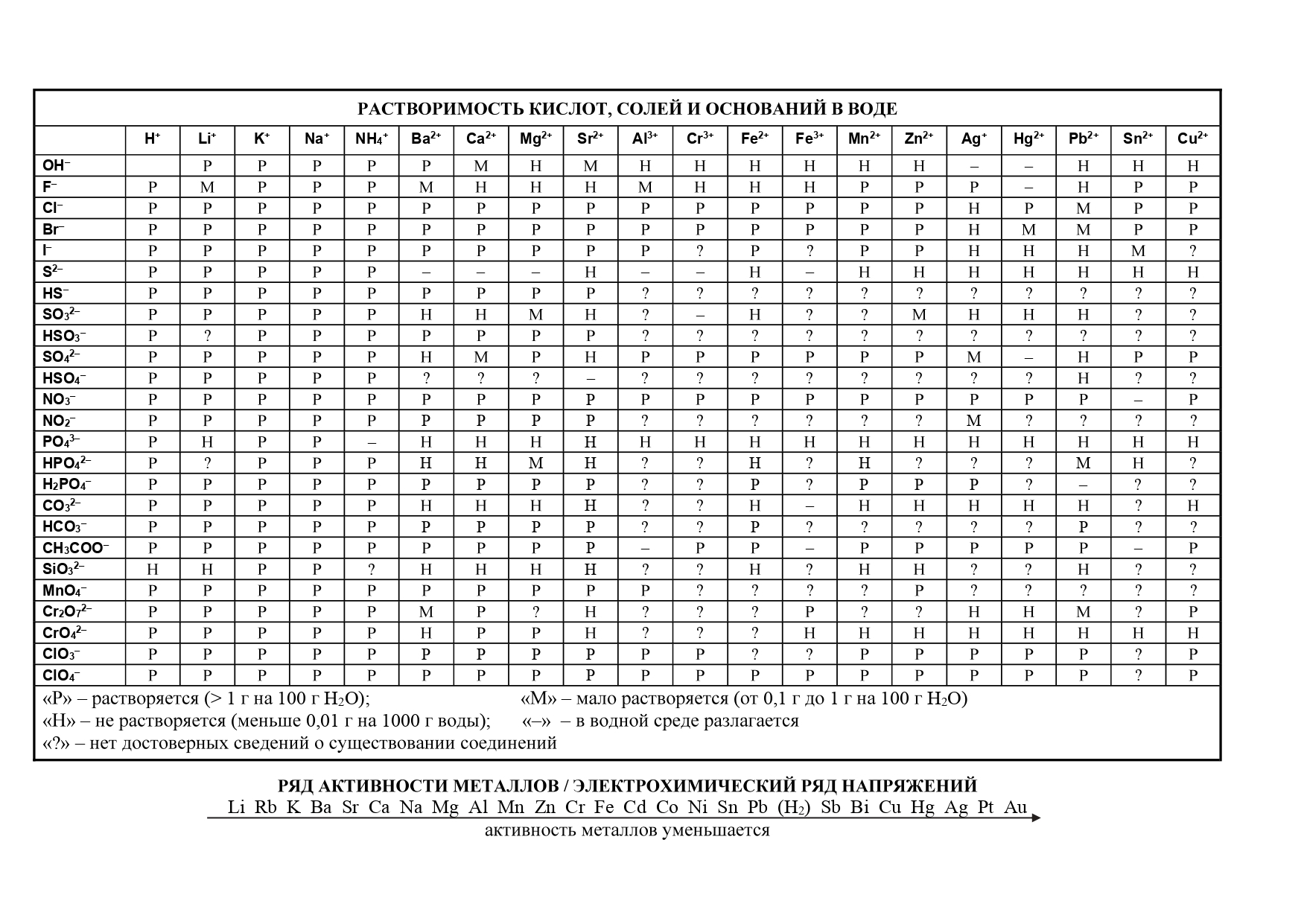
- таблица растворимости
- ряд активности металлов.
Они содержат в себе 80% информации, необходимой для решения большинства заданий.
Однако таблицы на форзацах разных учебников, продаваемые в книжных магазинах, располагающиеся на просторах интернета отличаются не только оформлением, но и содержанием. Что бы они оказались надёжно шпаргалкой, а не приятной неожиданностью, лучше с самого начала начинать работать с тем форматом, который официально разрешен на ЕГЭ твоего года.
Скачать эти таблицы можно ниже. А как сделать эти безликие таблицы наиболее информационными для тебя я расскажу на уроке.
- Таблица Д.И. Менделеева для ОГЭ и ЕГЭ
- Таблица растворимости и ряд активности для ОГЭ и ЕГЭ
- Таблица растворимости с расширенным рядом активности
- Таблица Д.И. Менделеева длиннопериодная для олимпиады
-
Главная
-
Теория ЕГЭ
-
Химия — теория ЕГЭ
-
Таблица растворимости ЕГЭ 2023 по химии
Таблица растворимости ЕГЭ 2023 по химии
- 01.11.2020
Подробная таблица растворимости, которой можно пользоваться на ЕГЭ по химии в 2023 году.
- Кстати, тренировочные варианты этого года ЕГЭ по химии
Обновлено: 17.11.2022
Смотрите Таблицу Менделеева для ЕГЭ (ей тоже можно пользоваться).
- Другая теория по химии
Таблица Растворимости в картинке JPG
Таблица Растворимости в PDF
Смотреть в PDF:
Или прямо сейчас: cкачать в pdf файле.
Сохранить ссылку:
Комментарии (0)
Добавить комментарий
Добавить комментарий
Комментарии без регистрации. Несодержательные сообщения удаляются.
Имя (обязательное)
E-Mail
Подписаться на уведомления о новых комментариях
Отправить
Уважаемый посетитель!
Если у вас есть вопрос, предложение или жалоба, пожалуйста, заполните короткую форму и изложите суть обращения в текстовом поле ниже. Мы обязательно с ним ознакомимся и в 30-дневный срок ответим на указанный вами адрес электронной почты
Статус Абитуриент Студент Родитель Соискатель Сотрудник Другое
Филиал Абакан Актобе Алагир Алматы Алушта Анапа Ангарск Архангельск Армавир Асбест Астана Астрахань Атырау Баку Балхаш Барановичи Барнаул Белая Калитва Белгород Бельцы Берлин Бишкек Благовещенск Бобров Бобруйск Борисов Боровичи Бронницы Брянск Бузулук Чехов Челябинск Череповец Черкесск Дамаск Дербент Димитровград Дмитров Долгопрудный Домодедово Дубай Дубна Душанбе Екатеринбург Электросталь Елец Элиста Ереван Евпатория Гана Гомель Гродно Грозный Хабаровск Ханты-Мансийск Хива Худжанд Иркутск Истра Иваново Ижевск Калининград Карабулак Караганда Каракол Кашира Казань Кемерово Киев Кинешма Киров Кизляр Королев Кострома Красноармейск Краснодар Красногорск Красноярск Краснознаменск Курган Курск Кызыл Липецк Лобня Магадан Махачкала Майкоп Минеральные Воды Минск Могилев Москва Моздок Мозырь Мурманск Набережные Челны Нальчик Наро-Фоминск Нижневартовск Нижний Новгород Нижний Тагил Ногинск Норильск Новокузнецк Новосибирск Новоуральск Ноябрьск Обнинск Одинцово Омск Орехово-Зуево Орел Оренбург Ош Озёры Павлодар Пенза Пермь Петропавловск Подольск Полоцк Псков Пушкино Пятигорск Радужный Ростов-на-Дону Рязань Рыбинск Ржев Сальск Самара Самарканд Санкт-Петербург Саратов Сергиев Посад Серпухов Севастополь Северодвинск Щербинка Шымкент Слоним Смоленск Солигорск Солнечногорск Ставрополь Сургут Светлогорск Сыктывкар Сызрань Тамбов Ташкент Тбилиси Терек Тихорецк Тобольск Тольятти Томск Троицк Тула Тверь Тюмень Уфа Ухта Улан-Удэ Ульяновск Ургенч Усть-Каменогорск Вёшенская Видное Владимир Владивосток Волгодонск Волгоград Волжск Воркута Воронеж Якутск Ярославль Юдино Жлобин Жуковский Златоуст Зубова Поляна Звенигород
Тип обращения Вопрос Предложение Благодарность Жалоба
Тема обращения Поступление Трудоустройство Обучение Оплата Кадровый резерв Внеучебная деятельность Работа автоматических сервисов университета Другое
* Все поля обязательны для заполнения
Я даю согласие на обработку персональных данных, согласен на получение информационных рассылок от Университета «Синергия» и соглашаюсь c политикой конфиденциальности
В этой статье вы найдете таблицу Менделеева и таблицу растворимости веществ.
Содержание
- Таблица Менделеева: распечатать для ЕГЭ
- Таблица растворимости по химии: распечатать для ЕГЭ
- Видео: Периодическая таблица Д.И.Менделеева — лучшая шпаргалка по химии
В школе, в каждом кабинете химии есть таблица Менделеева. Это великие научные труды знаменитого ученого, которые являются основой знаний наших современников о химии. В этой статье вы найдете и сможете распечатать таблицу с химическими элементами для ЕГЭ и таблицу растворимости солей и других веществ.
Таблица Менделеева: распечатать для ЕГЭ
Первая таблица появилась в 1869 году и в ней было всего 60 элементов. Затем ее расширили и разместили в ней 118 элементов, которые известны нам на сегодняшний день. Вся таблица систематизирована и состоит из периодов (ряды) и групп (столбцы). Поэтому сейчас такая табличка называется «Периодическая система Менделеева».
Кажется, что идея самой таблицы Менделеева обманчива, ведь упорядочить элементы по увеличению веса их атомов — это просто. Кроме этого, химические и физические свойства многих рядов атомов схожи с предшествующими в этой же таблице.
- Такая закономерная схожесть проявляется у всех рядов атомов с одинаковым зарядом ядра, кроме первых, так как они не имеют перед собой других рядов.
- Благодаря данному открытию и появилась возможность последовательного расположения в таблице, которая внешне напоминает обычный настенный календарь.
- Это открытие великого ученого помогло объединить большое количество элементов в одной таблице.
Важно запомнить: Система, придуманная Менделеевым не только синхронизирует элементы, но и их свойства. Все химики пользуются такой таблицей, чтобы найти правильные ответы на многие научные вопросы.
Ниже находится таблица Менделеева. Распечатайте ее, чтобы подготовиться к ЕГЭ и найти для себя все ответы.
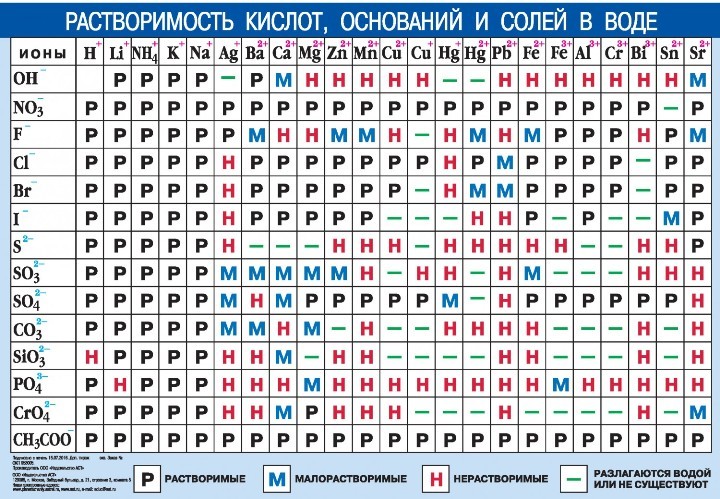
Таблица растворимости по химии: распечатать для ЕГЭ
Таблица растворимости позволяет определить, как будет вести себя вещество в солях или кислоте, и будет ли осадок в результате этой реакции. Чтобы проверить показатели растворов, ищите место взаимопересечения столбца и строчки, и вы увидите, какой знак там изображен.
Запомните: Растворимость — это показатель способности конкретного компонента создавать с другими составляющими однородность, а именно раствор, в котором эти компоненты находятся в виде атомов, молекул или частичек.
Выражение показателей растворов можно описать в виде концентрации растворенного компонента в его растворе или в процентах. Также растворимость может выражаться в виде веса или объема, отнесенного к 100 граммам или 100 сантиметрам кубическим растворителя — грамм/100 грамм или см³/100 см³.
Выражение растворимости:
- Газообразных веществ напрямую связано с температурой или давлением.
- Жидких и твердых веществ связано только с температурой.
Ниже размещена таблица растворимости кислот, оснований и солей в воде. Распечатывайте для использования на ЕГЭ, используйте и готовьтесь к экзамену.
Благодаря таблицам, которые находятся выше по тексту, вы сможете без проблем решать задачи по химии. Вы не сможете предугадать, какие задачи у вас будут в экзаменационных бланках. Но, порешав множество разных задач, вы сможете хорошо потренироваться и уже на экзамене вы легко выполните любую работу без проблем. Удачи!
Видео: Периодическая таблица Д.И.Менделеева — лучшая шпаргалка по химии
Таблица растворимости
Интерактивная таблица
Таблица растворимости — наглядная инфографика о растворимости солей. На пересечении катиона (по горизонтали) и аниона (по вертикали) отображается информация о соли, состоящей из данного катиона и данного аниона. Смотрите вкладки ниже, чтобы понять, какая информация там содержится.
Часто таблицу используют, чтобы предсказать возможность протекания реакции ионного обмена: если в процессе такой реакции образуется осадок (то есть нерастворимое вещество Н или малорастворимое М в этой таблице), то скорее всего реакция осуществима.
$$ce{BaCl2 + Na2SO4 ->[ce{H2O}] BaSO4 v + 2NaCl}$$
Однако, для совсем точного знания о ходе реакции обмена потребуется вычислить константу равновесия реакции, для которой необходимы знания произведений растворимости (ПР) малорастворимых и нерастворимых веществ. А чтобы узнать ПР, можно навести мышь на любое мало- или нерастворимое вещество: появится окошко со значением ПР вещества.
$$ce{BaSO4 <=> Ba^2+ + SO4^2-}, K_{s} = [ce{Ba^2+}][ce{SO4^2-}]$$
У таблицы растворимости есть следующие возможности:
- При наведении на пересечение катиона и аниона, если соединение нерастворимо (Н) или малорастворимо (М), отобразится значение произведения растворимости (ПР) этого соединения.
- При наведении на анион появится его название (гидроксид, фторид…);
- При наведении на любую клеточку отобразится подсказка о содержании данной ячейки.
Обозначения, используемые в таблице растворимости:
- Р: соединение растворимо (более 1 г на 100 г H2O);
- М: соединение малорастворимо (от 0,1 до 1 г на 100 г H2O);
- Н: соединение нерастворимо (менее 0,1 г на 100 г H2O);
- 🞩: нет данных о существовании соединения;
- —: соединение существует, но его невозможно получить обменом в водном растворе, то есть оно необратимо гидролизуется (Al2S3 + 6H2O = 2Al(OH)3 + 3H2S).
Все данные о растворимости приведены при стандартных условиях: 1 атм внешнего давления, температура 25°C.
Все данные о растворимости и о ПР веществ взяты из следующих источников:
- David R. Lide, ed., CRC Handbook of Chemistry and Physics, Internet Version 2005, <http://www.hbcpnetbase.com>, CRC Press, Boca Raton, FL, 2005
- «Неорганическая химия» в 3-х т. под ред. Ю. Д. Третьякова.
Если вы нашли ошибку, пожалуйста, сообщите об этом, выделив ошибку и нажав Ctrl+Enter, при необходимости добавив комментарий.
Спасибо за помощь, уважаемый читатель!
| Анион | H+ | NH4+ | Li+ | Na+ | K+ | Be2+ | Mg2+ | Ca2+ | Ba2+ | Al3+ | Zn2+ | Cr2+ | Cr3+ | Fe2+ | Fe3+ | Cu2+ | Pb2+ | Hg22+ | Hg2+ | Ag+ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
OH− Гидроксид |
Р | Р | Р | Р | Р | Н
ПР: 6,92 * 10-22 |
Н
ПР: 6,8 * 10-12 |
М
ПР: 6,3 * 10-6 |
Р | Н
ПР: 5,7 * 10-32 |
Н
ПР: 3,0 * 10-16 |
Н
ПР: 1,0 * 10-17 |
Н
ПР: 1,1 * 10-30 |
Н
ПР: 7,9 * 10-16 |
Н
ПР: 6,3 * 10-38 |
Н
ПР: 5,6 * 10-20 |
Н
ПР: 5,5 * 10-16 |
🞩 | 🞩 | 🞩 |
|
F− Фторид |
Р | Р | М
ПР: 1,5 * 10-3 |
Р | Р | Р | Н
ПР: 6,4 * 10-9 |
Н
ПР: 4,0 * 10-11 |
М
ПР: 1,7 * 10-6 |
М | М
ПР: 3,04 * 10-2 |
М
ПР: |
Р | Р | Р | Н | Н
ПР: 2,7 * 10-8 |
Н | — | Р |
|
Cl− Хлорид |
Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | М
ПР: 1,7 * 10-5 |
Н
ПР: 1,5 * 10-18 |
Р | Н
ПР: 1,8 * 10-10 |
|
Br− Бромид |
Р | Р | Р | Р | Р | М
ПР: |
Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | М
ПР: 5,0 * 10-5 |
Н
ПР: 7,9 * 10-23 |
М
ПР: |
Н
ПР: 5,3 * 10-13 |
|
I− Иодид |
Р | Р | Р | Р | Р | — | Р | Р | Р | Р | Р | Р | М
ПР: ? |
Р | 🞩 | 🞩 | Н
ПР: 8,7 * 10-9 |
Н
ПР: 5,4 * 10-29 |
Н | Н
ПР: 2,3 * 10-16 |
|
NO3− Нитрат |
Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
|
SO42− Сульфат |
Р | Р | Р | Р | Р | Р | Р | М
ПР: 3,7 * 10-5 |
Н
ПР: 1,8 * 10-10 |
Р | Р | Р | Р | Р | Р | Р | Н
ПР: 1,7 * 10-8 |
— | — | М
ПР: 1,2 *10-3 |
|
SO32− Сульфит |
Р | Р | Р | Р | Р | 🞩 | М
ПР: 3,0 * 10-3 |
Н
ПР: 3,2 * 10 -7 |
Н
ПР: 8,0 * 10-7 |
🞩 | М | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | Н | Н | 🞩 | Н
ПР: 1,5 * 10-14 |
|
CH3COO− Ацетат |
Р | Р | Р | Р | Р | Н | Р | Р | Р | 🞩 | Р | М
ПР: |
Р | 🞩 | 🞩 | Р | Р | Р | Р | М
ПР: |
|
CO32− Карбонат |
Р | Р | М
ПР: 1,9 * 10-3 |
Р | Р | М | М
ПР: 4,9 * 10-11 |
Н
ПР: 4,4 * 10-9 |
Н
ПР: 4,9 * 10-9 |
🞩 | Н
ПР: 5,3 * 10-11 |
🞩 | 🞩 | Н
ПР: 2,9 * 10-11 |
🞩 | — | Н
ПР: 3,6 * 10-14 |
Н
ПР: ? |
🞩 | Н
ПР: 1,2 * 10-12 |
|
S2− Сульфид |
Р | Р | Р | Р | Р | — | — | М
ПР: — |
Р | — | Н
ПР: 1,2 * 10-25 |
Н | — | Н | Н | Н
ПР: 1,4 * 10-36 |
Н
ПР: 8,7 * 10-29 |
Н | Н
ПР: 1,4 * 10-45 |
Н
ПР: 7,2 * 10-50 |
|
SiO32− Силикат |
Н | 🞩 | Н | Р | Р | 🞩 | М
ПР: N |
М
ПР: N |
Н | 🞩 | Н | 🞩 | 🞩 | Н | 🞩 | 🞩 | Н | 🞩 | 🞩 | Н |
|
PO43− Фосфат |
Р | — | Н
ПР: 3,2 * 10-9 |
Р | Р | 🞩 | Н
ПР: 1,04 * 10-24 |
Н
ПР: 1,0 * 10-25 |
Н
ПР: 6,0 * 10-39 |
М
ПР: 9,84 * 10-21 |
Н
ПР: 9,1 * 10-33 |
🞩 | Н | Н | Н | Н | Н | Н | Н | Н
ПР: 1,8 * 10-18 |
|
HPO4− Гидрофосфат |
Р | Р | 🞩 | Р | Р | Н | М | Н | Н | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | — | 🞩 | 🞩 | 🞩 |
|
H2PO4− Дигидрофосфат |
Р | Р | Р | Р | Р | 🞩 | 🞩 | Р | Р | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | Р | 🞩 | 🞩 | 🞩 |
|
ClO4− Перхлорат |
Р | Р | Р | Р | М
ПР: 1,0 * 10-2 |
Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
|
ClO3− Хлорат |
Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | 🞩 | 🞩 | Р | Р | Р | Р | 🞩 |
|
HCOO− Формиат |
Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | — | Н |
|
C2O42− Оксалат |
Р | Р | Р | Р | Р | Р | Н
ПР: 8,6 * 10-3 |
Н
ПР: 2,3 * 10-9 |
Н
ПР: 1,1 * 10-9 |
Р | Н
ПР: 1,38 * 10-9 |
🞩 | Н | Н
ПР: 2,1 * 10-7 |
Н | Н | Н | Н | Н | Н
ПР: 3,5 * 10-11 |
|
MnO4− Перманганат |
Р | М | Н | М | М | 🞩 | 🞩 | 🞩 | Р | 🞩 | Р | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | М |
|
CrO42− Хромат |
Р | Р | Р | Р | Р | Р | Р | Р | Н
ПР: 1,1 * 10-10 |
— | Н | 🞩 | Р | — | Р | Н | Н
ПР: 2,8 * 10-15 |
М | Н | Н
ПР: 1,1 * 10-12 |
|
Cr2O72− Дихромат |
Р | Р | Р | Р | Р | Р | Р | Р | Р | 🞩 | Р | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | Н
ПР: 1,1 * 10-10 |
|
ReO4− Перренат |
Р | Р | Р | Р | М | 🞩 | 🞩 | 🞩 | Р | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | М |
|
MoO42− Метамолибдат |
Н | Р | Р | Р | Р | 🞩 | Р | Н
ПР: 1,46 * 10-8 |
Н
ПР: 3,54 * 10-8 |
Н | Н | 🞩 | 🞩 | Н | 🞩 | Н | Н | 🞩 | 🞩 | Н
ПР: 2,8 * 10-12 |
|
WO42− Метавольфрамат |
Н | Р | Р | Р | Р | 🞩 | 🞩 | Н | Н | 🞩 | Н | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | Н | 🞩 | 🞩 | Н
ПР: 5,5 * 10-12 |
|
[Fe(CN)6]4− Гексацианоферрат(II) |
Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | 🞩 | — | Н | Н | Н | Н | Н | — | Н |
|
S2O32− Тиосульфат |
— | Р | Р | Р | Р | 🞩 | Р | Р | М | 🞩 | Р | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | Н | Н | — | Н |
|
N3− Азид |
Р | Р | Р | Р | Р | 🞩 | Р | Р | Р | — | 🞩 | 🞩 | 🞩 | 🞩 | Р | Н | Н
ПР: 2,6 * 10-9 |
Н | Н | Н |
|
SeO42− Селенат |
Р | Р | Р | Р | Р | Р | Р | Р | Н
ПР: |
🞩 | Р | 🞩 | 🞩 | 🞩 | 🞩 | Р | Н
ПР: |
🞩 | 🞩 | 🞩 |
|
CN− Цианид |
Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Н
ПР: |
Н
ПР: |
🞩 | Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Р | Н
ПР: 1,4 * 10-16 |
|
[Fe(CN)6]3− Гексацианоферрат(III) |
Р | Р | Р | Р | Р | 🞩 | Р | Р | Р | 🞩 | Н
ПР: |
🞩 | — | Н
ПР: |
Р | Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
|
CNS− Тиоцианат |
Р | Р | Р | Р | Р | Н
ПР: |
Р | Р | Р | Р | Р | Р | 🞩 | Р | Р | Р | М
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
|
VO43− Ортованадат |
🞩 | 🞩 | Р | Р | Р | 🞩 | 🞩 | 🞩 | Н
ПР: |
🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | Н
ПР: |
|
BO2− Метаборат |
Р | Р | Р | Р | Р | 🞩 | М
ПР: |
М
ПР: |
М
ПР: |
Н
ПР: |
Н
ПР: |
🞩 | Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
— | — | М
ПР: |
|
IO3− Иодат |
Р | Р | Р | Р | Р | Р | Р | М
ПР: |
Н
ПР: |
Н
ПР: |
М
ПР: |
🞩 | 🞩 | 🞩 | Н
ПР: |
М
ПР: |
Н
ПР: |
🞩 | Н
ПР: |
Н
ПР: |
|
SiF62− Гексафторосиликат |
Р | Р | Р | М
ПР: |
Н
ПР: |
🞩 | Р | Р | Н
ПР: |
🞩 | Р | 🞩 | 🞩 | Р | 🞩 | Р | Р | 🞩 | 🞩 | Р |
|
C17H35COO− Стеарат |
Н
ПР: |
Р | Н
ПР: |
Р | Р | 🞩 | Н
ПР: |
Н
ПР: |
Р | Н
ПР: |
Н
ПР: |
🞩 | Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
|
C6H5COOH− Бензоат |
М
ПР: |
Р | Р | Р | Р | 🞩 | Р | Р | Р | 🞩 | Р | 🞩 | 🞩 | 🞩 | 🞩 | Н
ПР: |
М
ПР: |
🞩 | М
ПР: |
М
ПР: |
|
[PtCl6]2− Гексахлороплатинат |
Р | М
ПР: |
Р | Р | М
ПР: |
🞩 | 🞩 | 🞩 | Р | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 | 🞩 |
|
AsO33− Арсенит |
🞩 | Р | 🞩 | Р | Р | 🞩 | Н
ПР: |
Н
ПР: |
Н
ПР: |
— | — | 🞩 | Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
|
AsO43− Ортоарсенат |
Р | Р | Н
ПР: |
Р | Р | Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
🞩 | Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Н
ПР: |
Физическая химия
Степан Чичулин
20.02.2021
Таблицы ЕГЭ по химии
Ниже приведены таблицы, идентичные используемым на ЕГЭ по химии: «Периодическая система химических элементов Д.И.Менделеева»
«Растворимость солей, кислот и оснований в воде» и «Электрохимический ряд напряжений металлов»: