30 октября 2022
В закладки
Обсудить
Жалоба
Цвета осадков и газов в неорганической химии
Для сдачи ОГЭ необходимо знать и предсказывать по формуле цвет осадка или газа, а также характерные запахи, которыми обладают газы. В данном документе собраны необходимые данные по этому вопросу.
Осадки бывают разных цветов и разной консистенции. Все это является частью описания признака реакции.
Задание 13 ОГЭ по химии.
priznaki-him-r.pdf
Автор: Фрундина Дарья Андреевна, учитель химии.
Таблица растворимости, цвета осадков
На чтение 4 мин Просмотров 2.6к. Опубликовано
Растворимость – это свойство вещества растворяться в воде или другом растворителе. В воде могут растворяться и твёрдые и жидкие и газообразные вещества. По растворимости все вещества делятся на три группы:
- хорошо растворимые
- мало растворимые
- нерастворимые
Абсолютно нерастворимых веществ несуществует, поэтому название нерастворимые условно и нужно читать “практически нерастворимые”.
Таблицу растворимости используют для проверки условий протекания реакции, так как одним из условий протекания реакции является образование осадка (необратимость протекания реакции), то по таблице растворимости можно проверить образование осадка и тем самым определить, протекает реакция или нет.
Растворимость веществ зависит от температуры зависит от температуры и давления, так, например, вещество KNO3 (нитрат калия) при температуре +20°C имеет растворимость 31,6 г / 100 г воды, а при температуре +100°C – 245 г / 100 г воды.
НЕРАСТВОРИМЫЕ ВЕЩЕСТВА
Жидкие
- Бензин
- Растительное масло
МАЛОРАСТВОРИМЫЕ ВЕЩЕСТВА
Твердые
- Алебастр
- Сульфат свинца
Жидкие
- Диэтиловый эфир
- Бензол
Газообразные
- Метан
- Азот
- Кислород
РАСТВОРИМЫЕ ВЕЩЕСТВА
Твердые
- Соль
- Медный купорос
Газообразные
- Хлороводород
- Аммиак
| Катионы Анионы | OH– | F– | Cl– | Br– | I– | S2- | NO3– | CO32- | SiO32- | SO42- | PO43- |
| H+ | Р | Р | Р | Р | Р | М | Р | – | Н | Р | Р |
| Na+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| K+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| NH4+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| Mg2+ | Н | РК | Р | Р | Р | М | Р | Н | РК | Р | РК |
| Ca2+ | М | НК | Р | Р | Р | М | Р | Н | РК | М | РК |
| Sr2+ | М | НК | Р | Р | Р | Р | Р | Н | РК | РК | РК |
| Ba2+ | Р | РК | Р | Р | Р | Р | Р | Н | РК | НК | РК |
| Sn2+ | Н | Р | Р | Р | М | РК | Р | Н | Н | Р | Н |
| Pb2+ | Н | Н | М | М | М | РК | Р | Н | Н | Н | Н |
| Al3+ | Н | М | Р | Р | Р | Г | Р | Г | НК | Р | РК |
| Cr3+ | Н | Р | Р | Р | Р | Г | Р | Г | Н | Р | РК |
| Mn2+ | Н | Р | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe3+ | Н | Р | Р | Р | – | – | Р | Г | Н | Р | РК |
| Co2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Ni2+ | Н | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cu2+ | Н | М | Р | Р | – | Н | Р | Г | Н | Р | Н |
| Zn2+ | Н | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cd2+ | Н | Р | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Hg2+ | Н | Р | Р | М | НК | НК | Р | Н | Н | Р | Н |
| Hg22+ | Н | Р | НК | НК | НК | РК | Р | Н | Н | М | Н |
| Ag+ | Н | Р | НК | НК | НК | НК | Р | Н | Н | М | Н |
| Катионы Анионы | OH– | F– | Cl– | Br– | I– | S2- | NO3– | CO32- | SiO32- | SO42- | PO43- |
- Р – вещество хорошо растворимо в воде
- М – вещество малорастворимо в воде
- Н – вещество практически нерастворимо в воде, но легко растворяется в слабых или разбавленных кислотах
- РК – вещество нерастворимо в воде и растворяется только в сильных неорганических кислотах
- НК – вещество нерастворимо ни в воде, ни в кислотах
- Г – вещество полностью гидролизуется при растворении и не существует в контакте с водой- – вещество не существует
СПИСОК РАСТВОРИМОСТИ ЭЛЕМЕНТОВ
ВЕЩЕСТВО ХОРОШО РАСТВОРИМО В ВОДЕ
- H-OH
- H-NO3
- Na-Cl
- Na-CO3
- K-F
- K-NO3
- NH4-OH
- NH4-S
- NH4-PO4
- Mg-SO4
- Sr-Cl
- Ba-OH
- Ba-NO3
- Sn-SO4
- Al-NO3
- Cr-I
- Mn-Br
- Fe-Br
- Fe-Cl
- Co-Br
- Ni-Br
- Cu-Br
- Zn-I
- Cd-Br
- Hg-Cl
- Ag-F
- H-F
- H-SO4
- Na-Br
- Na-SiO3
- K-Cl
- K-CO3
- NH4-F
- NH4-NO3
- Mg-Cl
- Ca-Cl
- Sr-Br
- Ba-Cl
- Sn-F
- Pb-NO3
- Al-SO4
- Cr-NO3
- Mn-I
- Fe-I
- Fe-Br
- Co-I
- Ni-I
- Cu-NO3
- Zn-NO3
- Cd-I
- Hg-NO3
- Ag-NO3
- H-Cl
- H-PO4
- Na-I
- Na-SO4
- K-Br
- K-SiO3
- NH4-Cl
- NH4-CO3
- Mg-Br
- Ca-Br
- Sr-I
- Ba-Br
- Sn-Cl
- Al-Cl
- Cr-F
- Cr-SO4
- Mn-NO3
- Fe-NO3
- Fe-NO3
- Co-NO3
- Ni-NO3
- Cu-SO4
- Zn-SO4
- Cd-NO3
- Hg-SO4
- H-Br
- Na-OH
- Na-S
- Na-PO4
- K-I
- K-SO4
- NH4-Br
- NH4-SiO3
- Mg-I
- Ca-I
- Sr-S
- Ba-I
- Sn-Br
- Al-Br
- Cr-Cl
- Mn-F
- Mn-SO4
- Fe-SO4
- Fe-SO4
- Co-SO4
- Ni-SO4
- Zn-Cl
- Cd-F
- Cd-SO4
- Hg2-F
ВЕЩЕСТВО МАЛОРАСТВОРИМО В ВОДЕ
- H-S
- Sr-OH
- Al-F
- Zn-F
- Mg-S
- Sn-I
- Fe-F
- Hg-Br
- Ca-OH
- Pb-Cl
- Co-F
- Hg2-SO4
- Ca-S
- Pb-Br
- Ni-F
- Ag-SO4
- Ca-SO4
- Pb-I
- Cu-F
ВЕЩЕСТВО ПРАКТИЧЕСКИ НЕРАСТВОРИМО В ВОДЕ, НО ЛЕГКО РАСТВОРЯЕТСЯ В СЛАБЫХ ИЛИ РАЗБАВЛЕННЫХ КИСЛОТАХ
- H-SiO3
- Ba-CO3
- Pb-OH
- Pb-PO4
- Mn-S
- Fe-S
- Fe-SiO3
- Co-PO4
- Cu-OH
- Zn-CO3
- Cd-SiO3
- Hg-PO4
- Ag-OH
- Mg-OH
- Sn-OH
- Pb-F
- Al-OH
- Mn-CO3
- Fe-CO3
- Co-OH
- Ni-OH
- Cu-S
- Zn-SiO3
- Cd-PO4
- Hg2-OH
- Ag-CO3
- Mg-CO3
- Sn-CO3
- Pb-CO3
- Cr-OH
- Mn-SiO3
- Fe-SiO3
- Co-S
- Ni-CO3
- Cu-SiO3
- Zn-PO4
- Hg-OH
- Hg2-CO3
- Ag-SiO3
- Ca-CO3
- Sn-SiO3
- Pb-SiO3
- Cr-SiO3
- Mn-PO4
- Fe-PO4
- Co-CO3
- Ni-SiO3
- Cu-PO4
- Cd-OH
- Hg-CO3
- Hg2-SiO3
- Ag-PO4
- Sr-CO3
- Sn-PO4
- Pb-SO4
- Mn-OH
- Fe-OH
- Fe-OH
- Co-SiO3
- Ni-PO4
- Zn-OH
- Cd-CO3
- Hg-SiO3
- Hg2-PO4
ВЕЩЕСТВО НЕРАСТВОРИМО В ВОДЕ И РАСТВОРЯЕТСЯ ТОЛЬКО В СИЛЬНЫХ НЕОРГАНИЧЕСКИХ КИСЛОТАХ
- Mg-F
- Sr-SiO3
- Ba-PO4
- Fe-PO4
- Mg-SiO3
- Sr-SO4
- Sn-S
- Ni-S
- Mg-PO4
- Sr-PO4
- Pb-S
- Zn-S
- Ca-SiO3
- Ba-F
- Al-PO4
- Cd-S
- Ca-PO4
- Ba-SiO3
- Cr-PO4
- Hg2-S
ВЕЩЕСТВО НЕРАСТВОРИМО НИ В ВОДЕ, НИ В КИСЛОТАХ
- Ca-F
- Hg-S
- Ag-Br
- Sr-F
- Hg2-Cl
- Ag-I
- Ba-SO4
- Hg2-Br
- Ag-S
- Al-SiO3
- Hg2-I
- Hg-I
- Ag-Cl
ВЕЩЕСТВО ПОЛНОСТЬЮ ГИДРОЛИЗУЕТСЯ ПРИ РАСТВОРЕНИИ И НЕ СУЩЕСТВУЕТ В КОНТАКТЕ С ВОДОЙ
- Al-S
- Cu-CO3
- Al-CO3
- Cr-S
- Cr-CO3
- Fe-CO3
ВЕЩЕСТВО НЕ СУЩЕСТВУЕТ
- H-CO3
- Fe-I
- Fe-S
- Cu-I
Стандартная (школьная) таблица растворимости

ЦВЕТА ОСАДКОВ ТАБЛИЦЫ РАСТВОРИМОСТИ
Гидроксиды

Фториды
Хлориды
Бромиды

Йодиды
Сульфиды

Сульфиты
Сульфаты
Карбонаты
Силикаты

Фосфаты

Цвета некоторых неорганических соединений.
Для успешного выполнения заданий ЕГЭ требуется помнить внешний вид и цвета соединений. Проще всего их запомнить, один раз увидев. Ниже приводятся фотографии наиболее «популярных» соединений. В подписях под картинками указаны те цвета, которыми в ЕГЭ чаще всего обозначают эти вещества.
| Соединения меди | |
 |
 |
| Металлическая медь, (красный или золотисто-красный) |
Оксид меди (II), (чёрный порошок) |
 |
 |
| Медный купорос, (синее кристаллическое вещество) |
Малахит, (сине-зелёный осадок) |
 |
|
| Гидроксид меди (II), (синий студенистый осадок) |
|
| Соединения железа | |
 |
|
| Оксид железа (III), (красный порошок) |
|
| Соединения хрома | |
 |
 |
| Оксид хрома (III), (зелёный порошок) |
Оксид хрома (VI), (Красные кристаллы) |
 |
 |
| Дихромат калия, (оранжевый порошок или раствор) |
Хромат калия, (жёлтый порошок или раствор) |
| Соединения серебра | |
 |
 |
| Хлорид серебра, (белый творожистый осадок) |
Бромид серебра, (бледно-желтый творожистый осадок) |
 |
 |
| Йодид серебра, (желтый творожистый осадок) |
Фосфат серебра, (жёлтый осадок) |
| Соединения марганца | |
 |
 |
| Перманганат калия, (фиолетовые кристаллы или раствор) |
Манганат калия, (зелёный раствор или кристаллы) |
 |
 |
| Диоксид марганца, (чёрно-коричневый порошок) |
Сульфат марганца (II), (бледно-розовый порошок или раствор) |
| Прочие вещества | |
 |
 |
| Диоксид азота, (бурый газ) |
Бром, (коричневая жидкость с красными парами) |
 |
 |
| Йод, (серо-коричневые кристаллы с фиолетовыми парами) |
Сера, (жёлтый порошок) |
 |
 |
| Красный фосфор, (красный порошок) |
Белый фосфор, (бледно-жёлтое воскообразное вещество) |
Если вам понравился наш материал — записывайтесь на курсы подготовки к ЕГЭ по химии онлайн
Спасибо за то, что пользуйтесь нашими материалами.
Информация на странице «Цвета некоторых неорганических соединений.» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать необходимые и поступить в ВУЗ или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из разделов нашего сайта.
Публикация обновлена:
09.03.2023
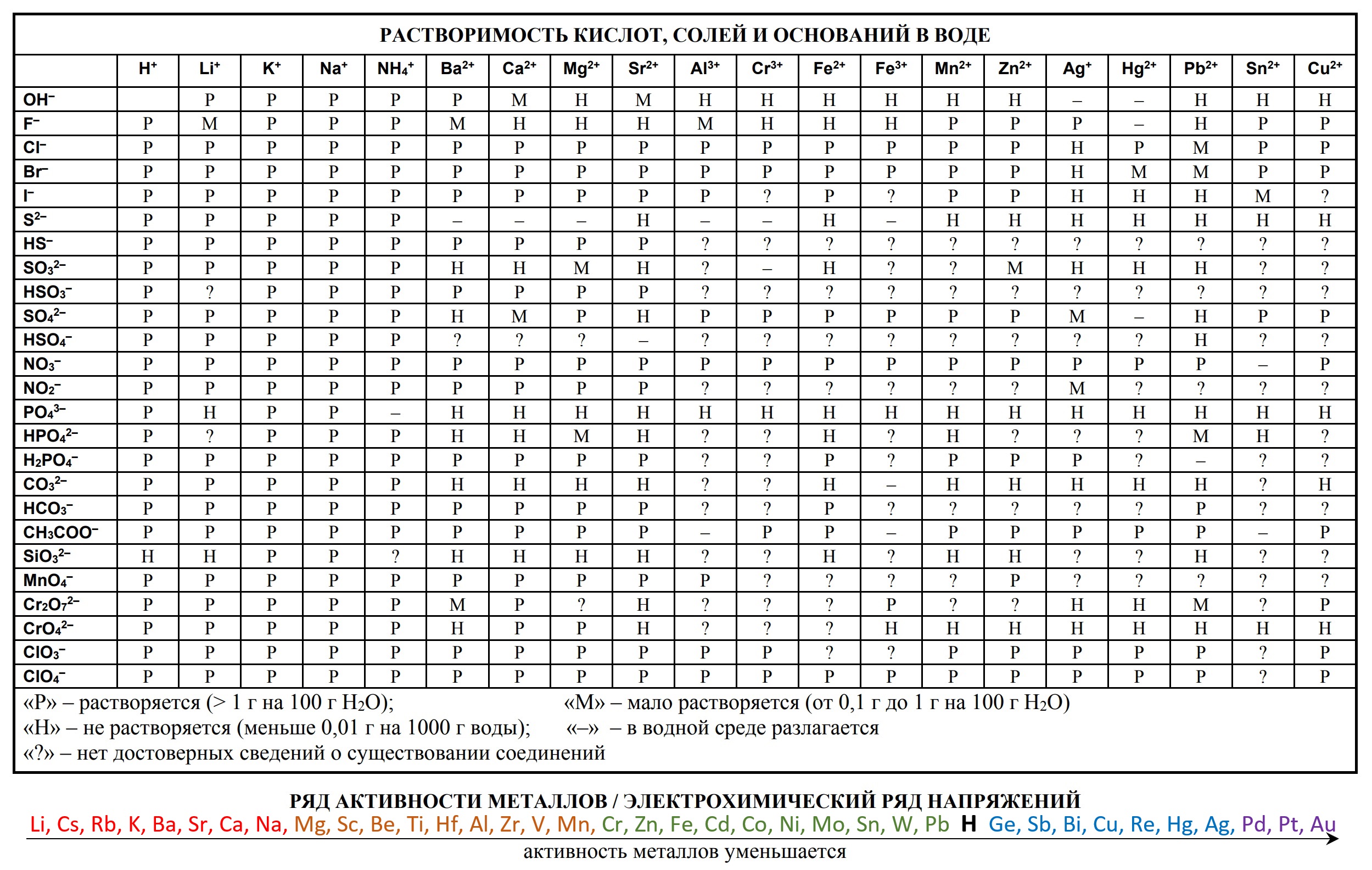
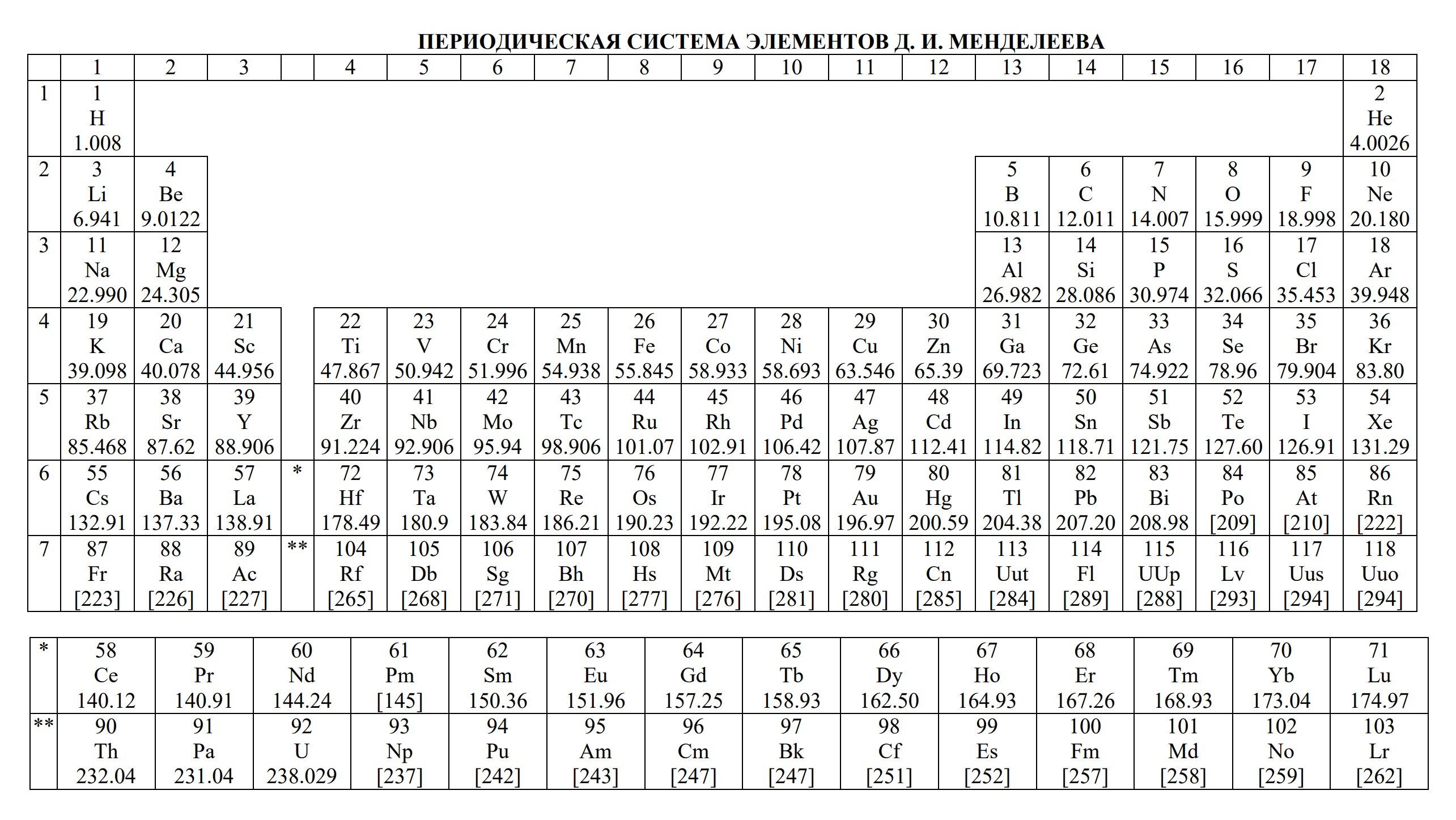
Таблицы на ЕГЭ и ОГЭ по химии
На сдаче ЕГЭ и ОГЭ по химии можно использовать три таблицы:
- периодическая система химических элементов Д.И. Менделеева
- таблица растворимости
- ряд активности металлов.
Они содержат в себе 80% информации, необходимой для решения большинства заданий.
Однако таблицы на форзацах разных учебников, продаваемые в книжных магазинах, располагающиеся на просторах интернета отличаются не только оформлением, но и содержанием. Что бы они оказались надёжно шпаргалкой, а не приятной неожиданностью, лучше с самого начала начинать работать с тем форматом, который официально разрешен на ЕГЭ твоего года.
Скачать эти таблицы можно ниже. А как сделать эти безликие таблицы наиболее информационными для тебя я расскажу на уроке.
- Таблица Д.И. Менделеева для ОГЭ и ЕГЭ
- Таблица растворимости и ряд активности для ОГЭ и ЕГЭ
- Таблица растворимости с расширенным рядом активности
- Таблица Д.И. Менделеева длиннопериодная для олимпиады