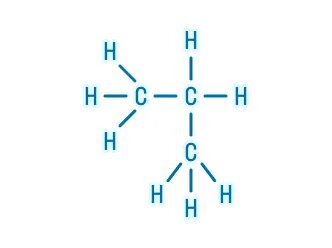
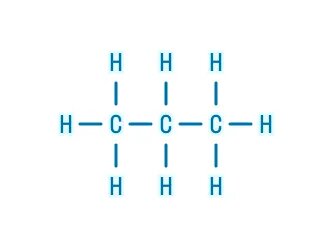
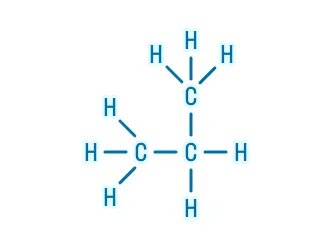
Органическая химия – это химия углерода и его соединений с другими элементами.
В молекулах органических веществ могут присутствовать также атомы: водорода Н, кислорода О, азота N, серы S, фосфора P, галогенов, металлов и других элементов.
Количество известных органических соединений в настоящее время превышает 20 миллионов.
Углерод в органических веществах
Атомы углерода могут соединяться друг с другом с образованием цепей различного строения (разветвленные, неразветвленные, замкнутые) и длины (от двух до сотен тысяч атомов углерода).
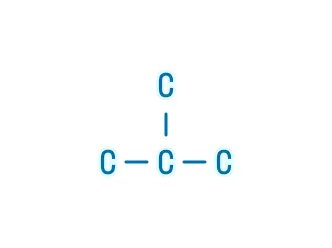
В органических веществах углерод имеет валентность IV (образует 4 связи).
- Атом углерода может образовывать одинарные, двойные и тройные связи.
CH3-CH3 CH2=CH2 CH≡CH
В основе современной органической химии лежит теория строения органических соединений.
Основные положения теории строения органических соединений
Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается структурной формулой (формулой строения).
- Свойства веществ зависят не только от вида и числа атомов в молекуле, но и от их взаимного расположения – т.е. от строения молекулы.
Это приводит к тому, что вещества одного и того же состава могут иметь разное строение, т. е. к появлению изомерии.
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
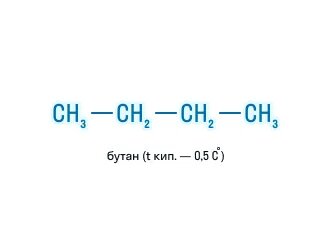
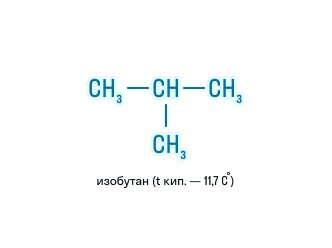
| Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилпропан) с разветвленным скелетом | |
|
н-Бутан CH3-CH2-CH2-CH3 |
Изобутан CH3-CH(CH3)-CH3 |
При этом температура кипения н-бутана -0,5оС, а изобутана -11,4оС.
- По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы – определить свойства.
- Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга. Это отражается на химических и физических свойствах вещества.
Формулы строения органических веществ
Состав органического вещества можно описать химическими формулами.
Химические формулы органических веществ бывают следующих типов:
Простейшая формула – может быть получена опытным путем через определение соотношения количества атомов химических элементов в веществе.
Например, простейшая формула метана CH4, а вот бензола – СН.
Истинная формула (брутто-формула) – показывает истинный состав молекулы, но не показывает ее структуру. Истинная формула показывает точное количество атомов каждого элемента в одной молекуле.
Например, истинная формула бензола C6H6.
Полная (развернутая) структурная формула однозначно описывает порядок соединения атомов в молекуле.
Например, полная структурная формула бутана:
Сокращенная структурная формула – это структурная формула, в которой не указываются связи между углеродом и водородом.
Например, сокращенная структурная формула бутана:
CH3-CH2-CH2-CH3
Типы углеродных атомов в составе органических молекул
Типы углеродных атомов в составе органических молекул
|
Атомы углерода |
|||
| Первичные | Вторичные | Третичные | Четвертичные |
| Атомы углерода, которые в углеродной цепи соединены с одним атомом углерода | Атомы углерода, которые в углеродной цепи соединены с двумя атомами углерода | Атомы углерода, которые в углеродной цепи соединены с тремя атомами углерода | Атомы углерода, которые в углеродной цепи соединены с четырьмя атомами углерода |
Типы связей в молекулах органических веществ
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле.
По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов.
σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
Виды σ-связей
π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи.
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
| Одинарная связь
С–С, С–Н, С–О |
Двойная связь
С=С, С=О |
Тройная связь
С≡С, С≡N |
| σ-связь | σ-связь + π-связь | σ-связь + две π-связи |
Гибридизация атомных орбиталей углерода
Электронная формула атома углерода в основном состоянии:
+6С 1s22s22p2
+6С 1s 2s
2p
В возбужденном состоянии: один электрон переходит с 2s-подуровня на 2р-подуровень.
+6С* 1s22s12p3
+6С* 1s2 2s1
2p3
Таким образом, в возбужденном состоянии углерод содержит четыре неспаренных электрона, может образовать четыре химические связи и проявляет валентность IV в соединениях.
При образовании четырех химических связей атомом углерода происходит гибридизация атомных орбиталей.
Гибридизация атомных орбиталей — это выравнивание электронной плотности атомных орбиталей разного типа с образованием новых, молекулярных орбиталей, форма и энергия которых одинаковы.
В гибридизацию вступают атомные орбитали с небольшой разницей в энергии (как правило, орбитали одного энергетического уровня). В зависимости от числа и типа орбиталей, участвующих в гибридизации, для атома углерода возможны sp3, sp2 и sp-гибридизация.
sp3-Гибридизация
В sp3-гибридизацию вступают одна s-орбиталь и три p-орбитали. При этом образуются четыре sp3-гибридные орбитали:
Изображение с портала orgchem.ru
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в состоянии sp3-гибридизации направлены в пространстве под углом 109о 28’ друг к другу, что соответствует тетраэдрическому строению.
Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода. Валентный угол Н–С–Н в метане равен 109о 28’
Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
Например, пространственное строение н-бутана
sp2-Гибридизация
В sp2-гибридизацию вступают одна s-орбиталь и две p-орбитали. Одна p-орбиталь не гибридизуется:
Три sp2-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому три sp2-гибридные орбитали атома углерода направлены в пространстве под углом 120о друг к другу, что соответствует плоскому строению (треугольник).
При этом негибридная р-орбиталь располагается перпендикулярно плоскости, в которой расположены три гибридные sp2— орбитали.
Изображение с портала orgchem.ru
Например, молекула этилена C2H4 имеет плоское строение. Сигма-связь между атомами углерода образуется за счет перекрывания sp2-гибридных орбиталей. Пи-связь между атомами углерода образуется за счет перекрывания негибридных р-орбиталей.
Модель молекулы этилена:
sp-Гибридизация
В sp-гибридизацию вступают одна s-орбиталь и одна p-орбиталь. Две p-орбитали не вступают в гибридизацию:
Две sp-гибридные орбитали атома углерода направлены в пространстве под углом 180о друг к другу, что соответствует линейному строению.
Изображение с портала orgchem.ru
При этом две р-орбитали располагаются перпендикулярно друг другу и перпендикулярно линии, на которой расположены гибридные орбитали.
Например, молекула ацетилена имеет линейное строение.
Изомерия
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:
При этом температура кипения н-бутана –0,5оС, а изобутана –11,4оС.
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию).
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:
2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы. Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):
2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:
2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):
Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия)
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла.
Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
Например, бутен-2 существует в виде цис— и транс-изомеров
1,2-Диметилпропан также образует цис-транс-изомеры:
Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 оС, а транс-бутена-2 0,88оС.
При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Например, в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.
Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:
Классификация органических соединений
Классификацию органических веществ определяют строение углеродной цепи (углеродного скелета) и наличие и особенности строения функциональных групп.
Углеродный скелет – это последовательность соединенных между собой атомов углерода в органической молекуле.
Функциональная группа – это атом или группа атомов, которая определяет принадлежность молекулы к определенному классу органических веществ и химические свойства, соответствующие данному классу веществ.
|
Классификация органических веществ по составу |
||
| Углеводороды | Кислородсодержащие вещества | Азотсодержащие вещества |
| Состоят из атомов углерода и водорода | Содержат также атомы кислорода | Содержат также атомы азота |
Углеводороды
Углеводороды– это вещества, состав которых отражается формулой СхНу, то есть в их составе только атомы углерода и водорода.
В зависимости от типа связей между атомами С, они делятся на предельные или насыщенные (все связи одинарные) и непредельные (ненасыщенные) — в молекуле присутствуют двойные и тройные связи.
Кроме того, углеводороды делятся на циклические (углеродная цепь образует кольцо) и ациклические или алифатические (углеродная цепь не замкнута в кольцо).
| Углеводороды | |||||
| Предельные (содержат только одинарные связи) | Непредельные (содержат двойные или тройные связи между атомами углерода) | ||||
| Алканы | Циклоалканы | Алкены | Алкадиены | Алкины | Ароматические углеводороды |
| Углеводороды с открытой (незамкнутой) углеродной цепью | Атомы углерода соединены в замкнутый цикл | Одна двойная связь | Две двойные связи | Одна тройная связь | Циклические углеводороды с тремя двойными связями (бензольное кольцо) |
| CnH2n+2 | CnH2n | CnH2n | CnH2n-2 | CnH2n-2 | CnH2n-6 |
| Этан
CH3-CH3 |
Циклобутан
|
Этилен
CH2=CH2 |
Дивинил
CH2=CН-СН=СH2 |
Ацетилен
СН≡СН |
Бензол
|
| Ациклические углеводороды | |
| С неразветвленной цепью | С разветвленной углеродной цепью |
| н-Бутан
CH3-CH2-CH2-CH3 |
Изобутан
|
Кислородсодержащие органические вещества
Так как кислород имеет валентность II, он может образовать либо 2 одинарные связи, либо одну двойную. Соответственно, в органической молекуле он соединяется с водородом и углеродом.
- группа –О-Н (гидроксильная)
- группа >С=О (карбонильная)
- группа –СОО- (карбоксильная)
|
Кислородсодержащие органические вещества |
|||||
| Группа ОН | Группа С=О | Группа -СОО- | |||
| Гидроксил | Карбонил | Карбоксил | |||
| Спирт | Фенол | Альдегид | Кетон | Карбоновая кислота | Сложный эфир |
| R-OH |  |
 |
 |
 |
|
| Метанол
CH3-OH |
Фенол
|
Ацетальдегид
|
Пропанон
|
Уксусная кислота
|
Метилацетат
|
Азотсодержащие органические вещества
Азотсодержащие вещества можно также разделить на классы по наличию определенных функциональных групп.
- амины – содержат группы –NН2, –NH–, либо -N< ,
- нитрилы (группа –СºN),
- азотистые гетероциклы.
Некоторые органические вещества содержат и азот, и кислород.
К ним относятся:
- нитросоединения –NO2
- амиды –CONH2,
- аминокислоты – полифункциональные соединения, которые содержат и карбоксильную группу –COOH, и аминогруппу –NH2
| Азотсодержащие вещества | |||||
| Амины | Нитрилы | Нитросоединения | Амиды | Аминокислоты | Гетероциклы |
| -NH2
-NH- -N< |
-C≡N | R-NO2 | R-C(NH2)=O | -NH2, -COOH | |
| Метиламин
CH3-NH2 |
Нитрил уксусной кислоты
CH3-C≡N |
Нитрометан
CH3-NO2 |
Амид уксусной кислоты
CH3-C(NH2)=O |
Аминоуксусная кислота
CH2(NH2)-COOH |
Пиррол
|
Другие органические вещества
Органические соединения очень многочисленны и разнообразны.
К важным классам органических соединений также относятся галогенопроизводные органические вещества R–Hal ,которые содержат также атомы галогенов (хлора, фтора, брома и др.).
В состав органических соединений также могут входить несколько одинаковых или различных функциональных групп.
Гомологи. Гомологический ряд
Органические вещества разных классов тесно взаимосвязаны.
Соединения, содержащие одинаковые функциональные свойства, проявляют схожие химические и физические свойства.
Вещества, которые содержат одинаковые функциональные группы, имеют сходное строение, но отличаются друг от друга на одну или несколько групп –СH2–, образуют гомологический ряд.
Гомологи – это вещества, которые входят в один и тот же гомологический ряд.
Группу –СH2– называют гомологической разностью.
3.1. Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах.
Органическая химия — раздел химии, в котором изучают соединения углерода, их строение, свойства, взаимопревращения.
Само название дисциплины — «органическая химия» — возникло достаточно давно. Причина его кроется в том, что большинство соединений углерода, с которыми сталкивались исследователи на начальном этапе становления химической науки, имели растительное или животное происхождение. Тем не менее, в порядке исключения, отдельные соединения углерода относят к неорганическим. Так, например, неорганическими веществами принято считать оксиды углерода, угольную кислоту, карбонаты, гидрокарбонаты, циановодород и некоторые другие.
В настоящее время известно чуть менее 30-ти миллионов разнообразных органических веществ и этот список непрерывно пополняется. Такое огромное число органических соединений связано, прежде всего, со следующими специфическими свойствами углерода:
1) атомы углерода могут соединяться друг с другом в цепи произвольной длины;
2) возможно не только последовательное (линейное) соединение атомов углерода между собой, но также разветвленное и даже циклическое;
3) возможны разные виды связей между атомами углерода, а именно одинарные, двойные и тройные. При этом валентность углерода в органических соединениях всегда равна четырем.
Помимо этого, большому разнообразию органических соединений способствует также и то, что атомы углерода способны образовывать связи и с атомами многих других химических элементов, например, водородом, кислородом, азотом, фосфором, серой, галогенами. При этом водород, кислород и азот встречаются наиболее часто.
Следует отметить, что довольно долго органическая химия представляла для ученых «темный лес». Какое-то время в науке даже была популярна теория витализма, согласно которой органические вещества не могут быть получены «искусственным» способом, т.е. вне живой материи. Однако теория витализма просуществовала не очень долго, ввиду того что одно за одним обнаруживались вещества, синтез которых возможен вне живых организмов.
У исследователей вызывало недоумение то, что многие органические вещества имеют одинаковый качественный и количественный состав, однако часто обладают совершенно непохожими друг на друга физическими и химическими свойствами. Так, например, диметиловый эфир и этиловый спирт имеют абсолютно одинаковый элементный состав, однако диметиловый эфир в обычных условиях представляет собой газ, а этиловый спирт – жидкость. Кроме того, диметиловый эфир с натрием не реагирует, а этиловый спирт взаимодействует с ним, выделяя газообразный водород.
Исследователями XIX века было выдвинуто множество предположений касательно того, как все-таки устроены органические вещества. Существенно важные предположения были выдвинуты немецким ученым Ф.А.Кекуле, который первый высказал идею о том, что атомы разных химических элементов имеют конкретные значения валентностей, а атомы углерода в органических соединениях четырехвалентны и способны объединяться друг с другом, образуя цепи. Позднее, отталкиваясь от предположений Кекуле, российский ученый Александр Михайлович Бутлеров разработал теорию строения органических соединений, которая не потеряла свою актуальность и в наше время. Рассмотрим основные положения этой теории:
1) все атомы в молекулах органических веществ соединены друг с другом в определенной последовательности в соответствии с их валентностью. Атомы углерода имеют постоянную валентность, равную четырем, и могут образовывать друг с другом цепи различного строения;
2) физические и химические свойства любого органического вещества зависят не только от состава его молекул, но также и от порядка соединения атомов в этой молекуле между собой;
3) отдельные атомы, а также группы атомов в молекуле оказывают влияние друг на друга. Такое взаимное влияние отражается в физических и химических свойствах соединений;
4) исследуя физические и химические свойства органического соединения можно установить его строение. Верно также обратное – зная строение молекулы того или иного вещества, можно спрогнозировать его свойства.
Аналогично тому, как периодический закон Д.И.Менделева стал научным фундаментом неорганической химии, теория строения органических веществ А.М. Бутлерова фактически стала отправной точкой в становлении органической химии как науки. Следует отметить, что после создания теории строения Бутлерова органическая химия начала свое развитие очень быстрыми темпами.
Изомерия и гомология
Согласно второму положению теории Бутлерова, свойства органических веществ зависят не только от качественного и количественного состава молекул, но и от порядка соединения атомов в этих молекулах между собой.
В связи с этим, среди органических веществ широко распространено такое явление как изомерия.
Изомерия – явление, когда разные вещества имеют абсолютно одинаковый состав молекул, т.е. одинаковую молекулярную формулу.
Очень часто изомеры сильно отличаются по физическим и химическим свойствам. Например:
Типы изомерии
Структурная изомерия
а) Изомерия углеродного скелета
б) Изомерия положения:
кратной связи
заместителей:
функциональных групп:
в) Межклассовая изомерия:
Межклассовая изомерия имеет место, когда соединения, являющиеся изомерами, относятся к разным классам органических соединений.
Пространственная изомерия
Пространственная изомерия — явление, когда разные вещества при одинаковом порядке присоединения атомов друг к другу отличаются друг от друга фиксировано-различным положением атомов или групп атомов в пространстве.
Существует два типа пространственной изомерии – геометрическая и оптическая. Задания на оптическую изомерию на ЕГЭ не встречаются, поэтому рассмотрим только геометрическую.
Если в молекуле какого-либо соединения есть двойная C=C связь или цикл, иногда в таких случаях возможно явление геометрической или цис-транс-изомерии.
Например, такой вид изомерии возможен для бутена-2. Смысл ее заключается в том, что двойная связь между атомами углерода фактически имеет плоское строение, а заместители при этих атомах углерода могут фиксированно располагаться либо над, либо под этой плоскостью:
Когда одинаковые заместители находятся по одну сторону плоскости говорят, что это цис-изомер, а когда по разные — транс-изомер.
На в виде структурных формул цис- и транс-изомеры (на примере бутена-2) изображают следующим образом:
Отметим, что геометрическая изомерия невозможна в случае, если хотя бы у одного атома углерода при двойной связи будет два одинаковых заместителя. Так, например, цис-транс-изомерия невозможна для пропена:
Как можно видеть из иллюстрации выше, если поменять местами метильный радикал и атом водорода, находящиеся при втором углеродном атоме, по разные стороны плоскости, мы получим ту же самую молекулу, на которую просто посмотрели с другой стороны.
Влияние атомов и групп атомов друг на друга в молекулах органических соединений
Понятие о химической структуре как о последовательности связанных друг с другом атомов было существенно расширено с появлением электронной теории. С позиций данной теории можно объяснить, каким образом атомы и группы атомов в молекуле оказывают влияние друг на друга.
Различают два возможных способа влияния одних участков молекулы на другие:
1) Индуктивный эффект
2) Мезомерный эффект
Индуктивный эффект
Для демонстрации данного явления возьмем для примера молекулу 1-хлорпропана (CH3CH2CH2Cl). Связь между атомами углерода и хлора является полярной, поскольку хлор имеет намного более высокую электроотрицательность по сравнению с углеродом. В результате смещения электронной плотности от атома углерода к атому хлора на атоме углерода формируется частичный положительный заряд (δ+), а на атоме хлора — частичный отрицательный (δ-):
Смещение электронной плотности от одного атома к другому часто обозначают стрелкой, направленной к более электроотрицательному атому:
Однако, интересным является такой момент, что, кроме смещения электронной плотности от первого атома углерода к атому хлора, также имеет место смещение, но в несколько меньшей степени от второго атома углерода к первому, а также от третьего ко второму:
Такое смещение электронной плотности по цепи σ-связей называют индуктивным эффектом (I). Данный эффект затухает по мере удаления от влияющей группы и уже практически не проявляется после 3 σ-связей.
В случае, когда атом или группа атомов обладают большей электроотрицательностью по сравнению с атомами углерода, говорят, что такие заместители обладают отрицательным индуктивным эффектом (-I). Таким образом, в рассмотренном выше примере отрицательным индуктивным эффектом обладает атом хлора. Кроме хлора, отрицательным индуктивным эффектом обладают следующие заместители:
–F, –Cl, –Br, –I, –OH, –NH2, –CN, –NO2, –COH, –COOH
Если электроотрицательность атома или группы атомов меньше электроотрицательности атома углерода, фактически происходит передача электронной плотности от таких заместителей к углеродным атомам. В таком случае говорят, что заместитель обладает положительным индуктивным эффектом (+I) (является электронодонорным).
Так, заместителями с +I-эффектом являются предельные углеводородные радикалы. При этом выраженность +I-эффекта возрастает с удлинением углеводородного радикала:
–CH3, –C2H5, –C3H7, –C4H9
Следует отметить, что атомы углерода, находящиеся в разных валентных состояниях, обладают также и разной электроотрицательностью. Атомы углерода в состоянии sp-гибридизации имеют большую электроотрицательность по сравнению с атомами углерода в состоянии sp2-гибридизации, которые, в свою очередь, более электроотрицательны, чем атомы углерода в состоянии sp3-гибридизации.
Мезомерный эффект (М), или эффект сопряжения, — влияние заместителя, передаваемое по системе сопряженных π-связей.
Знак мезомерного эффекта определяется по тому же принципу, что и знак индуктивного эффекта. Если заместитель увеличивает электронную плотность в сопряженной системе, он обладает положительным мезомерным эффектом (+М) и является электронодонорным. Положительным мезомерным эффектом обладают двойные углерод-углеродные связи, заместители, содержащие неподеленную электронную пару: -NH2, -OН, галогены.
Отрицательным мезомерным эффектом (–М) обладают заместители, оттягивающие электронную плотность от сопряженной системы, при этом электронная плотность в системе уменьшается.
Отрицательным мезомерным эффектом обладают группы:
–NO2, –COOH, –SO3H, -COH, >C=O
За счет перераспределения электронной плотности за счет мезомерного и индуктивного эффектов в молекуле на некоторых атомах появляются частичные положительные или отрицательные заряды, что имеет отражение в химических свойствах вещества.
Графически мезомерный эффект показывают изогнутой стрелкой, которая начинается в центре электронной плотности и завершается там, куда смещается электронная плотность. Так, например, в молекуле хлористого винила мезомерный эффект возникает при сопряжении неподеленной электронной пары атома хлора, с электронами π-связи между углеродными атомами. Таким образом, в результате этого на атоме хлора появляется частичный положительный заряд, а обладающее подвижностью π-электронное облако под воздействием электронной пары смещается в сторону крайнего атома углерода, на котором возникает вследствие этого частичный отрицательный заряд:
Если в молекуле имеются чередующиеся одинарные и двойные связи, то говорят, что молекула содержит сопряженную π-электронную систему. Интересным свойством такой системы является то, что мезомерный эффект в ней не затухает.
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
ОСНОВНЫЕ ПОЛОЖЕНИЯ
ТЕОРИИ ХИМИЧЕСКОГО СТРОЕНИЯ А.М. БУТЛЕРОВА
1 ПОЛОЖЕНИЕ:
Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям.
Органические вещества образуют углеродные цепи, в которых углерод всегда имеет валентность IV.
2 ПОЛОЖЕНИЕ
Свойства веществ определяются не только их качественным и количественным составом, но и химическим строением молекулы (порядком связи атомов друг с другом).
СТРУКТУРНАЯ ФОРМУЛА, ИЛИ ФОРМУЛА СТРОЕНИЯ — схематическое изображение строения молекулы, показывающее последовательность соединения атомов и функциональных групп
3 ПОЛОЖЕНИЕ
По свойствам можно описать строение его молекулы, а по строению молекулы — предсказать свойства вещества.
4 ПОЛОЖЕНИЕ
Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга, причем влияние ослабевает при увеличении расстояния между ними. Это отражается на химических и физических свойствах вещества.
ГОМОЛОГИ
Вещества, имеющие сходное химическое строение (тип углеродного скелета, вид, количество и расположение заместителей, вид, количество и расположение кратных связей и т.д.), но отличающиеся лишь длиной углеродной цепи (на одну или несколько –СН2- групп)
ИЗОМЕРЫ
вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение, а, следовательно, и свойства. Возможность образовывать изомеры называется изомерией.
1. структурная
2. пространственная (стереоизомерия).
СТРУКТУРНАЯ ИЗОМЕРИЯ И ЕЕ ВИДЫ
Структурные изомеры отличаются друг от друга порядком связей между атомами в молекуле;
1. ИЗОМЕРИЯ УГЛЕРОДНОГО СКЕЛЕТА:
вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Веществ с молекулярной формулой С4Н10 существует два:
2. ИЗОМЕРИЯ ПОЛОЖЕНИЯ
обусловлена различным положением кратной связи или функциональной группы при одинаковом углеродном скелете молекул.
Например:
С3Н8О:
3. МЕЖКЛАССОВАЯ ИЗОМЕРИЯ
вещества из разных классов веществ имеют одинаковую общую формулу.
ПАРЫ МЕЖКЛАССОВЫХ ИЗОМЕРОВ:
CnH2n — алкены и циклоалканы
CnH2n-2 — алкины и алкадиены (и циклоалкены)
СnH2n+2O — спирты и простые эфиры
CnH2nO — альдегиды и кетоны, а также: циклические спирты, циклические эфиры, непредельные спирты и эфиры
CnH2nO2 — карбоновые кислоты и сложные эфиры
ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ И ЕЕ ВИДЫ
стереоизомеры отличаются расположением атомов в пространстве при одинаковом порядке связей между ними.
1. ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ (ИЛИ ЦИС-ТРАНС-ИЗОМЕРИЯ)
Геометрическая изомерия свойственна соединениям, содержащим двойные связи С = С и циклопарафинам.
Заместители могут быть расположены либо по одну сторону плоскости двойной связи или цикла (цис-положение), либо по разные стороны (транс-положение).
Геометрические изомеры различаются по физическим свойствам (температурам кипения и плавления, растворимости и др
Некоторые физические свойства малеиновой и фумаровой кислот
2. ОПТИЧЕСКАЯ ИЗОМЕРИЯ
свойственна молекулам органических веществ, не совмещающимся со своим зеркальным отображением (т. е. с молекулой, соответствующей этому зеркальному отображению). Это кислоты, спирты, углеводы и др.
ИЗОМЕРИЯ АЛКАНОВ
СТРУКТУРНАЯ ИЗОМЕРИЯ
1.изомерия углеродного скелета.
ИЗОМЕРИЯ ЦИКЛОАЛКАНОВ
1. Изомерия углеродного скелета
a) число углеродных атомов в кольце:
б) число углеродных атомов в заместителях:
в) положение заместителя в кольце:
2. Межклассовая изомерия: циклоалканы изомерны алкенам.
ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ
Например, в молекуле 1,2-диметилциклопропана две группы СН3 могут находиться по одну сторону от плоскости цикла (цис-изомер) или по разные стороны (транс-изомер):
ИЗОМЕРИЯ АЛКЕНОВ:
1. Изомерия углеродного скелета:
(начиная с С4Н8 – бутен и 2-метилпропен)
2. Изомерия положения кратной связи:
3. Межклассовая изомерия:
с циклоалканами (начиная с пропена): C4H8 — бутен и циклобутан.
ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ:
Из-за того, что вокруг двойной связи невозможно свободное вращение, становится возможной цис-транс-изомерия.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи:
ИЗОМЕРИЯ ДИЕНОВ
1. Изомерия положения двойных связей:
2. Изомерия углеродного скелета:
3. Межклассовая изомерия с алкинами и циклоалкенами.
Например, формуле С4Н6 соответствуют следующие соединения:
4. Пространственная изомерия: цис-транс-изомерия.
12(Б) Тесты ЕГЭ ФИПИ 2015 Гомология и изомерия. Радикал. Функциональная группа.
Теория органического строения Основные положения теории химического строения А.М. Бутлерова
1) Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям.
Последовательность межатомных связей в молекуле называется ее химическим строением и отражается структурной формулой (формулой строения).
Органические вещества содержат в своей основе УГЛЕРОДНЫЕ ЦЕПИ, в которых углерод имеет валентность IV.
Связи между атомами углерода в органических цепях бывают одинарные, двойные и тройные.
Кроме углерода, в органических веществах чаще всего присутствуют: атомы Н, атомы О (двухвалентные), а также атомы азота, галогенов и ещё некоторые виды атомов.
2) Свойства веществ зависят не только от вида и числа атомов в молекуле, но и от их взаимного расположения – т.е. от строения молекулы. Это приводит к тому, что вещества одного и того же состава могут иметь разное строение, т.е. к появлению понятия ИЗОМЕРИИ.
3) По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы — предвидеть свойства.
4) Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга. Это отражается на химических и физических свойствах вещества.
1) Строение атома углерода.
Электронное строение атома углерода изображается следующим образом: 1s22s22p2 или схематически
Углерод в органических соединениях четырехвалентен.
Это связано с тем, что при образовании ковалентной связи атом углерода переходит в возбужденное состояние, при котором электронная пара на 2s- орбитали разобщается и один электрон занимает вакантную p-орбиталь. Схематически: ––>
В результате имеется уже не два, а четыре неспаренных электрона.
2) Сигма и пи-связи.
- Сигма-связь – это связь, в которой перекрывание орбиталей происходит ВДОЛЬ ОСИ, соединяющей ядра атомов.
- Сигма-связь может быть образована всеми типами орбиталей (s,p,d, гибридными).
- Сигма-связь – это основная связь в молекуле, они более прочные и образуют скелет молекулы.
Между двумя атомами в химической частице возможна только одна σ-связь. Все σ-связи обладают осевой симметрией относительно межъядерной оси.
Пи-связь – это связь, в которой перекрывание орбитаоей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи.
Пи-связь образуется при дополнительном перекрывании р- или d-орбиталей, перпендикулярных линии связи и параллельных друг другу.
Пи-связь- дополнительная к сигма-связи, она менее прочная и легче разрывается при химических реакциях.
Одинарные и кратные связи.
|
Одинарная (σ) |
Двойная (σ+π) |
Тройная (σ + π + π) |
|
С-С, С-Н, С-О |
С=O и С=С |
С≡С и С≡N |
3) Гибридизация.
Поскольку четыре электрона у атома углерода различны (2s- и 2p- электроны), то должны бы быть различны и связи, однако известно, что связи в молекуле метана равнозначны. Поэтому для объяснения пространственного строения органических молекул используют метод гибридизации.
1. Если в гибридизации участвуют все четыре орбитали возбужденного атома углерода (одна 2s- и три 2p- орбитали), то образуются четыре новых равноценных sp3— гибридных орбитали, имеющие форму вытянутой гантели. Вследствие взаимного отталкивания sp3— гибридные орбитали направлены в пространстве к вершинам тетраэдра и углы между ними равны 109028′ (наиболее выгодное расположение).
2. При sp2-гибридизации гибридизуются одна s- и две р-орбитали и образуются три гибридные орбитали, оси которых расположены в одной плоскости и направлены относительно друг друга под углом 120°.
3. При sp-гибридизации гибридизуются одна s- и одна р-орбитали и образуются две гибридные орбитали, оси которых расположены на одной прямой и направлены в разные стороны от ядра рассматриваемого атома углерода под углом 180°.
ТИПЫ ГИБРИДИЗАЦИИ в органических веществах.
|
Тип гибридизации |
Геометрическая форма |
Угол между связями |
Примеры |
|
|
sp |
линейная |
180o |
Атом С с тройной и одинарной связью или с двумя двойными связями. ̶ С≡ или =С= |
|
|
sp2 |
треугольная |
120o |
Атом С с двойной и двумя одинарными связями ̶ С = ∣ |
|
|
sp3 |
тетраэдрическая |
109,5o |
Атом С с четырьмя одинарными связями |
|
|
Строение молекулы метана: |
Строение сигма (1) и пи (2) связей молекулы этилена. |
Строение ацетилена |
|
Sp3— гибридизация |
Sp2 — гибридизация |
Sp- гибридизация |
4) Изомерия.
Изомеры – вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию). Структурные изомеры отличаются друг от друга порядком связей между атомами в молекуле; стереоизомеры — расположением атомов в пространстве при одинаковом порядке связей между ними.
СТРУКТУРНАЯ ИЗОМЕРИЯ.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Веществ с молекулярной формулой С4Н10 существует два:
|
н-бутан (с линейным скелетом): |
и изо-бутан, или 2-метилпропан: |
|
СН3 – СН2 – СН2 – СН3 |
СН3 – СН – СН3 │ СН3 |
2. Изомерия положения обусловлена различным положением функциональной группы или заместителя при одинаковом углеродном скелете молекул. Так, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):
СН3 – СН2 – СН2 – ОН и СН3 – СН – СН3
│
ОН
Изомерия непредельных соединений может быть вызвана различным положением кратной связи, как, например, в бутене-1 и бутене-2:
СН3-СН2-СН=СН2 и СН3-СН=СН-СН3
3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Пары межклассовых изомеров:
CnH2n — алкены и циклоалканы
CnH2n-2 — алкины и алкадиены (а также циклоалкены)
СnH2n+2O — спирты и простые эфиры.
CnH2nO — альдегиды и кетоны, а также: циклические спирты, циклические эфиры, непредельные спирты и эфиры.
CnH2nO2 — карбоновые кислоты и сложные эфиры.
ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ.
1. Геометрическая изомерия (или цис-транс-изомерия) .
Геометрическая изомерия свойственна соединениям, содержащим двойные связи
С = С и неароматическим циклическим соединениям; она обусловлена невозможностью свободного вращения атомов вокруг двойной связи или в цикле.
В этих случаях заместители могут быть расположены либо по одну сторону плоскости двойной связи или цикла (цис-положение), либо по разные стороны (транс-положение).
Примерами геометрических изомеров могут служить две формы этилен-1,2-дикарбоновой кислоты — цис-форма, или малеиновая кислота , и транс-форма, или фумаровая кислота , а также цис- и транс-формы циклопропан-1,2-дикарбоновой кислоты
Геометрические изомеры обычно существенно различаются по физическим свойствам (температурам кипения и плавления, растворимости, дипольным моментам, термодинамической устойчивости и др.). В таблице приведены некоторые свойства геометрических изомеров — малеиновой и фумаровой кислот.
Некоторые физические свойства малеиновой и фумаровой кислот
|
Свойства |
Малеиновая кислота (цис-форма) |
Фумаровая кислота (транс-форма) |
|
Температура плавления, °С |
130 |
286 |
|
Растворимость в 100 г воды при 20 °С, г |
78,8 |
0,7 |
|
Константа диссоциации при 25°С(К1) |
1,17·10-2 |
9,3·10-4 |
2. Оптическая изомерия свойственна молекулам органических веществ, не имеющим плоскости симметрии (плоскости, разделяющей молекулу на две зеркально тождественные половины) и не совмещающимся со своим зеркальным отображением (т. е. с молекулой, соответствующей этому зеркальному отображению).
Такие асимметричные молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через кристалл, расплав или раствор вещества.
Чаще всего оптическая активность обусловлена наличием в молекуле асимметрического атома углерода, т. е. атома углерода, связанного с четырьмя различными заместителями.
Примером может служить молочная кислота: CH3C*H(OH)COOH (асимметрический атом углерода отмечен звёздочкой). Согласно тетраэдрической модели атома углерода, заместители располагаются в углах правильного тетраэдра, в центре которого находится атом углерода:
Как видно из приведённых формул, молекула молочной кислоты ни при каком перемещении в пространстве не может совпасть со своим зеркальным отображением. Эти две формы кислоты относятся друг к другу, как правая рука к левой, и называются оптическими антиподами (энантиомерами).
Предпосылки возникновения
В 1860 году состоялся первый Международный съезд химиков в Карлсруэ, где ученые четко обозначили разницу между привычными для нас понятиями атома и молекулы. В это же время утвердили и атомно-молекулярное учение, которое позже легло в основу теории химического строения.
Чуть раньше, в 1853 году, английский химик Эдуард Франкленд ввел понятие «валентность», а спустя пять лет Фридрих Кекуле установил, что валентность углерода в органических соединениях равна четырем. К тому же Кекуле и Купер уже в 1857 году выдвигали предположения о том, что атомы углерода могут образовывать цепочки.
Однако у великих умов еще оставались вопросы. Например, как несколько химических элементов способны образовывать такое многообразие соединений? Или как вещества, имеющие одинаковую исходную формулу, могут иметь разные физические и химические свойства? Вот здесь-то и выдвинул свою теорию химического строения Александр Михайлович Бутлеров.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
А. М. Бутлеров и его идеи
Александр Михайлович Бутлеров — великий русский химик, ученик Н. Н. Зинина, лауреат Ломоносовской премии и создатель теории химического строения органических веществ.
Еще в 1858 году на заседании Парижского химического общества Бутлеров, выступив с первым докладом, внес ясность в определение радикалов. Он утверждал, что радикалами следует считать не только органические группы атомов, но и характерные для различных классов сочетания атомов. Например, —OH или —NH2. Позже такие сочетания атомов получили название функциональных групп. В этом же докладе Александр Михайлович впервые употребил термин «структура».
В более развернутой и доработанной форме Бутлеров представил свою теорию на суд общественности в 1861 году в химической секции Съезда немецких естествоиспытателей и врачей. В его докладе «О химическом строении вещества» говорилось, что теоретическая сторона химии на текущий момент перестала отвечать фактическому развитию химии как науки. В частности, ученый отметил нестыковки в теориях, выдвинутых ранее.
Нужно сказать, что сам Бутлеров не формулировал теорию химического строения по пунктам: мысли на этот счет он выдвигал в различных статьях, они же пронизывают все его практические эксперименты.
Основные положения теории Бутлерова
С Бутлеровым мы познакомились, теперь пришло время познакомиться с основными положениями теории химического строения органических веществ:
-
Атомы в молекулах соединены между собой химическими связями в соответствии с их валентностью.
Важно помнить
Валентность углерода в органических соединениях равна 4.
-
Атомы в молекулах органических веществ соединены в определенной последовательности, которую характеризует химическое строение молекулы.
Определенная последовательность соединений атомов в молекуле с учетом их валентностей называется химическим строением, которое, в свою очередь, отражают структурные формулы. А последовательное соединение атомов углерода друг с другом, образующее каркас молекулы, называется углеродным скелетом. Но есть одно но: структурные формулы не отражают пространственное расположение молекулы. Вот как можно изобразить строение одной и той же молекулы различными структурными формулами:
Структурные формулы чаще всего изображают в сокращенном виде, например CH3—CH2—CH2—CH3. Однако в сокращенном виде видна только связь «углерод — углерод» и не видны связи «углерод — водород» и «углерод — кислород».
Если в молекуле четыре атома углерода и более, то ее строение может быть не только линейным, но и разветвленным:
Давайте внимательно рассмотрим строение каждой молекулы. Атомы углерода одной из молекул связаны с одним или двумя соседними атомами углерода, как, например, в другой молекуле один из атомов углерода связан сразу с тремя атомами углерода. Отсюда можно предположить, что разному порядку связывания атомов при одинаковом количестве атомов углерода и водорода в данном случае должны соответствовать различные вещества с разными свойствами. Действительно, все так и есть:
Разницу в температурах кипения при одинаковом количественном и качественном составе подтверждают литературные данные.
Все это приводит нас к такому понятию, как изомеры. Изомерами называют вещества с одинаковым количественным и качественным составом, но с разными физико-химическими свойствами, которые обусловлены различным строением. Явление существования различных форм веществ или изомеров называется изомерией. Об изомерах и изомерии мы уже рассказывали в нашем блоге.
-
Свойства органических веществ зависят не только от числа и природы входящих в состав атомов, но и от химического строения молекулы. Зная строение вещества, можно охарактеризовать его свойства.
-
В молекулах существует взаимное влияние как непосредственно связанных, так и не связанных между собой атомов.
-
Химическое строение вещества можно определить благодаря изучению его химических превращений.
Вопросы для самопроверки
-
Основоположником теории химического строения является…
-
Зинин
-
Ломоносов
-
Менделеев
-
Бутлеров
-
Какова валентность углерода в органических молекулах?
-
I
-
V
-
II
-
IV
-
Определенная последовательность соединений атомов в молекуле называется…
-
Изомерией
-
Гомологами
-
Углеродным скелетом
-
Химической формулой
-
Способны ли структурные формулы отображать пространственное строение молекулы?
-
Да
-
Нет
-
Это одно и то же
-
Верно ли утверждение: «Наличие изомеров зависит от общего количества атомов углерода в молекуле»?
-
Верно
-
Неверно
-
Изомеры есть у всех веществ
-
Можно ли предугадать химические свойства, зная строение молекулы?
-
Это невозможно
-
Можно, так как свойства зависят от строения
-
Только зная свойства, можно рассказать о строении молекулы
Глубже разобраться в положениях и значении теории Бутлерова можно на уроках химии в онлайн-школе Skysmart. Мы учим понимать химические явления на примерах из окружающей ученика реальности, показываем межпредметные связи и помогаем ответить на вопрос «Зачем все это учить?». Оставьте заявку и пройдите бесплатное тестирование, а мы подберем подходящий курс и рекомендации для самостоятельного обучения!
Ответы на вопросы
-
d
-
d
-
c
-
b
-
a
-
b







































![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)